九年级化学制取氧气3
2.3制取氧气(第三课时)人教版(2024)九年级化学上册课件

3.催化剂及其化工生产中的重要作用
催化剂在化工生产过程中有重要作用,有的反应如果没有催化剂 就不能进行,大多数化工生产都有催化剂的参与。例如在石油炼制过 程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理中用催化剂促 进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制 剂还是宝贵的药物。
说法中正确的是
(填序号)。
A.不用催化剂过氧化氢溶液就不能分解
B.同一个化学反应可以有多种催化剂,同一物质也可以做不同反应的催化剂
C.催化剂只能加快化学反应的速率
D.某同学用氯酸钾制氧气时,误将高锰酸钾当作MnO2一起加热,结果发现反应 速率和氧气的产量均增加了,故催化剂还可以增加生成物的质量。
【答案】(1)产生气泡的速率;(2)先将分液漏斗的活塞关闭,然后用双手 紧握锥形瓶的外壁,然后观察注射器的活塞是否向外移动,若向外移动,说明 该装置的气密性是良好的;产生等体积的氧气所需要的时间;(3)B
(1)酒精+氧气 点燃 水+二氧化碳,应填充到_____c____处。
(2)碳酸
二氧化碳+水,应该填充到_____d_____处。
【答案】(1)c(2)d
【解析】(1)该反应的反应物和生成物均是两种,不符合“一 变多”、“多变一”的形式,不属于分解反应、化合反应;是 物质与氧气发生的化学反应,属于氧化反应;则应填充到c处。 (2)该反应符合“一变多”的形式,符合分解反应的特征,属 于分解反应,应该填充到d处。故答案为: (1)c(2)d.
故选:D。
例2.下列对催化剂描述正确的是( A ) A.某些化学反应可以有多种催化剂
B.只有分解反应才需要催化剂
C.催化剂的作用是加快反应速率
D.催化剂可以增加生成物质量
人教版九年级化学上册第二单元课题3制取氧气

思考
过氧化氢 二氧化锰 水 + 氧气
(H2O2 )
(H2O) (O2 )
这个反应中还有其他的催化剂吗?
生土豆块
结论: 实验室能用过氧化氢添加催化剂的方法制氧气。
实验室还可常用加热氯酸钾和二氧化锰的 方法制氧气(二氧化锰仍为催化剂)
氯酸钾 二氧化锰
加热
KClO3
白色固体
氯化钾 + 氧气
KCl
O2
5、验满方: 将一根带火星的木条伸入集气瓶中
7、放置方法: 正放,盖上玻璃片。
因为氧气比空气的密度略大
8、实验步骤: (1)组装仪器,检查装置气密性
检查装置气密性的方法
连接仪器,将导气管的 一端放入水中,双手紧握 试管,观察导气管口 是 否有气泡产生。若有 气 泡产生,则装置气密性良 好,反之,则不好。
氯酸钾 二氧化锰 氯化钾 + 氧气
加热
过氧化氢 二氧化锰 水 + 氧气
想一想: 上述三个反应有什么共同特征?与化合反
应有什么不同?
高锰酸钾 加热 锰酸钾+二氧化锰+氧气
氯酸钾 二氧化锰 氯化钾+氧气
加热
分解反应
过氧化氢 二氧化锰 水 + 氧气
化
学
反
铁 + 氧气 点燃 四氧化三铁
应
硫 + 氧气 点燃 二氧化硫
二.氧气的实验室制法 1、实验药品:
探究活动1:实验室能用高锰酸钾制氧气吗?
实验编号
(1)加热试管,用排水法 收集一瓶氧气
(2)把带火星的木条伸入 集气瓶中
温度对反现应象有影响 导管口有气泡冒出
带火星的木条复燃
结论:高锰酸钾在加热条件下可用于实验室制氧气
人教版九年级上册 第二单元 课题3 制取氧气——过氧化氢制取氧气

A
B + C+……
过氧化氢 二氧化锰 水 + 氧气
H2O2
H2O
O2
化合反应与分解反应的区别与联系
化学
反应类型
化合反应
分解反应
定义 形式
由两种或两种以上 由一种物质生成两
的物质生成另一种 种或两种以上其他
物质的反应
物质的反应
A+B→C(多变一) A→B+C(一变多)
参加反应的 物质种类
两种或两种以上
化学
【例2】催化剂在化学反应中所起的作用是(C)
(A)加快化学反应速率 (B)使生成物质量增加 (C)改变化学反应速率 (D)减慢化学反应速率
化学
练习:1、下列有关催化剂的叙述正确的是( C )
A、在化学反应里能加快其他物质的化学反应速率, 而本身的质量和性质在反应前后没有改变的物 质。
B、二氧化锰是催化剂。 C、在化学反应里能改变其他物质的化学反应速率,
化学
步骤3:反应停止后,重新加入过氧化氢 溶液,把带火星的木条伸入试管。观察发生 的现象。
带有火星的木条
木条复燃
过氧化氢溶液
分解过氧化氢制氧气的反应中二氧化锰的作用
化学
现象 木条复燃
氧气是过氧化氢产生的,二氧 结论 化锰只起加快产生氧气的作用
分解过氧化氢制氧气的反应中二氧化锰的作用
化学
【思考1】在第2个实验中,是不是过氧化氢 与二氧化锰反应生成了氧气呢?
过氧化氢+二氧化锰→氧气+?
【思考2】二氧化锰好象永远也用不完,二氧化 锰在这个反应中到底扮演了一个什么角色呢?
分解过氧化氢制氧气的反应中二氧化锰的作用
化学
人教版九年级化学 第二单元 课题3 制取氧气实验知识归纳
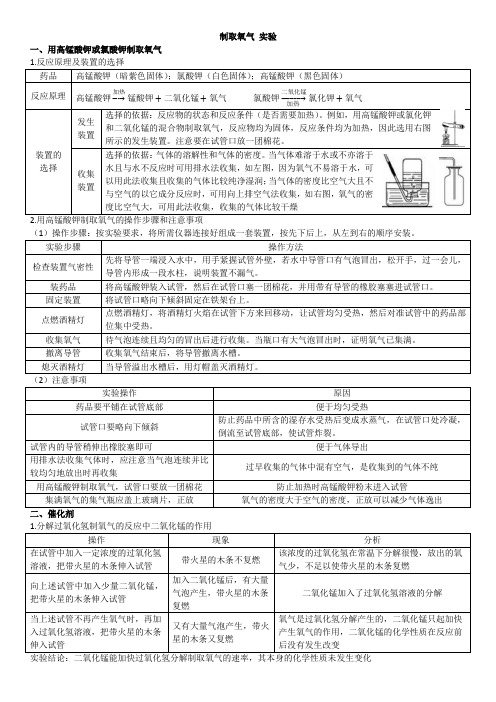
制取氧气实验一、用高锰酸钾或氯酸钾制取氧气药品高锰酸钾(暗紫色固体);氯酸钾(白色固体);高锰酸钾(黑色固体)反应原理高锰酸钾加热→锰酸钾+二氧化锰+氧气氯酸钾二氧化锰→氯化钾+氧气装置的选择发生装置选择的依据:反应物的状态和反应条件(是否需要加热)。
例如,用高锰酸钾或氯化钾和二氧化锰的混合物制取氧气,反应物均为固体,反应条件均为加热,因此选用右图所示的发生装置。
注意要在试管口放一团棉花。
收集装置选择的依据:气体的溶解性和气体的密度。
当气体难溶于水或不亦溶于水且与水不反应时可用排水法收集,如左图,因为氧气不易溶于水,可以用此法收集且收集的气体比较纯净湿润;当气体的密度比空气大且不与空气的以它成分反应时,可用向上排空气法收集,如右图,氧气的密度比空气大,可用此法收集,收集的气体比较干燥2.用高锰酸钾制取氧气的操作步骤和注意事项实验步骤操作方法检查装置气密性先将导管一端浸入水中,用手紧握试管外壁,若水中导管口有气泡冒出,松开手,过一会儿,导管内形成一段水柱,说明装置不漏气。
装药品将高锰酸钾装入试管,然后在试管口塞一团棉花,并用带有导管的橡胶塞塞进试管口。
固定装置将试管口略向下倾斜固定在铁架台上。
点燃酒精灯点燃酒精灯,将酒精灯火焰在试管下方来回移动,让试管均匀受热,然后对准试管中的药品部位集中受热。
收集氧气待气泡连续且均匀的冒出后进行收集。
当瓶口有大气泡冒出时,证明氧气已集满。
撤离导管收集氧气结束后,将导管撤离水槽。
熄灭酒精灯当导管溢出水槽后,用灯帽盖灭酒精灯。
(2)注意事项实验操作原因药品要平铺在试管底部便于均匀受热试管口要略向下倾斜防止药品中所含的湿存水受热后变成水蒸气,在试管口处冷凝,倒流至试管底部,使试管炸裂。
试管内的导管稍伸出橡胶塞即可便于气体导出用排水法收集气体时,应注意当气泡连续并比较均匀地放出时再收集过早收集的气体中混有空气,是收集到的气体不纯用高锰酸钾制取氧气,试管口要放一团棉花防止加热时高锰酸钾粉末进入试管集满氧气的集气瓶应盖上玻璃片,正放氧气的密度大于空气的密度,正放可以减少气体逸出操作现象分析在试管中加入一定浓度的过氧化氢溶液,把带火星的木条伸入试管带火星的木条不复燃该浓度的过氧化氢在常温下分解很慢,放出的氧气少,不足以使带火星的木条复燃向上述试管中加入少量二氧化锰,把带火星的木条伸入试管加入二氧化锰后,有大量气泡产生,带火星的木条复燃二氧化锰加入了过氧化氢溶液的分解当上述试管不再产生氧气时,再加入过氧化氢溶液,把带火星的木条伸入试管又有大量气泡产生,带火星的木条又复燃氧气是过氧化氢分解产生的,二氧化锰只起加快产生氧气的作用,二氧化锰的化学性质在反应前后没有发生改变加热2.验证某物质可做某反应催化剂的方法(1)称取一定量的某物质,记录质量m1。
人教版九年级化学上册第2单元3 制取氧气(共33张PPT)

(二)分解过氧化氢制取氧气
1、药品:过氧化氢溶液和二氧化锰
观察下列实验并填空:
反应式: 过氧化氢
水+ 氧气
编号 现象
分析
(1)
常温下过氧化氢分解很慢,放
带火星的木条不 出的氧气少,不足以使带火星
复燃
的木条复燃。
(2) 加入二氧化锰后, 二氧化锰加速了过氧化氢溶液
带火星的木条复 的分解,放出的氧气使带火星
燃
的木条复燃。
(3) 重新加入过氧化 氧气是过氧化氢产生的,二氧 氢溶液,带火星 化锰只起加快产生氧气的作用。 的木条又复燃
结论 二氧化锰能加快过氧化氢制氧气的速率, 二氧化锰本身未见变化。
【思考】
二氧化锰好象永远也用不完,二氧 化锰在这个反应中到底扮演了一个什 么角色呢?
催化剂
在化学反应中能改变其他物质的化学反应 的速率,而本身的质量和化学性质在反应 前后都没有发生变化的物质叫催化剂(又 叫触媒)。
2、反应原理:
氯酸钾 KClO3
二氧化锰 加热
二氧化锰 加热
氯化钾 + 氧气 KCl + O2
3、实验装置: (固固加热型)
4、实验步骤
1查、 查装置的气密性 茶
2装、 装入药品
庄
3定、 固定在铁架台上 定
4点、 点燃酒精灯
点
5收、 收集气体
收
6离、 7熄、
将导管撤离水槽 利
熄灭酒精灯
息
三个反应有何共同特征? 与化合反应有什么不同?
检查有无灯 芯和酒精
试管口要略 向下倾斜
必需使用 胶皮管
实验注意事项
(1)为什么要在试管口放一团棉花?
答:为了防止加热时 高锰酸钾粉末进入导 管,使导管堵塞。
人教版九年级化学上册第二单元课题3-制取氧气(共51张PPT)

发生变化的物质。
催化剂
一 变: 改变化学反应速率
二不变:
质量
(加快或减慢)
化学性质
文字表达式: 过氧化氢 二氧化锰水 + 氧气 符号表达式:H2O2 MnO2 H2O + O2
彩色小颗粒为活化酶, 加快洗衣粉去污能力
化妆品中含有的催化剂, 减慢皮肤衰老速率
2.催化剂在化学反应中所起的作用是(C)
(A)加快化学反应速率 (B)使生成物质量增加 (C)改变化学反应速率 (D)减慢化学反应速率
3.实验室制取氧气时,装药品的大试管
口应 (C)
(A)朝下
(B)朝上
(C)略向下倾斜 (D)略向上倾斜
4.实验室采用排水法收集氧气时,需将
导气管伸入盛满水的集气瓶,这个操作应
H2O2 → H2O + O2 (慢) 所以,过氧化氢在实验室必须密封保存在不见光的 地方。
过氧化氢(H2O2)为什么俗称双氧水?
化学名称 俗称 过氧化氢 双氧水
氧化氢
水
化学式 H2O2 H2O
色味态
无色无味 液体
无色无味 液体
氯酸钾,化学式为KClO3,白色固体……
【实验2-5】
高锰酸钾 KMnO4
实验室 制法:
KMnO4
K2MnO4 + MnO2 + O2
KClO3
MnO2
△
KCl + O2
H2O2 MnO2 H2O + O2
共同点
① 都有氧气生成(反应物中都含氧元素); ② 都是分解反应:多变一,基本反应类型之一 ③ 都有二氧化锰 (MnO2) ① 催化剂 一变: 改变化学反应速率
九年级化学 第二单元 课题3制取氧气

实验室制取氨气时发生装置应选择(
C 收集装置应选择( )装置。
)A 装置,
B A
E D C
归纳氧气的实验室制法
过氧化氢 二氧化锰 水 + 氧气
氯酸钾
二氧化锰 加热
氯化钾+氧气
高锰酸钾 加热 锰酸钾+二氧化锰+氧气
一变 多
分解反应
氧气的工业制法
• 工业上生产大量氧气是用分离液态空气的 方法
• 在低温条件下加压,使空气转变为液态空 气,然后蒸发。由于液态氮的沸点比液态 氧的沸点低,因此氮气首先从液态空气中 蒸发出来,剩下的主要就是液态氧。
【思考】
我们知道氧气是一
种化学性质比较活泼的
气体,它可以跟很多物 质发生反应。那么,在
O2
实验中我们用到的这些
氧气是如何得到的呢?
氧气的制取方法可分为: 工业制法 实验室制法
一、实验室制法
加热高锰酸钾(KMnO4) 原理 加热氯酸钾(KClO3)和二氧
化锰(MnO2)的混合物 分解过氧化氢溶液(H2O2)
分离液态空气法
降温
空气 加压
液态空气
液态氮气(-196℃) 液态氧气(-183℃)
利用沸点不同 液态氮气先蒸发了,剩下
蒸发
的主要是液态氧气,再把 它贮存起来
三、工业制法(分离液态空气法)
依据:液氮和液氧的沸点不同(液 氮较低先蒸发,剩下的是液氧)
(物理变化)
③催化剂并不具有通用性,如二氧化锰在过氧化氢
分解制取氧气时,能够起催化作用,是催化剂,但 对于其他反应就不一定了。
④同一化学反应可有多种催化剂。如双氧水分解制取 氧气时,既可用二氧化锰做催化剂,也可用硫酸铜 溶液做催化剂。
人教版初三化学_2.3制取氧气

(1)制取氧气过程中使用了哪 些仪器?
酒精灯、试管、铁架台、带塞子的导 管、集气瓶、水槽。
(2)哪部分是气体发生装置, 哪部分是气体收集装置?
学会整合 二、实验室制取氧气的装置小结:
固液不 加热型
用过氧化氢制取氧气
固固要 加热型
用氯酸钾和二氧化锰制取氧气
气体收集装置
3.加热氯酸钾制取氧气
药品:
氯酸钾( KClO3 )、二氧化锰(MnO2)
无棉花
什和 么高 不锰 同酸 ?钾
有
加热氯酸钾和二氧化锰制取氧气的装置图
文字表达式:
氯酸钾 二氧化锰 氯化钾 + 氧气
加热
2KClO3 M=nO2 2KCl + 3O2↑
实验操作步骤 和高锰酸钾 一样 (1)按要求连接仪器;
②使高锰酸钾受热;
③用高锰酸钾和氯酸钾共热;
④使二氧化锰受热.判断这四种方
法( C )
A.全正确
B.全不正确
C.①②③正确 D.只有①②正确
6.下列反应属于分解反应的是( )
A.硫+氧气
二氧化硫
点燃
c
B.石蜡+氧气
二氧化碳+水Байду номын сангаас
C.氧化汞
点燃
汞+氧气
加热
D.镁+氧气
氧化镁
点燃
7.医院给病人输氧时用到类似下
序为______②__③___①__④__⑥__⑤__。
课后习题答案
1.过氧化氢 加热 水+氧气 高锰酸钾 加热 锰酸钾+二氧化锰+氧气 木炭+氧气 点燃 二氧化碳
2.C B A D
3. (1)水槽中水倒吸入导管 (2)防止生成的水倒流炸裂试管 (3)预热 (4)防止水槽中水倒流 (5)装置气密性不好,收集前没有排
课题3 制取氧气 2024-2025学年九年级化学人教版(2024)上册

应,还能形成一股美丽的紫色烟雾,反应的文字表达式为“铝+碘 碘化铝”,则水
的作用是 ( C )
A.氧化作用 B.提供热量
C.催化作用
D.分解作用
7.下列变化属于分解反应的是 ( D ) A.氧气+氢气 水 B.氢气+氧化铜 铜+水 C.酒精+氧气 水+二氧化碳 D.高锰酸钾 锰酸钾+二氧化锰+氧气
(1)仪器a的名称为____试__管____。 (2)若实验室用高锰酸钾制取氧气,应选用的发生装置是___A____(填字母),该化学反 应的文字表达式为___高__锰__酸__钾_______锰__酸__钾__+_二__氧__化__锰__+__氧__气____,属于的基本反应 类型是___分__解__反__应_____。 (3)若用C装置收集氧气,待氧气收集满后,停止反应的操作是___先__将__导__管__移__出__水__面__,_ _后__熄__灭__酒__精__灯_____。
二、催化剂和催化作用 1.探究实验
实验现象:实验(1)中带火星的木条____不__复__燃____,实验(2)中带火星的木条__复__燃____, 重复实验(2),二氧化锰的质量不减少,将二氧化锰分离出来,再加到过氧化氢溶液 中,还能加速过氧化氢分解。 实验结论:二氧化锰能____加_快_____(填“加快”或“减慢”)过氧化氢的分解速率,但其 _质__量_____和化学性质没有改变。
素养 分层评价
【A层 基础练】
【知识点1】实验室制取氧气
1.实验室用高锰酸钾制氧气的实验中,不需要使用的一组仪器是 ( A )
A.烧杯、玻璃棒
B.试管、集气瓶
C.酒精灯、铁架台
人教版化学-九年级上册第二单元课题3制取氧气

第二单元我们周围的空气课题3 制取氧气(讲学)课标定位1.了解实验室制取氧气的主要方法和原理2.练习连接仪器的基本操作,动手制取氧气,并试验氧气的化学性质3.认识分解反应、催化剂和催化作用4.通过制取氧气并试验氧气的化学性质的实验,初步了解通过化学实验制取新物质的方法,体验实验过程及实验成功的快乐,并学习分析实验中出现的问题。
知识梳理知识点一、制取氧气知识在线实验室制氧气:1.实验药品:过氧化氢溶液、高锰酸钾、氯酸钾和二氧化锰。
2.实验原理:(1)过氧化氢水+氧气。
(2)高锰酸钾锰酸钾+二氧化锰+氧气。
(3)氯酸钾氯化钾+氧气。
3.实验装置:(1)用过氧化氢溶液和二氧化锰制氧气时:固-液不加热型(如下图)。
用过氧化氢制取氧气(2)用高锰酸钾或氯酸钾和二氧化锰制氧气时:固-固加热型(如下图)。
说明:用高锰酸钾制氧气的装置中应在试管口放一团棉花,目的是防止加热时高锰酸钾粉末进入导管。
4.收集方法:(1)由于氧气不易溶于水,可用排水法收集。
(2)由于氧气的密度比空气的大,可用向上排空气法收集。
5.检验方法:将带火星的木条伸入集气瓶内,如果木条复燃,证明该瓶内的气体是氧气。
6.验满方法:(1)用向上排空气法收集时,将带火星的木条放在集气瓶口,如果木条复燃,说明该瓶内的氧气已满。
(2)用排水法收集时,当有大气泡从瓶口冒出时,说明该瓶内的氧气已满。
7.操作步骤:用高锰酸钾制取氧气并用排水集气法收集气体的一般步骤为:a.组装好仪器并检查装置的气密性;b.将药品装入试管并在试管口堵上一团棉花,用带导管的单孔橡皮塞塞紧试管;c.将试管固定在铁架台上;d.集气瓶里装满水并倒放在水槽中;e.点燃酒精灯,先预热试管,再对准药品处加热;f.用排水法收集氧气;g.收集完毕,将导管撤管撤离水槽;h.熄灭酒精灯。
工业制氧气:1.方法:分离液态空气法。
2.原理:利用液态空气中液氮和液氧的沸点不同,采用低温蒸发的方法,使氮气先分离出来,剩余的主要是液态氧。
人教版九年级化学上册第2单元3 制取氧气(共25张PPT)

4、实验室用高锰酸钾制氧气,有如下操作步 骤:①加热 ②连接装置,并检查装置的气密 性 ③装药品 ④用排水法收集氧气 ⑤从水槽 中取出导管 ⑥熄灭酒精灯 ⑦将试管固定到 铁架台上,正确的操作顺序是( ) A.②③⑦①④⑥⑤ B.②③⑦①④⑤⑥ C.③②⑦①④⑤⑥ D.②⑦③①④⑤⑥
谢谢
5、实验完毕,先撤导管,后移酒精灯
原因:防止水槽内的水倒吸到 热的试管底部,使试管炸裂。
6、收集满氧气的集气瓶为什么要正立放在 桌面上?
答:因为氧气的密度比空气的密度大,倒放会使氧 气从瓶口与玻璃片的缝隙中跑掉。
O2
探究:分解过氧化氢制氧气的反应中二氧化锰的作用
实验
现象
分析
在常温下,把带火星的木条伸 入过氧化氢溶液的试管
氧气的收集与验满方法 1.排水法 (1)因为氧气不易溶于水; (2)当集气瓶口有大气泡逸出时,证明已收集满。
2.向上排空气法 (1)因为氧气的密度大于空气的密度;
(2)将带火星的木条放在集气瓶口,木条复燃已满。
4. 制取氧气的常用装置
实验装置装搭原则: “先左后右,由下而上” 视频
3.MP4
5. 操作步骤 用带导管的橡皮塞塞住试管
催化剂:在化学反应中能改变其他物质的反应速率, 而本身的质量和化学性质在反应前后都没有发生变化 的物质。 催化剂在化学反应中所起的作用叫做催化作用。
催化剂的特点:
1.改变(增大或减小)其他物质的化学反应的速率。
2.质量和化学性质在反应前后没有发生变化。
2.分解过氧化氢(H2O2)溶液
过氧化氢 二氧化锰 水 + 氧气
3.气体收集装置(排水法)
导管
集气瓶
水 水槽
排水法收集
一. 适用范围 不易溶解于水的气体
九年级化学:课题3 制取氧气

(3)若使用高锰酸钾制取氧气,可选用的发生装置是__A____(填字母)。 (4)选用D装置收集氧气的原因是_氧__气__不__易__溶__于__水__,__不__与__水__反__应__。 14.(2013,龙东)实验室里现有氯酸钾和二氧化锰,以及下列仪器。
(1)请写出标号仪器名称:A__试__管____;B__酒__精__灯___。 (2)利用上述仪器和药品制氧气,你选择的仪器是_②__③__⑤__⑥__⑦__⑧__(填 序号)。利用该组合装置制氧气的化学方程式是 ___氯__酸__钾__二_―_氧 加_―_化 热_→_锰__氯__化__钾__+__氧__气____________。
1.检验氧气与氧气验满操作不同,检验氧气时将带火星的木条 伸入瓶内,验满时将带火星的木条放在集气瓶口。
2.在反应前后催化剂的化学性质不变,物质性质可能会改变。 某一反应的催化剂不一定是唯一的。
理解催化剂时,一般要抓住“一变两不变”。“改变”包括“加 快”和“减慢”两层含义;催化剂只能改变化学反应速率,而不能 增加或减少生成物的质量。
11.将一种无色无味的液体A装入试管,用带火星的木条伸入试管, 无现象,而向其中加入少量黑色粉末B后,迅速产生气泡,生成了 使带火星的木条复燃的气体C,使金属E红热并伸入盛有气体C且瓶 底有少量液体D的集气瓶中,金属E剧烈燃烧,火星四射,生成黑色 固体F。
(1)写出它们的名称: A._过__氧__化__氢_____;B.__二__氧__化__锰_____;C.____氧__气______; D.___水______;E.___铁_______;F.__四__氧__化__三__铁___。 (2)黑色粉末B在A的分解反应中起__催__化____作用,是这个反应的 __催__化____剂。
九年级化学《课题 3 制取氧气》PPT课件

带有火星 的木条
木条复燃
过氧化氢 溶液
过氧化氢 溶液
步骤三:反应停止后,重新加入过氧化氢溶液,把带 火星的木条伸入试管,观察发生的现象。
现 象:带火星的木条复燃;
结 论:二氧化锰(MnO2)仍然在起作用,使过氧化氢溶 液分解产生氧气。
03 催化剂和催化作用
1.催化剂的概念
在化学反应里能改变其他物质的化 学反应速率,而本身的质量和化学 性质在反应前后都没有变化的物质 叫催化剂(又叫触媒) 。
2.化合反应和分解反应的区别
反应类型
化合反应
分解反应
定义
由两种或两种以上的物质 由一种物质生成两种或两 生成另一种物质的反应 种以上其他物质的反应
形式
A + B → AB(多变一) AB → A + B (一变多)
参加反应的 物质种类
生成物质的 种类
两种或两种以上 一种
一种 两种或两种以上
课堂小结
如果开始便将红热的木炭伸入盛有氧气的集气瓶底部,因木 炭在氧气中燃烧放出大量的热并产生二氧化碳,易使集气瓶 中的氧气逸出损失,会迅速使瓶中氧气的含量降低,影响实 验现象。
03 氧气的工业制法
工业生产要考虑很多实际情况
例如:原料是否易得 价格是否便宜 成本是否低廉 能否大量生产 对环境的影响
1.原理
(1)导管口塞一团棉花
防止加热时高锰酸钾粉末进入 导管
(4)加热时要先预热,再对准药品 部位加热
防止受热不均匀,使试管炸裂
(2)导管伸入试管不能太长 便于气体顺利排出
(3)试管口略向下倾斜
(5)等有连续均匀的气泡产生时再收集
刚产生的气泡中混有空气, 这时的气体不纯 (6)实验完毕先撤导管,后移酒精灯
九年级上册化学制取氧气的3个方法

九年级上册化学制取氧气的3个方法制取氧气是化学实验中常见的一个内容,有多种方法可以制取氧气。
下面将介绍三种制取氧气的方法,并详细说明其原理和实验步骤。
第一种方法是使用过氧化铅酸钾制取氧气。
过氧化铅酸钾(化学式为K2O2)在分解时可以释放出氧气。
实验步骤如下:1.准备好实验器材,包括过氧化铅酸钾、试剂瓶、试管、水槽等。
2.将过氧化铅酸钾加入试管中,大约取1克左右。
3.在实验操作过程中要细心,避免实验中物品碰撞或撞击试管。
4.将试管放在水槽中,加入适量的水,使水杂质溶解。
5.用滴管加入少量酒精,在试管中打燃即可,观察到火焰即产生了氧气。
6.将试管放在水中,进行水浴,等待过氧化铅酸钾完全分解产生氧气。
7.过程中可以用酒精灯或火花直接点燃氧气,观察氧气燃烧的特性。
第二种方法是使用氢氧化钠和氯酸钾制取氧气。
氢氧化钠和氯酸钾反应会生成氧气。
实验步骤如下:1.准备好实验器材,包括氢氧化钠、氯酸钾、试剂瓶、试管、水槽等。
2.将氢氧化钠和氯酸钾分别加入两个试管中,每个试管取约1克左右。
3.将两个试管放在水槽中,加入适量的水,使水杂质溶解。
4.用滴管分别向两个试管中加入少量酒精,并用酒精灯依次点燃两个试管中的酒精,观察到火焰即产生了氧气。
5.将试管放在水中,进行水浴,等待反应完全进行产生氧气。
6.过程中可以用酒精灯或火花直接点燃氧气,观察氧气燃烧的特性。
第三种方法是使用高锰酸钾制取氧气。
高锰酸钾在加热时能够分解产生氧气。
实验步骤如下:1.准备好实验器材,包括高锰酸钾、试剂瓶、试管、水槽等。
2.将高锰酸钾加入试管中,大约取0.5克左右。
3.将试管放在水槽中,加入适量的水,使水杂质溶解。
4.用滴管加入少量浓硫酸,使其充分溶解。
5.加热试管,可以用酒精灯或火焰加热,观察到氧气的产生。
6.过程中注意安全,避免试管破裂或氧气泄漏。
这三种方法都可以制取氧气,但要注意在实验过程中要遵守安全操作规范,戴好防护眼镜和手套,避免发生意外。
人教版九年级化学上册第二单元课题3制取氧气

(4)在实验③中,等试管内无气泡冒出时,再加入过氧化氢溶液, 发 现 _ _ _ _仍_ _能_产_ _生_ _气_泡_ , 说 明 在 该 过 程 中 二 氧 化 锰 的 化 学 性 质 ___不__变____(填“改变”或“不变”)。
知识点一 实验室制取氧气的原理 1.实验室制取氧气的原理(用文字表达式): ①__高__锰__酸__钾__―_加_―_热→__锰__酸 ___钾__+__二__氧__化__锰__+__氧__气__; ②__氯__酸__钾__二_―_氧 加_―_化 热_→_锰__氯__化__钾__+__氧__气_______; ③__过__氧__化__氢__二_―_氧_―_化_→_锰__水__+__氧__气________。
1.用下列各组物质,可以较快地制得氧气的是( C )
①纯净的氯酸钾 ②纯净的二氧化锰 ③混有高锰酸钾的氯酸钾
④混有二氧化锰的过氧化氢
A.只有②
B.②和③
C.③和④
D.①②③④
2.(2014,宿迁)下列有关氧气的制取、收集、验满、性质的实验
中错误的是( D )
3.(2014,来宾)下列关于催化剂的说法,正确的是( A ) A.催化剂能改变化学反应速率 B.反应前后催化剂的质量改变 C.催化剂能加快化学反应速率 D.反应前后催化剂的化学性质改变
13.(2014,南京)根据下列装置图,回答有关问题: (1)写出装置图中标号仪器的名称: a__试__管____;b__集__气__瓶____。
人教版九年级化学第二单元课题3制取氧气知识归纳
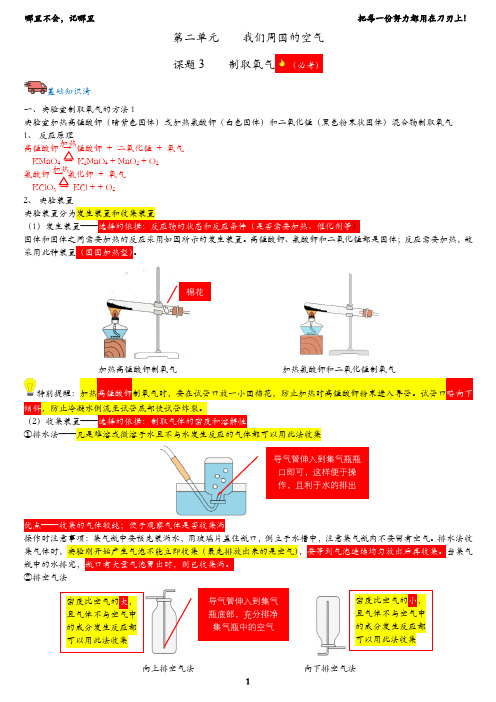
哪里不会,记哪里 把每一份努力都用在刀刃上!第二单元 我们周围的空气 课题3 制取氧气基础知识清一、实验室制取氧气的方法1实验室加热高锰酸钾(暗紫色固体)或加热氯酸钾(白色固体)和二氧化锰(黑色粉末状固体)混合物制取氧气1、 反应原理高锰酸钾 →锰酸钾 + 二氧化锰 + 氧气 KMnO 4 →K 2MnO 4 + MnO 2 + O 2氯酸钾 → 氯化钾 +氧气 KClO 3→ KCl + + O 2 2、 实验装置 实验装置分为发生装置和收集装置(1)发生装置——)固体和固体之间需要加热的反应采用如图所示的发生装置。
高锰酸钾、氯酸钾和二氧化锰都是固体;反应需要加热,故采用此种装置。
加热高锰酸钾制氧气 加热氯酸钾和二氧化锰制氧气特别提醒:加热高锰酸钾制氧气时,要在试管口放一小团棉花,防止加热时高锰酸钾粉末进入导管。
试管口略向下,防止冷凝水倒流至试管底部使试管炸裂。
(2)收集装置——①排水法——凡是难溶或微溶于水且不与水发生反应的气体都可以用此法收集操作时注意事项:集气瓶中要预先装满水,用玻璃片盖住瓶口,倒立于水槽中,注意集气瓶内不要留有空气。
排水法收集气体时,实验刚开始产生气泡不能立即收集(最先排放出来的是空气),当集气瓶中的水排完, ②排空气法向上排空气法 向下排空气法加热加热(3)多功能瓶的使用 ②)如图①:密度大于空气的气体从)先将瓶内装满水,气体从)如果要测定某气体的体积,特别提醒:①仪器的组装要按先下后上、从左到右的顺序进行;②药品平铺在试管底部的目的是增大受热面积,便于均匀受热;③试管口放一团棉花是为了防止加热时高锰酸钾粉末进入导管;④试管内的导管略露出橡胶塞即可,便于气体导出;⑤试管口略向下倾斜是为了防止冷凝水回流使试管炸裂;⑥集气瓶充满水后盖上毛玻璃片,倒放在水槽中;⑦应注意当导管口有气泡连续并比较均匀冒出时,才能收集氧气,否则收集的氧气中混有空气;⑧集满氧气的集气瓶应盖上玻璃片,正放,因为氧气的密度比空气的略大,正放可减少氧气逸散;⑨停止加热时,应先将导管从水槽中撤出,再熄灭酒精灯,以防止水槽中的水倒吸,炸裂试管。
初三化学 课题3 制取氧气

16.某同学设计了4种制氧气的方案:①用氯酸钾和二氧化
锰共热;②使高锰酸钾受热;③用高锰酸钾和氯酸钾共
C 热;④使二氧化锰受热.判断这四种方法:( )
小结: 实验室制取氧气的原理
过氧化氢 二氧化锰 水 + 氧气
红砖粉、
H2O2 MnO2 H2O + O2
氯酸钾
二氧化锰 加热
氯化钾 + 氧气
氧化铜、 氧化铁也 可以作这
KClO3 高锰酸钾
MnO2
△
加热
KCl + O2 锰酸钾+二氧化锰+氧气
二个反应 的催化剂
KMnO4 △
K2MnO4 + MnO2 + O2
氮气先蒸发
空气 低温加压 液态空气 蒸发
液态氧气
分离液态空气过程,没有生成新的物质
(共23小题)
1.下列反应属于分解反应的是( D )
A. 硫 + 氧气 点燃 二氧化硫 B. 石蜡 + 氧气 点燃二氧化碳 + 水 C. 铁 + 氧气 点燃四氧化三铁 D. 氧化汞 加热汞 + 氧气
2、下列化学反应中,属于氧化反应的是(AC),
H2O2 MnO2 H2O + O2 (符号表达式)
【说明】此反应中,二氧化锰既不是反应物 也不是生成物,是催化剂,是反应条件,所 以写在箭头的上方。
塞子
实验室用过氧化氢(H2O2) 活塞
和二氧化锰制取氧气的装置
图,如何在装置中加入这二种
药品?先加固体后加液体
九年级化学实验室制氧气的三种方法化学式
初中化学的重点,也是历年中考的热点。
我们不仅要学好氧气制取的知识,而且要触类旁通,逐步掌握实验室制取气体的一般思路和方法。
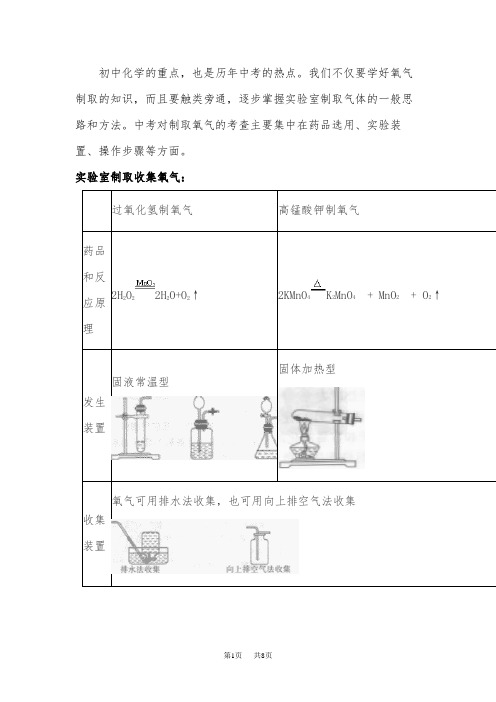
中考对制取氧气的考查主要集中在药品选用、实验装2H2O22H2O+O2↑2KMnO4K2MnO4+ MnO2+ O2↑固体加热型固液常温型氧气可用排水法收集,也可用向上排空气法收集氧气的用途用途作用:冶炼工艺在炼钢过程中吹以高纯度氧气,氧便和碳及磷、硫、硅等起氧化反应,这不但降低了钢的含碳量,还有利于清除磷、硫、硅等杂质。
而且氧化过程中产生的热量足以维持炼钢过程所需的温度,因此,吹氧不但缩短了冶炼时间,同时提高了钢的质量。
高炉炼铁时,提高鼓风中的氧浓度可以降焦比,提高产量。
在有色金属冶炼中,采用富氧也可以缩短冶炼时间提高产量。
化学工业在生产合成氨时,氧气主要用于原料气的氧化,以强化工艺过程,提高化肥产量。
再例如,重油的高温裂化,以及煤粉的气化等。
国防工业液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂,可燃物质浸渍液氧后具有强烈的爆炸性,可制作液氧炸药。
医疗保健供给呼吸:用于缺氧、低氧或无氧环境,例如:潜水作业、登山运动、高空飞行、宇宙航行、医疗抢救等时。
其它方面如:它本身作为助燃剂与乙炔、丙烷等可燃气体配合使用,达到焊割金属的作用,各行各业中,特别是机械企业里用途很广,作为切割之用也很方便,是首选的一种切割方法。
过度吸氧负作用:早在19世纪中叶,英国科学家保尔·伯特首先发现,如果让动物呼吸纯氧会引起中毒,人类也同样。
氧气瓶氧气瓶人如果在大于0.05MPa(半个大气压)的纯氧环境中,对所有的细胞都有毒害作用,吸入时间过长,就可能发生“氧中毒”。
肺部毛细管屏障被破坏,导致肺水肿、肺淤血和出血,严重影响呼吸功能,进而使各脏器缺氧而发生损害。
在0.1MPa(1个大气压)的纯氧环境中,人只能存活24小时,就会发生肺炎,最终导致呼吸衰竭、窒息而死。
人在0.2MPa(2个大气压)高压纯氧环境中,最多可停留1.5小时~2小时,超过了会引起脑中毒,生命节奏紊乱,精神错乱,记忆丧失。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
