第13章习题答案
大学物理课本答案习题 第十三章习题解答

习题十三13-1 如题图13-1所示,两条平行长直导线和一个矩形导线框共面,且导线框的一个边与长直导线平行,到两长直导线的距离分别为1r ,2r 。
已知两导线中电流都为0sin I I t ω=,其中I 0和ω为常数,t 为时间。
导线框长为a ,宽为b ,求导线框中的感应电动势。
解:无限长直电流激发的磁感应强度为02IB rμ=π。
取坐标Ox 垂直于直导线,坐标原点取在矩形导线框的左边框上,坐标正方向为水平向右。
取回路的绕行正方向为顺时针。
由场强的叠加原理可得x 处的磁感应强度大小00122()2()IIB r x r x μμ=+π+π+方向垂直纸面向里。
通过微分面积d d S a x =的磁通量为00m 12d d d d 2()2()I I B S B S a x r x r x μμΦππ⎡⎤=⋅==+⎢⎥++⎣⎦通过矩形线圈的磁通量为00m 012d 2()2()b I I a x r x r x μμΦ⎡⎤=+⎢⎥π+π+⎣⎦⎰012012ln ln sin 2a r b r b I t r r μω⎛⎫++=+ ⎪π⎝⎭ 感生电动势0m 12012d ln ln cos d 2i a r b r b I t t r r μωΦεω⎛⎫++=-=-+ ⎪π⎝⎭ 012012()()ln cos 2ar b r b I t r r μωω⎡⎤++=-⎢⎥π⎣⎦0i ε>时,回路中感应电动势的实际方向为顺时针;0i ε<时,回路中感应电动势的实际方向为逆时针。
13-2 如题图13-2所示,有一半径为r =10cm 的多匝圆形线圈,匝数N =100,置于均匀磁场B 中(B =0.5T )。
圆形线圈可绕通过圆心的轴O 1O 2转动,转速1600r min n -=⋅。
求圆线圈自图示的初始位置转过题图13-1题图13-2解图13-1/2π时,(1) 线圈中的瞬时电流值(线圈的电阻为R =100Ω,不计自感); (2) 圆心处磁感应强度。
武汉大学版无机化学课后习题答案(第三版)第13章 配位化学原理

配位化学基础1.某物质的实验式为PtCl 4・2NH 3,其水溶液不导电,加入AgNO 3亦不产生沉淀,以强碱处理并没有NH 3放出,写出它的配位化学式。
解[Pt(NH 3)2Cl 4]2. 下列化合物中哪些是配合物?哪些是螯合物?哪些是复盐?哪些是简单盐?(1)CuS0”・5HQ (2)KPtCl4226(3)Co(NH 3)6Cl 3(4)Ni(en)2Cl 2(5)(NH )o S0/FeS0/6HQ (6)Cu (NHCHCOO )o42442222(7)Cu (OOCCH 3)2(8)KClMgCl 2・6H 2O 解配合物:K 2PtCl 6,C O (NH 3)6C13,C U SO 4・5H 2O螯合物:Ni(en)2Cl 2,Cu(NH 2CH 2COO)2复盐:(NH 4)2SO 4・FeSO 4・6H 2OKClMgCl^^O 简单盐:Cu(OOCH 3)2(3) 三氯化三(乙二胺)合钻(III ) (4) 氯化二氯•四水合钻(III ) (5) 二水合溴化二溴•四水合钻(III ) (6) 羟・水•草酸根•乙二胺合铬(III ) (7) 六硝基合钻(III )配阴离子 (8) 氯•硝基•四氨合钻(III )配阳离子(9)三氯•水•二吡啶合铬(III )(10)二氨•草酸根合镍(II )3. 命名下列各配合物和配离子:(1)(NH 4)3[SbCl 6] (3)[Co (en )3]Cl 3(5)[Cr (H 2O )4Br 2]Br.2H 2O (7)Co (NO 2)6]3 (9)[Cr (Py )2(H 2O )Cl 3] 解(1)六氯合锑(III )酸铵(2)四氢合铝(III )酸锂(2)Li[AlH 4] (4)[Co (H 2O )4Cl 2]Cl6)[Cr (H 2O )(en )(C 2O 4)(OH )2248)[Co (NH 3)4(NO 2)C]+ 10)[Ni (NH 3)2(C 2O 4)]4. 指出下列配合物的空间构型并画出它们可能存在的立体异构体:1)[Pt (NH 3)2(NO 2)Cl] 3)Pt (NH 3)2(OH )2Cl 2] 5)[Co (NH 3)3(OH )3] 7)[Cr (en )2(SCN )2]SCN 9)[Co (NH 3)(en )Cl 3](2)Pt (Py )(NH 3)ClBr] (4)NH 4[Co (NH 3)2(NO 2)4] (6)[Ni (NH 3)2Cl 2] (8)[Co (en )3]Cl 310)[Co (en )2(NO 2)2]Cl 2解(1)[Pt (NH 3)2(NO 2)Cl]平面正方形2种异构体H 3NH 3N3)[Pt(NH 3)2(OH)2Cl 2]八面体5种异构体H 3N 2)OHHOHONH 3210)[Co(en)2(NO 2)2]Cl 2ClNH 3 HOOH八面体7) 8) [Co(NH 3)3(OH)3]八面体 H 3NOH[Ni(NH 3)2Cl 2] 无异构体[Cr(en)2(SCN)2]SCN[Cr(en)2(SCN)2]-八面体 [Co(en)3]Cl 3[Co(en)3]3+ 八面体2种异构体[Co(NH 3)(en)Cl 3]八面体2种异构体5) 4)[Co(NH 3)2(NO 2)4]-NH 32种异构体NO 2NH3四面体 2种异构体NH 3SCNNCS2种异构体en24.90B.M 。
电工学第三版第13章答案

返回练习题集
上一题
下一题
13.3.2 图示电路 是右移寄存器还是左 移寄存器?设待存数 码为 1001 ,画出 Q4 、Q3、Q2 和 Q1 的波 形,列出状态表。
解: 波形如图。
CP Q4 Q3 Q2 Q1
J
1 CP
Q4
Q3
Q2
Q1
J
J
J
J
C
C
C
C
K
K
K
K
CP 顺序 J
0
0
1
1
2
0
3
0
4
1
5
0
6
练习题解答
13.1.1 图示电路是可以 用来产生单脉冲的电路。试分 析其产生单脉冲的原理,画出 Q 和 Q 的波形。
解:
+5V
1k?
1k?
R
S
RS
Q
Q Q
返回练习题集
下一题
13.1.2 初始状态为 0
的基本 R-S 触发器(低
电平有效), R 和 S 端 R 的输入信号波形如图所示 S
,求 Q 和 Q 的波形。
Q
解:波形如图。
Q
返回练习题集
上一题
下一题
13.2.1 已知图示电路中各输入端的波形如图所示, 工 作前各触发器先置 0 , 求 Q1、Q2 和 Q3 的波形。
Q1 Q1 S CR
Q2 Q2 C
JK
Q3 Q3 C
D
CP
A1
RD CP
A2
AA21
解: 波形如图。
Q1
Q2
Q3
返回练习题集
上一题
下一题
解: 为左移寄存器。
材料力学习题册答案-第13章 能量法

5.如下图刚架受一对平衡力F作用,各段的EI相同且等于常量,试用图乘法求两端A、B间的相对转角。
解:应用图乘法,在A、B点加一对单位力偶。它们的内力图如下图。
6.图示刚架,各段的抗弯刚度均为EI。试计算B截面的水平位移和C截面的转角。
解:应用图乘法,在B截面加一水平单位力,在C截面加一单位力偶,它们的内力图如下图。
第十三章能量法
一、选择题
1.一圆轴在图1所示两种受扭情况下,其〔A〕。
A应变能相同,自由端扭转角不同;
B应变能不同,自由端扭转角相同;
C应变能和自由端扭转角均相同;
D应变能和自由端扭转角均不同。
〔图1〕
2.图2所示悬臂梁,当单独作用力F时,截面B的转角为θ,假设先加力偶M,后加F,那么在加F的过程中,力偶M〔C〕。
A不做功;B做正功;
C做负功,其值为 ;D做负功,其值为 。
3.图2所示悬臂梁,加载次序有下述三种方式:第一种为F、M同时按比例施加;第二种为先加F,后加M;第三种为先加M,后加F。在线弹性范围内,它们的变形能应为〔D〕。
A第一种大;B第二种大;
C第三种大;D一样大。
4.图3所示等截面直杆,受一对大小相等,方向相反的力F作用。假设杆的拉压刚度为EA,材料的泊松比为μ,那么由功的互等定理可知,该杆的轴向变形为 ,l为杆件长度。〔提示:在杆的轴向施加另一组拉力F。〕
A 0;B ;
C ;D无法确定。
〔图2〕〔图3〕
二、计算题
1.图示静定桁架,各杆的拉压刚度均为EA相等。试求节点C的水平位移。
解:解法1-功能原理,因为要求的水平位移与P力方向一致,所以可以用这种方法。
由静力学知识可简单地求出各杆的内力,如下表所示。
第13章 带传动习题1答案

第13章带传动(第一次作业)一、填空:1. 带传动由主动轮、从动轮和紧套在两轮上的带组成,依靠带与带轮之间的摩擦力进行传动。
2. 带传动中,带中产生的应力有:___拉应力____、_____弯曲应力____、__离应力___三种。
3. 带传动运转时应使带的__松 __边在上, _紧__边在下,目的是__增大包角___。
4. 主动轮的有效拉力与_____初拉力____、_____当量摩擦系数____、_____包角_____有关。
5. 当A型V带的初步计算长度为1150时,其基准长度为_____1120_______。
6. 单根V带所能传递的功率与___速度__、___当量摩擦系数___、__包角___有关。
7. 已知V带的截面夹角是40度,带轮轮槽的ϕ角应比40__小_,且轮径越小,ϕ角越_小_。
8. 带传动中的初拉力F0是由于______安装时把带张紧______产生的拉力。
运转时,即将进入主动轮的一边,拉力由F0______增大______到F1;而将进入从动轮的一边,拉力由F0_______降低_____到F2。
有效拉力为_____ F=F1-F2_______。
9. 带传动中,若小带轮为主动轮,则带的最大应力发生在带___进入主动轮 _处,其值为_σ1+ σb1+ σc___。
二、选择:10.空载时,(静止时??)带的紧边拉力与松边拉力的比值F1/F2是_____A _______A. 1B. e fαC. 0D.1<F1/F2<e fα11. 小带轮直径取值要求d1>=dmin,是因为______ C ______。
A. 小带轮直径必须标准化B. 限制中心距C. 不使带中的弯曲应力过大12. 带传动的优点是______ C______。
A. 结构紧凑,制造成本低廉B. 结构简单,传动比准确,中心距便于调整14. V带(三角带)传动的带轮基准直径应取为_____B_______。
工程光学-郁道银-第13章光的衍射课后习题答案
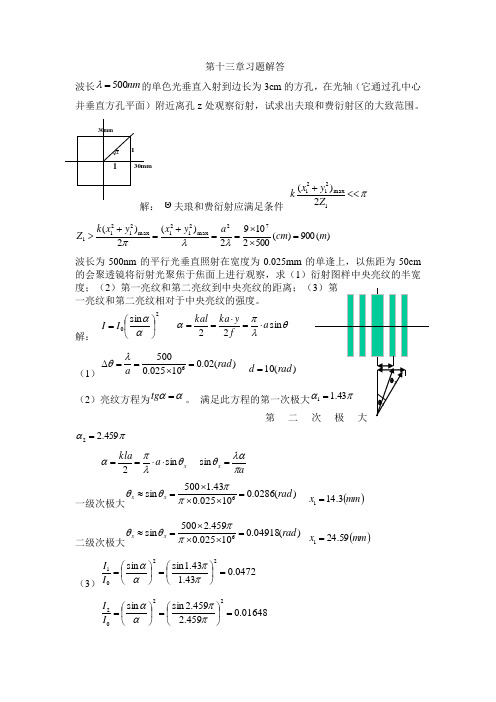
1θ2θ2mm3011mm 30第十三章习题解答波长nm 500=λ的单色光垂直入射到边长为3cm 的方孔,在光轴(它通过孔中心并垂直方孔平面)附近离孔z 处观察衍射,试求出夫琅和费衍射区的大致范围。
解: 夫琅和费衍射应满足条件 π<<+1max 21212)(Z y x k)(900)(50021092)(2)(72max 2121max 21211m cm a y x y x k Z =⨯⨯==+=+>λλπ波长为500nm 的平行光垂直照射在宽度为0.025mm 的单逢上,以焦距为50cm的会聚透镜将衍射光聚焦于焦面上进行观察,求(1)衍射图样中央亮纹的半宽度;(2)第一亮纹和第二亮纹到中央亮纹的距离;(3)第一亮纹和第二亮纹相对于中央亮纹的强度。
解: 20sin ⎪⎭⎫⎝⎛=ααI I θλπαs i n 22a f y ka kal ⋅=⋅==(1))(02.010025.05006rad a=⨯==∆λθ )(10rad d =(2)亮纹方程为αα=tg 。
满足此方程的第一次极大πα43.11= 第二次极大πα459.22=x a k l a θλπαs i n 2⋅⋅==a x πλαθ=sin 一级次极大)(0286.010025.043.1500sin 6rad x x =⨯⨯⨯=≈ππθθ ()mm x 3.141=二级次极大)(04918.010025.0459.2500sin 6rad x x =⨯⨯⨯=≈ππθθ ()mm x 59.241=(3)0472.043.143.1sin sin 2201=⎪⎭⎫⎝⎛=⎪⎭⎫ ⎝⎛=ππααI I01648.0459.2459.2s i n s i n 2202=⎪⎭⎫ ⎝⎛=⎪⎭⎫ ⎝⎛=ππααI I10.若望远镜能分辨角距离为rad 7103-⨯的两颗星,它的物镜的最小直径是多少?同时为了充分利用望远镜的分辨率,望远镜应有多大的放大率?解:D λθ22.10= )(24.21031055022.179m D =⨯⨯⨯=--⨯-=⨯⨯⨯⨯⨯=''=Γ969310180606060067πϕ11. 若要使照相机感光胶片能分辨m μ2线距,(1)感光胶片的分辨率至少是没毫米多少线;(2)照相机镜头的相对孔径f D至少是多大?(设光波波长550nm ) 解:)(50010213mm N 线=⨯=-3355.01490=≈'NfD12. 一台显微镜的数值孔径为0。
第13章 过渡元素 习题参考答案

第13章 过渡元素 习题参考答案1.解:(1) TiO 2+ H 2SO 4(浓) −→−∆TiOSO 4+ H 2O (2) TiCl 4 + 3H 2O → H 2TiO 3↓ + 4HCl↑ (3) VO 43-+ 4H +(过量) → VO 2+ +2H 2O(4) 2VO 2++ SO 32-+ 2H + → 2VO + +SO 42-+H 2O (5) 5VO 2++ MnO 4-+H 2O→ 5VO 2+ + Mn 2++ 2H + (6)V 2O 5 + 6H + + 2Cl - → 2VO 2+ + Cl 2↑+ 3H 2O(浓HCl)(7) V 2O 5 + 6OH -−→−冷2VO 43- + 3H 2O V 2O 5 + 2OH -−→−热2VO 3- + H 2O 2.解: 最终产物分别为VO 2+、V 3+ 、V 2+3.解:(1) 2[Cr(OH)4]- + 3Br 2+ 8OH -→ 2CrO 42- + 6Br -+ 8H 2O(浓HCl)(2) Cr 2O 72- + 3H 2S+ 8H + → 2 Cr 3+ + 3S ↓+ 7H 2O (3) Cr 2O 72-+ 6I -+ 14H + → 2 Cr 3+ + 3I 2 + 7H 2O (4) Cr 2O 72- + 14H + + 6Cl - →2 Cr 3++ 3Cl 2↑ + 7H 2O(浓HCl)(5) Cr 2O 3+ 3K 2S 2O 7+ 6H + → 2Mn 2+ +5O 2↑+ 8H 2O (6) 2Cr 3++ 3S 2-+ 6H 2O → 2 Cr(OH)3↓+ 3H 2S ↑ 4.解:5.解: f K ([Fe(bipy)3]2+)=4.32⨯1018; 即[Fe(bipy)3]2+更稳定 6.解:A 是K 2MnO 4(1)3 MnO 42- + 2CO 2 → MnO 2↓+ 2MnO 4- + 2CO 32-(A) (B) (C) MnO 2 + 4HCl(浓) → MnCl 2 + Cl 2↑+ 2H 2O (B) (D)(2)3Mn 2+ + 2MnO 4- + 2H 2O → 5MnO 2↓ + 4H +(C) (B)Cl 2 + 2MnO 42- → 2MnO 4- + 2Cl - (D) (A) (C) 7.解:(1) 2MnO 4- + 16H + + 10Cl - → 2Mn 2+ +5Cl 2↑+ 8H 2O(浓HCl)(2) 2MnO 4- + 3NO 2- + H 2O → 2MnO 2↓+ 3NO 3- + 2OH -(3) 2Mn 2+ + 5NaBiO 3 + 14H + → 2MnO 4- + 5Bi 3+ + 5Na + + 7H 2O (4) 2MnO 4- + NO 2- + 2OH - → 2MnO 42-+ NO 3- + H 2O (5) 2MnO 4- + 5H 2O 2 + 6H + → 2Mn 2+ +5O 2↑+ 8H 2O 8.解:此棕黑色粉末为MnO 2。
软件测试 第2版慕课版习题答案 第13章 课后习题答案

第13章软件测试的拓展与提高课后习题及答案
1.企业的测试策略体现在几个方面?
(1)合理地减少测试工作量。
通过以下方式减少测试工作量。
①减少冗余的测试。
②减少无价值的测试。
(2)提高测试效率。
2.为什么要制订测试计划?
(1)测试计划文档为完成测试任务提供便利。
(2)测试计划文档改善测试任务与测试过程之间的联系。
(3)测试计划文档为组织、规划与管理测试项目提供支持。
3.简述基于CMMl的测试流程和传统测试流程的区别。
基于CMMl的测试流程从全局的角度来看,主要是在V模型的基础上在需求分析、概要设计和详细设计阶段增加了需求测试、概要设计测试和详细设计测试3个环节
4.通过调研,了解当前互联网公司是如何将DevOps部署到企业的软件质量保障流程中的。
使用DevOps自动化工具
(1)Jenkins
(2)Maven
(3)DOCker+Jenkins打造自动化测试。
大学物理Ⅰ第13章光的干涉与衍射习题答案

第13章 光的干涉与衍射训练题(含答案)一、选择题1. 如图所示,折射率为n 2、厚度为e 的透明介质薄膜的上方和下方的透明介质的折射率分别为n 1和n 3,已知n 1< n 2> n 3。
若用波长为λ的单色平行光垂直入射到该薄膜上,则从薄膜上、下两表面反射的光束(用①与②示意)的光程差是[ ] (A ) e n 22 (B) 222λ-e n(C) λ-e n 22 (D) 2222n e n λ-2.真空波长为λ的单色光,在折射率为n 的均匀透明介质中从A 点沿某一路径传播到B 点,路径的长度为l 。
若l 等于下列各选项给出的值,A 、B 两点光振动位相差记为ϕ∆,则[ ] (A) 3, 32l λϕπ=∆= (B) πϕλn nl 3,23=∆=(C) πϕλ3,23=∆=nl (D) πϕλn nl 3,23=∆=3. 在双缝干涉实验中,两缝隙间距离为d ,双缝与屏幕之间的距离为)(d D D >>。
波长为λ的平行单色光垂直照射到双缝上。
屏幕上干涉条纹中相邻暗纹之间的距离是 [ ] (A)d D λ2 (B) D dλ (C) λdD (D) dDλ4. 如图所示,用波长为λ的单色光照射双缝干涉实验装置,若将一折射率为n 、劈角为α的透明劈尖b 插入光线2中,则当劈尖b 缓慢向上移动时(只遮住S 2),屏C 上的干涉条纹[ ] (A) 间隔变大,向下移动。
(B) 间隔变小,向上移动。
(C) 间隔不变,向下移动。
(D) 间隔不变,向上移动。
5. 把一平凸透镜放在平玻璃上,构成牛顿环装置。
当平凸透镜慢慢地向上平移时,由反射光形成的牛顿环[ ] (A) 向中心收缩,条纹间隔变小。
Sλ3(B) 向中心收缩,环心呈明暗交替变化。
(C) 向外扩张,环心呈明暗交替变化。
(D) 向外扩张,条纹间隔变大。
6. 根据惠更斯-菲涅耳原理,若已知光在某时刻的波阵面为S ,则S 的前方某点P 的光强度决定于波阵面S 上所有面积元发出的子波各自传到P 点的 [ ] (A) 振动振幅之和。
第13章非参数检验习题答案

第13章非参数检验教材习题答案13.1 为了解一种节能灯的使用寿命,随机抽取了8只灯泡,测得其使用寿命(:小时时)如命(单单位:小下:3250 3500 2850 3700 3010 2910 2980 3420 (1)检验该种节能灯的使用寿命是否服从正态分布?(a=0.05) (1)检验该种节能灯使用寿命的中位数是否等于3000小时?(a=0.05) 详细答案:(1)K—S检验结果如下表:精确双尾概率,不拒绝原假设,没有证据表明该种节能灯的使用寿命不服从正态分布。
(2)中位数的符号检验如下表:精确的双尾概率为,不拒绝原假设,没有证据表明该种节能灯的使用寿命的实际中位数与3000有显著差异。
13.2 利用13.1题的数据,采用Wilcoxon符号秩检验该种节能灯使用寿命的中位数是否等于3000小时?(a=0.05) 详细答案:检验结果如下表精确的双尾概率,不拒绝原假设。
没有证据表明该种节能灯的使用寿命的实际中位数与3000有显著差异。
13.3 为分析股票的每股收益状况,在某证券市场上随机抽取10只股票,得到2005年和2006股收益年的每股收益数据如下表,采用Wilcoxon符号秩检验分析:2007年与2006年相比,每,每股是否有显著提高?(a=0.05) 股票代码2006年每股收益(元)2007年每股收益(元)1 0.12 0.26 2 0.95 0.87 3 0.20 0.24 4 0.02 0.12 5 0.05 0.13 6 0.56 0.51 7 0.31 0.35 8 0.25 0.42 9 0.16 0.37 10 0.06 0.05 详细答案:配对样本的Wilcoxon符号秩检验如下表:精确的单尾,拒绝,2006年与2005年相比每股收益有显著提高。
13.4 某种品牌的彩电在两个城市销售,其中在A城市有6个商场销售,在B城市有8个商场销售,下表是各商场一年的销售量(单位:台)。
第13章 光的干涉习题答案

思 考 题13-1.单色光从空气射入水中,则( )(A )频率、波长和波速都将变小 (B )频率不变、波长和波速都变大 (C )频率不变,波长波速都变小 (D )频率、波长和波速都不变 答:频率ν不变,nλλ=,vcn =,而水空气n n <,故选(C ) 13-2.如图所示,波长为λ的单色平行光垂直入射到折射率为n 2、厚度为e 的透明介质薄膜上,薄膜上下两边透明介质的折射率分别为n 1和n 3,已知n 1<n 2, n 2>n 3,则从薄膜上下两表面反射的两光束的光程差是( )(A)2en 2。
(B) 2en 2+2λ。
(C) 2en 2-λ。
(D) 2en 2+22n λ。
答:由n 1<n 2, n 2>n 3可知,光线在薄膜上下两表面反射时有半波损失,故选(B)。
13-3 来自不同光源的两束白光,例如两束手电筒光,照射在同一区域内,是不能产生干涉花样的,这是由于( )(A) 白光是由许多不同波长的光构成的。
(B) 来自不同光源的光,不能具有正好相同的频率。
(C) 两光源发出的光强度不同。
(D) 两个光源是独立的,不是相干光源。
答:普通的独立光源是非相干光源。
选(D )。
13-4在双缝干涉实验中,为使屏上的干涉条纹间距变大,可以采取的办法是(A)使屏靠近双缝。
(B)使两缝的间距变小。
(C)把两个缝的宽度稍微调窄。
(D)改用波长较小的单色光源。
答:由条纹间距公式af x λ2=∆,可知选(B )。
13-5.在杨氏双缝实验中,如以过双缝中点垂直的直线为轴,将缝转过一个角度α,转动方向如图所示,则在屏幕上干涉的中央明纹将( )(A)向上移动 (B)向下移动 (C)不动 (D)消失答:中央明纹出现的位置是光通过双缝后到屏幕上光程差为0的地方,故选(A ) 13-6.在双缝干涉实验中,入射光的波长为λ,用玻璃纸遮住双缝中的一条缝,若玻璃纸中的光程比相同厚度的空气的光程大2.5λ,则屏上原来的明纹处( )(A) 仍为明条纹思考题13-5图(B) 变为暗条纹(C) 既非明条纹,也非暗条纹(D) 无法确定是明条纹还是暗条纹 答:明条纹和暗条纹光程差2λ,故选(B)。
物理化学中国石油大学课后习题答案第13章

粘度近似等于水的粘度,为 0.001kg ⋅ m−1 ⋅s−1 (即 Pa ⋅s )。
解:当粒子在重力场中达到沉降平衡时,有沉降力 = 粘滞阻力,即
-2-
物理化学习题解答
( ) 4 π r3
3
ρ粒子 − ρ介质
g ≈ 6πηr Δx Δt
故 Δt =
6ηΔx
1=
6× 0.001× 0.01
1
( ) ( ) 4
解:
胶核
(
Au
) m
优先吸附与其有共同组成的
AuO2−
,因此胶团结构为
⎡⎣(
Au
) m
⋅
nAuO
− 2
,
(
n
−
x
)
Na
+
⎤⎦
x
−
⋅
xNa
+
2 . 某 溶 胶 中 粒 子 的 平 均 直 径 为 4.2nm , 设 其 粘 度 和 纯 水 相 同 ,
η = 1×10−3 kg ⋅ m−1 ⋅ s−1 ,试计算:
−
⎤
960 )× 9.8 ⎥
⎥ ⎥ ⎥
Pα
⎢⎣
1 6 .7
⎥⎦
=1.023P α ⋅ s
5.试计算在 293K 时,地心力场中使粒子半径分别为(1) 1.0×10−5 m ,(2)
100nm ,(3) 1.5nm 的金溶胶下降 0.01m 需时若干。
已知分散介质的密度为1000kg ⋅ m−3 ,金的密度为1.93×104 kg ⋅ m−3 ,溶液的
Δt = ⎢2.51×10−10 × ⎢ ⎣
1 1.0 ×10−7
⎤
2
⎥ ⎥
s
有机化学课后习题答案第13章
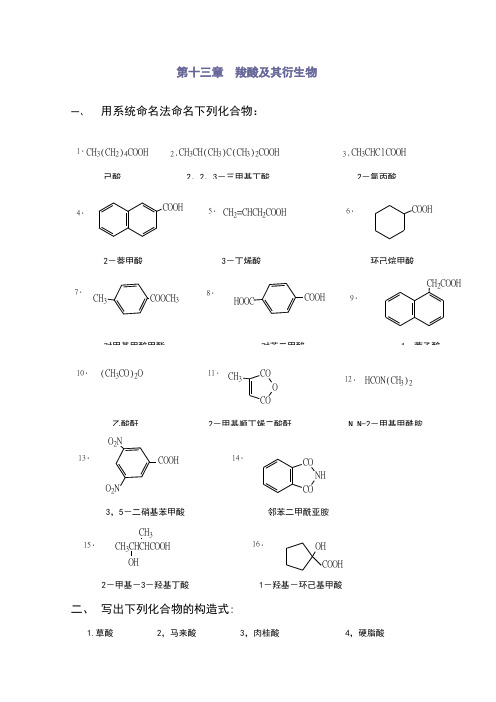
第十三章 羧酸及其衍生物一、 用系统命名法命名下列化合物:1.CH 3(CH 2)4COOH2.CH 3CH(CH 3)C(CH 3)2COOH3.CH 3CHClCOOH4.COOH5.CH 2=CHCH 2COOH6.COOH7.CH 3COOCH 38.HOOCCOOH9.CH 2COOH10.(CH 3CO)2O11.COO CO CH 312.HCON(CH 3)213.COOHO 2NO 2N14.CO NH3,5-二硝基苯甲酸 邻苯二甲酰亚胺15.CH 3CHCHCOOH CH 3OH16.OH COOH2-甲基-3-羟基丁酸 1-羟基-环己基甲酸二、 写出下列化合物的构造式:1.草酸 2,马来酸 3,肉桂酸 4,硬脂酸HOOCCOOHC C H H COOH COOHCH=CHCOOHCH 3(CH 2)16COOH5.α-甲基丙烯酸甲酯 6,邻苯二甲酸酐 7,乙酰苯胺 8,过氧化苯甲酰胺CH 2=C CH 3COOCH 3CO O CONHCOCH3CO C O OO NHC O H 2NCOOC 2H 5CNH C NHO OH 2N CNH 2NHCOO COnCH 2CH O C OCH 3[]n三、写出分子式为C 5H 6O 4的不饱和二元酸的所有异构体(包括顺反异构)的结构式,并指出那些容易生成酸酐:解:有三种异构体:2-戊烯-1,5-二酸;2-甲基-顺丁烯二酸;2-甲基-反丁烯二酸。
其中2-甲基-顺丁烯二酸易于生成酸酐。
CC H COOHCOOH C C H COOHCH 3HOOCCH 3HOOC CH=CHCH 2COOH2-戊烯-1,5-二酸; 2-甲基-顺丁烯二酸; 2-甲基-反丁烯二酸四、比较下列各组化合物的酸性强度:1,醋酸, 丙二酸, 草酸, 苯酚, 甲酸CH 3COOH ,HOOCCOOH HOOCCH 2COOH ,,OH ,HCOOHHOOCCOOHHOOCCH 2COOHHCOOHOHCH 3COOH>>>>2.C 6H 5OH ,CH 3COOH ,F 3CCOOH ,ClCH 2COOH ,C 2H 5OHF 3CCOOHClCH 2COOH CH 3COOH C 6H 5OHC 2H 5OH>>>>3.NO 2COOHCOOHNO 2COOHOHOHNO 2COOHCOOH NO 2COOH OHOH>>>>五、用化学方法区别下列化合物:1.乙醇,乙醛,乙酸2.甲酸,乙酸,丙二酸3.草酸,马来酸,丁二酸4,COOHCOOHCH 2OHOH2-羟基苯甲酸 苯甲酸 苯甲醇5.乙酰氯,乙酸酐,氯乙烷六、写出异丁酸和下列试剂作用的主要产物:1.Br 2/PCH 3CH 3CHCOOH Br /PCH 3CCOOH BrCH 32.LiAlH 4/H 2OCH 3CHCOOH CH 3LiAlH /H 2OCH 3CH 3CHCH 2OH 3.SOCl 2CH 3CH 3CHCOOH2CH 3CH 3CHCOCl4.(CH 3CO)2O/CH 3CH 3CHCOOH (CH 3CO)2O/CH 3CHCO)2CH 3(O +CH 3COOH5.PBr 3CH 3CH 3CHCOOH PBr (CH 3)2CHCOBr6.CH 3CH 2OH/H 2SO 4CH 3CH 3CHCOOH CH 3CH 2OH/H 2SO 4(CH 3)2CHCOOC 2H 57.NH 3/CH 3CH 3CHCOOHNH/(CH 3)2CHCONH 2七、分离下列混合物:CH 3CH 2COCH 2CH 3,CH 3CH 2CH 2CHO ,CH 3CH 2CH 2CH 2OH ,CH 3CH 2CH 2COOHCH 3CH 2CH 2COOH CH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO CH 3CH 2COCH 2CH 3NaOHaqCH 2CH 2COONaCH 3CH 2CH 2COOHCH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO CH 3CH 2COCH 2CH 3CH 3CH 2CH 2CHSO 3NaOHH +,H OCH 3CH 2CH 2CHOCH 3CH 2COCH 2CH 3NH 23NHOHCH 3CH 2CCH 2CH 3NNHOHHClCH 3CH 2COCH 2CH 3CH 3CH 2CH 2CH 2OH八、写出下列化合物加热后生成的主要产物:1, 1,2-甲基-2-羟基丙酸2, 2,β-羟基丁酸3, 3,β-甲基-γ-羟基戊酸 4, 4,δ-羟基戊酸5, 5,乙二酸九、完成下列各反应式(写出主要产物或主要试剂)1.CH 3CH 2CN (A)H 2O,H +CH 3CH 2COOHCH 3CH 2COCl(B)SOCl2(G)H 2,Pd/BaSO 4CH 3CH 2CHO2CONH 2P 2O 5(C)NH 3NaOBr,NaOH CH 3CH 2NH 22.C=O1.C 2H 5MgBr 2H 3O OH C 2H 5PBr 31.Mg,(C H )2O 2CO 2,H 3OC 2H 5COOH3.ClC ClO2NH 3H 2NC NH 2OH 2N CNH 2OH 2NC ONHC NH 2O4.C=O24OH CNH O +OH COOHOO OC O C十、完成下列转变:1.CH 3CH 2COOH CH 3CH 2CH 2COOHCH 3CH 2COOH CH 3CH 2CH 2OHPBr CH 3CH 2CH 2BrCH 3CH 2CH 2CN H O +CH 3CH 2CH 2COOH2.CH 3CH 2CH 2COH CH 3CH 2COOHCH 3CH 2CH 2COOH 2CH 3CH 2CHCOOHCl-OHCH 3CH 2CHCOOHOHKMnO ,H +CH 3CH 2COOH3.2CH 2COOHCH 2COOHC=CH 2+HBrROORCH 2Br25)OCH 2MgBr122,H 3O4.CH 3COCH 2CH 2CBr(CH 3)2CH 3COCH 2CH 2C(CH 3)2COOHCH 3COCH 2CH 2CBr(CH 3)222+CH 3CCH 2CH 2CBr(CH 3)2O OMg,(C 2H 5)OOOCH 3C CH 3CH 2CH 2CMgBrCH 3122.H 3OCH 3COCH 2CH 2C(CH 3)2COOH十一、试写出下列反应的主要产物:6.(R )-2-溴丙酸 + (S)-2-丁醇 H +/⊿C 2H 5HCH 3OO CBr H CH 3H +HCH 3OHCH 3CH 2+CH 3H COOHBr7.CH 3CH 2COONa+CH 3CH 2CH 2COClCH 3CH 2CH 2CO O CCH 2CHCH 3O 8.CH 2CH 2C CO O+2C 2H 5OHC 2H 5OC O CH 2CH 2COC 2H 5O9.CH 3CONH 2+NaOBr-OHCH 3NH 210.CNCONH 2+P 2O 5十二、预测下列化合物在碱性条件下水解反应的速度顺序。
宏观经济学习题答案第十三章 习题答案

第十三章 简单国民收入决定理论1.在两部门经济中,均衡发生于( )之时。
A.实际储蓄等于实际投资;B.实际消费加实际投资等于产出值;C.计划储蓄等于计划投资;D.总投资等于企业部门的收入。
解答:C2.当消费函数为c =a +by(a>0,0<b<1),这表明,平均消费倾向( )。
A .大于边际消费倾向;B .小于边际消费倾向;C .等于边际消费倾向;D .以上三种情况都可能。
解答:A3.如果边际储蓄倾向为0.3,投资支出增加60亿元,这将导致均衡收入GDP 增加 ( )。
A . 20亿元;B . 60亿元;C . 180亿元;D . 200亿元。
解答:D4.在均衡产出水平上,是否计划存货投资和非计划存货投资都必然为零?解答:当处于均衡产出水平时,计划存货投资一般不为零,而非计划存货投资必然为零。
这是因为计划存货投资是计划投资的一部分,而均衡产出就是等于消费加计划投资的产出,因此计划存货不一定是零。
计划存货增加时,存货投资就大于零;计划存货减少时,存货投资就小于零。
需要指出的是,存货是存量,存货投资是流量,存货投资是指存货的变动。
在均衡产出水平上,计划存货投资是计划投资的一部分,它不一定是零,但是非计划存货投资一定是零,如果非计划存货投资不是零,那就不是均衡产出了。
比方说,企业错误估计了形势,超出市场需要而多生产了产品,就造成了非计划存货投资。
5.能否说边际消费倾向和平均消费倾向总是大于零而小于1?解答:消费倾向就是消费支出和收入的关系,又称消费函数。
消费支出和收入的关系可以从两个方面加以考察,一是考察消费支出变动量和收入变动量的关系,这就是边际消费倾向(可以用公式MPC =Δc Δy或MPC =d c d y表示),二是考察一定收入水平上消费支出量和该收入量的关系,这就是平均消费倾向(可以用公式APC =c y表示)。
边际消费倾向总大于零而小于1,因为一般说来,消费者增加收入后,既不会不增加消费即MPC =Δc Δy=0,也不会把增加的收入全用于增加消费,一般情况是一部分用于增加消费,另一部分用于增加储蓄,即Δy =Δc +Δs ,因此,Δc Δy +Δs Δy =1,所以,Δc Δy =1-Δs Δy 。
生物化学课后习题答案-第十三章xt13

第十三章 蛋白质的生物合成一、课后习题1.在蛋白质分子中,通常含量较高的是Ser和Leu,其次是His和Cys,含量最少的是Met和Trp。
一种氨基酸在蛋白质分子中出现的频率与它的密码子数量有什么关系?这种关系得选择其优点如何?2.AUG和UAG是蛋白合成中特定的起始和终止密码,序列同5’-UUAUGAAUGUACCGUGGUAGUU-3’的mRNA中什么样的开放阅读框才能编码一个短肽?写出该短肽的氨基酸序列。
3.细菌的基因组通常含有多少个rRNA基因拷贝,他们能迅速地转录以生产大量rRNA装配成核糖体相对对比而言,编码核糖体蛋白的基因只有一份拷贝,试解释rRNA基因和核糖体蛋白基因数量的差别。
4.DNA中的点突变(一个碱基被另一个碱基取代)可能导致一个氨基酸被另一个氨基酸替换。
但在某些情况下,由于密码子的简并性,基因编码的氨基酸序列也可能不会改变。
一种细菌生产的胞外蛋白酶在其活性位点上(—Gly-Leu-Cys-Arg—)有一个半胱氨酸残基。
紫外线照射过后,分离得到两个突变菌株。
菌株1生产以Ser取代活性部位Cys的无活性酶(—Gly-Leu-Ser-Arg—);而在菌株2内,合成了一条C末端结束在活性部位内的以—Gly-Leu—COO-结尾的截断了的肽链,指出在每一种菌株中可能发生的突变。
5.一双螺旋DNA的模板链中一段序列如下:CTTAACACCCCTGACTTCGCGCCGTCG(1)写出转录出的mRNA核苷酸序列?(2)写出5’开始的该转录mRNA序列所对应得多肽的氨基酸序列?(3)假设此DNA的另一条链被转录和翻译,所得的氨基酸序列会与(2)中的一样吗?(2)与(3)得出的答案在生物学上有什么意义?6.假设反应从游离氨基酸、tRNA、氨酰tRNA合成酶、mRNA、80S核糖体以及翻译因子开始,那么翻译一分子牛胰核糖酸酶要用掉多少个高能磷酸键?翻译一分子肌红蛋白需要消耗多少个高能磷酸键?7.噬菌体T4 DNA的相对分子质量为1.3×108(双链),假定全部核苷酸均用于编码氨基酸,试问:(1)T4 DNA可为多少氨基酸编码?(2)T4 DNA可为多少相对分子质量等于35000的不同蛋白质编码?(核苷酸对的相对分子质量按618计,氨基酸平均相对分子质量按120计)8.核糖体的基本结构和功能有哪些?9.在蛋白质定向运输时,多肽本身有何作用?高尔基体的功能是什么?参考答案:1.在蛋白质分子中,一种氨基酸出现的频率与它密码子的数量具有一定的正向关系,如:亮氨酸,苏氨酸都有6个密码子,通常在蛋白质分子中出现的几率也最高;而甲硫氨酸和色氨酸只有一个密码子,在蛋白质中出现的频率相对小一些。
《管理学》习题与答案——第13章 组织设计

第十三章组织设计一、教学要点1、管理幅度、管理层次与组织形态的关系。
2、扁平形组织结构的基本特点。
3、锥形组织结构的基本特点。
4、影响管理幅度的因素。
5、组织设计的任务。
6、组织设计的基本原则。
7、组织设计的影响因素。
8、经营环境如何影响组织设计?9、经营战略如何影响组织设计?10、企业技术类型与组织结构特征间的相互关系。
11、信息技术对组织结构的影响。
12、企业发展阶段与组织结构特征间的关系。
13、经营规模如何影响组织设计?14、职能部门化的依据、优点和局限性。
15、产品部门化的依据、优点和局限性。
16、区域部门化的依据、优点和局限性。
17、矩阵组织的依据、优点和局限性。
18、权力的性质和特征。
19、组织中集权倾向的产生原因。
20、组织过分集权的弊端。
21、判断分权程度的标准。
22、组织中促进分权及不利于分权的因素。
23、制度分权与授权的概念以及两者间的区别。
24、关键名词:组织设计、管理幅度、管理层次、组织结构、扁平形结构、锥形结构、因事设职、因人设职、权责对等、命令统一、保守型战略、风险型战略、分析型战略、组织发展五阶段理论、Parkinson法则、部门化、横向分工、纵向分工、职能部门化、产品部门化、区域部门化、矩阵组织、权力、集权、分权、制度分权、授权二、习题(一)填充题1.组织设计的实质是对管理人员的管理劳动进行__________和____________的分工。
2.管理中的组织职能就是在________的基础上,设计出组织所需的________及其之间的关系。
3.组织结构的必要性和重要性是随着___________和___________而不断提高。
4.管理层次受到_________和__________的影响。
它与组织规模成_____比,在组织规模已定的条件下,它与管理幅度成_____比。
5.组织设计的任务是提供企业的________________和编制________________。
习题答案(第13章)

第13章思考与练习1.连接的主要作用是什么?分为哪几种方法?答:连接是将两个或两个以上的零件连合成一体的结构。
为了便于机器的制造、安装、维修等,常采用不同的连接方法将零、部件合成一整体。
连接分为三大类。
(1)不可拆连接,如焊连接、铆钉连接、胶接等。
(2)可拆连接,如键连接、销连接和螺纹连接等。
(3)过盈配合连接2.键连接的主要作用是什么?答:主要用于轴和轴上零件之间的轴向固定,有的还能实现轴零件的轴向固定或轴向滑动。
3.圆头、方头及单圆头普通平键各有何优、缺点?分别适用于什么场合?轴和轮毂孔上键槽是怎样加工的?答:A型平键键槽由立式键槽铣刀加工,键在槽中轴向固定较好,但键的头部侧面与轮毂上的键槽并不接触,因而键的圆头部分不能充分利用,而且轴上键槽端部的应力集中较大。
B型平键键槽用卧式键槽铣刀加工,避免了上述缺点,但对于尺寸较大的键,宜用紧定螺钉固定在轴上的键槽中,以防松动。
C型平键一般用于轴端。
4.如何选取普通平键的尺寸b×h×L?它的公称长度与工作长度之间有什么关系?答:根据轴的直径d从标准(见表17.1)中选择平键宽度b(高度h),键的长度L应略小于轮毂长度,并与标准中规定的长度系列相符。
公称长度L,工作长度l,其之间的关系为:A型键l=L-b,B型键l=L,C型键l=L-b/2。
5.普通平键连接有哪些失效形式?主要失效形式是什么?怎样进行强度校核?如强度不够,可采取哪些措施?答:普通平键连接属于静连接,其主要失效形式是连接中强度较弱零件的工作面被压溃。
导向平键和滑键连接属于动连接,其主要失效形式是工作面过度磨损。
故强度计算时,静连接校核挤压强度,动连接校核压力强度。
如果校核后键连接的强度不够,在不超过轮毂宽度的条件下,可适当增加键的长度,但键的长度一般不应超过2.25d,否则载荷沿键长方向的分布将很不均匀;或者相隔180°布置两个平键,因考虑制造误差引起的载荷分布不均,只能按1.5个键做强度校核。
大学物理课后习题及答案 第13章

第13章 光学一 选择题*13-1 在水中的鱼看来,水面上和岸上的所有景物,都出现在一倒立圆锥里,其顶角为( )(A)48.8(B)41.2(C)97.6(D)82.4解:选(C)。
利用折射定律,当入射角为1=90i 时,由折射定律1122sin sin n i n i = ,其中空气折射率11n =,水折射率2 1.33n =,代入数据,得折射角2=48.8i ,因此倒立圆锥顶角为22=97.6i 。
*13-2 一远视眼的近点在1 m 处,要看清楚眼前10 cm 处的物体,应配戴的眼镜是( )(A)焦距为10 cm 的凸透镜 (B)焦距为10 cm 的凹透镜 (C)焦距为11 cm 的凸透镜 (D)焦距为11 cm 的凹透镜解:选(C)。
利用公式111's s f+=,根据教材上约定的正负号法则,'1m s =-,0.1m s =,代入得焦距0.11m =11cm f =,因为0f >,所以为凸透镜。
13-3 在双缝干涉实验中,若单色光源S 到两缝S 1、S 2距离相等,则观察屏上中央明纹位于图中O 处,现将光源S 向下移动到图13-3中的S ′位置,则[ ] (A) 中央明纹向上移动,且条纹间距增大(B) 中央明纹向上移动,且条纹间距不变(C) 中央明纹向下移动,且条纹间距增大 (D) 中央明纹向下移动,且条纹间距不变解:选(B)。
光源S 由两缝S 1、S 2到O 处的光程差为零,对应中央明纹;当习题13-3图向下移动至S ′时,S ′到S 1的光程增加,S ′到S 2的光程减少,为了保持光程差为零,S 1到屏的光程要减少,S 2到屏的光程要增加,即中央明纹对应位置要向上移动;条纹间距dD x λ=∆,由于波长λ、双缝间距d 和双缝所在平面到屏幕的距离D 都不变,所以条纹间距不变。
13-4 用平行单色光垂直照射在单缝上时,可观察夫琅禾费衍射。
若屏上点P 处为第二级暗纹,则相应的单缝波阵面可分成的半波带数目为[ ](A) 3个 (B) 4个 (C) 5个 (D) 6个解:选(B)。
第十三章课后习题答案

第十三章 热力学基础13 -1 如图所示,bca 为理想气体绝热过程,b1a 和b2a 是任意过程,则上述两过程中气体作功与吸收热量的情况是( )(A) b1a 过程放热,作负功;b2a 过程放热,作负功(B) b1a 过程吸热,作负功;b2a 过程放热,作负功(C) b1a 过程吸热,作正功;b2a 过程吸热,作负功(D) b1a 过程放热,作正功;b2a 过程吸热,作正功分析与解 bca ,b1a 和b2a 均是外界压缩系统,由⎰=V p W d 知系统经这三个过程均作负功,因而(C)、(D)不对.理想气体的内能是温度的单值函数,因此三个过程初末态内能变化相等,设为ΔE .对绝热过程bca ,由热力学第一定律知ΔE =-W bca .另外,由图可知:|W b2a |>|W bca |>|W b1a |,则W b2a <W bca <W b1a .对b1a 过程:Q =ΔE +W b1a >ΔE +W bca =0 是吸热过程.而对b2a 过程:Q =ΔE +W b2a <ΔE +W bca =0 是放热过程.可见(A)不对,正确的是(B).13 -2 如图,一定量的理想气体,由平衡态A 变到平衡态B ,且它们的压强相等,即p A =p B ,请问在状态A 和状态B 之间,气体无论经过的是什么过程,气体必然( )(A) 对外作正功 (B) 内能增加(C) 从外界吸热 (D) 向外界放热分析与解 由p -V 图可知,p A V A <p B V B ,即知T A <T B ,则对一定量理想气体必有E B >E A .即气体由状态A 变化到状态B,内能必增加.而作功、热传递是过程量,将与具体过程有关.所以(A)、(C)、(D)不是必然结果,只有(B)正确.13 -3 两个相同的刚性容器,一个盛有氢气,一个盛氦气(均视为刚性分子理想气体).开始时它们的压强和温度都相同,现将3J 热量传给氦气,使之升高到一定的温度.若使氢气也升高同样的温度,则应向氢气传递热量为( )(A) 6J (B) 3 J (C) 5 J (D) 10 J分析与解 当容器体积不变,即为等体过程时系统不作功,根据热力学第一定律Q =ΔE +W ,有Q =ΔE .而由理想气体内能公式T R i M m E Δ2Δ=,可知欲使氢气和氦气升高相同温度,须传递的热量 ⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛=e e e 222e 2H H H H H H H H /:i M m i M m Q Q .再由理想气体物态方程pV =mM RT ,初始时,氢气和氦气是具有相同的温度、压强和体积,因而物质的量相同,则3/5/:e 2e 2H H H H ==i i Q Q .因此正确答案为(C).13 -4 有人想像了四个理想气体的循环过程,则在理论上可以实现的为( )分析与解由绝热过程方程pVγ=常量,以及等温过程方程pV=常量,可知绝热线比等温线要陡,所以(A)过程不对,(B)、(C)过程中都有两条绝热线相交于一点,这是不可能的.而且(B)过程的循环表明系统从单一热源吸热且不引起外界变化,使之全部变成有用功,违反了热力学第二定律.因此只有(D)正确.13 -5一台工作于温度分别为327 ℃和27 ℃的高温热源与低温源之间的卡诺热机,每经历一个循环吸热2 000 J,则对外作功()(A) 2 000J(B) 1 000J(C) 4 000J(D) 500J分析与解热机循环效率η=W/Q吸,对卡诺机,其循环效率又可表为:η=1-T2 /T1,则由W /Q吸=1 -T2 /T1可求答案.正确答案为(B).13 -6根据热力学第二定律()(A) 自然界中的一切自发过程都是不可逆的(B) 不可逆过程就是不能向相反方向进行的过程(C) 热量可以从高温物体传到低温物体,但不能从低温物体传到高温物体(D) 任何过程总是沿着熵增加的方向进行分析与解 对选项(B):不可逆过程应是指在不引起其他变化的条件下,不能使逆过程重复正过程的每一状态,或者虽然重复但必然会引起其他变化的过程.对选项(C):应是热量不可能从低温物体自动传到高温物体而不引起外界的变化.对选项(D):缺少了在孤立系统中这一前提条件.只有选项(A)正确. 13 -7 位于委内瑞拉的安赫尔瀑布是世界上落差最大的瀑布,它高979m.如果在水下落的过程中,重力对它所作的功中有50%转换为热量使水温升高,求水由瀑布顶部落到底部而产生的温差.( 水的比热容c 为4.18×103 J·kg -1·K -1 ) 分析 取质量为m 的水作为研究对象,水从瀑布顶部下落到底部过程中重力作功W =mgh ,按题意,被水吸收的热量Q =0.5W ,则水吸收热量后升高的温度可由Q =mc ΔT 求得.解 由上述分析得mc ΔT =0.5mgh水下落后升高的温度ΔT =0.5gh /c =1.15K13 -8 如图所示,一定量的空气,开始在状态A ,其压强为2.0×105Pa ,体积为2.0 ×10-3m 3 ,沿直线AB 变化到状态B 后,压强变为1.0 ×105Pa ,体积变为3.0 ×10-3m 3 ,求此过程中气体所作的功.分析 理想气体作功的表达式为()⎰=V V p W d .功的数值就等于p -V 图中过程曲线下所对应的面积.解 S ABCD =1/2(BC +AD)×CD故 W =150 J13 -9 汽缸内储有2.0mol 的空气,温度为27 ℃,若维持压强不变,而使空气的体积膨胀到原体积的3s 倍,求空气膨胀时所作的功.分析 本题是等压膨胀过程,气体作功()1221d V V p V p W V V -==⎰,其中压强p 可通过物态方程求得.解 根据物态方程11RT pV v =,汽缸内气体的压强11/V RT p v = ,则作功为 ()()J 1097.92/31112112⨯==-=-=RT V V V RT V V p W v v 13 -10 一定量的空气,吸收了1.71×103J 的热量,并保持在1.0 ×105Pa 下膨胀,体积从1.0×10-2m 3 增加到1.5×10-2m 3 ,问空气对外作了多少功? 它的内能改变了多少?分析 由于气体作等压膨胀,气体作功可直接由W =p (V 2 -V 1 )求得.取该空气为系统,根据热力学第一定律Q =ΔE +W 可确定它的内能变化.在计算过程中要注意热量、功、内能的正负取值.解 该空气等压膨胀,对外作功为W =p (V 2-V 1 )=5.0 ×102J其内能的改变为Q =ΔE +W =1.21 ×103J13 -11 0.1kg 的水蒸气自120 ℃加热升温到140℃,问(1) 在等体过程中;(2) 在等压过程中,各吸收了多少热量? 根据实验测定,已知水蒸气的摩尔定压热容C p,m =36.21J·mol -1·K -1,摩尔定容热容C V,m =27.82J·mol -1·K -1. 分析 由量热学知热量的计算公式为T C Q m Δv =.按热力学第一定律,在等体过程中,T C E Q ΔΔm V ,V v ==;在等压过程中, T C E V p Q ΔΔd m p,p v =+=⎰.解 (1) 在等体过程中吸收的热量为J 101.3ΔΔ3m V,V ⨯===T C Mm E Q (2) 在等压过程中吸收的热量为 ()J 100.4Δd 312m p,p ⨯=-=+=⎰T T C M m E V p Q 13 -12 如图所示,在绝热壁的汽缸内盛有1mol 的氮气,活塞外为大气,氮气的压强为1.51 ×105 Pa ,活塞面积为0.02m 2 .从汽缸底部加热,使活塞缓慢上升了0.5m.问(1) 气体经历了什么过程? (2) 汽缸中的气体吸收了多少热量? (根据实验测定,已知氮气的摩尔定压热容C p ,m =29.12J·mol -1·K -1,摩尔定容热容C V,m =20.80J·mol -1·K -1 )分析 因活塞可以自由移动,活塞对气体的作用力始终为大气压力和活塞重力之和.容器内气体压强将保持不变.对等压过程,吸热T C Q Δm p,p v =.ΔT 可由理想气体物态方程求出.解 (1) 由分析可知气体经历了等压膨胀过程.(2) 吸热T C Q Δm p,p v =.其中ν =1 mol ,C p,m =29.12J·mol -1·K-1.由理想气体物态方程pV =νRT ,得ΔT =(p 2V 2 -p 1 V 1 )/R =p(V 2 -V 1 )/R =p· S· Δl /R则 J 105.293m p,p ⨯==pS ΔSΔl C Q13 -13 一压强为1.0 ×105Pa,体积为1.0×10-3m 3的氧气自0℃加热到100 ℃.问:(1) 当压强不变时,需要多少热量?当体积不变时,需要多少热量?(2) 在等压或等体过程中各作了多少功?分析 (1) 求Q p 和Q V 的方法与题13-11相同.(2) 求过程的作功通常有两个途径.① 利用公式()V V p W d ⎰=;② 利用热力学第一定律去求解.在本题中,热量Q 已求出,而内能变化可由()12m V ,V ΔT T C E Q -==v 得到.从而可求得功W .解 根据题给初态条件得氧气的物质的量为mol 1041.4/2111-⨯===RT V p Mm v 氧气的摩尔定压热容R C 27m p,=,摩尔定容热容R C 25m V,=. (1) 求Q p 、Q V等压过程氧气(系统)吸热()J 1.128Δd 12m p,p =-=+=⎰T T C E V p Q v等体过程氧气(系统)吸热()J 5.91Δ12m V ,V =-==T T C E Q v(2) 按分析中的两种方法求作功值解1 ① 利用公式()V V p W d ⎰=求解.在等压过程中,T R Mm V p W d d d ==,则得 J 6.36d d 21p ===⎰⎰T T T R Mm W W 而在等体过程中,因气体的体积不变,故作功为()0d V ==⎰V V p W② 利用热力学第一定律Q =ΔE +W 求解.氧气的内能变化为()J 5.91Δ12m V,V =-==T T C Mm E Q 由于在(1) 中已求出Q p 与Q V ,则由热力学第一定律可得在等压过程、等体过程中所作的功分别为J 6.36Δp p =-=E Q W0ΔV V =-=E Q W13 -14 如图所示,系统从状态A 沿ABC 变化到状态C 的过程中,外界有326J 的热量传递给系统,同时系统对外作功126J.当系统从状态C 沿另一曲线CA 返回到状态A 时,外界对系统作功为52J ,则此过程中系统是吸热还是放热?传递热量是多少?分析 已知系统从状态C 到状态A ,外界对系统作功为W CA ,如果再能知道此过程中内能的变化ΔE AC ,则由热力学第一定律即可求得该过程中系统传递的热量Q CA .由于理想气体的内能是状态(温度)的函数,利用题中给出的ABC 过程吸热、作功的情况,由热力学第一定律即可求得由A 至C 过程中系统内能的变化ΔE AC ,而ΔE AC =-ΔE AC ,故可求得Q CA .解 系统经ABC 过程所吸收的热量及对外所作的功分别为Q ABC =326J , W ABC =126J则由热力学第一定律可得由A 到C 过程中系统内能的增量ΔE AC =Q ABC -W ABC =200J由此可得从C 到A ,系统内能的增量为ΔE CA =-200J从C 到A ,系统所吸收的热量为Q CA =ΔE CA +W CA =-252J式中负号表示系统向外界放热252 J.这里要说明的是由于CA 是一未知过程,上述求出的放热是过程的总效果,而对其中每一微小过程来讲并不一定都是放热.13 -15 如图所示,一定量的理想气体经历ACB 过程时吸热700J ,则经历ACBDA 过程时吸热又为多少?分析 从图中可见ACBDA 过程是一个循环过程.由于理想气体系统经历一个循环的内能变化为零,故根据热力学第一定律,循环系统净吸热即为外界对系统所作的净功.为了求得该循环过程中所作的功,可将ACBDA 循环过程分成ACB 、BD 及DA 三个过程讨论.其中BD 及DA 分别为等体和等压过程,过程中所作的功按定义很容易求得;而ACB 过程中所作的功可根据上题同样的方法利用热力学第一定律去求.解 由图中数据有p A V A =p B V B ,则A 、B 两状态温度相同,故ACB 过程内能的变化ΔE CAB =0,由热力学第一定律可得系统对外界作功W CAB =Q CAB -ΔE CAB =Q CAB =700J在等体过程BD 及等压过程DA 中气体作功分别为()⎰==0d BD V V p W()⎰-=-==J 1200d 12A DA V V P V p W则在循环过程ACBDA 中系统所作的总功为J 500D A BD A CB -=++=W W W W负号表示外界对系统作功.由热力学第一定律可得,系统在循环中吸收的总热量为J 500-==W Q负号表示在此过程中,热量传递的总效果为放热.13 -16 在温度不是很低的情况下,许多物质的摩尔定压热容都可以用下式表示2m p,2--+=cT bT a C式中a 、b 和c 是常量,T 是热力学温度.求:(1) 在恒定压强下,1 mol 物质的温度从T 1升高到T 2时需要的热量;(2) 在温度T 1 和T 2 之间的平均摩尔热容;(3) 对镁这种物质来说,若C p ,m 的单位为J·mol -1·K -1,则a =25.7J·mol -1·K-1 ,b =3.13 ×10-3J·mol -1·K-2,c =3.27 ×105J·mol -1·K.计算镁在300K时的摩尔定压热容C p,m ,以及在200K和400K之间C p,m 的平均值. 分析 由题目知摩尔定压热容C p,m 随温度变化的函数关系,则根据积分式⎰=21d m p,p T T T C Q 即可求得在恒定压强下,1mol 物质从T 1 升高到T 2所吸收的热量Qp .故温度在T 1 至T 2之间的平均摩尔热容()12p m p,/T T Q C -=. 解 (1) 11 mol 物质从T 1 升高到T 2时吸热为()()()()11122122122m p,p d 2d 21----+-+-=-+==⎰⎰T T c T T b T T a T cT bT a T C Q T T (2) 在T 1 和T 2 间的平均摩尔热容为()()21212p m p,//T T c T T a T T Q C -+=-=(3) 镁在T =300 K 时的摩尔定压热容为-1-12m p,K mol J 9.232⋅⋅=-+=-cT bT a C镁在200 K 和400 K 之间C p ,m 的平均值为()-1-12112m p,K mol J 5.23/⋅⋅=-+=T T c T T a C13 -17 空气由压强为1.52×105 Pa ,体积为5.0×10-3m 3 ,等温膨胀到压强为1.01×105 Pa ,然后再经等压压缩到原来的体积.试计算空气所作的功. 解 空气在等温膨胀过程中所作的功为()()2111121T /ln /ln p p V p V V RT Mm W == 空气在等压压缩过程中所作的功为()⎰-==12d V V p V p W 利用等温过程关系p 1 V 1 =p 2 V 2 ,则空气在整个过程中所作的功为()J 7.55/ln 11122111=-+=+=V p V p p p V p W W W T p13 -18 如图所示,使1mol 氧气(1) 由A 等温地变到B ;(2) 由A 等体地变到C ,再由C 等压地变到B.试分别计算氧气所作的功和吸收的热量.分析 从p -V 图(也称示功图)上可以看出,氧气在AB 与ACB 两个过程中所作的功是不同的,其大小可通过()V V p W d ⎰=求出.考虑到内能是状态的函数,其变化值与过程无关,所以这两个不同过程的内能变化是相同的,而且因初、末状态温度相同T A =T B ,故ΔE =0,利用热力学第一定律Q =W +ΔE ,可求出每一过程所吸收的热量.解 (1) 沿AB 作等温膨胀的过程中,系统作功()()J 1077.2/ln /ln 31⨯===A B B A A B AB V V V p V V RT Mm W 由分析可知在等温过程中,氧气吸收的热量为Q AB =W AB =2.77 ×103J (2) 沿A 到C 再到B 的过程中系统作功和吸热分别为W ACB =W AC +W CB =W CB =p C (V B -V C )=2.0×103JQ ACB =W A CB =2.0×103 J13 -19 将体积为1.0 ×10-4m 3 、压强为1.01×105Pa 的氢气绝热压缩,使其体积变为2.0 ×10-5 m 3 ,求压缩过程中气体所作的功.(氢气的摩尔定压热容与摩尔定容热容比值γ=1.41)分析 可采用题13-13 中气体作功的两种计算方法.(1) 气体作功可由积分V p W d ⎰=求解,其中函数p (V )可通过绝热过程方程pV C γ= 得出.(2)因为过程是绝热的,故Q =0,因此,有W =-ΔE ;而系统内能的变化可由系统的始末状态求出.解 根据上述分析,这里采用方法(1)求解,方法(2)留给读者试解.设p 、V 分别为绝热过程中任一状态的压强和体积,则由γγpV V p =11得 γγV V p p -=11氢气绝热压缩作功为J 0.231d d 121211121-=⎥⎦⎤⎢⎣⎡-⎥⎦⎤⎢⎣⎡-===⎰⎰-V V V V γp V V V p V p W V V γγ 13 -20 试验用的火炮炮筒长为3.66 m ,内膛直径为0.152 m ,炮弹质量为45.4kg ,击发后火药爆燃完全时炮弹已被推行0.98 m ,速度为311 m·s -1 ,这时膛内气体压强为2.43×108Pa.设此后膛内气体做绝热膨胀,直到炮弹出口.求(1) 在这一绝热膨胀过程中气体对炮弹作功多少?设摩尔定压热容与摩尔定容热容比值为 1.2γ=.(2) 炮弹的出口速度(忽略摩擦).分析 (1) 气体绝热膨胀作功可由公式1d 2211--==⎰γV p V p V p W 计算.由题中条件可知绝热膨胀前后气体的体积V 1和V 2,因此只要通过绝热过程方程γγV p V p 2211=求出绝热膨胀后气体的压强就可求出作功值.(2) 在忽略摩擦的情况下,可认为气体所作的功全部用来增加炮弹的动能.由此可得到炮弹速度.解 由题设l =3.66 m,D =0.152 m ,m =45.4 kg ,l 1=0.98 m ,v 1=311 m·s -1 ,p 1 =2.43×108Pa ,γ=1.2.(1) 炮弹出口时气体压强为()()Pa 1000.5//7112112⨯===γγl l p V V p p 气体作功J 1000.54π11d 6222112211⨯=--=--==⎰D γl p l p γV p V p V p W (2) 根据分析2122121v v m m W -=,则 -121s m 563⋅=+=v 2W/m v13 -21 1mol 氢气在温度为300K,体积为0.025m 3 的状态下,经过(1)等压膨胀,(2)等温膨胀,(3)绝热膨胀.气体的体积都变为原来的两倍.试分别计算这三种过程中氢气对外作的功以及吸收的热量.分析 这三个过程是教材中重点讨论的过程.在p -V 图上,它们的过程曲线如图所示.由图可知过程(1 ) 作功最多, 过程( 3 ) 作功最少.温度T B >T C >T D ,而过程(3) 是绝热过程,因此过程(1)和(2)均吸热,且过程(1)吸热多.具体计算时只需直接代有关公式即可.解 (1) 等压膨胀()()J 1049.23⨯==-=-=A A B AA AB A p RT V V V RT V V p W v()J 1073.8273,,⨯===-=+=A A m p A B m p p p T R T C T T C E ΔW Q v v (2) 等温膨胀 J 1073.12ln /3⨯===A A RT V W C T vRTlnV对等温过程ΔE =0,所以J 1073.13⨯==T T W Q(3) 绝热膨胀T D =T A (V A /V D )γ-1=300 ×(0.5)0.4=227.4K对绝热过程a 0Q =,则有 ()()J 1051.125Δ3,⨯=-=-=-=D A D A m V a T T R T T C E W v 13 -22 绝热汽缸被一不导热的隔板均分成体积相等的A 、B 两室,隔板可无摩擦地平移,如图所示.A 、B 中各有1mol 氮气,它们的温度都是T0 ,体积都是V0 .现用A 室中的电热丝对气体加热,平衡后A 室体积为B 室的两倍,试求(1) 此时A 、B 两室气体的温度;(2) A 中气体吸收的热量.分析 (1) B 室中气体经历的是一个绝热压缩过程,遵循绝热方程TVγ-1 =常数,由此可求出B 中气体的末态温度TB .又由于A 、B 两室中隔板可无摩擦平移,故A 、B 两室等压.则由物态方程pV A =νRT A 和pV B =νRT B 可知T A =2T B .(2) 欲求A 室中气体吸收的热量,我们可以有两种方法.方法一:视A 、B 为整体,那么系统(汽缸)对外不作功,吸收的热量等于系统内能的增量.即QA =ΔE A +ΔE B .方法二:A 室吸热一方面提高其内能ΔE A ,另外对“外界”B 室作功WA.而对B 室而言,由于是绝热的,“外界” 对它作的功就全部用于提高系统的内能ΔEB .因而在数值上W A =ΔE B .同样得到Q A =ΔE A +ΔE B . 解 设平衡后A 、B 中气体的温度、体积分别为T A ,T B 和V A ,V B .而由分析知压强p A =p B =p .由题已知⎩⎨⎧=+=022V V V V V B A B A ,得⎩⎨⎧==3/23/400V V V V BA (1) 根据分析,对B 室有B γB γT V T V 1010--=得 ()0010176.1/T T V V T γB B ==-;0353.2T T T B A == (2) ()()0007.312525ΔΔT T T R T T R E E Q B A A A A =-+-=+= 13-23 0.32 kg 的氧气作如图所示的ABCDA 循环,V 2 =2V 1 ,T 1=300K,T 2=200K,求循环效率.分析 该循环是正循环.循环效率可根据定义式η=W /Q 来求出,其中W 表示一个循环过程系统作的净功,Q 为循环过程系统吸收的总热量. 解 根据分析,因AB 、CD 为等温过程,循环过程中系统作的净功为()()()J 1076.5/ln /ln 32121211⨯=-==+=V V T T R M m V V RT Mm W W W CD AB由于吸热过程仅在等温膨胀(对应于AB 段)和等体升压(对应于DA 段)中发生,而等温过程中ΔE =0,则AB AB W Q =.等体升压过程中W =0,则DA DA E Q Δ=,所以,循环过程中系统吸热的总量为()()()()J 1081.325/ln /ln Δ42112121,121⨯=-+=-+=+=+=T T R M m V V RT Mm T T C M m V V RT Mm E W Q Q Q m V DAAB DA AB 由此得到该循环的效率为 %15/==Q W η13 -24 图(a)是某单原子理想气体循环过程的V -T 图,图中V C =2V A .试问:(1) 图中所示循环是代表制冷机还是热机? (2) 如是正循环(热机循环),求出其循环效率.分析 以正、逆循环来区分热机和制冷机是针对p -V 图中循环曲线行进方向而言的.因此,对图(a)中的循环进行分析时,一般要先将其转换为p -V 图.转换方法主要是通过找每一过程的特殊点,并利用理想气体物态方程来完成.由图(a)可以看出,BC 为等体降温过程,CA 为等温压缩过程;而对AB 过程的分析,可以依据图中直线过原点来判别.其直线方程为V =CT ,C 为常数.将其与理想气体物态方程pV =m/MRT 比较可知该过程为等压膨胀过程(注意:如果直线不过原点,就不是等压过程).这样,就可得出p -V 图中的过程曲线,并可判别是正循环(热机循环)还是逆循环(制冷机循环),再参考题13-23的方法求出循环效率.解 (1) 根据分析,将V -T 图转换为相应的p -V 图,如图(b)所示.图中曲线行进方向是正循环,即为热机循环.(2) 根据得到的p -V 图可知,AB 为等压膨胀过程,为吸热过程.BC 为等体降压过程,CA 为等温压缩过程,均为放热过程.故系统在循环过程中吸收和放出的热量分别为()A B m p T T C M m Q -=,1 ()()A C A A B m V V V RT Mm T T C M m Q /ln ,2+-= CA 为等温线,有T A =T C ;AB 为等压线,且因V C =2V A ,则有T A =T B /2.对单原子理想气体,其摩尔定压热容C p ,m =5R/2,摩尔定容热容C V ,m =3R/2.故循环效率为()()3/125/2ln 2312/5/2ln 321/112=+-=⎥⎦⎤⎢⎣⎡+-=-=A A A T T T Q Q η 13 -25 一卡诺热机的低温热源温度为7℃,效率为40%,若要将其效率提高到50%,问高温热源的温度需提高多少?解 设高温热源的温度分别为1T '、1T '',则有12/1T T η'-=', 12/1T T η''-=''其中T 2 为低温热源温度.由上述两式可得高温热源需提高的温度为K 3.931111Δ211=⎪⎪⎭⎫ ⎝⎛'--''-='-''=T ηηT T T 13 -26 一定量的理想气体,经历如图所示的循环过程.其中AB 和CD 是等压过程,BC 和DA 是绝热过程.已知B 点温度T B =T 1,C 点温度T C =T 2.(1) 证明该热机的效率η=1-T 2/T 1 ,(2) 这个循环是卡诺循环吗?分析 首先分析判断循环中各过程的吸热、放热情况.BC 和DA 是绝热过程,故Q BC 、Q DA 均为零;而AB 为等压膨胀过程(吸热)、CD 为等压压缩过程(放热),这两个过程所吸收和放出的热量均可由相关的温度表示.再利用绝热和等压的过程方程,建立四点温度之间的联系,最终可得到求证的形式. 证 (1) 根据分析可知 ()()⎪⎪⎭⎫ ⎝⎛-⎪⎪⎭⎫ ⎝⎛--=---=---=-=B A C D B C A B D CA B m p C D m p AB CD T T T T T T T T T T T T C MT T C M m Q Q η1/11111,, (1) 与求证的结果比较,只需证得BA C D T T T T = .为此,对AB 、CD 、BC 、DA 分别列出过程方程如下V A /T A =V B /T B (2)V C /T C =V D /T D (3) C γC B γB T V T V 11--= (4)A γA D γD T V T V 11--= (5)联立求解上述各式,可证得η=1-T C /T B =1-T 2/T 1(2) 虽然该循环效率的表达式与卡诺循环相似,但并不是卡诺循环.其原因是:① 卡诺循环是由两条绝热线和两条等温线构成,而这个循环则与卡诺循环不同;② 式中T 1、T 2的含意不同,本题中T 1、T 2只是温度变化中两特定点的温度,不是两等温热源的恒定温度.13 -27 一小型热电厂内,一台利用地热发电的热机工作于温度为227℃的地下热源和温度为27℃的地表之间.假定该热机每小时能从地下热源获取1.8 ×1011J的热量.试从理论上计算其最大功率为多少?分析 热机必须工作在最高的循环效率时,才能获取最大的功率.由卡诺定理可知,在高温热源T 1和低温热源T 2之间工作的可逆卡诺热机的效率最高,其效率为η=1-T 2/T 1 .由于已知热机在确定的时间内吸取的热量,故由效率与功率的关系式Q pt Q W η//==,可得此条件下的最大功率.解 根据分析,热机获得的最大功率为()-1712s J 100.2//1/⋅⨯=-==t Q T T t Q ηp13 -28 有一以理想气体为工作物质的热机,其循环如图所示,试证明热()()1/1/12121---=p p V V γη 分析 该热机由三个过程组成,图中AB 是绝热过程,BC 是等压压缩过程,CA 是等体升压过程.其中CA 过程系统吸热,BC 过程系统放热.本题可从效率定义CA BC Q Q Q Q η/1/112-=-=出发,利用热力学第一定律和等体、等压方程以及γ=C p,m 桙C V,m 的关系来证明.证 该热机循环的效率为CA BC Q Q Q Q η/1/112-=-=其中Q BC =m /M C p,m (T C -T B ),Q CA =m/M C V,m (T A -T C ),则上式可写为1/1/11---=---=C A CB C A B C T T T T γT T T T γη 在等压过程BC 和等体过程CA 中分别有T B /V 1 =T C /V 2,T A /P 1 =T C /P 2,代入上式得()()1/1/12121---=p p V V γη 13 -29 如图所示为理想的狄赛尔(Diesel)内燃机循环过程,它由两绝热线AB 、CD 和等压线BC 及等体线DA 组成.试证此内燃机的效率为()()()1//1/12312123---=-V V V V γV V ηγγ证 求证方法与题13-28相似.由于该循环仅在DA 过程中放热、BC 过程中吸热,则热机效率为 ()()B C AD B C m p A D m V BCDA T T T T γT T C M T T C M m Q Q η---=---=-=111/1,, (1) 在绝热过程AB 中,有1211--=γB γA V T V T ,即()121//-=γA B V V T T (2)在等压过程BC 中,有23//V T V T B C =,即23//V V T T B C = (3)再利用绝热过程CD,得1311--=γC γD V T V T (4)解上述各式,可证得()()()1//1/12312123---=-V V V V γV V ηγγ 13 -30 如图所示,将两部卡诺热机连接起来,使从一个热机输出的热量,输入到另一个热机中去.设第一个热机工作在温度为T 1和T 2的两热源之间,其效率为η1 ,而第二个热机工作在温度为T 2 和T 3 的两热源之间,其效率为η2.如组合热机的总效率以η=(W 1 +W 2 )/Q 1 表示.试证总效率表达式为η=(1 -η1 )η2 +η1 或 η=1 -T 3/T 1分析 按效率定义,两热机单独的效率分别为η1=W 1 /Q 1和η2=W 2 /Q 2,其中W 1 =Q 1-Q 2 ,W 2 =Q 2-Q 3 .第一个等式的证明可采用两种方法:(1) 从等式右侧出发,将η1 、η2 的上述表达式代入,即可得证.读者可以一试.(2) 从等式左侧的组合热机效率η=(W 1 +W 2 )/Q 1出发,利用η1、η2的表达式,即可证明.由于卡诺热机的效率只取决于两热源的温度,故只需分别将两个卡诺热机的效率表达式η1=1-T 2 /T 1 和η2=1-T 3 /T 2 代入第一个等式,即可得到第二个等式.证 按分析中所述方法(2) 求证.因η1=W 1 /Q 1 、η2=W 2 /Q 2 ,则组合热机效率12211211121Q Q ηηQ W Q W Q W W η+=+=+= (1) 以Q 2 =Q 1-W 1 代入式(1) ,可证得η=η1 +η2 (1-η1 ) (2) 将η1=1-T 2 /T 1 和η2=1-T 3 /T 2代入式(2),亦可证得η=1-T 2 /T 1 +(1-T 3 /T 2 )T 2 /T 1 =1-T 3 /T 113 -31 在夏季,假定室外温度恒定为37℃,启动空调使室内温度始终保持在17 ℃.如果每天有2.51 ×108 J 的热量通过热传导等方式自室外流入室内,则空调一天耗电多少? (设该空调制冷机的制冷系数为同条件下的卡诺制冷机制冷系数的60%)分析 耗电量的单位为kW·h ,1kW·h =3.6 ×106J.图示是空调的工作过程示意图.因为卡诺制冷机的制冷系数为212T T T e k -=,其中T 1为高温热源温度(室外环境温度),T 2为低温热源温度(室内温度).所以,空调的制冷系数为e =e k · 60% =0.6 T 2/( T 1 -T 2 )另一方面,由制冷系数的定义,有e =Q 2 /(Q 1 -Q 2 )其中Q 1为空调传递给高温热源的热量,即空调向室外排放的总热量;Q 2是空调从房间内吸取的总热量.若Q ′为室外传进室内的热量,则在热平衡时Q 2=Q ′.由此,就可以求出空调的耗电作功总值W =Q 1-Q 2 .解 根据上述分析,空调的制冷系数为7.8%60212=-=T T T e在室内温度恒定时,有Q 2=Q ′.由e =Q 2 /(Q 1-Q 2 )可得空调运行一天所耗电功W =Q 1-Q 2=Q 2/e =Q ′/e =2.89×107=8.0 kW·h13 -32 一定量的理想气体进行如图所示的逆向斯特林循环(回热式制冷机中的工作循环),其中1→2为等温(T 1 )压缩过程,3→4为等温(T 2 )膨胀过程,其他两过程为等体过程.求证此循环的制冷系数和逆向卡诺循环制冷系数相等.(这一循环是回热式制冷机中的工作循环,具有较好的制冷效果.4→1过程从热库吸收的热量在2→3过程中又放回给了热库,故均不计入循环系数计算.)证明 1→2 过程气体放热2111lnV V RT Q v = 3→4 过程气体吸热 2122lnV V RT Q v = 则制冷系数 e =Q 2 /(Q 1-Q 2 )= T 2/( T 1-T 2 ).与逆向卡诺循环的制冷系数相同.13 -33 物质的量为ν的理想气体,其摩尔定容热容C V,m =3R/2,从状态A(p A ,V A ,T A )分别经如图所示的ADB 过程和ACB 过程,到达状态B(p B ,V B ,T B ).试问在这两个过程中气体的熵变各为多少? 图中AD 为等温线.分析 熵是热力学的状态函数,状态A 与B 之间的熵变ΔSAB 不会因路径的不同而改变.此外,ADB 与ACB 过程均由两个子过程组成.总的熵变应等于各子过程熵变之和,即DB AD AB S S S ΔΔΔ+=或CB AC AB S S S ΔΔΔ+=. 解 (1) ADB 过程的熵变为()()D B p,m A D B D D A T BD P D A T DBAD AB T T C V V T T C T W T Q T Q S S S /ln /ln /d /d /d /d ΔΔΔm p,v vR v +=+=+=+=⎰⎰⎰⎰ (1)在等温过程AD 中,有T D =T A ;等压过程DB 中,有V B /T B =V D /T D ;而C p ,m =C V ,m +R ,故式(1)可改写为()()()()A B A B A B p,m A B B D ADB V T V V V T C V T V T S /ln 23/ln /ln /ln ΔvR vR v vR +=+=(2) ACB 过程的熵变为()()C B V,m A C p,m CB AC BA ACB T TC V T C S S Q/T S /ln /ln ΔΔd Δv v +=+==⎰ (2)利用V C =V B 、p C =p A 、T C /V C =T A /V A 及T B /p B =T C /p C ,则式(2)可写为()()()()()()()A B A B A A B B V,m A B A B A B V,m ACB V T V V V p V p C V V p p V V R C S /ln 23/ln /ln /ln /ln /ln ΔvR vR v vR v v +=+=++=通过上述计算可看出,虽然ADB 及ACB 两过程不同,但熵变相同.因此,在计算熵变时,可选取比较容易计算的途径进行.13 -34 有一体积为2.0 ×10-2m 3的绝热容器,用一隔板将其分为两部分,如图所示.开始时在左边(体积V 1 =5.0 ×10-3m 3)一侧充有1mol 理想气体,右边一侧为真空.现打开隔板让气体自由膨胀而充满整个容器,求熵变.分析 在求解本题时,要注意⎰=BA T Q S d Δ 的适用条件.在绝热自由膨胀过程中,d Q =0,若仍运用上式计算熵变,必然有ΔS =0.显然,这是错误的结果.由于熵是状态的单值函数,当初态与末态不同时,熵变不应为零.出现上述错误的原因就是忽视了公式的适用条件. ⎰=BA T Q S d Δ 只适用于可逆过程,而自由膨胀过程是不可逆的.因此,在求解不可逆过程的熵变时,通常需要在初态与末态之间设计一个可逆过程,然后再按可逆过程熵变的积分式进行计算.在选取可逆过程时,尽量使其积分便于计算.解 根据上述分析,在本题中因初末态时气体的体积V 1 、V 2 均已知,且温度相同,故可选一可逆等温过程.在等温过程中,d Q =d W =p d V ,而VRT M m p =,则熵变为 ()1-12K J 52.11/ln d 1d d Δ12⋅=====⎰⎰⎰V V R M m V V R M m T V p T Q S V V。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第13章简单国民收入决定理论
一、填空题
1、总供给总需求
2、消费收入储蓄收入
3、平均消费倾向边际消费倾向
4、1 1
5、预期收益率利息率
6、下降上升稳定不变
7、投资国民收入边际消费倾向
8、没有得到
9、反方向减少减少减少
二、单项选择
1、C;
2、C;
3、A;
4、C;
5、B;
6、B;
7、A;8、D;9、C;10、B;11、D;12、B;
13、A;14、D;
三、判断题
1、√;
2、×;
3、×;
4、√;
5、×;
6、×;
7、×;8、√;9、×;10、√;11、×;12、×;
四、简答题
1、传统经济学认为,节俭即少消费,可以有较多的剩余,因而可以增加储蓄,近而增加投资,而投资的增加可以带来更多的收入,所以,无论从个人还是社会来看,节俭都是美德。
现代经济学认为,社会经济一般是处于小于充分就业的状态下,存在着生产能力过剩和资源闲置,因此,多消费会使投资增加,投资增加又会带动国民收入增加,如果全国上下都节俭,则消费减少,投资减少,社会总需求下降,国民收入减少,失业增加,陷入经济衰退。
所以,节俭从个人家庭看是美德,从社会经济发展角度看则成为“罪恶”,这就是节俭反论。
五、计算题
1、解:(1)∵C=100+0.8Y ,I=50
又Y=C+I
∴Y=100+0.8Y+50
则Y=750(亿元)
C=100+0.8Y
=100+0.8×750
=100+600
=700(亿元)
又∵Y=C+S
∴S=Y-C
=750-700
=50(亿元)
(2)∵△I=100,边际消费倾向b为0.8
∴投资乘数K= 1/(1-b)=5
∴国民收入增量△Y=K* △I=5*100=500(亿元)
2、解:∵△I=80亿,MPS=0.25
∴K= 1/(1-b)=1/MPS= 4
∵K= 4
∴△Y=△I×K
=80×4
=320(亿元)
又∵MPS=0.25
∴MPC=1-MPS
=1-0.25
=0.75
MPC=
∴△C=△Y×MPC
=320×0.75
=240(亿元)。
