高中_大学有机化学知识的大全总结【免费】
有机化学基础知识点总结

有机化学基础知识点总结有机化学是研究碳及其化合物的化学性质、结构、合成方法和应用的学科。
下面是有机化学的基础知识点总结:1.键合理论:有机化合物的化学性质与其分子内的键有着密切关系。
有机化学中常见的键有共价键、极性键和离子键。
2.碳骨架:大多数有机化合物的分子都是由碳原子构成的骨架。
根据碳原子之间的连接方式,碳骨架可分为直链、分支链、环状和杂环等几种不同的类型。
3.功能团:有机化合物中的功能团是指具有一定化学性质的结构单元。
常见的有机化合物功能团有羟基、醇基、酮基、酯基、羧基等。
4.反应类型:有机化学中常见的反应类型有取代反应、消除反应、加成反应、缩合反应、氧化还原反应等。
5.反应机理:有机化学反应的过程可以通过反应机理来描述。
常见的反应机理包括亲核取代反应机理、亲电取代反应机理、酸碱催化反应机理等。
6.按键性质分类:根据碳原子上的官能团的不同,有机化合物可分为饱和化合物和不饱和化合物。
饱和化合物中的碳碳键都是单键,而不饱和化合物中的碳碳键可以是双键或者三键。
7.合成方法:有机化学中的合成方法包括物理法、化学法和生物法。
常见的合成方法有酸催化、碱催化、取代反应、缩合反应等。
8.离子性和共价性:有机化合物既有离子性也有共价性。
大多数有机化合物分子中的键为共价键,但分子之间的作用力常常具有离子性质。
9.异构体:同一种分子式但结构不同的化合物称为异构体。
异构体可以分为构造异构体、空间异构体和立体异构体等几种类型。
10.应用领域:有机化学在药物、农药、材料科学等领域有着广泛的应用。
有机合成和有机反应研究的进展为新药的发现和农药的合成提供了重要的支持。
以上是有机化学的基础知识点总结,了解这些知识点对于学习和理解有机化学的基本概念和原理非常重要。
有机化学是一个广阔而深奥的学科,需要通过不断学习和实践来掌握和应用。
高中化学中有机化学的知识点总结8篇

高中化学中有机化学的知识点总结8篇第1篇示例:高中化学中有机化学是高中化学课程中的重要部分,主要研究有机物的结构、性质、合成方法和反应机理等内容。
有机化学知识是高中化学学习的难点,掌握有机化学知识对于高中化学学习和日常生活都有重要意义。
下面就是有机化学的一些重要知识点总结:1. 有机物的定义有机化学研究的是含有碳元素的化合物,碳元素是有机物的主要组成元素,因此有机物也被称为碳化合物。
有机物包括烃类、醇类、醛酮类、羧酸类等多种化合物。
2. 有机化合物的分类有机化合物主要分为脂肪烃、环烷烃、环烯烃、芳香烃、醇、醚、醛、酮、羧酸、酯等多种类别,每种类别都有其独特的特性和反应规律。
3. 有机物的结构有机物的结构包括分子式、结构式、键式和构象式等不同表示方法,通过这些表示方法可以清晰地描述有机物的分子结构和化学键构型。
4. 有机物的性质有机物具有多样性和复杂性的性质,包括物理性质(如沸点、熔点、密度等)和化学性质(如稳定性、溶解性、反应性等)。
5. 有机合成方法有机化学是有机合成的基础,有机合成方法包括加成反应、取代反应、消除反应、重排反应等多种方法,通过这些方法可以合成各种有机化合物。
6. 有机反应机理有机反应机理是研究有机反应过程中的原子或基团之间的结合和断裂规律,包括亲核取代、亲电取代、自由基取代等不同类型的有机反应机理。
7. 有机化学在生活中的应用有机化学在生活中有广泛的应用,例如食品添加剂、药物、化妆品、材料合成等领域都离不开有机化学知识。
第2篇示例:高中化学中有机化学的知识点总结有机化学是化学的一个重要分支,研究有机物的结构、性质、合成和反应规律。
在高中化学课程中,有机化学是一个重要的部分,学生需要掌握一定的有机化学知识。
下面我们来总结一下高中化学中有机化学的知识点。
1. 有机物的结构有机物是由碳和氢组成的化合物,其中碳是主要元素。
有机物的结构可以分为链状结构、环状结构和支链结构。
根据碳原子之间的连接方式不同,有机物可以是直链烷烃、环烷烃、烯烃、炔烃、芳香烃等不同类型。
高中有机化学知识归纳和总结(完整版)

高中有机化学知识点归纳和总结(完整版)一、同系物结构相似,在分子组成上相差一个或若干个CH 2原子团的物质物质。
同系物的判断要点:1、通式相同,但通式相同不一定是同系物。
2、组成元素种类必须相同3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。
结构相似不一定完全相同,如CH 3CH 2CH 3和(CH 3)4C ,前者无支链,后者有支链仍为同系物。
4、在分子组成上必须相差一个或几个CH 2原子团,但通式相同组成上相差一个或几个CH 2原子团不一定是同系物,如CH 3CH 2Br 和CH 3CH 2CH 2Cl 都是卤代烃,且组成相差一个CH 2原子团,但不是同系物。
5、同分异构体之间不是同系物。
二、同分异构体化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。
具有同分异构现象的化合物互称同分异构体。
1、同分异构体的种类:⑴ 碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C 5H 12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑵ 位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑶ 异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
⑷ 其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
各类有机物异构体情况:⑴ C n H 2n +2:只能是烷烃,而且只有碳链异构。
如CH 3(CH 2)3CH 3、CH 3CH(CH 3)CH 2CH 3、C(CH 3)4 ⑵ C n H 2n :单烯烃、环烷烃。
如CH 2=CHCH 2CH 3、CH 3CH=CHCH 3、CH 2=C(CH 3)2、 、⑶ C n H 2n -2:炔烃、二烯烃。
有机化学知识点总结【有机化学基础知识点归纳】

有机化学知识点总结【有机化学基础知识点归纳】1、常温常压下为气态的有机物:1〜4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2、碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯)都难溶于水;苯酚在常温微溶与水,但髙于651任意比互溶。
3、所有烃、酯、一氯烷烃的密度都小于水;一溴烷烃、多卤代烃、硝基化合物的密度都大于水。
4、能使溴水反应褪色的有机物有:烯烃、炔烃、苯酚、醛、含不饱和碳碳键(碳碳双键、碳碳叁键)的有机物。
能使溴水萃取褪色的有:苯、苯的同系物(甲苯)、CC14、氯仿、液态烷烃等。
5、能使酸性髙锰酸钾溶液褪色的有机物:烯烃、炔烃、苯的同系物、醇类、醛类、含不饱和碳碳键的有机物、酚类(苯酚)。
6、碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
7、无同分异构体的有机物是:烷烃:CH4、C2H6、C3H8;烯烃:C2H4;炔烃:C2H2;氯代烃:CH3C1、CH2C12、CHC13、CC14、C2H5Cl;醇:CH4O;醛:CH20、C2H4O;酸:CH202。
8、属于取代反应范畴的有:卤代、硝化、磺化、酯化、水解、分子间脱水(如:乙醇分子间脱水)等。
9、能与氢气发生加成反应的物质:烯烃、炔烃、苯及其同系物、醛、酮、不饱和羧酸(CH2二CHCOOH)及其酯(CH3CH=xxxx3)、油酸甘油酯等。
10、能发生水解的物质:金属碳化物(CaC2)、卤代烃(xxxxr)、醇钠(xxxxNa)、酚钠(C6H5ONa)、羧酸盐(xxxxa)、酯类(xxxxH2CH3)、二糖(C12H22O11)(蔗糖、麦芽糖、纤维二糖、乳糖)、多糖(淀粉、纤维素)((C6H10O5)n)、蛋白质(酶)、油脂(硬脂酸甘油酯、油酸甘油酯)等。
高中有机化学知识归纳总结

有机化学知识点归纳(一) 第 1 页 共 4 页有机物的物理性质1、状态:固态:饱和高级脂肪酸、脂肪、葡萄糖、果糖、蔗糖、麦芽糖、淀粉、维生素、醋酸(16.6℃以下);气态:C 4以下的烷、烯、炔烃、甲醛、一氯甲烷、新戊烷; 液态:油状:乙酸乙酯、油酸;粘稠状:石油、乙二醇、丙三醇。
2、气味:无味:甲烷、乙炔(常因混有PH 3、H 2S 和AsH 3而带有臭味); 稍有气味:乙烯;特殊气味:甲醛、乙醛、甲酸和乙酸; 香味:乙醇、低级酯; 3、颜色:白色:葡萄糖、多糖 黑色或深棕色:石油 4、密度:比水轻:苯、液态烃、一氯代烃、乙醇、乙醛、低级酯、汽油; 比水重:溴苯、乙二醇、丙三醇、CCl 4。
5、挥发性:乙醇、乙醛、乙酸。
6、水溶性:不溶:高级脂肪酸、酯、溴苯、甲烷、乙烯、苯及同系物、石油、CCl 4; 易溶:甲醛、乙酸、乙二醇;与水混溶:乙醇、乙醛、甲酸、丙三醇。
最简式相同的有机物1、CH :C 2H2、C 6H 6(苯、棱晶烷、盆烯)、C 8H 8(立方烷、苯乙烯); 2、CH 2:烯烃和环烷烃;3、CH 2O :甲醛、乙酸、甲酸甲酯、葡萄糖;4、C n H 2n O :饱和一元醛(或饱和一元酮)与二倍于其碳原子数的饱和一元羧酸或酯;如乙醛(C 2H 4O )与丁酸及异构体(C 4H 8O 2) 5、炔烃(或二烯烃)与三倍于其碳原子数的苯及苯的同系物。
如:丙炔(C 3H 4)与丙苯(C 9H 12)能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯) 2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 3 6FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 3 2FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO变色Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应) △有机化学知识点归纳(一) 第 2 页 共 4 页2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物 2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐)有机化学计算1、有机物化学式的确定(1)确定有机物的式量的方法①根据标准状况下气体的密度ρ,求算该气体的式量:M = 22.4ρ(标准状况)②根据气体A 对气体B 的相对密度D ,求算气体A 的式量:M A = D M B ③求混合物的平均式量:M = m (混总)/n (混总) ④根据化学反应方程式计算烃的式量。
大学有机化学期末复习知识点总结

⼤学有机化学期末复习知识点总结有机化学复习总结⼀.有机化合物的命名1. 能够⽤系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍⽣物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或⽴体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
⽴体结构的表⽰⽅法:1)伞形式:COOHOH3 2)锯架式:CH 3HHOH 2H 53)纽曼投影式:4)菲舍尔投影式:COOH3OH H5)构象(conformation) (1)⼄烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3)环⼰烷构象:最稳定构象是椅式构象。
⼀取代环⼰烷最稳定构象是e 取代的椅式构象。
多取代环⼰烷最稳定构象是e 取代最多或⼤基团处于e 键上的椅式构象⽴体结构的标记⽅法1. Z/E 标记法:在表⽰烯烃的构型时,如果在次序规则中两个优先的基团在同⼀侧,为Z 构型,在相反侧,为E 构型。
2、顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同⼀侧,则为顺式;在相反侧,则为反式。
3、 R/S 标记法:在标记⼿性分⼦时,先把与⼿性碳相连的四个基团按次序规则排序。
然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序是顺时针,则为R 构型,如果是逆时针,则为S 构型。
注:将伞状透视式与菲舍尔投影式互换的⽅法是:先按要求书写其透视式或投影式,然后分别标出其R/S 构型,如果两者构型相同,则为同⼀化合物,否则为其对映体。
有机化学知识点全归纳
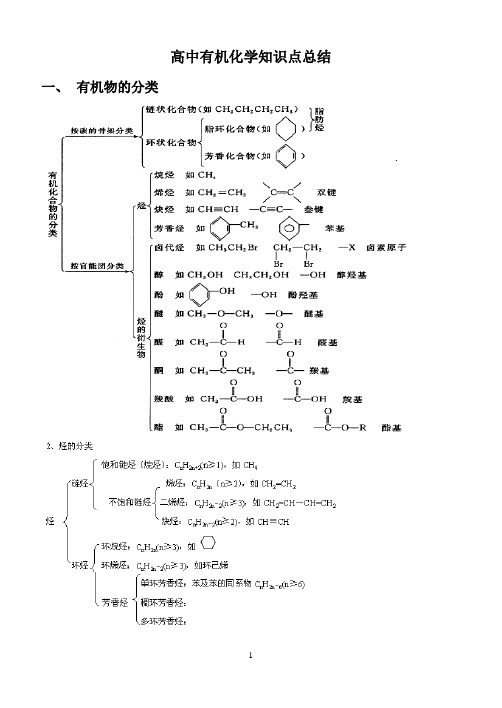
高中有机化学知识点总结一、有机物的分类二、有机物的转化关系1、常见链状有机物的转化(注意反应条件)2、常见环状有机物的转化二、 有机物的命名1.烷烃:选主链,称某烷;编号位,定支链;取代基,短线连;不同基,简在前,相同基,合并算。
长多近小写烃名,先简后繁位次清。
先小然后大,一基跟一位,数目汉数字,位置阿拉伯,字数短线隔,数字逗号撇。
其他类别的有机物:选含官能团的最长碳链为主链,从靠近官能团的一端编号,要指明官能团的位置。
练习2-甲基-1-丁烯与氢气加成以后的产物的名称为:三、有机物的组成和结构1.有机物的结构特点:化合价、成键方式、同分异构2.表示方法:(1)化学式:分子式 电子式 结构式 结构简式 最简式(实验式)键线式等 (2)模型:球棍模型 比例模型3.不饱和度:又称缺氢指数Ω=双键数+叁键数×2+环数 = (2n+2-m) /2ONaCOONa— —BrOH Br — Br(17) (18)4.同分异构:概念、分类、书写⑪碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C5H12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑫位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑬异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、氨基乙酸和硝基乙烷、葡萄糖与果糖、蔗糖与麦芽糖等。
⑭其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
5.同系物的概念(1)定义:________相似,在分子组成上相差______________________的物质互相称为同系物。
注意:①同系物之间具有相似的分子结构,因此化学性质相似,物理性质则随碳原子数的增加而发生规律性的变化。
高中有机化学知识归纳和总结(完整版)

醇、酮等,它们具有碳链异构、官能 团位置异构、异类异构,书写按顺序 考虑。一般情况是碳 链 异 构 → 官 能 团位置异构→异类异构。 ⑶ 芳香族化合物:二元取代物的取代基 在苯环上的相对位置具有邻 、间 、对 三种。
3、 判 断 同 分 异 构 体 的 常 见 方 法 :
2FeI + 3Br = 2FeBr + 2I 2
2 3 2 △
Mg + Br2 === MgBr2
(其中亦有 Mg 与 H+、Mg 与 HBrO 的反应)
⑷ Zn、Mg 等单质 如
⑸ -1 价的 I(氢碘酸及碘化物)变色
⑹ NaOH 等强碱、Na2CO3 和 AgNO3 等盐
Br2 + H2O = HBr + HBrO 2HBr + Na2CO3 = 2NaBr + CO2↑+ H2O HBrO + Na2CO3 = NaBrO + NaHCO3
七、能萃取溴而使溴水褪色的物质
上层变无色的(ρ>1):卤代烃(CCl4、
有机化学知识点归纳(一)
第 13 页 共 42 页
氯仿、溴苯等)、CS2 等; 下层变无色的(ρ<1):直馏汽油、煤焦
油、苯及苯的同 系物、低级酯、 液态环烷烃、液 态饱和烃(如己 烷等)等
八 、能 使 酸 性 高 锰 酸 钾 溶 液 褪 色 的 物 质
醇、邻二甲苯与间二甲苯及对二甲
苯。 ⑶ 异类异构:指官能团不同而造成的异
构,也叫官能团异构。如 1—丁炔与 1,3—丁二烯、丙烯与环丙烷、乙醇
有机化学知识点归纳(一)
第 2 页 共 42 页
高中化学的归纳有机化学总结

高中化学的归纳有机化学总结有机化学是化学科学中的一个重要分支,研究有机化合物的结构、性质、合成、反应和应用等方面。
在高中化学学习中,有机化学是一个非常重要的内容,本文将对高中有机化学的归纳总结进行探讨。
一、有机化学基础知识有机化学的基础知识是高中化学学习的重点,包括分子构建、键的类型、化学键的性质等。
分子构建是有机化学的基础,分子的构成元素和原子组成决定了有机化合物的性质。
有机分子中常见的键类型有共价键和极性共价键,它们的性质决定了分子的稳定性和反应性。
二、有机化学的反应类型有机化学的反应类型是高中化学学习中的重要内容。
常见的有机化学反应类型包括取代反应、加成反应、消除反应等。
取代反应是指有机化合物中一个原子或官能团被另一个原子或官能团所取代,这种反应一般以化学键的形式进行。
加成反应是指两个或多个分子相互作用形成新的化学键,而不改变原分子结构。
消除反应是指有机化合物中两个官能团结合脱离,生成一个双键或三键的反应。
三、有机化学的官能团官能团是有机化合物中具有特定化学性质的原子或原子团,不同的官能团对化合物的性质具有重要影响。
常见的有机化学官能团包括醇、酮、醛、酸、酯等。
醇是带有羟基(-OH)的化合物,具有亲水性和酸碱中性。
酮和醛由羰基(C=O)功能团构成,具有不同的化学性质。
酸是带有羧基(-COOH)的化合物,具有酸性。
酯是由酸和醇缩合而成,具有特定的酯基结构。
四、有机化学的命名规则有机化学的命名规则是高中化学学习中需要重点掌握的内容。
根据命名规则,有机化合物的命名主要包括链状碳骨架的命名和官能团的命名。
链状碳骨架的命名根据碳原子数和官能团的位置进行命名,而官能团的命名则依据官能团的特点和位置进行命名。
五、有机化学实验技术有机化学实验技术是高中化学学习中不可或缺的一部分,它包括有机合成方法、分离纯化技术和分析表征技术等。
有机合成方法是指通过化学反应得到目标有机化合物的方法,常见的有机合成方法包括酯化反应、醛缩合反应等。
高中化学有机化学知识点总结(全)

高中化学有机化学知识点总结(全)高中化学有机化学知识点总结
1. 有机化学的定义
有机化学是研究有机物的性质、结构、合成和反应规律的科学。
有机物主要由碳元素构成,并且通常含有氢、氧、氮、硫等其他元素。
2. 有机化合物的命名
有机化合物的命名遵循一定的命名规则。
常见的命名体系包括IUPAC命名法和通用命名法,其中IUPAC命名法是最常用的。
3. 有机化合物的结构
有机化合物的结构可以用结构式、分子式和谱图表示。
结构式
可以分为平面结构式和立体结构式,分子式表示化合物由哪些元素
组成,谱图可以提供有机化合物的结构信息。
4. 有机化合物的性质
有机化合物具有很多特点,包括燃烧性、溶解性、稳定性、化
学反应性等。
这些性质往往与有机化合物的结构密切相关。
5. 有机化合物的合成
有机化合物的合成方法多种多样,包括酯的酸催化缩合、卤代
烷的卤化反应、醇的脱水反应等。
不同的合成方法可以达到不同的
合成目的。
6. 有机化合物的反应
有机化合物的反应种类繁多,主要包括取代反应、加成反应、
消除反应、重排反应等。
这些反应可以改变有机化合物的结构和性质。
7. 有机化合物的分类
有机化合物可以按照功能团、碳骨架、化学性质等方面进行分类。
常见的有机化合物类别包括烃类、醇类、酮类、醛类、酯类等。
8. 重要的有机化合物
有机化学中存在许多重要的化合物,例如乙醇、甲烷、乙烯、
甲苯等。
这些化合物在工业生产和日常生活中都有广泛的应用。
以上是高中化学有机化学的知识点总结,希望对你有帮助!。
(完整版)高中有机化学基础知识点归纳(全)汇总

一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
二、重要的反应1.能使溴水(Br2/H2O)褪色的物质(1)有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。
③通过氧化反应使之褪色:含有—CHO(醛基)的有机物(有水参加反应)注意:纯净的只含有—CHO(醛基)的有机物不能使溴的四氯化碳溶液褪色④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯(2)无机物①通过与碱发生歧化反应3Br2 + 6OH- == 5Br- + BrO3- + 3H2O或Br2 + 2OH- == Br- + BrO- + H2O②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质1)有机物:含有、—C≡C—、—OH(较慢)、—CHO的物质苯环相连的侧链碳上有氢原子的苯的同系物(但苯不反应)2)无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+3.与Na反应的有机物:含有—OH、—COOH的有机物与NaOH反应的有机物:常温下,易与—COOH的有机物反应加热时,能与卤代烃、酯反应(取代反应)与Na2CO3反应的有机物:含有—COOH的有机物反应生成羧酸钠,并放出CO2气体;与NaHCO3反应的有机物:含有—COOH的有机物反应生成羧酸钠并放出等物质的量的CO2气体。
4.既能与强酸,又能与强碱反应的物质(1)氨基酸,如甘氨酸等H2NCH2COOH + HCl → HOOCCH2NH3ClH2NCH2COOH + NaOH → H2NCH2COONa + H2O(2)蛋白质分子中的肽链的链端或支链上仍有呈酸性的—COOH和呈碱性的—NH2,故蛋白质仍能与碱和酸反应。
(完整版)大学有机化学知识点总结
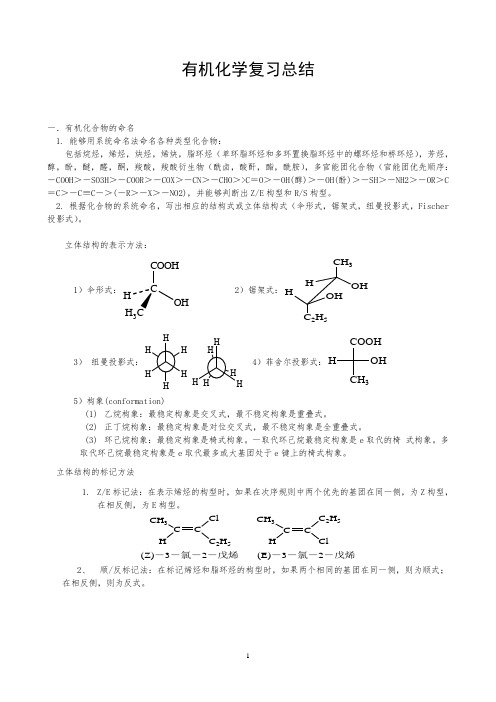
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOHH 3 2)锯架式:CH 3OH HHOH C 2H 53)纽曼投影式:H H 4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C H C 2H 5CH 3C CH 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3C CHCH 3HCH 3CCH HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
高中有机化学知识点总结5篇

高中有机化学知识点总结5篇第1篇示例:高中有机化学知识点总结有机化学是化学领域中的一个重要分支,主要研究碳和氢元素以及它们的官能团之间的化学反应和结构。
在高中化学学习中,有机化学是一个重要的部分。
以下是高中有机化学知识点的总结:一、有机物的结构1. 碳的共价键:碳原子能形成四条共价键,因此有机化合物中几乎所有的结构都是以碳原子为中心的。
2. 极性键和非极性键:有机化合物中的键可以是极性的或非极性的,极性键的两端电性相差较大,而非极性键的两端电性相差较小。
3. 碳骨架:有机化合物的结构是由碳原子构成的碳骨架,碳骨架的形式多种多样,包括直链、支链、环状等。
4. 官能团:官能团是有机化合物中具有特定化学性质的功能性团,例如羟基、羧基、氨基等。
二、有机化学反应1. 加成反应:两个分子结合成一个分子,通常涉及双键或三键的断裂和形成。
3. 取代反应:有机化合物中的一个原子或基团被另一个原子或基团所取代。
4. 氧化还原反应:涉及氧化剂和还原剂的参与,原子的氧化态发生改变。
三、重要官能团1. 羟基(-OH):羟基是氧原子与氢原子的共价键,常见于醇、酚等化合物中,具有亲水性。
2. 羧基(-COOH):羧基由一个羰基和一个羟基组成,通常具有酸性。
3. 氨基(-NH2):氨基由两个氢原子与氮原子形成的共价键,通常在胺类化合物中出现。
4. 醛基和酮基:醛基(-CHO)和酮基(-CO-)是碳氧双键的官能团,分别出现在醛和酮类化合物中。
四、重要有机化合物1. 烷烃:由碳氢构成,只含有碳-碳单键的碳氢化合物。
4. 醇:含有羟基的有机化合物。
7. 脂肪族环化合物:通过碳原子形成环状结构的化合物,如环烷烃等。
第2篇示例:高中有机化学知识点总结有机化学作为化学的一个重要分支,主要研究碳氢化合物及其衍生物的结构、性质、合成方法和反应规律。
在高中化学学习中,有机化学是一个重要的内容,是学生们学习化学知识的重点之一。
下面我们就来总结一下高中有机化学的知识点。
大学有机化学知识点总结
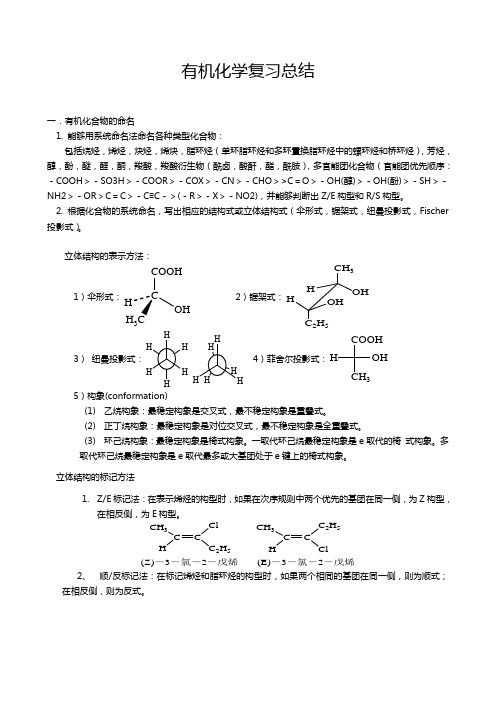
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:COOHOHH 3 2)锯架式:CH 3OHHHOH C 2H 53)纽曼投影式:4)菲舍尔投影式:COOH3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3CHC 2H 5CH 3CHC 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH3C CHCH3HCH3C CHHCH3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、R/S标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
高中有机化学基础知识点总结7篇

高中有机化学基础知识点总结7篇第1篇示例:高中有机化学基础知识点总结有机化学是研究含有碳的化合物的化学性质、结构和反应的学科。
在高中化学课程中,有机化学占据了重要的地位。
下面将总结高中有机化学的基础知识点,帮助同学们更好地理解这一部分内容。
一、有机化合物的命名有机化合物的命名是有机化学的基础,掌握了命名规则,就能更好地理解和运用有机化合物。
主要包括以下几种命名方式:1. 以碳原子数命名:甲烷(一碳)、乙烷(二碳)、丙烷(三碳)等。
2. 以官能团命名:醇、醛、酮、酯等。
3. 以取代基命名:氯代甲烷、溴代乙烷等。
有机化合物的结构是指它们由碳和氢以及其他原子组成的分子结构。
了解有机化合物的结构有助于理解其性质和反应。
主要包括以下几种结构:1. 直链烷烃:碳原子按直线连接,例如正戊烷。
2. 环状烷烃:碳原子形成环状结构,例如环己烷。
3. 双键和三键结构:有机化合物中可以存在双键和三键,例如乙烯和乙炔。
有机化合物的物理性质和化学性质是指其在物理和化学方面的特点。
主要包括以下几点:1. 沸点和熔点:不同种类的有机化合物由于分子结构的不同,其沸点和熔点也不相同。
2. 溶解性:有机化合物通常溶解于有机溶剂,不溶于水。
3. 酸碱性:有机化合物中含有醇基、酸基等官能团,可表现出酸碱性。
四、有机反应有机化合物的反应是有机化学的核心内容。
有机反应主要包括取代反应、加成反应、消除反应等。
以下是常见的有机反应:1. 取代反应:烷烃通过取代反应能够形成卤代烷。
2. 加成反应:烯烃通过加成反应可以形成醇、醛、醯胺等。
五、有机聚合物有机聚合物是一类由重复单体通过共价键连接而成的高分子化合物。
有机聚合物在生活中有着广泛的应用,例如聚乙烯、聚丙烯、聚氯乙烯等。
以上就是高中有机化学基础知识点的总结。
希未这篇文章能够帮助同学们更好地掌握有机化学的基础知识,为日后的学习打下扎实的基础。
【若需进一步了解该领域,请关注专业书籍及教学视频,或进行相关实验操作。
高中有机化学知识归纳总结(完整版)

有机化学知识点一、同系物结构相似,在分子组成上相差一个或若干个CH 2原子团的物质物质。
同系物的判断要点:1、通式相同,但通式相同不一定是同系物。
2、组成元素种类必须相同3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。
结构相似不一定完全相同,如CH 3CH 2CH 3和(CH 3)4C ,前者无支链,后者有支链仍为同系物。
4、在分子组成上必须相差一个或几个CH 2原子团,但通式相同组成上相差一个或几个CH 2原子团不一定是同系物,如CH 3CH 2Br 和CH 3CH 2CH 2Cl 都是卤代烃,且组成相差一个CH 2原子团,但不是同系物。
5、同分异构体之间不是同系物。
二、同分异构体化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。
具有同分异构现象的化合物互称同分异构体。
1、同分异构体的种类:⑴ 碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C 5H 12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑵ 位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑶ 异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
⑷ 其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
各类有机物异构体情况:⑴ C n H 2n +2:只能是烷烃,而且只有碳链异构。
如CH 3(CH 2)3CH 3、CH 3CH(CH 3)CH 2CH 3、C(CH 3)4 ⑵ C n H 2n :单烯烃、环烷烃。
如CH 2=CHCH 2CH 3、CH 3CH=CHCH 3、CH 2=C(CH 3)2、 、⑶ C n H 2n -2:炔烃、二烯烃。
如:CH ≡CCH 2CH 3、CH 3C ≡CCH 3、CH 2=CHCH=CH 2⑷ C n H 2n -6:芳香烃(苯及其同系物)、 ⑸ C n H 2n +2O :饱和脂肪醇、醚。
