高中化学选修三课件配合物四
合集下载
2016年福建省东山第二中学高二化学课件选修3专题4配合物的形成和应用(共20张ppt)

一、配合物的形成
活动与探究 P76 《金榜》P41
实验现象: 先出现蓝色沉淀,继续滴加浓氨水 沉淀溶解,生成深蓝色溶液。 结论: Cu2+和过量浓氨水反应生成可溶性物质。 Cu2+ +2NH3. H2O = Cu(OH)2↓+ 2NH4+ Cu(OH)2+4NH3 = [Cu(NH3)4]2++2OH-
第二单元 配合物是如何形成的
学习目标:
1.了解人类对配合物结构认识的历史.
2.知道简单配合物的基本组成和形成条件. 3.理解配合物的结构和性质之间的关系. 4.认识配合物在生产生活和科学研究方面的广泛应用. 重点:1.配合物的基本组成和形成条件. 2.理解配合物的结构和性质之间的关系. 3.认识配合物在生产生活和科学研究方面的广泛应用. 难点:1.配合物的基本组成和形成条件. 2.理解配合物的结构和性质之间的关系. 3.认识配合物在生产生活和科学研究方面的广泛应用.
[Pt(NH3)2Cl4]
中心原子:Pt 配位体:NH3、Cl配位数:6
2、判断下列配合物的中心原子的化合价
[Ag(NH3)2]OH
+1 +2
+1
0
-1
[Cr(H2O)5Cl]Cl2· H2O K[Pt(NH3)Cl3]
-1
+3 0 -1 +1 +2 0 -1
+3
0
-1 -1
0
K4[Fe(CN)6]
配 合 物
内 界
配位原子 N 。
内 界
外界
外界
[Cu(NH3)4] SO4
中 配 配 外 心 位 位 界 原 体 数 离 子 子
活动与探究 P76 《金榜》P41
实验现象: 先出现蓝色沉淀,继续滴加浓氨水 沉淀溶解,生成深蓝色溶液。 结论: Cu2+和过量浓氨水反应生成可溶性物质。 Cu2+ +2NH3. H2O = Cu(OH)2↓+ 2NH4+ Cu(OH)2+4NH3 = [Cu(NH3)4]2++2OH-
第二单元 配合物是如何形成的
学习目标:
1.了解人类对配合物结构认识的历史.
2.知道简单配合物的基本组成和形成条件. 3.理解配合物的结构和性质之间的关系. 4.认识配合物在生产生活和科学研究方面的广泛应用. 重点:1.配合物的基本组成和形成条件. 2.理解配合物的结构和性质之间的关系. 3.认识配合物在生产生活和科学研究方面的广泛应用. 难点:1.配合物的基本组成和形成条件. 2.理解配合物的结构和性质之间的关系. 3.认识配合物在生产生活和科学研究方面的广泛应用.
[Pt(NH3)2Cl4]
中心原子:Pt 配位体:NH3、Cl配位数:6
2、判断下列配合物的中心原子的化合价
[Ag(NH3)2]OH
+1 +2
+1
0
-1
[Cr(H2O)5Cl]Cl2· H2O K[Pt(NH3)Cl3]
-1
+3 0 -1 +1 +2 0 -1
+3
0
-1 -1
0
K4[Fe(CN)6]
配 合 物
内 界
配位原子 N 。
内 界
外界
外界
[Cu(NH3)4] SO4
中 配 配 外 心 位 位 界 原 体 数 离 子 子
高中化学选修三--全套PPT课件
且它们的自旋方向相反
2、洪特规则
怎么填
电子总是优先单独地占据简并轨道
且它们的自旋方向相同
-
28
3、电子排布图
例:写出O原子的电子排布图 O原子的电子排布式: 1s2 2s2 2p4
1s2 2s2
2p4
-
29
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图 O原子
的递增而呈周期性的变化
1、原子半径
层数 层数多半径大 电子间斥力大 决定因素
核电 核电荷数大半径小 正负电荷
荷数
间引力大
同周期主族元素:从左至右原子半径递减
同主族元素:从上至下原子半径递增
电子层结构相同的离子原- 子序数小的半径大!39
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转 化为气态基态正离子所需最低能量 同周期主族元素第一电离能从左至右逐渐升高
-
58
2、键长
①定义:形成共价键的两个原子间的核间距 共价半径:同种原子的共价键键长的一半
稀有气体为单原子分子,无共价半径
②意义:键长越短,键能越大,分子越稳定
-
59
观察表2-2 某些共价键的键能
③结论:同种元素间形成的共价键的键长: 单键>双键>叁键
-
60
3、键角
①定义:两个共价键之间的夹角 ②常见键角: 共价键的方向性
化学 选修三
原子结构 原子结构与性质
原子结构与元素的性质 共价键
分子结构与性质 分子的立体结构
晶体结构与性质
分子的性质
晶体的常识
分子晶体与原子晶体
金属晶体
高中化学选修三全套ppt课件
书写时:1s2 2s2 2p6 3s2 3p6 3d10 4s2 写出K Ca Ti Co Ga Kr Br的电子排布式
19
Zn:1s2 2s2 2p6 3s2 3p6 3d10 4s2 Ar 简 化
Zn:[Ar] 3d10 4s2 ②简化电子排布式
价层电子:主族、0族元素最外层 副族、Ⅷ族最外层和次外层
小黑点:概率密度
单位体积内出现的概率 小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图 电子出现的概率约为90%的空间 即精简版电子云
③电子云轮廓图特点 a.形状 ns能级的电子云轮廓图:球形 np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
24
b.电子云扩展程度 同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、洪特规则
怎么填
电子总是优先单独地占据简并轨道
且它们的自旋方向相同
30
3、电子排布图
例:写出O原子的电子排布图 O原子的电子排布式: 1s2 2s2 2p4
1s2 2s2
2p4
31
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图 O原子
Enp﹤E(n+1)p ﹤ E(n+2)p ﹤ E(n+3)p
15
能层 K L
M
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 2 6 2 6 10 2 6 10 14
数
能层 2 8 电子
18
数 2n2 2n2
2n2
32 2n2
16
三、构造原理与电子排布式
19
Zn:1s2 2s2 2p6 3s2 3p6 3d10 4s2 Ar 简 化
Zn:[Ar] 3d10 4s2 ②简化电子排布式
价层电子:主族、0族元素最外层 副族、Ⅷ族最外层和次外层
小黑点:概率密度
单位体积内出现的概率 小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图 电子出现的概率约为90%的空间 即精简版电子云
③电子云轮廓图特点 a.形状 ns能级的电子云轮廓图:球形 np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
24
b.电子云扩展程度 同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、洪特规则
怎么填
电子总是优先单独地占据简并轨道
且它们的自旋方向相同
30
3、电子排布图
例:写出O原子的电子排布图 O原子的电子排布式: 1s2 2s2 2p4
1s2 2s2
2p4
31
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图 O原子
Enp﹤E(n+1)p ﹤ E(n+2)p ﹤ E(n+3)p
15
能层 K L
M
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 2 6 2 6 10 2 6 10 14
数
能层 2 8 电子
18
数 2n2 2n2
2n2
32 2n2
16
三、构造原理与电子排布式
高中化学苏教版选修三 4.2 配合物的形成和应用 课件 (共19张PPT)

配位体具有孤电子对
内界
外界(或无外界) 外界和内界可完全电离
内界很难继续电离。
巩固提升 1.指出下列各配合物中的内界(配离子)、 中心原子、配位体、配位数及配位原子。
(1) [Co(NH3)5Cl] Cl2
(2) Na3[AlF6]
(3) K2[Pt(NH3)2(OH)2Cl2]
内界为
内界为
[Co(NH3)5Cl]2+ 中心原子 Co3+
(1)中心原子是提供空轨道 接受孤电子对的金属离子 (或原子),一般是带正电荷的阳离子,常见的有 过渡金属离子Fe3+、Ag+、Cu2+、Zn2+等。 (2)配位体是提供孤电子对的分子或阴离子,如 NH3、H2O、CO、Cl-、F-、SCN-、CN-等。 直接提供孤电子对的原子叫做配位原子,如NH3 中的N、H2O分子中的O、CO分子中的C等。 (3)配位数是中心原子形成的配位键的数目。 (4)内界和外界:配离子称为内界,与内界电性匹 配的离子称为外界。
内界为[AlF6]3中心原子 Al3+
[Pt(NH3)2(OH)2Cl2]2中心原子 Pt2+
配位体 NH3、Cl配位数 6
配位体 F配位数 6
配位体 NH3、OH-、Cl配位数 6
配位原子 N、Cl 配位原子 F 配位原子 N、O、Cl
巩固提升
2.向下列配合物的水溶液中加入AgNO3溶 液,不能生成AgCl沉淀的是( B )
孤电子对的:H+、
NH3、H2O、CO、Cl-、配位键的形成条件:部分过渡金属离
F-、CN-、SCN-
子(Ag+、Zn2+、
一个原子单方面提供孤电子对, Cu2+、Fe3+等)
另一个原子有能接受孤电子对的“空轨道”。
内界
外界(或无外界) 外界和内界可完全电离
内界很难继续电离。
巩固提升 1.指出下列各配合物中的内界(配离子)、 中心原子、配位体、配位数及配位原子。
(1) [Co(NH3)5Cl] Cl2
(2) Na3[AlF6]
(3) K2[Pt(NH3)2(OH)2Cl2]
内界为
内界为
[Co(NH3)5Cl]2+ 中心原子 Co3+
(1)中心原子是提供空轨道 接受孤电子对的金属离子 (或原子),一般是带正电荷的阳离子,常见的有 过渡金属离子Fe3+、Ag+、Cu2+、Zn2+等。 (2)配位体是提供孤电子对的分子或阴离子,如 NH3、H2O、CO、Cl-、F-、SCN-、CN-等。 直接提供孤电子对的原子叫做配位原子,如NH3 中的N、H2O分子中的O、CO分子中的C等。 (3)配位数是中心原子形成的配位键的数目。 (4)内界和外界:配离子称为内界,与内界电性匹 配的离子称为外界。
内界为[AlF6]3中心原子 Al3+
[Pt(NH3)2(OH)2Cl2]2中心原子 Pt2+
配位体 NH3、Cl配位数 6
配位体 F配位数 6
配位体 NH3、OH-、Cl配位数 6
配位原子 N、Cl 配位原子 F 配位原子 N、O、Cl
巩固提升
2.向下列配合物的水溶液中加入AgNO3溶 液,不能生成AgCl沉淀的是( B )
孤电子对的:H+、
NH3、H2O、CO、Cl-、配位键的形成条件:部分过渡金属离
F-、CN-、SCN-
子(Ag+、Zn2+、
一个原子单方面提供孤电子对, Cu2+、Fe3+等)
另一个原子有能接受孤电子对的“空轨道”。
高中化学苏教版选修3 专题4第二单元 配合物的形成和应用 课件(34张)

3.配合物的稳定性 配合物具有一定的稳定性,配合物中的配位键越强,配 合 物 越稳定。当作为中心原子的金属离子相同时,配合物的稳 定 性与配位体的性质有关。例如:血红素中的Fe2+与CO分子形 成的配位键比Fe2+与O2分子形成的配位键强,因此血红素 中 的Fe2+与CO分子结合后,就很难再与O2分子结合,血 红 素 就失去了输送氧气的功能,从而导致人体CO中毒。
2.配合物的溶解性
有的配合物易溶于水,如[Ag(NH3)2]OH、[Cu(NH3)4]SO4、 Fe(SCN)3等。利用配合物的这一性质,可将一些难溶于水 的 物质,如AgOH、AgCl、Cu(OH)2等溶解在氨水中形成 配 合 物。如在照相底片的定影过程中,未曝光的AgBr常用硫代 硫
酸钠(Na2S2O3)溶解,反应的化学方程式为AgBr+ 2Na2S2O3===Na3[Ag(S2O3)2]+NaBr。金和铂之所以能溶于王 水中,也是与生成配合物的溶解性有关,反应式为Au+
有些配合物不存在外界,如[PtCl2(NH3)2]、[CoCl3(NH3)3] 等。另外,有些配合物是由中心原子与配位体构成,如 [Ni(CO)4]、[Fe(CO)5]等。
2.配合物的结构
配位数
杂化轨道 类型
空间构型
结构示意图
实例
2
sp
直线形
[Ag(N+H3)2] [Cu(N+H3)2]
4
sp3
正四面体
子对,所以不能形成配位键。
3.下列不属于配离子的是( D ) A.[Ag(NH3)2]+ B.[Cu(CN)4]2- C.[Fe(SCN)6]3-
D.MnO- 4
解析:MnO4- 无配位原子。
4.向下列配合物的水溶液中加入AgNO 3溶 液, 不 能 生 成 AgCl沉淀的是( B ) A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3] C.[Co(NH3)6]Cl3 D.[Co(NH3)5Cl]Cl2 解析:在配合物中,内界以配位键结合很牢固,难以在溶 液
高中化学选修三__全套课件 共202页PPT资料

σ键 按成键方式 按电子云 π键 重叠方式
极性共价键 不同原子 成键
非极性共 同种原子
价键
成键
4、σ键
定义: 两个原子轨道沿键轴方向 以“头碰头”的方式重叠
H
H
HH
HH
Cl
Cl
H
H
①类型 s-s σ键 例:H2 s-p σ键 例:HCl p-p σ键 例:Cl2
HH
Cl H
HH
②特点 头碰头 重叠程度大,稳定性高
同周期主族元素从左至右电负性逐渐变大 同主族元素从上至下电负性逐渐变小
②电负性应用
一般而言 金属<1.8,非金属>1.8 1.8左右的既有金属性,又有非金属性
对角线规则:元素周期表中的某些主族元素 其某些性质与右下角元素相似
4、金属性与非金属性
金属性:金属单质的还原性 非金属性:非金属单质的氧化性 同主族元素从上至下 金属性增强,非金属性减弱
越易反应,非金属性越强 气态氢化物的稳定性
越稳定,非金属性越强 最高价氧化物对应水化物——最高价含氧酸
酸性强弱 酸性越强,非金属性越强
5、化合价
主族元素族序数=最高正价=价电子数 F、O 非金属最低负化合价=主族元素族序数—8
同周期的主族元素从左至右 化合价由+1→+7, -4 →0递增 巩固练习见资料
量关系
3.知道原子核外电子的能级分布及其能
.
量关系
4.能用符号表示原子核外的不同能级,
初步知道量子数的涵义
5.了解原子结构的构造原理,能用构造
原理认识原子的核外电子排布
6.能用电子排布式表示常见元素(1~
36号)原子核外电子的排布
一、开天辟地——原子的诞生
极性共价键 不同原子 成键
非极性共 同种原子
价键
成键
4、σ键
定义: 两个原子轨道沿键轴方向 以“头碰头”的方式重叠
H
H
HH
HH
Cl
Cl
H
H
①类型 s-s σ键 例:H2 s-p σ键 例:HCl p-p σ键 例:Cl2
HH
Cl H
HH
②特点 头碰头 重叠程度大,稳定性高
同周期主族元素从左至右电负性逐渐变大 同主族元素从上至下电负性逐渐变小
②电负性应用
一般而言 金属<1.8,非金属>1.8 1.8左右的既有金属性,又有非金属性
对角线规则:元素周期表中的某些主族元素 其某些性质与右下角元素相似
4、金属性与非金属性
金属性:金属单质的还原性 非金属性:非金属单质的氧化性 同主族元素从上至下 金属性增强,非金属性减弱
越易反应,非金属性越强 气态氢化物的稳定性
越稳定,非金属性越强 最高价氧化物对应水化物——最高价含氧酸
酸性强弱 酸性越强,非金属性越强
5、化合价
主族元素族序数=最高正价=价电子数 F、O 非金属最低负化合价=主族元素族序数—8
同周期的主族元素从左至右 化合价由+1→+7, -4 →0递增 巩固练习见资料
量关系
3.知道原子核外电子的能级分布及其能
.
量关系
4.能用符号表示原子核外的不同能级,
初步知道量子数的涵义
5.了解原子结构的构造原理,能用构造
原理认识原子的核外电子排布
6.能用电子排布式表示常见元素(1~
36号)原子核外电子的排布
一、开天辟地——原子的诞生
苏教版 高中化学 选修三 专题4(2)《配合物的形成和应用》ppt课件

(
)
分析:√。Cu2+与氨气分子中的氮原子通过共用氮原子提供的孤电子 对形成配位键。
2.下列关于配合物的说法中不正确的是
(
)
A.许多过渡金属离子对多种配位体具有很强的结合力,因而过渡金属
配合物远比主族金属配合物多
B.配合物中,中心离子与配位体间、配离子与酸根离子间都是以配位
键结合
C.配离子中,中心离子提供空轨道,配位体提供孤电子对
4.(SJ·P83改编)下列配合物中配位数为2的是
(
)
A.[Ag(NH3)2]+
C.[Co(NH3)6]3+
B.[PtCl2(NH3)2]
D.[Ni(CN)4]2-
【解析】选A。配位数是指直接同中心原子配位的原子或分子的数
目,B、D两项配位数为4,C项配位数为6。
一、配位键与配合物 1.配位键: (1)形成条件:①中心原子必须有空轨道;②配位原子必须有孤电子对。 (2)表示方法:配位键用“A→B”表示,A为提供孤电子对的原(离) 子,B为接受孤电子对的原(离)子。
2+生成[Cu(NH ) ]2+。 浓氨水 离开,可用_______,Cu 3 4
(3)定量测定物质的组成。
(4)溶解某些特殊物质:金和铂之所以能溶于王水中,也是与生成配离
子的反应有关。
Au+HNO3+4HCl====H[AuCl4]+NO↑+2H2O
3Pt+4HNO3+18HCl====3H2[PtCl6]+4NO↑+8H2O
2
NH3分子 配位体:_______
4 配位数:__
(3)形成条件。 孤电子对 。如中性分子有____________ H2O、NH3、CO 等;离子有 ①配位体有_________ F-、Cl-、CN- 等。 ____________
选修三配合物PPT课件
-
2
实验2-2 已知氢氧化铜与足量氨水反应 后溶解是因为生成了[Cu(NH3) 4]2+ ,其 结构简式为:
NH3
2+
H3N Cu NH3
NH3
试写出实验中发生的两个反应的离子方程式?
Cu 2+ +2NH3 .H2O
Cu(OH)2 +2 NH4 +
Cu(OH)2 + 4NH3 . H2O
蓝色沉淀
[Cu(NH3) 4]2+ +2OH—+4H2O
[Co(NH3)2(en)2](NO3)3 配位数6
*中心离子的电荷高,对配位体的吸引力较强,有 利于形成配位数较高的配合物。 *中心离子半径越大,其周围可容纳配体就越多, 配位数越大。
常见的配位数与中心离子的电荷数有如下的关系:
中心离子的电荷:+1 2
+3 +4
常见的配位数: 2 4(或6) 6(或4) 6(或8)
用二、三、四等数字表示配位体数。不同配位名 称之间用圆点“·”分开。 阴离子次序为:简单 离子——复杂离子——有机酸根离子。
中性分子次序为:NH3—H2O—有机分子。
-
11
1.配位阴离子配合物--配位阴离子“酸”外
界K2[SiF6]
六氟合硅(Ⅳ)酸钾
K[PtCl5(NH3)]
五氯·一氨合铂(Ⅳ)酸钾
-
13
形成配合物时性质的改变
1、颜色的改变 Fe3+ + nNCS- == [Fe(NCS)n](n-3)-
2、溶解度的改变: AgCl + HCl =[AgCl2]- + H+ AgCl + 2NH3 == [Ag(NH3)2]+ + ClAu + HNO3 + 4HCl == H[AuCl4] + NO + 2H2O 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
高中选修三配合物

离子位于中心,六个氨分子作为配体通过配位键与铁离子相连。
02 03
铜(II)与乙二胺的配合物
铜(II)离子可以与乙二胺形成四乙二胺合铜(II)配合物([Cu(en)2]2+),其 中铜离子位于中心,四个乙二胺分子作为配体通过配位键与铜离子相连 。
钴(II)与氯离子的配合物
钴(II)离子可以与氯离子形成四氯合钴(II)配合物([CoCl4]2-),其中钴离 子位于中心,四个氯离子作为配体通过配位键与钴离子相连。
B
溶液的性质
溶液的pH值、离子强度、溶剂性质等也会 影响配合物的稳定性。例如,在强酸性溶液 中,一些配合物可能会发生解离;在强碱性
D
溶液中,一些配合物可能会发生沉淀。
03 配合物在化学反应中作用
氧化还原反应中作用
配合物作为氧化剂
01
某些配合物中的中心原子可以接受电子,从而作为氧化剂参与
氧化还原反应。
以中心原子的元素符号表示,其氧化态用 罗马数字标明。
配合物结构与性质
02
配合物空间构型
01
直线型
配合物中心原子与配体以直线方式排列,如 [Cu(NH3)2]+。
02
平面型
配合物中心原子与配体在同一平面上,形成平面构型, 如[PtCl4]2-。
03
四面体型
配合物中心原子位于四面体中心,四个配体位于四面体 的顶点,如[Ni(CO)4]。
谢谢聆听
稀土金属离子
如镧系和锕系元素,具有 特殊的电子构型和化学性 质,能与多种配体形成稳 定的配合物。
常见配体类型及其性质
氨和胺类配体
具有孤对电子的氮原子可以与 金属离子形成配位键,如氨 (NH3)、乙二胺(en)等。
苏教版高中化学选修三课件配合物第4课时.pptx

思考题:
向CoCl2溶液中滴加氨水,使生成的Co(OH)2沉 淀溶解生成[Co(NH3)6]2+。此时向溶液中通入空气, 得到的产物中有一种其组成可用CoCl3·5NH3表示。 把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶 液,则析出AgCl沉淀。经测定,每1mol CoCl3·5NH3只生成2mol AgCl。请写出表示此配合 物结构的化学式(钴的配位数为6):__断不正 确的是 A、[Fe(CN)6]3->[Fe(SCN)6]3- B、[Co(NH3)6]2+>[Co(NH3)6]3+
C、[AlF6]3->[AlBr6]3- D、[Cu(NH3)4]2+>[Zn(NH3)4]2+ (Cu2+的半径小于Zn2+的半径)
答案:B
配合物的稳定性
配合物具有一定的稳定性,配合物中 的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时, 配合物的稳定性与配体的性质有关。
配合物的稳定性
(1)中心离子的影响 简单阳离子,半径越小稳定性越强。
(2)配位原子电负性的影响 配位原子的电负性越大,配合物越稳定;
配位原子电负性越小,配合物越不稳定。 (3)配位体碱性越强,配合物越稳定。
B.[Cr(H2O)5Cl]Cl2·H2O C.[Cr(H2O)4Cl2]Cl·2H2O D.[Cr(H2O)3Cl3]·3H2O
答案:B
思考题:
写出[Ag(NH3)2]OH的中心离子、配位原 子、配位数并写出它电离的离子方程式。
中心离子:Ag+ 配位原子:NH3分子中的N原子 配位数:2 [Ag(NH3)2]OH=[Ag(NH3)2]++OH-
此配合物中Co的化合价为__+__3__。
苏教版高中化学选修三课件专题四《第二单元人类对配合物结构的认识》课件2(17张)

例如: [Cu(NH3)4]SO4、Fe(SCN)3、Na3[AlF6]、 [Ag(NH3)2]OH等
2019/2/7
问题解决
请根据[Cu(NH3)4]2+的形成原理,总结 配合物的形成条件。
2.配合物形成的条件:
(1)中心原子(或离子)必须存在空轨道。 (2)配位体具有孤电子对。
2019/2/7
2019/2/7
2、外界:SO42 除内界以外的部分,一般是简单
离子。 有的配合物只有内界没有外界, 如:Fe(C0)5
2019/2/7
(1)配合物整体(包括内界和外界)应显电中性; (2)一个中心原子(离子)可同时结合多种配位体。 如:Pt(NH3)2Cl2 (3)对于具有内外界的配合物,中心原子和配位 体通过配位键结合,一般很难电离;内外界之间 以离子键结合,在水溶液中较易电离。
书写[Cu(NH3)4]SO4的电离方程式
(4)配位键的存在是配合物与其它物质最本质 的区别
2019/2/7
小结: 1.配合物的概念 2.配合物的形成条件 3.配合物的组成
[Cu(NH3)4]SO4
中心离子 配位体
配位数 外界离子
内界 配合物
外界
2019/2/7
分析下列配合物
配合物
[Ag(NH3)2]OH K4[Fe(CN)6] Na3[AlF6]
人类对配合物结构的认识
2019/2/7
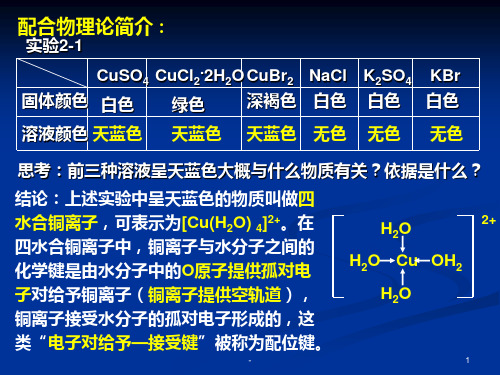
实验1
向试管中加入2ml5%的CuSO4溶液,再逐滴加入 浓氨水,边滴加边振荡,观察实验现象。
实验2
取2ml5%的CuCl2溶液进行如上实验,观察现象并 分析原理。
2019/2/7
1.NH4+的形成过程: NH4+的结构式: 2.孤电子对: 3.配位键:
2019/2/7
问题解决
请根据[Cu(NH3)4]2+的形成原理,总结 配合物的形成条件。
2.配合物形成的条件:
(1)中心原子(或离子)必须存在空轨道。 (2)配位体具有孤电子对。
2019/2/7
2019/2/7
2、外界:SO42 除内界以外的部分,一般是简单
离子。 有的配合物只有内界没有外界, 如:Fe(C0)5
2019/2/7
(1)配合物整体(包括内界和外界)应显电中性; (2)一个中心原子(离子)可同时结合多种配位体。 如:Pt(NH3)2Cl2 (3)对于具有内外界的配合物,中心原子和配位 体通过配位键结合,一般很难电离;内外界之间 以离子键结合,在水溶液中较易电离。
书写[Cu(NH3)4]SO4的电离方程式
(4)配位键的存在是配合物与其它物质最本质 的区别
2019/2/7
小结: 1.配合物的概念 2.配合物的形成条件 3.配合物的组成
[Cu(NH3)4]SO4
中心离子 配位体
配位数 外界离子
内界 配合物
外界
2019/2/7
分析下列配合物
配合物
[Ag(NH3)2]OH K4[Fe(CN)6] Na3[AlF6]
人类对配合物结构的认识
2019/2/7
实验1
向试管中加入2ml5%的CuSO4溶液,再逐滴加入 浓氨水,边滴加边振荡,观察实验现象。
实验2
取2ml5%的CuCl2溶液进行如上实验,观察现象并 分析原理。
2019/2/7
1.NH4+的形成过程: NH4+的结构式: 2.孤电子对: 3.配位键:
高中化学苏教版选修3课件:4.2 配合物的形成和应用

配合物 A B 颜色 棕黄色 淡黄色 极性 极性 非极性 在水中的溶 解性(100 g 水中) 0.257 7 g 0.036 6 g 抗癌活性 有活性 无活性
第二单元
目标导航
配合物的形成和应用
课前预习导学
KEQIAN YUXI DAOXUE
课堂合作探究
KETANG HEZUO TANJIU
预习引导
2.配合物的构型 (1)配合物的空间构型: 配合物的中心原子、配位体的种类和数目的不同可以形成不同空 间构型的配合物。如下表:
形成体(中 心离子) 配位数 配位体 形成的 配离子 配离子的 空间构型 Ag+ 2 NH3 [Ag(NH3)2]+ 直线形 Zn2+ 4 NH3 [Zn(NH3)4]2+ 正四面体 Ni2+ 4 CN[Ni(CN)4]2正方形 Al3+ 6 F[AlF6]3正八面体
第二单元
目标导航
配合物的形成和应用
课前预习导学
KEQIAN YUXI DAOXUE
课堂合作探究
KETANG HEZUO TANJIU
预习引导
(2)配合物的同分异构现象: Ⅰ.配位异构:配位体与中心原子配位引起的异构,如 [CrCl(H2O)5]Cl2· H2O 与[CrCl2(H2 O)4]Cl· 2H2O,[CoSO4(NH3)5]Br 与[CoBr (NH3 )5] SO4 等。 Ⅱ.空间异构:配位体相同,内界、外界相同,仅是配位体在中心原子 周围分布不同的一些配合物。如下表:顺式、反式 Pt(NH3)2Cl2 的性质。
第二单元
目标导航
配合物的形成和应用
课前预习导学
KEQIAN YUXI DAOXUE
课堂合作探究
第二单元
目标导航
配合物的形成和应用
课前预习导学
KEQIAN YUXI DAOXUE
课堂合作探究
KETANG HEZUO TANJIU
预习引导
2.配合物的构型 (1)配合物的空间构型: 配合物的中心原子、配位体的种类和数目的不同可以形成不同空 间构型的配合物。如下表:
形成体(中 心离子) 配位数 配位体 形成的 配离子 配离子的 空间构型 Ag+ 2 NH3 [Ag(NH3)2]+ 直线形 Zn2+ 4 NH3 [Zn(NH3)4]2+ 正四面体 Ni2+ 4 CN[Ni(CN)4]2正方形 Al3+ 6 F[AlF6]3正八面体
第二单元
目标导航
配合物的形成和应用
课前预习导学
KEQIAN YUXI DAOXUE
课堂合作探究
KETANG HEZUO TANJIU
预习引导
(2)配合物的同分异构现象: Ⅰ.配位异构:配位体与中心原子配位引起的异构,如 [CrCl(H2O)5]Cl2· H2O 与[CrCl2(H2 O)4]Cl· 2H2O,[CoSO4(NH3)5]Br 与[CoBr (NH3 )5] SO4 等。 Ⅱ.空间异构:配位体相同,内界、外界相同,仅是配位体在中心原子 周围分布不同的一些配合物。如下表:顺式、反式 Pt(NH3)2Cl2 的性质。
第二单元
目标导航
配合物的形成和应用
课前预习导学
KEQIAN YUXI DAOXUE
课堂合作探究
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[Co(NH3)5Cl]Cl2
答案:B
思考题:
向CoCl2溶液中滴加氨水,使生成的Co(OH)2沉 淀溶解生成[Co(NH3)6]2+。此时向溶液中通入空气, 得到的产物中有一种其组成可用CoCl3· 5NH3表示。 把分离出的CoCl3· 5NH3溶于水后立即加硝酸银溶 液,则析出AgCl沉淀。经测定,每1mol CoCl3· 5NH3只生成2mol AgCl。请写出表示此配合 物结构的化学式(钴的配位数为6):___________, 此配合物中Co的化合价)2]OH的中心离子、配位原 子、配位数并写出它电离的离子方程式。 中心离子:Ag+
配位原子:NH3分子中的N原子
配位数:2 [Ag(NH3)2]OH=[Ag(NH3)2]++OH-
配合物的稳定性
配合物具有一定的稳定性,配合物中 的配位键越强,配合物越稳定。 当作为中心原子的金属离子相同时, 配合物的稳定性与配体的性质有关。
同分异构体
什么叫同分异构体? 配合物是否存在同分异构体? 配合物的同分异构体的性质是否有 区别?
思考题:
0.01mol氯化铬(CrCl3· 6H2O)在水溶液中 用过量硝酸银溶液处理,产生0.02mol AgCl 沉淀。此氯化铬最可能是 答案: B A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2· H2O C.[Cr(H2O)4Cl2]Cl· 2H2O D.[Cr(H2O)3Cl3]· 3H2O
配合物的稳定性
(1)中心离子的影响 简单阳离子,半径越小稳定性越强。 (2)配位原子电负性的影响 配位原子的电负性越大,配合物越稳定; 配位原子电负性越小,配合物越不稳定。 (3)配位体碱性越强,配合物越稳定。
配合物的稳定性
下列各配合物的稳定性,判断不正 确的是 A、[Fe(CN)6]3->[Fe(SCN)6]3- B、[Co(NH3)6]2+>[Co(NH3)6]3+ C、[AlF6]3->[AlBr6]3- D、[Cu(NH3)4]2+>[Zn(NH3)4]2+ (Cu2+的半径小于Zn2+的半径)
