植物总RNA提取
植物总rna的提取 思政

植物总rna的提取思政
植物总 RNA 的提取是植物分子生物学研究中的重要环节,它涉及到植物基因表达、转录组学等方面的研究。
在这个过程中,我们可以从以下几个方面融入思政元素:
1. 科学精神与职业道德:在进行植物总 RNA 提取实验时,需要遵循科学的方法和规范,严谨认真地操作。
这培养了学生的科学精神,让他们了解到科学研究需要耐心、细心和实事求是的态度。
同时,也教育学生在实验中要遵循职业道德,尊重实验结果,不篡改数据,培养学生诚实守信的良好品质。
2. 环境保护与可持续发展:在植物总 RNA 提取过程中,可以向学生强调保护环境和可持续发展的重要性。
例如,选择合适的植物材料,避免过度采集导致植物物种的减少。
还可以教育学生在实验结束后正确处理废液和废弃物,减少对环境的污染。
3. 团队合作与责任担当:植物总 RNA 提取通常需要多人合作完成,这培养了学生的团队合作精神。
在实验过程中,每个成员都要承担起自己的责任,认真完成分配的任务,共同努力以确保实验的顺利进行。
4. 创新意识与科学探索:在植物总 RNA 提取实验中,鼓励学生尝试新的方法和技术,培养他们的创新意识。
同时,引导学生对实验结果进行分析和讨论,激发他们的科学探索精神。
通过将思政元素融入植物总 RNA 提取实验教学中,不仅可以提高学生的实验技能,还能培养他们的综合素质,使他们成为具有社会责任感、创新精神和团队合作能力的人才。
RNA试剂盒提取步骤

常规植物样品总RNA小量抽提1. 植物样品的研磨。
�收集植物样品并尽快浸泡到液氮中以防止RNA 的降解。
使用研钵、研磨棒和液氮将植物样品研磨成尽量细小的粉末。
RNA 的产量取决于样品类型和研磨效果。
注:研磨后的植物粉末可直接保持于-70°C。
�快速称取50-100mg 的研磨好的植物样品至1.5ml 预冷的离心管中。
注:在加入裂解液之前,不要让样品解冻。
初次使用时,推荐先使用50mg,待取得理想结果后,再酌情提高用量。
2. 立即加入500µlBuffer RL/β-ME混合液至样品中。
立即于最高速度涡旋30-60 秒充分打散样品,室温静置3-5 分钟让样品充分裂解。
注:使用前分装适量的Buffer RL,每1ml Buffer RL 加入20µl β-疏基乙醇(β-ME)或2M DTT。
若植物用量增加超过100mg,按比例增加Buffer RL/2-ME 的用量。
3. 室温下,14,000 x g 离心5 分钟。
4. 把gDNA 过滤柱装在2ml 收集管中。
把第三步的上清液转移至gDNA过滤柱中。
14,000 x g 离心1 分钟。
5. 弃去gDNA 过滤柱。
加入0.5倍体积无水乙醇(~250µl)至滤液中。
用移液枪吸打3-5次混匀。
6. 把HiPure RNA Mini Column 装在2ml 收集管中。
转移第5 步的混合液至RNA柱子中。
10,000 x g 离心30-60 秒。
7. (可选)这一步可插入DNase 进行膜上消化。
(请另外订购DNase On Column Kit 进化膜上DNase 消化)。
8. 倒弃滤液,把柱子装在收集管中。
加入500µl Buffer RW1 至柱子中。
10,000 x g离心30-60 秒。
9. 倒弃滤液,把柱子装回收集管中。
加入600µl Buffer RW2 (已用乙醇稀释)至柱子中。
10,000 ×g 离心30-60 秒。
植物RNA提取方法

RNA提取方法1、在超净工作台中取500uL裂解液RLT加入到1.5mL的离心管中,加入5uL β-巯基乙醇,60uL PLANTaid混匀备用;2、在95%乙醇擦过的桌面上用液氮研磨适量植物组织,取50mg 细粉转入上述装有RLT和PLANTaid的离心管中,立即剧烈震荡2-3min充分裂解,将裂解物13000rpm常温离心10min。
3、在新的离心管中加入新开封的无水乙醇250uL,按1:2的比例加入上清液500uL,用移液枪慢慢混匀,13000rpm常温离心60s。
4、每个吸附柱RA中加入750~800uL的上清液,静置后13000 rpm 常温离心1min,弃废液。
可以2管或3管合并到一个吸附柱RA 中。
5、向吸附柱RA中加入350~400uL的去蛋白液RWL,放置5min,12000 rpm常温离心30~60s,弃废液,将吸附柱放回到收集管中。
6、向吸附柱RA膜中央加入50uL DNase I工作液(DNase I 5uL,buffer5uL,无RNase 水40uL),37℃烘箱放置30min。
7、向吸附柱RA中加入350~400uL的去蛋白液RWL,放置5min,12000 rpm常温离心30~60s,弃废液,将吸附柱放回到收集管中。
该步骤可再重复一次。
8、加入漂洗液RW(请先检查是否已加入污水乙醇)500uL,静置后12000 rpm常温离心30s,弃掉废液;加入500uL漂洗液RW,重复一次。
9、将吸附柱RA放回空收集管中,12000 rpm常温离心30s,尽量除去漂洗液,以免漂洗液中残留的乙醇抑制下游反应。
10、取出吸附柱RA,放入一个新的RNase free离心管中,加入25uL 灭菌后的RNase free water(事先在80℃水浴中加热),室温放置2min,12000 rpm常温离心1min;将试管中的溶液吸出后再次加到吸附柱中,室温放置2min,12000 rpm常温离心1min。
提植物总RNA及去DNA和反转录标准方法(会给实验室一大笔提取试剂盒的经费)

Trizol法提取植物总的RNA及反转录可用于RT-PCR【中文版】一、植物总RNA 的提取抽提RNA 所用的研钵酒精灼烧5-10min或灭菌.,器皿均高温高压灭菌,以去除RNA 酶,所有试剂都保证没有RNA 酶污染。
1) 1.5ml 离心管,取0.1g 组织在液氮中研磨至粉末, 立即加入1ml Trizol,涡旋充分混匀后放置2min。
2) 加0.2体积(氯仿Chloroform),剧烈振荡15s(vortex),室温放置3min(或不放置,直接离心)。
3) 4℃,12000rpm 离心5min,样品会分成3 层,取上层水相,取上清。
4) 加等体积的异丙醇,混匀,4℃放置10min以上。
或可以-80℃过夜。
5) 4℃,12000rpm 离心20min,4℃弃上清,管底管侧形成胶状沉淀(可看到白色沉淀)。
6) 加1ml 75%乙醇,充分溶解沉淀。
4℃,12000rpm 离心5min。
倒掉上清,用移液器吸干。
7) 晾干约10 min。
(不要晾太长时间,看不到水就可以加灭菌水)8) 加50μl灭菌的超纯水,65℃溶解,-20℃(最好-80℃)保存。
(注:要是处理DNase就不能加这么多水。
可以加5μl)整个提取步骤最好咋在4℃或冰上完成二、DNase I 处理消化植物总RNA 中的基因组DNA1) 将上述全部提取的植物总RNA 5μl,然后顺序加入1μl 10×缓冲液,1μl DNase,3μl RNase-free水,总体积10μl,充分混匀后,37℃温育30 min。
2)加入300ul 灭菌水提高体积,然后加入300ul PCI,vortex;4℃,12000rpm 离心5min;3) 加入1/10 体积3M 醋酸钠(autoclaved) pH 5.2, 和2倍体积的100% EtOH;(-20℃,10-30min或可以-80℃过夜)4) 4℃,12000rpm 离心15min,6)75% EtOH, 300ul, 12000 rpm 5min7) dry (10-15min)and add 30-50 ul of ddH2O三、反转录cDNA1) 在上述总体积为11μl 反应液中加入1μl Oligo(dT)18 引物4μl 5×缓冲液,2 μl dNTP,1μl 反转录酶,1μl RNase 抑制剂,总体积20μl,充分混匀后,42℃温育1-1.5hr。
植物总RNA的提取(异硫氰酸胍法)

植物总RNA的提取(异硫氰酸胍法)
1.取1.2g绿叶,液N中研磨成冻粉,装入预冷的50ml离心管中,置冰上,加4ml 4M的异硫氰酸胍,混匀后加3ml Tris饱和酚,混匀后加0.3ml 2M的NaAc(pH4.8),0.6ml 三氯甲烷(CHCl3),混匀后振荡,置冰上30min。
2.取出离心管,于4℃ 8000rpm离心13min,上清液移于另一50ml离心管中,加2倍体积的无水乙醇混匀,4℃放置1h。
3.取出离心管,再于4℃ 8000rpm离心13min,沉淀用1ml 4M LiCl溶解(可用枪头慢慢吸和冲),转入1.5ml离心管,置冰上2h(或过夜)。
4.取出离心管,于4℃ 13000rpm离心15min,沉淀加400μl 0.1%DEPC水溶解(可用枪头慢慢吸和冲),再加400μl CHCl3充分混匀约10min。
5.4℃ 13000rpm离心6min,吸出上清约350μl于另一1.5ml离心管中,加1/10体积的3M NaAc (pH5.0—5.2),加2倍体积的无水乙醇,-20℃放置30min(或1—2h)。
6.4℃ 13000rpm离心13min,沉淀用70%的乙醇洗两次(可不离心),风干后,用100μl 0.1%DEPC 水溶解。
7.取3μl电泳检测,取3.5μl稀释至350μl测定RNA浓度,剩余RNA于-20℃保存备用。
动植物总RNA提取-Trizol法

动植物总RNA提取-Trizol法Trizol法适用于人类、动物、植物、微生物的组织或培养细菌,样品量从几十毫克至几克。
用Trizol 法提取的总RNA绝无蛋白和DNA污染。
RNA可直接用于Northern斑点分析,斑点杂交,Poly(A)+分离,体外翻译,RNase封阻分析和分子克隆。
1、将组织在液N中磨成粉末后,再以50-100mg组织加入1ml Trizol液研磨,注意样品总体积不能超过所用Trizol体积的10%。
2、研磨液室温放置5分钟,然后以每1mlTrizol液加入0.2ml的比例加入氯仿,盖紧离心管,用手剧烈摇荡离心管15秒。
3、取上层水相于一新的离心管,按每mlTrizol液加0.5ml异丙醇的比例加入异丙醇,室温放置10分钟,12000g离心10分钟。
4、弃去上清液,按每ml Trizol液加入至少1ml的比例加入75%乙醇,涡旋混匀,4℃下7500g离心5分钟。
5、小心弃去上清液,然后室温或真空干燥5-10分钟,注意不要干燥过分,否则会降低RNA的溶解度。
然后将RNA溶于水中,必要时可55℃-60℃水溶10分钟。
RNA可进行mRNA分离,或贮存于70%乙醇并保存于-70℃。
[注意] 1、整个操作要带口罩及一次性手套,并尽可能在低温下操作。
2、加氯仿前的匀浆液可在-70℃保存一个月以上,RNA沉淀在70%乙醇中可在4℃保存一周,-20℃保存一年。
Trizol 是一种新型总RNA 抽提试剂,内含异硫氰酸胍等物质,能迅速破碎细胞,抑制细胞释放出的核酸酶。
TRIzol的主要成分是酚。
主要作用是裂解细胞,使细胞中的蛋白,核酸物质解聚得到释放。
酚虽可有效的变性蛋白质,但是它不能完全抑制RNA酶活性,因此TRIzol中还加入了8-羟基喹啉、异硫氰酸胍、β-巯基乙醇等来抑制内源和外源RNase。
x0.1%的8-羟基喹啉的,与氯仿联合使用可增强对RNase的抑制x异硫氰酸胍属于解偶剂,是一类强力的蛋白质变性剂,可溶解蛋白质,并使蛋白质二级结构消失,细胞结构降解,核蛋白迅速与核酸分离。
总RNA提取

总RNA的提取(Trizol法提取)在收集到生物材料之后,最好能即刻进行RNA制备工作。
若需暂时储存,则应以液氮将生物材料急速冷冻后,储存于-80℃冷冻柜。
在制备RNA时,将储存于冷冻柜的材料取出,立即以加入液氮研磨的方式打破细胞,不可以先行解冻,以避免RNase的作用。
1.提取组织RNA时,每50~100mg组织用1ml Trizol试剂对组织进行裂解;提取细胞RNA时,先离心沉淀细胞,每5-10 ╳106个细胞加1ml Trizol后,反复用枪吹打或剧烈振荡以裂解细胞;2.将上述组织或细胞的Trizol裂解液转入EP管中,在室温15~30C下放臵5分钟;3.在上述EP管中,按照每1ml TRIZOL加0.2ml氯仿的量加入氯仿,盖上EP管盖子,在手中用力震荡15秒,在室温下(15℃~30℃)放臵2~3分钟后,12000g(2℃~8℃)离心15分钟;4.取上层水相臵于新EP管中,按照每1ml TRIZOL加0.5ml异丙醇的量加入异丙醇,在室温下(15℃~30℃)放臵10分钟,12000g(2℃~8℃)离心10分钟;5.弃上清,按照每1ml TRIZOL加1ml 75%乙醇进行洗涤,涡旋混合,7500g(2℃~8℃)离心5分钟,弃上清;6.让沉淀的RNA在室温下自然干燥;7.用Rnase-free water 溶解RNA沉淀。
8.TRIZOL百科名片TRIzol是一种新型总RNA抽提试剂,可以直接从细胞或组织中提取总RNA。
其含有苯酚、异硫氰酸胍等物质,能迅速破碎细胞并抑制细胞释放出的核酸酶。
TRIzol 在破碎和溶解细胞时能保持RNA的完整性,因此对纯化DNA及标准化RNA的生产十分有用。
主要成分TRIzol的主要成分是苯酚。
苯酚的主要作用是裂解细胞,使细胞中的蛋白,核酸物质解聚得到释放。
苯酚虽可有效地变性蛋白质,但不能完全抑制RNA酶活性,因此TRIzol中还加入了8-羟基喹啉、异硫氰酸胍、β-巯基乙醇等来抑制内源和外源RNase(RNA酶)。
提取植物rna的步骤及原理

提取植物rna的步骤及原理嘿,咱今儿就来讲讲提取植物 RNA 的那些事儿!这可是个有趣又神奇的过程哦。
你想想看,小小的植物细胞里,居然藏着 RNA 这么重要的东西。
那要怎么把它给弄出来呢?首先啊,得把植物材料准备好,就像要做菜得先准备好食材一样。
然后呢,就得用一些特别的试剂啦,就像厨师的调料一样,能让 RNA 乖乖地现身。
第一步呢,就是把植物细胞给破碎掉,让里面的东西都跑出来。
这就好比拆礼物,得把包装纸撕开,才能看到里面的宝贝嘛。
破碎细胞的方法有很多种,可以用一些专门的仪器,或者用一些化学试剂,就像用锤子砸开或者用剪刀剪开一样。
接下来,就该把 RNA 和其他的杂质分离开啦。
这可不容易哦,就好像在一堆沙子里找金子一样。
但是咱有办法呀,通过一些特殊的步骤和试剂,就能让 RNA 脱颖而出。
这其中的原理呢,其实也不难理解。
RNA 有它自己的特点呀,咱就利用这些特点来抓住它。
就像你知道一个人的喜好,就能根据这个来找到他一样。
比如说,有些试剂能和 RNA 结合,而不和其他东西结合,这样不就把 RNA 给挑出来了嘛。
然后呢,把分离出来的 RNA 洗一洗,就像洗干净刚挖出来的土豆一样,让它干干净净的。
再之后,就是把 RNA 给浓缩一下啦。
这就好比把一大锅汤熬成一小碗精华,让 RNA 变得更纯更浓。
最后,你就得到了纯净的植物 RNA 啦!哇塞,是不是很神奇?这就像是从一个大宝藏里找到了最珍贵的宝贝一样。
提取植物 RNA 的过程虽然有点复杂,但是只要你一步一步来,认真细心,就一定能成功。
就像搭积木一样,一块一块地往上搭,最后就能搭出漂亮的城堡。
而且呀,当你成功提取出 RNA 的时候,那种成就感,简直没法形容!就好像你自己做出了一道超级美味的大餐一样。
所以啊,别害怕,大胆去尝试提取植物 RNA 吧!说不定你会发现更多有趣的事情呢!反正我觉得这是个超级有意思的事儿,你也一定会喜欢的啦!。
Trizol法提取动植物细胞组织总RNA
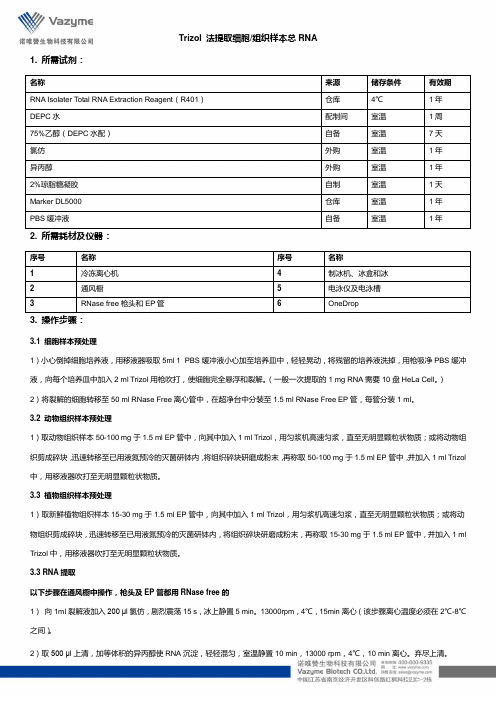
Trizol 法提取细胞/组织样本总RNA1. 所需试剂:名称来源储存条件有效期RNA Isolater Total RNA Extraction Reagent(R401)仓库4℃1年DEPC水配制间室温1周75%乙醇(DEPC水配)自备室温7天氯仿外购室温1年异丙醇外购室温1年2%琼脂糖凝胶自制室温1天Marker DL5000 仓库室温1年PBS缓冲液自备室温1年2. 所需耗材及仪器:序号名称序号名称1 冷冻离心机 4 制冰机、冰盒和冰2 通风橱 5 电泳仪及电泳槽3 RNase free枪头和EP管 6 OneDrop3. 操作步骤:3.1 细胞样本预处理1)小心倒掉细胞培养液,用移液器吸取5ml 1×PBS缓冲液小心加至培养皿中,轻轻晃动,将残留的培养液洗掉,用枪吸净PBS缓冲液,向每个培养皿中加入2 ml Trizol用枪吹打,使细胞完全悬浮和裂解。
(一般一次提取的1 mg RNA需要10盘HeLa Cell。
)2)将裂解的细胞转移至50 ml RNase Free离心管中,在超净台中分装至1.5 ml RNase Free EP管,每管分装1 ml。
3.2 动物组织样本预处理1)取动物组织样本50-100 mg于1.5 ml EP管中,向其中加入1 ml Trizol,用匀浆机高速匀浆,直至无明显颗粒状物质;或将动物组织剪成碎块,迅速转移至已用液氮预冷的灭菌研钵内,将组织碎块研磨成粉末,再称取50-100 mg于1.5 ml EP管中,并加入1 ml Trizol 中,用移液器吹打至无明显颗粒状物质。
3.3 植物组织样本预处理1)取新鲜植物组织样本15-30 mg于1.5 ml EP管中,向其中加入1 ml Trizol,用匀浆机高速匀浆,直至无明显颗粒状物质;或将动物组织剪成碎块,迅速转移至已用液氮预冷的灭菌研钵内,将组织碎块研磨成粉末,再称取15-30 mg于1.5 ml EP管中,并加入1 ml Trizol中,用移液器吹打至无明显颗粒状物质。
植物总RNA提取

植物总RNA提取1、于-80℃(或采的新鲜叶片)取出样品于一次性手,放入液氮中,在消毒过的研钵中快速研磨至细粉,分别取.01g左右于1.5mL无RNAse离心管中,并立即加入1mL Trizol,充分混合(震荡机震荡混匀),室温放置5min;2、加入200μL 氯仿,充分(剧烈)震荡混匀,4℃静置15min,于4℃离心机12000g离心15min;3、取出离心管,吸取上清液于新的1.5mL无RNAse离心管中(用中枪头靠近管壁吸取3次,约600μL),加入等体积预冷好的异丙醇,反复颠倒(轻柔地),4℃放置12分钟(可适当静置久一点,也可放置于-20℃,低温及多点时间静止有助于RNA的析出,建议-20℃放置30min以上)后,于4℃离心机12000g 离心10min;4、取出离心管,弃去上清液,加入1mL 预冷的75%乙醇溶液(RNA专用,采用进口无RNAse 50mL离心管,加入37.5mL无水乙醇,懂DEPC处理水定容至50mL),反复颠倒使RNA沉淀悬起(切记不可震荡),室温静置1~2min,于4℃离心机12000g(1000g)离心5min;5、重复步骤4;6、取出离心管,弃去上清液,加入1mL 预冷的无水乙醇,反复颠倒使RNA沉淀悬起(切记不可震荡),室温静置1~2min,于4℃离心机12000g(1000g)离心5min;7、取出离心管,弃去上清液,倒扣于干净的滤纸上,是RNA干燥;8、加入50-100μL DEPC处理水溶解RNA,用枪吸打混匀;9、测RNA浓度及吸光值比(260/280);10、电泳检测是否降解;11、-20℃或-80℃保存。
260/280RNA的260/280应在1.9-2.1之间,则纯度较好,若低于1.8表示蛋白杂质较多,高于2.2则表示RNA降解。
电泳甘蔗总RNA电泳应有三条条带,分别为28S, 18S, 5S 。
总RNA提取实验原理

总RNA提取实验原理、步骤和问题解答Trizol 试剂是直接从细胞或组织中提取总RNA的试剂。
它在破碎和溶解细胞时能保持RNA的完整性,裂解细胞并释放出RNA,酸性条件使RNA与DNA分离, 加入氯仿后离心,样品分成水样层和有机层。
RNA存在于水样层中。
收集上面的的水样层后,RNA可以通过异丙醇沉淀来还原。
在除去水样层后,样品中的DNA和蛋白也能相继以沉淀的方式还原。
乙醇沉淀能析出中间层的DNA,在有机层中加入异丙醇能沉淀出蛋白。
共纯化DNA对于样品间标准化RNA的产量十分有用。
无论是人、动物、植物还是细菌组织,各种样品最大使用量( 1ml Trizol ),动物组织( 50mg) ,植物组织(100 mg) ,丝状真菌( 100mg) ,动物细胞(5 ×106~1×107) ,酵母(1 ×107) 。
TRIZOL试剂能促进不同种属不同分子量大小的多种RNA的析出。
例如,从大鼠肝脏抽提的RNA琼脂糖凝胶电泳并用溴化乙啶染色,可见许多介于7 kb 和15 kb 之间不连续的高分子量条带, ( mRNA和hnRNA成分) 两条优势核糖体RNA条带位于~5 kb (28S) 和~2 kb (18S) ,低分子量RNA介于0.1 和0.3 kb 之间(tRNA, 5S) 。
当抽提的RNA用TE稀释时其A260/A280比值≥1.8 。
[ 实验用品]【实验耗材】1、移液枪:1ml、200μl 、20μl 、10μl 、2μl 。
酒精擦拭,头部重点,紫外线照射。
2、吸头:1ml、200μl 、20μl3、匀浆管:5ml4、吸头台:放置1ml 吸头的一个,放置20μl 吸头的一个5、EP管:1.5ml 、0.2ml 、100μl6、试剂瓶:2个60ml 的棕色广口试剂瓶。
青霉素小瓶(分装无水乙醇,高压的DEPC水,-20°C保存)。
7、量筒:50ml、250ml、500ml8、容量250ml、500ml、1000ml9、试管架:5ml、1.5ml 、20μl10、盐水瓶:250ml、500ml 各2个备用,一个装无水乙醇,另一个装DEPC水11、铝制饭盒:4个12、塑料小饭盒:1个13、大瓷缸:2个14、锡泊纸:一卷15、卷纸:2 卷16、三角烧瓶:带盖,稍大(融琼脂糖)【实验仪器】天平、振荡器、高速离心机、0.5 ~10ul 、20~200ul 、100~1000ul 加样器。
植物总RNA的提取和电泳

⑨ 加入500μl RPE到离心柱内,最大转速 离心2min,干燥离心柱,弃去搜集管;
植物细胞内旳RNA主要是 rRNA(占80~85 %)、tRNA及小分子RNA(占10~15%)和 mRNA(占1~5%)。rRNA含量最丰富,由 25S、18S和5S几类构成。mRNA种类繁多,分
子量从数百至数千碱基不等,但绝大多数 mRNA在3’端都有一种polyA尾巴,所以,可 根据此特征用寡聚脱氧胸苷(OligodT)层析柱 从总RNA中将 mRNA分离出来。一般情况下, 提取旳总RNA也可用于Northern blot试验。
⑩ ⑩把离心柱接在一种新旳1.5 ml Eppen 管上,加入30~50μl 无RNase水 (0.1%DEPC处理),10000 rpm离心 1min,洗出RNA。若RNA产量在20μg 以上,用30~50 μl无RNase水再洗脱1 次。RNA样品保存于-20℃备用。
琼脂糖凝胶非变性电泳
所需试剂: 10ⅹ凝胶缓冲液
2. 样品制备:在离心管里,将RNA样品与 10×样品缓冲液以9:1百分比混合。65oC 温浴5-10分钟, 迅速在冰上冷浴5分钟 , 瞬时离心数秒。对于Northern杂交试 验,总RNA上样量可到达10-30g。
3. 上样前凝胶须预电泳5min,随即将样品加 入上样孔。以5V/cm旳电压电泳1.5h-2.0h。
3. 试验材料与试剂
材料: 新鲜植物组织 (水稻) 试剂:Qiagen RNeasy植物试剂盒, 甲醛,琼脂糖电泳系统 ,凝胶成象系 统等。
植物DNA和RNA提取方法

实验一植物基因组D N A的提取一、实验目的掌握植物总DNA的抽提方法和基本原理。
学习根据不同的植物和实验要求设计和改良植物总DNA抽提方法。
二、实验原理通常采用机械研磨的方法破碎植物的组织和细胞,由于植物细胞匀浆含有多种酶类(尤其是氧化酶类)对DNA的抽提产生不利的影响,在抽提缓冲液中需加入抗氧化剂或强还原剂(如巯基乙醇)以降低这些酶类的活性。
在液氮中研磨,材料易于破碎,并减少研磨过程中各种酶类的作用。
十二烷基肌酸钠(sarkosyl)、十六烷基三甲基溴化铵(hexadyltrimethyl ammomum bromide,简称为CTAB)、十二烷基硫酸钠(sodium dodecyl sulfate,简称SDS)等离子型表面活性剂,能溶解细胞膜和核膜蛋白,使核蛋白解聚,从而使DNA得以游离出来。
再加入苯酚和氯仿等有机溶剂,能使蛋白质变性,并使抽提液分相,因核酸(DNA、RNA)水溶性很强,经离心后即可从抽提液中除去细胞碎片和大部分蛋白质。
上清液中加入无水乙醇使DNA沉淀,沉淀DNA溶于TE溶液中,即得植物总DNA溶液。
三、实验材料水稻幼叶四、主要试剂配方2% CTAB抽提缓冲溶液: CTAB 4g NaCl 16.364 g 1M Tris-HCl 20ml( PH8.0) 0.5M EDTA 8ml,先用70ml ddH2O溶解, 再定容至200ml灭菌, 冷却后0.2-1% 2-巯基乙醇(400ul)氯仿-异戊醇(24:1):先加96ml氯仿,再加4ml异戊醇,摇匀即可。
五、实验步骤1. DNA的提取(1)2%CTAB抽提缓冲液在65℃水浴中预热。
(2)取少量叶片(约1g)置于研钵中,用液氮磨至粉状;(3)加入700ul的2%CTAB抽提缓冲液,轻轻搅动;(4)将磨碎液分倒入1.5 ml的灭菌离心管中,磨碎液的高度约占管的三分之二;(5)置于65℃的水浴槽或恒温箱中,每隔10 min轻轻摇动,40 min后取出;(6)冷却2 min后,加入氯仿-异戊醇(24:1)至满管,剧烈振荡2~3 min,使两者混合均匀;(7)放入离心机中10 000 rpm离心10 min,与此同时,将600 μl的异丙醇加入另一新的灭菌离心管中;(8)10 000 rpm离心1 min后,移液器轻轻地吸取上清夜,转入含有异丙醇的离心管内,将离心管慢慢上下摇动30 sec,使异丙醇与水层充分混合至能见到DNA絮状物;(9)10000 rpm离心1 min后,立即倒掉液体,注意勿将白色DNA沉淀倒出,将离心管倒立于铺开的纸巾上;(10)60 sec后,直立离心管,加入720 μl的75%乙醇及80 μl 5 M的醋酸钠,轻轻转动,用手指弹管尖,使沉淀与管底的DNA块状物浮游于液体中;(11)放置30 min,使DNA块状物的不纯物溶解;(12)10000 rpm离心1 min后,倒掉液体,再加入800 μl 75%的乙醇,将DNA再洗30 min;(13)10000 rpm离心30 sec后,立即倒掉液体,将离心管倒立于铺开的纸巾上;数分钟后,直立离心管,干燥DNA(自然风干或用风筒吹干);(14)加入50 μl 0.5 × TE(含RNase)缓冲液,使DNA溶解,置于37℃恒温箱约15 h,使RNA消解;(15)置于-20℃保存、备用。
实验八_植物总RNA的提取1

实验步骤 1
• 1 剪取植株叶片0.1克,放在液氮中磨成粉 末。将粉末转入离心管中,加1 ml Trizol 液,按住管盖用力摇动使其匀浆,室温下 放置5分钟,使其充分裂解(可放-20℃保 存几个月)
• 注意:样品总体积不能超过所用Trizol体积 的10%
实验步骤 2
• 2 加入200 l的氯仿,盖紧离心管,按住管 盖剧烈摇荡15 sec,于室温放置2-3 min • 3 于4 ℃,12000 rpm离心15 min,取上清 液于一新离心管中,加入600 l的异丙醇 (与上清等体积),颠倒数次混匀;室温放置 10 min;(若蛋白含量过高,可重复上一 步骤)
• 75%乙醇:用DEPC处理水配制75%乙醇,用高 温灭菌器皿配制,然后装入高温烘烤的玻璃瓶中, 存放于低温冰箱
10×MOPS buffer 的配制
MOPS 20.93 g 乙酸钠 3.4 g EDTA 1.86g 加DEPC水至500 ml NaOH调PH至7.0 黑暗保存
操作过程不要说话,以免降解RNA
RNA抽提准备工作——缘由
• RNA容易受RNA酶( RNase )的攻击而降解
• RNase是一类生物活性极其稳定的酶类,能耐
高温、耐酸、耐碱、高压灭菌处理也不能使其
完全失活。在提取RNA实验中,要尽量抑制 RNase的活性。
实验成败的关键 :严格防止RNA酶的污染
RNA抽提准备工作
• 所有的组织中均存在RNA酶,人的皮肤、 头发、手指、唾液、试剂、容器等均可能 污染,因此全部实验过程中均需戴手套操 作并经常更换手套; • 所用的玻璃器皿需置于干燥烘箱中200℃烘 烤2小时以上; • 凡是不能用高温烘烤的材料如塑料容器等 皆可用0.1%的焦碳酸二乙酯(DEPC)水溶液 处理,灭菌后倒掉液体、干燥待用。
植物样品总RNA的提取与纯化

植物样品总RNA的提取与纯化
将研钵放到冰上预冷,将液氮倒入研钵中,取植物样品迅速放到研钵中迅速研磨
↓
将研磨至细的植物样品粉末加入预先盛有1ml T rizol的1.5ml离心管中(装有T rizol的1.5ml 离心管放置冰上先预冷,加入的样品不能太多,一小刚勺足够,剧烈震荡,使植物样品充
分分散)
↓4℃离心,120000g,10min
取上清(约900μl),加入200μl酸酚 / 氯仿 / 异戊醇(25:24:1)剧烈震荡,混匀至油乳状,冰上放置2~3min
↓4℃离心,12000g,5min
取上清(约450μl)加入等体积的氯仿 / 异戊醇(24:1)剧烈震荡,混匀至油乳状,冰上放置2~3min
↓4℃离心,12000g,5min
取上清(约300μl)加入1/ 2体积的异丙醇,剧烈震荡,混匀至油乳状,冰上放置10min
↓4℃离心,12000g,10min
弃上清,加入1ml75%的乙醇,涡旋使RNA沉淀漂浮起来
↓4℃离心,稍离心
小心吸去上清液,再重复以上清洗步骤一次(也可只清洗一次)
↓
RNA沉淀直接放置超净工作台上干燥5min(不是太干,否则RNA很难溶解),将RNA用无RNA酶的水(DEPC处理过的)溶解。
(以上试剂均用0.1 %的DEPC 室温处理过夜 ,然后再高压灭菌;玻璃器皿于200 ℃干热灭菌 8h。
塑料制品用氯仿处理 5 min ,再高压灭菌。
)。
植物总RNA提取

1. 所有的离心步骤均在室温完成,使用转速可以达到13 000 rpm的传统台式离心机,如Eppendorf 5415C 或者类似离心机。
2. 需要自备乙醇,β-巯基乙醇,一次性注射器(可选),研钵。
3.裂解液RLT 和去蛋白液RW1中含有刺激性化合物,操作时要戴乳胶手套,避免沾染皮肤,眼睛和衣服。若沾染皮肤、眼睛时,要用大量清水或者生理盐水冲洗。
4.植物组织裂解是否充分直接影响到RNA 提取的质量和产量,本试剂盒中提供的裂解液RLT,主要成分为异硫氰酸胍,适用于大多数植物组织的裂解,但有些植物组织(例如玉米的乳白色胚乳)或丝状真菌,由于次级代谢产物较特殊,异硫氰酸胍使样品产生固化,导致RNA 无法提取,此时可以向我们索取另一种裂解液RLC,将解决该问题。
植物总R
实验方法原理
通过裂解液β-巯基乙醇迅速裂解细胞和灭活细胞RNA酶,植物RNA助提剂PLANTaid帮助结合多糖多酚并通过离心去除,然后用乙醇调节结合条件后,RNA在高离序盐状态下选择性吸附于离心柱内硅基质膜,再通过一系列快速的漂洗-离心的步骤,去蛋白液和漂洗液将细胞代谢物,蛋白等杂质去除, 最后低盐的RNase free H2O将纯净RNA从硅基质膜上洗脱。
五、加700 μl 去蛋白液RW1,室温放置30秒,12 000 rpm 离心30秒,弃掉废液。
如果DNA残留明显,可在加入RW1后室温放置5分钟后再离心。
六、加入500 ul漂洗液RW(请先检查是否已加入无水乙醇),12 000 rpm 离心30秒,弃掉废液。加入500 ul漂洗液RW,重复一遍。
浓度:取一定量的 RNA 提取物,用RNase-free 水稀释n 倍,用RNase-free水将分光光度计调零,取稀释液进行OD260,OD280 测定,按照以下公式进行RNA浓度的计算:终浓度(ng/μl)= (OD260)x(稀释倍数n)x40
植物总rna的提取实验注意事项

植物总rna的提取实验注意事项植物总RNA的提取是分子生物学研究中重要的实验步骤之一,它用于获取植物细胞中的总RNA,为后续的分析和研究提供基础。
在进行植物总RNA的提取实验时,需要注意以下几个方面。
实验前需要准备好实验所需的材料和试剂。
常用的提取试剂包括三氯醋酸(Trizol)、石蜡和醇等。
在使用这些试剂时,需要按照说明书的要求进行操作,并严格控制各种试剂的浓度和比例。
实验过程中要注意实验操作的严谨性和准确性。
在提取植物总RNA 时,需要避免污染和杂质的干扰,因此要保持实验环境的清洁和卫生。
实验中使用的试剂和器具要经过严格的消毒和清洗,以防止外源性RNA的污染。
实验过程中要注意植物样品的处理。
植物样品采集后应立即进行处理,避免长时间的保存和暴露在空气中。
处理植物样品时,需要将其迅速冷冻或浸泡在液氮中,以保持样品中RNA的完整性和稳定性。
在提取植物总RNA的过程中,应注意避免RNA的降解。
RNA易受到核酸酶的降解作用,因此在实验过程中要注意避免与核酸酶接触。
在提取RNA的过程中,应尽量快速完成,避免长时间的震荡和离心等操作,以减少RNA的降解。
实验过程中还需注意提取的RNA质量。
提取得到的RNA应经过质检,如使用琼脂糖凝胶电泳或分光光度计检测其完整性和浓度。
如果发现RNA的完整性不好或浓度过低,需要重新提取或进行适当的处理。
实验完成后,还需妥善保存提取得到的植物总RNA。
一般情况下,可以使用无核酸酶的管或离心管保存RNA样品,并储存在低温冰箱或液氮罐中。
同时,为了防止RNA的降解和污染,还应尽量避免多次冻融和长时间的保存。
进行植物总RNA的提取实验时,需要注意实验操作的准确性和严谨性,避免RNA的降解和污染。
同时,还需注意植物样品的处理和提取得到的RNA的质量,以确保实验结果的准确性和可靠性。
通过合理的实验设计和操作,可以有效地提取植物总RNA,为后续的分析和研究提供可靠的数据基础。
植物rna提取降解常见原因

植物rna提取降解常见原因植物RNA提取降解主要有以下几个常见原因:1. RNA酶的存在:植物细胞包含多种RNA酶,它们能够降解RNA分子。
一些RNA酶具有非特异性降解作用,即它们可以降解任何类型的RNA分子,而另一些RNA酶具有特异性降解作用,只能降解特定类型的RNA分子。
当进行植物RNA提取时,这些RNA酶可能会被释放到提取液中,导致RNA的降解。
2. 热稳定性差:RNA分子在高温下容易降解。
植物RNA提取时,需要在一个较高的温度下进行细胞破碎和RNA分子释放。
然而,在高温下,RNA分子很容易发生降解,特别是在没有合适的保护条件和酶抑制剂的情况下。
3. RNase的存在:不论在细胞内还是在外界环境中,RNase都普遍存在。
RNase 是一种水解RNA分子的酶类,它能够分解RNA的磷酸二酯键。
RNase可以通过指尖、皮肤、培养器皿、试剂等多种途径污染RNA样品,导致RNA的降解。
4. 样品处理不当:在植物RNA提取的过程中,样品处理可能会影响RNA的完整性。
例如,不恰当的冷冻和解冻过程、长时间的样品保存、采集后长时间的样品处理等都会对RNA的完整性造成损害。
5. 细胞壁的存在:植物细胞具有细胞壁结构,这种结构在RNA提取过程中可能成为阻碍RNA释放的障碍。
植物细胞壁由多种复杂的聚合物组成,如纤维素、半乳糖聚糖等,它们对RNA分子的释放和提取可能会造成阻碍,导致RNA的降解。
6. 氧化损伤:氧化反应是RNA降解的另一个重要原因。
在植物RNA提取过程中,氧气存在于提取试剂、空气以及植物细胞中,容易引发RNA的氧化反应,导致RNA的降解。
为了避免RNA降解,我们可以采取一些措施:1. 使用RNase-free环境:RNA提取过程中应尽量避免RNase的污染。
在操作过程中,可以使用RNase-free试剂和器皿,佩戴手套,使用RNase抑制剂等。
2. 冷藏样品:样品在采集和处理过程中应尽量避免长时间的暴露在室温下。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CTAB法提取植物总RNA
一、试剂配置
1M Tris PH=8.0(每25ml SSTE用0.25ml , 每200ml CTAB提取液用20ml):100ml中加12.114g Tris碱,加DEPC处理过的水至80ml ,用浓HCl调PH至8.0。
0.5M EDTA(每200ml CTAB中加10ml,每25ml SSTE中加0.05ml) : 50ml中加9.3g EDTA,加NaOH约1g,DEPC-H2O 40ml,调PH=8.0(不要调过),定容后加50ul DEPC-H2O。
EDTA很难溶,可稍加热。
10%SDS (每25ml SSTE加1.25ml): 50ml中加入5g SDS,用DEPC-H2O定容至50ml。
SDS很难溶,可稍加热。
4M LiCl:每200ml加33.912g无水LiCl,定容后加200ul DEPC水,灭菌。
3M NaAc:每10ml加4.0824g NaAc粉末。
CTAB提取液:2% CTAB(W/V),2% PVP(W/V),25 mM EDTA,100 mM Tris-Cl pH 8.0,2.0 M NaCl,0.5 g/l Spermidine(亚精胺),灭菌后加入2%(V/V)ß-巯基乙醇。
SSTE buffer:1.0 M NaCl,0.5%SDS,10 mMTris-Cl pH 8.0,1 mM EDTA。
氯仿/异戊醇(24:1,v/v): 将氯仿和异戊醇按体积24:1的比例混匀,置棕色瓶中,4℃保存。
酚:氯仿:异戊醇(25:24:1) : 按饱和酚、氯仿、异戊醇体积比为25:24:1比例混匀,置棕色瓶中,4℃保存。
二、操作步骤
Day 1
(1)65°C水浴中预热15 mL CTAB提取液(加入300μL ß-巯基乙醇)。
(2)液氮中研磨2~3 g新鲜或-70°C冷冻的材料。
(3)转移样品至有CTAB提取液的离心管中,立即激烈涡旋30s-60s,短时放回65°C水浴中(4~5 min)。
(4)加入等体积的氯仿/异戊醇(24:1)并涡旋混合,10000 rpm常温离心15 min。
沉淀蛋白质
(5)将上清转移至一新离心管,重复抽提一次。
沉淀蛋白质
(6)将上清转移至一新离心管中,加入等体积的4M LiCl, 使LiCl的终浓度为2 M,4°C下沉淀过夜(<16h)。
RNA变性
Day 2
(7)4°C,15000 rpm离心1 h沉淀RNA,弃上清去除DNA,用500μL70%乙醇洗沉淀去除杂质,然后用500μL 100%乙醇洗沉淀。
(8)用500μL SSTE溶解沉淀(RNA),转移至1.5 mL离心管中,加入等体积的氯仿/异戊醇去除蛋白质杂质抽提一次。
(9)加入1/10体积的NaAc ,2×体积的无水乙醇,在-70°C沉淀30 min或-20°C沉淀2 h。
(10)4°C ,15000rpm离心20 min沉淀RNA(全速)。
(11)先用400μL 70%乙醇洗沉淀,然后用400 μL100%乙醇洗沉淀,干燥后用65μLDEPC水溶解RNA。
三、用DNase处理提取的RNA
(1)用65μLDEPC水溶解RNA沉淀。
(2)加入10×DNase assay buffer 7.5 μL,RNase inhibitor 1.0 μL,DNaseⅠ 1.5μL
(3)37°C水浴20min。
(4)调整样品体积至250μL(加入175μLDEPC-H2O)。
(5)加入1/10体积3 M NaAc(pH=5.2),即25μL,颠倒管子或涡旋混匀。
(6)加入2×体积冷的无水乙醇,混匀后,储存在-20°C 30 min。
(7)4°C离心20 min,沉淀RNA (全速)。
(8)用70%乙醇洗沉淀,然后用无水乙醇洗沉淀。
(9)干燥后,用50μLDEPC水溶解RNA。
置-70°C冰箱中保存。
四、电泳检测RNA
(1)配制1.2%的琼脂糖凝胶(20mL):称取琼脂糖0.24 g,加DEPC处理的ddH2O 12.04 mL,5×RNA 电
泳缓冲液4 mL,电炉加热融化琼脂糖,冷却至55°C,加入甲醛1.96 mL,冷却后倒胶。
(2)RNA电泳:取去离子甲酰胺10μL,甲醛1.5μL,10×RNA Buffer 2μL,RNA (2~4 μg, <10μL) 混合液,65°C加热15min,迅速在冰浴中冷却片刻,然后加入3μL RNA 加样缓冲液和0.5μL EB,上样电泳。
电泳Buffer为1× RNA buffer。
出现的电泳条带有两条,是两条最大的核糖体RNA(rRNA)分子,即18S 和28S rRNA,较小的RNA也很丰富但看不到,因为太小,跑出了凝胶的边界。
多数细胞中的信使RNA(mRNA)经EB染色后不足以形成可见的带。
只要18S 和28S rRNA带亮,且28S rRNA大约为18S rRNA 的两倍,说明提取的RNA没有发生降解,纯度好。
五、提取的RNA的浓度检测
(1)取少量待测RNA样品,用TE或蒸馏水稀释50倍(或100倍)。
(2)用TE或蒸馏水做空白,在260 nm、280 nm、310 nm处调节紫外分光光度计的读数至零。
(3)加入待测RNA样品在三个波长处读取OD值。
(3)纯RNA 样品的OD260/OD280大约为1.7-2.0之间,OD260/OD230应大于2.0。
(5)根据OD值计算RNA浓度或纯度。
[SSRNA]=40×(OD260-OD310)×稀释倍数
六、问题及解决方案
注意事项:
1 DEPC-H2O应该提前处理好,大约4000ml。
2 所有药品均用DEPC-H2O配置。
3 EDTA, SDS, CTAB, SSTE均较难溶,可稍微加热。
4 EDTA调PH值不可调过。
5 NaAc调PH值时用冰醋酸。
6 PH计校对时先调整PH=6.86的溶液。
六、问题及解决方案
(1)RNA出现降解
原因:操作过程中温度太高。
RNase的存在和RNase-inhibitor的含量不足
解决办法:1、试验过程中所用器皿要避免RNase的存在
2、整个操作过程中应在低温(4°C)或冰上进行
3、始终带手套
(2)OD260/OD280比值偏低
原因:Protein含量过高。
解决办法:向RNA样品中加入等体积的苯酚/氯仿(1:1)重新抽提一次。
当然这样会损失RNA样品,有时达40%.
(3)OD260/OD230比值偏低
原因:异硫氰酸胍等分子造成污染。
解决办法:1、向RNA样品中加入1/10体积的2M NaAc(PH=4.0),然后加入等体积的异丙醇,在-20°C条件下放置30min。
2、4°C 10000rpm 15min,沉淀用1mM EDTA回溶。
3、重复步骤1和2。
4。
、70%乙醇洗涤一遍,干燥,用无RNase污染的水回溶。
