hcl溶解热
hcl溶于水体积变化

当盐酸(HCl)溶于水时,总体积会发生变化。
为了理解和预测这种变化,我们需要深入探讨一些基本的化学原理。
首先,我们必须了解,当一种物质溶解于另一种物质中时,会产生分子间的相互作用。
具体到HCl溶于水的情况,HCl分子会与水分子结合,形成水合分子。
这种结合会导致原先的物质体积发生变化。
我们知道,物质溶解的过程伴随着能量的变化。
HCl溶于水时,会释放出能量,这会导致物质的体积膨胀。
然而,这种膨胀的程度是有限的,因为HCl与水结合形成的水合分子占据了较为固定的空间。
另一方面,我们还需要考虑到物质溶解过程中的熵变。
熵是衡量物质混乱度的物理量,熵值的改变可以反映物质状态的变化。
在HCl溶于水的过程中,由于分子间相互作用和结合方式的复杂性,熵值会有所降低。
这意味着,溶质和溶剂的混合并不是完全无序的,而是形成了一种新的有序结构。
综合以上因素,我们可以得出结论:当盐酸(HCl)溶于水时,总体积会发生变化。
具体来说,由于能量释放和熵值降低的影响,体积会有所膨胀,但这种膨胀是有限的,因为水合分子的形成限制了体积的进一步增加。
值得注意的是,这种体积变化在实际应用中具有重要意义。
例如,在化学实验中,我们需要精确控制溶液的体积,以便进行准确的实验操作和结果分析。
因此,了解HCl溶于水时的体积变化有助于我们更好地进行实验设计和操作。
总的来说,盐酸溶于水时,总体积会发生变化。
这种变化是由于分子间的相互作用、能量释放以及熵值改变等多种因素共同作用的结果。
了解这种体积变化有助于我们更好地理解和应用相关化学原理。
盐酸的溶解性及溶解度规律

盐酸的溶解性及溶解度规律引言盐酸是一种常见的无机酸,广泛用于实验室和工业生产中。
了解盐酸的溶解性及其溶解度规律对于正确使用和处理盐酸具有重要意义。
本文将探讨盐酸的溶解性及其溶解度规律,并提供相关实验结果和数据。
盐酸的溶解性盐酸在常温下能够与水快速反应并溶解。
其溶解性主要受温度和浓度的影响。
温度对盐酸溶解性的影响随着温度的升高,盐酸的溶解性增加。
这是因为温度升高可以提高分子的热运动能量,促使盐酸分子与水分子更有效地相互作用,从而增加溶解度。
浓度对盐酸溶解性的影响在一定温度范围内,盐酸浓度的增加会使其溶解度增加。
当盐酸浓度较低时,溶解度与浓度呈正相关关系;然而,当盐酸浓度较高时,溶解度的增加变得较小,这是因为溶液中的水分子已经饱和。
盐酸的溶解度规律盐酸的溶解度可以通过溶解度曲线来描述,该曲线可以根据实验测定的数据绘制得出。
盐酸的溶解度曲线盐酸的溶解度曲线呈现出以下特征:在一定温度范围内,溶解度随着盐酸浓度的增加而增加,但增加速率逐渐减小。
当盐酸浓度达到一定值时,溶解度将趋于饱和,以后的盐酸加入将不再显著增加溶解度。
实验结果和数据以下是一组用于绘制盐酸的溶解度曲线的实验结果和数据:结论本文介绍了盐酸的溶解性及其溶解度规律。
通过了解温度和浓度对盐酸溶解性的影响,我们可以正确地使用和处理盐酸。
此外,盐酸的溶解度曲线可以通过实验测定的数据绘制得出,以进一步了解溶解度规律。
在实验中要注意使用正确的实验条件,如温度控制、浓度测量和数据记录,以确保实验结果的准确性。
氯化氢 解析

氯化氢解析
氯化氢(化学式:HCl)是一种无色、有刺激性气味的气体,既可溶于水,也可与很多有机物反应。
以下是关于氯化氢的解析:
1. 组成:氯化氢由一个氢原子和一个氯原子组成。
2. 物理性质:
- 普通条件下为无色气体,具有刺激性气味。
- 不溶于大部分有机物,但可溶于水,生成盐酸。
- 凝点为 -85.05℃,沸点为 -85.05℃。
3. 化学性质:
- 氯化氢是一种强酸,能与碱反应,生成盐和水,如HCl + NaOH → NaCl + H2O。
- 对有机物具有腐蚀性,可与许多有机物反应,如与醇反应生成氯代烷,如HCl + CH3OH → CH3Cl + H2O。
- 与金属反应,可生成相应的金属盐和氢气,如2HCl + Zn → ZnCl2 + H2。
4. 应用:
- 用于制取盐酸。
- 用于清洗金属表面和酸洗。
- 用于制备其他氯化物。
- 用于净化、调节和酸化水。
5. 安全注意事项:
- 氯化氢是腐蚀性气体,对皮肤、眼睛和呼吸系统有刺激性和损伤作用,操作时需注意做好防护。
- 在操作氯化氢时要注意通风,避免其浓度过高。
- 氯化氢具有燃烧性,与可燃物质接触时易发生燃烧或爆炸,需避免与可燃物共存或混合。
hcl分解温度

hcl分解温度摘要:1.HCl的分解温度概述2.HCl分解的化学反应方程式3.影响HCl分解温度的因素4.提高HCl分解温度的方法5.总结与展望正文:在我们生活和工作中,HCl(氢氯酸)是一种常见的化学物质,其分解温度是化学领域关注的一个重要参数。
本文将介绍HCl的分解温度,分析影响HCl分解的因素,并提出提高HCl分解温度的方法。
一、HCl的分解温度概述HCl在常温下为无色气体,具有强烈的刺激性气味。
在标准大气压下(101.3 kPa),HCl的沸点为-85.5℃,凝固点为-114℃。
HCl的分解温度一般在1000℃左右,但在特定条件下,如高温高压环境,HCl的分解温度可能更高。
二、HCl分解的化学反应方程式HCl的分解反应为:HCl(g) → H2(g) + Cl2(g)在高温下,HCl分子中的氢和氯原子分离,生成氢气和氯气。
三、影响HCl分解温度的因素1.压强:随着压强的增大,HCl的分解温度会升高。
2.温度:一般情况下,温度越高,HCl的分解温度越低。
3.催化剂:合适的催化剂可以降低HCl分解的活化能,从而降低分解温度。
四、提高HCl分解温度的方法1.选择合适的催化剂:研究合适的催化剂,以降低HCl分解的活化能,从而提高分解温度。
2.优化反应条件:提高反应压力、温度等条件,有助于提高HCl分解温度。
3.选择合适的载体:合适的载体可以提高催化剂的活性和稳定性,从而提高HCl分解温度。
五、总结与展望HCl分解温度受多种因素影响,通过优化催化剂、反应条件和载体等方面,可以提高HCl的分解温度。
在实际应用中,研究HCl的高温分解行为对于化工生产、环境保护等领域具有重要意义。
未来,随着科学技术的不断发展,有望实现更高效、环保的HCl分解方法。
氯化氢溶解热与温度对应表_概述说明以及解释

氯化氢溶解热与温度对应表概述说明以及解释1. 引言1.1 概述本文旨在研究氯化氢溶解热与温度之间的对应关系。
溶解热是指当一定量的物质在特定温度下溶解时释放或吸收的能量。
溶解热与温度之间的关系是化学领域中一个重要而有趣的课题,其了解不仅有助于深入理解物质的性质,还对相关工艺和应用有着重要意义。
1.2 文章结构本文分为五个主要部分进行论述。
首先,在第二部分“氯化氢溶解热与温度对应表”中,我们将介绍氯化氢溶解热以及所采用的实验方法和数据收集过程。
接着,我们将探讨温度对氯化氢溶解热的影响,并提供相应实验结果和数据分析。
在第三部分“解释氯化氢溶解热与温度的关系”中,我们将阐述反应热量相关概念,并详细说明温度变化如何影响反应热量产生机制。
此外,我们还将通过实际例子和实验验证结果展示这一关系。
第四部分为“结论”,我们将总结氯化氢溶解热与温度关系的主要发现,并提出可能存在的误差以及未来改进方向的建议。
最后,在第五部分“后续研究方向”中,我们将探讨其他物质溶解热与温度关系,并讨论可能影响溶解热和温度对应关系的因素。
同时,我们还将展望温度变化对其他化学反应性质的影响,为未来的研究提供一些有价值的思路和方向。
1.3 目的本文旨在深入了解氯化氢溶解热与温度之间的对应关系,并阐明其基本原理和机制。
通过实验数据和案例分析,我们将揭示溶解热与温度之间的联系,为进一步探索相关领域提供理论基础。
预计本文所介绍的实验方法和结果也能为工程应用和相关行业提供指导性意见。
通过本文的分析和讨论,希望能够加深人们对于溶解热与温度关系的理解,并拓宽对这一课题未来研究方向和挑战的认识。
2. 氯化氢溶解热与温度对应表:2.1 定义和背景知识:在化学中,溶解热是指单位物质质量在特定条件下从一个相转变到另一个相时释放或吸收的能量。
而温度是指物体分子运动的程度和热能的一种度量。
溶解热与温度之间存在着一定的关系,通过实验可以获得氯化氢溶解热与温度之间的对应关系。
盐酸培训材料

边混合边边燃烧还是先混合再点燃
案例三
• 事故名称:盐酸贮槽爆炸 • 发生日期:1993年5月27日 • 发生单位:山东某厂 • 事故经过:氯碱车间一名设备员在盐酸装车高架贮槽旁用
手持电动砂轮对电动机基础进行修整,砂轮机产生的火花 引燃了盐酸贮槽上部水封盒上方泄漏出的氢气。该设备员 在用于干粉灭火器灭火时,引起回火,使盐酸贮槽发生爆 炸,该设备员被炸伤,送医院途中死亡。 • 原因分析(1)盐酸贮槽区属禁火区,未经批准私自用砂 轮机磨削,属违章操作,火花引燃了氢气; (2)着火后 处理不当,引起氢气回火,引爆贮槽内可爆炸气体。 • 教训(1)对职工加强遵章守纪的教育,防止发生违章现 象;(2)在检修或安装设备时,事先制定好方案,防止 工作中的任意性,尤其是干部更应带头严格按方案办。
• 2、纯度的影响
• 在同样的温度下,氯化氢纯度越高,所制备的盐酸浓度也越 高。
• 3、流速的影响
• 根据双膜吸收理论,气液两相接触的自由界面附近,分别存 在着看作滞流流动的气膜和液膜,即在气相一侧存在气膜, 液相一侧存在液膜。氯化氢分子必须以扩散的方式克服两膜 阻力,穿过两膜进入液相主体,对于像氯化氢一类易溶于水 的气体来说,分子扩散的阻力主要来自气膜,而气膜的厚度 又取决与气体的流速:流速越大,气膜越薄,氯化氢分子扩 散阻力越小,扩散的速度越大,吸收效率也就越高。气液接 触的相界面越大,溶质分子向水中的扩散的机会越高,
二合一炉灯座(燃烧器)现场图
盐酸罐前酸封改造
图一:酸封改造前
图二:酸封改造增加排气点
指标与巡检ห้องสมุดไป่ตู้关系
• 巡检重要是巡检设备和工艺指标 • 6月24日,二合一盐酸炉炉压60Kpa,紧急停炉
巡检与关键控制点
hcl的物理常数

hcl的物理常数
氯化氢,化学式为HCl,是无色有刺激性气味的气体,对空气的比重为1.29,易溶于水,0℃时1升水中约能溶解500升氯化氢。
其部分物理常数如下:
- 分子量:36.4606
- 熔点:158.8K(-114.2℃)
- 沸点:187.9K(-85℃)
氯化氢会与空气中的水蒸气结合并生成盐酸,盐酸具有强腐蚀性,与雨水一同落入地面就形成腐蚀性比较强的酸雨,对植物、建筑物等危害很大,深入地下还可能污染地下水和土壤。
在使用和处理氯化氢时,应遵守安全操作规程,并采取适当的防护措施。
如果你想了解更多关于氯化氢的信息,可以再次向我提问。
hcl生产热

hcl生产热
HCL (氯化氢) 是一种强酸性气体,它是由氯气和氢气反应而成的。
在生产过程中,通常使用HCl的水溶液(盐酸)形式。
HCl生产热是由于其与水发生反应时释放出的能量所致。
HCl与水反应生成热的过程可以描述为一个放热反应,即放出热量。
这是一个外放热量的反应,因为在反应中化学键的重新排列导致了能量的释放。
而且,该反应是剧烈的,因此需要在适当的条件下进行并控制。
在HCl与水反应的过程中,HCl会与水分子发生反应,生成盐酸溶液并释放能量。
这种能量释放是由于新生成的化学键的形成比原有化学键的断裂所释放的能量更大。
因此,HCl的生产过程中会伴随着热量的释放。
在实际操作中,为了安全起见,HCl的生产通常会在恒温条件下进行,并采取必要的措施来控制反应温度和反应速率,以确保操作的安全性和效率。
总结来说,HCl生产热是由于其与水反应时释放出的能量所致。
在生产过程中,需要控制反应温度和反应速率以确保安全和效率。
盐酸加热的计算

盐酸加热的计算
盐酸(HCl)是一种强酸,当加热盐酸时,它会逐渐分解为氢气(H2)和氯气(Cl2)。
分解方程式如下:
2HCl (aq) -> H2 (g) + Cl2 (g)
在计算盐酸加热时,我们可以考虑以下几个方面:
1. 反应热量计算:根据热力学数据,我们可以获得盐酸分解反应的标准焓变(ΔH°)。
通过计算产生的氢气和氯气分别的摩尔数,并乘以标准焓变,就可以计算出反应的热量变化。
2. 物质的量计算:根据反应的摩尔比例,我们可以计算出所需的盐酸的摩尔数。
如果有其他相关物质的摩尔数已知,也可以计算出其他物质的量。
3. 反应速率计算:盐酸的分解速率受到温度的影响。
通过考虑不同温度下的反应速率常数和反应时间,可以计算出在不同温度下反应的进程。
需要注意的是,以上计算都是基于理想情况下的模型,并且可能受到实际反应条件、反应速率和反应平衡的影响。
所以在实际操作中,还需要考虑其他因素,如反应容器的选择、监测反应进程等。
浓盐酸的性质

浓盐酸的性质浓盐酸(称为氢氯酸,其化学式为HCl)是一种强酸,具有强烈的腐蚀性和挥发性。
在常温常压下,浓盐酸为无色透明的液体,具有刺鼻味道。
在本文中,我们将详细讨论浓盐酸的性质。
1. 物理性质浓盐酸密度较大,相对分子质量为36.46,水解热为-92.31kJ/mol,显热为-74.84kJ/mol。
在室温下,1mol/L的浓盐酸密度约为1.19g/cm^3,沸点为-85℃,沸点在100℃以下,而且是一种高挥发性的液体。
由于其挥发性的性质,打开盖子容易造成雾形物质,直接吸入容易引起呼吸道和眼睛的刺激。
2. 化学性质2.1 酸碱性质盐酸的化学性质极其活泼,是经常被使用于化学实验室中的一种化学试剂。
它是一种强酸,可以与碱、氧化剂和某些金属反应。
在水中,盐酸溶液会电离成为铵根离子和氢离子,因此盐酸是一种酸。
HCl + H2O → H3O+ + Cl-当盐酸与碱反应时,会产生盐和水。
HCl + NaOH → NaCl + HOH当盐酸与氧化剂反应时,会发生氧化还原反应。
例如,在盐酸和过氧化氢的反应中会释放出氧气。
HCl + H2O2 → H2O + O2 + Cl当盐酸与某些金属反应时,会产生相应的金属的氯化物和氢气。
Zn + 2HCl → ZnCl2 + H22.2 氧化还原性质由于盐酸具有强的氧化还原性,所以它也被广泛应用于分析化学和一些电化学实验。
在分析化学实验中,盐酸也可以到达与铁类物质有关的葡萄糖氧化酶那种还原性实验。
2.3腐蚀性质盐酸是一种极度腐蚀性液体,能够腐蚀多种材料。
在实验室中,使用盐酸时必须采取严格的防护措施,如在使用盐酸时必须戴上手套、穿上防护服等。
在与皮肤、眼睛接触时应立即用充足的清水洗净,并积极获得医疗帮助。
盐酸对金属具有极强的腐蚀性,能腐蚀铁、钢、锡等金属,会在金属表面形成一层氯化物膜,这也是盐酸有助于清洁金属表面的原因。
此外,盐酸还可以腐蚀有机材料,如纺织品、橡胶、塑料等。
因此,浓盐酸具有强的酸碱性质、氧化还原性质和腐蚀性质。
hcl汽化潜热

HCL汽化潜热概述HCL(氯化氢)是一种常见的无机酸,具有强烈的腐蚀性和刺激性。
在化学工业中,HCL广泛应用于溶剂、催化剂、试剂和清洗剂等方面。
了解HCL的物理性质对于安全操作和工艺优化至关重要。
本文将重点介绍HCL的汽化潜热,这是衡量液体物质蒸发过程中所需吸收的能量。
汽化潜热的定义汽化潜热是指单位质量液体在恒定温度下从液相转变为气相所需吸收或释放的热量。
在常温下,HCL呈现为无色气体,但可以通过降温将其转变为液体状态。
当我们将HCL液体加热到其沸点时,它会迅速转变为气体,并且在这个过程中需要吸收一定数量的热量。
HCL的物理性质沸点和汽化潜热HCL的沸点是-85.05°C(187.9K),这意味着只要将其加热到这个温度,HCL就会从液体转变为气体。
HCL的汽化潜热是指在沸点下单位质量的HCL从液态转化为气态所需吸收的热量。
根据实验数据,HCL的汽化潜热约为15.3 kJ/mol。
气体状态方程HCL在气体状态下遵循理想气体状态方程,即PV=nRT。
其中P表示压力,V表示体积,n表示物质的摩尔数,R是理想气体常数,T表示温度。
根据这个方程可以计算出在给定温度和压力下HCL气体的摩尔数。
影响汽化潜热的因素温度温度是影响汽化潜热的关键因素之一。
随着温度的升高,液体分子间相互作用减弱,使得分子能够更容易地从液相转变为气相。
因此,在较高温度下,汽化潜热较低。
压力压力对汽化潜热也有一定影响。
根据Le Chatelier原理,在较高压力下,液体分子更难以脱离液相转变为气相,因此汽化潜热较高。
溶解度HCL在水中具有较高的溶解度。
溶解度的增加会导致液体分子间的相互作用增强,从而使得分子更难从液相转变为气相。
因此,当HCL与水混合时,汽化潜热会受到影响。
应用工业应用HCL广泛应用于工业生产中的各个领域。
它可以作为催化剂使用,促进许多重要反应的进行。
此外,HCL还可以用作清洗剂和消毒剂,在制药、食品加工和水处理等行业起着重要作用。
盐酸加热的计算

盐酸加热的计算
(最新版)
目录
1.盐酸的性质和加热的必要性
2.盐酸加热的计算方法
3.盐酸加热的注意事项
4.结论
正文
盐酸是一种强酸,它在许多化学反应和工业过程中都有着重要的应用。
然而,由于盐酸的不稳定性,加热是必不可少的步骤。
盐酸加热的计算,是确保安全和有效性的重要环节。
首先,让我们了解一下盐酸的性质和加热的必要性。
盐酸,化学式为HCl,是一种强酸,具有强烈的腐蚀性。
在许多化学反应和工业过程中,
盐酸都需要加热以提高其反应速率和效率。
然而,盐酸在高温下容易分解,产生有毒的氯气,因此,加热盐酸需要特别小心,需要进行精确的计算。
接下来,我们来介绍一下盐酸加热的计算方法。
盐酸加热的计算主要包括两个方面,一是计算盐酸的摩尔浓度,二是计算加热所需的热量。
盐酸的摩尔浓度可以通过测量盐酸的质量和体积来计算。
加热所需的热量则需要根据盐酸的质量和比热容来计算。
此外,还需要考虑到热量的损失和盐酸的热效应。
然后,我们来讨论一下盐酸加热的注意事项。
首先,加热盐酸的设备必须能够承受高温,且具有良好的防腐性能。
其次,加热过程中需要定期检测盐酸的温度和浓度,以防止盐酸分解产生有毒的氯气。
最后,加热完成后,需要等待盐酸冷却至室温后再进行下一步的操作。
总的来说,盐酸加热的计算是保证盐酸加热过程安全和有效的重要环
节。
只有通过精确的计算,才能确保盐酸在加热过程中不会分解,也不会产生有毒的氯气。
盐酸的物理化学性质

盐酸的物理化学性质 盐酸是氢氯酸的俗称,是氯化氢(HCl)⽓体的⽔溶液,为⽆⾊透明的⼀元强酸。
接下来店铺⼩编为你整理了盐酸的物理化学性质,⼀起来看看吧。
盐酸的物理性质 外观:⽆⾊液体,有腐蚀性。
为氯化氢的⽔溶液(⼯业⽤盐酸会因有杂质三价铁盐⽽略显黄⾊)。
有刺激性⽓味。
由于浓盐酸具有挥发性,挥发出的氯化氢⽓体与空⽓中的⽔蒸⽓作⽤形成盐酸⼩液滴,所以会看到酸雾。
pKa值:-7 密度: 1.18g/cm3 熔点: -27.32 ℃ (38%溶液) 沸点: 110 °C (20.2%溶液);48 °C(38%溶液) 相对蒸⽓密度(空⽓=1):1.26 饱和蒸⽓压(kPa):30.66(21℃) 黏度: 1.9 mPa·s, 25 °C(31.5%溶液) 溶解性:与⽔混溶,浓盐酸溶于⽔有热量放出。
溶于碱液并与碱液发⽣中和反应。
能与⼄醇任意混溶,氯化氢能溶于苯。
盐酸的化学性质 强酸性 1、和碱反应⽣成氯化物和⽔ HCl + NaOH = NaCl + H2O 2、能与碳酸盐反应,⽣成⼆氧化碳 K2CO3 + 2HCl = 2KCl+ CO2↑ + H2O 3、能与活泼⾦属单质反应,⽣成氢⽓ Fe+ 2HCl =FeCl2+ H2↑ 4、能与⾦属氧化物反应,⽣成盐和⽔ MgO+2HCl=MgCl2+H2O 5、能⽤来制取弱酸 CaCO3+2HCl=CaCl2+H2O+CO2↑(不⽤Na2CO3因为反应速率过快,实验室常⽤盐酸于制取⼆氧化碳的⽅法) CH3COONa+HCl=CH3COOH+NaCl 6、能和盐反应,⽣成新酸和新盐 2HCl+Na2SO3=SO2↑+H2O+2NaCl Na2S2O3+2HCl=2NaCl+H2O+SO2↑+S↓ 另外,盐酸能与硝酸银溶液反应,⽣成不溶于稀硝酸的氯化银,氯化银极微溶于⽔,产⽣⽩⾊的凝乳状沉淀。
HCl+AgNO3===HNO3+AgCl↓ 还原性 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 4HCl(浓)+MnO2=加热=MnCl2+2H2O+Cl2↑ 14HCl(浓)+K2Cr2O7==3Cl2(⽓体)+2CrCl3+2KCl+7H2O NaClO+2HCl=NaCl+Cl2+H2O 电离⽅程式 HCl===H+ +Cl- 盐酸的制备⽅法 主要是⽤⽔吸收氯化氢⽽得。
hcl hbr沸点

hcl hbr沸点HCl和HBr是两种不同的化学物质,它们都有不同的沸点。
HCl 是一种稳定的氯化酸,广泛用于实验室和工业应用,以及工程上的清洗,杀菌和加工金属。
HBr则是一种具有毒性的碱性物质,具有用于制备某些杀虫剂的应用。
两者的沸点也有所不同,本文将探讨它们的沸点以及它们之间的不同之处。
HCl的沸点被确定为一般范围为 -86.4C至-85.0C。
其临界温度,即沸点,通常在-83.7C到-83.4C之间。
这种沸点现象使得它可以在相对较低的温度下汽化,使得它成为一种实用的实验室和工业用途的物质。
HBr的沸点被测定为 -67.2C到-66.0C的一般范围内,而其临界温度常常处在-65.5C到-65.2C之间。
由此可见,HBr的沸点略低于HCl。
HBr除了具有一定的毒性之外,还具有可用于制备某些杀虫剂等物质的优势。
HCl和HBr有着不同的沸点,但是它们之间又有着一些相似之处。
首先,它们都可以按照一般范围和临界温度准确测量沸点。
其次,它们都是用于实验室和工业应用的高纯度物质。
此外,它们都可以用于工程上的清洗,杀虫和加工金属。
然而,它们有一个显著的不同点,HCl具有较高的沸点,而HBr具有更低的沸点,最低温度可以降至-67.2C。
从以上内容可以看出,HCl和HBr有着不同的沸点,即HCl平均沸点为 -86.4C至-85.0C,而HBr的沸点降至-67.2C到-66.0C之间。
另外,它们还有一些相似之处,比如都具有用于实验室和工业应用的高纯度,以及可用于工程上的清洗,杀虫和加工金属等。
然而,HBr 相比HCl具有更低的沸点,使得它可以在更低温度下汽化,可以有效地利用于制备某些杀虫剂。
因此可以看出,HCl和HBr沸点不同,其中HCl的沸点较高,而HBr的沸点较低。
由此可见,针对不同的实验室和工业应用,选择正确的沸点可以在一定程度上提高工作效率,有助于实验室和工业应用的发展。
综上所述,HCl和HBr物质具有不同的沸点,因此在实验室和工业应用时,应考虑选择了恰当的沸点,以此来提高工作效率。
氯化氢特性表

氯化氢特性表
中文名:氯化氢
分子式:HCl
危险货物编号:22022
外观与性状:无色有刺激性气味的气体。
主要用途:制染料、香料、药物、各种氯化物及腐蚀抑制剂。
侵入途径:吸入、食入
皮肤接触:脱去污染的衣着,立即用水冲洗至少15分钟。就医。
眼睛接触:立即提起眼睑,用流动清水冲洗10分钟或用2%碳酸氢钠溶液冲洗。就医。
急救及防护措施
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。给予2~4%碳酸氢钠溶液雾化吸入。就医
食入:误服者给饮牛奶或蛋清。立即就医。
工程控制
理化性质
熔点
-114.2℃沸点-85℃ Nhomakorabea闪点
——
建规火险分级
——
爆炸上限
——
相对密度(水=1)
1.19
爆炸下限
——
相对蒸汽密度(空气=1)
1.27
临界温度
51.4℃
饱和蒸汽压
4225.6kPa/20℃
临界压力
8.26MPa
溶解性
易溶于水
危险特性:具有强腐蚀性。能与一些活性金属粉末发生反应,放出氢气。遇氰化物能产生剧毒的氰化氢气体。若遇高热,容器内压增大,有开裂和爆炸的危险。
燃烧爆炸危险性
燃烧分解产物
氯化氢
稳定性
稳定
禁忌物
碱类、活性金属粉末。
包装类别
Ⅲ
危险性类别
第2.2类不燃气体
聚合危害
不出现
灭火方法:不燃。切断气源。喷水冷却容器,可能的话将容器从火场移至空旷处。雾状水。
盐酸与氢氧化钠中和热标准值

盐酸(HCl)和氢氧化钠(NaOH)的中和反应是一种酸碱中和反应,通常伴随着热释放。
该反应的热标准值(ΔH)可以通过热量测定实验来测定,但具体数值取决于反应条件(如浓度和温度)以及反应的摩尔量。
在标准条件下(25摄氏度和1大气压),1摩尔的盐酸和1摩尔的氢氧化钠中和反应的热标准值约为-57.1千焦耳/摩尔(kJ/mol)。
这表示中和反应是放热的,系统释放了热量。
反应方程式如下:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
需要注意的是,如果你在非标准条件下进行反应(如不同的温度或浓度),热标准值可能会有所不同。
为了准确测定热标准值,通常需要使用热量计或热量测定设备来进行实验测定。
浓盐酸熔点

浓盐酸熔点
浓盐酸是一种质量比较重的酸类物质,其熔点也是一个非常特殊
的物理参数。
本文将围绕浓盐酸熔点这一主题,分步骤进行详细的阐述。
一、浓盐酸的概述
浓盐酸,又称氯化氢,是一种非常强酸,其化学式为HCl。
它很容易与水或其他含水物质相互作用,在这个过程中会产生能量和热。
它常常
被用作溶解其他化学物质的溶剂,在化学实验和工业生产中得到广泛
应用。
二、浓盐酸的熔点
浓盐酸的熔点是一个非常特殊的物理参数,与其他物质的熔点不同。
通常情况下,浓盐酸是难以固化的,只有在特定条件下才能使其固化。
浓盐酸的熔点大约在-114℃左右,这是很多常温常压的条件下都达不
到的温度。
三、浓盐酸熔点的含义
浓盐酸熔点意味着它可以在相应温度下从液态转变为固态。
这一特性
可以应用于某些化学反应和工业过程中,也可以用于存储和运输。
此外,浓盐酸的固态形式可以方便地被切割和处理,这也是浓盐酸熔点
非常重要的原因之一。
四、浓盐酸熔点的重要性
浓盐酸熔点是浓盐酸的一个非常独特的物理参数,具有重要的应用价值。
它可以方便地存储和运输,也可以作为某些化学反应的反应介质。
此外,浓盐酸的固态形式也被广泛用于工业加工中,如纸浆生产等领域。
总之,围绕浓盐酸熔点这一特殊的物理参数,我们可以看到它在
实际应用中的重要性。
我们需要更深入地了解这个参数,以便更好地
利用它在我们的实验和生产中。
盐酸理化特性表
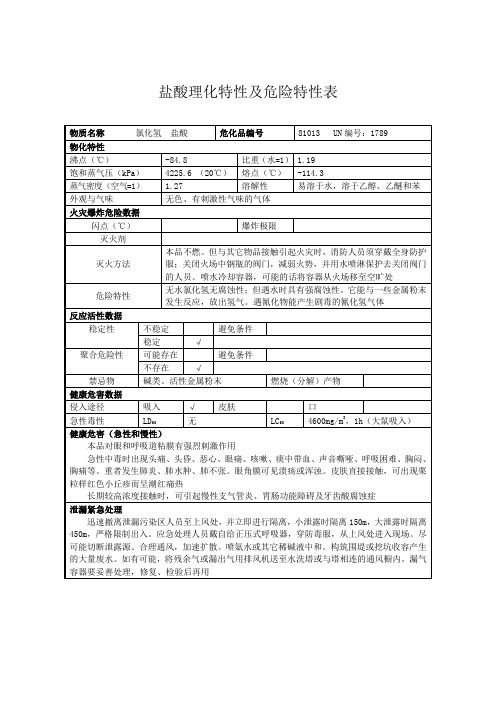
盐酸理化特性及危险特性表物质名称氯化氢盐酸危化品编号81013 UN编号:1789物化特性沸点(℃)-84.8比重(水=1) 1.19饱和蒸气压(kPa)4225.6 (20℃)熔点(℃)-114.3蒸气密度(空气=1) 1.27溶解性易溶于水,溶于乙醇、乙醚和苯外观与气味无色、有刺激性气味的气体火灾爆炸危险数据闪点(℃)爆炸极限灭火剂灭火方法本品不燃。
但与其它物品接触引起火灾时,消防人员须穿戴全身防护服;关闭火场中钢瓶的阀门,减弱火势,并用水喷淋保护去关闭阀门的人员。
喷水冷却容器,可能的话将容器从火场移至空旷处危险特性无水氯化氢无腐蚀性;但遇水时具有强腐蚀性。
它能与一些金属粉末发生反应,放出氢气。
遇氰化物能产生剧毒的氰化氢气体反应活性数据稳定性不稳定避免条件稳定√聚合危险性可能存在避免条件不存在√禁忌物碱类、活性金属粉末燃烧(分解)产物健康危害数据侵入途径吸入√皮肤口急性毒性LD50无LC504600mg/m3,1h(大鼠吸入)健康危害(急性和慢性)本品对眼和呼吸道粘膜有强烈刺激作用急性中毒时出现头痛、头昏、恶心、眼痛、咳嗽、痰中带血、声音嘶哑、呼吸困难、胸闷、胸痛等。
重者发生肺炎、肺水肿、肺不张。
眼角膜可见溃疡或浑浊。
皮肤直接接触,可出现栗粒样红色小丘疹而呈潮红痛热长期较高浓度接触时,可引起慢性支气管炎、胃肠功能障碍及牙齿酸腐蚀症泄漏紧急处理迅速撤离泄漏污染区人员至上风处,并立即进行隔离,小泄露时隔离150m,大泄露时隔离450m,严格限制出入。
应急处理人员戴自给正压式呼吸器,穿防毒服,从上风处进入现场。
尽可能切断泄露源。
合理通风,加速扩散。
喷氨水或其它稀碱液中和。
构筑围堤或挖坑收容产生的大量废水。
如有可能,将残余气或漏出气用排风机送至水洗塔或与塔相连的通风橱内。
漏气容器要妥善处理,修复、检验后再用储运注意事项属不燃有毒压缩气体。
应储存于阴凉、通风仓间内,仓温不宜超过30℃。
远离火种、热源,防止阳光直射。
