硝酸钾溶解热数据处理
KNO3的积分溶解热数据记录数据处理表
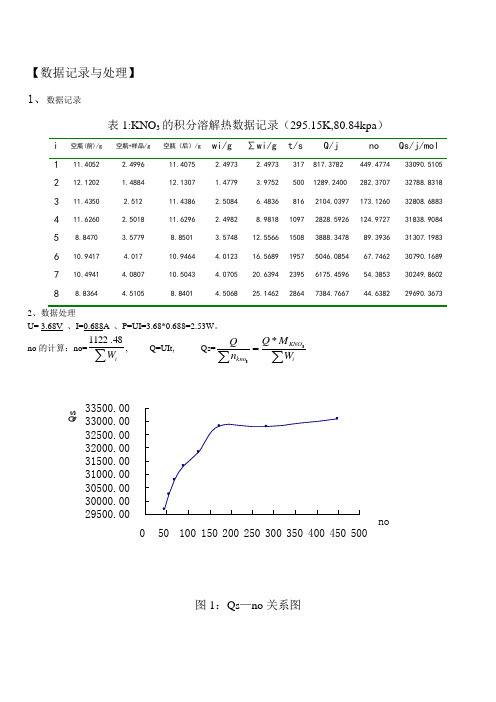
【数据记录与处理】 1、数据记录表1:KNO 3的积分溶解热数据记录(295.15K,80.84kpa )i 空瓶(前)/g空瓶+样品/g空瓶(后)/gwi/g ∑wi/g t/sQ/j noQs/j/mol1 11.4052 2.4996 11.4075 2.4973 2.4973 317 817.3782449.477433090.5105 2 12.1202 1.4884 12.1307 1.4779 3.9752 500 1289.2400 282.3707 32788.8318 3 11.4350 2.512 11.4386 2.5084 6.4836 816 2104.0397 173.1260 32808.6883 4 11.6260 2.5018 11.6296 2.49828.9818 1097 2828.5926 124.972731838.9084 5 8.8470 3.5779 8.8501 3.5748 12.5566 1508 3888.3478 89.3936 31307.1983 6 10.9417 4.017 10.9464 4.0123 16.5689 1957 5046.0854 67.7462 30790.1689 7 10.4941 4.0807 10.5043 4.0705 20.6394 2395 6175.4596 54.3853 30249.8602 88.83644.51058.84014.5068 25.1462 2864 7384.7667 44.638229690.36732、数据处理U= 3.68V 、I=0.688A 、P=UI=3.68*0.688=2.53W 。
no 的计算:no=∑i W 48.1122, Q=UIt, Qs=∑∑=iKNO kno W M Q n Q33*29500.0030000.0030500.0031000.0031500.0032000.0032500.0033000.0033500.00050100150200250300350400450500noQ s图1:Qs —no 关系图1、本实验的装置可从以下几个方面改进:本实验采用杜瓦瓶作为反应装置,可视性不好,可以考虑用透明的绝热玻璃装置,增强反应的透明度,更容易观察硝酸钾的溶解性。
大学溶解热实验报告

一、实验目的1. 了解溶解热的定义、分类及其测定方法。
2. 掌握电热补偿法测量溶解热的基本原理和操作步骤。
3. 通过实验,测定硝酸钾在水中的积分溶解热,并计算微分溶解热、积分冲淡热和微分冲淡热。
4. 分析实验误差,提高实验操作技能。
二、实验原理溶解热是指在恒温、恒压条件下,将一定量的溶质溶解于溶剂中时所产生的热效应。
溶解热分为积分溶解热和微分溶解热。
积分溶解热是指在恒温、恒压条件下,1mol 溶质溶解在一定量的溶剂中时所产生的热效应。
微分溶解热是指在恒温、恒压条件下,在大量给定浓度的溶液中加入1mol溶质时所产生的热效应。
溶解热可以通过绝热测温式量热计进行测量。
该量热计在绝热恒压条件下工作,通过测量溶液温度的变化,计算出溶解热。
三、实验仪器与药品1. 仪器:保温瓶、磁力搅拌器、热敏电阻测温装置、加热器、直流稳压稳流电源、精密毫安表、秒表、容量瓶(500ml)、烧杯(1000ml)、温度计、研钵、称量瓶、分析天平(公用)、高精度万用表(公用)。
2. 药品:KNO3(AR)。
四、实验步骤1. 搭建实验装置,要求装置具有良好的绝热性能。
2. 量取500mL去离子水注入保温瓶中,开动磁力搅拌器,用电加热方法调节水温,使之尽量接近室温,输出温度基本保持不变。
3. 调节惠斯通电桥的调节旋钮,使输出温度为5度。
待温度基本稳定后,记录约4min。
4. 打开电源开关,设定电源输出的电压值(20V以上)和电流值(0.95A)。
5. 按下电源的输出按键,开始加热,温度上升至7度时(以无纸记录仪上显示的数值为准)停止加热。
待温度稳定后,记录温度。
6. 重复步骤4-5,进行多次实验,求取平均值。
五、数据处理1. 计算硝酸钾的摩尔质量。
2. 根据实验数据,计算硝酸钾在水中的积分溶解热。
3. 根据积分溶解热,计算微分溶解热、积分冲淡热和微分冲淡热。
六、实验结果与分析1. 硝酸钾的摩尔质量为101.1g/mol。
2. 硝酸钾在水中的积分溶解热为-10.26 kJ/mol。
硝酸钾溶解热测定实验的改进

连接好线路 。用容量瓶量取 3 0 0 m L蒸 馏水倒 入杜 瓦瓶 中, 放入磁子 ,拧紧瓶 盖。用 台秤粗 称 已研细 的样 品约 3 . 6 g ,倒 人称量瓶 中,用分析天平准确称 出称量瓶和样 品的质量 m。 。打 开 电源开关 ,同时按下秒 表 ,每隔 1 a r i n记 录一 次温 度。 当温
3 5 . 3 2 9 k J・mo l b y t h e e x p e r i me n t .
Ke y wo r ds :di s s o l ut i o n h e a t ;me a s u r e me n t me t h o d;me a s u r e me n t o n—l i n e;n i t e r
可靠的实验结果 。由实验测得 硝酸钾的积分溶解 热为 3 5 . 3 2 9 k J・ m o l ~。
关键 词 :溶解热; 测定方法; 联机检测;硝酸钾
【清华】011890-雍有-溶解热

4 结论
根据表 4 中数据可以看出,随着 KNO3 浓度的增大,摩尔积分溶解热不断增大,摩尔微分溶解热不断增 大,而摩尔微分稀释热不断减小
5 参考文献
[1] 《基础物理化学实验》贺德华麻英张连庆编高等教育出版社 [2] 《化工原理(上册)》(第三版)蒋维钧戴猷元顾忠君编著清华大学出版社
14441.90
31.0905
36.0000
ΔsolHm/(kJ/mol)
35.0000 34.0000
△solHm
33.0000
32.0000
31.0000
30.0000 0.00
200.00
400.00 n0
600.00
800.00
图2 ∆
-n0 图
利用 origin 在图上画出 n0=80,100,200,300,400 时对应点的切线,根据切点坐标、切线斜率、切线截距可
雍有 2010011890 化 03
以
( sol H nA
)T
, P,nB
表示,简写为
( sol H nA
) nB
。
在恒温恒压下,对于指定的溶剂 A 和溶质 B,溶解热的大小取决于 A 和 B 的物质的量,即
sol H (nA , nB )
(3)
由(3)式可推导得:
sol H
sol H nB
(1)
式中, nB 为溶解于溶剂 A 中的溶质 B 的物质的量。
摩尔微分溶解热 在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,
以
(
sol H nB
)T
, P, nA
表示,简写为
(
sol H nB
溶解热实验数据处理-origin 8.0

下面以一组学生实验数据(表1)为例,详细介绍Origin软件在溶解热数据处理的应用。
表1.硝酸钾溶解热的实验数据水0 用Origin 8.0软件处理实验数据的步骤(1)绘制散点图。
打开Origin 8.0,点击项目“Book1”中的A(X)列,从行“1”开始依次输入n0值,同样在B(Y)列输入Q s值。
选中所有数据,右击选择“Plot/Symbol/Scatter”或者直接点击工具条上的Scatter按钮,得到散点图,如图1所示。
图1. 用Origin绘制散点图(2)非线性拟合。
左键单击“Graph1”窗口中任意一个散点,依次选择菜单栏中“Analysis/Fitting/Fit Exponential”,在弹出的对话框中的“Function”下拉菜单中选择“ExpDec1”(Exponential Decay1,即一次指数衰减)进行拟合,并在“Settings”选项卡中选择“Advanced”,找到“Find Specific X/Y”,勾选“Find Y from X”项,以便寻找拟合曲线上任意X坐标所对应的Y值,这一步操作较为关键。
如图2所示,点击“Fit”完成拟合。
图2.用Origin对数据进行非线性拟合与此同时,在“Book1”中会自动生成三个工作表:“fitexp1”用来记录拟合情况,“fitexpCurves1”则记录拟合曲线中数据点的坐标值,“fitexpFindYfrom X”用来输入任意的X值,程序自动计算出其对应的Y值。
同时,在“Graph1”中生成了包含方程详细信息的表格,由如图3可知,本实验数据所得到的拟合曲线方程为Qs = -10.515*exp(-n0/46.848) + 37.372,R2=0.99157(R2即Adj. R-Square的值)。
图3. Origin拟合曲线的方程和偏差点击工具栏中的“Text Tool”按钮,可在“Graph1”的文本框中插入曲线方程和R2的值,选中文本框,单击右键选择“properties”可进行美化,如字体、字号和颜色的设置等。
实验九 溶解热的测定
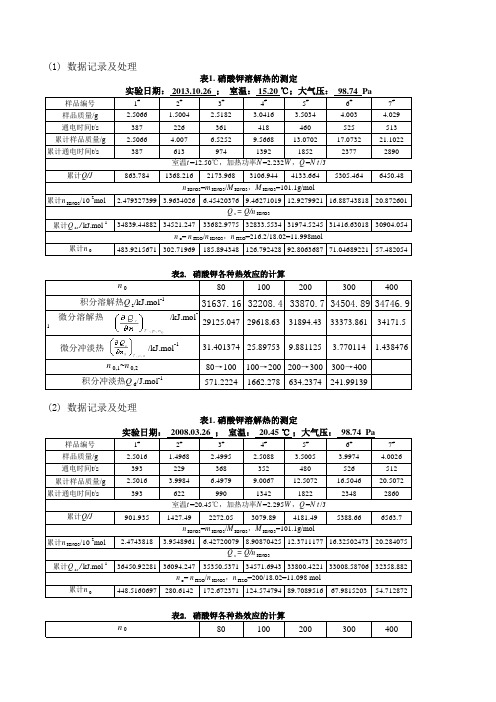
样品编号1#2#3#4#5#6#7#样品质量/g 2.5066 1.5004 2.5182 3.0416 3.5034 4.003 4.029通电时间t/s 387226361418460525513累计样品质量/g 2.5066 4.007 6.52529.566813.070217.073221.1022累计通电时间t/s3876139741392185223772890累计Q/J 863.7841368.2162173.9683106.9444133.6645305.4646450.48累计n KNO3/10-2mol 2.479327399 3.9634026 6.454203769.4627101912.927992116.8874381820.872601累计Q s s /kJ.mol -134839.4488234521.24733682.977532833.553431974.524531416.6301830904.054累计n 0483.9215671302.71969185.894348126.79242892.806368771.0468922157.4820548010020030040031637.1632208.433870.734504.8934746.980→100100→200200→300300→400571.22241662.278634.2374241.99139样品编号1#2#3#4#5#6#7#样品质量/g 2.5016 1.4968 2.4995 2.5088 3.5005 3.9974 4.0026通电时间t/s 393229368352480526512累计样品质量/g 2.5016 3.9984 6.49799.006712.507216.504620.5072累计通电时间t/s3936229901342182223482860累计Q/J 901.9351427.492272.053079.894181.495388.666563.7累计n KNO3/10-2mol 2.47438183.95489616.427200798.9087042512.371117716.3250247320.284075累计Q s s /kJ.mol -136450.9228136094.24735350.537134571.694333800.422133008.5870632358.882累计n 0448.5160697280.6142172.672371124.57479489.708951667.981520354.7128728010020030040034171.51.43847633373.8613.77011431894.439.88112529618.6325.8975329125.04731.401374n o = n H2O /n KNO3,n H2O =200/18.02=11.098 moln 0(2) 数据记录及处理表1. 硝酸钾溶解热的测定实验日期: 2008.03.26 ; 室温: 20.45 ℃ ;大气压: 98.74 Pa室温t =20.45℃,加热功率N =2.295W ,Q =N t /J n KNO3=m KNO3/M KNO3,M KNO3=101.1g/molQ s = Q/n KNO3n o = n H2O /n KNO3,n H2O =216.2/18.02=11.998moln 0积分溶解热Q s /kJ.mol -1n 0,1~n 0,2积分冲淡热Q d /J.mol-1微分溶解热/kJ.mol -1微分冲淡热 /kJ.mol -1(1) 数据记录及处理表1. 硝酸钾溶解热的测定实验日期: 2013.10.26 ; 室温: 15.20 ℃;大气压: 98.74 Pa室温t =12.50℃,加热功率N =2.232W ,Q =N t /J n KNO3=m KNO3/M KNO3,M KNO3=101.1g/molQ s = Q/n KNO333473.6734058.135607.836174.4836395.180→100100→200200→300300→400584.4341549.652566.7199220.66232样品编号1#2#3#4#5#6#7#样品质量/g 2.5044 1.5068 2.5079 2.5061 3.5068 4.0003 4.0129通电时间t/s 373219356344457505485累计样品质量/g 2.5044 4.0112 6.51919.025212.53216.532320.5452累计通电时间t/s3735929481292174922542739累计Q/J 856.7811359.8242177.5562967.7244017.4535177.4386291.483累计n KNO3/10-2mol 2.477151335 3.9675569 6.448170138.9270029712.395647916.3524233420.321662累计Q s s /kJ.mol -134587.349934273.58633770.138833244.348832410.189831661.5946830959.491累计n 0448.0146143279.71874172.110844124.31943989.531423667.8676167354.6116768010020030040032137.8432734.933959.634332.3834521.880→100100→200200→300300→400597.101471224.699372.733189.38388样品编号1#2#3#4#5#6#7#样品质量/g 2.5044 1.5068 2.5079 2.5061 3.5068 4.0003 4.0129通电时间t/s 373219356344457505485累计样品质量/g 2.5044 4.0112 6.51919.025212.53216.532320.5452累计通电时间t/s3735929481292174922542739累计Q/J856.7811359.8242177.5562967.7244017.4535177.4386291.483微分冲淡热 /kJ.mol-1微分溶解热 /kJ.mol -1 微分冲淡热 /kJ.mol -1微分溶解热 /kJ.mol -135851.541.35900133932.851.47227335161.3653.377052333592.9282.464833733831.038.88365132810.425.74612531511.9825.461330272.8924.6205330771.78233.77365729262.18335.945768(4) 数据记录及处理表1. 硝酸钾溶解热的测定实验日期: 2008.03.26 ; 室温: 25.39 ℃ ;大气压: 98.74 Pa室温t =25.39℃,加热功率N =2.297W ,Q =N t /Jn o = n H2O /n KNO3,n H2O =200/18.02=11.098 moln 0积分溶解热Q s /kJ.mol -1n 0,1~n 0,2积分冲淡热Q d /J.mol-1(3) 数据记录及处理表1. 硝酸钾溶解热的测定实验日期: 2008.03.26 ; 室温: 25.39 ℃ ;大气压: 98.74 Pa室温t =25.39℃,加热功率N =2.297W ,Q =N t /J n KNO3=m KNO3/M KNO3,M KNO3=101.1g/molQ s = Q/n KNO3积分溶解热Q s /kJ.mol-1n 0,1~n 0,2积分冲淡热Q d /J.mol -1累计n KNO3/10-2mol 2.477151335 3.9675569 6.448170138.9270029712.395647916.3524233420.321662累计Q s s/kJ.mol-134587.349934273.58633770.138833244.348832410.189831661.5946830959.491累计n0448.0146143279.71874172.110844124.31943989.531423667.8676167354.6116768010020030040032137.84432734.94533959.64534332.377934521.7680→100100→200200→300300→400597.101471224.6994372.73304189.38388累计n0481.4`185.23126.8592.7570.9957.48累计Q s s/kJ.mol-136968.236714.236274.135825.535236.334659.834049.58010020030040031639.45332210.77433873.48434507.990734750.1280→100100→200200→300300→400 571.321741662.7102634.50625242.133********.34 1.439459微分溶解热 /kJ.mol-1微分冲淡热 /kJ.mol-1微分溶解热 /kJ.mol-1微分冲淡热 /kJ.mol-133376.36953.772070733932.851.47227331896.5589.884631633592.92782.4648336729620.52725.90246832810.425.746125429126.94631.40633730272.89224.620532n0积分溶解热Q s/kJ.mol-1n0,1~n0,2积分冲淡热Q d/J.mol-1n o= n H2O/n KNO3,n H2O=200/18.02=11.098 moln0积分溶解热Q s/kJ.mol-1n0,1~n0,2积分冲淡热Q d/J.mol-129262.18335.945768n KNO3=m KNO3/M KNO3,M KNO3=101.1g/molQ s= Q/n KNO3PaPaPaPa。
溶解热的测定实验报告

溶解热测定姓名 学号 班级 实验日期1 实验目的(1)了解电热补偿法测定热效应的基本原理。
(2)用电热补偿法测定硝酸钾在水中的积分溶解热,通过计算或作图求出硝酸钾在水中的微分溶解热、积分溶解热和微分冲淡热。
(3)掌握用微机采集数据、处理数据的实验方法和实验技术。
2 实验原理溶解热:恒温恒压下,物质的量为2n 的溶质溶于物质的量为1n 的溶剂(或溶于某浓度溶液)中产生的热效应,用Q 表示。
积分溶解热:恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用s Q 表示。
微分溶解热:恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以12nn Q ⎪⎪⎭⎫⎝⎛∂∂表示。
冲淡热:恒温恒压下,一定量的溶剂A 加到某浓度的溶液使之稀释所产生的热效应。
积分冲淡热:恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液的过程中产生的热效应,以d Q 表示。
微分冲淡热:恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以21n n Q ⎪⎪⎭⎫⎝⎛∂∂或20n s n Q ⎪⎪⎭⎫ ⎝⎛∂∂表示。
它们之间关系可表示为:s Q n Q =2 令021n n n= 21002n s n s n Q n n Q Q ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎪⎭⎫ ⎝⎛∂∂= ()()0201n s n s d Q Q Q -=积分溶解热s Q 可由实验测得,其他三种热效应则可通过0n Q s -曲线求得,曲线某点的切线的斜率为该浓度下的摩尔微分稀释热,切线与纵坐标的截距,为该浓度下的摩尔微分溶解热(即OC )。
显然,图中A 点的摩尔溶解热与B 点的摩尔溶解热之差为该过程的摩尔积分稀释热(即BE )。
欲求溶解过程的各种热效应,应测定各种浓度下的摩尔积分溶解热。
实验中采用累加的方法,先在纯溶剂中加入溶质,测出溶解热,然后在这溶液中再加入溶质,测出热效应,根据先后加入溶质总量可求出,各次热效应总和即为该浓度下的溶解热。
溶解热的测定实验报告

溶解热的测定 实验报告姓名/学号:何一白/2012011908 班级:化22 同组实验者姓名:苏剑晓 实验日期:2014年12月4日 提交报告日期:2014年12月10日带实验的老师姓名:王溢磊1 引言(简明的实验目的/原理)1.1 实验目的1.测量硝酸钾在不同浓度水溶液的溶解热,求硝酸钾在水中溶解过程的各种热效应。
2。
掌握量热装置的基本组合及电热补偿法测定热效应的基本原理。
3。
复习和掌握常用的测温技术.1。
2 实验原理物质溶于溶剂中,一般伴随有热效应的发生。
盐类的溶解通常包含着几个同时进行的过程:晶格的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等。
热效应的大小和符号决定于溶剂及溶质的性质和它们的相对量。
在热化学中,关于溶解过程的热效应,需要了解以下几个基本概念。
溶解热 在恒温恒压下,溶质B 溶于溶剂A (或溶于某浓度溶液)中产生的热效应,用sol H ∆表示。
摩尔积分溶解热 在恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用sol m H ∆表示.sol sol m BHH n ∆∆=(1) 式中, B n 为溶解于溶剂A 中的溶质B 的物质的量。
摩尔微分溶解热 在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以,,()A sol T P n B H n ∂∆∂表示,简写为()A sol n BHn ∂∆∂。
稀释热 在恒温恒压下,一定量的溶剂A 加到某浓度的溶液中使之稀释,所产生的热效应。
摩尔积分稀释热 在恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液,这个过程产生的热效应,以dil m H ∆表示。
21dil m sol m sol m H H H ∆=∆-∆(2)式中,2sol m H ∆、1sol m H ∆为两种浓度的摩尔积分溶解热。
摩尔微分稀释热 在恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以,,()B sol T P n A Hn ∂∆∂表示,简写为()B sol n AHn ∂∆∂. 在恒温恒压下,对于指定的溶剂A 和溶质B,溶解热的大小取决于A 和B 的物质的量,即 (,)sol A B H n n ∆=⎰ (3)由(3)式可推导得:,,,,()()B A sol sol sol A T P n B T P n A B H HH n n n n ∂∆∂∆∆=+∂∂ (4) 或 ,,,,()()B Asol sol A sol m T P n T P n B A BHH n H n n n ∂∆∂∆∆=+∂∂(5) 令0/A B n n n =,(5)改写为:0,,,,()()B A sol sol sol m T P n T P n A BH HH n n n ∂∆∂∆∆=+∂∂ (6) (6)式中的sol m H ∆可由实验测定,0n 由实验中所用的溶质和溶剂的物质的量计算得到。
溶解热的测定(KNO3溶解热的测定)

I=
(A); U=
(V); IU=
(W)
i 1 2 3 4 5 6 7 8
【思考问题】 1.本实验的装置是否可测定放热反应的热效应?可否用来测定液体的比 热、水化热、生成热及有机物的混合等热效应? 2.对本实验的装置、线路你有何改进意见?
swc-ⅡD型数字式精密温度计的使用方法
SWC-ⅡD智能数字恒温控制器使用方法: 1、将传感器置于介质中,电源开关置于“开”。观察显示屏上温度 与温差的读数。 2、当温度与温差的读数达到平衡的时候,按下采零键,当温差的读 数显示为0.000的时候,按下锁定键。 3、时间的设定。按下向上箭头,使读数为15秒。松开按纽,读数开 始倒记时。当到达0时,蜂鸣器鸣叫,温差读数保持2秒不变,此时记下 读数即可。
显示“0C”表 明仪器处于温度测量测量状态. (2)将面板“测量-保持”按钮置于测量位置。 3.温差测量 (1)将面板“温度-温差”按钮置于“温差”位置,此时显示器最末
尾显示“0”,表明仪器处于温差测量测量状态. (2)将面板“测量-保持”按钮置于测量位置。 (3)按被测物的实际温度调节“基温选择”,使读数的绝对值尽可能
本实验装置除测定溶解热外还可以用来测定中和热水化热生成热及液态有机物的混合热等总效应但要根据需要设计合适的反应热如中和热的测定可将溶解热装置的漏斗部分换成一个碱贮存器以便将碱液加入酸液可以直接从瓶口加入碱贮存器下端为一胶塞混合时用玻璃棒捅破也可以为涂凡士林的毛细管混合时可用吸耳球吹气压出
KNO3溶解热的测定
图Ⅲ-2-1 QS—n0关系图 由图Ⅲ-2-1可见,欲求溶解过程的各种热效应,首先要测定各种浓度下 的积分溶解热,然后作图计算。
一般量热计由数字式精密温度计、搅拌器、杜瓦瓶、加样漏斗和加 热器等组成。
物理化学实验报告-溶解热的测定

溶解热 Q:在恒温、恒压下,物质得量为 n2 得溶质溶于物质得量为 n1得溶剂(或溶于某浓 度得溶液)中产生得热效应。
积分溶解热 Qs:在恒温、恒压下,1mol 溶质溶于物质得量为 n1得溶剂中产生得热效应.
微分溶解热 得热效应.
:在恒温、恒压下,1mol 溶质溶于某一确定浓度得无限量得溶液中
冲淡热:在恒温、恒压下,物质得量为 n1 得溶剂加入到某浓度得溶液中产生得热效应。
效应得计算通过累加,并使用 excel 软件进行计算.
加入序 1
23Leabharlann 4567
8
号
加 入 得 0 、 0 0 、 0 1 0、0205 0、02 0、035 0 、 0 、 0 3 0、0113
得 27525 3960
94
9307 050
039420 9417 56
n/mol
溶 解 得 0、02 0 、 0、0620 0 、 0 9 0、1264 0、16 0 、 2 0 0、21
其中积分溶解热 可以直接由实验测定,其她三种可以由
曲线求得。
欲求溶解过程中得各种热效应,应先测量各种浓度下得得积分溶解热。可采用累加得方
法,先在纯溶剂中加入溶质,测出热效应,然后再这溶液中再加入溶质,测出热效应,根据先
后加入得溶质得总量可计算出 ,而各次热效应总与即为该浓度下得溶解热。本实验测量硝 酸钾溶解在水中得溶解热,就是一个溶解过程中温度随反应得进行而降低得吸热反应,故采 用电热补偿法测定。先测定体系得初始温度 T,当反应进行后温度不断降低时,由电加热法 使体系复原到起始温度,根据所耗电能求出热效应Q。 3、仪器与试剂 反应热测量数据采集接口装置: NDRH-1型,温度测量范围0~40℃,温度测量分辨率 0、001℃,电压测量范围0~20V, 电压测量分辨率0、01V,电流测量范围 0~2A,电流测量分辨率0、01A。 精密稳流电源:YP-2B 型。 微机、打印机。 量热计(包括杜瓦瓶,搅拌器,加热器,搅拌子). 称量瓶 8 只,毛笔,研钵。 硝酸钾(A、R、) 4、实验操作 (1)取 8 个称量瓶,分别编号。
溶解热的测定实验报告

溶解热的测定实验报告一、实验目的1、掌握量热法测定物质溶解热的原理和方法。
2、了解温度和浓度对溶解热的影响。
3、学会使用数字贝克曼温度计和恒温槽等仪器。
二、实验原理溶解热是指在一定温度和压力下,溶质溶解于溶剂中产生的热效应。
溶解热分为积分溶解热和微分溶解热。
积分溶解热是指在定温定压下,把 1 摩尔溶质溶解在一定量的溶剂中所产生的热效应。
微分溶解热是指在定温定压下,在大量溶液中加入 1 摩尔溶质所产生的热效应。
在本实验中,采用绝热式量热法测定硝酸钾在水中的溶解热。
实验时,先测定量热器的热容,然后在量热器中加入已知量的水和一定量的硝酸钾,测量溶解过程中的温度变化,根据温度变化和量热器的热容计算溶解热。
量热器的热容可以通过已知溶解热的物质(如氯化钾)来测定。
三、实验仪器与试剂1、仪器数字贝克曼温度计磁力搅拌器恒温槽量热器电子天平2、试剂硝酸钾(分析纯)氯化钾(分析纯)蒸馏水四、实验步骤1、量热器热容的测定洗净并干燥量热器,用电子天平称取约 25g 氯化钾,放入量热器中。
用量筒量取 200ml 蒸馏水,倒入量热器中,插入搅拌棒,盖好盖子。
将数字贝克曼温度计插入量热器,启动磁力搅拌器,搅拌均匀。
观察温度计示数,待温度稳定后,记录初始温度 T1。
迅速加入氯化钾,同时启动秒表,继续搅拌,观察温度变化。
当温度升至最高点并稳定后,记录终止温度 T2。
根据氯化钾的溶解热(已知)和温度变化,计算量热器的热容 C。
2、硝酸钾溶解热的测定洗净量热器,用电子天平称取约 5g 硝酸钾。
用量筒量取 200ml 蒸馏水,倒入量热器中,插入搅拌棒,盖好盖子。
将数字贝克曼温度计插入量热器,启动磁力搅拌器,搅拌均匀。
观察温度计示数,待温度稳定后,记录初始温度 T3。
迅速加入硝酸钾,同时启动秒表,继续搅拌,观察温度变化。
当温度降至最低点并稳定后,记录终止温度 T4。
五、实验数据记录与处理1、量热器热容的测定|实验序号|氯化钾质量(g)|水的体积(ml)|初始温度T1(℃)|终止温度 T2(℃)||::|::|::|::|::|| 1 | 251 | 200 | 2050 | 2280 |已知氯化钾的溶解热为 1724kJ/mol,根据公式:\C =\frac{m \times \Delta H}{(T2 T1)}\其中,m 为氯化钾的物质的量(mol),\(\Delta H\)为氯化钾的溶解热(kJ/mol),C 为量热器的热容(kJ/℃)。
物化实验报告溶解热的测定_KCl、KNO3资料

华南师范大学实验报告学生姓名 学 号____ 专 业 化学(师范) 年级、班级___ 课程名称 物理化学实验 实验项目 实验类型 □验证 □设计 □综合 实验时间 年 月 日 实验指导老师 实验评分 【实验目的】1. 设计简单量热装置测定某物质在水中的积分溶解热。
2. 复习和掌握常用的量热技术与温度测定与校正方法。
3. 由作图法求出该物质在水中的摩尔稀释焓、微分溶解焓、微分稀释焓。
【实验原理】溶解热,即为一定量的物质溶解于一定量的溶剂中所产生的热效应。
溶解热除了与溶剂量及溶质量有关外,还与体系所处的温度及压力有关。
溶解热分为积分溶解热和微分溶解热。
积分溶解热是指在等温等压下把1mol 溶质溶解在一定量的溶剂中时所产生的热效应。
它是溶液组成的函数,若形成溶液的浓度趋近于零,积分溶解热也趋近于一定值,称为无限稀释积分溶解热。
积分溶解热是溶解时所产生的热量的总和,可由实验直接测定。
微分溶解热是等温等压下,在大量给定浓度的溶液里加入1mol 溶质时所产生的热效应,它可以表示为0,,)(np T sol n H∂∆∂,因溶液的量很大,所以尽管加入1mol 溶质,浓度仍可视为不变。
微分热难以直接测量,但可通过实验,用间接的方法求得。
溶解热的测量可通过绝热测温式量热计进行,它是在绝热恒压而且不做非体积功的条件下,通过测定量热系统的温度变化,而推算出该系统在等温等压下的热效应。
本实验采用标准物质法进行量热计能当量的标定。
利用1molKCl 溶于200mL 水中的积分溶解热数据进行量热计的标定。
当上述溶解过程在恒压绝热式量热计中进行时,可设计如下途径:在上述途径中,ΔH1为KCl(s)、H2O(l)及量热计从T1等压变温至T2过程的焓变,ΔH2则为在T2温度下,物质的量为n1 mol的KCl(s)溶于n2 mol H2O(l)中,形成终态溶液的焓变。
因为ΔH=ΔH1 +ΔH2=0ΔH2 =-ΔH1所以ΔH1=[ n1 C p,m(KCl,s)+ n2C p,m(H2O,l)+K]×(T2-T1)ΔH2=n1Δsol H mK=-[n1 C p,m(KCl,s)+ n2C p,m(H2O,l)]+ n1Δsol H m/( T2-T1)=-[m1 C p (KCl,s)+ m2 C p (H2O,l)]+ m1Δsol H m/M1ΔT (1)式中,m1、m2分别为溶解过程加入的KCl(s)和H2O(l)的质量;C p,m为物质的恒压比热容;C p (KCl,s)=0.699kJ/(kg·K),C p (H2O,l)=4.184 kJ/(kg·K);M1为KCl的摩尔质量;ΔT= T2-T1,即为溶解前后系统温度的差值;Δsol H m为1mol KCl溶解于200mL H2O的积分溶解热,其不同温度下的积分溶解热值见附录。
物化实验报告:溶解热的测定-KCl、KNO3

物化实验报告:溶解热的测定-KCl、KNO3华南师范大学实验报告课程名称 物理化学实验 实验项目 溶解热的测定【实验目的】1.用量热计简单测定硝酸钾在水中的溶解热。
2.掌握贝克曼温度计的调节和使用。
【实验原理】盐类的溶解往往同时进行着两个过程:一是晶格破坏,为吸热过程;二是离子的溶剂化,为放热过程。
溶解热是这两种热效应的总和。
最终是吸热还是放热,则由这两种热效应的相对大小来决定。
本实验在定压、不做非体积功的绝热体系中进行时,体系的总焓保持不变,根据热平衡,即可计算过程所涉及的热效应。
T C C W C W W M H m sol ∆⋅++-=∆][322111)( (3.1)式中: m Sol H ∆为盐在溶液温度和浓度下的积分溶解热,单位:kJ ·mo1–1;1W 为溶质的质量,单位:kg ;T ∆为溶解过程的真实温差,单位:K ;2W 为水的质量,单位:kg ;M 为溶质的摩尔质量,单位:kg ·mo1–1;21C C 、分别为溶质和水的比热,单位:11--⋅K kg kJ ;温度3C 为量热计的热容(指除溶液外,使体系升高1℃所需要的热量) ,单位:kJ 。
图3.1溶解热测定装配图实验测得W 1、W 2、ΔT 及量热计的热容后,即可按(3.1)式算出熔解热m Sol H 。
【仪器与药品 】溶解热测量装置一套(如图3.1所示);500ml 量筒一个;KCl(A.R.) ;KNO 3(A.R.)【实验步骤】1.量热计热容的测定:本实验采用氯化钾在水中的溶解热来标定量热计热容3C 。
为此,先在干净的量热计中装入500m1蒸馏水,将与贝克曼温度计接好的传感器插入量热计中,放在磁力搅拌器上,启动搅拌器, 保持60-90转/分钟的搅拌速度,此时,数字显示应在室温附近,至温度变化基本稳定后,每分钟准确记录读数一次,连续8次后,打开量热计盖,立即将称量好的10克氯化钾(准确至0.01克)迅速加入量热计中,盖上盖,继续搅拌,每分钟记录一次读数,读取12次即可停止。
硝酸钾溶解度的测定实验报告

硝酸钾溶解度的测定实验报告硝酸钾是一种常用的无机化合物,可溶于水中形成透明无色溶液。
本实验的目的是通过溶解度的测定,了解硝酸钾在不同温度下的溶解度变化规律,并探讨溶解度与温度之间的关系。
实验原理:硝酸钾的溶解度是指在特定温度下,单位溶剂中能溶解的硝酸钾的质量。
溶解度与温度密切相关,一般来说,随着温度的升高,固体物质在溶液中的溶解度会增加。
实验仪器与试剂:仪器:天平、热水浴、试管架、玻璃棒、滴管等;试剂:硝酸钾、去离子水。
实验步骤:1. 准备一定质量的硝酸钾固体,用天平称量并记录其准确质量。
2. 取一小量去离子水放入试管中,再加入少量的硝酸钾固体,将试管置于水浴中加热。
3. 不断搅拌试管中的溶液,直到固体完全溶解为止,记下此时溶液的温度,并等待温度稳定。
4. 用滴管将溶液逐滴加入试管中,每滴加一滴,直到出现沉淀。
记录加入的滴数。
5. 重复以上步骤,分别在不同温度下进行实验,得到一组完整的溶解度数据。
实验结果与讨论:根据实验数据,我们可以得到硝酸钾在不同温度下的溶解度值。
通过对实验结果的分析,我们可以发现溶解度随温度的升高而增加的趋势。
这是因为随着温度的上升,溶液中的溶剂分子会增加动能,使得溶解作用更为剧烈,固体物质的溶解度增加。
实验中还可以得到另一个结论,即溶解度的测定可以通过观察溶液中是否有沉淀来进行。
当溶液中的溶质含量达到饱和时,任何微小的结晶都可能导致溶液出现沉淀。
因此,当观察到第一个沉淀结晶时,说明溶液已经达到了饱和状态,此时的滴数可以作为该温度下硝酸钾的溶解度值。
总结:通过本实验,我们了解了硝酸钾溶解度与温度之间的关系,并探讨了溶解度的测定方法。
实验表明,硝酸钾的溶解度随着温度的升高而增加。
这对于理解溶解度与温度的关系有重要的意义,也为相关工业过程提供了参考数据。
硝酸钾溶解热的测定

物理化学实验报告题目:电池电动势测热力学常数作者刘语嫣届别 2 0 0 9 届学院化学化工学院专业制药工程指导教师张旭学实验日期2010年 10月20日目录摘要关键字前言实验部分1.实验目的2.实验原理3.实验仪器及试剂4.实验装置图5.实验步骤6.实验数据记录及处理7.实验误差分析参考文献电池电动势测热力学常数摘要:本实验利用对消法测定了电池Ag -AgCl│NaCl(m1)║AgNO3(m2)|Ag 的电动势,求AgCl的溶度积Ksp,并根据不同温度下电池电动势的变化求得电池的相关热力学函数,测定了其在不同温度下的电动势并计算热力学函数变化值△G298.△ H298、△S298。
关键字:电池;电动势;热力学函数;前言:电池电动势的测量,实质上是一种特定的电池开路电压的测量。
但是,任何电动势测量仪测量时均不可避免有电流通过电池,不过一般电池都有电动势的测量方法在物理化学研究中具有重要的实际意义。
通过电池电动势的测量可以获得氧化还原体系的许多热力学函数,如平衡常数、电解质活度及活度系数、离解常数、溶解度、络合常数、酸碱度以及某些热力学函数改变量等。
本实验采用补偿法测定电池电动势。
一实验部分1.1实验目的1.1.1巩固电位差计测定原电池电动势的原理和方法,掌握电动势法测定化学反应热力学函数变化值的有关原理和方法1.1.2根据可逆热力学体系的要求设计可逆电池,测定其在不同温度下的电动势值,计算电池反应的热力学函数∆G、∆S及∆H 。
1.1.3了解银-氯化银电极的制备方法。
1.2 实验原理原电池是由两个“半电池”组成,每一个半电池中包含一个电极和相应的电解质溶液。
不同的半电池可以组成各种各样的原电池。
电池反应中正极起还原作用,负极起氧化作用,而电池反应是电池中两个电极反应的总和,其电动势为组成该电池的两个半电池的电极电势的代数和。
通过电池电动势的测量可以获得氧化还原体系的许多热力学函数,如平衡常数、电解质活度及活度系数、离解常数、溶解度、络合常数、酸碱度以及某些热力学函数改变量等。
