气固相反应
气固相反应

气固相反应
气固相反应是指在固体和气体之间发生的化学反应。
气固相反应特别常见,几乎所有的日常生活中都会接触到这种反应。
此外,这种反应也是工业上重要的化学反应,用于生产固体原料和固体产品,如水泥、石灰、硅胶、热塑性塑料等。
气固反应是一种复杂的化学反应,其反应机理包括物态转变和溶解反应,还有交叉聚合反应。
其中,物态转变主要通过温度变化和压力变化来实现,而溶解反应主要是由溶剂和溶质的相互作用实现的,其中溶剂可以是液体、固体或气体。
交叉聚合反应则是指当两种或两种以上的分子相互作用时,会产生新的分子链,从而产生特定的结构和物质。
气固反应的速率主要由温度和压力来决定,通常情况下,温度越高,反应速率越快。
另外,压力的增加也会增加反应的速率,这是因为压力的增加会加快分子结构的转变。
气固反应也受到许多其它因素的影响,如溶剂、活性剂、光照、表面活性剂等,它们可以改变反应的速率,从而影响气固反应产物的形成和性质。
气固反应的用途也很广泛。
它可以用来制备各种固体原料,如水泥、石灰、硅胶、热塑性塑料、硅酸铝复合材料等,也可以用来制备各种固体产品,如电子器件、冰淇淋、冰糕、饮料等。
此外,气固反应还可以用来处理化学垃圾,使其成为固体原料,通过这种方式将有害物质转化为可以安全处理的物质。
总之,气固反应是几乎存在于我们每一天生活中的常见反应,不仅在日常生活中有着广泛的用途,而且在工业生产中也是重要的反应。
通过本文,我们可以更加深入地了解气固反应,掌握其反应机理和应用,为科学研究提供借鉴。
气固相反应动力学
例如是,可天逆然吸气热的反蒸应汽,转提化高反温应度有C利H于4提高H反2O应速率C并O提高H甲2烷的平衡转化率,
但考虑到设备材质等条件限制,一般转化炉内温度小于800-850℃。
第五节 温度对反应速率的影响及最佳温度
3)可逆放热反应
rA
k1
f1 (
y)
k2
f2
(
y)
k1
f1 (
y ) 1
f1 (
y ) 1
k2 k1
f2 ( y) f1( y)
k1
f1 (
y ) 1
f2 ( y)
K
y
f1( y)
1)不可逆反应:只有正反应,上式中中括号部分为1。由于反应速率常数随温度 的升高而升高,因此,无论是放热反应还是吸热反应,都应该在尽可能高的 温度下进行,以获得较大的反应速率,但在实际生产中,要考虑以下问题:
Ea Ea0 A
Ed
Ed0
A
Ea0,Ed0,,为常数
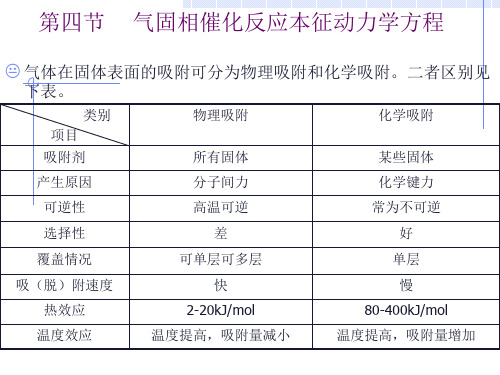
第四节 气固相催化反应本征动力学方程
将吸附和脱附活化能代入净吸附速率的表达式中:
r
ra
rd
A pA
f
A
exp
Ea0 RgT
A
RgT
k
'
f
'
A
exp
E2 RgT
由条件
rA T
y
0,对上式求导,使其等于零,并以Top代替T
f1( y)k10
E1 RgTo2p
《气固相反应动力学》课件

目录
• 气固相反应动力学概述 • 气固相反应动力学的基本原理 • 气固相反应的动力学实验研究 • 气固相反应的动力学模拟研究 • 气固相反应动力学的应用研究 • 总结与展望
01
气固相反应动力学概述
定义与特点
定义
气固相反应动力学是研究气体与固体 物质之间反应速率和反应机制的学科 。
科学研究
气固相反应动力学是化学反应工 程和物理化学等领域的重要分支 ,对于深入理解反应机制和探索 新反应路径具有重要意义。
气固相反应动力学的发展历程
早期研究
早在19世纪,科学家就开始研究气固相反应,初期主要关注燃烧和氧 化等简单反应。
理论模型建立
随着实验技术的发展,20世纪初开始建立气固相反应的动力学模型, 如扩散控制模型和化学反应控制模型等。
工业粉尘治理
通过气固相反应技术对工业生产过程中产生的粉尘进行控制和处理 ,减少空气污染。
土壤修复
利用气固相反应技术对受污染的土壤进行修复,如通过化学氧化还原 反应降低土壤中的重金属含量。
在新材料研发中的应用
纳米材料制备
气固相反应技术可用于制备纳米材料,如纳米碳管、纳米氧化物 等,具有广泛的应用前景。
实验技术进步
20世纪中叶以后,实验技术的进步为气固相反应动力学研究提供了更 多手段,如激光诱导荧光、质谱仪等技术的应用。
当前研究热点
目前,气固相反应动力学的研究重点包括新型催化剂的设计与制备、 反应机理的深入研究以及计算机模拟在动力学研究中的应用等。
02
气固相反应动力学的基本 原理
化学反应动力学基础
跨学科合作
气固相反应动力学涉及多个学科领域,需要加强跨学科合 作,促进多学科交叉融合,共同推动气固相反应动力学的 发展。
第五章 气-固相催化反应动力学

第五章 气-固相催化反应动力学本章核心内容:介绍了气-固相催化反应的特点、固体催化剂的特征参数和均匀及不均匀吸附等温方程的要点,在此基础上,阐述了不同控制步骤的气-固相催化反应本征动力学方程。
本章的重点在于讨论有关固体催化剂的反应-传质-传热耦合的宏观过程、宏观动力学方程的建立及求解方法。
前已述及,化学反应可分为均相反应和非均相反应两大类。
均相反应动力学因无相间传质传热阻力属于本征动力学范畴,而气固两相催化反应存在相间传递阻力,使可测的主体气流温度和浓度与实际反应值不同,为了描述真实的反应速率,进行有效的气固催化反应器设计,从第五章开始,将学习和讨论气固非均相反应动力学及其反应器设计内容。
本章从它的机理方程入手,详细讨论气固相催化反应宏观动力学规律。
5-1 气-固相催化反应 5-1-1 气-固相催化反应概述所谓气固相催化反应是指在反应条件下,在固体催化剂表面上进行的、反应物和产物均呈气态的一类化学反应。
例如,氮气和氢气在固体铁催化剂表面上进行的合成反应,二氧化硫在固体钒催化剂表面上转化为三氧化硫的反应,合成气在铜基催化剂表面上进行合成甲醇的反应等等,都属于气固相催化反应。
这一类型的催化反应在化工生产中所占的份额相当大,因此气固相催化反应动力学研究及其反应器设计等相关内容成为化学反应工程学的核心内容之一。
气固相催化反应的最大特点莫过于固体催化剂表面这个反应平台,它不仅可以改变反应路径、降低反应活化能,加快反应速率。
因此,在定义气固相催化反应速率时,离不开固体催化剂表面积S 这个参变量的引入,即dtdn S r ii 1±= (5-1) 固体催化剂表面积是固体催化剂的重要性能参数之一,对于特定的催化剂而言,单位质量催化剂所具有的表面积几乎是一个常量,两者之间具有高度的对应关系,所以在定义气固相催化反应速率时,也常常用固体催化剂质量W 替代式(5-1)中的S。
气-固相催化反应动力学研究的目的就是要建立气固相催化反应动力学方程,为气固相催化反应器的开发设计、选型、优化操作与控制提供理论依据。
反应工程第二章气固相催化反应宏观动力学

Ds
2 2
Knudsen扩散系数
DK
2 3
ra
V
9700ra
T / M cm2 / s
V
8RT /( M )
2-5 气体中的分子扩散
• 对于双组分气体,相对于体质mol中心的扩散通量 (单位时间,单位截面积上通过的物质量)其规律
可以用Fickˊs law来表达:(扩散通量与浓度梯度成
正比) J A DABgrad CA 或 J A DABCT grad yA
微孔,孔壁就是反应面。反应物只有进入颗粒内部才能起反应。 本节研究气体在颗粒内的扩散过程,这是气-固相催化反应宏
观动力学的重要内容之一。 1.气体进入颗粒内部的传质方式 颗粒外表面和颗粒内部具有压力差,但由于颗粒较小(一般为
d=3~5mm),压力差忽略不计。在没有压力差的情况下气体 进入颗粒内部的传质方式是分子热运动,分子热运动的结果就是 发生分子扩散。
2-3 催化反应阶段的判 别
(rA)g = ks f (CAs )Si =kGSe (CAg CAs )
(rA )g =
CAg
C
* A
1 1
kG Se ksSi
1。本征动力学控制
1
1 且 1
kGSe ksSi
2。内扩散强烈影响
1
1 且 1
kG Se ksSi
3。外扩散控制
1
1 且 1
kGSe ksSi
第二节 催化剂颗粒内气体的扩散
在颗粒内部由于两种碰撞不断改变分子运动的方向,使分子 停滞不前。
由于分子扩散的阻力,越到颗粒中心处,分子数目就越少, 反映在浓度上,该组分的浓度就越小。
如果分子扩散没有阻力,颗粒外表面处和颗粒内部 的分子 数是相同的,反映在浓度上,CAs=CAc。
气液固相反应动力学

• 气液固相反应动力学概述 • 气液相反应动力学 • 固相反应动力学 • 气液固三相反应动力学 • 气液固相反应动力学应用
01
气液固相反应动力学概述
定义与特点
定义
气液固相反应动力学是研究气液固三 相反应过程中反应速率和反应机制的 学科。
特点
气液固相反应通常涉及多相混合物, 反应过程复杂,影响因素众多,需要 深入研究和理解。
指导反应器设计
了解气液固相反应动力学有助于设计更高效的反应器,提高生产效 率和产品质量。
促进新工艺开发
通过研究气液固相反应动力学,可以发现新的反应路径和机理,促 进新工艺和技术的开发。
02
气液相反应动力学
液相传质过程
扩散
01
物质在液相中的传递主要依靠扩散作用,扩散速率取决于浓度
梯度、分子扩散系数和扩散路径长度。
太阳能利用
太阳能是一种清洁可再生的能源,气液固相反应动力学在太阳能利用领域中用于研究光催 化反应机理和光电转换效率,推动太阳能技术的进步。
核能利用
核能是一种高效能源,气液固相反应动力学在核能利用中用于研究放射性废物的处理和转 化,提高核能利用的安全性和效率。
THANKS
感谢观看
究土壤中污染物的迁移转化规律,为土壤修复技术提供理论依据。
03
废物资源化
通过气液固相反应动力学研究,实现废物的资源化利用,如废弃物的焚
烧、生物质能源转化等,降低环境污染,提高资源利用效率。
在能源领域的应用
燃料燃烧
燃烧是能源转化中的重要环节,气液固相反应动力学研究燃料在燃烧过程中的反应机理和 动力学参数,有助于提高燃烧效率,降低污染物排放。
对流
02
第五章气固相催化反应本征动力学

rd kd exp(h ) kd kd 0 f ( ) exp( Ed0 RT ) h RT
表观吸附速率为 r ra rd ka pA exp(g ) kd exp(h )
平衡时:ka kd
pA
exp[( g h) ]
令
K
A
ka kd
f hg
则
1 f
ln(K A pA )
焦姆金等温吸附方程
令
ka ka0 exp( Ea0 RT ) f ( )
活性 选择性 寿命
催化剂的性能
影响
物理性质: 比表面积; 孔容积; 孔容积分布。
1、比表面积:单位质量的催化剂具有的表面积Sg,m2/g; 影响催化剂的吸附量和活性。
!!!测定表面积的方法是:氮吸附法。
2、孔容积:每克催化剂内部微孔的容积Vg。cm3/g !!!测定孔容积较准确的方法是:氦-汞法。
非活化的,低活化能;活化的, 高活化能。>40kJ/mol
<8kJ/mol
>40kJ/mol
多分子层
单分子层
高度可逆
常不可逆
用于测定表面积、微孔尺寸
用于测定活化中心的面积及阐 明反应动力学规律
2、化学吸附速率的一般表达式
1)吸附方程:
A+σ→A σ
吸附率: A
被A组分覆盖的活性中心数 总的活性中心数
3)提高催化剂的机械强度。
4、催化剂活化:目的是除去吸附和沉积Байду номын сангаас外来杂质。
方法是:1)适度加热驱除易除去的外来杂质; 2)小心燃烧除去顽固杂质; 3)用氢气、硫化氢、一氧化碳或氯化烃作为活化剂
活化催化剂。
5、催化剂的开工和停工
化学反应工程-15-第四章-气固相催化反应本征动力学

四、抑制剂
抑制剂是促进剂的对立物,抑制剂用来降低催化剂对不希望发 生的副反应的催化活性。
4.2.2催化剂的制备
催化剂的活性不仅取决于化学组成,而且与其结构有关。催化剂的 结构特征在很大程度上取决于制备技术。
ka
k10V
exp
Ea0 RT
同时: g
RT
则:ra ka PA exp g A 1
脱附过程:rd
k1' A
k1'0 exp
Ed0 A
RT
A
k1'0 A
exp
Ed0 RT
exp
A
RT
V可认为是常数,令:
kd
k1'0 A exp
Ed0 RT
同时: h
RT
则:rd kd exp h A 2
总速率:r ra rd ka PA exp g A kd exp h A
达到平衡时:r=0,即:
一部分才能碰上空白的活性位,碰撞的几率为f A ;
3、吸附活化能Ea。只有能量大于Ea的气体分子才有可能被吸附, 这种分子占总分子数的分率为:
exp Ea RT
则: ra
k0 PA
f
A
exp
Ea RT
k0为吸附比例常数。
化学脱附速率为 rd 取决于两个因素:
主要的制备方法 ①浸渍法; ②沉淀法; ③离子交换法; ④共混合法; ⑤滚涂法; ⑥溶蚀法; ⑦热溶法; ⑧沥滤法; ⑨络合催化剂的固载化法。
气固相催化反应宏观动力学

气固相催化反应宏观动力学化学反应工程主要研究化学反应器的原理,研究物理因素对化学反应的影响,以研究反应动力学为主要内容,并据此进行工业反应器的设计及放大。
工业中,气固相催化反应十分常见,如SO 2催化氧化、H 2和CO 低压合成甲醇、由乙炔合成醋酸乙烯等,所以气固相催化反应的宏观动力学是教学重点。
但气固相催化反应宏观动力学这部分的知识较难理解,公式复杂,反应速率表达形式多,我们在教学过程中很难理解和掌握。
以下就这部分知识进行说明和分析。
反应动力学有本征动力学和宏观动力学之分。
在气固相催化反应中,反应发生在固体催化剂的内表面,完整的反应步骤有:反应物从气相主体扩散,穿过颗粒外气膜滞流层,达到颗粒外表面;反应物从颗粒外表面沿微孔向颗粒内表面扩散;反应物被催化剂颗粒内表面的活性中心吸附;被吸附的反应物在内表面上发生化学反应;产物由内表面上脱附;产物由微孔内向颗粒外表面扩散;产物由外表面穿过气膜层向气流主体扩散。
因此,完整的反应包含了颗粒外的气相扩散、颗粒内的气相扩散和表面催化反应过程。
而扩散现象的存在必然会对反应速率造成影响。
外扩散是纯传质的物理过程,内扩散与表面催化反应是同时进行的,所有又称“内扩散-反应过程”。
如仅研究表面反应过程,即排除内、外扩散影响下的催化剂表面与所接触的气体间的反应情况的动力学,则为本征动力学。
而将所有扩散影响考虑在内的情况,则为宏观动力学。
宏观反应速率不仅和化学反应本征反应速率有关,而且与过程的扩散速率有关。
如当外扩散为控制步骤时,反应的宏观速率就仅取决于传质扩散速率。
1、反应速率的表达及反应速率常数间的相互关系对气固相催化反应,反应速率的表达可以用体积反应速率、表面积反应速率或质量反应速率,即反应区可以用不同的基准,相应地化学反应速率常数的基准也有很多。
体积反应速率的表达为:dVdF r ii v±= (1)式中反应区体积可以指催化剂颗粒床层的堆体积,或者是床层中催化剂颗粒的体积。
气-固相反应动力学

ra A pA f (A )exp(Ea / RT ), ( A 为A的吸附常数)
ra pA f (A )exp(Ea / RT )
影响化学脱附速率大小的因素有以下两个。
① 化学脱附需要脱附活化能 Ed,只有能量高于Ed的吸附态 分子才能脱附,它们所占百分数为exp(-Ed/RT )。 ② 化学脱附速率与表面覆盖率θA有关,用f ′ (θA )表示, θA 越大,脱附速率越大。
大孔: ra > 25 nm 催化剂内孔径大小不等,而且有一定的分布,用平均孔半径。 平均孔半径的测定:
mg、 S g、 ra、L、 n
内表面积: 孔总容积: 两者相除,得
mg Sg (2 ra L)n
mgVg ( ra 2 L)n
ra 2Vg Sg
(间接可测的量)
2.固体催化剂的活化 (略,自学)
第二章
气-固相催化反应本征及宏观动力学
第一节 催化及固体催化剂
一、催化反应
1.均相催化反应,反应所在场所是反应空间。 催化反应 2.非均相催化反应,反应场所在催化剂表面。
二、固体催化剂
固体催化剂主要是多孔材料,或由多孔材料为载体与担 载在载体表面的活性物质所组成。 工业固体催化剂是由反应和反应器所决定的具有一定形 状的规则颗粒(直径约2 ~ 10 mm) 。催化剂颗粒内有许多孔 径大小不同、分布曲折的孔道,催化剂的活性位置绝对地分 布在催化剂颗粒内的孔道侧壁上(内表面上)。
* bA pA A 覆盖率 A , B 覆盖率 * * 1+bA pA +bB pB
* bB pB B , * * 1+bA pA +bB pB
1 bi pi* , 总空白率 1 i 第i 组分覆盖率 i * 1+ b j p* i 1 1+ b j p j j
气固相反应和反应器分析

煤的气化是将煤转化为气体燃料的过程,通过气化反应将煤中的碳、氢等元素转化为可燃气体,如一 氧化碳、氢气和甲烷等。
硫铁矿烧渣处理
硫铁矿烧渣的生成
硫铁矿烧渣是在硫铁矿的焙烧过程中产 生的固体废弃物,主要成分为铁、硫、 二氧化硅等。
VS
硫铁矿烧渣的处理
通过气固相反应可以将硫铁矿烧渣中的有 价元素转化为可利用的物质,如回收铁、 硫等,同时减少废渣对环境的污染。
03
气固相反应器类型与特点
固定床反应器
总结词
固定床反应器是一种常用的气固相反应器,其特点是固体颗粒在反应器内固定不动,气流通过固体颗粒进行反应。
详细描述
固定床反应器具有结构简单、操作方便、易于控制等优点,适用于多种气固相反应。在固定床反应器中,固体颗 粒作为催化剂或反应物,气流通过催化剂床层进行反应。由于固体颗粒固定不动,因此气流阻力较小,适用于大 规模生产。
应器类型
根据气固相反应的特性和 要求,选择合适的反应器 类型,如固定床、流化床 等。
设计反应器尺寸
根据生产能力和工艺要求, 确定反应器的直径、高度 等尺寸参数。
优化内部构件
合理设计反应器内部的导 流板、分布器、挡板等构 件,以提高气固混合和传 热传质效率。
常见的反应动力学方程有Arrhenius方 程、Eyring方程等,它们可以用来描 述不同条件下的反应速率。
反应动力学模型
反应动力学模型是根据实验数据和理论分析建立起来的,用于描述反应过程和预 测反应结果的数学模型。
常见的反应动力学模型有速率控制模型、扩散控制模型等,它们可以用来指导工 业生产过程和优化反应条件。
数值求解
利用数值方法求解数学模型,得到反应过程的模拟结 果。
反应工程第二版 第四章气固相催化反应本征动力学

• 本章讨论化学动力学过程。
10
固体催化剂
• 固体催化剂由三部分组成,活性组分、 助剂和载体。
• 三者不能截然分开。 • 通常对活性组分的要求: • 具有尽可能高的催化活性,选择性和抗
毒性。 • 通常对载体的要求: • 高强度,高比表面。
化学吸附 强
可高于 沸点温度 接近反应热
19
化学吸附与脱附
• 化学吸附速率的表达
• 活性中心:固体催化剂表面能够与气相 分子发生反应的原子。以符号σ表示。
• 吸附式可以表示为如下型式:
•
A+ σ→A σ
• A-反应物, σ-活性中心, A σ-吸附
了反应物的活性中心
20
吸附率:
A
被A组分覆盖的活性中心数 总活性中心数
11
• 活性组分 • 以金属为主,根据不同的用途,有金属
氧化物及硫化物等等。 • 一个成功的催化剂往往是主催化剂和助
催化剂及载体的完美结合。 • 活性组分的选择,根据目前的知识水平
只能有一个大致的方向,尚不能预先选 择。
12
• 载体 • 以多孔物质为主,如硅藻土、三氧化二
铝等。 • 根据不同的需要,有不同的孔径和比表
26
对双组分吸附:
A组分
A
σ
kaA
Aσ
kdA
吸附速率
raA kaA pAV
脱附速率
rdA kdAA
表观速率:
B组分
B
σ
kaB
Bσ
kdB
吸附速率
raB kaB pBV
脱附速率
rdB kdBB
气固相催化反应的步骤

气固相催化反应的步骤
1. 催化剂预处理:将催化剂进行预处理,以去除表面的杂质和活性物种,并提高催化剂的活性和选择性。
常用的预处理方法包括煅烧、还原和氧化等。
2. 催化剂加载:将经过预处理的催化剂加载到固体底物上,形成催化剂-底物体系。
加载方法可以采用浸渍、沉积或物理吸附等。
3. 底物进料:将气体底物通过气体供给系统导入反应器。
底物可以是单一气体或混合气体,取决于具体反应的要求。
4. 反应发生:底物分子在催化剂表面发生吸附和解析反应。
此过程中,催化剂促进了底物分子之间的化学反应,并降低了反应的活化能,从而提高了反应速率和选择性。
5. 产物分离:反应产物经过催化剂表面的解析,从催化剂表面脱附,并通过分离系统进行分离和收集。
常用的分离方法包括凝固、吸附和脱附等。
6. 催化剂再生:催化剂在反应过程中可能会受到中毒或失活,需要进行再生以恢复催化剂活性。
催化剂再生方法根据具体反应的特点而不同,常用的再生方法包括煅烧、洗涤和修复等。
以上是气固相催化反应的一般步骤,具体情况会因反应种类不同而有所差异。
气固相催化反应过程

气固相催化反应过程
气固相反应本征动力学是研究不受扩散干扰条件下的固体催化剂与其相接触的气体之间的反应动力学。
一般而言,气固相催化反应过程经历一下七个步骤:
①反应组分从流体主体向固体催化剂外表面传递(外扩散过程)
②反应组分从催化剂外表面相催化剂内表面传递(内扩散过程)
③反应组分在催化剂表面的活性中心吸附(吸附过程)
④在催化剂表面上进行化学反应(表面反应过程)
⑤反应产物在催化剂表面上脱附(脱附过程)
⑥反应产物从催化剂内表面向催化剂外表面传递(内扩散过程)
⑦反应产物从催化剂外表面向流体主体传递(外扩散过程)
七个步骤中,第①和第⑦步是气相主题通过气膜与颗粒处表面进行物质传递,称为外扩散过程;第②和⑥步是颗粒内的传质,称为内扩散过程;第③和第④步是在颗粒表面上进行化学吸附和化学脱附的过程;第⑤步是在颗粒表面上进行的表面反应动力学过程。
以上气割步骤是前后串联的:
外扩散内扩散
表面过程
由此可见,气固相催化反应过程是一个步骤过程。
如果其中某一步骤的反应速率与其他各步的反应速率相比要慢得多,以致整个反应速率取决于这一步的反应速率,该步骤就称为反应速率控制步骤。
反应过程达到定态时,各步骤的反应速率应该相等,且过程的反应速率等于
控制步骤的反应速率。
这一点对于分析和解决实际问题非常重要。
第二章 气固相催化反应宏观动力学-第四版

第二章气-固相催化反应宏观动力学气-固相催化反应步骤:1、扩散(外扩散、内扩散)2、吸附3、表面反应4、脱附5、扩散(内扩散、外扩散)第一节气-固相催化反应宏观过程2-1 气-固相催化反应过程中反应组分的浓度分布以球形催化剂为例:滞流层内扩散-物理过程滞流层内反应物浓度梯度为常量 As Ag C C --外扩散过程的推动力。
进行内扩散时,同时进行反应。
R ↑,反应量↑,反应物浓度↓ 活性↑,反应物浓度↓ 产物扩散过程与反应物相反。
2-2 内扩散有效因子与总体速率由于催化剂对反应物扩散程度不一样,反应物反应的量也不同,在催化剂内表面上的反应量一定小于按固体外表面计算的反应速度,二者之比称为内扩散有效因子或内表面利用率,或者有效因子。
内扩散有效因子定义解析式: ()()iAS s S A s S C f k dSC f k i⎰=ζ式中:s k -单位表面积计算的反应速率常数 A C -颗粒内反应物浓度 AS C -颗粒外表面上反应物浓度 i S -单位体积床层催化剂的内表面积 内扩散有效因子定义:率及内表面计算的反应速按反应组分外表面浓度梯度计算的扩散速率按反应组分外表面浓度=ζ稳定时:单位时间扩散到外表面的量=颗粒内的反应量 即:()()()ζAS i s AS Ag e g g A C f S k C C S k r =-= 上式即为外扩散在内的宏观动力学。
式中:()g A r -宏观反应速率 g k -外扩散传质系数e S -单位体积床层中的外表面积如一级反应:则()*A AS AS C C C f -=其中:*A C -平衡浓度则宏观动力学方程:()()()*A AS i s AS Ag e g g A C C S k C C S k r -=-=ζeg i s Ai s Ag e g AS S k S k C S k C S k C ++=ζζ*()()eg i s Ai s Ag e g Ag e g Ag i s e g g A S k S k C S k C S k C S k C S k S k r +--+=ζζζ*ζi s eg Ag Ag S k S k C C 11+-=稳定时,反应放热量=外表面传热量即()()()()()g S e S R AS i s R g A T T S H C f S k H r -=∆-=∆-αζ 式中:S α-气流主体与外表面间的给热系数 S T -外表面温度 g T -气流主体温度 2-3 催化反应控制阶段的判别 1、化学动力学控制 条件:(1)ζi s eg S k S k 11<<(2) 1→ζ内、外扩散的影响可忽略。
化学反应工程-15-第四章-气固相催化反应

r r3 k3 A B
应用Langmuir均匀吸附理论,可以求出 A 和 B 的值! 对(1):因达到平衡
k1 PAV k1 A
A K A PAV
同理对(2)
k1 设K A k 1 1
B K B PBV
2
A R V 1 1, B S V 2 1
V 1
1 1 K1 PA K 4 PR
V 2 ,
1 1 K 2 PB K 5 PS
K1 PA K 2 PB A , B 1 K1 PA K 4 PR 1 K 2 PB K 5 PS
故
PR k PA K r 1 K1PA
4、两种活性中心 对反应: A B R S ,设表面反应控制
' r r3 k3 A B k3 R S
S K5 PSV 2 A K1 PAV 1 , B K 2 PBV 2 , , R K 4 PRV 1
③吸附项的指数是控制步骤中吸附中心参与的个数,当n=1 时,说明控制步骤中仅一个吸附中心参与,当n=3时,说明三 个吸附中心参与控制步骤; 时, A2 2 2 A A K A PA V ④当出现解离吸附,如: ,在吸附项中出现
K A P项; A
⑤若存在两种不同吸附中心时,吸附项中会出现相乘形式; ⑥若分母中未出现某组分的吸附项,而且吸附项中还出现其他 组分分压相乘形式一项,则反应多半为该组分的吸附或脱附过程 所控制。
2
h g h
2 K PNH 3 k a PN A 3 2 K2 P P H2
2.3 气-固相催化反应宏观过程与催化剂颗粒内气体的扩散

设:某反应的关键组分为反应物A; 催化剂为球形,半径Rp; 颗粒内活性组分均匀分布; 颗粒外表面有滞流边界层。 A在气相主体、颗粒外表面、 CA 内表面的浓度分别为 CAg 、CAs、 CAc; 平衡浓度为CA*。 (1) 外扩散过程 扩散推动力:CAg -CAs CA 是直线分布。 (2) 扩散-反应过程 CAC为内扩散过程和反应过程 的表观浓度,浓度分布是曲线。
C Ag 1 1 kG Se k s Si ζ
(rA ) g =
B、二级不可逆反应 若本征动力学方程为二级不可逆反应,则有:
2 rA k s f (C A ) k s C A 2 (rA ) g =kG S e (C Ag C As )= k s Si C As ζ
C As
1 ( k S ) 2 4 k S k S ζC k S G e G e s i Ag G e 2k s Si ζ
颗粒内浓度分布如右图此时而内扩散具有强烈影响作用可略去外扩散的阻滞acac此种情况发生在催化剂颗粒此种情况发生在催化剂颗粒相当大并且外扩散传质系相当大并且外扩散传质系数和反应速率常数都相对较数和反应速率常数都相对较大的时候大的时候此时
2.3 气-固相催化反应宏观过程与催化剂颗粒内 气体的扩散 2.3.1气-固相催化反应宏观过程
CAC
0
Rp
CA
CAg
CAS CAC
0
ห้องสมุดไป่ตู้
Rp
CA
CAg
CAS CAC
0
Rp
CA
CAg CAS
CAC
0
Rp
(3) 内扩散强烈影响
1 1 且 1,外扩散的阻滞 kG S e k s S i 作用可略去, 而内扩散具有强烈影响 , 则:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气固相反应
气固相反应是将反应物化学结合或发生化学反应,以改变反应物在固体状态下
的物理和化学特性。
它是一种用于保护重要化学品、制备合成产品及加工助剂等应用领域中的反应方法。
气固相反应特别适合在不改变温度和压力的条件下,快速获得一系列稳定的产物。
相比传统的液体-液体反应,气固相反应可以有效降低能量
耗散,释放大量热量,提高反应效率,进而改善反应物性质。
气固相反应优势在于反应速度更快,使得反应可以在更短的时间内发生,更重
要的是,可以在室温环境下发生反应,因而节省了反应的能耗。
此外,在气固反应中,多种反应物可以混合比例,使得调整反应条件更加灵活,系统更加可靠。
此外,气固反应的转化率更高,产物的纯度也更高,因而缩短了反应所需的时间和成本。
总之,气固相反应是一种既有利于节能又有利于质量保证的有效工艺,在生物
分子、有机材料以及合成材料行业有着重要的应用性价值。
