有机化学复习纲要
有机化学复习提纲

第三讲有机化合物的命名Outline1、普通命名法2、系统命名法3、各类有机化合物的命名(1)烃的命名(烷烃、烯烃、炔烃、芳香烃、环烷烃)(2)卤代烃的命名(3)含氧化合物的命名(醇,酚、醚、醛、酮、醌、羧酸)(4)羧酸衍生物(酰卤、酸酐、酯、酰胺)和取代羧酸(卤代酸、羟基酸、酮酸、氨基酸)的命名优先次序原则:1、将直接连在双键碳原子上连个院子按原子序数大小为序排列。
大的优先,小的在后。
同位素原子以质量大的优先2、与双键碳原子相连的两个原子相同时,比较连在这两个原子上的其他原子,若第二个也相同则比较第三个,原子序数较大者优先。
3、与双键碳原子相连的基团有双键或三键是,可见其看作连接两个或三个相同的院子ZE命名:两个碳上的优先基团在双键同侧,Z型,异测E型单螺环烷烃的系统命名:双环桥环烷烃的系统命名:对映异构体构型的命名D、L命名:RS命名:1、将连在手性碳原子上的四个基团按次序规则排序,优先的在前;2、将次序最低的集团远离观察者,其他三个基团沿顺时针具有R构型,逆时针为s构型。
采用费歇尔投影式时,若次序最低的院子或基团处于垂直方向上,顺时针为r构型:若处于水平方向上,顺时针为s构型Objective requirements:1、掌握普通命名法2、掌握系统命名法3、掌握各类有机化合物的命名原则4、掌握优先次序原则5、熟悉常见基团的命名6、学会比较各类有机化合物命名的异同点7、了解碳原子的类型与命名之间的关系8、了解某些有机化合物的俗名第四讲立体化学基础第二章构象异构(第四节)第三章顺反异构(第一节)第五章立体化学基础(第一、二节)-------对映异构现象Outline第一节构象异构一、构象异构现象二、链烃的构象异构1、乙烷的构象异构2、丁烷的构象异构三、脂环烃的构象异构1、环己烷分子的构象异构2、一取代环己烷的构象异构3、二取代环己烷的构象异构第二节顺反异构一、顺反异构现象二、产生顺反异构的条件三、顺反异构的命名1、顺/反命名法2、Z/E命名法四、脂环化合物的顺反异构五、顺反异构体的性质1、理化性质2、生物学性质第三节对映异构一、对映异构体的旋光性1、平面偏振光和物质的旋光性2、旋光仪和比旋光度二、对映异构现象1、化合物的旋光性与分子结构的关系(1)手性和手性分子(2)对映异构体(3)分子的对称性2、含一个手性碳原子化合物的对映异构基本规则:1、手性碳原子上任意两个基团的位置经偶数次互换,构型保持不变;奇数次互换内发生了改变2.投影式不离开纸平面旋转180或其整数倍,构型不变,若旋转90或其整数倍,转变为其对映异构体3、若固定投影式的一个基团不动,其余三个基团按顺时针或逆时针方向旋转构型保持不变3、对映体的表示方法对映体的标记(1)相对构型命名法-----D/L标记法(2)绝对构型命名法-----R/S标记法三、含两个或两个以上手性碳原子化合物的对映异构1、含两个不同碳原子化合物的对映异构含有不同手性碳原子分子具有旋光异构体数目为2的n次方个(n为手性碳原子数目),对映体为2的n-1次方对2、含两个相同碳原子化合物的对映异构只有3个旋光异构体四、对映异构体的性质Obejective requirements:1、构象异构现象(1)掌握同分异构的概念及分类(2)掌握环己烷的构象异构及稳定性的排列(3)熟悉链状化合物的构象异构(4)了解含两个以上取代基环己烷的构象异构2、顺反异构现象(1)掌握顺反异构产生的条件,学会判断分子是否具有顺反异构、(2)掌握顺反异构体的表达方式(3)掌握顺反异构体的命名,顺反命名法和Z/E命名法。
大学有机化学复习提纲

C*构型的确定,从离序数最小基的最远方向 看,其余3基的序数由大到小为顺时针记作‘R’, 反时针记作‘S’
4、多官能团化合物的命名 • 当化合物中含有多个官能团时,一般按下列顺
序,选取其中最优者为主体名,其余作取代基 (个别有例外)。
• 一些主要官能团按优先递减排序如下: —COOH,—SO3H,—COOR,—COCl, —CONH2,—CN,—CHO,=C=O(酮), —OH , —SH , —NH2 , ——C≡C— , —C=C—
• THF、NBS、TNT、DMSO、DMF等
二、有机化合物结构
• 1、同分异构 • 2、构象分析 • 3、结构理论
1、同分异构
• 异构体类型: 构造异构(C架、位置、官能团) 立体异构(顺反、对映)
• 异构体书写: 一般常见物质或结构较简单物质的同
分分异异构构体体等。如写分子式为C5H10、C5H12同 • 互变异构现象:酮式—烯醇式互变异构、
• 卤仿反应:
• R-CO-CH3 + NaOX (X2 + NaOH)
R-
COOH
• 酰胺重排:
• R-CONH2 +Br2 +OH— • 缩合逆反应:
R-NH2
• R2C=CH-CHO +OH—(H2O) + CH3CHO
R2C=O
• 成环反应
• 三元环:
•
碳 烯 插 入 C=C + CH2I2 + Cu-
• 羧酸衍生物的水解、醇解、氨解反应
• 重氮化反应可使芳环氨基转换成其他 原子或原子团
• 烯加水成醇,炔加水成醛酮,烯与炔 加HX或X2成卤代物、加HOX成卤代醇、 催化加氢成烷,烯硼氢化氧化水解生成 反马氏规则的醇,炔硼氢化氧化水解成 醛(酸化水解成烯)
有机化学复习提纲

有机化学(农科)期末考试复习提纲(2008.6)一、烷烃1、命名;2、构象(判断和写画出稳定构象-纽曼投影式);3、化学性质(烷基自由基的稳定性判断)。
二、烯烃1、结构与命名(包括顺反、ZE命名);2、化学性质与鉴别及结果判断(与HBr的亲电加成,马氏规则和反马氏规则,а-H反应,硼氢化反应;碳正离子稳定;能利用KMnO4鉴别烯烃,能利用KMnO4、O3氧化反应产物推断原烯烃的结构)。
三、炔烃与共轭烯烃1、结构与命名(包括同时含双、三键);2、炔烃与共轭烯烃的化学性质,能利用银氨溶液进行端基炔烃的鉴别;3、Diels-Alder反应;4、诱导效应和共轭效应的类别与应用。
四、脂环烃1、命名(不饱和脂环烃、桥环);2、化学性质(开环反应);3、构象分析(顺反异构、环已烷以及衍生物的椅式稳定构象)。
五、芳香烃1、芳香烃的结构和命名及芳香性的判断;2、单环芳香烃的化学性质(亲电取代反应,侧链的氧化和卤代反应,掌握取代单环芳香烃的合成)3、定位效应及其解释(掌握取代基对再取代活性、取代位置的影响)4、稠环芳香烃的命名(以萘为重点)。
六、对映异构1、手性、手性碳、手性分子、对映体的概念;2、含一个手性碳化合物的旋光异构:构型的表示方法和构型的判断及外消旋体、非对映体的概念;3、含两个手性碳化合物的旋光异构:含两个不同和相同手性碳化合物的构型判断、内消旋体的概念。
4、不含手性碳的旋光异构:丙二烯型、联苯型七、卤代烃1、卤代烃的分类与命名;2、亲核取代反应以及卤代烃亲核取代反应活性的判断(与硝酸银反应);3、掌握卤代烃的消除反应(扎伊切夫规则),与取代反应的竞争反应与反应条件;4、格氏试剂的生成、性质及有机合成上的应用八、醇、酚、醚•1、醇(重点是烯醇)、酚、醚的命名•2、醇的亲核取代、消除反应(条件:硫酸、加热)和氧化反应,与Lucas 试剂反应、发生碘仿反应•3、酚的结构特点和性质(酸性强弱的判断),酚或烯醇式结构与FeCl3试剂反应•4、醚与HI的反应(注意醚键的断裂方式),醚的制备(Williamson合成法)九、醛与酮1、醛酮的命名(还要注意醛酮与氨的衍生物反应产物的命名);2、醛酮的化学性质与鉴别(亲核加成反应及其反应活性比较,羥醛缩合反应,歧化反应、氧化反应、碘仿反应等);3、醛、酮的制备(掌握利用格氏试剂合成酮)。
高中有机化学完整提纲

不饱和烃碳原子所结合的氢原子数少于饱和链烃(烷烃)里的氢原子数的烃分子中含有C=C或C≡C的烃,其中所含的H原子数少于相同碳原子数的烷烃中的H原子数。
乙烯烯烃一、乙烯的组成和分子结构分子式:C2H4 电子式:结构式:H H 结构简式:CH2=CH2或H2C=CH2H―C=C―H结构特点:六个原子全部共处于同一平面二、乙烯的实验室制法1、工业:石油裂解产品2、实验室:(1)药品乙醇、浓硫酸(体积比1∶3)(5)原理: CH3-CH2OH CH2=CH2↑+ H2O分子内脱水、属消去反应副反应:CH3-CH2OH + CH3-CH2OH CH3-CH2-O-CH2-CH3 + H2O乙醚分子间脱水、属取代反应C2H5OH 2C+3H20C+2H2SO4== CO2↑+SO2↑+2H2O问题与思考反应物的体积比是多少?浓硫酸与乙醇的体积比为3∶1为什么加入几片碎瓷片?加碎瓷片防止爆沸为什么使用温度计?控制反应温度在170摄氏度温度计水银球所插的位置?水银球在反应物中间为什么要迅速升温至1700C?防止在1400C时生成乙醚用什么方法收集乙烯?排水法收集浓硫酸的作用是什么?催化剂、脱水剂加热过程中混合液往往变黑的原因?反应后期,浓硫酸将乙醇炭化加热时间过长,还会产生有刺激性气味的气体,为什么?浓硫酸将炭氧化生成二氧化碳,本身被还原成二氧化硫三、乙烯的性质1、物理性质无色稍有气味的气体密度比空气小(1.25g/L)难溶于水2、化学性质(1)氧化反应①燃烧:现象:火焰明亮,伴有黑烟CH2=CH2+3O2 2CO2+2H20②使紫色的KMnO4(H+)溶液褪色思考:可否用KMnO4(H+)溶液鉴别C2H6、C2H4 ?除去C2H6中的C2H4?(2)加成反应CH2=CH2使橙红色的Br2水褪色H-C=C-H + Br-Br H-C-C-H(溴水或溴的四氯化碳溶液)或CH2=CH2 + Br2 CH2Br-CH2Br加成反应:有机物分子中双键(或三键)两端的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。
高中-《有机化学基础》复习提纲

《有机化学基础》复习提纲一、有机物组成的表示方法例:写出乙酸的分子式、电子式、结构式、最简式?二、几个概念1、官能团:是决定有机物化学特性的原子或原子团。
例:指出右边有机物所含官能团,预测其性质。
2、基:例: 写出氨基的电子式和丁基的结构简式?3、同系物的概念:例如:CH3CH2OH和丙三醇,甲苯和苯乙烯,互为同系物?4、同分异构体的类别——官能团异构——官能团结合在不同的碳原子上——支链多少与大小的改变例如:写出C7H8O(含有苯环)的同分异构体?三、典型有机物的命名例如:四、有机物的物理性质1.沸点(1)同类物质:碳原子个数不同时,随分子中碳原子数的增多,分子间作用力增大,沸点逐渐升高;碳原子个数相同时,支链越多,沸点越低。
(2)不同类物质:碳原子个数相同时,其沸点的变化规律一般为:羧酸>醇>醛>烷。
2.水溶性(1)溶于水(或互溶)的常见有机化合物有:低级的醇、醛、羧酸等。
(2)不溶水(或难溶水)的常见有机化合物有:烃、卤代烃(包括溴苯、四氯化碳等),酯(包括油脂)、高级脂肪酸、硝基苯。
(3)苯酚的溶水性大小受温度影响,650C以上能与水互溶,650C以下在水中溶解度不大。
3.密度(1)密度比水小(在水溶液上层)的有机化合物有:烃(汽油、苯、苯的同系物)、一氯化烷、酯、油脂、高级脂肪酸等。
(2)密度比水大(在水溶液下层)的有机化合物有:溴苯、硝基苯、苯酚、四氯化碳、溴乙烷等。
五、有机物的化学性质(烃及其衍生物官能团转化图)糖、油脂和蛋白质的结构性质六、有机化学的反应类型1.取代反应(1)卤代反应——烷烃、苯,苯的同系物,苯酚、醇、饱和卤代烃等.(2)硝化反应——苯、苯的同系物、苯酚注意:硝化反应一般情况指苯环上...的氢原子被硝基取代的反应.(3)水解反应——卤代烃、酯、油脂、糖、蛋白质.水解条件应区分清楚.如:卤代烃——强碱的水溶液;糖——强酸溶液;酯——无机酸或碱(碱性条件水解反应趋于完全);油脂——无机酸或碱(碱性条件水解反应趋于完全)、高温水蒸气;蛋白质——酸、碱、酶(4)酯化反应——醇、酸(包括有机羧酸和无机含氧酸)2.加成反应:分子中含有等可能加成3.消去反应注意:卤代烃和醇发生消去反应的实验条件不同,但结构条件同。
有机化学期末复习重点

第1 章 绪 论 1. 有机化合物与有机化学的定义2.有机化合物的特点(了解)3.共价键的特性和属性。
注意:分子的极性与键的极性和分子的对称性有关。
4.共价键的断裂和有机化学反应的基本类型(1) 共价键的断裂方式分为均裂和异裂,根据共价键的断裂和形成的方式不同,可把有机反应机理分为:游离基反应、离子型反应和协同反应等 3 大类。
5.有机反应中“离子型”反应根据反应试剂类型不同,分为亲电反应与亲核反应两类:(1) 亲电试剂与亲电反应:由缺电子的试剂进攻部分负电荷的碳原子而发生的,这类十分需要电子的试剂称为亲电试剂。
如含有 H +、Cl +、Br +、NO 2+、RN 2+、R 3C +等正离子的试剂。
由亲电试剂的进攻而引起的反应称为亲电反应。
(2) 亲核试剂和亲核反应:由能供给电子的试剂进攻具有部分正电荷的碳原子而发生的,这类能供给电子的试剂称亲核试剂,如 H 2O、ROH、OH -、RO -、Br -、NH 3、RNH 2、CN -等。
由亲核试剂的进攻而引起的反应称为亲核反应。
注意:有机反应中,加成反应分为亲电加成(烯烃与卤素的反应)、亲核加成(羰基与氰氢酸、水、醇、格氏试剂、氨的衍生物之间的反应)、自由基加成(如:不对称与 HBr 在过氧化物存在下的反应属于自由基加成,遵循反马氏规则)三类。
第 2 章 烷烃和环烷烃一、烷烃的命名:1.掌握有机化合物系统命名的基本原则2.碳原子的分类(伯、仲、叔、季)与常见烷基的结构和名称(P 48)3.顺序规则 —— 主要烷基的优先次序:甲基<乙基<丙基<异丙基二、烷烃的结构(了解)三、烷烃的构象异构(属于立体异构)乙烷中最典型的 2 种构象是交叉式(稳定构象)和重叠式,用 Newman 投影式和锯架式表示。
丁烷的 4 种典型构象及其稳定顺序:对位交叉式>邻位交叉式>部分重叠式>全重叠式。
四、烷烃的化学性质(掌握)烷烃卤代反应的机制——游离基(自由基)反应,分链引发、链增长与链终止是的 3 个阶段;烷烃卤代反应的取向主要由自由基稳定性次序来决定。
高二化学选修《有机化学》复习提纲
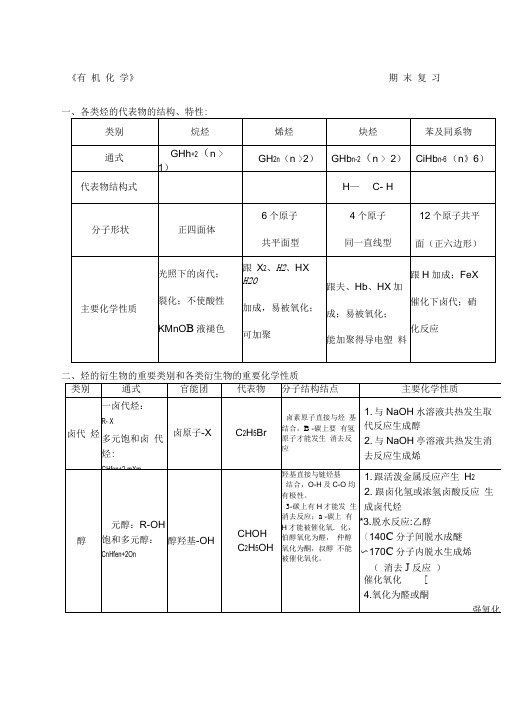
《有机化学》期末复习一、各类烃的代表物的结构、特性:二、烃的衍生物的重要类别和各类衍生物的重要化学性质三、重要的有机反应及类型1取代反应(1) 酯化反应(2) 水解反应aOH卜CHCI+H2O ? C 2H OH+HCI CH 3COOC I+HO H+CH 3COOH+HOH(3)(4)(5)2. 加成反应CH~CH^ CH 2+KBr+HO CH,—C —H + H 3 —*CH 3CH 2OH ,氧化反应 ''(2) 醇、醛的催化氧化:CH 3CHO + 2Cu(OH> + NaO^-CHCOONa + Cd + 3HO (4)被强氧化剂氧化:烯、炔、醇、醛、酚、苯的同系物等被酸性高锰酸钾氧化(1) 能与H 加成的反应:(烯、炔、苯环、醛基、酮)6. 聚合反应7. 中和反应CH )—C —OH T HaOH —- CH,—C —(Th +四、重要的反应.,1. 能使溴水(Br 2/H 2O )褪色的物质CH,—CH —CHj(烯烃与 X 2、H 2O HX H 2)CLCH, CH=CH a + Htl 3 乙醇HO C HOH170绡 尸严LH OHCHjoHCH f +HbO CHkCH-CHBr+KOHCH, C-0H4.(1)燃烧反应:2C 2Hb +5Q 4CG+2HO?2CH a CHOH+O2CH 3CHO+22OAg 550 °CI2CHj —C —Oil2CHCHO+O(3)被弱氧化剂氧化:CHCHO + 2Ag(NH)2OHIICHj —C —ONH*+ 2 AgJ +3NH + H 2O①通过加成反应使之褪色:含有…、-CW 的不饱和化合物②通过取代反应使之褪色:酚类(注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀[三溴苯酚]。
)③通过氧化反应使之褪色:含有-CH 0(醛基)的有机物(有水参加反应)(注意:纯净的只含有一CH(醛基)的有机物不能使溴的四氯化碳溶液褪色)2. 能使酸性高锰酸钾溶液KMn OH+褪色的物质含有…」、-y、-0H (较慢)、-CH0的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物(与苯不反应)3.与Na反应的有机物:-OH、-COOH与NaOH反应的有机物:酚羟基、-COOH加热时能与卤代烃、酯反应(取代反应)与NaCO反应的有机物:酚羟基反应生成酚钠和NaHCO -COOH反应放出CO 气体。
高三化学三轮复习指导纲要3有机化学

第三部分有机化学基础【考纲要求】有机化学基础1. 了解有机化合物数目众多和异构现象普遍存在的本质原因。
2. 理解基团、官能团、同分异构、同系列等概念。
能够识别结构式(结构简式)中各原子的连接次序和方式、基团和官能团。
能够辨认同系物和列举异构体。
了解烷烃的命名原则。
3. 以一些典型的烃类化合物为例,了解有机化合物的基本碳架结构。
掌握各类烃(烷烃、烯烃、炔烃、芳香烃)中各种碳碳键、碳氢键的性质和主要化学反应。
4. 以一些典型的烃类衍生物(乙醇、溴乙烷、苯酚、乙醛、乙酸、乙酸乙酯、脂肪酸、甘油酯、多羟基醛、氨基酸等)为例,了解官能团在化合物中的作用。
掌握各主要官能团的性质和主要化学反应。
5.了解石油化工、农副产品化工、资源综合利用及污染和环保的概念。
6. 了解在生活和生产中常见有机物的性质和用途。
7. 以葡萄糖为例,了解糖类的基本组成和结构,主要性质和用途。
8. 了解蛋白质的基本组成和结构、主要性质和用途。
9. 初步了解重要合成材料的主要品种的主要性质和用途。
理解由单体进行聚合反应(加聚和缩聚)生成高分子化合物的简单原理。
10. 通过上述各类化合物的化学反应,掌握有机反应的主要类型。
11. 综合应用各类化合物的不同性质,进行区别、鉴定、分离、提纯或推导未知物的结构简式。
组合多个化合物的化学反应,合成具有指定结构简式的产物。
【回归课本】1.常见有机物之间的转化关系2.与同分异构体有关的综合脉络3.有机反应主要类型归纳下属反应物涉及官能团或有机物类型其它注意问题取代反应酯水解、卤代、硝化、磺化、醇成醚、氨基酸成肽、皂化、多糖水解、肽和蛋白质水解等等烷、苯、醇、羧酸、酯和油脂、卤代烃、氨基酸、糖类、蛋白质等等卤代反应中卤素单质的消耗量;酯皂化时消耗NaOH的量(酚跟酸形成的酯水解时要特别注意)。
加成反应氢化、油脂硬化C=C、C≡C、C=O、苯环酸和酯中的碳氧双键一般不加成;C=C和C≡C能跟水、卤化氢、氢气、卤素单质等多种试剂反应,但C=O一般只跟氢气、氰化氢等反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学复习纲要一、命名有机化合物的命名通常具有下列形式:取代基名称+ 骨架名称+ 类别名称把次序在先的官能团作为母体基团,其余作为取代基。
排列次序如下:—COOH,—SO3H,—COO -,—CO—X ,—CO—NH2 ,—CHO ,—CN ,=O ,—OH ,—NH2,—O—(—RO),—C≡C—,-C=C—,其中—X 和—NO2只能作为取代基。
1、脂肪族化合物的命名(1)确定母体基团,写出类别名称(2)选择主链,写出骨架名称(3)编号,写出母体基团位次(4)加上次要基团及取代基的位次及名称例如:CH3CH(OH)CH2CHO (3-羟基丁醛)CH3CH(CH3)CH(OH)CH2CHO (4-甲基-3-羟基戊醛)2、芳香族化合物命名(母体基团排列次序见前)(1)写出母体化合物的名称(2)编号。
有的芳环有固定编号,对于有苯环的母体化合物,将与母体基团相连的碳原子为1号,使取代基的位次最小。
(3)加上取代基的名称。
OHCOOHCH32Br(邻羟基苯甲酸)(3-溴-4-甲基苯胺)如果官能团不与苯环直接相连,则苯环作为取代基使用。
如:CH2CH3CHO(3-苯基丙醛)3、脂环族化合物的命名:桥环、螺环二、性质(一)自由基取代(烷烃)CH4+Cl2CH3Cl……(二)亲电加成(烯烃、炔烃、二烯烃)在反应中具有亲电性能的试剂叫做亲电试剂。
由亲电试剂的进攻引起的加成反应叫做亲电加成反应。
● 不对称加成规则(马尔可夫尼科夫规则):凡是不对称烯烃与HX 等极性试剂加成时,带正电荷的部分加在含氢较多的双键碳原子上,其它部分则加在含氢少的双键碳原子上。
(此规则对炔烃同样适用)● 反马氏规则:当有过氧化物存在时,不对称烯烃与 HBr 加成,带正电的部分加在含氢较少的双键碳原子上,其余部分则加在含氢较多的双键碳原子上。
(炔烃同样适用)+RCH=CH 2H H XX H X H OH H OSO 2OH XOHOH 2RCH 2CH 3 RCHXCH 2X RCHXCH 3RCH(OH)CH 3RCH(OSO 2OH)CH RCH(OH)CH 3RCH(OH)CH 2X● 烯烃的硼氢化反应:进一步氧化、水解可制得醇,此反应符合反马氏规则。
● 炔烃的亲电加成反应,由于是叁键反应分两步进行。
若双键、叁键同时存在,加氢时,先叁键后双键;加卤素时,先双键后叁键。
(与上述试剂都可反应,注意炔烃与H 2O 反应时发生的重排)。
炔烃除了可以发生亲电加成反应外,还可以发生亲核加成反应。
如:+CH CH HCNCH 3OH CH 3COOHCH 2=CHCN CH 2=CHOCH 3CH 2=CHOCOCH 3(醋酸乙烯酯)● 二烯烃的亲电加成反应有1,4—加成、1,2—加成。
(其中包括双烯合成,是生成六员环化合物的反应) ● 氧化反应: 1.用酸性 KMnO 4氧化并加热,烯烃分子中双键断裂生成酮或羧酸;炔烃在此条件下生成羧酸。
不同结构的烯、炔生成不同的产物,用此可以推测原来烯(炔)分子中双键(叁键)的位置和 原烯烃(炔烃)的结构。
+R 2CHCHR'4C O RRR'COOH2. 烯烃经过臭氧化、水解(Zn 粉+H 2O )可得醛或酮,以此也可以推测原烯烃的结构。
+R 2CHCHR'C O RRR'CHO① O 32● 末端炔的性质1、末端炔可与Ag(NH 3)2NO 3、Cu(NH 3)2Cl 反应生成沉淀2、可与金属钠反应: RCCH2RC CNaRCCR'R' X此反应可用来由末端炔合成其他的炔。
(三)亲电取代(芳烃)+XRXXCORO SO 3O NO 2OH 2NO 2X SO 3H R COR HX AlCl 3H 2SO 4AlCl 3无水3无水+O H 2+O H 2++HX还可以进行二元取代。
定位规律如下:(1)当环上已有了一个取代基时,第二个取代基所进入的位置主要由原来苯环上的取代基来决定。
常见的取代基分为两类:● 第一类定位基(邻、对位定位基),定位能力先强后弱。
—O - ,—NH 2 ,—NHR ,—NR 2 ,—OH ,—OCH 3 , —NHCOCH 3 ,—OCOR ,—C 6H 5,—CH 3 ,—X 等。
● 第二类定位基(间位定位基):—N +(CH 3)3 ,—NO 2 ,—CN ,—COOH ,—SO 3H ,—CHO ,—COR 等。
(2)二元取代苯的定位规律:● 环上原有的两个取代基定位效应一致时,由定位规律决定,既第三个取代基进入共同一致影响的位置。
● 两个取代基定位效应不一致时,属于同一类由定位能力强的决定(相差不大则为混合物);不属于同一类,则由第一类定位基决定。
(3)萘的定位规律:A、两类定位基对苯环的影响(α位比β位易被取代)B、有第二类定位基时由于使苯环钝化,在异环上进行二元取代。
●侧链的反应(α—H的氧化、卤代)(四)亲核取代(卤代烃)●在反应中,亲正电性的富电子试剂叫做亲核试剂。
由亲核试剂进攻带部分正电的碳原子而引起的取代反应叫亲核取代反应。
R XNa OHNa ORNa CNH NH2Ag ONO2OHRCOOH+ROHRORRCNRNH2RONO2NaClNaClNaClH X+++++(制混醚的方法)(可增长碳链,制羧酸)(可鉴别卤烃)醇叔卤烷在上述试剂作用下发生消除反应,生成烯烃。
●查依采夫规则:当仲、叔卤烷发生消除反应时,氢原子主要是从含氢较少的碳原子上脱去。
(较易生成烷基取代较多的烯烃)●格氏试剂生成:R X+Mg RMg X干醚(注意与格氏试剂有关的反应)(五)亲核加成(醛、酮)反应时试剂带负电的部分首先进攻带部分正电的羰基碳原子,然后带正电的部分加到羰基氧原子上。
反应的难易程度:HCHO>CH3CHO>CH3COCH3>RCOCH3>RCOR’CO HCNNaHSO 3ROH RMgX COHCNC OHORC OR OR C OH R COH COOH C OHSO 3NaH +① 干醚2ROH +3+(增长碳链)(大多数醛及脂肪族甲基酮)(用来保护羰基)(增长碳链,制伯、仲、叔醇)CO +N H 2NH 2NH 2OH NH 2NHCONH 2-H OCNNHCONH 2C N OHCN NH 2(与苯肼及2,4-二硝基苯肼反应)● 还原反应:C OCH 2(克莱门森还原,黄鸣龙还原)催化加氢 —→醇 ;化学还原剂(NaBH 4)还原得醇,可保留双键。
● 歧化反应:(不含α-氢的醛)+HCHOHCOONa CH 3OH● α—H 的反应:碘仿(可用来鉴别乙醛、乙醇、甲基酮和能氧化成甲基酮的醇)、羟醛缩合(此反应既增长了碳链又在分子中引入了羟基,同时也是制备α、β-不饱和醛的方法) (六)羧酸及其衍生物 1、 羧酸● 甲酸的特殊性:既具有醛的性质又具有酸的性质。
2、 羧酸衍生物●与格氏试剂的反应:生成叔醇(合成上常用酰氯和酯)●酰胺的特殊性质:酸碱性、脱水(非取代酰胺,生成晴)、霍夫曼降级反应(制取伯胺)、还原。
●乙酰乙酸乙酯(β-丁酮酸乙酯)及丙二酸二乙酯的制法、性质和应用。
(七)含氮化合物●硝基化合物的还原(主要制取芳胺)●胺的弱碱性,可利用此性质鉴别芳胺和不溶于酸的有机物,也可用于分离和提纯。
判断碱性强弱的规律。
●胺的烷基化反应,生成伯、仲、叔胺和季胺盐。
●胺的酰基化反应,通常用来保护氨基。
●异腈反应(可鉴别伯胺)●亚硝基化反应(重氮盐的生成,注意:一般用NaNO2+HCl或H2SO4在低温下反应)●芳胺的反应:(1)由于伯胺极易被氧化,所以常采用保护氨基的方法,既先进行酰基化反应,待其他反应完成后,再将酰基水解掉。
(2)芳环上的取代:氨基可使苯环活化,因此要制取一元取代物就必须降低苯环的活性,方法如下:先酰基化得到邻对位产物,再将酰基水解掉;先与硫酸或盐酸反应生成铵盐得到间位产物,再加NaOH还原为氨基。
进行硝化反应时由于先与硫酸作用,因此得到间位产物,若要得到邻对位产物要先进行酰基化反应。
●重氮盐的反应(重氮基被取代)重氮盐的重氮基可被-H、-OH、-X、-CN 取代,在有机合成上可用来去氨基、制酚、卤素衍生物及引入羧基。
反应如下:N 2N 2ClN 2HSO 4N 2ClX N 2X CNOH Cu 2X 2Cu 2(在有机合成上可作为去氨基的方法)被-H 取代被-OH 取代(可制备酚)被-X 取代(制备不易或不能用卤代法得到的卤素衍生物)被-CN 取代(可由来在苯环上引入羧基)● 偶合反应 :重氮盐与酚或芳胺作用,由偶氮基—N=N — 将两个分子偶联起来生成有颜色的化合物。
(见书396~399页)● 偶氮化合物用适当的还原剂还原(SnCl 2 + HCl 或 Na 2S 2O 4 )可得到两个芳胺如:NaO 3SN N OHOH NH 2NH 2SO 3Na2+根据所得到的产物可推出原来偶氮化合物的结构。
(八)碳水化合物、蛋白质氨基酸单糖、二糖的氧环式结构;成脎反应(各类糖的成脎速度比较);氨基酸、蛋白质性质及多肽的水解。
(九)对映异构 构型的标记法:D/ L 、R/ S (十)杂环化合物典型杂环化合物的结构及名称、鉴别方法。
(十一)脂环族化合物双环及螺环化合物的命名、性质及脂环族化合物的稳定性。
(十二)醇、酚、醚、醌 ● 醇: 醇钠的生成、生成卤烃的反应、消除反应(分子间、分子内)● 酚: 酚的酸性、酚酯的生成(与酰卤或酸酐反应)、环上取代反应、显色反应 ● 醚: 醚的裂解(与HI 反应)●醌: 醌氢醌的生成(用此反应解释实验现象)(十三)四谱简介利用红外光谱、核磁共振谱(或给出的有关数据)推测简单分子的化学结构三、化合物的制法(可用于合成)(一)烯烃:醇分子内脱水;卤代烃消除反应。
(二)炔烃:卤烃消除反应。
(三)用苯经过取代得到其他芳烃衍生物。
(四)卤烷:烷烃直接卤代;烯烃与X2、HX 加成;醇与HX作用(伯醇与NaCl+H2SO4)、或醇与PCl5作用(五)醇、酚、醚●醇:1、烯烃水合(直接、间接);2、卤烃水解3、醛、酮、酯还原生成伯、仲醇;4、从格氏试剂制备:格氏试剂分别与甲醛、醛、酮、酯(酰氯)作用生成伯、仲、叔醇。
(注意反应时要用干醚)●酚:可用重氮盐的反应制取;利用苯磺酸钠加NaOH,碱熔,再加酸得到;用芳卤烃在加热、加压、Cu的条件下与NaOH 作用,再加HCl 得到酚。
●醚:醇分子间脱水;威廉森合成(卤烃的醇解)(六)醛、酮●醇的氧化●羰基合成(烯烃+ CO + H2)●炔烃水合:除了乙炔外都生成酮。
(七)羧酸●醇、醛的氧化。
●腈的水解(是增长碳链的一个方法)●从格氏试剂制备:R—MgX + CO2(干冰)●从烯烃与CO,H2O 作用制备●利用卤仿反应可制取少一个碳原子的羧酸(八)胺●卤烷氨解(胺的烷基化,可得到伯、仲、叔胺)●醇与氨的作用:●从硝基化合物还原:注意苯环上连有两个硝基时,可进行选择性还原,所用试剂为NH4SH,●晴或酰胺的还原:晴可还原成伯胺;酰胺可还原成伯、仲、叔胺。
