2018版高中化学鲁科版选修3课件:第2章 第2节 第1课时 一些典型分子的空间构型
高中化学 选修3 第二章 分子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学生使用

选修3 第一章原子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学习目标:1.认识共价分子结构的多样性和复杂性。
2.理解价层电子对互斥理论的含义。
3.能根据有关理论判断简单分子或离子的构型。
教学难点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学重点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学过程:知识回顾:1.分析下列化学式中画有横线的元素,选出符合要求的物质并填空。
A.NH3B.H2O C.HCl D.CH4E.C2H6F.N2(1)所有的价电子都参与形成共价键的是______;(2)只有一个价电子参与形成共价键的是______;(3)最外层有未参与成键的电子对的是______;(4)既有σ键,又有π键的是______;(5)既有极性键又有非极性键的是__________;(6)分子构型为正四面体的是____________。
【解析】A.NH3中N原子与3个H原子形成3个σ键,还有一对不成键电子;B.H2O中O原子与2个H原子形成2个σ键,还有两对不成键电子;C.HCl中Cl原子与1个H原子形成1个σ键,还有三对不成键电子;D.CH4中C原子与4个H原子形成4个σ键,所有价电子都参与成键,其分子构型为正四面体形;E.C2H6中C原子分别与3个H原子及另1个C原子形成4个σ键,所有价电子都参与成键;C—H为极性键,C—C为非极性键;F.N2中N原子与另1个N原子形成1个σ键,2个π键,还有一对不成键电子。
答案(1)DE (2)C (3)ABCF (4)F (5)E (6)D2.常见分子的立体构型通常有两种表示方法,一是比例模型,二是球棍模型。
请你用短线将下列几种分子的比例模型、球棍模型连接起来。
【解析】 本题主要考查常见分子的立体构型。
H 2O 分子为三原子分子呈V 形,应选E—c ;NH 3分子为四原子分子呈三角锥形,应选B—d ; CCl 4分子为五原子分子呈正四面体形,应选C—a ; CO 2分子为三原子分子呈直线形,应选A—b 。
(鲁科版高中化学精品系列)选修3第2章第1节 共价键模型 第1课时 公开课课件

2、HCl分子的形成过程 S-P
H H-Cl Cl
3、Cl2分子的形成过程 P-P
Cl Cl Cl Cl
科学探究
N N
N2分子中三条键的成键方式 分别是什么?
N原子的价电子排布式:2S22P 3
p-pπ键的形成
N2中p-pσ键和p-pπ键的形成过程
N N
电子云重叠时优先形成σ键, 且任何两个原子之间只能形成 一个σ键。
课堂练习
1.下列有关σ键的说法不正确的是( C ) A、如果电子云图像是由两个s电子云重叠形成的,即形 成s-sσ键 B、s电子与p电子形成s-pσ键 C、p电子与p电子不能形成σ键 D、HCl分子里含一个s-pσ键 2.σ键与π键是共价键的两种重要类型,两者的形成方式 不同,性质也有较大差别,下列关于它们的说法中不正 确的是( B ) A、两个原子之间形成共价键时最多有一个σ键 B、π键比σ键重叠程度大更稳定 C、σ键的电子云分布呈轴对称 D、π键的电子云分布是通过键轴的平面呈镜面对称
两个核外电子自旋方向相反的氢原子靠近
v
V:势能 r:核间距
0
r
r0
v
V:势能 r:核间距
0
r0
r
r0
v
V:势能 r:核间距
0
r0
r
r0
H2 中的化学
键,可以认
为是电子自 旋相反成对, 结果使体系 的能量降低
v
V:势能 r:核间距
0
r0
r0=0.074nm
r
两个核外电子自旋方向相同的氢原子靠近
0.9 1.4 0
有
有
电负性:O:3.5 Cl:3.0
H:2.1
Na:0.9Leabharlann 讨论:共价键的形成条件是什么?
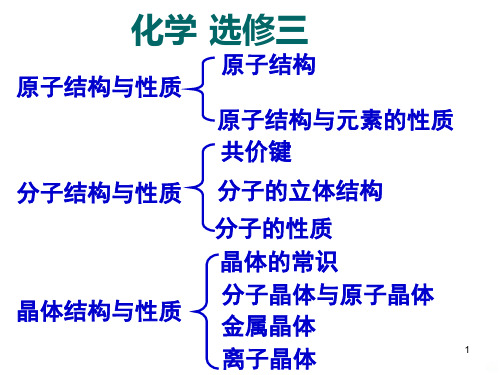
高中化学选修三全套共张PPT课件
处于一定空间运动状态的电子在原子核外空间
的概率密度分布的形象化描述
小黑点:概率密度
单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图
电子出现的概率约为90%的空间
即精简版电子云
③电子云轮廓图特点
a.形状
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
能级符号:ns、np、nd、nf…… n代表能层
最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一
K
二
L
三
M
四……
N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
14
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转
化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能
利用逐级电离能判断化合价
43
3、电负性(第三课时)
键合电子:参与化学键形成
原子的价电子
孤对电子:未参与化学键形成
①电负性
不同元素的原子对键合电子吸引能力
②特点
头碰头
重叠程度大,稳定性高
轴对称
可绕键轴旋转
H
Cl
s-p σ键
H
H
56
5、π键
定义:两个原子轨道以平行
即“肩并肩”方式重叠
高中化学第2章第1节共价键模型课件鲁科版选修3

25
(3)σ 键的特征 ①以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云图 形不变,这种特征称为轴对称。 ②形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。 (4)σ 键的存在:共价单键为 σ 键;共价双键和共价叁键中存在 σ 键(通 常含一个 σ 键)。
26
2.π 键 (1)π 键:形成共价键的未成对电子的原子轨道,采取“肩并肩”的方 式重叠,这种共价键叫 π 键。 (2)如下图 pp π 键的形成
34
键参数
1.键参数
概念
对分子的影响
在 101.3 kPa、298 K 条件下,断开 1 mol
AB(g)分子中的化学键,使其分别生成气 键能越大,键越牢固, 键能
态 A 原子和气态 B 原子所吸收的能量称为 含该键的分子越稳定 A—B 键的键能(单位:kJ·mol-1)
35
键长 成键的两个原子核间的距离(单位:nm) 键角 分子中相邻键之间的夹角(单位:度)
形成元素
电子对偏移
原子电性
因两原子电负性相同,共用
非极性键 同种元素
两原子均不显电性
电子对 不偏移
极性键
电子对偏向电负性大的原 电负性较大的原子
不同 元素
子
显负电性
11
一、共价键 3.共价键的特征 (1)饱和性:一个原子中的一个未成对电子与另一个原子中的一个未 成对电子配对成键后,一般来说就不能再与其他原子的未成对电子 配对成 键了,即每个原子所能形成共价键的总数或以单键连接的原子数目是一定 的,这称为共价键的饱和性。原子能够形成共价键的数目是确定的,即共 价键的饱和性。
17
休息时间到啦
同学们,下课休息十分钟。现在是休息时间,你们休息一 下眼睛,
化学同步鲁科版选修3学案:第2章 第2节 第2课时 分子的空间构型与分子性质 Word版含解析

第2课时分子的空间构型与分子性质[课标要求]1.了解极性分子和非极性分子。
2.了解“手性分子”在生命科学等方面的应用。
1.对称分子:依据对称轴的旋转或借助对称面的反映能够复原的分子。
2.手性碳原子:连接四个不同原子或原子团的碳原子。
3.手性分子:含有手性碳原子的分子。
4.极性分子:分子内存在正、负两极的分子;非极性分子:分子内没有正、负两极的分子。
5.含有极性键的双原子分子是极性分子,只含有非极性键的分子和分子空间构型对称的分子是非极性分子。
分子的对称性1.对称分子2.手性分子1.在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”,凡具有一个手性碳原子的化合物一定具有光学活性。
下列分子中含有“手性碳原子”的是()A.CBr2F2B.CH3CH2OHC.CH3CH2CH3D.CH3CH(OH)COOH解析:选D手性碳原子连接四个不同的原子或原子团。
2.下列分子含有“手性”碳,属于手性分子的是()A.B.H2NCH2COOHC.D.CH2CH2解析:选C抓住“手性”的含义,C原子上连接有四个不同的原子或原子团,即为手性碳原子。
分子的极性1.分子极性的实验探究2.极性分子和非极性分子[特别提醒]相似相溶原理是指极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。
1.极性分子中一定含有极性键,一定不含非极性键吗? 提示:一定含有极性键,可能含有非极性键。
2.非极性分子中一定含有非极性键吗?提示:分子结构对称时,可能含有极性键,而不含有非极性键。
判断分子极性的方法 (1)根据分子的对称性判断分子结构对称,正电荷重心和负电荷重心重合,则为非极性分子,正、负电荷重心不重合,则为极性分子。
(2)根据键的极性判断(3)经验规律①化合价法:若中心原子A 的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,否则为极性分子。
②孤对电子法:若中心原子有孤对电子则为极性分子,否则为非极性分子。
优秀课件鲁科版高中化学选修3第三章第二节第二课时离子晶体课件 (共37张PPT)

8 Cs+: Cl-:8
6 Cs+: Cl-: 6
迁移.应用
S2Zn2+
晶胞的1/8
晶体 类型
晶胞 类型 晶胞结构 示意图 最近且距离 相等的异种 离子数
NaCl的形成
根据NaCl晶体的特征,结合我们给 转移 不稳定 金属晶体下定义的方式,同学们能不能 给离子晶体下定义呢?
稳 定
静电作用
电子
Na+ -
离子晶体
一、概念
阳离子 和______ 阴离子 通过离子键 ______ _____结合、 (1)定义: 有规律 的排列所形成的晶体。 在空间呈现______ (2)构成微粒: 阴离子、阳离子 (3)相互作用: 离子键 (4)常见的离子晶体:
体心 八个顶点 1个 8个
CsCl晶胞还呈电中性吗?
Why ?
活动探究 二
ClCs+
Cl-
1 顶点: 8× =1 8
Cs+ 体心: 1 × 1 =1
在CsCl晶体的一个晶胞中,Cl-的个数等 1 ,Cs+的个数等于___ 1 。 于___
Cs+:Cl- =1:1,晶胞还呈电中性。
由此可见,在离子晶体中,其实并不存在单独的 “CsCl”分子,只是在整个晶体中Cs+与Cl-的个数比为 1:1,因此CsCl”这一化学式表示的只是氯化铯的组成。
NaCl晶胞还呈电中性吗?
Why ?
活动探究 一
Cl Cl + + Na+ ClNa Na Cl + Cl + Na Cl-
氯 化 Na 钠 + Na Cl Cl Cl 晶 + + NaNa+ Na 体 Cl Cl Na+ ClNa+
化学选修3第2章课时详细课件

化学平衡
总结词
化学平衡是指在一定条件下,可逆反应的正逆反 应速率相等,反应物和生成物的浓度不再发生变 化的状态。
总结词
影响化学平衡的因素主要包括温度、压力和反应 物浓度等。
详细描述
化学平衡是动态平衡,正逆反应仍然在进行,只 是速率相等,各组分的浓度保持不变。化学平衡 常数是一个描述平衡状态的物理量,只与温度有 关。
热学性质
晶体的热膨胀系数、热导率等热学性质与晶 体内部结构密切相关。
力学性质
晶体的硬度、抗压强度等力学性质与晶体内 部结构密切相关。
晶体缺陷与性质
点缺陷
晶体中局部区域的原子排列出现 异常,如空位、间隙原子等,对 晶体的物理和化学性质产生影响。
线缺陷
晶体中出现的裂纹或位错,对晶体 的力学性质产生影响。
化学选修3第2章课时详细 课件
• 引言 • 化学键与分子间作用力 • 分子结构与性质 • 晶体结构与性质 • 化学反应速率与平衡 • 本章总结与复习
01
引言
本章的重要性
掌握物质结构的基础知识
为后续学习奠定基础
本章主要介绍了物质结构的基本概念、 原理和规律,是化学学科的重要基础。
本章内容是后续学习化学选修3其他 章节的基础,对于提高学生的化学素 养和应对高考具有重要意义。
共价键
01
02
03
04
定义
共价键是原子之间通过共享电 子形成的化学键,是共价化合
物中存在的相互作用力。
形成条件
通常在非金属元素之间形成共 价键。
特点
共价键具有方向性和饱和性, 其强度较高,对物质性质影响
较大。
实例
水(H₂O)中的氢原子和氧原 子之间的相互作用就是共价键。
2018-2019学年高二化学选修3教师用书:第2章 第2节 第1课时 一些典型分子的空间构型

第2节共价键与分子的空间构型第1课时一些典型分子的空间构型1.了解典型的分子空间构型,能够制作典型分子的空间模型。
2.了解杂化轨道理论,掌握常见的杂化轨道类型。
(重点)3.能够应用杂化轨道理论解释典型分子的空间构型。
(难点)教材整理1轨道杂化和杂化轨道1.2.甲烷中碳原子的杂化类型。
(1)任意能级的s轨道和p轨道都可以形成杂化轨道。
(×)(2)有多少个原子轨道发生杂化就形成多少个杂化轨道。
(√)(3)杂化轨道用于形成π键。
(×)(4)杂化轨道能量相同。
(√)教材整理2杂化轨道的类型1个s轨道和2个p轨道能否形成sp1杂化轨道?【提示】不能。
轨道杂化后形成杂化轨道的数目与杂化之前相同。
1个s 轨道和2个p轨道形成sp2杂化轨道。
[合作·探究][探究背景]NH3、CH4两分子中,N、C原子都采用sp3杂化,NH3分子空间构型是三角锥形,CH4分子是正四面体形。
[探究问题]1.形成sp3杂化的原子轨道是哪些?杂化轨道夹角是多少?【提示】2s和2p原子轨道,109.5°。
2.两分子空间构型不同的原因是什么?【提示】形成的4个sp3杂化轨道中,NH3分子中只有三个轨道中的未成对电子与H原子的1s电子成键。
另1个轨道中有一对未成键的孤对电子不参加成键,但对成键电子对有较强的排斥作用,使三个N—H键角变小,成为三角锥形。
而CH4分子中4个杂化轨道都分别与4个H原子形成共价键,轨道夹角=共价键键角=109.5°,为正四面体形。
[核心·突破]1.杂化轨道的特点(1)形成分子时,通常存在激发、杂化和轨道重叠等过程。
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
(3)杂化前后轨道数目不变。
(4)杂化后轨道伸展方向、形状发生改变。
(5)只有能量相近的轨道才能杂化(n s、n p)。
2.分子空间构型的确定题组1轨道杂化和杂化轨道1.下列有关杂化轨道的说法不正确的是()A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道B.轨道数目杂化前后可以相等,也可以不等C.杂化轨道成键时,要满足原子轨道最大重叠原理、能量最低原则C.CH4分子中两个sp3杂化轨道的夹角为109.5°【解析】轨道数目杂化前后一定相等。
(完整版)2-2-1一些典型分子的空间构型课件

甲烷的空间构型 乙烯的空间构型 乙炔的空间构型
H
C
H
120。 H
180。
C C 120。 H C C H
H
109.5。 H H
H
H
联想质疑
z
y x 杂化轨道理论动画
思考表达
谈谈对课本41页图2-2-3和42页图2-2-6的理解。
归纳总结
决定
典型分子 C杂化类型 反映空间构型
甲烷
sp3
正四面体形
乙烯
课堂检测
直线形 平面三角形 正四面体形
CH4 CCl4 BCl3 BeCl2 乙炔
sp3杂化轨道-p
sp3杂化轨道-s sp1杂化轨道-p sp1杂化轨道-s sp2杂化轨道-p sp1杂化轨道sp1杂化轨道
选修3 物质结构与性质(鲁科版) 第2章第2节 共价键与分子的空间构型
一些典型分子的空间构型
山东省章丘市第四中学 范才萌
复习回顾
H2中共价键 的形成过程:
HCl中共价键 的形成过程:
Cl2或N2中共价 键 y
x z y
x
z
y
y
x
x
动画展示:一些典型分子的空间构型
sp2
平面形
乙炔
sp1
直线形
键角
109.5。
120。 180。
迁移运用
结合下列分子的空间构型,分析中心原子的杂化 类型,并尝试应用杂化轨道理论解释其空间构型。
F
C
F
109.5。 F
F 正四面体形
F
B
F
120。
F
平面三角形
180。
Cl Be Cl
直线形
勇敢超越
鲁科版选修3化学全册教学课件

(x,y,z) 波函数
四个量子数
①主量子数n: 描述电子离核的远近. n取值为正整数1,2,3,4,5,6… 对应符号为 K,L,M,N,O,P… n 所表示的运动状态称为电子层
②角量子数l :描述(电子云)原子轨道的形状. l 取值为 0,1,2,3… (n-1).共n个数值.
符号为 s, p, d, f 等.
得非常近的谱线.
③在磁场中所有原子光谱可能会分裂成多条谱线.
这些问题用玻尔的原子模型无法解释. 原子中电子的运动状态应用多个量子数来描述. 量子力学中单个电子的空间运动状态称为原子轨道.
每个原子轨道可由三个只能取整数的量子数n、
l 、m共同描述.
思维历程: 量子力学的诞生 (教材P6).
薛定谔方程 与四个量子数
n
l
m
原子轨道
取值 符号 取值 符号 取值
符号
ms 取值
1K0 s 0
1s
±1/2
2L
0s 0
2s
±1/2
1 p 0, ±1 2px 2py 2pz ±1/2
0s0
3s
±1/2
1
p 0, ±1 3px 3py 3pz ±1/2
3M
2
d
0, ±1 ±2
3dxy 3dyz 3dxz 3dx2-y2 3dz2
1、氢原子光谱
狭义的光:波长400~700nm之间的电磁波;
广义的光:即电磁波,包括可见光、红外光、 紫外光、X射线等。
[知识支持] 连续光谱(continuous spectrum):
若由光谱仪获得的光谱是由各种波长的光 所组成,且相近的波长差别极小而不能分辨, 则所得光谱为连续光谱。如阳光等。
鲁科版高中化学选修三课件第2章第2节共价键与分子的空间构型第1课时

(2)孤电子对数的计算 中心原子上的孤电子对数=
与中心原子结合的原 中心原子的价电子数-子未成对电子数之和
2 2.价电子对互斥模型与分子空间构型的关系 价电子对互斥理论模型说的是价电子对的空间构型, 而分子的空间构型指的是成键电子对空间构型,不包括孤 对电子。
①当中心原子无孤对电子时,两者的构型一致;
●新课导入建议 在宏观世界中,花朵、蝴蝶、冰晶等诸多物质展现出 规则与和谐的美。科学巨匠爱因斯坦曾感叹:“在宇宙的 秩序与和谐面前,人类不能不在内心里发出由衷的赞叹, 激起无限的好奇。”实际上,宏观的秩序与和谐源于微观 的规则与对称。 通常,不同的分子具有不同的空间构型。例如,甲烷分子 呈正四面体形、氨分子呈三角锥形、苯环呈正六边形。那 么,这些分子为什么具有不同的空间构型呢?
5.杂化轨道的特点 (1)形成分子时,通常存在激发、杂化和轨道重叠等过 程。 (2)原子轨道的杂化只有在形成分子的过程中才会发 生,孤立的原子是不可能发生杂化的。 (3)杂化前后轨道数目不变。 (4)杂化后轨道伸展方向、形状发生改变。 (5)只有能量相近的轨道才能杂化(ns、np)。
sp1杂化和sp2杂化的两种形式中,原子还有未参与杂化 的p轨道,可用于形成π键,而杂化轨道只能用于形成σ键或 者用来容纳未参与成键的孤对电子。
【解析】 (1)甲醇中碳原子的杂化方式为sp3,分子构 型为四面体,而甲醛中碳原子的杂化方式为sp2,分子构型 为平面三角形,其O—C—H键角为120°,比甲醇中的 O—C—H键角大。
(2)a处Cl原子形成2个σ键后原子中还有2对孤对电子, 因此它采取sp3杂化。
【答案】 (1)sp3 小于 (2)sp3 K2CuCl3
分子的空间构型与杂化轨道类型的关系
高中化学鲁科版选修3课件:第2章第1节 共价键模型

相同,共用电子对不发生偏向 ,两原子均不显电性,这样 的共价键叫非极性共价键,简称非极性键,如Cl—Cl。
二、键参数 1.键能 (1)定义:在101.3 kPa、298 K条件下,断开 1 mol AB(g)分子中的化学键,使其分别生成气态A原子和气态B 原子所吸收 的能量。 (2)表示方式: EA-B 。 (3)含义:键能大小可定量地表示化学键的 强弱程度 , 键能越大,共价键越 牢固,含有该键的分子越 稳定 。
2.氢原子和氟原子、氯原子均可以形成σ键,其成键轨道完 全相同吗? 分析:不相同。氢原子的未成对电子在1s轨道,氟原子、 氯原子的未成对电子分别位于2p、3p轨道,所以HF中的 σ键是1s与2p轨道“头碰头”重叠;而HCl分中的σ键是1s与 3p轨道“头碰头”重叠。
3.为什么氯化氢的分子式为HCl,而水是H2O? 分析:氢原子和氯原子都只有一个未成对电子,根据共 价键的饱和性,一个氢原子和一个氯原子的未成对电子 配对成键,两原子的最外层均达稳定结构,故氯化氢的 分子式为HCl;而一个氧原子有两个未成对电子,要分 别与两个氢原子的未成对电子配对成键,氧原子的最外 层才达到稳定结构。故水的分子式为H2O。
(3)形成元素: 通常,电负性 相同或差值小 的非金属元素原子形成的 化学键为共价键。 (4)表示方法: 用一条短线表示由 一对共用电子形成的共价键,如 H—Cl、H—O—H等;“ === ”表示两对电子形成的共价键, “≡ ”表示三对共用电子形成的共价键等。
2.σ键和π键 (1)σ键: 原子轨道以“ 头碰头 ”方式相互重叠导致电子在核间出现 的概率 增大而形成的共价键。 (2)π键: 原子轨道以“ 肩并肩 ”方式相互重叠导致电子在核间出现 的概率 增大而形成的共价键。 (3)氮分子的N≡N中有一 个σ键, 两个π键。
鲁科版高中化学选修三课件第2章第1节.pptx

本质
高概率地出现在两个原子核之间的 __电__子__与两个原子核之间的__电__性__作__用__
形成 通常是电负性相同或差值小的 元素 ___非__金__属____元素原子
表 用一条短线表示由___一__对__共__用__电__子___所形成 示 的共价键,如H—H、H—Cl;“”表示原子 方 间共用两对电子所形成的共价键,“”表示原 法 子间共用三对电子所形成的共价键
则:(1)A、B、C、D的元素名称分别是 _______、________、________、________。 (2)AD4分子中含有的共价键类型为________ (填“σ键”或“π键”)。 (3)D的负一价阴离子的电子排布式为 ________,B2C2的电子式为________,属 ________(填“离子化合物”或“共价化合 物”)。
想一想 1.非金属元素之间形成的化学键都是共价键 吗? 提示:不一定,如NH4Cl是离子化合物。
2.σ键与π键 (1)σ键 原子轨道以“___头__碰__头___”方式相互重叠导 致电子在核间出现的概率增大而形成的共价 键称为σ键。 (2)π键 原子轨道以“____肩_并__肩____”方式相互重叠导 致电子在核间出现的
【解析】 A在自然界中形成的物质种类最 多,是碳元素;淡黄色固体B2C2是Na2O2,即 B为钠,C为氧;元素D的负一价阴离子的电 子层结构与氩原子相同,D为氯。
【答案】 (1)碳 钠 氧 氯 (2)σ键 (3)1s22s22p63s23p6 离子化合物
【答案】 A
共价键参数的应用
例2 能说明BF3分子的四个原子在同一平 面的理由是( ) A.B—F键的键角为120° B.B—F键是非极性键 C.三个B—F键的键能相同 D.三个B—F键的键长相等
高中化学鲁科版选修三课件:第2章 第2节 第2课时 分子的空间构型与分子性质(23张PPT)

能是极性分子,如 CH3CH2OH 等,B 项说法错误;CO2 是由极 性键形成的非极性分子,C 项说法错误;以极性键结合的双原子
分子都是极性分子,D 项说法正确。答案:D
4.下列含有极性键的非极性分子是
()
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2
⑥H2S ⑦SO2 ⑧CS2 ⑨H2O ⑩HF
CO2、CS2等 (键角180°)
H2O(键角 104.5°)、
SO2(键角 119.5°)等
分子类型
四
原
子
AB3
分
子
五 原
AB4
子 分 ABnC4-n 子 (n<4且
为整数)
键的极性 极性键 极性键 极性键
极性键
分子构型 平面三角 形(对称) 三角锥形 (不对称)
正四面体 形(对称)
四面体形 (不对称)
第 2 课时 分子的空间构型与分子性质
[课标要求] 1.了解极性分子和非极性分子。 2.了解“手性分子”在生命科学等方面的应用。
1.对称分子:依据对称轴的旋转或借助对称面的反映能够复原 的分子。
2.手性碳原子:连接四个不同原子或原子团的碳原子。 3.手性分子:含有手性碳原子的分子。 4.极性分子:分子内存在正
A.由极性键构成的分子都是极性分子
B.含非极性键的分子一定是非极性分子
C.极性分子一定含有极性键,非极性分子一定含有非极性键
D.以极性键结合的双原子分子,一定是极性分子 解析:由极性键构成的分子若空间构型对称,则分子是非极性分
子,A 项说法错误;含非极性键的分子也可能含有极性键,也可
判断分子极性的方法 (1)根据分子的对称性判断 分子结构对称,正电荷重心和负电荷重心重合,则为非极性 分子,正、负电荷重心不重合,则为极性分子。 (2)根据键的极性判断
化学鲁科版选修3课件:第2章 章末知识网络构建

•7、不能把小孩子的精神世界变成单纯学习知识。如果我们力求使儿童的全部精神力量都专注到功课上去,他的生活就会变得不堪忍受。 他不仅应该是一个学生,而且首先应该是一个有多方面兴趣、要求和愿望的人。2021/11/162021/11/16November 16, 2021
章末
章
末
综
知识网络构建
合
测
评
1.共价键
2.金ቤተ መጻሕፍቲ ባይዱ键和离子键 (1)金属键
(2)离子键
3.分子间作用力与分子的空间构型 (1)分子间作用力
•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
•8、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不能 在他的身上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。 2021/11/162021/11/162021/11/162021/11/16
(2)分子的空间构型 分 子 的 空 间 构 型理常论见解分释子价 杂的电 化空子 轨间对 道构互 理型斥 论⑰V三 ⑱理—形角论—(锥杂H形化2O(方)(N(式HBC3sssFH)ppp31423)杂 )杂 杂化化 化
【答案】 1.①共用电子对 ②方向性 ③饱和性 ④头碰头 ⑤肩并肩 ⑥稳定
鲁科版高二化学选修三1.1原子结构模型课件(17张)

第2章 化学键与分子间作用力
第1节 共价键模型(第1课时)
阜阳市红旗学键 的知识,回答以下几个问题:
(1)化学键的定义及基本分类 (2)离子键、共价键的定义
(3)离子化合物、共价化合物的定义
一、共价键的形成和本质 1.共价键的形成
三、共价键的类型
1.σ键:“头碰头”
s—s px—s px—px
++
-
++
-
++
X
形成σ键的电子 称为σ电子。
X 原子轨道沿核
间连线重叠
-
(即头碰头方
X 式)形成的共
价键,叫σ键.
2.π键:“肩并肩”
pZ—pZ
ZZ
+
+
X
I
I
原子轨道在核间连线两 侧进行重叠(即采用肩并 肩)方式形成的共价键,叫 π键.
A.①②③ C. ①③⑥
B.③④⑤⑥ D. ③⑤⑥
课后练习
1、P39页迁移应用:1、2、3、4 2、预习第三节《共价键与分子的空间构型》
从氢分子形成示意图说起
(1)氢原子间距离与能量的关系: (2)为什么会出现这种情况?
2.共价键的本质: 高概率地出现在两个原子核间的电子与
两个原子核之间的电性作用是共价键的本质. 如:H2 是H原子间1s电子 HCl是H的1s电子与Cl的3p电子 Cl2 是两个Cl原子3p轨道上的一个电子。
3.共价键的形成条件
1.通常电负性相同或差值小的非金属元素 原子形成的化学键;
2.成键原子一般有未成对电子,用来相互 配对成键(自旋反向);
3.成键原子的原子轨道在空间重叠使体系 能量降低。
高中化学第2章章末复习课课件鲁科版选修3

栏目导航
18
4.根据共价键类型判断 从杂化轨道理论可知,原子之间成键时,未杂化轨道形成 π 键,杂化 轨道形成 σ 键。对于能够明确结构式的分子、离子,可直接用下式判断其 中心原子的杂化轨道类型:杂化轨道数 n=中心原子的 σ 键数+中心原子 的孤电子对数(双键、叁键中只有一个σ键,其余均为π键)。 (1)SiF4 分子中硅原子杂化轨道类型分析:基态硅原子有 4 个价电子, 与 4 个氟原子恰好形成 4 个 σ 键,无未成键电子,n=4,则 SiF4 分子中 硅原子采用 sp3 杂化。
21
(2)(CH3)3N 可看做三个甲基取代了 NH3 分子中的三个氢原子,所以 其分子中氮原子采用 sp3 杂化。
(3)H2O2 可看做羟基取代了 H2O 分子中的一个氢原子,故 H2O2 中氧 原子应采用 sp3 杂化。
(4)B(OH)3 可看做三个羟基取代了 BF3 中的氟原子,可知 B(OH)3 中 硼原子采用 sp2 杂化。
根据价电子对互斥理论能够比较容易而准确地判断 ABm 型共价分子 或离子的空间构型和中心原子杂化轨道类型,其关系如下表。
中心原子价
杂化轨道空
中心原子杂
电子对数
间构型
化轨道类型
2
直线形
sp1
3
平面三角形
sp2
4
正四面体形
sp3
15
运用该理论的关键是准确计算中心原子的价电子对数,其计算方法如 下:
注意:对于阳离子,a=中心原子价电子数-离子电荷数;对于阴离 子,a=中心原子价电子数+|离子电荷数|。
金属元素之
一方有空轨 属(合金)
非金属元素
间)
化学鲁科版选修3课件:第2章 章末知识网络构建

You made my day!
我们,还在路上……
【答案】 1.①共用电子对 ②方向性 ③饱和性 ④头碰头 ⑤肩并肩 ⑥稳定
2.⑦金属阳离子 ⑧金属离子、自由电子 ⑨无饱和性、无方向性 ⑩ 越强 ⑪阴、阳离子 ⑫阴、阳离子 ⑬无饱和性、无方向性 ⑭越强
3.⑮越高 ⑯升高 ⑰平面三角形 ⑱四面体形
章末综合测评(二) 点击图标进入…
•不习惯读书进修的人,常会自满于现状,觉得没有什么事情需要学习,于是他们不进则退2022年4月13日星期三2022/4/132022/4/132022/4/13 •读书,永远不恨其晚。晚比永远不读强。2022年4月2022/4/132022/4/132022/4/134/13/2022 •正确的略读可使人用很少的时间接触大量的文献,并挑选出有意义的部分。2022/4/132022/4/13April 13, 2022 •书籍是屹立在时间的汪洋大海中的灯塔。
章末
章
末
综
知识网络构建
合ห้องสมุดไป่ตู้
测
评
1.共价键
2.金属键和离子键 (1)金属键
(2)离子键
3.分子间作用力与分子的空间构型 (1)分子间作用力
(2)分子的空间构型 分 子 的 空 间 构 型理常论见解分释子价 杂的电 化空子 轨间对 道构互 理型斥 论⑰V三 ⑱理—形角论—(锥杂H形化2O(方)(N(式HBC3sssFH)ppp31423)杂 )杂 杂化化 化
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2节 第1课时
知 识 点 二
共价键与分子的空间构型 一些典型分子的空间构型
学 业 分 层 测 评
1.了解典型的分子空间构型,能够制作典型分子的空间模型。 2.了解杂化轨道理论,掌握常见的杂化轨道类型。 (重点) 3.能够应用杂化轨道理论解释典型分子的空间构型。(难点)
甲 烷 分 子 的 空 间 构 型
【提示】 2s和2p原子轨道,109.5°。
2.两分子空间构型不同的原因是什么?
【提示】 形成的4个sp3杂化轨道中,NH3分子中只有三个轨道中的未成对 电子与H原子的1s电子成键。另1个轨道中有一对未成键的孤对电子不参加成 键,但对成键电子对有较强的排斥作用,使三个N—H键角变小,成为三角锥 形。而CH4分子中4个杂化轨道都分别与4个H原子形成共价键,轨道夹角=共价 键键角=109.5° ,为正四面体形。
【答案】 (1)sp3
CH4>NH3>H2O BF3、C2H4、C6H6 CH4 H2O NH3
(2)BeCl2、C2H2、CO2
【规律方法】
杂化轨道类型的判断
(1)对于ABm型分子、中心原子的杂化轨道数可以这样计算。杂化轨道数 中心原子价电子数+配位原子提供的价电子数 n= 。 2 其中配位原子中,卤素原子、氢原子提供1个价电子,硫原子、氧原子不 提供价电子,即提供价电子数为0。
【解析】 乙炔的结构式为H—C≡C—H,其空间构型为直线形,属于sp1 杂化。
【答案】 A
5.在 式是( ) sp2 sp3
中,中间的碳原子和两边的碳原子分别采用的杂化方
A.sp2 C.sp2
B.sp3 D.sp1
sp3 sp3
【解析】
中碳原子形成了3个σ键,无未成键价电子对,需要形成
3个杂化轨道,采用的杂化方式是sp2。两边的碳原子各自形成了4个σ键,无未 成键电子对,需要形成4个杂化轨道,采用的是sp3杂化。
杂化类型 用于杂化的原子轨道及数目 杂化轨道的数目 杂化轨道间的夹角 空间构型 实例
CO2、C2H2 BF3、苯、乙烯 CH4、CCl4
1个s轨道和2个p轨道能否形成sp1杂化轨道?
【提示】 不能。轨道杂化后形成杂化轨道的数目与杂化之前相同。1个s 轨道和2个p轨道形成sp2杂化轨道。
[合作· 探究] [探究背景] NH3、CH4两分子中,N、C原子都采用sp3杂化,NH3分子空间构型是三角 锥形,CH4分子是正四面体形。 [探究问题] 1.形成sp3杂化的原子轨道是哪些?杂化轨道夹角是多少?
【答案】 A
3.能正确表示CH4中碳原子成键方式的示意图为(
)
【解析】 碳原子中的2s轨道与2p轨道形成4个等性的杂化轨道,因此碳原 子最外层上的4个电子分占在4个sp3杂化轨道上并且自旋方向相同。
【答案】 D
题组2 杂化轨道的类型 4.乙炔分子中的碳原子采取的杂化方式是( A.sp1杂化 C.sp3杂化 B.sp2杂化 D.无法确定 )
CH4 CCl4
sp3
四面体
3
1
NH3 NF3
2
2
V形
H2O
冲关] [题组· 题组1 轨道杂化和杂化轨道 )
1.下列关杂化轨道的说法不正确的是(
A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新 轨道 B.轨道数目杂化前后可以相等,也可以不等 C.杂化轨道成键时,要满足原子轨道最大重叠原理、能量最低原则 C.CH4分子中两个sp3杂化轨道的夹角为109.5°
[基础· 初探] 教材整理1 轨道杂化和杂化轨道
1.
2.甲烷中碳原子的杂化类型。
(1)任意能级的s轨道和p轨道都可以形成杂化轨道。(×) (2)有多少个原子轨道发生杂化就形成多少个杂化轨道。(√) (3)杂化轨道用于形成π键。(×) (4)杂化轨道能量相同。(√)
教材整理 2
杂化轨道的类型 sp1 s p 1 1 2 180° 直线形 sp2 1 2 3 120° 平面三角形 sp3 1 3 4 109.5° 正四面体形
【答案】 C
6.(1)对于CH4、NH3、H2O三分子,中心原子都采用________杂化,键角 由大到小顺序是________。 (2)对于H2O、BeCl2、BF3、C2H2、C2H4、CH4、C6H6、NH3、CO2等分子, 中心原子采用sp1杂化的:________,sp2杂化的:________,sp3杂化的: ________。
2.分子空间构型的确定 轨道杂 电子对的 成键电 化类型 空间构型 子对数 孤对 电子 数 0 电子对的排 列方式 分子的 空间构 型 直线形 平面三 角形 V形 HC≡CH BeCl2 CO2 BF3 BCl3 实例
sp
1
直线型
2
sp
2
平面三角 形
3
0
2
1
SnBr2 PbCl2
4
0
正四面 体 三角锥
[核心· 突破] 1.杂化轨道的特点 (1)形成分子时,通常存在激发、杂化和轨道重叠等过程。 (2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可 能发生杂化的。 (3)杂化前后轨道数目不变。 (4)杂化后轨道伸展方向、形状发生改变。 (5)只有能量相近的轨道才能杂化(ns、np)。
【解析】 轨道数目杂化前后一定相等。
【答案】 B
2.下列关于杂化轨道的说法错误的是( A.所有原子轨道都参与杂化
)
B.同一原子中能量相近的原子轨道参与杂化 C.杂化轨道能量集中,有利于牢固成键 D.杂化轨道中不一定有电子
【解析】 参与杂化的原子轨道,其能量不能相差太大,如1s轨道与2s、 2p轨道能量相差太大,不能形成杂化轨道,即只有能量相近的原子轨道才能参 与杂化,故A项错误,B项正确;杂化轨道的电子云一头大一头小,成键时利用 大的一头,可使电子云重叠程度更大,形成牢固的化学键,故C项正确;并不 是所有的杂化轨道中都会有电子,也可以是空轨道,也可以有一对孤电子对(如 NH3、H2O的形成),故D项正确。
例如: 代表物 杂化轨道数(n) 杂化轨道类型 1 CO2 sp1 (4 + 0) = 2 2 1 CH2O sp2 (4 + 2 + 0) = 3 2 1 CH4 sp3 (4 + 4) = 4 2 1 SO2 sp2 (6 + 0) = 3 2 1 NH3 sp3 (5 + 3) = 4 2 1 H2O sp3 (6 + 2) = 4 2
