湖南省长沙市2018中考化学复习第二部分重点专题突破专题三物质的推断课件201803261139
湖南省长沙市2018中考化学复习第二部分重点专题突破专题三物质的推断专题集训(含答案)
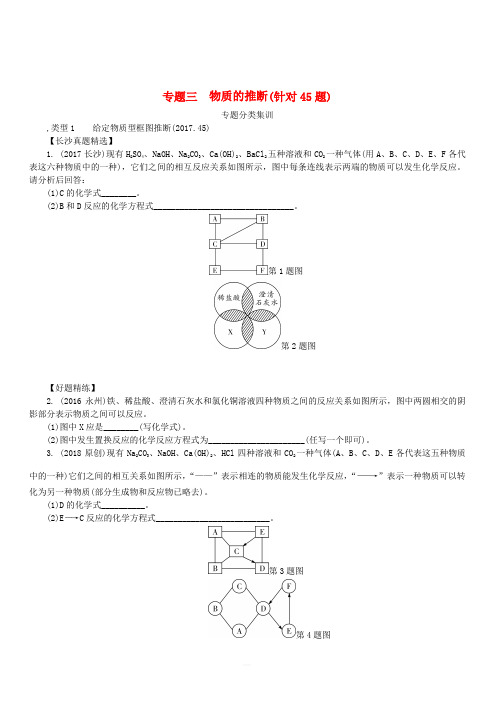
专题三物质的推断(针对45题)专题分类集训,类型1 给定物质型框图推断(2017.45)【长沙真题精选】1. (2017长沙)现有H2SO4、NaOH、Na2CO3、Ca(OH)2、BaCl2五种溶液和CO2一种气体(用A、B、C、D、E、F各代表这六种物质中的一种),它们之间的相互反应关系如图所示,图中每条连线表示两端的物质可以发生化学反应。
请分析后回答:(1)C的化学式________。
(2)B和D反应的化学方程式________________________________。
第1题图第2题图【好题精练】2. (2016永州)铁、稀盐酸、澄清石灰水和氯化铜溶液四种物质之间的反应关系如图所示,图中两圆相交的阴影部分表示物质之间可以反应。
(1)图中X应是________(写化学式)。
(2)图中发生置换反应的化学反应方程式为______________________(任写一个即可)。
3. (2018原创)现有Na2CO3、NaOH、Ca(OH)2、HCl四种溶液和CO2一种气体(A、B、C、D、E各代表这五种物质中的一种)它们之间的相互关系如图所示,“——”表示相连的物质能发生化学反应,“――→”表示一种物质可以转化为另一种物质(部分生成物和反应物已略去)。
(1)D的化学式__________。
(2)E―→C反应的化学方程式__________________________。
第3题图第4题图4. A~F分别为碳酸氢铵、碳酸钙、稀盐酸、碳酸钠、氢氧化钙、氧化钙中的一种,A中不含金属元素,它们间有如图所示的反应与转化关系。
图中“――→”表示物质间的转化关系,“——”表示两种物质能相互反应。
请回答下列问题:(1)C的化学式____________。
(2)B、C间反应的化学方程式为______________________________。
5. (2016枣庄)A、B、C、D、E分别是锌、硫酸、氢氧化钡、硫酸铜和碳酸钠五种物质中的一种。
2018长沙中考化学复习名师PPT课件(5份) 人教版4

2、判断下列说法的正误。
(1)只要有单质和化合物参加的 反应一定是置换反应 ( ╳ )
(2)只要有单质和化合物生成的 反应一定是置换反应 ( ╳ )
(3)还原氧化铜的反应一定是置
二.金属与盐酸、稀硫酸的反应
A组:在试管中分别
放入镁条、锌粒、铁 丝、铜丝。然后,分 别向其中加入一些稀 盐酸。
B组:在试管中分别放
入镁条、锌粒、铁丝、 铜丝。然后,分别向 其中加入一些稀硫酸。
镁与稀盐 酸(或稀 硫酸)
锌与与稀 盐酸(或 稀硫酸)
铁与与稀 铜与与稀 盐酸(或 盐酸(或 稀硫酸) 稀硫酸)
换反应
(╳ )
三.金属与盐溶液的反应
实验步骤: 1.把一根用砂纸打磨过的铝丝浸入硫酸铜
溶液中,一会取出,观察。 2.把一根洁净铜丝浸入硝酸银溶液中,一
会取出,观察。 3.把另一根洁净铜丝浸入硫酸铝溶液中,
一会取出,观察。
铝丝浸入硫酸铜溶液中 铜丝浸入硝酸银溶液中
实验
反应现象
铝丝浸入硫 铝丝上有红色物质 酸铜溶液中 生成,溶液颜色逐
金属的化学性质
想一想 现假黄金多为黄铜(铜锌合金), 根据你所学知识,能不能初步鉴定 “真黄金”与“假黄金”?
知识回顾
1 、我们学过哪些金属可以和氧气反应? 2、它们和氧气反应的条件呢?
3Fe+2O2 点燃 Fe3O4 2Mg+O2 点燃 2MgO
一.金属与氧气的反应
大多数金属都能与氧气反应,但反应难易和剧烈程度不同
渐变淡
2018湖南中考化学复习:常考专题突破PPT课件(18份) 人教版1优质课件

【实验验证】
①取澄清液,加入适量的CaCl2溶液:无明显现象,则澄清液
中不含__N__a_2_C_O__3_______;
②取澄清液,通入CO2气体:产生浑浊。写出产生浑浊的化
学方程式_C__a_(_O_H__)_2_+__C_O__2_____C__a_C_O__3_↓_+__H__2O_______。
三、氢氧化钙
1. 性质:氢氧化钙微溶于水。 2. 检验:①通入二氧化碳,石灰水变浑浊;②加入碳 酸钠溶液,有白色沉淀生成。
3. 涉及的化学方程式:①氧化钙与水反应: __C__a_O_+__H__2O______C_a_(_O__H_)_2_____;②CO2通入澄清石 灰水,变浑浊:C__a_(O__H_)_2_+__C_O__2____C__a_C_O__3↓_+__H__2_O__。
【交流反思】化学反应后形成的溶液中溶质的确定,既要考
虑反应产物,也要考虑反应物是否过量。
【解析】【问题分析】(1)实验1利用滴加有酚酞溶液的氢氧 化钠溶液与稀盐酸混合验证酸碱中和反应。(2)实验2中氢氧 化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠。(3) 根据澄清液显碱性,结合所涉及物质分析,可能石灰水有剩 余,溶液中含有Ca(OH)2;也可能是碳酸钠溶液有剩余,溶 液中含有 Na2CO3。【实验验证】①氯化钙与碳酸钠溶液反应 生成碳酸钙沉淀和氯化钠,根据“无明显现象”,可知澄清 液中不含Na2CO3;②二氧化碳与氢氧化钙溶液反应生成碳 酸钙沉淀和水。
第二部分 湖南5年中考常考专题突破
专题七 实验探究题
目录
类型一 反应后物质成分的探究 类型二 物质变质的探究 类型三 标签受损类成分的探究 类型四 混合物成分的探究 类型五 金属性质的相关探究
中考化学 专题复习三 物质的推断课件

_______;
CaC③O3溶于酸B但a没CO有3 气体产生的白色沉淀(2个):
__________、Al(OH)3。
2021/12/12
Mg(OH)2
第五页,共五十页。
题眼二 物质的用途
(1)通常用于灭火的气体是___C_O_。2 (2)常用作消毒剂的是____、酒精___(ji_ǔj_īn、Hg) 2_O__2 ___K_。MnO4
(6)推断中常见的碱:NaOH、Ca(OH)2。
(7)推断中常见的钠盐:NaCl、Na2CO3、NaHCO3。
2021/12/12
第十页,共五十页。
题眼四 元素、物质之最
(1)地壳中含量最多的元素是_____,O含量最多的金
属元素是_____。 Al
(2)形成化合物最多的元素是_____C。
(3)人体中含量最多的物质是____H;2O按体积分数计
复分解(fēnjiě)反应
2ቤተ መጻሕፍቲ ባይዱ21/12/12
第二十一页,共五十页。
【解题思路】
第1步:“题眼突破”:(1)根据(gēnjù)“题眼四” (元素、物质之最)可以推出最清洁的燃料N是 氢气。(2)根据“题眼一”(物质的特征颜色)可 以推出常温下为液态的金属P为汞。(3)根据“题
眼一”(物质的特征颜色)可以推出不溶于稀硝酸 的白色沉淀为氯化银,则Q中一定含有氯元素。
1. 常见的单质或化合物 (1)密度最小的气体:H2。
(2)有刺激性气味的气体:SO2、NH3。
(3)造成酸雨(suān yǔ)的主要物质之一:SO2。 (4)使紫色石蕊溶液变蓝的气体:NH3。
(5)与水反应放出大量热的是:CaO。
2021/12/12
第八页,共五十页。
2018湖南中考化学复习:常考专题突破PPT课件(18份) 人教版3优质课件

___部__分__氨__气__溶__于__水__中__(写一条)。
【解析】(1)氮化镁与水反应的化学方程式为:Mg3N2+6H2O
3Mg(OH)2+2NH3↑。(2)设a g镁和氧气反应生成氧化镁的质量为
【实验猜想】猜想1:只有CO; 猜想2:只有__C_O__2 _(填化学式);猜想3:只有CO和 CO2。 【设计实验】基于猜想3,根据CO和CO2的性质,兴趣 小组 同学设计了如下实验:
【实验探究】 (1)观察到A装置中的澄清石灰水变浑浊,证明草酸分解有 CO2气体生成,请写出A装置中的化学反应方程式: ___C _O __2_ __C _a _(_O _H __)_2_______C _a _C __O _3_ __ _H __2_O _________;
(一)装置B的作用是___吸__收__水__蒸__气_____;
(二)装置D的作用是_防__止__空__气__中__的__水__蒸__气__进__入__C__装__置__中_____; (三)实验步骤④中鼓入空气的目的是__使__生__成__的__氨__气__完__全____ ___被__浓__硫_酸__吸__收__;
【解析】【实验猜想】草酸固体分解生成碳的氧化物和水,
碳的氧化物包括一氧化碳和二氧化碳,则猜想2为只有CO2。 【实验探究】(1)A装置中发生的反应是CO2与澄清石灰水反应 生成碳酸钙和水,化学方程式为CO2+Ca(OH)2=== CaCO3↓+ H2O。(2)一氧化碳具有还原性,与氧化铜反应可生成铜和二氧 化碳,二氧化碳能使澄清石灰水变浑浊,即可观察到C装置中 澄清石灰水不变浑浊,装置F中的澄清石灰水变浑浊;E装置
【初中化学】2018湖南中考化学复习:常考专题突破PPT课件(18份) 人教版8

湖南5年中考常考专题突破
专题五 物质的推断与推断
专题突破
一、常见物质的转化关系
专题突破
专题分类集训
题眼一
物质的状态和颜色
1.固体的颜色
颜色
物质(化学式) 铁锈的主要成分(Fe2O3)、红磷(P)、铜(Cu)、 氧化汞粉末(2016株洲)
红色 黑色
炭粉(பைடு நூலகம்年5考)、铁粉(2013娄底)、CuO(5年6
84 100 盐
MgCO3、NaHCO3 CaCO3
106
160
Na2CO3(2017株洲)
CuSO4(2015株洲) CH4
有机物
16
专题分类集训
类型一
一步转化(选择题)(2017岳阳38题,2014年2考,2013 郴州19题)
2KMnO4 K2MnO4+MnO2+O2↑ 。 (1)KClO3分解制取O2:__________________________________
△
2H2O2 2H2O+O2↑ (2)H2O2分解制取O2:__________________________________ 。
MnO2
题眼六
有热量变化的
4.溶解(吸热,使温度降低):固体硝酸铵(NH4NO3)溶于水。
题眼七
常见的物质
1. 常温下,无色无味的气体(5年3考):O2、N2、CO2、
CO、CH4。
2. 常温下,无色液体(5年3考):H2O。
3. 常见的酸(2015株洲、娄底):H2SO4、HCl、HNO3。
4.常见的碱(2017怀化,2015怀化):NaOH、Ca(OH)2、
Ba(OH)2。
题眼八
组成元素相同的物质
2018中考化学总复习第二部分专题复习高分保障专题3物质的推断课件新人教版

【思路点拨】 (1)若甲、丙是单质,乙、丁是化合物,且甲、 乙均为黑色粉末,则甲是碳,乙是氧化铜,高温条件下碳和氧 化铜反应生成铜和二氧化碳,属于置换反应,反应结束后,固 体质量减少。(2)某些盐能和某些碱反应生成另外一种盐和另 外一种碱,因此若甲、乙、丙、丁都是化合物,则反应物是碱 和盐,生成物也是碱和盐,且丙是蓝色沉淀,则丁是盐,例如 硫酸铜和氢氧化钠反应生成硫酸钠和氢氧化铜沉淀。
押题训练
1.甲、乙、丙、丁四种物质在一定条件下能发生如下反 应:甲+乙→丙+丁。 (1)若甲、丙为化合物,乙、丁为单质,则上述反应的基 本反应类型是 置换反应 ,写出一个符合该反应类型的化 学方程式 CuSO4+Fe===FeSO4+Cu(合理即可) 。 (2)若甲、乙、丙、丁均为化合物,且甲溶液呈蓝色,乙 为烧碱,则乙的化学式为 NaOH ,反应发生时观察到的现 象是 有蓝色沉淀从溶液中析出 。 (3)若甲、乙、丙、丁均为化合物,且丙为水,丁为盐, 则该反应 不一定 (填“一定”或“不一定”)是中和反应, 理由是 某些金属氧化物与酸反应生成盐和水,某些非金属 氧化物与碱反应也生成盐和水 。 (4)若甲、乙、丙为化合物,丁为单质,且乙、丙是组成 元素相同的气体,该反应在工业上的用途是 冶炼合金(或 炼铁) 。
类型2 框图型推断题 这类题型一般不限定物质范围,给出各物质转化关系, 要求考生推断出各未知物。此题型要以物质的转化关系为依 据,用逆推法由果求因,再用顺推法加以验证。 【例2】[2017· 襄阳中考]图示中A~F是初中化学常见的物 质。按单质、氧化物、酸、碱、盐分类,A、B、C、D、E 是五种不同类别的物质,F是大理石的主要成分。图中“—” 表示相连的两种物质之间可以发生反应,“→”表示物质间 存在着相应的转化关系(部分反应物、生成物及反应条件已 略去)。请回答:
【初中化学】2018长沙中考化学复习名师PPT课件(5份) 人教版1

说出酸、碱、盐的溶解性规律(20℃)
OH-
H+
NH4+ K+ 溶、挥 溶
NO3-
溶、挥
溶 溶
Cl-
溶、挥
溶 溶
SO42-
溶
溶 溶
CO32-
溶、挥
溶 溶
Na+
Ba2+ Ca2+
BaCl2 + Na2SO4 =BaSO4 ↓ + 2NaCl
归纳盐的化学性质
1.盐 + 金属 → 新盐 + 新金属
(可溶)
2.盐 +
3.盐 +
(可溶)
酸 → 新盐 + 新酸
碱 → 新盐 + 新碱
(可溶) (至少有一种沉淀)
4.盐 +
(可溶)
盐
(可溶)
→
新盐 + 新盐
(至少有一种沉淀)
复分解反应
两种化合物在反应时互相交换成分生成另外两种 化合物的反应。
AB+CD → AD+CB
特点:双交换、价不变
复分解反应的条件 至少具备以下3个条件中的一个:
(1)生成水;(2)生成气体;(3)生成沉淀。
(1) HCl+ NaOH = NaCl + H2O
(2) CaCO3 +2HCl = CaCl2 + H2O+CO2↑ (3) Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑ (4) Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓
在金属活动性顺序表中,只有______ 位于前面 的金属才能把____的金属从它的___ 盐溶液 位于后面 中置换出来,与氢的位置___关;盐必须 无 是___盐。 可溶性 不能用K、Ca、Na置换盐溶液中的金属
2018长沙中考化学复习名师PPT课件(5份) 人教版3

排空气法(密度比空气大) 导管伸入集气瓶底部,便于排 尽集气瓶中的空气。
优点:收集的氧气较干燥。
氧气的检验和验满 检验:
将带火星的木条伸入瓶中,若木条复 燃,则说明该气体是氧气。
验满:
将带火星的木条放在瓶口,若木条复 燃,则说明收集的氧气已满。
再
见
• • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • •
我们周围的空气
一、空气的成分及用途
1.成分
2.用途
氮气(N2):保护气(食品包装、灯泡、焊接
金属)——化学性质不活泼 氧气(O2):医疗、飞行、登山、潜水等——供 给呼吸;炼钢、焊接、切割金属 等——助燃性 稀有气体:电光源(霓虹灯、闪光灯、航标灯); 氦气用于制造低温环境
二氧化碳:光合作用的原料;灭火;人工降雨
CO和CH4燃烧产生蓝色火焰,均是放热反应。
综上所述: 氧气是一种化学性质比较活泼的气体, 它在氧化反应中提供氧,具有氧化性,是 一种常用的氧化剂。
四、实验室制取氧气
高锰酸钾制氧气:
2KMnO4 K2MnO4 + MnO2 + O2↑ 2KCl + 3O2 ↑
氯酸钾制氧气:
2KClO3
MnO2
高锰酸钾制取氧气时,在试
(2) 常见物质在空气或氧气中燃烧 ①与非金属单质反应: 木炭 C + O2
点 燃
CO2
在空气中:木炭红热,无烟,无焰,放热。
在氧气中:剧烈燃烧,放热,发出白光。 硫 S + O2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7. 可作干燥剂的是浓硫酸、氢氧化钠固体、碱石灰。
8. 能治疗胃酸过多的是碳酸氢钠、氢氧化铝、氢氧化镁。
9. 可用于建ቤተ መጻሕፍቲ ባይዱ材料的是碳酸钙、氢氧化钙。
题眼三 物质的俗名、主要成分、化学式 俗名(名称) 胃酸 苛性钠、火碱、烧碱 生石灰 铁锈 熟石灰、消石灰、 澄清石灰水 学名(或主要成分) 盐酸(2016.45) 氢氧化钠 氧化钙 氧化铁 化学式 HCl NaOH CaO Fe2O3
氢氧化钙
Ca(OH)2
俗名(名称)
苏打、纯碱
学名(或主要成分)
10. 能改良酸性土壤的是氢氧化钙。
11. 可作补钙剂的是碳酸钙。
12. 常用作调味品、配制生理盐水的是氯化钠。
13. 发酵粉的主要成分是碳酸氢钠,并可用来焙制糕点。
题眼五 物质和元素之最 1. 物质之最 (1)人类使用最广、年产量最高(2015.45)、合金中使用最 铁(Fe) 多的金属单质 ______。 (2)生物体内含量最多的物质、人类赖以生存的无色液体、 最常用的溶剂________ 水(H。 2O)
5. 盐 常见的盐: ① 碳酸盐:Na2CO3、CaCO3、 BaCO3等; ② 氯化盐:BaCl2、CuCl2、 MgCl2等; ③ 硫酸盐 :CuSO4、 Na2SO4、BaSO4等 ; ④ 硝酸盐 :Ba(NO3)2、AgNO3等。 性质:
①能和金属反应(必须是相对活泼的金属置
换不活泼的,K、Ca、Na除外), 条件是
如硫酸铜和铁反应;
②能和酸反应,如碳酸钙和盐酸反应;
能发生
复分解
③能和碱反应,如硫酸铜和氢氧化钠反应;
④能和盐反应,如氯化钠和硝酸银。
反应
二、常考物质的三角关系
题眼二 物质的状态和颜色
1. 固体的颜色 颜色 红色 物质 铁锈的主要成分(Fe2O3))(2016.45)、铜
(Cu)(2014.45)、红磷(P) 氧化铜(CuO)(2014.45)、炭粉、铁粉、四氧化
碳酸钠
化学式
Na2CO3
小苏打
大理石、石灰石
碳酸氢钠
碳酸钙
NaHCO3
CaCO3
食盐、生理盐水
沼气、天然气 酒精
氯化钠
甲烷 乙醇
NaCl
CH4 C2H5OH
题眼四 物质的性质/用途
1. 造成温室效应的主要气体是________ 二氧化碳。(2010.45)
2. 可用于冶炼金属的是碳、氢气、一氧化碳。 氢气 。 3. 最清洁的燃料是_____
氢气(H2) 。 (3)最理想的燃料________
(4)最简单的有机物__________ 甲烷(CH4) 。 氢气(H2) 。 (5)相对分子质量最小的单质________ (6)相对分子质量最小的氧化物________ 水(H2O)。
(7)相同条件下,密度最小的气体氢气 ________ (H2 ) 。 一氧化碳 (CO) 。 (8)易与血红蛋白结合,造成人体中毒的气体 ____________
金刚石(C) 。 (9)天然存在最硬的物质___________
2. 元素之最 O ,最多的金属元素_____ Al 。 (1)地壳中含量最多的元素____ H 。 (2)相对原子质量最小的元素____
题眼六 组成元素相同的物质
1. 气体:CO2和CO。
2. 液体:H2O和H2O2。
3. 固体:Fe2O3和Fe3O4。
②高温煅烧石灰石能生成二氧化碳; ③稀盐酸和碳酸盐反应能生成二氧化碳。 CO: 能还原金属氧化物生成二氧化碳和金属单质。 Fe2O3 、CuO: ①能和酸反应生成盐和水; ②能与氢气、碳、一氧化碳等还原性物质反应生成 金属单质。 CaO: ①能和水反应生成氢氧化钙; ②高温煅烧石灰石能生成氧化钙。
浅绿色 FeCl2、Fe(NO3)2、FeSO4 等含Fe2+的溶液
黄色 紫红色 FeCl3、Fe(NO3)3、Fe2(SO4)3等含Fe3+的溶液 KMnO4溶液
3. 初中常见的7种沉淀 (1)蓝色沉淀:Cu(OH)2(碱)。 (2)红褐色沉淀:Fe(OH)3(碱)。 (3)白色沉淀: 盐:BaSO4、AgCl、CaCO3、BaCO3; 碱:Mg(OH)2。 ①不溶于水也不溶于稀硝酸的白色沉淀(盐): BaSO4(2012.45)、AgCl。 ②溶于酸并有气体放出的白色沉淀(盐):CaCO3、BaCO3。 ③溶于酸但没有气体放出的白色沉淀(碱):Mg(OH)2。
4. 溶液中溶质:铁盐与亚铁盐,如FeCl3和FeCl2、
Fe2(SO4)3和FeSO4。
题眼七 常见物质的相对分子质量
相对分子质量 18(相对分子质量最小) 56 80 160 160 化学式 H2 O CaO CuO Fe2O3 CuSO4
3. 酸(HCl、H2SO4) 性质:
①能和活泼金属反应,如锌和硫酸反应; ②能和金属氧化物反应,如氧化铜和盐酸反应; ③能和碱反应,如氢氧化钠和盐酸反应; ④能和部分盐反应,如碳酸钠和硫酸反应。
4. 碱[NaOH 、Ca(OH)2、Ba(OH)2] 性质:
①能和酸反应,如氢氧化钙和盐酸反应; ②能和某些非金属氧化物反应,如二氧化碳和氢氧化 钠反应; ③能和部分盐溶液反应,如氢氧化钙和碳酸钠反应。
三铁(Fe3O4)
黑色
颜色 白色
物质(化学式) 碳酸钠(Na2CO3)、氢氧化钠(NaOH)、氢氧化
钙[Ca(OH)2]、氧化钙(CaO)
高锰酸钾(KMnO4)、碘(I2) 镁(Mg)、铁(Fe)、锌(Zn)、银(Ag)、铝(Al)等 大多数金属
暗紫色 银白色
2. 溶液的颜色 蓝色 CuSO4、Cu(NO3)2等含Cu2+的溶液
第二部分 重点专题突破
专题三 物质的推断(针对45题)
题眼归纳
题眼一 长沙常考的物质及物质间的关系 一、长沙常考的物质及性质 1. 单质(Fe 、Cu 、Zn) 性质:①和酸反应,如铁、锌和盐酸反应; ② 能和部分盐溶液反应,如锌和硫酸铜溶液反应。 2. 氧化物(CO2、CO、Fe2O3、CaO) CO2: ①能和氢氧化钙反应生成碳酸钙沉淀;
