N的方程式
初中科学生物方程式大全

初中科学生物方程式大全1. 光合作用方程式:6CO2 + 6H2O → C6H12O6 + 6O2光合作用方程式:6CO2 + 6H2O → C6H12O6 + 6O2光合作用是植物通过光能将二氧化碳和水转化为葡萄糖和氧气的过程。
2. 呼吸作用方程式:C6H12O6 + 6O2 → 6CO2 + 6H2O + 能量呼吸作用方程式:C6H12O6 + 6O2 → 6CO2 + 6H2O + 能量呼吸作用是生物体将葡萄糖和氧气转化为二氧化碳、水和能量的过程。
3. 发酵作用方程式:C6H12O6 → 2C2H5OH + 2CO2 + 能量发酵作用方程式:C6H12O6 → 2C2H5OH + 2CO2 + 能量发酵作用是在没有氧气的情况下,微生物通过分解葡萄糖产生乙醇、二氧化碳和能量的过程。
4. 染色体分裂方程式(有丝分裂):2N → 2N + 2N染色体分裂方程式(有丝分裂):2N → 2N + 2N染色体分裂是细胞有丝分裂过程中染色体复制和分配的过程。
5. 减数分裂方程式:2N → N + N减数分裂方程式:2N → N + N减数分裂是生殖细胞分裂的过程,通过该过程形成基因组数量减半的细胞。
6. 克隆生殖方程式:1N → 1N + 1N克隆生殖方程式:1N →1N + 1N克隆生殖是通过无性生殖方式产生与原个体完全相同的后代。
7. 牛顿第二定律方程式: F = ma牛顿第二定律方程式: F =ma牛顿第二定律描述了物体在受力作用下的加速度与受力和质量之间的关系。
8. 光的折射方程式:n1 * sin(θ1) = n2 * sin(θ2)光的折射方程式:n1 * sin(θ1) = n2 * sin(θ2)光的折射定律描述了光线从一个介质传播到另一个介质时的折射规律。
9. 生态金字塔方程式:生产者→ 消费者1 → 消费者2 → 消费者3生态金字塔方程式:生产者→ 消费者1 → 消费者2 → 消费者3生态金字塔描述了一个生态系统中不同生物之间的能量传递关系。
高中化学方程式问题

一、高一化学方程式总结(1) 硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl(2) 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl(3) 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(4) 木炭还原氧化铜: 2CuO + C(高温)2Cu + CO2↑(5) 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl(6) 氧化物的反应a) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Ob) 氧化钙与水反应:CaO + H2O = Ca(OH)2c) 氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2Od) 氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2Oe) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl(7) Na的化学反应方程式a) 钠在空气中燃烧:4Na + O2 = 2Na2Ob) 钠与氧气反应: 2Na + O2 △Na2O2 过氧化钠c) 过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑d) 过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2e) 钠与水反应:2Na + 2H2O = 2NaOH + H2↑(8) Fe及化合物的化学反应方程式a) 铁与水蒸气反应:3Fe + 4H2O(g) = 高温=F3O4 + 4H2↑b) 铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cuc) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Od) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCle) 硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4f) 氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3g) 氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑h) 三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2i) 氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3(9) Al及其化合物的化学反应方程式a) 铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑b) 实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓+3(NH3)2SO4c) 氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2Od) 氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2Oe) 氢氧化铝加热分解:2Al(OH)3 △Al2O3 + 3H2Of) 二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2Og) 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑h) 二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3i) 二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2Oj) 往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 +H2SiO3↓k) 硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓(10)Cl及其化合物的反应方程式a) 氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl3b) 氯气与金属铜反应:Cu + Cl2 点燃CuCl2c) 氯气与金属钠反应:2Na + Cl2 点燃2NaCld) 氯气与水反应:Cl2 + H2O = HCl + HClOe) 次氯酸光照分解:2HClO 光照2HCl + O2↑f) 氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2Og) 氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2Oh) 盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓+ HNO3i) 漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓+ 2HClO(11)N及其化合物的反应方程式a) 氮气与氧气在放电下反应:N2 + O2 放电2NOb) 一氧化氮与氧气反应:2NO + O2 = 2NO2c) 二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NOd) 二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂2SO3e) 三氧化硫与水反应:SO3 + H2O = H2SO4(12)氨及其反应方程式a) 氨水受热分解:NH3·H2O △NH3↑+ H2Ob) 氨气与氯化氢反应:NH3 + HCl = NH4Clc) 氯化铵受热分解:NH4Cl △NH3↑+ HCl↑d) 碳酸氢氨受热分解:NH4HCO3 △NH3↑+ H2O↑+ CO2↑e) 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑+ NaNO3 + H2Of) 氨气的实验室制取:2NH4Cl + Ca(OH)2 △CaCl2 + 2H2O + 2NH3↑g) 氯气与氢气反应:Cl2 + H2 点燃2HClh) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑+ Na2SO4 + 2H2O(13)S及其化合物的化学反应方程式a) SO2 +CaO = CaSO3b) SO2 +2NaOH = Na2SO3 + H2Oc) SO2 +Ca(OH)2 = CaSO3↓+ H2Od) SO2 +Cl2 + 2H2O = 2HCl + H2SO4e) SO2 +2H2S = 3S + 2H2Of) 二氧化硫与水反应:SO2 + H2O ≈H2SO3g) 浓硫酸与铜反应:Cu + 2H2SO4(浓) △CuSO4 + 2H2O + SO2↑h) 浓硫酸与木炭反应:C + 2H2SO4(浓) △CO2 ↑+ 2SO2↑+ 2H2Oi) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑+ Na2SO4 + 2H2O(14)N及其化合物的反应方程式a) NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2Ob) 浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑c) 稀硝酸与铜反应:3Cu + 8HNO3(稀) △3Cu(NO3)2 + 4H2O + 2NO↑(15)硅Si的反应方程式冶炼纯硅a) Si +2F 2 = SiF4b ) Si+ 2NaOH + H2O = NaSiO3 +2H2↑c) 硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉Si +2CO (石英沙)(焦碳)(粗硅)粗硅转变为纯硅:Si(粗)+ 2Cl2 △SiCl4 SiCl4 + 2H2 高温== Si(纯)+ 4HCl二、氯的化学方程式Cl2+SO2+ 2H2O = H2SO4+2HCl 2HCl = H2+Cl22NH3+3Cl2 = N2+6HCl8NH3+3Cl2 = N2+6NH4ClSi(粗)+2Cl2 = SiCl4C+2Cl2 = CCl4Cl2 +H2 = 2HCl3Cl2 +2P = 2PCl3Cl2 +PCl3 = PCl5Cl2 +2Na = 2NaCl3Cl2 +2Fe = 2FeCl3Cl2 +2FeCl2 = 2FeCl3Cl2+Cu = CuCl22Cl2+2NaBr = 2NaCl+Br2Cl2 +2NaI = 2NaCl+I25Cl2+I2+6H2O = 2HIO3+10HCl Cl2 +Na2S = 2NaCl+SCl2 +H2S = 2HCl+SCl2+SO2 +2H2O = H2SO4 +2HCl Cl2 +H2O2 =2HCl+O2【练习】1、KClO3与浓HCl发生如下反应: KClO3+6HCl→KCl+3Cl2↑+3H2O,该反应中被氧化的氯元素与被还原的氯元素的质量比是:A.6:1B.1:6C.3:1D.5:1选D1个Cl由-1 到-1,未变。
高一化学必修一常用公式及方程式

高一化学必修一常用公式及方程式n=N/N A N A:阿伏伽德罗常数≈6.02×1023mol-1n:物质的量,单位:molN:粒子数n=m/M m:质量,单位:gM:摩尔质量,单位:g/mol(数值上等于相对分子质量)n=V/Vm (只适用于气体)V:气体体积Vm:气体摩尔体积,在标准状况下≈22.4L/mol同温同压下:V1/V2=n1/n2=N1/N2n=cV(用于溶液)c:物质的量浓度,单位:mol/L溶液稀释:c浓V浓=c稀V稀2Na+2H2O==2NaOH+H2↑(现象:浮熔游响红)4Na+O2==2Na2O 2Na+O2 == Na2O2(淡黄色)2Na2O2+2H2O==4NaOH+O2↑2Na2O2+2CO2==2Na2CO3+O22Na2O2+2CO2==2Na2CO3+O22Na2O2+4HCl==4NaCl+2H2O+O2↑NaHCO3+NaOH==Na2CO3+2H2O2NaHCO3+Ca(OH)2(少量)=CaCO3↓+Na2CO3+2H2O2HCO3-+Ca2++2O H-== CaCO3↓+CO32-+2H2O NaHCO3+Ca(OH)2(过量)=CaCO3↓+NaOH+H2OHCO3-+Ca2++O H-=CaCO3↓+H2O2Al+6HCl==2AlCl3+3H2↑2Al+2NaOH+2H2O==2NaAlO2+3H2↑Al2O3+2NaOH==2NaAlO2+H2OAl(OH)3+NaOH==NaAlO2+2H2OAl(OH)3+O H-==AlO2-+2H2OAl3+与O H-反应:Al3++3O H-==Al(OH)3↓Al3++4O H-==AlO2-+2H2O实验室制取Al(OH)3:Al2(SO4)3+6NH3.H2O==2Al(OH)3↓+3(NH4)2SO4Al3++3NH3.H2O==Al(OH)3↓+3NH4+Al(OH)3的不稳定性:Al(OH)3==Al2O3+2H2OKAl(SO4)2与Ba(OH)2的反应:①Al3+恰好完全反应:2KAl(SO4)2+3Ba(OH)2=======K2SO4+BaSO4↓+2Al(OH)3↓2Al3++3SO42-+3Ba2++6O H-==3BaSO4↓+2Al(OH)3↓②SO42-恰好完全反应:KAl(SO4)2+2Ba(OH)2===2BaSO4↓+K AlO2+2H2OAl3++2SO42-+2Ba2++4O H-==2BaSO4↓+AlO2-+2H2O2NaAlO2的电离方程式:NaAlO2==Na++AlO2-~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~FeO+2HCl==FeCl2+H2O(FeO+2H+=Fe2++H2O)Fe2O3+6HCl==2FeCl3+3H2O((Fe2O3+6H+=2Fe3++3H2O)Fe3O4+8HCl=2FeCl3+FeCl2+4H2O(Fe3O4+8H+=2Fe3++Fe2++4 H2O)4Fe(OH)2+O2+2H2O=4Fe(OH)3 (白色变为灰绿色变为红褐色)Fe+2FeCl3==3FeCl2(Fe+2Fe3+==3Fe2+)2FeCl3+Cu==2FeCl2+CuCl2(2Fe3++Cu==2Fe2++Cu2+)2Fe+3Cl2==2FeCl3 H2+Cl2==2HCl(苍白色火焰)Cl2+H2O==HClO+HCl 2HClO==2HCl+O2↑Cl2+2NaOH==NaClO+NaCl+H2O(Cl2+2O H-=C l-+Cl O-+H2O) 漂白粉的制取:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O漂白原理:Ca(ClO)2+CO2+H2O==CaCO3↓+2HClOCl2的实验室制法:Mn O2+4HCl(浓)==MnCl2+Cl2↑+2H2O SO2的还原性:SO2+Cl2+2H2O==H2SO4+2HClSO2的氧化性:SO2+2H2S==3S+2H2OSO2与碱反应:SO2(少量)+2NaOH==Na2SO3+H2OSO2(过量)+NaOH==NaHSO3SO2(少量)+2NH3.H2O==(NH4)2SO3+H2O3NO2+H2O==2HNO3+NONH3+HCl==NH4Cl(产生大量白烟)NH3的实验室制法:NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O C+4HNO3(浓)==CO2↑+4NO2↑+2H2OC+2H2SO4(浓)==CO2↑+SO2↑+2H2OCu+2H2SO4(浓)==CuSO4+SO2↑+2H2OCu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O(Cu+4H++2NO3-==Cu2++2NO2↑+2H2O)3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O(3Cu+8H++2NO3-==3Cu2+ +2NO↑+4H2O)Fe(不足)+4HNO3(稀)==Fe(NO3)3(黄色)+NO↑+2H2O3Fe(过量)+8HNO3(稀)==3Fe(NO3)2(浅绿色)+2NO↑+4H2O Si+4HF==SiF4↑+2H2↑Si+2NaOH+H2O==Na2SiO3+2H2↑SiO2+2C==Si+COSiO2+Na2CO3==Na2SiO3+CO2SiO2+HF==SiF4↑+H2ONa2SiO3+2HCl==H2SiO3↓+2NaCl(硅酸的制法)Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3-温馨提示:如不慎侵犯了您的权益,可联系文库删除处理,感谢您的关注!。
高中化学方程式大全

目录一、高一化学方程式总结 (1)二、氯的化学方程式: (3)三、氯的离子方程式: (3)四、铝的化学反应方程式 (4)五、铜的化学反应方程式 (4)六、铁的化学方程式 (5)七、高中常用的离子方程式 (6)一、高一化学方程式总结(1) 硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl(2) 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl(3) 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(4) 木炭还原氧化铜: 2CuO + C(高温)2Cu + CO2↑(5) 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl(6) 氧化物的反应a) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Ob) 氧化钙与水反应:CaO + H2O = Ca(OH)2c) 氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2Od) 氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2Oe) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl(7) Na的化学反应方程式a) 钠在空气中燃烧:4Na + O2 = 2Na2Ob) 钠与氧气反应:2Na + O2 △ Na2O2 过氧化钠c) 过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑d) 过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2e) 钠与水反应:2Na + 2H2O = 2NaOH + H2↑(8) Fe及化合物的化学反应方程式a) 铁与水蒸气反应:3Fe + 4H2O(g) = 高温=F3O4 + 4H2↑b) 铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cuc) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Od) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCle) 硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4f) 氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3g) 氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑h) 三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2i) 氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3(9) Al及其化合物的化学反应方程式a) 铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑b) 实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH3)2SO4c) 氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2Od) 氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2Oe) 氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2Of) 二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2Og) 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑h) 二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3i) 二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2Oj) 往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ k) 硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓(10) Cl及其化合物的反应方程式a) 氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl3b) 氯气与金属铜反应:Cu + Cl2 点燃CuCl2c) 氯气与金属钠反应:2Na + Cl2 点燃2NaCld) 氯气与水反应:Cl2 + H2O = HCl + HClOe) 次氯酸光照分解:2HClO 光照2HCl + O2↑f) 氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2Og) 氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2Oh) 盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3i) 漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO(11) N及其化合物的反应方程式a) 氮气与氧气在放电下反应:N2 + O2 放电2NOb) 一氧化氮与氧气反应:2NO + O2 = 2NO2c) 二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NOd) 二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂2SO3e) 三氧化硫与水反应:SO3 + H2O = H2SO4(12) 氨及其反应方程式a) 氨水受热分解:NH3·H2O △NH3↑ + H2Ob) 氨气与氯化氢反应:NH3 + HCl = NH4Clc) 氯化铵受热分解:NH4Cl △NH3↑ + HCl↑d) 碳酸氢氨受热分解:NH4HCO3 △NH3↑ + H2O↑ + CO2↑e) 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑ + NaNO3 + H2Of) 氨气的实验室制取:2NH4Cl + Ca(OH)2 △CaCl2 + 2H2O + 2NH3↑g) 氯气与氢气反应:Cl2 + H2 点燃2HClh) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2Oi)(13) S及其化合物的化学反应方程式a) SO2 + CaO = CaSO3b) SO2 + 2NaOH = Na2SO3 + H2Oc) SO2 + Ca(OH)2 = CaSO3↓ + H2O d) SO2 + Cl2 + 2H2O = 2HCl + H2SO4e) SO2 + 2H2S = 3S + 2H2Of) 二氧化硫与水反应:SO2 + H2O ≈ H2SO3g) 浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑h) 浓硫酸与木炭反应:C + 2H2SO4(浓) △CO2 ↑+ 2SO2↑ + 2H2Oi) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2Oj)(14) N及其化合物的反应方程式a) NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2Ob) 浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑c) 稀硝酸与铜反应:3Cu + 8HNO3(稀) △3Cu(NO3)2 + 4H2O + 2NO↑(15) 硅Si的反应方程式冶炼纯硅a) Si + 2F 2 = SiF4 b ) Si + 2NaOH + H2O = NaSiO3 +2H2↑b) 硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉Si + 2CO (石英沙)(焦碳)(粗硅)c) 粗硅转变为纯硅:Si(粗)+ 2Cl2 △ SiCl4 SiCl4 + 2H2 高温== Si(纯)+ 4HCl二、氯的化学方程式:1) Cl2+SO2+ 2H2O = H2SO4+2HCl2) 2HCl = H2+Cl23) 2NH3+3Cl2 = N2+6HCl4) 8NH3+3Cl2 = N2+6NH4Cl5) Si(粗)+2Cl2 = SiCl46) C+2Cl2 = CCl47) Cl2 +H2 = 2HCl8) 3Cl2 +2P = 2PCl39) Cl2 +PCl3 = PCl510) Cl2 +2Na = 2NaCl11) 3Cl2 +2Fe = 2FeCl312) Cl2 +2FeCl2 = 2FeCl313) Cl2+Cu = CuCl214) 2Cl2+2NaBr = 2NaCl+Br215) Cl2 +2NaI = 2NaCl+I216) 5Cl2+I2+6H2O = 2HIO3+10HCl17) Cl2 +Na2S = 2NaCl+S18) Cl2 +H2S = 2HCl+S19) Cl2+SO2 +2H2O = H2SO4 +2HCl20) Cl2 +H2O2 =2HCl+O2 21) KClO3与浓HCl发生如下反应:KClO3+6HCl→KCl+3Cl2↑+3H2O,该反应中被氧化的氯元素与被还原的氯元素的质量比是: DA.6:1B.1:6C.3:1D.5:11个Cl由-1 到-1,未变。
n的所有化学方程式

n的所有化学方程式N是一种重要的物质物和化学物,它是大多数物质都能反应的物质,因此N的化学方程式有及其广泛的应用,也是研究物质和化学研究的重要内容。
本文将围绕N的化学方程式来进行介绍,以及它们的应用。
N的化学方程式可以分为三类:化合反应,分解反应和缩合反应。
首先,化合反应是N物质参与的最基本的化学反应。
其基本方程式为:N + X Y + Z。
其中,N表示N物质,X表示参与反应的物质,Y和Z分别表示反应后生成的物质。
化合反应是化学反应中重要的概念,它是其他类型反应的基础,也是物质组成结构的基本原理。
其次是分解反应,其基本方程式为:N + X Y1 + Y2 + Y3 + + Yn。
其中,X表示参与反应的物质,Y1, Y2, Y3等Yn表示反应后生成的物质。
分解反应是指由一种物质分解成多种物质的反应,这类反应发生的频率较少,但是也是N的重要特征之一。
最后是缩合反应,其基本方程式为:Y1 + Y2 N + X。
其中,Y1和Y2表示参与反应的物质,X表示反应后生成的物质。
缩合反应是指由多种物质缩合而成一种物质的反应,这类反应在化学过程中也是重要的应用。
N的化学方程式应用非常广泛,为科学家提供了大量的数据来拓展研究。
例如,N可以与其他物质发生化合反应,以实现合成新物质,从而制作新的材料,或者用于药物的研发等。
其分解反应也在许多情境下发挥作用,如在一些物质的改性工艺中,可以通过分解反应来改变物质的形态或性质,缩合反应则可以帮助人们获得更高质量的原料。
总之,N的化学方程式对于化学研究具有重要意义,它为科学家拓展研究的空间提供了重要的线索,并且在各个领域的应用也是非常广泛的。
氮气和氢气反应化学方程式

氮气和氢气反应化学方程式
氮气和氢气反应化学方程式为:
N₂ + 3H₂ → 2NH₃
这是一种典型的氮氢反应,也被称为哈伯-博斯曼合成反应。
在这个反应中,氮气和氢气以一定的条件进行反应,生成氨气。
氮气是一种常见的气体,它是空气的主要成分之一,占据空气中的78%。
而氢气则是宇宙中最常见的元素,也是地球上最轻的元素。
氮气和氢气在正常情况下是稳定的,不会发生自发的反应。
但是,当它们在适当的条件下相遇时,就会发生反应。
在哈伯-博斯曼合成反应中,氮气和氢气通过催化剂的作用进行反应。
催化剂可以提高反应速率,降低反应所需的能量。
通常使用铁或铁合金作为催化剂。
反应过程中,氮气和氢气先经过吸附,将分子分解成原子。
然后,氢气的氢原子与氮气的氮原子结合,形成氨分子。
最后,生成的氨气脱附,从催化剂表面释放出来。
这个反应是一个放热反应,释放出大量的热能。
反应中的能量变化使得反应是自发进行的。
同时,由于氮气和氢气的化学键能较高,反应前需要提供一定的能量以克服这个能垒。
催化剂的作用是降低反应的活化能,使反应更容易发生。
氮气和氢气反应生成的氨气在工业上有广泛的应用。
氨气是一种重要的化工原料,用于制造尿素、硝酸等化学品。
此外,氨气还被用作冷冻剂、气体燃料和肥料。
总结起来,氮气和氢气反应化学方程式为N₂ + 3H₂ → 2NH₃。
这是一个哈伯-博斯曼合成反应,通过催化剂的作用,在适当的条件下,氮气和氢气可以反应生成氨气。
这个反应是一个放热反应,同时也是工业上重要的化学反应之一。
氮化学方程式
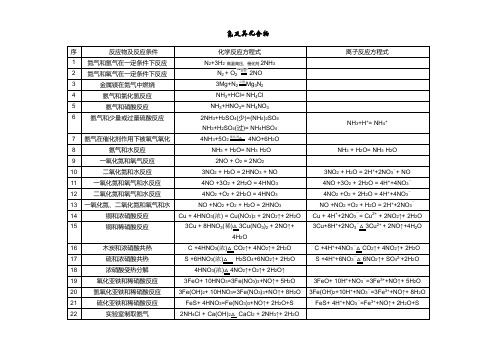
氮及其化合物序反应物及反应条件化学反应方程式离子反应方程式1 氮气和氢气在一定条件下反应N2+3H2 高温高压、催化剂2NH3×2 氮气和氧气在一定条件下反应N2 + O2放电2NO ×3 金属镁在氮气中燃烧3Mg+N2点燃Mg3N2 ×4 氨气和氯化氢反应NH3+HCl= NH4Cl ×5 氨气和硝酸反应NH3+HNO3= NH4NO3×6 氨气和少量或过量硫酸反应2NH3+H2SO4(少)=(NH4)2SO4NH3+H+= NH4+NH3+H2SO4(过)= NH4HSO47 氨气在催化剂作用下被氧气氧化4NH3+5O2催化剂△4NO+6H2O ×8 氨气和水反应NH3 + H2O= NH3·H2O NH3 + H2O= NH3·H2O9 一氧化氮和氧气反应2NO + O2 = 2NO2×10 二氧化氮和水反应3NO2 + H2O = 2HNO3 + NO 3NO2 + H2O = 2H++2NO3-+ NO11 一氧化氮和氧气和水反应4NO +3O2 + 2H2O = 4HNO34NO +3O2 + 2H2O = 4H++4NO3-12 二氧化氮和氧气和水反应4NO2 +O2 + 2H2O = 4HNO34NO2 +O2 + 2H2O = 4H++4NO3-13 一氧化氮、二氧化氮和氧气和水NO +NO2 +O2 + H2O = 2HNO3NO +NO2 +O2 + H2O = 2H++2NO3-14 铜和浓硝酸反应Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O Cu + 4H++2NO3-= Cu2+ + 2NO2↑+ 2H2O3Cu+8H++2NO3-△3Cu2+ + 2NO↑+4H2O 15 铜和稀硝酸反应3Cu + 8HNO3(稀)△3Cu(NO3)2+ 2NO↑+4H2O16 木炭和浓硝酸共热 C +4HNO3(浓)△CO2↑+ 4NO2↑+ 2H2O C +4H++4NO3-△CO2↑+ 4NO2↑+ 2H2O17 硫和浓硝酸共热S +6HNO3(浓)△H2SO4+6NO2↑+ 2H2O S +4H++6NO3-△6NO2↑+ SO42-+2H2O18 浓硝酸受热分解4HNO3(浓)△4NO2↑+O2↑+ 2H2O↑×19 氧化亚铁和稀硝酸反应3FeO+ 10HNO3=3Fe(NO3)3+NO↑+ 5H2O 3FeO+ 10H++NO3-=3Fe3++NO↑+ 5H2O20 氢氧化亚铁和稀硝酸反应3Fe(OH)2+ 10HNO3=3Fe(NO3)3+NO↑+ 8H2O 3Fe(OH)2+10H++NO3-=3Fe3++NO↑+ 8H2O21 硫化亚铁和稀硝酸反应FeS+ 4HNO3=Fe(NO3)3+NO↑+ 2H2O+S FeS+ 4H++NO3-=Fe3++NO↑+ 2H2O+S22 实验室制取氨气2NH4Cl + Ca(OH)2△ CaCl2 + 2NH3↑+ 2H2O ×。
高中化学常用化学方程式及计算公式

高中化学常用方程式一、高一化学方程式总结(1) 硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl(2) 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl(3) 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(4) 木炭还原氧化铜: 2CuO + C(高温)2Cu + CO2↑(5) 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl(6) 氧化物的反应a) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Ob) 氧化钙与水反应:CaO + H2O = Ca(OH)2c) 氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2Od) 氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2Oe) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl(7) Na的化学反应方程式a) 钠在空气中燃烧:4Na + O2 = 2Na2Ob) 钠与氧气反应:2Na + O2 △ Na2O2 过氧化钠c) 过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑d) 过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2e) 钠与水反应:2Na + 2H2O = 2NaOH + H2↑(8) Fe及化合物的化学反应方程式a) 铁与水蒸气反应:3Fe + 4H2O(g) = 高温=F3O4 + 4H2↑b) 铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cuc) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Od) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3N aOH = Fe(OH)3↓+ 3NaCle) 硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4f) 氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3g) 氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑h) 三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2i) 氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3(9) Al及其化合物的化学反应方程式a) 铝与氢氧化钠溶液反应:2Al + 2Na OH + 2H2O = 2NaAlO2 + 3H2↑b) 实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH3)2SO4c) 氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2Od) 氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2Oe) 氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2Of) 二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2Og) 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑h) 二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3i) 二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2Oj) 往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓k) 硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓(10) Cl及其化合物的反应方程式a) 氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl3b) 氯气与金属铜反应:Cu + Cl2 点燃CuCl2c) 氯气与金属钠反应:2Na + Cl2 点燃2NaCld) 氯气与水反应:Cl2 + H2O = HCl + HClOe) 次氯酸光照分解:2HClO 光照2HCl + O2↑f) 氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2Og) 氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2Oh) 盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3i) 漂白粉长期置露在空气中:Ca(C lO)2 + H2O + CO2 = CaCO3↓ + 2HClO(11) N及其化合物的反应方程式a) 氮气与氧气在放电下反应:N2 + O2 放电2NOb) 一氧化氮与氧气反应:2NO + O2 = 2NO2c) 二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NOd) 二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂2SO3e) 三氧化硫与水反应:SO3 + H2O = H2SO4(12) 氨及其反应方程式a) 氨水受热分解:NH3·H2O △NH3↑ + H2Ob) 氨气与氯化氢反应:NH3 + HCl = NH4Clc) 氯化铵受热分解:NH4Cl △NH3↑ + HCl↑d) 碳酸氢氨受热分解:NH4HCO3 △NH3↑ + H2O↑ + CO2↑e) 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑ + NaNO3 + H2Of) 氨气的实验室制取:2NH4Cl + Ca(OH)2 △CaCl2 + 2H2O + 2NH3↑g) 氯气与氢气反应:Cl2 + H2 点燃2HClh) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2Oi)(13) S及其化合物的化学反应方程式a) SO2 + CaO = CaSO3b) SO2 + 2NaOH = Na2SO3 + H2Oc) SO2 + Ca(OH)2 = CaSO3↓ + H2O d) SO2 + Cl2 + 2H2O = 2HCl + H2SO4e) SO2 + 2H2S = 3S + 2H2Of) 二氧化硫与水反应:SO2 + H2O ≈ H2SO3g) 浓硫酸与铜反应:Cu + 2H2SO4(浓) △CuSO4 + 2H2O + SO2↑h) 浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑ + 2H2Oi) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2Oj)(14) N及其化合物的反应方程式a) NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2Ob) 浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑c) 稀硝酸与铜反应:3Cu + 8HNO3(稀) △3Cu(NO3)2 + 4H2O + 2NO↑(15) 硅Si的反应方程式冶炼纯硅a) Si + 2F 2 = SiF4 b ) Si + 2NaOH + H2O = NaSiO3 +2H2↑3b) 硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO (石英沙)(焦碳)(粗硅)c) 粗硅转变为纯硅:Si (粗) + 2Cl2 △ SiCl4 SiCl4 + 2H2 高温== Si (纯)+ 4HCl二、 氯的化学方程式:1)Cl2+SO2+ 2H2O = H2SO4+2HCl 2)2HCl = H2+Cl2 3)2NH3+3Cl2 = N2+6HCl 4)8NH3+3Cl2 = N2+6NH4Cl 5)S i(粗)+2Cl2 = SiCl4 6)C +2Cl2 = CCl4 7)C l2 +H2 = 2HCl 8)3Cl2 +2P = 2PCl3 9)Cl2 +PCl3 = PCl5 10)C l2 +2Na = 2NaCl 11)3Cl2 +2Fe = 2FeCl3 12)C l2 +2FeCl2 = 2FeCl3 13)C l2+Cu = CuCl2 14)2Cl2+2NaBr = 2NaCl+Br2 15)C l2 +2NaI = 2NaCl+I2 16)5Cl2+I2+6H2O = 2HIO3+10HCl 17)l2 +Na2S = 2NaCl+S18) l2 +H2S = 2HCl+S19) l2+SO2 +2H2O = H2SO4 +2HCl20) l2 +H2O2 =2HCl+O221) KClO3与浓HCl 发生如下反应: KClO3+6HCl→KCl+3Cl2↑+3H2O,该反应中被氧化的氯元素与被还原的氯元素的质量比是: DA.6:1B.1:6C.3:1D.5:1 1个Cl 由-1 到-1,未变。
宇宙文明方程式

宇宙文明方程式美国天体物理学家弗兰克·德瑞克提出了计算宇宙文明社会的宇宙文明方程式的因子。
这个方程式是:N=n·P1·P2·P3·P4·t1/TN——目前银河系中高级文明数;n——银河系恒星总数;P1——恒星具有行星的概率;P2——行星中发生生命的概率;P3——在行星中发生生命,进化到智慧生物的概率;P4——这个智慧生物具有技术文明的概率;t1——技术文明的平均寿命;T——银河系年龄。
在这些因子中,意见分歧最大的是表示高度技术文明的平均寿命t1的值。
达到高度发展阶段的宇宙文明和现在的地球文明一样,由于核爆炸、天然资源的枯竭、环境圬染等原因,有灭亡的可能。
持悲观态度的人把t1值定为100年,持乐观态度的人把它定为1000万年。
至于宇宙文明方程式中其他因子值,科学家们意见大体一致。
把所有值都代入方程式,宇宙中高度文明数目就是从最少的一个(即地球)发展到。
100万个,这就是沙甘博士归纳出的数字。
某些科学家认为人类的技术发展已经到达了极限。
美国科学家普拉特博士明确地指出,在最近的100年间,人类的通讯速度达到了10的7次方倍数,旅行速度是10的2次方倍数,处理数据速度为10的6次方倍数。
他认为不可能再继续发展了。
也就是说人类的通讯速度不会超过光速,地球上的旅行速度不能超过第一宇宙速度(人造卫星的速度),如果超过第一宇宙速度,人们就要离开地球飞上天了。
其他的科学家也这样认为。
在地球的周围有很多的恒星,也必然有很多的行星。
不过,现代人类的人口如果继续这样增加下去,几百年以后,装载宇宙移民的火箭就是以光速飞行,也赶不上人口的增加速度。
即使我们利用木星,在太阳的周围建造宇宙城让地球人居住,恐怕也不是根本的解决办法,几千年后也将无济于事。
只得实行计划生育,必须限制人口的出生率。
必修一化学公式及方程式总结

一、计算公式:(n :物质的量;N :粒子个数;N A :阿伏伽德罗常数;m :质量;M摩尔质量;V :体积;Vm :摩尔体积;C :物质的量浓度;T :温度;P :压强;ρ:密度;ω%:质量分数)1、物质的量:n=NA N N=n ×N A N A = n N 摩尔质量:M=n m m=n ×M n=Mm 2、摩尔体积:Vm=n V V=n ×Vm n=mV V (其中标准状况下Vm=22.4L/mol ) 3、物质的量浓度C=V n n=C×V V=C n C 1V 1=C 2V 2(用于稀释) C=1000*ρ *ω%/M 4、配置溶液误差分析依据原理:C=MVm (与m 成正比,与V 成反比) 5、阿伏伽德罗定律:同温同压同体积时,气体的分子数相等(三同推一同,适用于气体,可以是单一气体,也可以是混合气体。
) 6、混合气体的平均摩尔质量求算:(1)、依据相对密度(D ):M1=M2D (D=ρ1:ρ2)(2)已知混合物的总质量m (混)和总物质的量n (混):(3)已知标准状况下,混合气体的密度(混):(混) 注意:该方法只适用于处于标准状况下(0℃,)的混合气体。
(4)M (平均)=n1%×M1+n2%×M2+n3%×M3+……二、方程式:1、第三章金属钠的有关反应反应: 4Na+O 2==2Na 2O (白色固体) 2Na 2O+O 22Na 2O 2 2Na+O 2Na 2O 2(淡黄色固体,有漂白性、供氧剂) Na+Cl 22NaCl2Na+ 2H 2O== 2NaOH+H 2↑Na 2O+2HCl==2NaCl+H 2O Na 2O+2H +=2Na ++H 2ONa 2O+H 2O==2NaOH (现象:浮、熔、游、响、红)Na 2O+H 2O=2Na ++2OH –Na 2O+CO 2==Na 2CO 32Na 2O 2+2H 2O===4NaOH+O 2↑(Na 2O 2既是氧化剂又是还原剂)2Na2O2+2H2O=4Na++4OH–+O2↑2Na2O2+2CO2==2Na2CO3+ O2↑(Na2O2既是氧化剂又是还原剂)2Na+CuSO4+2H2O==Cu(OH)2+Na2SO4+H2↑Na2CO3+2HCl==2NaCl+H2O+CO2↑Na2CO3+CaCl2=2NaCl +CaCO3↓Na2CO3+CO2+H2O=2NaHCO3 NaHCO3+HCl= NaCl+H2O+CO2↑NaHCO3+NaOH= Na2CO3+ H2O 2NaHCO 3 Na2CO3+ H2O+CO2↑金属Al的有关反应:4Al+3O2===2Al2O3(常温生成致密氧化膜而钝化,保护内部金属,俗名:刚玉) 3Al+6HCl==2AlCl3+3 H2↑2Al+2NaOH==2NaAlO2+ H2↑(Al是两性金属)Al2O3+6HCl==2AlCl3+ 3H2O (Al2O3+6H+=2Al3++3H2O )Al2O3+2NaOH===2NaAlO2+H2O(Al2O3两性氧化物)Al2O3+2OH―=2AlO2―+H2O Al3++3NH3﹒H2O==Al(OH)3↓+3NH4+(制备氢氧化铝两性氢氧化物,净水、做胃药)Al(OH)3+3HCl= AlCl3+3H2O Al(OH)3+NaOH=NaAlO2+2 H2O 2Al(OH)3Al2O3+ 3H2O金属Fe的有关反应:2O2+3Fe Fe3O4 (黑色晶体,有磁性,俗名:磁铁矿)2Fe+3O2 ==Fe2O3(红棕色粉末,俗名:铁红)[FeO是黑色粉末]高温4Fe+3H2O(g)=== Fe3O4+3H2↑Fe2++2OH-==Fe(OH)2↓(产生白色沉淀,迅速变成灰绿色,最后变成红褐色固体) 4Fe(OH)2+O2+H2O=4 Fe(OH)3Fe3++3OH-= Fe(OH)3↓(产生红褐色沉淀)2Fe(OH)3 Fe2O3+3H2O2、第四章与Si 相关的化学反应(SiO 2不溶于水的白色固体酸性氧化物) Si+2NaOH+H 2O==Na 2SiO 3+2H 2↑单质硅制备:SiO 2+2C==2CO ↑+Si(含杂质的粗硅) Si+2Cl 2== SiCl 4 SiCl4+2H2==4HCl+SiSiO 2+2NaOH = Na 2SiO 3+H 2O (制备硅酸钠,其水溶液叫水玻璃) SiO 2+CaO = =CaSiO 3SiO 2+2C==Si+2CO ↑(弱氧化性)SiO 2+3C=== SiC+2CO ↑(CO 既是氧化剂又是还原剂) SiO 2+4HF=SiF 4↑+2H 2O(工业制玻璃的反应原理)Na 2SiO 3+2HCl=H 2SiO 3(胶体)+2NaCl (制备硅酸,弱酸)H 2SiO 3 SiO 2 + H 2O 2NaOH+H 2SiO 3 == Na 2SiO 3+ 2H2O与卤素有关的化学反应: 实验室制备Cl 2:MnO 2 + 4HCl (浓) == MnCl 2 + Cl 2↑+ 2H 2O 2Fe+ 3Cl 2 2FeCl 3(棕黄色的烟) Fe+ I 2==Fe I 2 2P+ 3 Cl 2 ===2PCl 3(Cl2不足) 2P+ 5 Cl 2 ===2PCl 5(Cl 2过量) Cl 2+H 2O=HCl+HclO(弱酸,具有漂白性) 2HclO====2HCl+O 2↑ 2Ca(OH)2+2Cl 2=Ca(ClO)2 + CaCl 2 +2H 2O (制漂白粉原理) 漂白原理:Ca(ClO)2 + CO 2 + H 2O =CaCO 3↓+2HClO 高温 高温 高温 高温 高温高温 高温光照与S有关的反应:S+Fe FeS 2Cu+S Cu2S S + O2SO2CaO+SO2=CaSO3 Ca(OH)2+SO2=CaSO3↓+H2O2NaOH+SO2=Na2SO3 +H2O NaOH+SO2=NaHSO3SO2+2H2S=3S↓+2H2O (氧化性)SO2+Cl2+2H2O=2HCl+H2SO4(混合气体没有漂白性)SO3 + H2O = H2SO42NO + O2 = 2NO23 NO2+H2O =2HNO3 +NO4 NO + 2H2O + 3O2 = 4HNO3。
N、S化合物方程式总结

氮及其化合物总结1、N2是一种无___无味的气体,其电子式___________, N2化学性质________,具有该化学性质的原因是______________________。
2、固氮的方法有:____________、______________、___________________。
3、请用化学方程式解释雷雨发庄稼的原因___________________________________________________________________ ___________________________________________________________________ _________________________________________________________________。
4、二氧化氮是__________色____________味的气体,一氧化氮是____色______味的气体。
5、二氧化氮与水和氧气反应制硝酸的方程式:__________________________________________________________________。
6、一氧化氮与水和氧气反应制硝酸的方程式:__________________________________________________________________。
7、氨气的电子式______________,氨分子具有____________结构。
氨气是无色、_____________的气体,密度比空气_________, _______溶于水。
1体积水溶解_________体积氨气。
8、氨水的所含微粒___________________________________________________。
9、请写出氨水遇酚酞变红的原因_______________________________________。
物质的量用化学反应的计算

上述气体体积均已换算为标准状况,则根据上述操作
及实验数据填空:
(1)写出上述过程中所涉及反应的离子方程式 ;
(2)甲是
,甲溶液的物质的量浓度
为
,乙溶液的物质的量浓度为
;(二氧化
碳在溶液中的少量溶解忽略不计)
(3)将n mL的甲溶液与等体积的乙溶液按各种可能的
方式混合,产生的气体体积为V mL(标准状况),则V的
2 mol
22.4L
1 mol
c(NaOH)×0.4L 5.8L
n(NaClO)
⑴
n (NaClO) =
5.8L×1mol 22.4L
= 0. 26 mol
⑵ c(NaOH)=
5.8L×2mol 0.40L×22.4L
=1.3 mol/L
答:生成 NaClO 0.26mol,c(NaOH)为1.3mol/L。
“答”
[例1]完全中 和 0 .5 mol NaOH 需多少摩的 HNO3? 其质量是多 少克?
解:设需HNO3的物质的量为n。
NaOH + HNO3 == NaNO3 + H2O
1mol 0.5 mol
1mol n
n= 0.5 mol
V(NaOH) = n(NaOH)
V(HNO3)
n(HNO3)
【练习5】某盐酸的 =1.18g/cm3,HCl的质量分数为
36.5%。求①该盐酸物质的量浓度是多少? ②200mL
该盐酸与过量铁屑充分反应,生成 H2的体积(STP)是多
少?若反应后溶液体积变化忽略不计则FeCl2物质的量
浓度是多少?有多少克FeCl2?
解: 1000mL×1.18g/cm3×36.5%
n次方程式.doc

§4-5 n 次方程式(1)由n 次多项式到n 次方程式f (x )= a n x n +a n -1x n -1+…+a 1x +a 0 是n 次多项式,方程式f (x )=0称为n 次(多项)方程式。
例如:3x -35 =0,x 2-3x -54=0,(1+x 100)3=1.2分别是1次、2次、3次方程式。
(2)方程式的根:一个数x 0若满足f (x 0)=0,就称x 0为方程式f (x )=0的根或解。
有时特别强调x 0为复数、实数、有理数或整数,x 0又称为复数根、实根、有理根或整数根。
(3)实根的几何解释: 例如: (1)y =f (x )=x 2-3x -4的图形,如右图所示:图形与x 轴相交于两点(-1,0)、(4,0),其横坐标-1与4就是x 2-3x -4=0的实根。
(2)y =g (x )=x 2+x +1的图形,如右图所示:图形与x 轴没有交点,因为y =g (x )=(x +12)2+34,所以没有任何实数x ,使得g (x )=0,故g (x )=0方程式x 2+x +1=0 的解x = 错误! 。
一般而言,n 次多项式y =f (x ) 若该曲线和x 轴相交,那么交点P(x 0,f (x 0))的横坐标x 0必满足f (x 0)=0,所以x 0是方程式f (x )=0的一个实根,如果该曲线与x 轴没有交点,此时任何实数均不是方程式f (x )=0的根,因此方程式f (x )=0无实根。
实系数n 次方程式f (x )=0的实根α ⇔n 次函数y =f (x )的图形与x 轴交于点(α,0)讨论n 次方程式,就是要处理下面三个问题:有没有解?有多少解?如何找出解?(-x一个实系数的n次方程式,不一定有实数解。
例如x2+1=0就没有实数解,为此我们引进了复数,在复数系中,x2+1=0有两个复数根i及-i。
但就一般的n次方程式,在复数系中,是不是一定有根呢?这个存在性的问题,在公元1799年时,德国数学家高斯(Gauss 1777-1855)在他的博士论文中证明了在复数系中,n次方程式一定有根,它所讨论的方程式不限于实系数而是复数的系数,但实数亦可看作是复数,所以这个结果亦可用到实系数的n 次方程式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、氮气
氮气占空气体积的78%,其化学性质很稳定,通常情况下,一般不与其他物质反应,要反应需要较高的反应条件。
将游离态的氮转化为化合物叫做氮的固定:
1.工业上,在高温高压催化剂的条件下,用氮气与氢气反应制备氨气,写出该反应的化学方程式: N 2+3H 2 2NH 3
2.放电或高温条件下,氮气与氧气直接化合生成无色的一氧化氮,写出该反应的化学方程式: N 2 + O 22NO
二、氮的氧化物
1.一氧化氮有毒,不溶于水,在常温下很容易与空气中的氧气化合,生成二氧化氮,写出该反应的化学方程式: 2NO +O 2=2NO 2
2.二氧化氮是红棕色气体,有毒,溶于水时生成一氧化氮和硝酸,工业上利用这一原理生产硝酸,写出该反应的化学方程式: 3NO 2+H 2O=2HNO 3+NO
3.一氧化氮和氧气按体积比4:3充入圆底烧瓶,倒扣于水槽中,所得硝酸溶液充满整个烧瓶,写出该反应的化学方程式:4NO +3O 2+2H 2O = 4HNO 3
4.二氧化氮和氧气按体积比4:1充入圆底烧瓶,倒扣于水槽中,所得硝酸溶液充满整个烧瓶,写出该反应的化学方程式:4NO 2+O 2+2H 2O = 4HNO 3
三、氨气
1.与水反应:氨气是无色有刺激性气味的气体,极易溶于水(1:700),氨的水溶液叫做氨水,氨溶于水时,大部分与水结合成一水合氨,一水合氨中有一小部分电离成NH 4+和OH -,所以氨水显弱碱性。
一水合氨很不稳定,受热就会分解为氨和水,写出相关的化学反应方程式:NH 3+H 2O NH 3·H 2O NH 4++OH - 、NH 3·H 2O NH 3↑+H 2O
2.与酸反应:写出氨气与氯化氢、硝酸反应的化学方程式:
NH 3+HCl===NH 4Cl (大量白烟)、NH 3+H NO 3===NH 4NO 3(大量白烟)
3.与氧气反应:氨的催化氧化4NH 3 + 5O 2
4NO +6H 2O 4.实验室制氨气:写出加热氯化铵和氢氧化钙的固体混合物制备氨气的化学方程式: 2NH 4Cl(固) +Ca(OH)2(固)CaCl 2+2NH 3↑+2H 2O ,干燥氨气用碱石灰。
四、铵盐
1.铵盐受热易分解,写出氯化铵、碳酸氢铵受热分解的化学方程式:
NH 4
Cl NH 3↑+HCl↑、NH 4HCO 3NH 3↑+H 2O↑+CO 2↑
2.铵盐与碱共热,写出硝酸铵和氢氧化钠反应的化学方程式:
NH 4NO 3+NaOH NaNO 3+NH 3↑+H 2O
五、硝酸
硝酸是无色、有刺激性气味的液体,易挥发,除具备酸的通性,还有以下性质:
1.不稳定性:硝酸见光易分解,应放置在棕色试剂瓶中于阴暗处避光保存,写出该反应的化学方程式:4HNO 3
4NO 2 ↑+O 2 ↑+ 2H 2O
2.强氧化性:硝酸中+5价的氮得电子,被还原为较低价的氮,体现强氧化性。
(1)冷的浓硝酸使铁、铝发生钝化,常用铁槽车或铝槽车运输浓硝酸。
(2)与金属反应:硝酸与金属反应不生成氢气,浓度不同还原产物也不同,稀硝酸生成一氧化氮,浓硝酸生成二氧化氮,写出铜与浓硝酸、稀硝酸反应的化学方程式和离子方程式: 3Cu +8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O 、3Cu +8H ++2NO 3-=3Cu 2+
+2NO↑+4H 2O Cu +4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O 、Cu +4H ++2NO 3-=Cu 2+
+2NO 2↑+2H 2O
一、氮气
氮气占空气体积的78%,其化学性质很稳定,通常情况下,一般不与其他物质反应,要反应需要较高的反应条件。
将游离态的氮转化为化合物叫做氮的固定:
1.工业上,在高温高压催化剂的条件下,用氮气与氢气反应制备氨气,写出该反应的化学方程式: ___________________________________________
2.放电或高温条件下,氮气与氧气直接化合生成无色的一氧化氮,写出该反应的化学方程式:
___________________________________________
二、氮的氧化物
1.一氧化氮有毒,不溶于水,在常温下很容易与空气中的氧气化合,生成二氧化氮,写出该反应的化学方程式: ___________________________________________
2.二氧化氮是红棕色气体,有毒,溶于水时生成一氧化氮和硝酸,工业上利用这一原理生产硝酸,写出该反应的化学方程式:___________________________________________
3.一氧化氮和氧气按体积比4:3充入圆底烧瓶,倒扣于水槽中,所得硝酸溶液充满整个烧瓶,写出该反应的化学方程式:___________________________________________
4.二氧化氮和氧气按体积比4:1充入圆底烧瓶,倒扣于水槽中,所得硝酸溶液充满整个烧瓶,写出该反应的化学方程式: ___________________________________________
三、氨气
1.与水反应:氨气是无色有刺激性气味的气体,极易溶于水(1:700),氨的水溶液叫做氨水,氨溶于水时,大部分与水结合成一水合氨,一水合氨中有一小部分电离成NH4+和OH-,所以氨水显弱碱性。
一水合氨很不稳定,受热就会分解为氨和水,写出相关的化学反应方程式: ___________________________________________、_____________________________________________
2.与酸反应:写出氨气与氯化氢、硝酸反应的化学方程式:
_______________________________________________、________________________________________________
3.与氧气反应:氨的催化氧化 ___________________________________________
4.实验室制氨气:写出加热氯化铵和氢氧化钙的固体混合物制备氨气的化学方程式:
_______________________________________________________________,干燥氨气用 _________________。
四、铵盐
1.铵盐受热易分解,写出氯化铵、碳酸氢铵受热分解的化学方程式:
___________________________________________、 ___________________________________________
2.铵盐与碱共热,写出硝酸铵和氢氧化钠反应的化学方程式:
___________________________________________
五、硝酸
硝酸是无色、有刺激性气味的液体,易挥发,除具备酸的通性,还有以下性质:
1.不稳定性:硝酸见光易分解,应放置在棕色试剂瓶中于阴暗处避光保存,写出该反应的化学方程式: ___________________________________________
2.强氧化性:硝酸中+5价的氮得电子,被还原为较低价的氮,体现强氧化性。
(1)冷的浓硝酸使铁、铝发生钝化,常用铁槽车或铝槽车运输浓硝酸。
(2)与金属反应:硝酸与金属反应不生成氢气,浓度不同还原产物也不同,稀硝酸生成一氧化氮,浓硝酸生成二氧化氮,写出铜与浓硝酸、稀硝酸反应的化学方程式和离子方程式:________________________________________________、 ___________________________________________
________________________________________________、 ____________________________________________。
