(全国版)2019版中考化学复习主题一身边的化学物质专项(六)氢氧化钠变质的探究课件
中考化学精讲本 模块一 身边的化学物质 主题六 常见的酸和碱

2.氢氧化钠与氢氧化钙
①CCaa((OOHH))22++CCOO22======CCaaCCOO3↓3↓++H2HO2O, 22NNaaOOHH++CCOO22======NNaa2C2OC3O+3+H2OH2O; ②CCaa((OOHH))22++SSOO22======CCaaSSOO3↓3↓++H2HO2O, 22NNaaOOHH++SSOO22======NNaa22SSOO33++H2HO2O; ③CCaa((OOHH))22++22HHCCll======CCaaCCll22++22HH2O2O(复复分分解反解应反),应 NNaaOOHH++HHCCll======NNaaCCll+H+2OH2O; ④CCaa((OOHH))22++HH2S2OS4O=4====C=aCSaOS4+O42+H22OH2O, 22NNaaOOHH++HH22SSOO44======NNaa2S2OS4O+4+2H22OH2O; ⑤CCaa((OOHH))22++CCuuSSOO44======CCaaSSOO4+4+CuC(uO(HO)H2)↓2↓, 22NNaaOOHH++CCuuSSOO44======NNaa2S2OS4O+4+CuC(uO(HO)H2↓)2↓;
(1)仪器 a 的名称为烧烧杯杯。
(2)从紫甘蓝叶中提取植物色素的操作步骤如下:
①取适量紫甘蓝叶放在研钵中研碎; ②用水和酒精(体积比 1∶1)浸泡,过过滤滤(选填“过滤”或“蒸发”),取
液备用;
③将紫甘蓝提取液分别滴入白醋、石灰水、蒸馏水中,颜色变化如下表:
物质
白醋
石灰水
蒸馏水
显色情况
红色
绿色
蓝色
7.酸中一定含有氢元素,含有氢元素的物质不一定是酸。 (√√)
中考专项复习《氢氧化钠的变质》优秀课件

“NaOH溶液变质”有关的问题
NaOH变质的化学原理?
0 1
0 2
NaOH溶液是否变质?
部分变质还是完全变质?
0 3
0 4
如何重新转化?
谢谢
2.分别向两支试管中滴加你选 择的试剂,观察现象。
试试 剂剂
酚酞试液
稀盐酸
现现
×象象
都变红 ×
久置:气泡产生
新制:无明显现象
05 04 03 02 01
澄清石灰水
久置:有白色浑浊 新制:无明显现象
BaCl2溶 液 CaCl2溶液
久置:有白色浑浊 新制:无明显现象 久置:有白色浑浊 新制:无明显现象
NaOH溶液是完全变质 还是部分变质呢?
除杂原理:不增、不减、 不变、易分
选用试剂(均适量)
盐酸
不行,引新杂质,改变原物质。
评价并用化学方程式说明理由。
CaCl2溶液
不行,引新杂质。
2HCl+Na2CO3=2NaCl+H2O+CO2↑ HCl+NaOH=NaCl+H2O
澄清石灰水 √
行,新杂质碳酸钙能过滤除去。
CaCl2+Na2CO3=CaCO3↓+2NaCl Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
完全变质 Na2CO3
部分变质 Na2CO3和NaOH
除去Na2CO3,以免 干扰NaOH的鉴定!
如何除去Na2CO3?
1 CaCl2溶液﹑ BaCl2溶液呈中性。 2 部分碱和盐的溶解性表(20℃)。
√
步骤
取久置的NaOH溶液于 试管,滴入足量的BaCl2溶 液,再滴入无色酚酞溶液, 观察现象。
中考专题复习:实验探究 氢氧化钠变质的探究 课件

静止,取上层清液于试管中,滴入无色酚酞溶液,
有
,说明氢氧化钙部分变质,
若
,则全部变质。
我会选择
下列物质在空气中容易变质的是( )
①、烧碱溶液 ②、浓盐酸
③、生铁片
④、浓硫酸
⑤、铜片
⑥、生石灰
⑦、熟石灰
⑧、纯碱溶液
作业:
敞放在空气中的生石灰(CaO)是否变质,请你 设计相应实验加以验证。要求有实验猜想,实验设 计,实验现象,解释和结论。
,若不变
红,则说明
。
我会分析
(1)如何除去NaOH溶液中的Na2CO3?
在溶液中滴入
至不在产生沉淀为止,过滤。
A、Ca(OH)2
B、Ba(NO3)2
C、CaCl2
D、BaCl2
原理(用方程式表示) :
。
(2)氢氧化钠变质是由于它与空气中的二氧化碳
发生反应的缘故,因此氢氧化钠应
保存。
我会探究
氢氧化钙变质的探究
11.一个缺口的杯子,如果换一个角度看它,它仍然是圆的。 2.别人再好,也是别人。自己再不堪,也是自己,独一无二的自己。只要努力去做最好的自己,一生足矣。为自己的人生负责,为自己的梦想 买单。
6.最能让人感到快乐的事,莫过于经过一番努力后,所有东西正慢慢变成你想要的样子!1、立志是事业的大门,工作是登门入室的旅程。 12.得意时应善待他人,因为你失意时会需要他们。 14.要随时牢记在心中:决心取得成功比任何一件事情都重要。 13、有志者能使石头长出青草来。 1.你要多学点东西,你要多看会书,你要多跑些步,时间慢慢流,你想有一个更好的未来,那么从现在开始,你就要,好好努力。 12.本来无望的事,大胆尝试,往往能成功。 4、书卷多情似故人,晨昏忧乐每相亲。——于谦 12、自信是成功的先决条件。 9、别裁伪体亲风雅,转益多师是汝师。 9.运气永远不可能持续一辈子,能帮助你持续一辈子的东西只有你个人的能力。 13、如果刀刃怕伤了自己而不与磨刀石接触,就永远不会锋利。 3.未来是美好的,但也许它只是跟今天一样,不一定有我们想要的一切。每一个今天,都是我们想要的全部世界,别把所有的希望和约定都寄 放在明天,过好每一个今天,明天才会更有价值。
2019届中考化学一轮复习----氢氧化钠变质探究教学课件 (共24张PPT)

实质是检验是否存在Na2CO3(检验CO32-离子)
14:52
3、设计实验 4、实验验证
莱州市云峰中学
试用不同类型的物质来鉴别氢氧化钠是否变质
方案一:取样,加酸(足量)【稀盐酸或稀硫酸】 实验现象:溶液中有气泡生成。 反应原理: Na2CO3 +2HCl = 2NaCl+H2O+CO2↑
②再向其中滴加 无色酚酞试液 ②溶液变成红色
氢氧化钠溶液 部分变质
操作②能不能用硫酸铜溶液代替酚酞溶液呢?
14:52
讨论交流
•如果该瓶氢氧化钠溶液已经 变质了,那它还有没有使用 价值?并说明理由。
如何除去氢氧化钠溶液中的碳酸钠? 14:52
除杂原则:不引、不变、好分
选用试剂
酸(稀盐酸或 稀硫酸)
√盐【CaCl2 或BaCl2溶液】
Na2CO3 + CaCl2 = CaCO3↓+2NaCl
14:52
3、设计实验 4、实验验证 5、实验结论
实验步骤
实验现象
实验结论
①取少量待测液 于试管中,向其①有白色沉淀生成氢氧化钠溶液 全部变质
中滴加(足量) ②溶液没有明显变化
的CaCl2溶液 (或BaCl2溶液) ①有白色沉淀生成
采取的方法是加入适量的氢氧化钙溶液,然后过滤 。
反应方程式 CaCl2+Na2CO3=2NaCl+CaCO3↓
【拓展】
14:52
(1)通过上面的探究,氢氧化钠溶液应 密封保存,因为
类似的原因也需要用同样的方法保存的药品还有 C ,
敞口放置在空气中溶质的质量分数将减小的有 A、B、C 。 A.浓盐酸 B.浓硫酸 C.澄清石灰水
中考化学专题复习---氢氧化钠变质

除去氢氧化钠变质后的碳酸钠杂质
逐滴滴加氢氧化钙溶液或氢氧化钡至恰好不再产生 沉淀,然后过滤,就得到氢氧化钠溶液,再蒸发,
就得到氢氧化钠固体。Na2CO3 + Ca(OH)2 = CaCO3↓
+ 2NaOH Na2CO3+Ba(OH)2=2NaOH+BaCO3↓
归纳: ①不能选用盐酸或硫酸等酸液 ②不能用氯化钙等盐溶液
探究点二、NaOH的变质程度
我的猜想:
(1)没有变质 全部是NaOH (2)部分变质 NaOH和Na2CO3 (3)全部变质 全部是Na2CO3
【讨论】(1)检验NaOH的变质程度:实质上就
是检验Na2CO3存在之后再检验Na2CO3中是否还
有 NaOH 。那么, 不能
(“能”或
“不能”)直接用酚酞溶液来检验。
专题 氢氧化钠固体变质
问题
1:这瓶氢氧化钠变质了吗?如果变质, 变成了什么物质呢?
2:这瓶氢氧化钠是OH溶液已经变质
②NaOH溶液没有变质
想一想:
1.提出假设①的根据是什么?
氢氧化钠能吸取空气中的二氧化碳
2NaOH+CO2=N2CO3+H2O
类别 所用试剂
判断方法
酸 稀盐酸或稀硫酸 取少量待测溶液于试管中,加入足 量的稀盐酸,视察是否有气泡冒出
碱 氢氧化钙或氢氧 取少量待测溶液于试管中,加入少
化钡溶液
量石灰水,视察是否有沉淀产生
盐 氯化钙或氯化钡溶 取少量待测溶液于试管中,加入少量
液
氯化钙溶液,视察是否有沉淀产生
提示:NaOH转变成Na2CO3,实质是氢氧根离子变成了碳酸根离子。
结论:NaOH溶液 已经变质
(3)如何除去已变质的NaOH中的杂质
中考 物质变质考点归纳

中考物质变质考点归纳:氢氧化钠变质:1、氢氧化钠变质的原因:与空气中CO2反应,生成了碳酸钠。
2NaOH + CO2 = Na2CO3 + H2O2、检验氢氧化钠是否变质的方法:(分别滴加酸、碱、盐溶液,各为一种方法)①取少量样品于试管中,滴加稀盐酸(或者稀硫酸),如果产生气泡,说明已变质。
原理:碳酸钠会与酸反应生成二氧化碳气体;而氢氧化钠与酸反应无明显现象。
Na2CO3 + 2HCl = 2NaCl + CO2↑; NaOH + HCl = NaCl + H2O②取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生白色沉淀,说明已变质。
原理:Na2CO3会与Ca(OH)2反应生成碳酸钙白色沉淀,而氢氧化钠与氢氧化钙不反应Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH ; NaOH + Ca(OH)2≠③取少量样品于试管中,滴加氯化钙溶液(或者硝酸钙等其它可溶性钙盐、钡盐溶液)原理:Na2CO3会与CaCl2反应生成碳酸钙白色沉淀,而NaOH与CaCl2不反应,无明显现象。
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl ; NaOH + CaCl2 ≠3、检验氢氧化钠变质程度,是完全变质还是部分变质的方法:取少量样品于试管中,滴加足量的Ca Cl2溶液,再滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
原理:(1)氢氧化钠和变质后生成的碳酸钠溶液都呈碱性,滴加足量的氯化钙溶液是为了除尽生成的碳酸钠,这时会产生白色沉淀,然后滴加酚酞溶液,如果溶液呈红色,说明溶液呈碱性,有未变质的氢氧化钠,部分变质。
如果溶液不变红,说明没有氢氧化钠了,完全变质了。
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl(注意:除去碳酸钠时,不能用氢氧化钙,因为氢氧化钙与碳酸钠反应会生成新的氢氧化钠,会干扰对氢氧化钠的检验。
中考专题复习之探究氢氧化钠变质精品课件

A. 用过量【氨查水吸阅收资工料业尾】气中的SO2: 2NH3·H2O+SO2===2NH4++SO32-+H2O
氯化钡溶液呈中性。
【实验探究2】
实验步骤 先取少量该溶液放于试管 中,加入过量氯化钡溶液 静置,取上层清液于另一 支试管中,加入2﹣3滴酚 酞溶液
实验现象 有__白_色__沉__淀___生成
(查阅资料)CaCl2溶液,Ca(NO3)2溶液呈中性。 (实验探究)取白色粉末溶于水形成溶液A,设计如下实验:
猜想I:白色粉末是碳酸钠 猜想II:白色粉末是氢氧化钠 猜想III:白色粉末是碳酸钠和氢氧化钠
(1)由上述实验可知,猜想__Ⅱ_____肯定不成立。 (2)若操作①滴加过量稀盐酸有气体B产生,而滴加少量稀硫酸可能没有气体B产生。 其可能的原因是:_2_N_a_O__H__+_H_2_S_O__4═__N_a_2_S_O_4_+_2_H__2O____(用化学方程式回答)。
例6.(2015大庆)已知CO2通入澄清石灰水中,溶液变浑浊,继续通CO2气体由浑浊又变澄清 CaCO3+H2O+CO2=Ca(HCO3)2,由此某化学兴趣小组欲探究CO2与NaOH溶液反应后的溶质组成
【提出问题】CO2与NaOH溶液反应后的溶质组成
CO2+2NaOH =Na2CO3+H2O
(【52)盐查酸阅与草资木料灰:】2① HCl+、K2NCOaH3 C2KOC3+l+NHa2OO+HC═O2N↑[a现2C象O同3+(5H1)2]O
(3)小文从柜中取出标有“10% NaOH溶液”的试剂瓶,取少量样品加入试管中,向其 中滴入稀盐酸,发现产生气泡,判断该NaOH溶液中有Na2CO3,用化学方程式表示 NaOH溶液变质的原因:____2_N__a_O_H__+_C_O__2_=_N_a_2_C__O_3_+_H_2_O_。 小文同学对变质的NaOH溶液进行如下一系列实验,实现药品再利用。
化学必考知识点总结:氢氧化钠(NaOH)变质问题(附近三年中考试题))
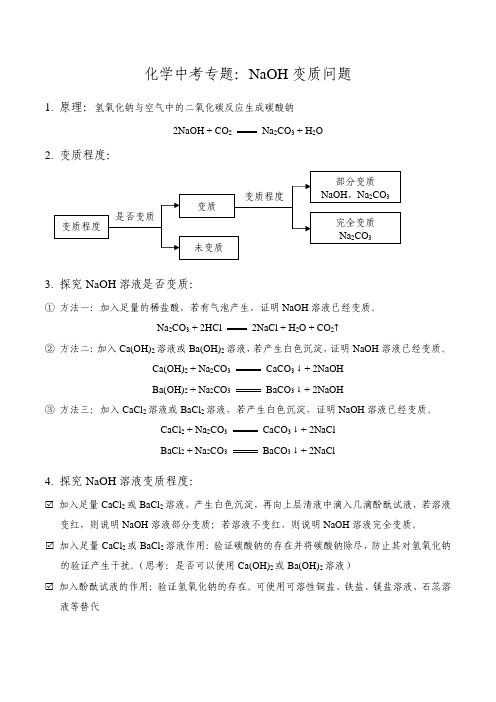
化学中考专题:NaOH 变质问题1. 原理:氢氧化钠与空气中的二氧化碳反应生成碳酸钠2NaOH + CO 2 Na 2CO 3 + H 2O2. 变质程度:3. 探究NaOH 溶液是否变质:① 方法一:加入足量的稀盐酸,若有气泡产生,证明NaOH 溶液已经变质。
Na 2CO 3 + 2HCl 2NaCl + H 2O + CO 2↑② 方法二:加入Ca(OH)2溶液或Ba(OH)2溶液,若产生白色沉淀,证明NaOH 溶液已经变质。
Ca(OH)2 + Na 2CO 3 CaCO 3↓+ 2NaOH Ba(OH)2 + Na 2CO 3BaCO 3↓+ 2NaOH③ 方法三:加入CaCl 2溶液或BaCl 2溶液,若产生白色沉淀,证明NaOH 溶液已经变质。
CaCl 2 + Na 2CO 3 CaCO 3↓+ 2NaCl BaCl 2 + Na 2CO 3BaCO 3↓+ 2NaCl4. 探究NaOH 溶液变质程度:加入足量CaCl 2或BaCl 2溶液,产生白色沉淀,再向上层清液中滴入几滴酚酞试液,若溶液变红,则说明NaOH 溶液部分变质;若溶液不变红,则说明NaOH 溶液完全变质。
加入足量CaCl 2或BaCl 2溶液作用:验证碳酸钠的存在并将碳酸钠除尽,防止其对氢氧化钠的验证产生干扰。
(思考:是否可以使用Ca(OH)2或Ba(OH)2溶液)加入酚酞试液的作用:验证氢氧化钠的存在。
可使用可溶性铜盐、铁盐、镁盐溶液、石蕊溶液等替代是否变质部分变质 NaOH 、Na 2CO 3 完全变质 Na 2CO 3未变质变质变质程度变质程度1.(2020.怀化)化学老师交给某研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质。
该小组的同学进行了如下实验探究:【提出问题】猜想Ⅰ:没变质,全部是;猜想Ⅱ:部分变质,既含有NaOH又含有Na2CO3;猜想Ⅲ:完全变质,全部是Na2CO3。
【查阅资料】i.已知反应: BaCl2 + Na2CO3 = BaCO3↓+ 2NaClⅱ.部分盐溶液在常温下的pH如下:【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题:滴加过量BaCl2溶液的目的是。
2019中考化学真题分类汇编 2考点14 酸碱盐和氧化物 6化学反应 氢氧化钠变质的研究

酸碱盐和氧化物
(18呼和浩特)10.实验室中同学们进行了如下图所示实验,成功探究出了久置氢氧化钠固体的变质情况。
下列说法正确的是
A.甲溶液可以选择稀盐酸或CaCl2溶液(查阅资料得知:CaCl2溶液显中性)
B.若Ⅱ、Ⅲ均有明显现象,则说明样品部分变质
C.D物质可能是气体,也可能是沉淀
D.溶液B中的溶质一定只含有NaOH和甲
(18陕西)22. (7分)化学兴趣小组的同学按图示装置及步骤验证氢氧化钠的化学性质。
【实验步骤】
I.将注射器内的液体注入A中的锥形瓶。
II.打开K,观察到C中部分红色溶液沿导管倒吸入A,片刻后回流停止。
III.打开K2,观察到B中溶液倒吸入A、C中,液面稳定后观察到A中溶液仍为红色,C中溶液变为无色。
同学们对相关问题分组展开如下探究。
【反思交流】(1)甲、乙两组同学的实验证明了NaOH能与稀盐酸、CO2发生反应;A中溶液里一定还存在NeCl。
写出NaOH与CO2发生反应的化学方程式_________。
(2)[实验步骤]中的现象_____(填“能”或“不能”)证明NaOH与CO2发生了反应。
【拓展迁移】对于无明显现象的化学反应,可通过检验有新物质生成或检验_____的方法来证明反应发生了。
2019年中考考前重点 化学《氢氧化钠变质》

中的碳酸 Na2CO3+BaCl2 BaCO3 +2NaCl (3)AD 【实验结论】部
分 【评价与反思】(1)部分变质的样品,溶液中的溶质为 NaOH 和 Na2CO3 , 稀盐酸需将氢氧化钠反应完,才能与碳酸钠反应 (2)氢氧化钡溶液会引入 氢氧根离子,对后续氢氧化钠的检验造成影响
专家密招赶紧看 1. 变 质 原 因 : NaOH 与 空 气 中 的 CO2 反 应 , 反 应 的 化 学 方 程 式 为
。
猜想 3:该溶液全部变质,溶液中的溶质只有 Na2CO3
【查阅资料】Na2CO3 溶液显碱性,能使无色酚酞溶液变红,而 BaCl2 溶液显中性。
【交流与讨论】NaOH 可能变质的原因是
。
【实验设计】
甲同学:
乙同学:
(1)由甲、乙两同学的实验,可推知猜想 一定不正确。
(2)乙同学实验中加入过量 BaCl2 溶液的作用是 的化学方程式
2NaOH+CO2 Na2CO3+H2O .
2.检验方法(实质是检验是存在 CO32 ,若有,则已变质)
试剂选择
现象及结论
稀盐酸(或稀硫
酸
酸)
取少量溶液于试管中,加入足 量稀盐酸(或稀硫酸),
若有气体生成,则已变质
取少量溶液于试管中,加入氢
氢氧化钙(或氢 氧化钙(或氢氧化钡)溶液, 碱
氧化钡)溶液 若有白色沉淀生成,则已变质
4.(推荐陕西)某化学兴趣小组同学发现,上个月做实验用的 NaOH 溶液忘记了 盖瓶盖。对于该溶液是否变质,甲乙两同学分别进行了如下实验探究: 【提出问题】该溶液是否变质,溶液中的溶质是什么? 【猜想与假设】
猜想 1:该溶液没有变质,溶液中的溶质只有 NaOH
中考化学复习方案 主题三 身边的化学物质 专项06 物质变质的实验探究课件

图G6-1
(1)上述(shàngshù)实验中,A操作的名称是过滤(guòlǜ)。
(2)“无色溶液”中溶质成分为
NaOH、NaCl、Ca(填Cl化2 学式)。
(3)根据上述实验,推断固体样品中一定含有
NaOH、Na2(填CO化3学式)。
2021/12/12
第十页,共十八页。
3.实验室中一瓶久置的氢氧化钠溶液可能发生了变质 (若发生变质,变质的结果是生成了
2.氢氧化钙变质的探究
(1)氢氧化钙变质的原因
氢氧化钙吸收空气中的 二氧化碳而(è变r 质yǎ,变ng质h的uà化t学àn方) 程式是
Ca(OH)2+CO2 CaCO3↓+H,变2质O后,固体质量会
变”)。
(填“增大”增“大减(小zē”nɡ或d“à) 不
(2)变质情况分析
氢氧化钙在空气中敞口放置(fàngzhì)一段时间后,其成分可能为以下几种情况:
Na2CO3),现在对该瓶氢氧化钠溶液进行分析检测。 猜测溶质 猜测一:溶液中溶质只有NaOH;
猜测二:溶液中溶质只有Na2CO3;
猜测三:溶液中溶质
既有NaOH,又有Na2C。O3
查阅资料 ①某溶液能使无色酚酞变红,则该溶液可能是碱溶液或其他碱性( jiǎn xìnɡ)溶液。
②Na2CO3溶液能使pH试纸变蓝,BaCl2溶液不能使pH试纸变色。
猜想三:该瓶粉末的成分可能为 碳酸。钙
作出猜想三的理由是
氢氧化钙可能(kěnéng)。完全变质
2021/12/12
第十四页,共十八页。
实验验证 请你参与(cānyù)探究,完成下面的实验报告。
实验步骤
(1)取少量样品于小烧杯中,加入适量水,充 分搅拌,过滤,取少量滤渣于试管中,加 入 稀盐酸 (2)取步骤(1)中的 滤液(lǜy于è)试管中,滴加 无色酚酞溶液
中考化学复习 主题一 身边的化学物质 专项(五)氢氧化钠、氢氧化钙、氧化钙的变质课件

考点突破
3.氧化钙变质(biàn zhì)的探究
(1)变质原因:氧化钙能与空气中的水发生反应,生成 (2)检验样品是否变质:取样品于试管中,滴加足量的稀盐酸,若有
,最C终a(生O成H)难2 溶的
。 CaCO3
生成,则样品已气经泡发生(q变ìp质à;取o样) 品于试管中,滴加适量蒸
馏水,插入一支温度计,若温度计示数
是否存在;加入过量BaCl2溶液或CaCl2溶液(呈中性,不干N溶a液2C,O观3察全部是除否去变红,就可以判断NaOH是否存在了。
(5)除去部分变质的氢氧化钠中的碳酸钠:滴加适量的
溶液,然后过滤,得到氢氧化钠溶液,再蒸发溶剂,得到氢氧
化钠固体。
NaOH、Na2CO3
。 Na2CO3
第二页,共九页。
考点突破
1.氢氧化钠(qīnɡ yǎnɡ huà nà)变质的探究
(3)检验氢氧化钠是否变质的方法
检验氢氧化钠是否变质,实质是检验固体物质中是否有
。N检a2验C的O3方法通常有:
①加酸溶液:取少量样品于试管中,滴加
足,量如稀果产盐生酸
,说明已气变泡(质q,ì其pà反o应) 原理用化学方程式表示
Image
12/12/2021
第九页,共九页。
为
Na2CO3+2HCl 。2NaCl+CO2↑+H2O
向样品中滴加几滴稀盐酸观察到无气泡,不能得出没有变质的结论,其原因
是 酸碱中和反应优先进行,盐酸加入后优先与样品中氢氧化钠。反应
②加碱溶液:取少量样品于试管中,向其中(qízhōng)滴加 Ca(OH)2[或Ba(OH)2] 溶液,如果产生
经变质。其反应原理用化学方程式表示为
中考化学复习方案 专项(04)碱的变质课件

2NaOH+CO2
yǎng huà tàn)增大(zēnɡ dà)202Biblioteka /12/8第二页,共九页。
(填“增
Na2CO3+H2O
2.检验氢氧化钠是否变质的方法
检验氢氧化钠是否变质,实质是检验是否有
-
,检验的方法通常有以下三种
:
C (或 Na
2CO3)
(1)加酸溶液:取少量样品于试管中,向其中滴加
检验氢氧化钠变质的程度,实质是检验是否有
Na2CO3
干扰,需要先加入足量的
,但在检验此物质时,受到
NaOH
,然后再加入
CaCl2除去干扰物质
溶液(róngyè)
(合理即可)
检验此物质的存在。
无色(wú
sè)酚酞溶液(合理即可)
2021/12/8
第五页,共九页。
4.除去部分变质的氢氧化钠中的碳酸钠
滴加适量的
主题(zhǔtí)一
专项(四)
碱的变质
2021/12/8
第一页,共九页。
身边的化学物质
考点突破
一、氢氧化钠变质的探究
1.氢氧化钠变质的原因
氢氧化钠固体敞口放置(fàngzhì)会吸收空气中的
而潮解,同时可吸收空气中的
水蒸气
而变质,变质的化学方程式是
,变质后质量会
二氧化碳(èr
大”“减小”或“不变”)。
生
,如果产
,说明已经变质。其反应(fǎnyìng)原理用化学方程式表示为
足量稀盐酸(或稀硫酸)
_________________________________________________________________________
【推选】中考科学 酸碱盐复习之氢氧化钠变质课件PPT资料

探究题:某化学兴趣小组甲、乙、丙三位同学对暴露在空气
中的氢氧化钠是否全部变质进行了探究:
甲同学,取样品加入盐酸,有气泡产生,完全反应后,蒸干
2 检得验氢到氧化的钠是固否变体质的全方法部是:是氯化钠,认为样品全部变质。
N3 a检2验CO氢乙3氧+化同Ba钠C变学l2质==程,度的取方法样是:品加水溶解,滴加无色酚酞试液变红色,认为
能否用酚酞来检验?为什么?
不能, Na2CO3溶液也呈碱性,都能使酚酞变红色
三、变质程度如何呢?
①部分变质 既酚有酞 NaOH又有Na2CO3 过量 ②完全变质 只有Na2CO3
检验出是否有NaOH !
CBaaCCOO33↓↓
?
①先除尽Na2CO3 ,②再检验是否有NaOH !
除尽Na2CO3
产生气体 +稀HCI / 稀H2SO4
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
产生沉淀 +Ba2+ +Ca2+
Cl--
NO3--
OH--
Na2CO3 + Ba(NO3)2 = 2NaNO3 + BaCO3↓ Na2CO3 + BaCl2 == 2NaCl + BaCO3↓ Na2CO3 + Ca(OH)2==2NaOH + CaCO3↓ Na2CO3 + CaCl2 == 2NaCl + CaCO3↓
浓盐酸
浓硫酸
潮解,与CO2反应 与CO2反应
与CO2反应 与水反应 CaO + H2O = Ca(OH)2 挥发出HCl气体
吸水性
二.氢氧化钠是否变质呢?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验操作步骤
(1)取少量样品于试管中,加入足量的稀盐酸
(2)另取少量样品于试管中,加水溶解, 加入过量的CaCl2溶液,振荡,静置 (3)取(2)中上层清液,滴加无色的酚酞 溶液
实验现象 有气泡产生
ห้องสมุดไป่ตู้
实验结论 假设 不正确
假设Ⅱ 正确
拓展应用 完全变质的KOH也有利用价值,从K2CO3的组成或性质看,K2CO3在农业上的用途是
(填
一种即可)。
[答案]查阅资料 2KOH+CO2 K2CO3+H2O 进行实验 (1)Ⅰ (2)产生白色沉淀 (3)酚酞溶液变红色 拓展应用 用作钾肥
。
(4)若测得E的pH=7,则A的成分是 碳酸钠 ,若测得E的pH>7,则A的成分是 氢氧化钠和碳酸钠 。
图G6-1
类型二 氢氧化钠变质程度的探究
3.某学习小组测定实验室里一瓶NaOH溶液是否变质,以及变质程度,进行了下列实验,实验方案正确的 () A.取少量样品,加入几滴酚酞溶液,溶液由无色变红色,证明氢氧化钠溶液没有变质 B.取少量样品,加入少量稀盐酸,没有气泡产生,证明氢氧化钠溶液没有变质 C.取少量样品,加入过量的氯化钡溶液,有白色沉淀生成,过滤,向滤液中加入几滴酚酞溶液,溶液不变色,证 明氢氧化钠溶液完全变质 D.取少量样品,加入过量的氢氧化钡溶液,有白色沉淀生成,过滤,向滤液中加入几滴酚酞溶液,溶液由无色 变红色,证明氢氧化钠溶液部分变质
5.[2018·巴中] 小明在实验室发现一瓶未密封的KOH固体,对其成分进行实验探究。
查阅资料 ①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原
因
。
②K2CO3溶液呈碱性,CaCl2溶液、KCl溶液呈中性。 猜想假设 假设Ⅰ:只含KOH;假设Ⅱ:含KOH和K2CO3;假设Ⅲ:只含K2CO3。 进行实验
2.已知NaOH容易与空气中的CO2作用而变质。小军同学在实验室发现一瓶敞口放置的NaOH固体后,设
计方案,对这瓶NaOH固体变质情况进行了如下实验探究: (1)上述实验操作的名称分别是:
① 溶解 ,④ 过滤
。
(2)根据上述实验,可以确定该固体 已
(填“已”或“未”)变质。
(3)步骤③中加过量氯化钙溶液的目的是 完全除去碳酸钠
专项(六) 氢氧化钠变质的探究
类型一 氢氧化钠是否变质的探究 1.下列物质的溶液长期敞口放置在空气中(不考 虑水分的蒸发),溶液质量因发生化学变化而增大 的是( )
A.浓盐酸 B.氯化钾溶液 C.浓氨水 D.氢氧化钠溶液
[答案] D
[解析] 浓盐酸、浓氨水在空气中 分别挥发出氯化氢气体、氨会使 溶液质量减小;氯化钾在空气中无 变化,溶液质量不变;氢氧化钠会吸 收空气中的二氧化碳生成碳酸钠, 发生化学变化导致溶液质量增加。
[答案] C [解析] 碳酸钠和氢氧化钠都显碱性,都能使酚酞溶液变色;氢氧化钠部分变质成碳酸钠,若滴加少量的稀盐 酸,氢氧化钠和盐酸先反应生成氯化钠和水,也不会出现气泡;加入氢氧化钡会引入氢氧根离子,对氢氧化钠 的检验造成干扰。
4.[2018·衢州] 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量样品配制成溶液,再取少 量溶液分别装入两支试管中,进行了如图G6-2所示实验。(注:BaCl2溶液呈中性)
图G6-2
(1)小柯认为“图甲实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确,并说明理由
:
。
(2)分析图乙实验的现象,可以确定样品的变质情况为
。
(3)进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在图G6-3中画出“生成 CO2的质量随加入稀盐酸质量变化”的大致图像。
图G6-3
[答案] (1)不正确,氢氧化钠和碳酸钠溶液均显碱性,无论氢氧化钠是否变质,都能使无色酚酞溶液变红色 (2)部分变质 (3)
[解析] (1)小柯的观点不正确;氢氧化钠固体露置在空气中,会发生潮解,能吸收空气中的二氧化碳气体生成碳酸钠和水而变 质,碳酸钠属于盐,其水溶液显碱性,碳酸钠溶液能使无色酚酞溶液变红色;氢氧化钠属于碱,其溶液能使无色酚酞溶液变红色。 所以,甲实验中,不论氢氧化钠是否变质,溶液都会变为红色。(2)乙实验中,向样品溶液中加入氯化钡溶液产生白色沉淀,证明 溶液中含有碳酸钠,因为碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠;由于加入足量的氯化钡溶液,碳酸钠被完全反应,生 成的氯化钠及过量的氯化钡的溶液均显中性,静置后取上层清液,滴加酚酞溶液,酚酞溶液变红色,证明溶液中含有氢氧化钠, 样品中含有氢氧化钠和碳酸钠,故氢氧化钠部分变质。(3)向样品中加入稀盐酸,盐酸先与氢氧化钠反应生成氯化钠和水,该 反应无气体产生;当氢氧化钠完全反应后,盐酸继续和碳酸钠反应生成氯化钠、二氧化碳和水;当碳酸钠完全反应后,再加稀 盐酸,无气体产生。生成二氧化碳质量随加入盐酸质量变化的图像如下:
