物理化学电子教案PPT课件
物理化学幻灯片PPT课件

质量作用定律的发现,后一个导致动态平衡观念的确立。
瑞典化学家贝格曼于1775年列出化学亲和力表
(认识到数量对反应结果的影响)
法国化学家贝托雷在1798年设想化学反应会逆向进行
(认识到化学反应中的质量效应)
法国化学家威廉米于1850年提出
的研究后来中断了50年。
直到19世纪下叶热力学理论基本奠定后,热质说才逐渐被 科学界摈弃。
2021
12
热化学界发现的第一个定律 ——黑斯定律
黑斯:出生于日内瓦,在俄国长 1836年,瑞士化学家
大并且接受了医学教育,他在圣
黑斯在俄国测量了很
彼得堡发表了他的研究成果,并
多反应的热效应,总
将其称为‘总热量守恒定律’,
dM dt
kM
挪威数学家古德贝格和化学家瓦格A +B C+D
(第一个表示物质浓度与反应速度关系的公式) (全面阐释质量作用定律)
2021
10
第二部分
热化学和 热力学基本定律
2021
11
从热质说到热化说
什么是热质说 把热视为一种运动着的微粒性的实在物质
1780年,拉普拉斯和拉瓦锡,在他们的论文中报道了他们 关于化学热反应的研究,由于受到 热质说的影响,这方面
1853年,英国物理学家开尔文给出了热力学第一定律的表 达式,‘能’这一术语被广泛接受。
2021
15
热力学第二定律的确立
1824年,法国工程师卡诺,通过对热机的分析得出:热机 必须在两个热源之间工作,热机的效率只取决于两个热源 的温差。可逆热机的工作效率最高。这就是卡诺原理。
物理化学电子课件第七章电化学基础

第二节 电解质溶液
六、电导测定的应用
2. 难溶盐或微溶盐在水中的溶解度很小,很难用普通的滴定方法测 定出来,但是可以用电导的方法测定。用一已预先测定了电导率的高 纯水,配置待测微溶或难溶盐的饱和溶液,测定此饱和溶液的电导率 κ,则测出值为盐和水的电导率之和,故
第二节 电解质溶液
3. 在科学研究及生产过程中,经常需要纯度很高的水。例如,半导 体器件的生产和加工过程,清洗用水若含有杂质会严重影响产品质量 甚至变为废品。
第二节 电解质溶液
表7-2 25 ℃时几种浓度KCl水溶液的电导率
第二节 电解质溶液
四、摩尔电导率与浓度的关系
科尔劳施 (Kolrausch)对电解质溶液的摩尔电导率进行了深入的 研究,根据实验结果得出结论:在很稀的溶液中,强电解质的摩尔电 导率Λm与其浓度c的平方根呈直线关系,即科尔劳施经验式:
第七章 电化学基础
第一节 电化学的基本概念 第二节 电解质溶液第三节 可逆电池及原电池热力学 第四节 电极电势 第五节 不可逆电极过程 第六节 电化学的基本应用
第一节电化学的基本概念
一、电解池与原电池
电化学的根本任务是揭示化学能与电能相互转换的规律,实现这 种转换的特殊装置称为电化学反应器,分为电解池和原电池两类。电 解池是将电能转化为化学能的装置,而原电池是将化学能转化为电能
第三节 可逆电池及原电池热力学
四、可逆电池的热力学 1.可逆电池的电动势E与电池反应的摩尔反应吉布斯函数ΔrGm的关
在恒温、恒压且电池可逆放电过程中,系统吉布斯函数的变化量等 于系统与环境间交换的可逆电功,即等于电池的电动势E与电量Q的乘积。 根据法拉第定律,每摩尔电池反应的电量为zF,故
第三节 可逆电池及原电池热力学
2024版傅献彩物理化学电子教案课件

01绪论Chapter物理化学概述物理化学的定义01物理化学的研究范围02物理化学在化学科学中的地位03物理化学的研究对象与任务研究对象研究任务实验方法通过实验手段观测和记录物质的物理现象和化学变化,获取实验数据。
理论方法运用数学、物理学等理论工具对实验数据进行处理和分析,揭示物质的基本规律。
计算方法利用计算机模拟和计算等方法,对物质的性质、结构和变化规律进行预测和研究。
物理化学的研究方法030201物理化学的学习方法与要求学习方法学习要求02热力学基础Chapter热力学基本概念与术语热力学系统状态与状态函数过程与途径热力学平衡态热力学第一定律能量守恒定律能量不能创造也不能消灭,只能从一种形式转化为另一种形式。
热力学能系统内能的变化等于传入系统的热量与外界对系统做功之和。
焓定义为系统的热力学能与体积的乘积,用于描述等压过程中的能量变化。
热力学第二定律热力学第二定律表述热力学温标熵增原理热力学函数与基本方程热力学函数热力学基本方程麦克斯韦关系式热力学在化学中的应用化学反应的热效应化学平衡相平衡03化学动力学基础Chapter化学反应速率的概念与表示方法化学反应速率表示方法摩尔浓度变化率、质量浓度变化率、气体分压变化率等化学反应速率理论简介碰撞理论过渡态理论01020304浓度越高,反应速率越快。
反应物浓度温度越高,反应速率越快。
温度催化剂可以降低反应的活化能,从而加快反应速率。
催化剂对于有气体参与的反应,压力的变化会影响反应速率。
压力影响化学反应速率的因素复杂反应动力学简介平行反应竞争反应连续反应根据反应条件(如温度、压力、浓度等)预测反应的速率。
预测反应速率通过调整反应条件(如温度、压力、催化剂等)来优化反应速率和选择性。
优化反应条件通过分析反应速率与各种因素的关系,可以推断出反应的机理和过渡态的性质。
研究反应机理化学反应速率理论的应用04电化学基础Chapter电化学基本概念与术语电化学电极电解质电离电导率将化学能转变为电能的装置。
物理化学核心教程电子课件

胶体分散系是指物质以微小的粒子分散在介质中所形成的体系。这些微小的粒子通常具有很大的表面 积和表面能,因此具有较高的稳定性。
稳定性
胶体分散系的稳定性取决于粒子间的相互作用和粒子的大小。如果粒子间的相互作用很强,或者粒子 的大小很小,则胶体分散系更加稳定。
07 环境化学
环境污染与生态平衡
当改变影响平衡的一个条件时,平衡 会向着减弱这种改变的方向移动。
勒夏特列原理
如果改变影响平衡的条件,平衡总是 向着减弱这种改变的方向移动。
酸碱平衡与沉淀溶解平衡
酸碱平衡
酸碱反应达到平衡时,溶液中的 氢离子和氢氧根离子浓度保持相 对稳定。
沉淀溶解平衡
难溶电解质在溶液中存在溶解和 沉淀的平衡状态,其平衡常数称 为溶度积。
反应机理与速率控制步骤
总结词
反应机理揭示了反应如何发生,而速率控制步骤决定 了整个反应的快慢。
详细描述
反应机理是化学反应的具体过程,包括各步反应的中间 产物和能量变化。通过了解反应机理,可以更好地理解 反应的本质。速率控制步骤是决定整个反应快慢的关键 步骤,控制了整个反应的速率。
温度对反应速率的影响
物理化学核心教程电 子课件
目录
CONTENTS
• 物理化学概述 • 热力学基础 • 化学动力学 • 化学平衡 • 物质结构基础 • 表面与胶体化学 • 环境化学
01 物理化学概述
物理化学的定义与重要性
定义
物理化学是研究物质在物理变化 和化学变化中表现出来的物理性 质和化学性质及其相互作用的科 学。
重要性
物理化学在科学、工程、技术、 医药等领域中具有广泛的应用, 是化学、化工、材料科学、环境 科学等学科的基础。
物理化学的发展历程
物理化学完整ppt课件

数称为(独立)组分数。 S:物种数
CSRR'
R:独立的化学平衡数 R′独立限制条件数
说明:★独立限制条件数只有在同一相中才能起作用
CaCO3(s)=CaO(s)+CO2(g) R′= 0 ★独立的化学平衡数:指物质间构成的化学平衡是相互独立的
C+H2O=CO+H2 C+CO2=2CO CO+H2O=CO2+H2 R=2 S=5 C=5-2=3
(1)因外压增加,使凝固点下降 0.00748K (2)因水中溶有空气,使凝固点下降 0.00241K
可编辑课件
16
例:如图为CO2的相图,试问: (1)将CO2在25℃液化,最小需加多大压力? (2)打开CO2灭火机阀门时,为什么会出现少量白色固体(俗称于冰)?
解:(1)根据相图,当温度为25℃ 液一气平衡时,压力应为67大气压, 在25℃时最小需要67大气压才能使 CO2液化。
2、水的相图
可编辑课件
13
◎组分数
S:物种数
CSRR'
R:独立的化学平衡数 R′独立限制条件数
总结1
说明:★独立限制条件数只有在同一相中才能起作用 ★独立的化学平衡数:指物质间构成的化学平衡是相互独立的
◎相律
◎单组分系统相图 F=C-P十2=3-P
单组分系统最多三相共存 单组分系统是双变量系统
可编辑课件
可编辑课件
7
杠杆规则还可以表示为:
(1)
m() 1 wB() wB 1
m( )
wB wB ()
m() m() wB() wB wB wB()
m( )
wB wB ()
m() wB wB() m wB() wB()
物化ppt课件专题培训
§4.2 多组分系统旳构成表达法
2. B旳质量分数 wB (Mass fraction of B)
wB def
m(B) mA
A
即B旳质量 m(B) 与混合物旳质量之比
wB 旳单位为1
§4.2 多组分系统旳构成表达法
3. B旳浓度 cB (又称为 B旳物质旳量浓度)
cB def
定义化学势
B
def
U ( nB )S,V ,nc (cB)
第一种基本公式就可表达为:
dU TdS pdV BdnB B
化学势旳定义
U U (S,V , n1, n2, , nk )
同理,
H H (S, p, n1, n2, , nk )
A A(T ,V , n1, n2, , nk )
Байду номын сангаас
B
G ( nB
)T , p,nc (cB)
化学势在判断相变和化学变化旳方向和程度方面
有主要作用。
化学势在相平衡中旳应用
设系统有α和β两相,在等温、等压下, β 相 中有极微量旳B种物质 dnB 转移到α相中
系统Gibbs自由能旳变化值为
dG dG dG B dnB B dnB
α相所得等于β相所失,即: dnB dnB
称为溶质B旳摩尔分数,又称为物质旳量分数。
摩尔分数旳单位为1
气态混合物中摩尔分数常用 yB 表达
在溶液中,表达溶质浓度旳措施有:
(1)溶质B旳质量摩尔浓度mB
Molality of solute B
mB def
nB m(A)
mB bB
溶质B旳物质旳量与溶剂A旳质量之比称为 溶质B旳质量摩尔浓度。
傅献彩物理化学电子教桉-第五版物理化学总复习省名师优质课赛课获奖课件市赛课一等奖课件

QP
r
H
m
(773K
)
61.2kJ.mol 1
rU
m
(773K
)
r
H
m
(773K
)
B (g)RT
61.2 (111) 8.314 773103 kJ.mol 1
67.6kJ.mol 1
W
rU
m
(773K
)
Q
(67.6 61.2)kJ.mol 1 6.4kJ.mol 1
或者
均活度系数、离子强度旳计算; 3、电池电动势、电极电势及电池反应旳
rGm , r H m , r Sm , Qr,Ka 旳计算;
4、会将简朴反应设计成原电池等。
1. 298K时电池: Zn(s)|ZnCl2 -1 ) | AgCl(s)|Ag(s) 电动势为 E=1.156V (1)写出电极反应和电池反应;
第三定律熵:
ST
T Qr
0K T
偏摩尔量、化学势及化学势判据:
Z nB
T ,P,nc
Z B,m
Z U , H ,V , A,G, S
B
G nB
T ,P,nc
GB,m
有可能发生过程
BB 0
可逆过程
3. 基本过程、基本公式
W、Q、U、H、S 、A及G旳计算:
理想气体自由膨胀
W Q U H 0
,298K
)
反应旳恒压热效应与恒容热效应旳关系:
r
H
m
(298K
)
rU
m
(298K
)
B (g)RT
如反应 H2 (g) 0.5O2 (g) H2O(l)
B (g)RT (0 0.5 1)RT 1.5RT
溶液ppt课件
旳化学势,它不是原则态。
上一内容 下一内容 回主目录
2024/9/28
溶质旳化学势
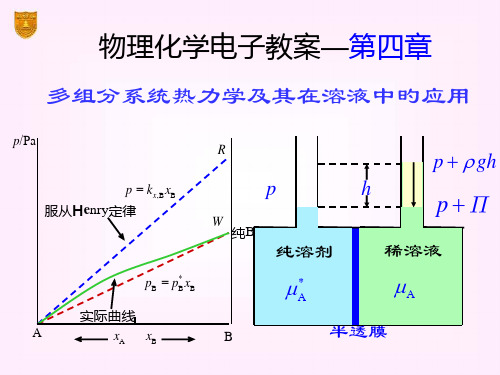
Henry定律因浓度表达措施不同,有如下三种形式:
pB kx xB kmmB kccB
(1)B (T , P) B (T ) RT ln(PB / P )
B (T ) RT ln(Kx / P ) RT ln xB
2024/9/28
溶质旳化学势
上一内容 下一内容 回主目录
2024/9/28
4.7 稀溶液旳依数性
依数性质:(colligative properties)当把一种不挥发
性物质溶于某一溶剂,构成稀溶液时,该溶液旳某些 性质只与溶质旳质点数(即多少)有关,而与溶质本 身旳性质无关,我们把稀溶液旳此种特征称为“依数 性”。 依数性旳种类:
2024/9/28
4.2 溶液构成旳表达法
4.质量分数wB(mass fraction)
wB
WB W (总)
溶质B旳质量与溶液总质量之比称为溶 质B旳质量分数。为无量纲量。
上一内容 下一内容 回主目录
2024/9/28
4.3 稀溶液中旳两个经验定律
拉乌尔定律(Raoult’s Law)
1887年,法国化学家拉乌尔在屡次试验旳基础上总
p)
(T
,
p
)
RTIn
P P
纯物质旳摩尔吉布斯自由能等于化学势
(T ,
P)
(T ,
P
)
RT
ln
P P
上一内容 下一内容 回主目录
2024/9/28
理想气体旳化学势
(T ,
P)
(T ,
P
)
RT
物理化学电子教案第九章

•(1)
PPT文档演模板
•(2)
物理化学电子教案第九章
左氧化,负极 右还原,正极 净反应
或
PPT文档演模板
物理化学电子教案第九章
从化学反应设计电池(1)
•Zn(s)+H2SO4(aq)→H2(p)+ZnSO4(aq)
•Zn(s) | ZnSO4 (aq)|| H2SO4 (aq)| H2(p) | Pt •验证:
•电池电动势的计算
•净反应:
•计算方法2:
PPT文档演模板
•两种方法结果相同
物理化学电子教案第九章
§9.7 电动势测定的应用
•求电解质溶液的平均活度因子 • 求难溶盐的活度积 • pH 的测定 • *电势-pH 图及其应用 •*细胞膜与膜电势 • *离子选择性电极和化学传感器简介
PPT文档演模板
•电池电动势的计算
•注意事项
•1.电极反应和电池反应都必须物量和电荷量平衡。
•2.电极电势都必须用还原电极电势,电动势等于 正极的还原电势减去负极的还原电势。
•3.要注明反应温度,不注明是指298 K。 •要注明电极的物态,气体要注明压力,溶液要注 明离子的活度。
PPT文档演模板
物理化学电子教案第九章
PPT文档演模板
•电位计
物理化学电子教案第九章
•标准电池
PPT文档演模板
•正
•负
•Weston标准电池结构简图 物理化学电子教案第九章
•Weston标准电池的反应 •负极 •正极 •净反应
•中含镉
•298.15K时
PPT文档演模板
物理化学电子教案第九章
•问 题
• 为什么在室温下,含Cd的质量分数在0.05~0.14 •之间,标准电池的电动势有定值?
物理化学电子教案第四章
2021/11/9
偏摩尔量的数值随混合物的组成变化
在温度、压力恒定下,混合物的组成发生变化 时,各组分偏摩尔量变化的相互依赖关系。
2021/11/9
同除以总摩尔数n 增202大1/11与/9 减小的比例与混合物中两组分的物质的量成反比
2021/11/9
对混合物中任 一组分B取偏 导数
2021/11/9
2. 多组分多相系统的热力学基本方程
G=∑G() A=∑A() H=∑H() U=∑U()
2021/11/9
G=∑G(), S=∑S(), V=∑V()
3. 化学势判据及其应用举例
2021/11/9
3. 化学势判据及其应用举例
亥姆霍兹函数判据
(dT 0,dV 0, W ' 0)
2021/11/9
§4.2 化学势
化学势的定义:混合物中组分B的偏摩尔吉布斯函数
B
( G nB
)T , p,nc
保持温度、压力和除B以外的其它组分不变,体系的
Gibbs自由能随 nB的变化率称为化学势,所以化学势 就是偏摩尔Gibbs自由能。
化学势在判断相变和化学变化的方向和限度方面有重 要作用。
多组分系统的组成表示法
溶质B的浓度表示法 (1)物质的摩尔分数 xB
溶质B物质的量与溶液总物质的量之比
(2)质量摩尔浓度bB
溶质B的物质的量除以溶剂A的质量
(3)物质的摩尔浓度cB
溶质B的物质的量除以溶液的体积
(4)质量分数wB
溶质B的质量与溶液总质量之比
def
xB
nB
ni
bB def
nB mA
25℃,100kPa
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案—第十一章
上一内容 下一内容 回主目录
返回
2020/11/8
第十一章 化学动力学基础(二)
11.1 碰撞理论 11.2 过渡态理论 11.3 单分子反应理论 11.4 分子反应动态学简介 11.5 在溶液中进行的反应 11.6 快速反应的测试 11.7 光化学反应 11.8 催化反应动力学
返回
2020/11/8
第三章 统计热力学基础
3.1 概论 3.2 Boltzmann 统计 3.3 配分函数 3.4 各配分函数的计算 3.5 配分函数对热力学函数的贡献 3.6 单原子理想气体热力学函数的计算 3.7 双原子理想气体热力学函数的计算
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案—第四章
气态溶液 固态溶液 液态溶液
正规溶液
非电解质溶液
上一内容 下一内容 回主目录
返回
2020/11/8
第四章 溶液
4.1 4.2 4.3
4.4
4.5 4.6 4.7 4.8 4.9 4.10 4.11
引言 溶液组成的表示法 偏摩尔量与化学势
稀溶液中的两个经验定律
混合气体中各组分的化学势 液体混合物 稀溶液中各组分的化学势 稀溶液的依数性 Duhem-Margules公式 非理想溶液 分配定律
上一内容 下一内容 回主目录
返回
2020/11/8
第二章 热力学第二定律
2.1 自发变化的共同特征 2.2 热力学第二定律 2.3 卡诺循环与卡诺定理 2.4 熵的概念 2.5 克劳修斯不等式与熵增加原理 2.6 熵变的计算
2.7 热力学第二定律的本质和熵的统计意义
2.8 亥姆霍兹自由能和吉布斯自由能
上一内容 下一内容 回主目录
返回
2020/11/8
第八章 可逆电池的电动势及其应用
主要内容
可逆电池和可逆电极 电动势的测定 可逆电池的书写方法及电动势的取号 可逆电池的热力学 电动势产生的机理 电极电势和电池的电动势 浓差电池和液体接界电势的计算公式 电动势测定的应用 生物电化学
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
2020/11/8
第二章 热力学第二定律
2.9 变化的方向和平衡条件 2.10 G的计算示例 2.11 几个热力学函数间的关系 2.12 克拉贝龙方程 2.13 热力学第三定律与规定熵
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案—第三章
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案—第十二章
上一内容 下一内容 回主目录
返回
2020/11/8
第十二章 界面现象
12.1 表面吉布斯自由能和表面张力 12.2 弯曲表面下的附加压力和蒸气压
物理化学电子教案—绪论
上一内容 下一内容 回主目录
返回
2020/11/8
绪论
0.1 物理化学的目的和内容 0.2 物理化学的研究方法 0.3 物理化学的建立与发展 0.4 近代化学的发展趋势和特点 0.5 物理化学课程的学习方法
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案 ——第一章
第一章 热力学第一定律及其应用
1.9 赫斯定律 1.10 几种热效应 1.11 反应热与温度的关系——基尔霍夫定律 1.12 绝热反应——非等温反应 *1.13 热力学第一定律的微观说明
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案——第二章
不可能把热从低温 物体传到高温物体, 而不引起其它变化
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案—第七章
电解
电能
电池
化学能
上一内容 下一内容 回主目录
返回
2020/11/8
第七章电解质溶液
主要内容
电化学的基本概念和法拉第定 律离子的电迁移和迁移数
电导 强电解质溶液理论简介
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案—第八章
返回
2020/11/8
物理化学电子教案—第九章
上一内容 下一内容 回主目录
返回
2020/11/8
第九章 电解与极化作用
9.1 分解电压 9.2 极化作用 9.3 电解时电极上的反应 9.4 金属的电化学腐蚀与防腐 9.5 化学电源
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案—第十章
UQW
上一内容 下一内容 回主目录
返回
2020/11/8
第一章 热力学第一定律及其应用
1.1 热力学概论 1.2 热力学第一定律 1.3 准静态过程与可逆过程 1.4 焓 1.5 热容 1.6 热力学第一定律对理想气体的应用
1.7 实际气体 1.8 热化学
上一内容 下一内容 回主目录
返回
2020/11/8
上一内容 下一内容 回主目录源自返回2020/11/8
物理化学电子教案—第五章
上一内容 下一内容 回主目录
返回
2020/11/8
第五章 相平衡
5.1 引言 5.2 多相体系平衡的一般条件 5.3 相律 5.4 单组分体系的相图 5.5 二组分体系的相图及其应用 5.6 三组分体系的相图及其应用 5.7 * 二级相变
上一内容 下一内容 回主目录
返回
2020/11/8
物理化学电子教案—第六章
上一内容 下一内容 回主目录
返回
2020/11/8
第六章 化学平衡
6.1 化学平衡的条件和反应的亲和势 6.2 化学反应的平衡常数和等温方程式 6.3 平衡常数与化学方程式的关系 6.4 复相化学平衡 6.5 平衡常数的测定和平衡转化率的计算 6.6 标准生成吉布斯自由能 6.7 用配分函数计算 rG m 和平衡常数 6.8 温度、压力及惰性气体对化学平衡的影响 6.9 同时平衡 6.10 反应的耦合 6.11 近似计算
积分法
微分法
半衰期法
孤立法
一级反应 对峙反应 平行反应 连续反应 链反应
上一内容 下一内容 回主目录
返回
2020/11/8
第十章 化学动力学基础(一)
10.1 化学动力学的任务和目的 10.2 化学反应速率表示法 10.3 化学反应的速率方程 10.4 具有简单级数的反应 10.5 几种典型的复杂反应 10.6 温度对反应速率的影响 10.7 活化能对反应速率的影响 10.8 链反应
