不对称PCR
各种PCR简介
原位PCR:PCR在组织或细胞样本片上直接进行,用原位杂交找到目的基因的表达位置。
递减PCR:每个循环降低1度退火温度,无需确定最佳退火温度即可反应。
菌落PCR:不用提取基因组DNA,不用酶切鉴定,直接对把菌体热解后暴露的DNA跑PCR简并PCR:用氨基酸序列设计带有简并性的引物库,可以发现新基因或基因家族、多重PCR:也就是把许多种引物放进去,一次增殖多种DNA(省资源)。
不对称PCR:两种引物含量不同(50或100:1),用于制作单链DNA(在前几轮循环中已把低浓度引物用完并搞出足够的模板链,之后便可以快速合成目标链)有色互补PCR(CCA-PCR):用不同荧光染料标记引物5'端,如果是靶基因那会出现两头荧光(正反链都符合各自引物故出现两种荧光,只有一头荧光不是靶序列)。
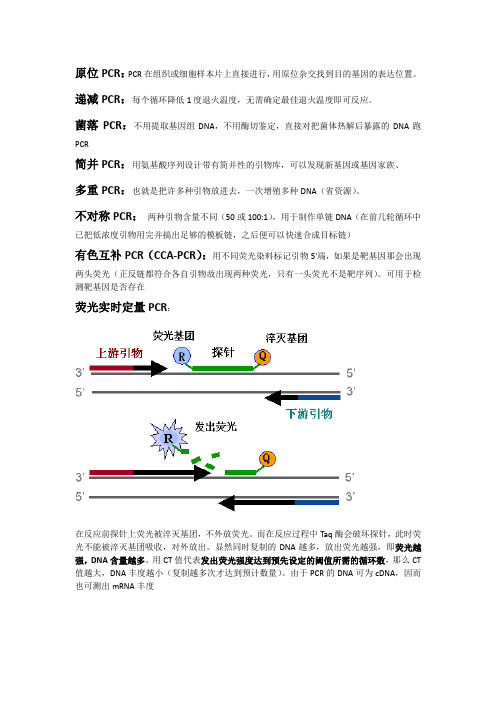
可用于检测靶基因是否存在荧光实时定量PCR:在反应前探针上荧光被淬灭基团,不外放荧光。
而在反应过程中Taq酶会破坏探针,此时荧光不能被淬灭基团吸收,对外放出。
显然同时复制的DNA越多,放出荧光越强,即荧光越强,DNA含量越多。
用CT值代表发出荧光强度达到预先设定的阈值所需的循环数,那么CT值越大,DNA丰度越小(复制越多次才达到预计数量)。
由于PCR的DNA可为cDNA,因而也可测出mRNA丰度热不对称交错PCR:为了用已知序列找未知序列。
基本原理为:1.用简并性引物在未知序列上创造位点。
2.用巢式PCR提高扩增产物特异性3.用2轮高温(特异性引物反应),1轮低温交替(非特异性引物反应)的超级PCR循环提高特异产物比例。
(即不对称PCR的部分)4.通过稀释来降低非特异性产物比例。
多重不对称扩增介绍

引物二聚体
包括引物间的二聚体以及引物自身所形成的发卡结 构,还有一类是第三方DNA介导的二聚体,这些二 聚体和非特异引物一样都会干扰引物与目标结合位 点的竞争,影响扩增效率。
针对不同对引物之间二聚体,目前可以采用Visual OMP6软件(7天试用版)进行验证。
不对称扩增对于低拷贝样本的 扩增较难,对于病原体检测需 要更详尽的PCR设计和优化。
可以获得大量SSDNA,快 速进行下游操作。比如直接 进行测序,或者下游杂交检 测无需经过变性这一步骤。
03
05
缺点
不对称PCR设计
设计不对称PCR引物时,限制性引物的Tm值较非 限制性引物Tm值高4~6°,扩增效果更佳。
不对称PCR设计在于控制限制性引物(低浓度引 物)的绝对量,限制性引物过多或过少,均不利 于SSDNA的制备。限制性引物量可以考虑设置在 之间。
设置限制性引物量后,再通过实验验证限制性引 物浓度和非限制性引物浓度的比例,目前常用比 例1:3、1:5、1:10、1:15、1:20进行优化,一 般情况下,1:10、1:20比例情况下效果可能更佳。
02
导致不平衡的原因: 1. 引物特异性; 2、最佳退火温度不一致; 2. 引物二聚体;4、模板量不同;5、引物扩增效率
引物特异性
如果引物与体系中其他非目的基因片段结合能力更强,那么目的 基因结合引物的能力就会受到竞争,从而导致扩增效率下降。 严格blast验证
最佳退火温度不一致
将多对引物放置入一个体系中扩增,由于进行PCR反应的退 火温度相同,所以要求每一对引物的最佳退火温度接近。
Mpprimer (开放、在 线)——最多 一次可以设计 6对引物、基 于PP3内核。
30多种PCR技术简单描述

1、Allele-specific PCR:等位基因特异性PCR,设计引物时选择在基因组的多态性区域,使等位基因的突变定位在(或接近)引物的3'端,在严谨的反应条件下,存在错配碱基的引物不能起始复制,而只有完全匹配的引物才能起始复制,产生的产物因此显示不同的基因型。
2、Assembly PCR(也称作Polymerase Cycling Assembly或PCA):组装PCR通过使用多个具有短重叠区的长的寡核苷酸来合成长的DNA链的方法。
通过寡核苷酸产生一条条正向或反向DNA链,而寡核苷酸的重叠区则确定链组装的顺序,因此可有选择性的产生最终的长链DNA分子。
3、Asymmetric PCR:不对称PCR,可选择性的扩增出靶DNA的一条链,从而用于测序反应或制备单链杂交探针。
反应中限制一个引物的加入量,随着这一引物的用尽,后续的扩增中另一引物延伸的产物量大大过量。
这一技术的关键是使用的限制引物的量要合适,引物量过多,则产物主要是双链DNA;引物量过少,在前几轮循环就被耗尽,结果导致单链的产量减少。
在不对称PCR的基础上发展出Linear-After-The-Exponential-PCR (LATE-PCR,线性指数PCR),使数量限制的引物比过量的引物的解链温度更高,从而维持较高的反应效率。
4、Dial-out PCRA highly parallel method for retrieving accurate DNA molecules for gene synthesis.A complex library of DNA molecules is modified with unique flanking tags(标签)before massively parallel sequencing. Tag-directed primers (标签靶向的引物)then enable the retrieval of molecules with desired sequences by PCR.5、Helicase-dependent amplification(依赖解旋酶的扩增)Similar to traditional PCR, but uses a constant temperature(恒温) rather than cycling through denaturation (变性)and annealing/extension (退火/延伸)cycles. DNA helicase, (DNA解旋酶)an enzyme that unwinds (解旋)DNA, is used in place of thermal denaturation(热变性).6、Hot start PCR:热启动PCR,是提高PCR特异性和可信度的最好的方法之一。
pcr的分类及其原理

PCR的分类及其原理PCR的主要类型包括:(1)反向PCR;(2)不对称PCR;(3)RT-PCR;(4)重组PCR(PCR体外诱变技术);(5)简并引物PCR;(6)定量PCR;(7)多重PCR;(8)锚定PCR;(9)原位PCR;(10)差异显示PCR;(11)巢式PCR;(12)共享引物PCR。
原理:(1)反向PCR:用于未知DNA片段的扩增。
先用连接酶将片段连接成环状,根据已知序列的碱基序列设计3’引物和5’引物扩增未知序列;(2)不对称PCR:原理是两端引物的浓度相差50~100倍,经PCR扩增得到单链DNA。
在PCR前25个循环中,主要生成双链产物,低浓度引物耗尽时,高浓度引物介导的PCR反应可产生大量单链DNA;(3)RT-PCR:先将mRNA逆转录成cDNA,接着以cDNA为模板进行PCR扩增。
合成cDNA第一链时,常用多聚(dT)引物进行。
后面的PCR扩增与普通PCR相同;(4)重组PCR:利用寡核苷酸引物在碱基不完全互补配对的情况下亦能同模板DNA退火的能力,设计引物时,人为地造成碱基取代、缺失或插入,从而通过PCR反应将突变引入靶DNA区段;(5)简并引物PCR:引物在未知DNA片段确切核苷酸序列的情况下,设计简并引物,从基因组(或cDNA)中把未知基因扩增出来;(6)定量PCR:以mRNA为模板合成cDNA后,再在同一反应管内同时加入参照基因和待测基因。
参照引物和待测基因引物进行PCR扩增,以参照基因扩增产物为基础,确定待测基因的相对量;(7)多重PCR:同一体系中加入多对引物,扩增同一模板的几个区域;(8)锚定PCR:通过DNA末端转移酶在cDNA 3’末端加上poly(dG)尾,设计相对应的锚定引物poly(dG),在锚定引物和基因特异引物作用下,扩增全序列的DNA片段;(9)原位PCR:以组织固定处理细胞内的核酸作为靶序列,进行PCR反应。
不必从组织细胞中分离模板DNA或RNA;(10)差异显示PCR:将两种mRNA的样品逆转录成cDNA第一链,后加入两种引物进行PCR扩增,一种为锚定引物,另一种为十碱基的随机引物。
PCR技术的原理与应用

多重PCR的用途主要有两方面:
1.多种病原微生物的同时检测或鉴定,它是在同一PCR反应 管中同时加上多种病原微生物的特异性引物,进行PCR扩增。 可用于同时检测多种病原体或鉴定出是那一型病原体感染。
2.病原微生物,某些遗传病及癌基因的分型鉴定:某些病原 微生物,某些遗传病或癌基因,型别较多,或突变或缺失 存在多个突变部位,多重PCR可提高其检出率并同时鉴定其 型别及突变等。
dNTP的质量与浓度:注意4种dNTP的浓度要相等(等摩尔配 制)。如其中任何一种浓度不同于其它几种时,就会引起错 配;浓度过低又会降低PCR产物的产量。dNTP能与Mg2+结 合,使游离的Mg2+浓度降低。
模板:模板核酸的量与纯化程度,是PCR成败与否的关键 环节之一。传统的DNA纯化方法通常采用SDS和蛋白酶K 来消化处理标本。SDS的主要功能是: 溶解细胞膜上的 脂类与蛋白质,因而溶解膜蛋白而破坏细胞膜,并解离 细胞中的核蛋白,SDS 还能与蛋白质结合而沉淀; 蛋白 酶K能水解消化蛋白质,特别是与DNA结合的组蛋白,再 用有机溶剂酚与氯仿抽提掉蛋白质和其它细胞组份,用
多重PCR的特点有:
①高效性,在同一PCR反应管内同时检出多种病原微生物,或 对有多个型别的目的基因进行分型,特别是用一滴血就可检 测多种病原体;
②系统性,多重PCR很适宜于成组病原体的检测,如肝炎病毒, 肠道致病性细菌,性病,无芽胞厌氧菌,战伤感染细菌及细 菌战剂的同时侦检;
③经济简便性,多种病原体在同一反应管内同时检出,将大 大的节省时间,节省试剂,节约经费开支,为临床提供更多 更准确的诊断信息。
锚定PCR原理示意图
标记PCR和彩色PCR:
标记PCR(Labelled Primers,LP-PCR),LP-PCR是利用同位 素或荧光素对PCR引物的5‘端进行标记,用来检测靶基因 是否存在。彩色PCR(Color Complementation assay PCR, CCAPCR),是LP-PCR的一种。它用不同颜色的荧光染料标记 引物的5’端,因而扩增后的靶基因序列分别带有引物 5‘的染料,通过电泳或离心沉淀,肉眼就可根据不同荧光 的颜色判定靶序列是否存在及其扩增状况,此法可用来检 测基因的突变,染色体重排或转位,基因缺失及微生物的 型别鉴定等。
30多种PCR技术简单形貌

1、Allele-specific PCR:等位基因特异性PCR,设计引物时选择在基因组的多态性区域,使等位基因的突变定位在(或接近)引物的3'端,在严谨的反应条件下,存在错配碱基的引物不能起始复制,而只有完全匹配的引物才能起始复制,产生的产物因此显示不同的基因型。
2、Assembly PCR(也称作Polymerase Cycling Assembly或PCA):组装PCR通过使用多个具有短重叠区的长的寡核苷酸来合成长的DNA链的方法。
通过寡核苷酸产生一条条正向或反向DNA链,而寡核苷酸的重叠区则确定链组装的顺序,因此可有选择性的产生最终的长链DNA分子。
3、Asymmetric PCR:不对称PCR,可选择性的扩增出靶DNA的一条链,从而用于测序反应或制备单链杂交探针。
反应中限制一个引物的加入量,随着这一引物的用尽,后续的扩增中另一引物延伸的产物量大大过量。
这一技术的关键是使用的限制引物的量要合适,引物量过多,则产物主要是双链DNA;引物量过少,在前几轮循环就被耗尽,结果导致单链的产量减少。
在不对称PCR 的基础上发展出Linear-After-The-Exponential-PCR (LATE-PCR,线性指数PCR),使数量限制的引物比过量的引物的解链温度更高,从而维持较高的反应效率。
4、Dial-out PCRA highly parallel method for retrieving accurate DNA molecules for gene synthesis. A complex library of DNA molecules is modified with unique flanking tags(标签) before massively parallel sequencing. Tag-directed primers (标签靶向的引物)then enable the retrieval of molecules with desired sequences by PCR.5、Helicase-dependent amplification(依赖解旋酶的扩增)Similar to traditional PCR, but uses a constant temperature(恒温) rather than cycling through denaturation (变性)and annealing/extension (退火/延伸)cycles. DNA helicase, (DNA解旋酶)an enzyme that unwinds (解旋)DNA, is used in place of thermal denaturation(热变性).6、Hot start PCR:热启动PCR,是提高PCR特异性和可信度的最好的方法之一。
不对称pcr无扩增曲线

不对称pcr无扩增曲线PCR(聚合酶链反应)是一种常用的分子生物学技术,可以在试管中扩增DNA序列,并用于疾病检测、基因工程以及基因组学研究等领域。
PCR的成功与否往往可以通过扩增曲线来判断,正常情况下,PCR扩增曲线应呈对称形状,但有时也会出现不对称PCR扩增曲线的情况。
不对称PCR扩增曲线通常显示为峰形不对称,即扩增曲线左侧或右侧峰值较高。
引起不对称PCR扩增曲线的原因有多种可能,下面将针对几种常见情况进行解析。
首先,不正确的反应物比例可能导致PCR曲线不对称。
PCR反应通常需要DNA模板、引物和酶等多种反应物。
如果其中某种反应物的浓度过高或过低,就可能导致PCR曲线不对称。
因此,在进行PCR实验前,准确计算反应物的比例非常重要。
其次,PCR反应条件的调节也可能影响PCR扩增曲线的对称性。
PCR反应需要适当的温度和时间条件来使DNA在不同步骤中进行变性、退火和延伸等过程。
如果温度和时间条件不恰当,就可能导致PCR曲线不对称。
因此,在实验中,合理调节PCR反应条件非常重要。
还有,PCR反应的起始DNA模板浓度也可能是导致PCR曲线不对称的原因之一。
DNA模板浓度过高或过低都会对PCR反应产生负面影响。
如果DNA模板浓度过高,可能导致反应物快速耗尽,PCR扩增过程提前结束;而如果DNA模板浓度过低,可能导致PCR扩增效率低下,扩增产品数量不足。
因此,在PCR实验中,选择合适的起始DNA模板浓度非常重要。
此外,酶的质量和效能也可能影响PCR扩增曲线的对称性。
PCR反应需要一种特殊的热稳定聚合酶来完成DNA的扩增工作。
如果选用的酶质量不佳或者已经过期,可能导致PCR扩增效果不佳,从而出现PCR 曲线不对称的现象。
因此,在进行PCR实验前,务必选用高质量的酶制备试剂。
综上所述,不对称PCR扩增曲线产生的原因有很多,其中包括反应物比例不正确、PCR反应条件不恰当、DNA模板浓度不合适以及酶的质量和效能等问题。
PCR技术的原理及其应用

反向PCR原理示意图
反向PCR的不足:
①需要从许多酶中选择限制酶,或者说必须选择一种 合适的酶进行酶切才能得到合理大小的DNA片段。这 种选择不能在非酶切位点切断靶DNA;
多重PCR的特点有:
①高效性,在同一PCR反应管内同时检出多种病原微生物,或 对有多个型别的目的基因进行分型,特别是用一滴血就可检 测多种病原体;
②系统性,多重PCR很适宜于成组病原体的检测,如肝炎病毒, 肠道致病性细菌,性病,无芽胞厌氧菌,战伤感染细菌及细 菌战剂的同时侦检;
③经济简便性,多种病原体在同一反应管内同时检出,将大 大的节省时间,节省试剂,节约经费开支,为临床提供更多 更准确的诊断信息。
反向PCR :
反向PCR的目的在于扩增一段已知序列旁侧的DNA,也就 是说这一反应体系不是在一对引物之间而是在引物外侧合成 DNA ,用于研究与已知DNA区段相连接的未知染色体序列。 这时选择的引物虽然与核心DNA区两末端序列互补,但两引物 3’端是相互反向的。扩增前先用限制性内切酶酶切样品DNA, 然后用DNA连接酶连接成一个环状DNA分子,通过反向PCR扩增 引物的上游片段和下游片段。
引物:引物是PCR特异性反应的关键,PCR 产物的特异性取 决于引物与模板DNA互补的程度。理论上,只要知道任何一 段模板DNA序列,就能按其设计互补的寡核苷酸链做引物, 利用PCR就可将模板DNA在体外大量扩增。
酶浓度:催化PCR反应约需酶量1ul(总反应体系为100ul时), 浓度过高可引起非特异性扩增,浓度过低则合成产物量减少。
不对称PCR

5′末端引物与突变引物的不同配比 末端引物与突变引物的不同配比PCR 扩增产物 末端引物与突变引物的不同配比 (1.1∶2 ; 2.1∶1 ; 3.10∶1 ; 4.25∶1 ; 5.50∶1 ; 6.DNA 100 bp ladder
• 2 退火温度的优化 • 第2 轮PCR 反应时, 选取不同的退火温度, 使5′端超长引物
• 在第2 轮PCR 反应中, 从图3 的1~4 样可以看出: • • •
在较低的退火温度下(50 ℃) , 大小片段的副 产物都有充分的机会与模板配对而得以延伸, 从而 使非目标产物形成的机会增多, 反应的特异性降低。 但退火温度太高(接近Tm 值) 时非特异性不高, 目 标分子的引物不能充分配对, 也可以导致PCR 反 应特异性的下降。
2.不对称PCR的原理 2.不对称PCR的原理
• 采用不等量的一对引物产生大量单链DNA(ss采用不等量的一对引物产生大量单链DNA(ssDNA),这两种引物分别称为非限制引物和限制性引 DNA),这两种引物分别称为非限制引物和限制性引 物,其最佳比例一般为50:1~100:1,关键是限制 物,其最佳比例一般为50:1~100:1,关键是限制 性引物的绝对量。限制性引物太多或者太少都不 利于制备ss-DNA。也可以用普通PCR制备靶DNA 利于制备ss-DNA。也可以用普通PCR制备靶DNA 双链DNA,再以双链DNA为模板,只用其中一种 双链DNA,再以双链DNA为模板,只用其中一种 过量引物进行单引物PCR制备SSDNA. 过量引物进行单引物PCR制备SSDNA. 由于产生的ss DNA和ds-DNA分子量不同,可 由于产生的ss-DNA和ds-DNA分子量不同,可
• Wangh还开发了一系列的Elixirs试剂这些试剂以一 Wangh还开发了一系列的Elixirs试剂这些试剂以一
TAIL-PCR技术及其发展

T AIL-PCR技术及其发展摘要TAIL-PCR,即热不对称交错PCR,它是一种用来分离与已知序列邻近的未知DNA 序列的分子生物学技术。
该技术通过3个特异性引物分别与简并引物组合做连续PCR循环,用不同退火温度选择性地扩增目标片段,所获片段可直接用做探针标记和测序模板。
此使用技术有具有简便、特异、高效、快速和灵敏等特点,已被广泛应用于分子生物学研究领域。
本文将从TAIL-PCR 技术的基本原理、操作方法应用范围等方面进行综述,并介绍TAIL-PCR 技术的发展史及其存在的不足与前景。
关键词TAIL-PCR, 引物,基因21世纪是生命科学飞速发展的时代,随着我国加入WTO和与世界科技日益接轨,技术的竞争已日益曾现出其核心地位和作用[1]。
正是因为基因是遗传物质的基本功能单位,科学家们对它的研究已有100多年的历史,且分离、克隆目的基因是研究基因结构、揭示基因功能及其表达的基础,所以,某个功能基因克隆就成了生物工程和分子生物学研究的一个重点。
基因克隆中常用的方法都要依靠染色体步移技术,基于PCR 的染色体步移技术使微量的核酸(DNA或RNA)操作变得简单易行,同时还使核酸研究脱离于活体生物[2],所以得到广泛发展。
热不对称性PCR (thermal asymmetric interlacedPCR, TAIL-PCR) 就是立在PCR 技术基础上的染色体步移技术,为扩增已知序列旁侧的未知DNA片段提供了捷径[3]。
此技术是Liu 和Whitter 在1995 年首先研究报道的。
该技术有简便、特异、高效、快速和灵敏的特点,和分离出的DNA 序列可用于图位克隆、遗传图谱绘制及直接测序等优点,正是由于该技术的特点及优点,近年来,被分子生物研究者广泛应用。
本文主要从TAIL-PCR 技术的基本原理、操作方法、应用范围及其发展和目前存在的问题与前景进行综述。
1、TAIL-PCR 技术原理TAIL-PCR 是PCR的一种随机引物,随机引物PCR 是将一种特异性引物结合在已知基因区域,随机引物结合在已知区域旁侧的某一区域,从而引发包括已知区域在内的片段的扩增(Ichikawa et al., 1997)[4]。
PCR的各种应用模式

PCR的各种应用模式1. 兼并引物(degenerate primer)PCR密码子具有兼并性,单以氨基酸顺序推测编码的DNA序列是不精确的,但可以设计成对兼并引物,扩增所有编码已知顺序的核酸序列。
用兼并引物时寡核苷酸中核苷酸序列可以改变,但核苷酸的数量应相同。
兼并度越低,产物特异性越强,设计引物时应尽量选择兼并性小的氨基酸,并避免引物3’末端兼并,针对兼并的混合引物已成功地用于未知靶DNA的扩增、克隆和序列分析。
现已成功地克隆了猪尿酸氧化酶基因、糖尿病相关肽基因和哺乳动物与禽类的嗜肝病毒基因。
用脱氧肌苷(deoxyinosine;di)引物进行PCR,可以代替编码蛋白的多种兼并密码子中的兼并碱基,di的特异性主要受cDNA浓度影响。
2. 套式引物(nested primer)PCR用第一套引物扩增15~30个循环,再用扩增DNA段内设定的第二套引物扩增15~30个循环,这样可使待扩增序列得到高效扩增,而次级结构却很少扩增。
用起始引物限量方法或centricon30(amicon)分子滤过器离心,在第二套引物加入前去除第一引物。
此方法已成功地用来分析中国仓鼠卵巢细胞as52的分子突变。
as52细胞含有单拷贝的细胞gpt(guanine phos-phribosy transferase)基因,与哺乳动物具有同源性。
套式引物PCR减少了引物非特异性退火,从而增加了特异性扩增,提高了扩增效率。
对环境样品中微生物检测和单拷贝的基因靶DNA的扩增是非常有效的。
若将套式PCR的内外引物稍加改变,延长外引物长度(至25~30bp),同进缩短内引物长度(15~17bp),使外引物先在高温退火温度下做双温循环扩增,然后改换至三温循环,使内引物在外引物扩增的基础上作低温火温度的三温循环直到扩增完成,这样就可以使两套引物一次同时加入,两种循环一气呵成,等于只做一次PCR,而灵敏度与套式二次PCR无异。
套式一次PCR的成功,使PCR检测的全过程可以在5h内完成,使当天出检验报告成为现实,也使PCR检测走入临床有了现实的基础。
不对称pcr原理

不对称pcr原理不对称PCR是一种特殊的PCR方法,其特点在于它只需一种引物就能扩增目标序列。
相比于传统PCR方法,不对称PCR方法具有更高的特异性、更快的扩增速度和更高的扩增效率,因此它在分子生物学研究中得到了广泛的应用。
不对称PCR是基于PCR原理的,即利用DNA聚合酶扩增一条特定DNA序列。
PCR反应是一个循环反应,每个循环由三个步骤组成:变性、退火和扩增。
在变性阶段,高温会使DNA双链解开,并使得DNA链变为单链。
在退火阶段,反应体系中的引物会与单链DNA结合,形成“引物-模板”复合物。
在扩增阶段,DNA聚合酶会沿着模板链进行扩增,产生新的DNA链。
不对称PCR的引物是一种长度不一的寡核苷酸序列,其中一个引物含有较多的序列,称为大引物,另一个引物含有较少的序列,称为小引物。
由于小引物含有较少的序列,因此DNA链扩增过程中,其扩增速度会比大引物缓慢。
由于引物的不对称设计,扩增产物中的目标序列与引物末端之间可能存在单瓣结构或者缺口,这种特殊结构可以通过DNA聚合酶的3'->5'外切酶活性被剪断,形成单链DNA分子。
因此,不对称PCR方法不仅能够扩增目标序列,还可以产生一定量的单链DNA片段。
不对称PCR主要有两种方式:不对称扩增和延伸链反应(ECA)。
不对称扩增采用大量的大引物和少量的小引物,同时控制PCR反应的特定条件,使得小引物被优先引发,产生的扩增产物中含有大量的目标序列和一定量的单链DNA分子。
ECA则是通过添加限制酶将DNA线性化,然后在PCR反应体系中加入大量的大引物和少量的小引物,尝试使小引物优先结合DNA模板,然后在PCR循环中对其进行延伸,产生大量的目标序列和单链DNA片段。
不对称PCR的应用非常广泛,例如,可以用于单链DNA片段的产生和纯化;可以用于特异性扩增目标序列,以及在PCR反应体系中添加单链DNA片段,以探究特异性交互作用等。
另外,在一些特定的分子生物学实验中,不对称PCR方法还可以用于检测DNA修饰和突变等。
不对称pcr原理

不对称pcr原理PCR(聚合酶链反应)是一种利用DNA聚合酶酶活和DNA模板特异性扩增序列特定段落的方法,它在分子生物学研究中应用广泛。
PCR技术的不对称性原理是利用两个不同的引物,其中一个引物比另一个引物在浓度上高出许多,从而在反应过程中产生非对称的扩增产物。
这种不对称PCR技术可以应用于许多实验中,例如位点突变分析、基因组DNA遗传多态性筛查、DNA序列确定以及基因重组等。
PCR反应的基本步骤包括变性、退火和扩增。
变性步骤是将DNA模板加热至高温,使其两条DNA链分离为两个单链。
在下一个步骤中,引物被加入反应体系中的降温退火过程中与目标序列特异性结合。
引物在退火的低温下与目标序列结合,形成引物和DNA模板的复合物,然后在较高温下由DNA聚合酶酶活催化DNA链的合成。
通过反复循环这三个步骤,可以扩增特定的DNA序列。
而不对称PCR技术含有两个不同的引物,其中一个引物的浓度比另一个引物高,从而在反应过程中产生非对称的扩增产物。
不对称PCR技术的优势主要体现在以下几个方面。
首先,不对称PCR可以针对复杂的基因组DNA进行快速和特异性扩增。
由于引物的不对称性,特异性引物浓度较低,因此扩增产物的选择性较高,能够避免非特异性扩增产物的生成。
其次,不对称PCR反应体系的单条引物经济实惠,降低了运行PCR反应的成本。
此外,不对称PCR的设计简单,易于操作。
最后,不对称PCR反应具有较长的引物和较短的扩增产物,因此可以应用于不同的实验目的。
传统PCR技术的引物通常采用相同长度的引物,它们的浓度相等。
这样的PCR反应会产生两条长度相似的扩增产物,对于一些实验而言不利。
而不对称PCR技术通过使用两条长度不同、浓度不等的引物,可以产生不对称长度的扩增产物。
其中一个较长的引物在反应中限制了扩增产物的长度,而另一个较短的引物则可以辅助保持聚合酶在反应体系中的高效率活性,从而实现对目标序列的高特异性扩增。
不对称PCR技术的应用非常广泛。
PCR类型

PCR类型1、共享引物PCR(Shared primer PCR):用3条引物来扩增两种不同的DNA 序列,其中一条引物与两种DNA序列都互补,这条引物与另外两条引物分别组成两对PCR引物。
又称引物竞争法PCR。
2、多重PCR:在一个反应体系中使用一对以上引物的PCR称为多重PCR。
其结果是产生多个PCR产物,用于检测特定基因序列的存在或缺失。
3、不对称PCR(Asymmetric PCR)在PCR中加入的上、下游引物量不同,一般为100:1,在前10~15个循环中产物为双链,当低浓度引物消耗尽后,高浓度引物介导的PCR就会产生大量单链DNA。
用于产生大量单链DNA可用于测序。
4、锚定PCR(Anchored PCR):以mRNA为模板,用oligo(dT)或与mRNA互补的寡核苷酸作引物,在cDNA3`端加上polydG作锚位,用poly(dc)作锚引物,进行PCR扩增。
可用于仅知一端顺序,另一端未知,或多变的DNA扩增。
5、反向PCR:是用反向的互补引物来扩增两引物以外的DNA片段,对某个已知DNA片段两侧的未知序列进行扩增。
可对未知序列扩增后进行分析,如探索邻接已知DNA片段的序列;用于仅知部分序列的全长cDNA的克隆,扩增基因文库的插入DNA;建立基因组步移文库。
6、彩色PCR(color PCR ):用不同的荧光物质标记PCR引物的5’端,扩增产物可发出不同的荧光。
7、原位PCR:原位聚合酶链式反应(In Still PCR,Is-PCR)是由Haase等于1990年首创。
它是利用完整的细胞作为一个微小的反应体系来扩增细胞内的目的片段,在不破坏细胞的前提下,利用一些特定的检测手段来检测细胞内的扩增产物。
8、定量PCR(quantitative PCR):以外参或内参为标准,通过对PCR终产物的分析或PCR过程的监测,对PCR起始模板量的定量。
基本原理:将目的基因和一个单拷贝的参照基因置同一试管→PCR →电泳得两条区带→比较两区带的丰度或引物标上标记物→检测放射性或荧光强度。
热不对称性pcR

热不对称交错PCR(TAIl-PCR)热不对称性PCR (thermal asymmetric interlaced PCR, TAIL-PCR)就是建立在PCR技术基础上的染色体步移技术,为扩增已知序列旁侧的未知DNA 片段提供了捷径。
该技术由Liu和Whitter于1995年首先研究并报道[22]。
以基因组DNA为模板,使用高退火温度的长特异引物和短的低退火温度的简并引物,通过特殊的热不对称(高严谨性PCR和低严谨性PCR 交替)循环程序,有效扩增特异产物。
该技术具有简单快速、特异性高、分离出的DNA 序列可以用于图位克隆、遗传图谱绘制和直接测序等优点,近年来,被分子生物学研究者广泛应用,成为分子生物学研究中非常实用的基因侧翼序列克隆技术[23,24],同时在植物基因克隆方面也取得了很大进展[25]。
TAIL-PCR技术的基本原理是利用目标序列旁的已知序列设计3个嵌套的特异性引物(special prime ,简称sp1 ,sp2 ,sp3 ,约20 bp) ,用它们分别和1个具有低Tm值的短的(14 bp) 随机简并引物(Arbitrary degenerate prime 简称AD)相组合,以基因组DNA作为模板,根据引物的长短和特异性的差异设计不对称的温度循环,通过分级反应来扩增特异引物。
TAIL-PCR包括3轮PCR反应。
第1轮PCR反应包括5次高严谨性反应、1次低严谨性反应、10次较低严谨性反应和12次热不对称的超级循环。
首先5次高严谨性的反应,使长的高退火温度的特异引物SPl与已知的序列退火并延伸,目标序列扩增成直线性型上升,由AD引物结合产生的非特异性产物的浓度则较低。
而后进行1次低退火温度的反应,目的是使简并引物结合到较多的目标序列上,接下来10次较低严谨性的反应可以使两种引物均能与模板退火,从而使原来由高严谨性循环所产生的单链靶DNA复制成双链DNA,为下一轮线性扩增模板做准备。
不对称PCR的引物浓度优化及在柑橘基因型分析上的应用

魏召新,朱世平,阳佳位,等.不对称PCR的引物浓度优化及在柑橘基因型分析上的应用[J ].江苏农业科学,2016,44(11):46-48.doi :10.15889/j.issn.1002-1302.2016.11.013不对称PCR的引物浓度优化及在柑橘基因型分析上的应用魏召新1,2,朱世平1,阳佳位1,闫树堂1,洪林2(1.中国农业科学院柑橘研究所,重庆402260;2.重庆市农业科学院果树研究所,重庆402260)摘要:对柑橘不对称PCR的引物比例浓度进行优化筛选,并以不同柑橘品种的基因组片段为模板验证不对称PCR在柑橘品种基因型分析中的可行性。
结果表明,不对称PCR双侧的引物最佳浓度因引物不同而不同,当浓度为10ʒ1时均能达到理想效果,可见不对称PCR可以用于柑橘基因型分析。
关键词:不对称PCR;单链构象多态性;柑橘;引物浓度比;基因型分析中图分类号:S666.201文献标志码:A文章编号:1002-1302(2016)11-0046-02收稿日期:2015-08-31基金项目:国家自然科学基金(编号:30971992);重庆市科学技术委员会基本科研项目(编号:cstsjbky00510)。
作者简介:魏召新(1979—),男,河南商丘人,硕士,助理研究员,主要从事柑橘分子生物学研究。
E -mail :350971781@qq.com 。
通信作者:洪林,硕士,助理研究员,主要从事果树栽培与遗传育种工作。
E -mail :loquatvalue@163.com 。
不对称PCR利用不等量的一对引物进行PCR扩增,产生单链产物(ssDNA ),这对引物分别称为非限制性引物与限制性引物。
在PCR反应的最初10 15个循环中,其扩增产物主要是双链DNA (dsDNA ),但当限制性引物消耗完后,非限制性引物引导的PCR就会产生大量的单链产物。
不对称PCR作为一个基础试验技术,方法简单、成本低廉、用途广泛,用于制备单链模板以用于双脱氧测序[1],用于cDNA 扩增以研究真核生物的DNA 外显子[2],用于单链探针制备[3],还可与酶联免疫法结合检测柑橘CTV 病毒[4],甚至结合毛细管电泳技术对人进行疾病诊断[5]。
不对称PCR

不对称PCR不对称PCR(asymmetric PCR)是用不等量的一对引物,PCR扩增后产生大量的单链DNA(SSDNA).这对引物分别称为非限制引物与限制性引物,其比例一般为50~100∶1.在PCR反应的最初10~15个循环中,其扩增产物主要是双链DNA,但当限制性引物(低浓度引物)消耗完后,非限制性引物(高浓度引物)引导的PCR就会产生大量的单链DNA.不对称PCR的关键是控制限制性引物的绝对量,需多次摸索优化两条引物的比例.还有一种方法是先用等浓度的引物PCR扩增,制备双键DNA,(dsDNA),然后以此dsDNA为模板,再以其中的一条引物进行第二次PCR,制备ssDNA.不对称PCR制备的ssDNA,主要用于核酸序列测定. 不对称PCR(Asymmetric PCR)的基本原理是采用不等量的一对引物产生大量的单链DNA(ss-DNA)。
这两种引物分别称为限制性引物与非限制性引物;其最佳比例一般为1:50~1:100,关键是限制引物的绝对量。
限制性引物太多太少,均不利于制备ss-DNA。
也可用普通PCR制备靶DNA双链DNA (ds-DNA),再以ds-DNA为模板,只用其中一种过量引物进行单引物PCR制备ss-DNA。
产生的ds-DNA与ss-DNA由于分子量不同可以在电泳中分开,而得到纯ss-DNA。
不对称PCR主要为测序制备ss-DNA,尤为用c-DNA
经不对称PCR进行DNA序列分析是研究真核DNA外显子的好方法。
热不对称交错PCR(TAIL-PCR)

热不对称交错PCR(TAIL-PCR)热不对称交错PCR(Thermal Asymmetric Interlaced PCR,Tail-PCR技术)Sep 04, 2007No Comments在分子生物学研究中,基因克隆和分子杂交的探针制备等操作常需分离与已知DNA序列邻近的未知序列。
虽然人们很早就采用随机引物的PCR,但由于无法有效地控制随机引物引发的非特异产物的产生,所以一直未能广泛应用。
近年有华南农业大学刘耀光教授设计的TAIL-PCR,又叫热不对称交错PCR,能够较好地解决上述难题。
该技术通过3个嵌套的特异性引物(specialprimer,简称sp1,sp2,sp3,约20bp)分别和一个低Tm值的简并引物(Arbitrarydegenerate prime,AD,约14bp))组合进行连续的PCR循环,利用不同的退火温度选择性地扩增目标片段,所获得的片段可以直接用做探针标记和测序模板。
在利用特异引物和随机引物进行PCR中一般有3种产物生成:①由特异性引物和简并引物扩增出的产物;②由同一特异性引物扩增出的产物;③由同一简并引物扩增出的产物。
在TAIL-PCR反应中,其中后2种目标产物可以通过以嵌套的特异性引物进行的后续反应来消除。
TAIL-PCR技术简单易行,反应高效灵敏,产物的特异性高,重复性好,能够在较短的时间内获得目标片段,已经成为分子生物学研究中的一种实用技术。
经改良过的TAIL-PCR成功地从突变体中克隆到外源插入基因的旁侧序列,从而为启动子的克隆提供了有效的新方法。
第一次反应包括5次高特异性、1次低特异、10次较低特异性反应和12个热不对称的超级循环。
5次高特异性反应,使sp1与已知的序列退火并延伸,增加了目标序列的浓度;1次低特异性的反应使简并引物结合到较多的目标序列上;10次较低特异性反应使2种引物均与模板退火,随后进行12次超级循环。
经上述反应得到了不同浓度的3种类型产物:特异性产物①型和非特异性产物(②型和③型)。
热不对称性pcR

热不对称交错PCR(TAIl-PCR)热不对称性PCR (thermal asymmetric interlaced PCR, TAIL-PCR)就是建立在PCR技术基础上的染色体步移技术,为扩增已知序列旁侧的未知DNA 片段提供了捷径。
该技术由Liu和Whitter于1995年首先研究并报道[22]。
以基因组DNA为模板,使用高退火温度的长特异引物和短的低退火温度的简并引物,通过特殊的热不对称(高严谨性PCR和低严谨性PCR 交替)循环程序,有效扩增特异产物。
该技术具有简单快速、特异性高、分离出的DNA 序列可以用于图位克隆、遗传图谱绘制和直接测序等优点,近年来,被分子生物学研究者广泛应用,成为分子生物学研究中非常实用的基因侧翼序列克隆技术[23,24],同时在植物基因克隆方面也取得了很大进展[25]。
TAIL-PCR技术的基本原理是利用目标序列旁的已知序列设计3个嵌套的特异性引物(special prime ,简称sp1 ,sp2 ,sp3 ,约20 bp) ,用它们分别和1个具有低Tm值的短的(14 bp) 随机简并引物(Arbitrary degenerate prime 简称AD)相组合,以基因组DNA作为模板,根据引物的长短和特异性的差异设计不对称的温度循环,通过分级反应来扩增特异引物。
TAIL-PCR包括3轮PCR反应。
第1轮PCR反应包括5次高严谨性反应、1次低严谨性反应、10次较低严谨性反应和12次热不对称的超级循环。
首先5次高严谨性的反应,使长的高退火温度的特异引物SPl与已知的序列退火并延伸,目标序列扩增成直线性型上升,由AD引物结合产生的非特异性产物的浓度则较低。
而后进行1次低退火温度的反应,目的是使简并引物结合到较多的目标序列上,接下来10次较低严谨性的反应可以使两种引物均能与模板退火,从而使原来由高严谨性循环所产生的单链靶DNA复制成双链DNA,为下一轮线性扩增模板做准备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不对称PCR不对称PCR(asymmetric PCR)是用不等量的一对引物,PCR扩增后产生大量的单链DNA(SSDNA).这对引物分别称为非限制引物与限制性引物,其比例一般为50~100∶1.在PCR反应的最初10~15个循环中,其扩增产物主要是双链DNA,但当限制性引物(低浓度引物)消耗完后,非限制性引物(高浓度引物)引导的PCR就会产生大量的单链DNA.不对称PCR的关键是控制限制性引物的绝对量,需多次摸索优化两条引物的比例.还有一种方法是先用等浓度的引物PCR扩增,制备双键DNA,(dsDNA),然后以此dsDNA为模板,再以其中的一条引物进行第二次PCR,制备ssDNA.不对称PCR制备的ssDNA,主要用于核酸序列测定. 不对称PCR(Asymmetric PCR)的基本原理是采用不等量的一对引物产生大量的单链DNA(ss-DNA)。
这两种引物分别称为限制性引物与非限制性引物;其最佳比例一般为1:50~1:100,关键是限制引物的绝对量。
限制性引物太多太少,均不利于制备ss-DNA。
也可用普通PCR制备靶DNA双链DNA (ds-DNA),再以ds-DNA为模板,只用其中一种过量引物进行单引物PCR制备ss-DNA。
产生的ds-DNA与ss-DNA由于分子量不同可以在电泳中分开,而得到纯ss-DNA。
不对称PCR主要为测序制备ss-DNA,尤为用c-DNA
经不对称PCR进行DNA序列分析是研究真核DNA外显子的好方法。
