化学反应工程第二章
化学反应工程-第2章

移项并积分得:
dCA kCA a CB b dt
CA 0
kt
dCA CA mCBn
CA
这时假设a,b分别为m, n ,则以时间t为横 坐标,以积分项 C
A0
CA
dC A m n C A CB
为纵坐标,当以具体数据代入时,作图就可 以得到斜率为k的直线。如果得到直线,则表明此 动力学方程是适合于所研究的反应的。若得到曲 线,则表明此动力学应被排除,应该重新假设a, b的值而加以检验。
即:
ln
C Ae
C A0 C Ae C A C Ae
1 k1 1 t K
代入2-20式得:
将实验测得的CA-t数据,按照上式 C
ln
C A0
A
C Ae C Ae
与t作图可以得一条直线,斜率为k1+k2, 又因为k1/k2可知,因此可以求出 k1,k2 值。
2.2 等温恒容过程 ⑵ 反应转化率
第二章 均相反应动力学基础
反应物A的转化率可以用下式定义
反应物A的转化量 n A 0 n A xA = A的起始量 n A0
注意: ① 转化率恒为正。 ② 反应物一般指关键反应物(限制反应物、着眼反应物), 其是以最小化学计量量存在的反应物。 ③ 根据nA0的选择不同,有单程转化率(以反应器进口物料 为基准,如氨合成过程的合成塔进口循环气。)和总转化率 (以过程进口物料为基准,如氨合成过程的新鲜气。)。
如果cA0远远小于cB0,cB在全部反应时间里近似 于不变,则二级反应可以作为拟一级反应处理。
适用范围:
利用积分法求取动力学方程式的过程, 实际上是个试差的过程,它一般在反应级 数是简单整数时使用。当级数为分数时, 试差就比较困难,这时应该用微分法。 其他不可逆反应动力学方程式的 积分式见书上表2-4.
化学反应工程第二章习题答案

化学反应工程第二章习题答案化工103班2-1银催化剂上进行甲醇氧化为甲醛的反应2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O进入反应器的原料中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇转化率达72%,甲醛的收率为69.2%,试计算:(1)反应的总选择性;(2)反应器出口组成。
解:根据甲醇:空气:水蒸气=2:4:1.3(摩尔比),以100mol进料为基准设χy分别为HCOH和co2生成量2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O对上式积分(n1)kct1cn1kcAcn1AOn111cn1n1AcA①0①式为无量纲对数形式可判别出kc的单位molm3n1kt111同理pn1pn1n1kn11ApAp的单位pa02-4在间歇反应器中进行等温二级、一级、零级均相反应,求出转化率由0变为0.9所需的时间,与转化率由0.9变为0.99所需时间之比。
解:等温二级反应111kt1ckt21AcA0cA2cA某A0.9某A0.999t190A0kcA0t1:t21:10等温一级反应ktlncA0cAln10同上解得t1t2kt1:t21:1等温零级反应ktcA0cA同上解得t10.9cA0A0kt20.09ck10:12-5某一反应在间歇反应器中进行,经8min后反应物转化了80%,经过18min后转化了90%,求表达此反应的动力学方程。
解dnrAAVdt积分后:tcA0dcArACcA0dcAcAcAn111n1n1AkcAkn1cA0cAt8min某A180%t18min某A290%28111kn1cn1cn1n1A0A01某A11811kn1cn11n1n1A0cA01某A2n2r2AkcA2-6某一气相一级反应A2RS,在恒温、恒压的实验反应器中进行,原料含75%A及25%惰性气体(摩尔比),经8min后其体积增加一倍。
求此时的转化率及该反应在此温度下的速率常数。
化学反应工程第二章

1 1 - xA kt
=
nA0
CA nA
CA C A0
=1 - x A
ln
ln
1 1 - xA
斜率﹦k 或
ln
C A0 CA
t
二级不可逆反应 A﹢B→产物
若 CA0﹦CB0
CA
( rA ) kC A
2
dC A dt
kC A C B
dC A dt
1 CA
dC A CA
2.13 93 k 5.02 86.8 k 0.0181 0.0309 1 2.13 K 1 5.02 K B B
2
2
2
9.58 89.3 k 6.46 86.3 k 0.0408 0.0338 1 9.58 K 1 6.46 K B B 3.3 92.2 k 0.0263 1 3.3 K B
第2章 均相反应动力学基础
2.1 概述
均相反应 均相反应是指参予反应的各物质均 处同一个相内进行的化学反应。
烃类的高温裂解为气相均相反应,酸碱中 和、酯化反应为典型的液相均相反应。
2.1.1化学反应速率及其表示
化学反应速率 :单位时间、单位反应体积、组分A 的摩尔数变化量称为A组分的反应速率。 例 反应物
1 xA C A0 1 xA
斜率﹦k 或
1 CA
1 C A0
t
若 CA0≠CB0 ,设β﹦ CB0 /CA0
dC A dt
kC A C B
CA
化学反应工程第二章题解

s 习 题2-1、 银催化剂上进行甲醇氧化为甲醛的反应3223222222232 4CH OH O HCHO H O CH OH O CO H O+?+?进入反应器的原料中,甲醇:空气:水蒸汽=2:4:1.3(摩尔比),反应后甲醇转化率达72%,甲醛的收率为69.2%,试计算: (1)反应的选择率; (2)反应气体出口组成。
解:(1)由Y S x =⋅得: 06920961072Y .S .x .=== (2) 以进口气体含甲醇2mol 、含空气4mol 、含水蒸汽1.3mol 为计算基准。
参加反应的甲醇的量:2×0.72=1.44(mol )出口气体含甲醇:2-1.44=0.56(mol )主反应消耗的甲醇:1.44×0.961=1.38384(mol ) 主反应消耗的氧气:1.38384/2=0.69192(mol ) 主反应生成的甲醛:1.38384(mol ) 主反应生成的水: 1.38384(mol )副反应消耗的甲醇:1.44×0.039=0.05616(mol ) 副反应消耗的氧气:0.05616×1.5=0.08424(mol ) 副反应生成的二氧化碳:0.05616(mol ) 副反应生成的水份:0.05616×2=0.11232(mol )因此,反应气体出口组成如下: 甲醇:0.56(mol ) 甲醛:1.38384(mol )氧气:4×0.21-0.69192-0.08424=0.06384(mol ) 氮气:4×0.79=3.16(mol ) 二氧化碳:0.05616(mol )水蒸汽:1.3+1.38384+0.11232=2.79616(mol )折算成摩尔百分比,出口气体含甲醇、甲醛、氧气、氮气、二氧化碳、水蒸汽的分率分别为:7.0%、 17.3%、0.8%、 39.4%、0.7%、34.9%2-2 、试推导 n 级不可逆反应的反应速率常数 C p k k 和的量纲。
化学反应工程__第2章_理想反应器讲解

平推流反应器(活塞流、理想置换反应器) Plug Flow Reactor(PFR)(无返混)
2020年8月15日星期六
返 混:不同停留时间的粒子间的混合 平推流:反应物料以相同的流速和一致的方向进行移动,
所有的物料在器内具有相同的停留时间。
2020年8月15日星期六
第一节 间歇反应器
1 物料衡算 2 热量衡算 3 反应容积的计算 4 间歇反应器的最优操作时间
例题2- 1
用间歇反应器进行乙酸和乙醇的酯化反应,每天生
产乙酸乙酯12000kg,其化学反应式为:
k1
CH3COOH C2H5OH
CH3COOC2H5 H2O
k2
原料中反应组分的质量比为A:B:S=1:2:1.35, 反应液的
密度为1020kg/m3, 并假定在反应过程中不变,每批装
料,卸料及清洗等辅助操作时间为1h,反应在100℃
Kg/m3);
△Hr----反应焓变(KJ/Kmol);
Tm----冷却(或加热)介质的温度(K)
对于恒容过程:
dT dt
dxA dt
UA CvV
(Tm
T)
(操作方程)
式中: ( H r )C A0 (物理意义:最大温升) Cv
对于恒容变温操作的间歇反应器的设计计算,就是联立设计方 程、操作方程及动力学方程式求解的过程。
11 ln
k 1 xA
VRv(tt0)v( 1 kln
1 1 xA
t0)
Return
◇2热量衡算
变温操作(绝热操作和变温(非等温非绝热))
要求反应时间,需要对反应器进行热量衡算。 由于间歇反应器任何瞬间都具有相同的温度,可就整个反 应器进行热量衡算:
化学反应工程第二章均相反应动力学基础

A
A+P
P
P+P
(2-8)
(2-9)
2.1.3 反应的转化率、选择性和收率
⑴转化率 转化率一般用关键组分来表示。所谓关键组分必须是反 应物,生产上选择的关键组分一般是反应物料中的主要
组分,即价值较高且不应是过量的,因此转化率的高低,
会一定程度上反映过程的经济效果,对反应过程的评价 提供直观的信息。
2.1.3 反应的转化率、选择性和收率
对于选择率一般有平均选择率和瞬时选择率之分,以平 行反应(2-5)、(2-6)为例,
两种选择率的定义为: 平均选择率 瞬时选择率 (2-2)
2.1.3 反应的转化率、选择性和收率
⑶收率Y 收率的定义为:
Y 生成目的产物所消耗的 A摩尔数 A的起始摩尔数
(2-3)
COCl2
3 2 2 CO CO Cl 2
(2-12)
该反应的速率方程为:
(rCO ) k c c
(2-18)
则对于氯气的反应级数是分数。
2.1.5 反应动力学方程
⑵反应速率常数kA 由式(2-13)知,当A、B组分的浓度等于1
(rA )k A ,说明kA就是浓度为1时的速率。 时,
温度是影响反应速率的主要因素,随着温度的升高速
三级反应常见。例如下面的气相反应(2-11):
2NO+O2 动力学速率方程为:
2 (rNO ) k NO cNO cO2
2NO2
(2-11)
(2-17)
2.1.5 反应动力学方程
级数在一定温度范围内保持不变,它的绝对值不会超过3, 但可以是分数,也可以是负数。例如下面的光气合成反 应:
CO+Cl2
生产上还经常遇到循环反应器,如合成氨或合成甲醇的 合成塔等,由于化学平衡或其他原因的限制,原料一次 通过反应器后,转化率一般很低,需要把出口的反应混
化学反应工程-第二章 复合反应与反应器选型

16
2.1.4 循环反应器
在工业生产上,有时为了控制反应物的合适浓度, 以便于控制温度、转化率和收率,或为了提高原 料的利用率,常常采用部分物料循环的操作方法, 如图所示。
17
循环反应器的基本假设: ①反应器内为理想活塞流流动; ②管线内不发生化学反应; ③整个体系处于定常态操作。
第二章
复合反应与反应器选型
1
2.2.1 单一不可逆反应过程平推流反应器 与全混流反应器的比较
图2-1 不同反应器中浓度、转化率、反应速率的变化图 2
对于平推流反应器,在恒温下进行,其
设计式为:
P
1
k
cn 1 A0
n
xA 0
1
1
A xA xA
dxA
对于全混流反应器,在恒温下进行,其
设计式为:
m
xA
图2-5 多釜串联反应器的空间时间
11
计算出口浓度或转化率
对于一级反应:
1
cA0 cA1 kcA1
2
cA1 cA2 kcA2
cA1
cA0
1 k1
cA2
cA1
1 k 2
cA0
1 k11 k 2
依此类推:
cAN N cA0
1 ki
i 1
12
如果各釜体积相同,即停留时间相同,则:
cAN
VR1 :VR2 V01 :V02
是应当遵循的条件
6
(2)全混流反应器的并联操作 多个全混流反应器并联操作时,达到相同 转化率使反应器体积最小,与平推流并联 操作同样道理,必须满足的条件相同。
7
(1)平推流反应器的串联操作 考虑N个平推流反应器的串联操作,
化学反应工程第二章解析

第二章 均相反应动力学基础均相反应 均相反应是指参予反应的各物质均处同一个相内进行化学反应。
在一个相中的反应物料是以分子尺度混合的,要求:①必须是均相体系 (微观条件) ②强烈的混合手段 (宏观条件) ③反应速率远小于分子扩散速度一、计量方程反应物计量系数为负,生成物计量系数为正。
计量方程表示物质量之间关系,与实际反应历程无关; 计量系数只有一个公因子;用一个计量方程表示物质量之间关系的体系称为单一反应,反之称为复合反应。
二、化学反应速率单位时间、单位反应容积内组分的物质的量(摩尔数)的变化称之为该组分的反应速率。
反应物:生成物:对于反应三、化学反应速率方程r 是反应物系的组成、温度和压力的函数。
32223NH H N =+032223=--N H NH A A Adn r Vd d t C dt=-=-R R Rdn r Vdt dC dt==A B S R A B S Rαααα+=+SABRABSRr r r r αααα===AA AB r [k (T)][f(C ,C ,)]=有两类;双曲函数型和幂函数型。
k -化学反应速率常数; a(b)-反应级数。
(1)反应级数(i) 反应级数与反应机理无直接的关系,也不等于各组份的计量系数; (ii) 反应级数表明反应速率对各组分浓度的敏感程度;(iii) 反应级数是由实验获得的经验值,只能在获得其值的实验条件范围内加以应用。
(2)反应速率常数k[k]: s -1·(mol/m 3)1-nE :是活化能,把反应分子“激发”到可进行反应的“活化状态”时所需的能量。
E 愈大,通常所需的反应温度亦愈高,反应速率对温度就愈敏感。
k 0 —指前因子,其单位与 反应速率常数相同;E— 化学反应的活化能,J/mol ; R — 气体常数,8.314J/(mol .K)。
a b A A B r kC C=2220.512H Br HBrHBrBr k c c r c k c =+0exp[]E k k RT=-01ln ln E k k R T=-⨯ln klnk 0 slop=-E/R1/T⏹ 反应速率的温度函数关系● 活化能越高,斜率越大,该反应对温度越敏感; ● 对于一定反应,低温时反应速率对温度变化更敏感。
均相反应的动力学基础

均相反应的动力学基础化学反应工程第二章均相反应动力学基础1§2.1基本概念和术语若参于反应的各物质均处同一个相内进行化学反应则称为均相反应。
均相反应动力学:研究各种因素如温度、催化剂、反应物组成和压力等对反应速率、反应产物分布的影响,并确定表达这些影响因素与反应速率之间定量关系的速率方程。
§2.1.1化学计量方程化学计量方程:表示各反应物、生成物在反应过程中量的变化关系的方程。
一个由S个组分参予的反应体系,其计量方程可写成:Si1iAi0式中:Ai表示i组分,i为i组分的计量系数。
通常反应物的计量系数为负数,反应产物的计量系数为正值。
注意:1.计量方程本身与反应的实际历程无关,仅表示由于反应引起的各个参予反应的物质之间量的变化关系。
2.规定在计量方程的计量系数之间不应含有除1以外的任何公因子。
这是为了消除计量系数在数值上的不确定性。
单一反应:只用一个计量方程即可唯一给出各反应组分之间量的变化关系的反应体系。
复杂反应:必须用两个或多个计量方程方能确定各反应组分之间量的变化关系的反应体系例如,合成氨反应的计量方程通常写成:N23H写成一般化的形式为:N23H而错误的形式有:2N26H2222NH32NH304NH30§2.1.2反应程度和转化率反应程度是各组分在反应前后的摩尔数变化与其计量系数的比值,用符化学反应工程第二章均相反应动力学基础2号ξ来表示,即:n1n10nini0nknk01ik或写成:nini0ii1.不论哪一个组分,其反应程度均是一致的,且恒为正值。
2.如果在一个反应体系中同时进行数个反应,各个反应各自有自己的反应程度,则任一反应组分i的反应量应等于各个反应所作贡献的代数和,即:Mnini0j1ijj其中:M为化学反应数,ij为第j个反应中组分I的化学计量系数。
转化率是指某一反应物转化的百分率或分率,其定义为:某某一反应物的转化量该反应物的起始量nk0nknk01.如果反应物不只一种,根据不同反应物计算所得的转化率数值可能是不一样的,但它们反映的都是同一个客观事实。
《化学反应工程》第三版(陈甘堂著)课后习题答案

《化学反应工程》第三版(陈甘堂著)课后习题答案第二章均相反应动力学基础2-4三级气相反应2NO+O22NO2,在30℃及1kgf/cm2下反应,已知反应速率常数2kC=2.65×104L2/(mol2 s),若以rA=kppApB表示,反应速率常数kp应为何值?解:原速率方程rA=dcA2cB=2.65×104cAdt由气体状态方程有cA=代入式(1)2-5考虑反应A课所以kp=2.65×104×(0.08477×303) 3=1.564后当压力单位为kgf/cm2时,R=0.08477,T=303K。
答p p 2rA=2.65×10 A B =2.65×104(RT) 3pApBRT RTp表示的动力学方程。
解:.因,wwnAp=A,微分得RTVdaw案24网pAp,cB=BRTRT3P,其动力学方程为( rA)=dnAn=kA。
试推导:在恒容下以总压VdtVδA=3 1=21dnA1dpA=VdtRTdt代入原动力学方程整理得wdpA=kpAdt设初始原料为纯A,yA0=1,总量为n0=nA0。
反应过程中总摩尔数根据膨胀因子定义δA=n n0nA0 nA若侵犯了您的版权利益,敬请来信通知我们!Y http://.cn.co(1)mol/[L s (kgf/cm2) 3]m(1)则nA=nA01(n n0)δA1(P P0)δA(2)恒容下上式可转换为pA=P0所以将式(2)和式(3)代入式(1)整理得2-6在700℃及3kgf/cm2恒压下发生下列反应:C4H10发生变化,试求下列各项的变化速率。
(1)乙烯分压;(2)H2的物质的量,mol;(3)丁烷的摩尔分数。
解:P=3kgf/cm2,(1)课MC4H10=58,(2)w.krC2H4=2( rC4H10)=2×2.4=4.8kgf/(cm2 s)PC4H10=PyC4H101 dpC4H10= P dt2.4-1==0.8 s 3w(3)nC4H10=nyC4H10=n0(1+δC4H10yC4H10,0xC4H10)yC4H10dnH2dtdnH2dt=hdaw后n0=nC4H10,0=δC4H10rC4H10=反应开始时,系统中含C4H*****kg,当反应完成50%时,丁烷分压以2.4kgf/(cm2 s)的速率dyC4H10dt答1rCH=2.4224wdnC4H10dt案116×1000=2000mol582+1 1==21网dyC4H10=n0(1+δC4H10yC4H10,0xC4H10) dt=2000×(1+2×1×0.5)×0.8=3200 mol/s若侵犯了您的版权利益,敬请来信通知我们!Y http://.cno2C2H4+H2,dP=k[(δA+1)P0 P]=k(3P0 P)dtm(3)dpA1dP= dtδAdt2-9反应APS,( r1)=k1cA , ( r2)=k2cp,已知t=0时,cA=cA0 ,cp0=cS0=0, k1/k2=0.2。
《化学反应工程》第二章
2
cm2 / s
2-6 Knusen扩散系数
当孔径(d0)小于λ,(λ/d0)>10时,碰撞发生在分子与 孔壁之间,分子间的作用很小,这就是努森扩散。
努森扩散系数 DK(cm2/s):
2 raV cm2 / s 3 ra : 孔半径, DK
DK 9700ra T / M cm2 / s T : 系统温度, M : 扩散物的相对分子量。
进而得
V : 平均分子运动速度。
9.871011 cm 分子平均自由程估算: p
λ:cm,p:Pa
2-7 催化剂孔内组分的综合扩散系数 上述两种扩散都存在并且,10-2 <(λ/d0)>10时,这就是 综合扩散。
e
H R (cAS cA )
颗粒中心反应物的浓度cAC为零时,可得颗粒外表面温度TS与中心 温度TC之差的最大值,即
TC TS max
DA,eff
e
H R cAS
2-11 等温催化剂一级反应内扩散有效因子的解析解 一、球型催化剂 若球型催化剂上进行一级不可逆反应,
TS 、Tg :表面温度与气体温度, αS:气体与颗粒表面间的给热系数。 吸热时,颗粒外表面温度<气流温度; 放热时,颗粒外表面温度>气流温度。
2-3 催化反应控制阶段的判别
1.本征动力学控制
1 1 k G S e k S S i
* (rA ) g kS Si (cAg c* ) k S ( c c ) S i AS A A
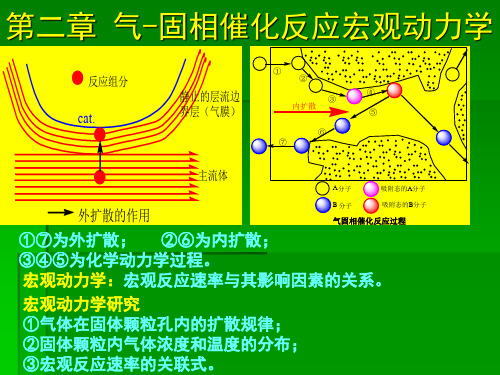
第一节 气-固相催化反应的宏观过程
2-1 气-固相催化反应过程中反应组分的浓度分布
以球形催化剂为例
化学反应工程-复习(二三四章)

k1 k1 − k 2
第二章 均相反应动力学基础 3 膨胀因子 膨胀因子是指每转化掉 摩尔反应物A时所引起的反应物料 是指每转化掉1 膨胀因子是指每转化掉1摩尔反应物 时所引起的反应物料 总摩尔数的变化量, 总摩尔数的变化量,即:
n − n0 n − n0 δA = = n0 y A0 x A n A0 x A
第二章 均相反应动力学基础 得率和收率为: 得率和收率为: Χ
Φ
P
= =
k k
1
k1 − k k1 − k
[e
2
− k
2
t
− e
− k1t
]
e
2
− k
P
1
− e − k1t 1 − e − k1t
2
t
对这种反应,中间物P存在一最高浓度,对应时间为 对这种反应,中间物P存在一最高浓度,对应时间为topt。以CP对topt 求导: 求导:
C A0
εA =
Vx A =1 − Vx A =0 Vx A = 0
它既与反应的化学计量关系有关, 它既与反应的化学计量关系有关,也与系统的惰性物量有 关。
第二章 均相反应动力学基础
它与膨胀因子的关系: 它与膨胀因子的关系:
ε A = y A0δ A
对物系体积随转化率为线性变化的过程, 对物系体积随转化率为线性变化的过程,有:
2.2 等温恒容过程 瞬时收率: 瞬时收率:
第二章 均相反应动力学基础
ϕP
目的产物的生成速率 = 关键反应物的消耗速率
rP dC P = =− rA dC A
瞬时选择性: 瞬时选择性:
目的产物的生成速率 sP = 某一副产物的生成速率 rP dC P = = rS dC S
化学反应工程 第二章 均相反应动力学基础

或者,
nK nK 0 (1 xK )
反应转化率和反应程度
以转化率表示的反应速率
rA
1 V
dnA dt
1 V
d[nA0(1 dt
xA )]
nA0 V
dxA dt
反应转化率和反应程度
反应程度
反应各组分在反应前后摩尔数的变化与其计 量系数的比值,即:
ni ni 0 i
不论对哪一组分,反应程度ξ均相同。
Example, THE ROCKET ENGINE
A rocket engine burns a stoichiometric mixture of fuel (liquid hydrogen) in oxidant (liquid oxygen). The combustion chamber is cylindrical, 75cm long and 60cm in diameter, and the combustion process produces 108kg/s of exhaust gases. If combustion is complete, find the rate of reaction of hydrogen and of oxygen.
for the volume of the person in
question
V person
75kg 1000kg / m3
0.075m 3
Next, noting that each mole of glucose
consumed uses 6moles of oxygen and
release 2816kJ of energy, we see that
the reaction equation
化学反应工程课件—第二章(反应速率)(PDF)

1
第二章 反应动力学基础
讲授内容
1 基本概念 2 单一反应速率式 3 复合反应 4 链锁反应
2009-5-3
2
2.1 基本概念
1 化学计量方程
本节 讲授 内容
2 化学反应速率的定义 3 转化率等重要概念
4 化学反应速率方程
4 反应机理与速率方程
2009-5-3
3
一、化学计量方程
100 − x / 2
100 − x / 2
解得: x = 1.504mol
y = 0.989mol
乙烯的转化量为 :1.504 + 0.989 / 2 = 1.999mol
2009-5-3
23
所以,乙烯的转化率为: 1.999 /15 = 13.33%
环氧乙烷的收率为: 1.504 /15 = 10.03%
和反应后的摩尔数 yk0、yk为着眼组分K的 起始摩尔分率和反应后
yK
= yK 0 (1− xK )
1+ δK yK0xK
对于任何反应组分i有
2009-5-3
的总摩尔数
yi
= yi0(1− xi )
1+δK yK0xK
=
yi0
(1−
αi αK
yK0 yi0
xK )
1+δK yK0xK 27
δK
= n − n0 nK 0 − nK
意
算结果均是如此),对于复杂反应Φ ≠ x
¾ 收率也有单程和全程之分(循环物料系统)
¾ 无论是收率还是选择性,还有其它的定义(结果不
一样,但说明同样的问题)
¾ 转化率x只能说明总的结果, Φ 说明在转化的反
化学反应工程2(第二章-均相反应动力学基础)

◆自催化反应:
特点:反应产物中某一产物对反应有催化作用,同时,为了使反应进
行 , 常 事 先 加 入 一 定 浓 度 的 催 化 剂 C , 设 浓 度 为 CC0 。
A+C2C+R……
设对各组分均为一级,则: rA
dCA dt
kCCCA
t=0, CA=CA0 CC=CC0 CR=CR0=0
continue
非等分子反应的膨胀因子及相关计算
膨胀因子:
K
1 K
s i1
i
n n0 n0yK0xK
K 的定义:
s
i Ai 0
i 1
的情况
每反应1mol的组分K所引起反应物系总摩尔数的变化量。
(举例:如合成氨的反应,求膨胀因子)
设关键组分K的转化率为xK,则:
yK
反应开始时总mol数(单位体积):CM0= CA0+ CC0
两参数是无法积 分的,设法变为 单参数微分形式
任何时刻:CC=CC0+(CA0-CA)=CM0- CA
rA
dCA dt
kCA CM 0
CA
积分得C
MO
k
t
ln
C C
A CM 0 A0 CM
C A0 0 CA
●幂函数型
对反应:AA+BB
kC
LL+MM
l CMm
kC'
Ca' A
Cb' B
Cl' L
C m' M
若为不可逆反应,则:
rA
k
c
化学反应工程第二章

二 复杂反应积分法
1. 一级可逆反应(reversible first-order reactions)
一级 A R (CRo 0)
k2 k1
dCA rA k1C A k2CR dt C Ao C A C R dCA rA k1C A k2 (C Ao C A ) (k1 k2 )C A k2C Ao dt
k2 k3 [M ] 末氏常数 k1
二 不同限定组分间关系 与反应速度的定义
(the definition of rates and their relation)
aA bB rR sS
(如:A 2 B 3R 4S )
同一个反应方程式只有一个温度和浓度影 响规律,不同限定组分之间的速度方程差别 用常数修正。
2.平行反应
A
(parallel reactions)
R S
k2
k1
rR k1C A
rS k 2 C A
dC A rA ( k1 k 2 ) C A dt
用同样方法可测出 nA
CD,C A CB时
C AC B C D 时
测出nB
测出nD
k kCB C D
nB
nD
k kCA C B
nA
nB
将nA,nB,nD代入k’,k’’,k’’’,k’’’’ 可求出四个值,均值为真k。 例: A 2B R
C Ao : CBo 1 : 2
M 1
2A R
M 1
dC A 2 kCA dt
1 1 kt C A C Ao
3.不可逆三分子三级反应 ( A B D 产物)
化学反应工程-第2章(21)

m p s g ( 2ra L) n m pVg ra Ln
2
内表面 积 mp:催化剂颗粒的质量,g
Sg
S M
ra
2Vg sg
孔容
V孔容积 Vg M 颗粒质量
催化剂颗粒 平均孔半径
表1-1是常用催化剂载体的比表面积和孔容。从表中可以看 出,催化剂颗粒的内表面积是何等的巨大。
b p (1 ) t (1 )(1 )
b p (1 ) t (1 )(1 )
b ( g / cm 堆体积) g = p ( 3 ) b p (1 ) 3 cm 空隙 cm 颗粒体积 1-( ) 3 cm 堆体积 g p( 3 ) g cm 颗粒体积 = ( ) p t (1 ) t 3 3 cm 孔容积 cm 载体体积 1 ( 3 ) cm 颗粒体积 b p (1 ) t (1 )(1 )
设有气-固相催化反应: CO( g ) H O( g ) CO ( g ) H ( g ) 2 2 2 反应步骤如下: (1) 外扩散:A和B从气相主体到达颗粒外表面; (2)内扩散:A和B从颗粒外表面进入颗粒内部; (3)化学吸附:A和B被活性位吸附,成为吸附态A和B; (4)表面反应:吸附态A和B起反应,生成吸附态C和D; (5)脱附:吸附态C和D脱附成自由的C和D。 (6)内扩散: C和D从颗粒内部到达颗粒外表面; (7)外扩散:C和D从颗粒颗粒外表面到达气相主体; 化学吸附、表面反应和脱附三步是串联的,构成了催化 反应过程。按照上述三步获得的催化反应动力学,称之为催 化反应化学动力学,或者催化反应本征动力学。
M 颗粒质量 P V颗粒体积
g / cm3
B、堆密度(床层密度):以床层的堆体积(颗粒体积和颗粒 间空隙之和)计算的密度。
化学反应工程-第2章 (2)

rA kc c
,( mol ) m3 s
A B
( r A
)
k
A
c
A
c B
式中k称作反应速率常数;α 、β 是反应级数。
对于(恒容)气相反应,由于分压与浓度成正比,也可 用分压来表示。
1 dnA ( rA ) k p PA PB V dt
注意各参数的量纲单位要一致 ,若分压的单位为Pa, 则kp的单位: mol
1 1 1 C A C A0 C A0
xA 1 x A
kt
当CA0不等于CB0时,分离变量并积分得:
xA
0
dxA C A 0 k dt 1 x A x A
0
t
解法1:利用积分公式:
du 1 ua ln u a u b b a u b c
1
对二级不可逆反应:
A + B → 产物
其反应速率方程为:
dCA dxA rA C A0 kC AC B dt dt kCA0 1 x A C B 0 C A0 x A
2 kCA 1 x A x A 0
CB0 / CA0
当CA0=CB0时,积分结果为:
C A0
CA
dC A f (Ci )
④.以上述各点的积分值对该点的t绘图。若得到一条 过原点的直线,则假定反应机理成立,从直线的斜率 得到反应速率常数kC;否则,必须重复上述①~③步 骤。
(1)不可逆反应
aA bB 产物
其动力学方程的形式为:
rA
dCA kCA a CB b dt
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
nA = nA0(1− xA )
亦可得到任意组分在任意时刻的摩尔数 可得到任意组分在任意时刻的摩尔数 αI nI = nI0 + nA0xA (−αA )
7
1.计算转化率起始状态的选择: 计算转化率起始状态的选择: 计算转化率起始状态的选择 反应起始原料组成; (1)间歇反应器 :反应起始原料组成; ) (2)连续流动反应器:进口原料组成; )连续流动反应器:进口原料组成; 2.等容反应 CA=CA0(1- XA) 等容反应 3.可逆等容反应 CAe=CA0(1- XAe) 可逆等容反应 4.单程转化率:原料通过反应器一次达到 单程转化率: 单程转化率 的转化率 5.全程转化率:新鲜原料进入反应系统到 全程转化率: 全程转化率 离开系统所达到的转化率。 离开系统所达到的转化率。
4
(-a)A + (− b)B +L+ rR+ sS +L= 0
a A A + a B B + L + a R R + aS S + L = 0
∑a I = 0
I
•特点: 特点: 特点 •1 只反映组份间的计量关系 •2 乘以非零常数,计量关系不变 乘以非零常数, •3 不得含有除 之外的其它公因子 不得含有除1之外的其它公因子
• 必有
1 1 − rA = (− rB ) = (rC ) = (rD ) 2 2
−r I r= −αI
• 当I为反应物时, 为反应物时, 为反应物时 • I为产物时, 为产物时, 为产物时
r=
αI
19
r I
• 用转化率表示反应速率: 用转化率表示反应速率: nA0 dx A kmol -rA = 一般式 3 V dt m s • 用浓度表示反应速率: 用浓度表示反应速率:
1
第一节: 第一节:基本概念
一、化学反应式 二、化学反应计量式 三、转化率 四、反应程度 五、转化率与反应程度的关系 六、化学反应速率 七、均相反应动力学方程 八、复合反应的选择性和收率
2
第一节: 第一节:基本概念
一、化学反应式 • 反应物经化学反应生成产物的过程用定 量关系式予以描述时,该定量关系式称为 量关系式予以描述时 该定量关系式称为 化学反应式: 化学反应式
21
七、均相反应动力学方程
• 定量描述反应速率与影响反应速率因素之间的 关系式称为反应动力学方程。 关系式称为反应动力学方程。 • 大量实验表明,均相反应的速率是反应物系组 大量实验表明, 温度和压力的函数。 成、温度和压力的函数。而反应压力通常可由 反应物系的组成和温度通过状态方程来确定, 反应物系的组成和温度通过状态方程来确定, 不是独立变量。 不是独立变量。所以主要考虑反应物系组成和 温度对反应速率的影响。 温度对反应速率的影响。 • 化学反应动力学方程有多种形式,一般分为幂 化学反应动力学方程有多种形式, 函数型和双曲线型。 函数型和双曲线型。
5
例:
1 SO2 + O2 = SO3 2 2 SO2 + O2 = 2 SO3 N 2 + 3H 2 = 2 NH 3
上各式均属正确,但下式不符合习惯: 上各式均属正确,但下式不符合习惯:
1 2 N 2 + H 2 = NH 3 3 3
6
三、转化率 • 目前普遍使用着眼组分 的转化率来描述 目前普遍使用着眼组分A的转化率来描述 一个化学反应进行的程度。 一个化学反应进行的程度。 • 定义 转 了 A组 量 nA0 − nA 化 的 分 xA = = A组 的 始 分 起 量 nA0
aA + bB+L →rR + sS+L
3
二、化学反应计量式 • 化学反应计量式(化学反应计量方程) 化学反应计量式(化学反应计量方程)
aA+ bB+L= rR + sS+L
• 是一个方程式,允许按方程式的运算规 是一个方程式, 则进行运算, 则进行运算,如将各相移至等号的同一 侧。
(− a)A+ (−b)B+ rR + sS+L= 0
25
•如果反应级数与反应组份的化学计量 如果反应级数与反应组份的化学计量 系数相同, 并且ß=b,此反应可 系数相同,即ą =a并且 并且 , 能是基元反应。 能是基元反应。 •基元反应的总级数一般为 •基元反应的总级数一般为1或2,极个 基元反应的总级数一般为1或2, 别有3,没有大于3级的基元反应 级的基元反应。 别有3,没有大于3级的基元反应。 •对于非基元反应, α , ß 多数为实验 对于非基元反应, 对于非基元反应 测得的经验值,可以是整数,小数, 测得的经验值,可以是整数,小数,甚 至是负数。 至是负数。
22
• 对于体系中进行一个不可逆反应的过程: 对于体系中进行一个不可逆反应的过程:
aA+ bB →rR + sS α β −3 −1 − rA = kccAcB m ⋅m s ol
• cA,cB:A,B组分的浓度 mol.m-3 , 组分的浓度 1. 反应级数 • α, β :A,B组分的反应级数, n = α + β为 组分的反应级数, , , 组分的反应级数 为 此反应的总级数。 此反应的总级数。
9
例:
• 随起始态的不同选择而不同
x0 x1 x2
R1
R2
• 2 与计量系数无关(与反应式的写法无 关) 1
SO2 + O2 = SO3 2 2 SO2 + O2 = 2 SO3
10
四、反应程度(反应进度) 反应程度(反应进度)
• 反应初始时各物质的量: nA0, nB0, nR0, nS0 反应初始时各物质的量: • 反应进行到某一时刻变为:nA, nB, nR, nS 反应进行到某一时刻变为: • 由反应计量式,必有: 由反应计量式,必有:
23
2.反应速率常数 反应速率常数
kc为以浓度表示的反应速率常数,是温度的函数, 为以浓度表示的反应速率常数,是温度的函数, 在一般工业精度上,符合阿累尼乌斯关系。 在一般工业精度上,符合1-n
kc = kc0e
−
E RT
• kc0 :指前因子,又称频率因子,与温度 指前因子,又称频率因子, 无关,具有和反应速率常数相同的因次。 无关,具有和反应速率常数相同的因次。 • E:活化能,[J·mol-1],从化学反应工程 :活化能, , 的角度看, 的角度看,活化能反映了反应速率对温 度变化的敏感程度。 度变化的敏感程度。 24
16
六、化学反应速率 • 常用以反应体系中各个组份分别定义的 反应速率。 反应速率。 1 dni ± ri = ± m ⋅ m−3s−1 ol V dt • • • • • ni:反应体系内,组分 的摩尔数; 反应体系内,组分i的摩尔数 V:反应体积 : t:时间 : “+”用产物表示反应速率 “-”用反应物表示反应速率
14
五、转化率与反应程度的关系 • 结合二者定义式,简单推导可得: 结合二者定义式,简单推导可得: nA0 − nA xA = nA = nA0 +αAξ nA0 • 得到: 得到:
−αA xA = ξ nA0
15
反应程度与转化率比较: 反应程度与转化率比较:
反应程度 转化率
对 于 任 何 一 种 反应程度相同 转 化 率 不 一 反应物或产物 定相同 对 能 够 达 到 的 表示不够明确 表示明确 最大值 因次 有 无
化学反应: 方向、限度--- ---化学热力学 化学反应: 方向、限度---化学热力学 机理、速率--- ---化学动力学 机理、速率---化学动力学
第二章均相反应动力学基础
•相:体系中物理、化学性质完全相同的部分 相 体系中物理、 称为一相。 称为一相。 •均相:反应物与产物都在同一相中。更确切 均相:反应物与产物都在同一相中。 均相 地说,参与反应的各个化学组份处于同一相中。 地说,参与反应的各个化学组份处于同一相中。 •反应动力学:研究反应体系温度、浓度(压 反应动力学:研究反应体系温度、浓度( 反应动力学 与反应速率的关系。 力)与反应速率的关系。
8
性质: 性质: • • • • • 1 随起始态的不同选择而不同。 随起始态的不同选择而不同。 2 与计量系数无关(与反应式的写法无关)。 与计量系数无关(与反应式的写法无关)。 3 广度量 4 最大值为 。 最大值为1。 5 通常选取重点关注的、经济价值相对高的 通常选取重点关注的、 组分定义转化率。 组分定义转化率。
17
对 反 于 应
A + 2B = 2C + D
以反应物A为基准定义的反应速率为: 以反应物 为基准定义的反应速率为: 为基准定义的反应速率为 1 dnA − rA = − m ⋅ m−3s−1 ol V dt • 以反应物 为基准定义的反应速率为: 以反应物B为基准定义的反应速率为 为基准定义的反应速率为: 1 dnB − rB = − m ⋅ m−3s−1 ol V dt • 以反应产物 为基准定义的反应速率为: 以反应产物C为基准定义的反应速率为: 为基准定义的反应速率为 1 dnC −3 −1 rC = m ol.m s 18 V dt
即:任何反应组份的反应量与其化学计量系数之 比相同。这一比值可以用来描述反应进行的程度。 比相同。这一比值可以用来描述反应进行的程度。 11
• 引入“反应程度”来描述反应进行的深度。 引入“反应程度”来描述反应进行的深度。 • 对于任一化学反应
(− a)A+ (−b)B+ rR + sS = 0
• 定义反应程度
dC A C A dV kmol − 变容:-rA = - 一般式 3 dt V dt m s dC A kmol 恒容 : -rA = - m3 s dt
