医疗器械临床试验机构汇总表
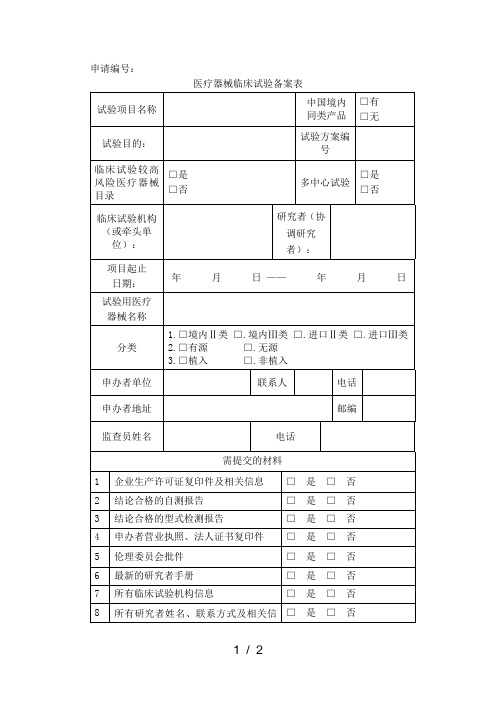
医疗器械临床试验备案表
医疗器械临床试验备案表
试验项目名称
中国境内同类产品
□有
□无
试验目的:
试验方案编号
临床试验较高风险医疗器械目录
□是
□否
多中心试验
□是
□否
临床试验机构(起止
日期:
年月日——年月日
试验用医疗
器械名称
分类
1.□境内Ⅱ类 □.境内Ⅲ类 □.进口Ⅱ类 □.进口Ⅲ类 2.□有源 □.无源 3.□植入 □.非植入
□ 是 □ 否
8
所有研究者姓名、联系方式及相关信息
□ 是 □ 否
9
监查员姓名、联系方式及相关信息
□ 是 □ 否
10
项目概要说明
□ 是 □ 否
11
SFDA批件(适用时)
□ 是 □ 否
12
申办者保证所提供资料真实性的声明
□ 是 □ 否
申请人签名:
年 月 日
备案号:
经办人签名:
年 月 日
申办者单位
联系人
电话
申办者地址
邮编
监查员姓名
电话
需提交的材料
1
企业生产许可证复印件及相关信息
□ 是 □ 否
2
结论合格的自测报告
□ 是 □ 否
3
结论合格的型式检测报告
□ 是 □ 否
4
申办者营业执照、法人证书复印件
□ 是 □ 否
5
伦理委员会批件
□ 是 □ 否
6
最新的研究者手册
□ 是 □ 否
7
所有临床试验机构信息
医疗器械临床试验机构汇总表

医疗器械临床试验机构汇总表1.北京协和医院北京协和医院,成立于1921年,是中国著名的综合性医院之一,也是医疗器械临床试验机构中的重要一员。
医院拥有先进的医疗设备和临床试验研究团队,为科研人员和医疗器械企业提供临床试验的场地和平台。
2.北京大学人民医院北京大学人民医院是国内一流的综合性医院之一,其临床试验中心设备先进,临床试验团队经验丰富。
医院积极参与临床试验,为患者提供更多、更好的医疗器械选择。
3.上海交通大学医学院附属瑞金医院上海交通大学医学院附属瑞金医院是上海市的综合性医院之一,也是医疗器械临床试验机构中的重要一员。
医院拥有完善的设备和专业的临床试验团队,为医疗器械的研究和开发提供支持。
4.广州中山大学附属第一医院中山大学附属第一医院是广州市的综合性医院之一,也是医疗器械临床试验机构的成员之一、医院拥有一流的设备和临床试验团队,为医疗器械的临床试验提供优质的环境和支持。
5.复旦大学附属华东医院复旦大学附属华东医院是上海市的综合性医院之一,具有临床试验资质。
医院设备先进,专业临床试验团队经验丰富,为医疗器械临床试验提供专业支持。
6.浙江大学医学院附属第一医院浙江大学医学院附属第一医院是杭州市的综合性医院之一,也是医疗器械临床试验机构的一员。
医院积极参与临床试验工作,为医疗器械的研发和临床应用提供支持。
7.南京医科大学附属第一医院南京医科大学附属第一医院是江苏省的综合性医院之一,拥有完善的设备和专业的临床试验团队。
医院参与多项临床试验,为医疗器械的发展和应用提供支持。
8.四川大学华西医院四川大学华西医院是成都市的综合性医院之一,也是医疗器械临床试验机构的一员。
医院设备齐全,临床试验团队经验丰富,为医疗器械的研究和应用提供支持。
9.中山大学附属第三医院中山大学附属第三医院是广州市的综合性医院之一,也是医疗器械临床试验机构的重要成员之一、医院设备先进,临床试验团队经验丰富,为医疗器械的研究和应用提供专业支持。
医疗器械临床试验保存文件目录

保存
8
伦理委员会审查意见
保存原件
保存
9
伦理委员成员表
保存原件
保存
10
临床试验申请表(若有)
保存原件
11
临床前实验室资料(若有)
保存原件
12
国家食品药
13
研究者履历及相关文件
保存
保存原件
14
临床试验有关的实验室检测正常值范围
保存
保存
15
医学或实验室操作的质控证明(若有)
保存
23
其他文件(方案、病例报告表、知情同意书、书面情况通知)的更新(若有)
保存
保存
24
新研究者的履历(若有)
保存
保存原件
25
医学、实验室检查,操作的正常值范围更新(若有)
保存
保存
26
试验用医疗器械与试验相关物资的交接单
保存
保存
27
新批号试验用医疗器械自检证明(若有)
保存
保存原件
28
监查员访视报告
保存原件
29
已签名的知情同意书
保存原件
30
原始医疗文件
保存原件
31
病例报告表(已填写,签名,注明日期)
保存原件
保存
32
严重不良事件报告(若有)
保存原件
保存
33
申办者致监管部门、伦理委员会的未预期的严重医疗器械不良事件报告(若有)
保存
保存原件
34
受试者鉴认编码表
保存原件
35
受试者筛选表与入选表
保存
36
研究者签名样张
保存
保存
三、临床试验终止或完成后
临床试验保存文件
2023年国家医疗器械抽检复检机构名单

30280
山东省医疗器械和药品包装检验研究院
北京市医疗器械检验研究院
江西省医疗器械检测中心
山东省医疗器械和药品包装检验研究院
北京市医疗器械检验研究院
江西省医疗器械检测中心
39
贴敷类医疗器械(远红外治疗贴、磁疗贴、穴位磁疗贴)
30290
山东省医疗器械和药品包装检验研究院
安徽省食品药品检验研究院
安徽省食品药品检验研究院
福建省食品药品质量检验研究院
江西省医疗器械检测中心
广西壮族自治区医疗器械检测中心
重庆医疗器械质量检验中心
云南省医疗器械检验研究院
深圳市药品检验研究院
北京市医疗器械检验研究院
河北省药品医疗器械检验研究院
辽宁省医疗器械检验检测院
江苏省医疗器械检验所
浙江省医疗器械检验研究院
安徽省食品药品检验研究院
湖南省药品检验检测研究院
上海市医疗器械检验研究院
湖南省药品检验检测研究院
28
Nd:YAG激光治疗机
30180
浙江省医疗器械检验研究院
浙江省医疗器械检验研究院
湖北省医疗器械质量监督检验研究院
29
婴儿光治疗设备
30190
浙江省医疗器械检验研究院
浙江省医疗器械检验研究院
江苏省医疗器械检验所
30
裂隙灯显微镜
天津市医疗器械质量监督检验中心
中国食品药品检定研究院
18
移动式C形臂X射线机
30080
辽宁省医疗器械检验检测院
北京市医疗器械检验研究院
天津市医疗器械质量监督检验中心
辽宁省医疗器械检验检测院
北京市医疗器械检验研究院
天津市医疗器械质量监督检验中心
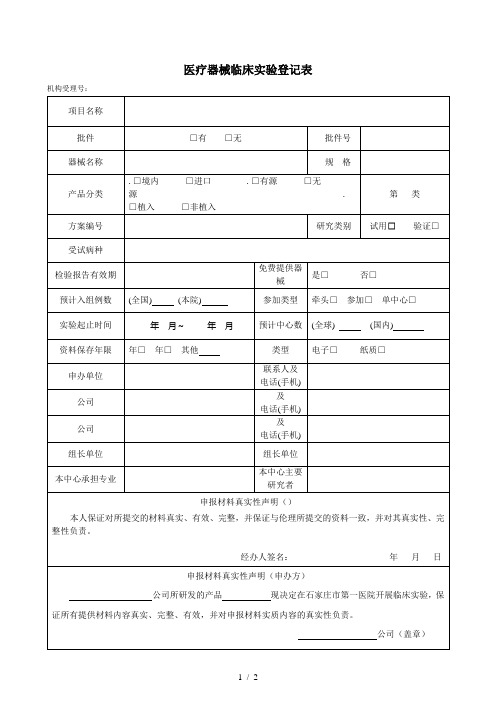
医疗器械临床试验登记表
公司(盖章)
研究团队成员:
姓名
职称
项目分工
是否获得证书
签名
联系电话
主要研究者声明
本人自觉接受国家有关法律和法规的约束,对该项目的所有临床研究资料及相关内容保密,保护受试者权益及隐私,并郑重承诺与该项目无任何利益冲突。
资料保存年限
年□年□其他
类型
电子□纸质□
申办单位
联系人及
电话(手机)
公司
及
电话(手机)
公司
及
电话(手机)
组长单位
组长单位
本中心承担专业
本中心主要研究者
申报材料真实性声明()
本人保证对所提交的材料真实、有效、完整,并保证与伦理所提交的资料一致,并对其真实性、完整性负责。
经办人签名:年月日
申报材料真实性声明(申办方)
本人已审阅所有临床实验资料,认为本科室的人员配备、病源量和设备条件满足该项目实验要求,团队成员有充分的时间、并保证在约定时间内入组完成实验。本人同意并确认上述人员参加该临床实验。
主要研究者签字:年月日
(此由机构填写)
机构意见:经形式审查资料合格。
审查人签字:年月日
注:.团队成员中必须授权有项目质控训。
.机构登记表正反面打印。
.所有选择项目的“□”内用“×”标注
医疗器械临床实验登记表
机构受理号:
项目名称
批件
□有□无
批件号
器械名称
规格
产品分类
.□境内□进口.□有源□无源.□植入□非植入
第类
方案编号
医疗器械临床试验备案机构目录

21 械临机构备 201800295 北京市房山区中医医院
22 械临机构备 201800323 北京大学第三医院
23 械临机构备 201800328 北京大学人民医院(北京大学第二临床医学院)
24 械临机构备 201800343 首都医科大学附属北京妇产医院
25 械临机构备 201800371 首都医科大学附属北京朝阳医院
11 械临机构备 201800128 首都医科大学附属北京潞河医院
12 械临机构备 201800183 北京回龙观医院
13 械临机构备 201800192 首都医科大学附属北京儿童医院
14 械临机构备 201800232 中国医学科学院阜外医院
15 械临机构备 201800245 北京爱尔英智眼科医院
49 械临机构备 201800663 首都医科大学附属北京安贞医院
50 械临机构备 201900052 首都医科大学附属北京天坛医院
51 械临机构备 201900067 中国中医科学院广安门医院
52 械临机构备 201900073 航天中心医院
53 械临机构备 201900147 北京市海淀医院
54 械临机构备 202000081 北京中医药大学第三附属医院
16 械临机构备 201800250 首都医科大学附属北京同仁医院
1
序号
备案号
机构名称
17 械临机构备 201800252 北京中医药大学东直门医院
18 械临机构备 201800254 首都医科大学附属北京友谊医院
19 械临机构备 201800291 北京大学国际医院
20 械临机构备 201800294 首都医科大学宣武医院
43 械临机构备 201800555 北京大学第一医院
医药(医疗器械)临床试验机构(全部)

汕头大学医学院第一附属医院
肿瘤、呼吸、风湿、普通外科
0054
青岛眼科医院
眼科
0055
汕头大学-香港中文大学联合汕头国际眼科中心
眼科
0056
内蒙古民族大学附属医院
民族医(蒙药)血液、民族医(蒙药)心血管、民族医(蒙药)脑血管、民族医(蒙药)风湿、民族医(蒙药)内分泌、民族医(蒙药)骨伤
0057
0029
中国人民解放军北京军区总医院
消化、神经内科、肝病、内分泌、肿瘤、心血管、呼吸、骨科
0030
中国人民解放军济南军区第四O一医院
创伤
0031
山东省皮肤病医院
皮肤
0032
河北省精神卫生中心(河北省第六人民医院)
精神
0033
杭州市第六人民医院
肝病、感染
0034
中国人民解放军第八十五医院
肝病
0035
中山大学附属第五医院
0114
湖南省中医药研究院附属医院
中医肿瘤、中医肝病、中医心血管、中医脑血管、中医肾病
0115
南京脑科医院
神经内科、精神
0116
山东省肿瘤医院
肿瘤
0117
陕西省中医医院
中医心血管、中医脑血管、中医消化、中医肿瘤
0118
医疗机构名称
认定专业
证书编号
中国医科大学附属第二医院
妇产、呼吸、心血管、内分泌、肾病、消化、肝病、麻醉、皮肤、小儿呼吸、小儿肾病
呼吸
0094
湖北省中医院(光谷院区)
中医骨伤、中医风湿、中医肾病
0095
湖北省中医院
中医心血管、中医脑血管、中医肝病、中医口腔、中医呼吸、中医妇产、中医儿科、中医外科(肝胆)
临床试验的分中心小结表(医疗器械、体外诊断试剂)

签字:日期:
本中心临床试验机构管理部门审核意见
盖章:日期:
表1:参加试验人员列表
姓名
科室
职称
研究中的职务
研究中分工
表2:受试者入选情况一览表
受试者筛
选号
受试者姓
名缩写
医疗器
械编号
知情同
意日期
筛选失
败原因
入组
日期
是否
日期
临床试验的分中心小结表(医疗器械/体外诊断试剂)
试验名称
试验目的
申办者/CRO
试验用医疗器械
名称
型号规格
分类
1
□境内Ⅱ类□境内Ⅲ类□进Ⅱ类□进Ⅲ类
2
□有源□无源□体外诊断试剂
3
□植入□非植入
需进行临床试验审批的第三类医疗器械
□是□否
中国境内同类产品
□有□无
多中心临床试验
□是□否
组长单位
本中心试验专业名称
试验期间盲态保持情况
试验盲态:□双盲□单盲□非盲有无紧急揭盲:□无□有
试验期间方案偏离情况
□无□有(如有,提供受试者方案偏离的具体情况)
本中心医疗器械缺陷和严重不良事件发生情况
医疗器械缺陷:□无□有严重不良事件:□无□有
临床研究监查情况
委派临床试验监查员单位:□申办方□CRO监查次数:次监查质量评价:
主要研究者
参加试验人员(可提供附表)
参加试验人员姓名、职称、科室、研究中分工等信息(附表1)
本中心伦理委员会批准日期
试验计划入组受试者数
筛选人数
随机化/入组人数
完成试验人数
第一例受试者(入组日期)
最后一例受试者结束随访日期
医疗器械临床试验方案范本

医疗器械临床试验
方案范本
1
2020年4月19日
附件4
医疗器械临床试验方案
方案编号:
G y r o G u i d e临床试验方案
试验用医疗器械名称:基于陀螺仪的简易神经外科手术导航系统型号规格:
试验用医疗器械的管理类别:
需进行临床试验审批的第三类医疗器械是□否□
中国境内同类产品有□无□
方案版本号和日期:V1.0
临床试验机构:浙江大学第二附属医院
研究者:方路平、潘清、高坤
申办者:方路平
代理人:高成龙
2
2020年4月19日
填写说明:
1.对于多中心临床试验,封面上的临床试验机构只填写牵头单位,其它机构在方案内容中列出。
2.对于多中心临床试验,封面上的研究者填写协调研究者。
3
2020年4月19日。
医疗器械企业表格汇总完整版

71、内校设备记录
72、顾客满意程度调查表
73、顾客满意度调查表发放记录
74、顾客信息反馈单
75、年度内部质量体系审核计划
76、内审实施计划表
77、审核组长任命书
78、会议签到表
79、内部质量体系审核检查表
80、不合格报告
81、内部质量体系审核报告
82、成品检验记录
83、工序巡检记录表
84、常温老化记录
85、整机台帐
86、机号发放记录
87、外购元器件、部件、整件和外协件质量检验记录
88、进货检验台帐
89、成品一次交验合格率汇总表
90、不合格品记录
91、不合格评审记录
92、改进和纠正预防措施处理单
93、改进、纠正和预防措施实施情况一览表
94、改进计划
95、产品交付监控统计表
受控文件清单(1.质量文件)
文件名称
编号
版本
份数
留用原因:
申请人:日期:
所在部门意见:
签名:日期:
文件保管部门意见:
签名:日期:
管理者代表意见:
签名:日期:
外来文件留用申请
编号:XAJ-XAJ-4.2.4-07
文件名称
编号
版本
份数
留用原因:
申请人:日期:
所在部门意见:
签名:日期:
文件保管部门意见:
签名:日期:
管理者代表意见:
签名:日期:
28、设备报废单
29、生产环境检查记录
30、顾客来电记录表
31、执行合同交付记录
32、合同台帐
33、经销商台帐
34、特殊销售合同评审记录表
35、来电订货记录表
医疗器械登记表【范本模板】

成都肯格王三氧电器有限公司
KGW/XDJ/Y150
2009/06/29
3
合格
9
三氧治疗仪
四川博欣生物科技发展有限公司
济南优科医疗技术有限公司
SYZ2000型
2008/7/6
4
合格
注:登记2千元以上第二、三类在用医疗器械设备;在用状态,填写“合格”、“不合格”、“维修"
《医疗机构8年以上在用医疗器械设备登记表》
成都普朗医疗设备有限公司
南京普爱射线影像设备有限公司
PLX112B型
2009/7/18
3
合格
6
手术无影灯
成都普朗医疗设备有限公司
江苏科凌医疗器械有限公司
KL90L
/2/1
3
合格
7
移动式手术床
成都普朗医疗设备有限公司
南京普爱射线影像设备有限公司
PLXF150
2009/06/11
3
合格
8
三氧消毒机
3
合格
2
心电图机
四川华润科技有限公司
深圳邦促有限公司
ECG-300
2009/05/10
3
合格
3
电解质分析仪
成都普朗医疗设备有限公司
成都普朗医疗设备有限公司
PL-1000B
2010/1/5
2
合格
4
B型超声诊断仪
成都普朗医疗设备有限公司
深圳市恩普电子技术有限公司
EMP-600
2005/8/18
7
合格
5
高频移动式手术X射线机
填报单位(盖章):填报日期:
序号
设 备 名 称
医疗器械临床试验机构备案(样表)

省级药品监管部门备案专用章
年 月 日
备注:
1.备案完成后,备案表一份由申办者所在地省级药品监督管理部门保存,一份由申办者保存。临床试验机构由申办者提交备案表复印件。
2.申办者同医疗器械注册申请人。
3.多中心临床试验指按照同一临床试验方案在三个以上(含三个)临床试验机构实施的临床试验。
附件3
医疗器械临床试验备案表
试验名称
XXXXXX临床试验
试验目的
XXXXXX
试验用医疗器械
名 称
XXXXXX
型号规格
XXXXXX
分 类
1.□境内Ⅱ类 □境内Ⅲ类 □进口Ⅱ类 □进口Ⅲ类
2.□有源 □无源 □体外诊断试剂
3.□植入 □非植入
需进行临床试验审批的第三类医疗器械
□是
□否
中国境内
同类产品
□有
2
申办者或代理人营业执照复印件
3
伦理委员会意见复印件
4
申办者与临床试验机构实施临床试验协议或合同的复印件
5
医疗器械临床试验批件复印件(需进行临床试验审批的第三类医疗器械)
我(们)声明备案表中填写的内容及提交的材料真实有效、有据可查,符合相关法规、规范的要求,对其承担相应的法律责任。
申办者签章:
年 月 日
□无
试验方案版本号及日期
XXXXXX
多中心
临床试验
□是
□否
临床试验机构(如多中心应注明牵头单位)
研究者
名称
地址
联系人
电话
姓名
科室
职务
电话
XXXXXX医院
XXXXXX
许X
136XXXXXX
张X
15.(2.5.P.)临床试验信息汇总表

附件415.(2.5.P.)临床试验信息汇总表本套格式申报资料主要适用于以药动学参数为终点评价指标的生物等效性试验资料的申报。
对于需要进行临床试验的特殊制剂等,信息汇总表应参照注册分类3的格式撰写。
基于目前的认识制定本套格式申报资料,可根据化合物的性质和试验特点做适当优化和补充。
须按时间顺序提交所进行的每项生物等效性试验的相关信息。
应以下级目录形式逐个研究项目填写“生物等效性试验信息汇总表”(“如2.5.P.1空腹生物等效性试验;2.5.P.2餐后生物等效性试验”),共用内容集中填写于首个试验项目中,其余项目参见首个试验,并注明标题编号。
2.5.P.1 XX药的空腹生物等效性试验表1(注:依次编号,下同):基本信息表xx:试验药物信息表xx: 处方信息(举例)应提交所有规格的处方信息表xx:体外溶出试验概要6应提交受试制剂和参比制剂所有规格的溶出试验结果。
7表xx: 试验设计表xx: 试验报告及生物样品储存信息表xx: 完成生物等效性试验的受试者信息(举例)表xx:不良事件发生率统计(举例)表xx: 受试者退出试验情况人原因)等。
表xx: 方案偏离情况表xx: 试验结果表xx:调整评价标准的生物等效性试验数据汇总表(若适用)表xx:生物样品分析方法学验证结果(举例)表xx:生物样品分析的标准曲线和质控数据概要*(举例)表xx :试验样品重复测定情况表xx:餐后生物等效性试验中试验餐的组成表xx:浓度数据汇总表(适用于采用体内药代法进行的生物等效性试验)(代码的定义详见后续表格)a)受试制剂组的药物浓度1718b)参比制剂组的药物浓度1920表xx:药动学参数汇总表(表格中代码的定义详见后续表格)(举例)a)受试制剂药动学参数21max22b)参比制剂药动学参数23max24注:生物样品浓度数据表中的代码定义如:N_FIRST=10 指“第10个”采样时间点而不是10小时N_FIRST=24 指“第24个”采样时间点而不是24小时个体药动学参数数据表中的代码定义表xx:试验备案及临床试验登记平台登记情况小结表**药物临床试验登记与信息公示平台网址:/表xx:预试验汇总表(若适用)表xx:参考资料列表。
医疗器械临床试验备案机构目录

械临机构备
沈阳中心血站(辽宁省血液中心)
吉林省:20个
1
械临机构备
吉林大学第一医院
2
械临机构备
长春市儿童医院
3
械临机构备
吉林省中医药科学院第一临床医院
4
械临机构备
四平市中心人民医院
5
械临机构备
通化市中心医院
6
械临机构备
吉林省人民医院
7
械临机构备
吉林大学中日联谊医院
8
械临机构备
长春中医药大学附属医院
18
械临机构备
沈阳何氏眼科医院(有限公司)
19
械临机构备
中国医科大学附属盛京医院
20
械临机构备
丹东市第一医院
21
械临机构备
大连市第六人民医院
22
械临机构备
沈阳市第四人民医院
23械临机构备锦州医科大学附 Nhomakorabea第三医院
24
械临机构备
大连大学附属新华医院
25
械临机构备
沈阳兴齐眼科医院
26
械临机构备
鞍钢集团公司总医院
械临机构备
赤峰市医院
辽宁省:27个
1
械临机构备
大连医科大学附属第二医院
2
械临机构备
辽宁中医药大学附属第二医院
3
械临机构备
锦州医科大学附属第一医院
4
械临机构备
大连大学附属中山医院
5
械临机构备
大连医科大学附属第一医院
6
械临机构备
沈阳市骨科医院
7
械临机构备
中国医科大学附属第一医院
8
械临机构备
沈阳爱尔眼视光医院
临床试验机构职责医疗器械

临床试验机构职责(医疗器械)
1目的:明确我院临床试验机构在医疗器械临床试验中的职责,规范其运行管理模式。
2范围:适用于本临床试验机构。
3内容:
3.1组织研究者承担医疗器械临床试验项目,包括国家市场监督管理总局批准的项目及对上市医疗器械的临床再评价项目。
3.2开展医疗器械临床试验咨询及信息交流。
3.3组织机构管理人员与医疗器械临床试验专业研究者的培训及经验交流。
3.4确保医疗器械临床试验遵循《医疗器械临床试验质量管理规范》进行。
试验前对所申请的项目进行审批并签署协议;试验中对项目进行监督质控;试验结束后对总结报告进行审核,相关材料验收归档。
3.5负责参加医疗器械临床试验的各科室的工作协调,做到职责明确,相互配合。
3.6接受严重不良事件报告,协调医疗器械临床试验专业组对受试者进行及时适宜的医疗处理,并协同伦理委员会在规定时间内上报相关部门。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械临床试验机构汇总表
日期:2014-02-10 浏览次数:2216 字号:[ 大中小 ] 视力保护色:
医疗器械临床试验机构汇总表说明
(仅供参考,如有差错以原文为准)
《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)第二十一条“承担医疗器械临床试验的医疗机构,是指经过国务院食品药品监督管理部门会同国务院卫生行政部门认定的药品临床试验
基地”。
附件《医疗器械临床试验机构汇总表》系国家食品药品监督管理局药物临床试验机构资格认定公告及复核检查公告的收集汇编。
根据国家食品药品监督管理局关于印发《药物临床试验机构资格认定办法(试行)》的通知(国食药监安[2004]44号)文件规定:对已取得药物临床试验机构资格的医疗机构每3年进行一次资格认
定复核检查,对复核检查不合格的医疗机构,取消其药物临床试验机构的资格并予以公告。
选择临床试验机构是请注意该机构的资质是否有效。
附件:医疗器械临床试验机构汇总表.xls。
