BE豁免指导原则
总局关于发布人体生物等效性试验豁免指导原则的通告(2016

总局关于发布人体生物等效性试验豁免指导原则的通告(2016年第87号)2016年05月19日发布为规范仿制药质量和疗效一致性评价工作,根据《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)的有关要求,国家食品药品监督管理总局组织制定了《人体生物等效性试验豁免指导原则》,现予发布。
特此通告。
附件:人体生物等效性试验豁免指导原则食品药品监管总局2016年5月18日附件人体生物等效性试验豁免指导原则本指导原则适用于仿制药质量和疗效一致性评价中口服固体常释制剂申请生物等效性(Bioequivalence)豁免。
该指导原则是基于国际公认的生物药剂学分类系统(Biopharmaceutics Classification System,以下简称BCS)起草。
一、药物BCS分类BCS系统是按照药物的水溶性和肠道渗透性对其进行分类的一个科学架构。
当涉及到口服固体常释制剂中活性药物成分(Active Pharmaceutical Ingredient,以下简称API)在体内吸收速度和程度时,BCS系统主要考虑以下三个关键因素,即:药物溶解性(Solubility)、肠道渗透性(Intestinal permeability)和制剂溶出度(Dissolution)。
(一)溶解性溶解性分类根据申请生物等效豁免制剂的最高剂量而界定。
当单次给药的最高剂量对应的API在体积为250ml(或更少)、pH值在1.0—6.8范围内的水溶性介质中完全溶解,则可认为该药物为高溶解性。
250ml的量来源于标准的生物等效性研究中受试者用于服药的一杯水的量。
(二)渗透性渗透性分类与API在人体内的吸收程度间接相关(指吸收剂量的分数,而不是全身的生物利用度),与API在人体肠道膜间质量转移速率直接相关,或者也可以考虑其他可以用来预测药物在体内吸收程度的非人体系统(如使用原位动物、体外上皮细胞培养等方法)对渗透性进行分类。
以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中关于多规格豁免BE药学

BE“”原国家食品药品监督管理总局于2016年3月发布了《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,该指导原则提出:对于多规格口服固体制剂(如,常释制剂:片剂和胶囊,调释制剂:肠溶片、缓释片剂、缓释胶囊等),可以基于其中某一规格(通常建议为最高规格)的人体生物等效性试验结果,采用体外药学评价的方法豁免其他规格人体生物等效性研究。
药学评价方法包括:1)各规格制剂在不同pH介质中体外溶出曲线相似;2)各规格制剂的处方比例相似。
其中处方比例相似是指以下两种情况:1)不同规格之间所有活性和非活性组分组成比例相似。
2)对于高活性的药物(原料药在制剂中所占重量比例低):①不同规格的制剂重量一致(差异不超过10%);②各规格使用相同的非活性组分;③规格的变更系通过改变活性组分的用量以及一个或多个非活性组分的用量来实现。
为更好的指导企业进行仿制药的开发,降低研发成本,提高研发效率,现对该指导原则中的“处方比例相似性”的相关问题进行解读。
一、“不同规格”、“各规格”的具体所指?答:“不同规格”、“各规格”是指仿制药拟豁免规格与仿制药BE规格相比。
二、“组成比例相似”如何理解?答:对于常释制剂:“组成比例相似”包括以下情况:①不同规格之间所有非活性和活性组分组成比例完全相同;②不同规格之间所有非活性成分和活性成份比例基本相同,即在处方等比放大或缩小的基础上,不同规格之间非活性成分的变化幅度在《已上市化学药品变更研究的技术指导原则(试行)》辅料用量变更中的普通口服固体制剂中等变更允许的范围内;③不同规格之间非活性成分和活性成分的比例不相似,如申请人申请豁免,应提供可视为处方相似的充分理由,监管机构在审评期间进行综合评估。
[8]对于调释制剂:“组成比例相似”包括以下情况:①不同规格之间所有非活性成分与活性成份的比例完全相同;②不同规格之间非活性成分与活性成分的比例不完全相同,如申请人申请豁免,应证明比例是合理的,且与产品的药物释放机制相适应。
BE豁免指导原则

人体生物等效性试验豁免指导原则本指导原则适用于仿制药质量和疗效一致性评价中口服固体常释制剂申请生物等效性(Bioequivalence)豁免.该指导原则是基于国际公认的生物药剂学分类系统(Biopharmaceutics Classification System,以下简称BCS)起草。
一、药物BCS分类BCS系统是按照药物的水溶性和肠道渗透性对其进行分类的一个科学架构。
当涉及到口服固体常释制剂中活性药物成分(Active Pharmaceutical Ingredient,以下简称API)在体内吸收速度和程度时,BCS系统主要考虑以下三个关键因素,即:药物溶解性(Solubility)、肠道渗透性(Intestinal permeability)和制剂溶出度(Dissolution)。
(一)溶解性溶解性分类根据申请生物等效豁免制剂的最高剂量而界定。
当单次给药的最高剂量对应的API在体积为250ml(或更少)、pH值在1.0—6。
8范围内的水溶性介质中完全溶解,则可认为该药物为高溶解性。
250ml 的量来源于标准的生物等效性研究中受试者用于服药的一杯水的量。
(二)渗透性渗透性分类与API在人体内的吸收程度间接相关(指吸收剂量的分数,而不是全身的生物利用度),与API在人体肠道膜间质量转移速率直接相关,或者也可以考虑其他可以用来预测药物在体内吸收程度的非人体系统(如使用原位动物、体外上皮细胞培养等方法)对渗透性进行分类。
当一个口服药物采用质量平衡测定的结果或是相对于静脉注射的参照剂量,显示在体内的吸收程度≥85%以上(并且有证据证明药物在胃肠道稳定性良好),则可说明该药物具有高渗透性。
(三)溶出度口服固体常释制剂具有快速溶出的定义是:采用中国药典2015版附录通则(0931)方法1 (篮法),转速为每分钟100转,或是方法2(桨法),转速为每分钟50或75转,溶出介质体积为500ml(或更少),在溶出介质:(1)0.1mol/L HCl或是不含酶的模拟胃液;(2)pH4。
人体生物等效性试验豁免指导原则

附件人体生物等效性试验豁免指导原则本指导原则适用于仿制药质量和疗效一致性评价中口服固体常释制剂申请生物等效性(Bioequivalence)豁免。
该指导原则是基于国际公认的生物药剂学分类系统(Biopharmaceutics Classification System,以下简称BCS)起草。
一、药物BCS分类BCS系统是按照药物的水溶性和肠道渗透性对其进行分类的一个科学架构。
当涉及到口服固体常释制剂中活性药物成分(Active Pharmaceutical Ingredient,以下简称API)在体内吸收速度和程度时,BCS系统主要考虑以下三个关键因素,即:药物溶解性(Solubility)、肠道渗透性(Intestinal permeability)和制剂溶出度(Dissolution)。
(一)溶解性溶解性分类根据申请生物等效豁免制剂的最高剂量而界定。
当单次给药的最高剂量对应的API在体积为250ml(或更少)、pH值在1.0—6.8范围内的水溶性介质中完全溶解,则可认为该药物为高溶解性。
250ml的量来源于标准的生物等效性研究中受试者用于服药的一杯水的量。
(二)渗透性渗透性分类与API在人体内的吸收程度间接相关(指吸收剂量的分数,而不是全身的生物利用度),与API在人体肠道膜间质量转移速率直接相关,或者也可以考虑其他可以用来预测药物在体内吸收程度的非人体系统(如使用原位动物、体外上皮细胞培养等方法)对渗透性进行分类。
当一个口服药物采用质量平衡测定的结果或是相对于静脉注射的参照剂量,显示在体内的吸收程度≥85%以上(并且有证据证明药物在胃肠道稳定性良好),则可说明该药物具有高渗透性。
(三)溶出度口服固体常释制剂具有快速溶出的定义是:采用中国药典2015版附录通则(0931)方法1 (篮法),转速为每分钟100转,或是方法2(桨法),转速为每分钟50或75转,溶出介质体积为500ml(或更少),在溶出介质:(1)0.1mol/L HCl或是不含酶的模拟胃液;(2)pH4.5缓冲介质;(3)pH6.8缓冲介质或是不含酶的模拟肠液中,30分钟内API的溶出均能达到标示量的85%以上。
豁免药物临床试验的技术指导原则

豁免药物临床试验的技术指导原则
1.定义豁免试验:豁免试验是指不需要进行安慰剂对照的药物临床试验,通常是因为该药物已经被证明具有显著的临床效果或者存在其他特定的原因。
2. 确定豁免试验的范围:豁免试验适用于哪些药物、哪些临床试验阶段以及哪些病种或疾病类型需要进行豁免等。
3. 确定豁免试验的设计:包括研究对象、研究设计、研究方案和研究终点等方面的设计。
4. 确定豁免试验的评估标准:包括药物安全性、药效以及其他需要评估的指标等。
5. 如何建立豁免试验的数据质量保证机制:包括数据管理、监测和分析等方面的机制建立。
6. 如何进行豁免试验的伦理审查:包括如何进行知情同意书的签署、如何确保试验的伦理合规性等方面的审查。
7. 如何进行豁免试验的报告和出版:包括研究结果的汇报、研究数据的公开等方面的报告和出版。
以上便是《豁免药物临床试验的技术指导原则》的内容。
- 1 -。
可豁免或简化人体生物等效性试验
0.2g
15
利奈唑胺片
0.6g
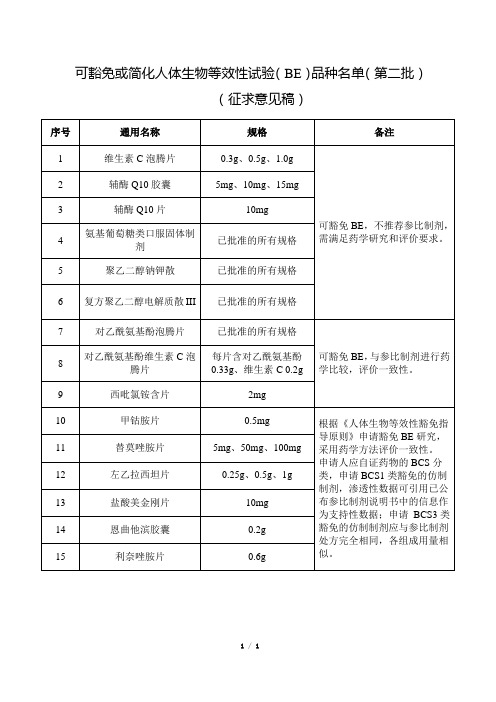
申请人应自证药物的BCS分类,申请BCS1类豁免的仿制制剂,渗透性数据可引用已公布参比制剂说明书中的信息作为支持性数据;申请BCS3类豁免的仿制制剂应与参比制剂处方完全相同,各组成用量相似。
11
替莫唑胺片
5mg、50mg、100mg
12
左乙拉西坦片
10mg
14
已批准的所有规格
6
复方聚乙二醇电解质散III
已批准的所有规格
7
对乙酰氨基酚泡腾片
已批准的所有规格
可豁免BE,与参比制剂进行药学比较,评价一致性。
8
对乙酰氨基酚维生素C泡腾片
每片含对乙酰氨基酚0.33g、维生素C0.2g
9
西吡氯铵含片
2mg
10
甲钴胺片
0.5mg
根据《人体生物等效性豁免指导原则》申请豁免BE研究,采用药学方法评价一致性。
可豁免或简化人体生物等效性试验(BE)品种名单(第二批)
(征求意见稿)
序号
通用名称
规格
备注
1
维生素C泡腾片
0.3g、0.5g、1.0g
可豁免BE,不推荐参比制剂,需满足药学研究和评价要求。
2
辅酶Q10胶囊
5mg、10mg、15mg
3
辅酶Q10片
10mg
4
氨基葡萄糖类口服固体制剂
已批准的所有规格
5
聚乙二醇钠钾散
人体生物等效性试验豁免指导原则

人体生物等效性试验豁免指导原则集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)附件人体生物等效性试验豁免指导原则本指导原则适用于仿制药质量和疗效一致性评价中口服固体常释制剂申请生物等效性(Bioequivalence)豁免。
该指导原则是基于国际公认的生物药剂学分类系统(Biopharmaceutics Classification System,以下简称BCS)起草。
一、药物BCS分类BCS系统是按照药物的水溶性和肠道渗透性对其进行分类的一个科学架构。
当涉及到口服固体常释制剂中活性药物成分(Active Pharmaceutical Ingredient,以下简称API)在体内吸收速度和程度时,BCS系统主要考虑以下三个关键因素,即:药物溶解性(Solubility)、肠道渗透性(Intestinal permeability)和制剂溶出度(Dissolution)。
(一)溶解性溶解性分类根据申请生物等效豁免制剂的最高剂量而界定。
当单次给药的最高剂量对应的API在体积为250ml(或更少)、pH值在1.0—6.8范围内的水溶性介质中完全溶解,则可认为该药物为高溶解性。
250ml的量来源于标准的生物等效性研究中受试者用于服药的一杯水的量。
(二)渗透性渗透性分类与API在人体内的吸收程度间接相关(指吸收剂量的分数,而不是全身的生物利用度),与API在人体肠道膜间质量转移速率直接相关,或者也可以考虑其他可以用来预测药物在体内吸收程度的非人体系统(如使用原位动物、体外上皮细胞培养等方法)对渗透性进行分类。
当一个口服药物采用质量平衡测定的结果或是相对于静脉注射的参照剂量,显示在体内的吸收程度≥85%以上(并且有证据证明药物在胃肠道稳定性良好),则可说明该药物具有高渗透性。
(三)溶出度口服固体常释制剂具有快速溶出的定义是:采用中国药典2015版附录通则(0931)方法1 (篮法),转速为每分钟100转,或是方法2(桨法),转速为每分钟50或75转,溶出介质体积为500ml(或更少),在溶出介质:(1)0.1mol/L HCl或是不含酶的模拟胃液;(2)pH4.5缓冲介质;(3)pH6.8缓冲介质或是不含酶的模拟肠液中,30分钟内API的溶出均能达到标示量的85%以上。
仿制药质量一致性评价中的生物豁免

l A Comparative Analysis of Biopharmaceutics Classification System and Biopharmaceutics Drug Disposition Classification System: A Cross-Sectional Survey
Ø 一定时间(30min)内在胃并不会被吸收 Ø 即使30min内释放有差别,依然可
以认为体内暴露水平会一致
基于BCS分类的生物豁免
豁免标准
Ø 口服固体常释,BCS分类1类和3类
– 体内溶出相对于胃排空时间快
Ø 前提
– 辅料成分不显著影响API的吸收 – 肠道稳定,吸附可以忽略
50% 40%
50% 40%
巴西 西班牙
30% 20% 16% 15% 10%
21%
25% 25%
14% 10%
8%
0% BCS I
BCS II BCS III BCS IV
总体
1、总体不等效概率 25% 2、BCS III不等效风险最低 3、 BCS I 不等效风险其次 4、BCSII不等效风险最高
9
不等效概率
例外1:辅料和BE
背景
Ø 颗粒剂,BCS分类III Ø 年销售额4个亿,80%的药店终端市场 Ø 蔗糖被甘露醇代替
• 有效性从24个月延长为36个月 • 口感更好
Ø 预试验,空腹 Ø 单次给药、交叉试验设计 Ø N=8
现象
Ø AUC降低80%
分析:
Ø 甘露醇可能会降低BCSIII类药的利用程度
2017/4/5
仿制药质量一致性评价中的生物豁免
中国药科大学 杨劲
人体生物等效性试验豁免指导原则:国际通则
大小规格be豁免 溶出曲线比较

大小规格be豁免溶出曲线比较1. 任务背景在药物研发和生产过程中,溶出曲线比较是一项重要的质量控制指标。
通过比较不同规格或大小的相同药物溶出曲线,可以评估药物的释放速率和特性是否一致,从而确保产品的质量和安全性。
本文将介绍大小规格be豁免溶出曲线比较的相关概念、方法和意义,以及在药物研发和生产中的应用。
2. 溶出曲线比较的概念和方法2.1 溶出曲线溶出曲线是用来描述药物在体外环境中的释放速率的曲线。
通常使用溶出试验来获取药物的溶出曲线数据。
溶出试验模拟了体内环境,通过浸泡药物样品,在特定条件下测量药物的溶出速率。
2.2 溶出曲线比较溶出曲线比较是一种比较不同样品的溶出曲线的方法。
在药物研发和生产中,常常需要比较不同规格或大小的相同药物的溶出曲线,以评估它们的相似性和一致性。
2.3 比较方法常用的溶出曲线比较方法包括统计分析和图形比较。
2.3.1 统计分析统计分析方法可以通过计算药物样品之间的差异来评估它们的相似性。
常用的统计分析方法包括t检验、方差分析和相关性分析等。
2.3.2 图形比较图形比较方法通过将不同样品的溶出曲线绘制在同一张图上,直观地比较它们的形状和趋势。
常用的图形比较方法包括折线图和散点图等。
3. 大小规格be豁免3.1 大小规格be豁免的概念大小规格be豁免是指在某些情况下,根据科学合理性和经验判断,可以豁免不同规格或大小的相同药物的溶出曲线比较。
这是为了减少不必要的重复试验和成本,同时确保产品质量和安全性。
3.2 豁免的条件和要求大小规格be豁免需要满足以下条件和要求:•产品的药物成分和制剂工艺必须相同;•药物的溶出速率必须在一定范围内;•药物的溶出曲线在一定时间内必须保持一致。
3.3 豁免的意义和应用大小规格be豁免的意义在于提高药物研发和生产的效率和效益。
通过豁免溶出曲线比较,可以节省时间和资源,减少重复试验的工作量,加快产品上市速度。
在药物研发过程中,大小规格be豁免可以用于同一药物不同规格的剂型开发。
CDE解读:豁免BE

CDE解读:豁免BE根据原国家食品药品监督管理总局2016年发布的《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,若湎足一定条件可允许豁免部分规格的生物等效性试验,并分常释和调释制剂2种情况进行说明。
首先,对于常释片剂和胶囊,一般采用申报的最高规格进行单次给药的空腹及餐后BE研究,若同时满足以下条件,其他规格制剂的生物等效性试验可豁免:①试验规格制剂符合生物等效性要求。
②各规格制剂在不同PH介质中体外溶出曲线相似。
③各规格制剂的处方比例相似,对于制剂处方比例相似的要求与FDA基本一致,包括不同规格之间组成比例相似、高活性药物(原料药占制剂重量比例低)的情况。
其次,对于调释制剂,一般采用申报的最高规格进行单次给药的空腹及餐后BE研究,若以下条件全部满足,则可以认为调释制剂的其他规格与相应规格的参比制剂具有生物等效性:①其他规格制剂的活性和非活性组分组成比例与试验规格的受试制剂相似。
②其他规格制剂的释药原理与试验规格的受试制剂相同。
③各规格制剂体外溶出试验结果相似。
同时建议至少在3种不同PH溶媒(例如PH1.2,4.5和6.8)中通过f2值判断其他规格的溶出曲线与BE研究中受试制剂溶出曲线的相似性。
除上述指导原则外,原国家食品药品监督管理总局2015年发布的《普通口服固体制剂溶出度试验技术指导原则》,也对规格豁免的情况进行了简单说明:对于多规格药品,当药物具有线性动力学的特点且不同剂量规格药品处方组成比例相似时,可对最大剂量规格的药品开展BE研究,基于充分的溶出度比较试验,可以豁免小剂量规格药品的体内研究。
处方组成比例相似性的判定可参见《己上市化学药品变更研究技术指导原则》中“变更药品处方中已有药用要求的辅料”项下的相应内容。
需要说明的是,与FDA/EMA不同,国内尚未有特定药物的生物等效性指南发布。
中国食品药品检定研究院于2017年对EMA和FDA《特定药物的生物等效性指导原则》的有关内容开展了翻译工作并公布在官网,以期对我国正在开展的仿制药质量与疗效一致性评价工作起到借鉴和指导作用。
人体生物等效性试验豁免指导原则

附件人体生物等效性试验豁免指导原则本指导原则适用于仿制药质量和疗效一致性评价中口服固体常释制剂申请生物等效性(Bioequivalence)豁免。
该指导原则是基于国际公认的生物药剂学分类系统(Biopharmaceutics Classification System,以下简称BCS)起草。
一、药物BCS分类BCS系统是按照药物的水溶性和肠道渗透性对其进行分类的一个科学架构。
当涉及到口服固体常释制剂中活性药物成分(Active Pharmaceutical Ingredient,以下简称API)在体内吸收速度和程度时,BCS系统主要考虑以下三个关键因素,即:药物溶解性(Solubility)、肠道渗透性(Intestinal permeability)和制剂溶出度(Dissolution)。
(一)溶解性溶解性分类根据申请生物等效豁免制剂的最高剂量而界定。
当单次给药的最高剂量对应的API在体积为250ml(或更少)、pH值在1.0—6.8范围内的水溶性介质中完全溶解,则可认为该药物为高溶解性。
250ml的量来源于标准的生物等效性研究中受试者用于服药的一杯水的量。
(二)渗透性渗透性分类与API在人体内的吸收程度间接相关(指吸收剂量的分数,而不是全身的生物利用度),与API在人体肠道膜间质量转移速率直接相关,或者也可以考虑其他可以用来预测药物在体内吸收程度的非人体系统(如使用原位动物、体外上皮细胞培养等方法)对渗透性进行分类。
当一个口服药物采用质量平衡测定的结果或是相对于静脉注射的参照剂量,显示在体内的吸收程度≥85%以上(并且有证据证明药物在胃肠道稳定性良好),则可说明该药物具有高渗透性。
(三)溶出度口服固体常释制剂具有快速溶出的定义是:采用中国药典2015版附录通则(0931)方法1 (篮法),转速为每分钟100转,或是方法2(桨法),转速为每分钟50或75转,溶出介质体积为500ml (或更少),在溶出介质:(1)0.1mol/L HCl或是不含酶的模拟胃液;(2)pH4.5缓冲介质;(3)pH6.8缓冲介质或是不含酶的模拟肠液中,30分钟内API的溶出均能达到标示量的85%以上。
人体生物等效性试验豁免指导原则()

质量转移速率直接相关,或者也可以考虑其他可以用来预测药物 在体内吸收程度的非人体系统(如使用原位动物、体外上皮细胞 培养等方法)对渗透性进行分类。当一个口服药物采用质量平衡 测定的结果或是相对于静脉注射的参照剂量,显示在体内的吸收 程度≥85%以上(并且有证据证明药物在胃肠道稳定性良好),则 可说明该药物具有高渗透性。
—5——
(2)口腔吸收制剂 由于 BCS 分类是基于胃肠粘膜的渗透和吸收,因此不适用 于口腔吸收制剂,如:类似舌下片或颊下片的制剂。对于口含片、 口腔崩解片等,如果该制剂从口腔吸收也不适用。 三、申请生物等效豁免应提供的资料 (一)高溶解性的数据支持(或文献资料) 1.测定方法的描述,包括分析方法和缓冲溶液的组成信息。 2.原料药的化学结构,分子量,性质(酸、碱、两性或中性) 和解离常数(pKa)。 3.测试结果(平均值、标准偏差、变异系数)以表格的形式 汇总,不同 pH 溶液、药物溶解度(如 mg/ml)以及溶解最大规 格需要的介质体积。 4.pH-溶解度的曲线图 (二)高渗透性的数据支持(或文献资料) 1.测定方法的描述,包括分析方法和缓冲溶液的组成。 2.人体药物代谢动力学研究(PK),包括设计方案和 PK 数 据对应的方法。 3.对于直接渗透性研究方法,需要说明所用方法的适用性, 包括研究方案的描述,受试者、动物和上皮细胞系的选择标准, 供体液里的药物浓度,分析方法的描述,计算吸收程度或渗透性 的方法等信息。 4.选择的模型药物的清单,应包含以下数据:说明研究方法
在选定的缓冲介质中,应该使用经过验证的含量测定方法测 定 API 的浓度,并能区分 API 和其降解产物。若观察到原料药的 降解是缓冲液成分或者 pH 值造成的,则也应该提交胃肠道稳定性 研究部分的稳定性数据。根据测量在 pH 值 1.0—6.8 范围内水溶性 缓冲介质中药物溶解的最高剂量来确定药物的溶解度类别。当某 种药物的最大剂量能在 pH 值 1.0—6.8 的范围内、完全溶解在小于 250ml 的水溶性缓冲介质中,可认为该药物是高溶解性的。
豁免药物临床试验的技术指导原则

豁免药物临床试验的技术指导原则
一、药物研发阶段临床试验设计要符合国家相关规定,确保实验的合法性和安全性。
二、在药物临床试验前,需要对受试者进行全面的评估和筛选,确保其身体健康状况和生理功能正常,以降低实验风险。
三、在实验过程中,需要严格按照试验方案进行操作,记录受试者的生理指标和药物应用情况,及时发现并处理异常情况。
四、在实验结束后,需要对试验数据进行统计和分析,评估药物的安全性和有效性,并及时向相关部门汇报试验结果。
五、对于特殊人群,如孕妇、儿童、老年人等,需要特别关注其安全性和实验效果,制定相应的试验方案和流程。
六、在实验过程中,需要对受试者进行充分的知情同意,保护其合法权益,确保试验的道德合理性。
- 1 -。
可豁免或简化人体生物等效性
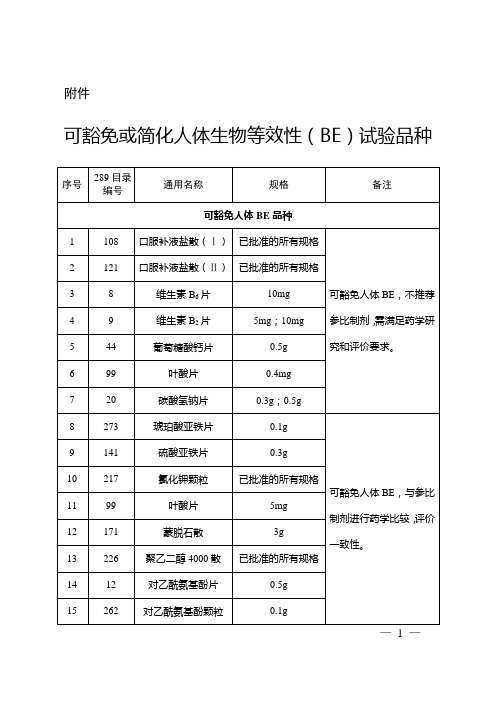
124
枸橼酸铋钾胶囊
0.3g/0.11g铋
48
195
枸橼酸铋钾片
0.3g/0.11g铋
附件
可豁免或简化人体生物等效性(BE)试验品种
序号
289目录
编号
通用名称
规格
备注
可豁免人体BE品种
1
108
口服补液盐散(Ⅰ)
已批准的所有规格
可豁免人体BE,不推荐参比制剂,需满足药学研究和评价要求。
2
121
口服补液盐散(Ⅱ)
已批准的所有规格
3
8
维生素B6片
10mg
4
9
维生素B2片
5mg;10mg
5
44
104
磷酸氯喹片
250mg
27
48
盐酸多西环素片
50mg;100mg
28
288
拉米夫定片
已批准的所有规格
29
53
盐酸雷尼替丁片
0.15g
30
10
盐酸雷尼替丁胶囊
0.15g
31
51
阿替洛尔片
25mg;50mg
32
6
异烟肼片
100mg;300mg
可简化人体BE品种
33
106
替硝唑片
0.5g
可豁免空腹BE研究。
42
211
硫唑嘌呤片
50mg;100mg
43
289
依非韦伦片
50mg;200mg;600mg
44
1
复方磺胺甲噁唑片
100mg:20mg
400mg:80mg
45
31
磺胺嘧啶片
0.2g;0.5g
重磅!BE试验机构正式实行备案制!

重磅!BE试验机构正式实行备案制!总局发布发一致性评价相关公告,为做好仿制药质量和疗效一致性评价工作(以下简称一致性评价),现就有关事宜公告如下:一、为便于企业选择参比制剂,国家食品药品监督管理总局将把《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》(2016年第106号)所附289个品种的原研企业药品列出清单并向社会公布,供企业选择参比制剂时参考。
清单分为已在中国境内上市和未在中国境内上市两类。
建议企业按以下顺序选择其一作为参比制剂备案:(一)原研药品:进口原研药品、经审核确定的原研企业在中国境内生产上市的药品、未进口原研药品;(二)在原研企业停止生产的情况下,可选择美国、日本或欧盟获准上市并获得参比制剂地位的药品。
对国家食品药品监督管理总局已公布的参比制剂,建议企业按照公布的参比制剂开展研究,未备案的无需再备案;对已公布的参比制剂存疑的,可向国家食品药品监督管理总局药品审评中心提出异议并说明理由,国家食品药品监督管理总局召开专家咨询委员会会议公开审议,并公开审议结果。
二、企业报国家食品药品监督管理总局备案的参比制剂全部向社会公开。
对国家食品药品监督管理总局未公布参比制剂的品种,由国家食品药品监督管理总局组织专家咨询委员会讨论后区别情况提出如下指导性意见:(一)可以确认符合参比制剂条件的;(二)存疑的;(三)明显不符合条件的。
对于(二)(三)两种情况是否继续进行研究或重新选择参比制剂,由企业自主决定并承担相应的责任。
三、企业自行从境外采购的参比制剂产品,在提交一致性评价资料时需提供购买凭证、产品包装及说明书等材料,或以其他适当方法证明所用参比制剂是标明企业的产品。
企业发现所使用的参比制剂产品为假冒产品的,应终止正在进行的研究工作,已申报的,应及时向国家食品药品监督管理总局药品审评中心报告并撤回一致性评价申请,视情况免于责任;监管部门发现企业使用的参比制剂产品为假冒产品的,应及时通报相关企业,终止审评审批;已批准上市的要撤销批准文件并向社会公开信息,责成企业作出解释并根据情况立案调查。
人体生物等效豁免技术指导原则

人体生物等效豁免技术指导原则人体生物等效豁免技术指导原则,是指在一些特定情况下,可以将不同物质或技术视为等效的原则。
这些原则提供了一种灵活的方式,使相关机构能够评估和处理生物等效问题。
以下是关于人体生物等效豁免技术指导原则的详细内容:1.根据相似性:人体生物等效豁免技术指导原则的核心原则是根据相似性来确定是否可以将不同物质或技术视为等效。
相似性的评估可以从多个方面进行,包括化学成分、制备方法、质量控制标准等。
2.临床数据支持:人体生物等效豁免技术指导原则要求在评估生物等效性时,必须依据临床数据进行支持。
这些数据可以包括安全性、药代动力学和药效学等方面的数据。
这些数据可以证明两个物质或技术在人体内的作用机制和效果是相似的。
3.质量控制:人体生物等效豁免技术指导原则要求对生物等效技术进行严格的质量控制。
这包括对原料的选择、制备过程的监控和产品的质量检测等方面。
这些措施可以确保等效技术的质量和稳定性。
4.安全性评估:人体生物等效豁免技术指导原则要求对生物等效技术的安全性进行评估。
这包括对潜在的毒性和不良反应进行评价,并确保等效技术的使用是安全可靠的。
6.监测和追踪:人体生物等效豁免技术指导原则要求建立健全的监测和追踪系统,对使用等效技术的患者进行监测和追踪。
这可以帮助评估等效技术的疗效和安全性,及时发现和解决潜在的问题。
综上所述,人体生物等效豁免技术指导原则提供了一种灵活的方式,使相关机构能够根据相似性和临床数据评估生物等效问题。
它的实施需要严格的质量控制、安全性评估、合规性审核和监测追踪。
只有在符合相关法规和规定的前提下,经过审批和审核程序的等效技术才能被应用于临床实践中。
豁免药物临床试验的技术指导原则

豁免药物临床试验的技术指导原则
豁免药物临床试验是指一些特定情况下,药物厂商可据此申请免除一些常规的临床试验步骤,加快该药物上市的进程。
本篇文章将对豁免药物临床试验的技术指导原则进行详细阐述。
1. 确认豁免条件
药物厂商必须在早期尽早确认自己的实际情况是否符合豁免药物临床试验的条件。
其中,豁免条件包括但不限于:新药物与现有药物相似度高、针对少数患者的药物(罕见病等)、重大医学需要等。
2. 提供客观证据
申请豁免药物临床试验需要提供充分的客观证据,证明该药物符合豁免条件。
可提供的证据包括:既往研究的临床试验结果,文献、专业咨询机构的专家意见等。
3. 可行性分析
在准备申请豁免药物临床试验前,药物厂商必须进行可行性分析,避免给审批过程带来多余的麻烦。
对于可能受到审计人员质疑的地方,药物厂商应准备充分的材料予以解答。
4. 对审批流程做好充分准备
药物厂商需妥善准备审批所需的材料,以便在审批过程中能够满足相关要求。
在提供所需材料前,厂商需先进行内部技术备案,确保材料的正确性和可靠性。
5. 合规管理
对于豁免药物临床试验申请得以批准的药物,药物厂商必须严格遵守豁免条件,并对药物的临床使用过程进行监测。
针对药物异常的反应和意外效应,药物生产商应及时与当地的监管机构进行沟通,充分了解其对药物使用的进一步指导。
总结:申请豁免药物临床试验需要符合某些具体条件,同时还需要药物制造商充分准备和提供相关材料,符合审评部门的要求。
在药物生产中,药物厂商应严格遵守相关规定,及时反馈药物异常反应,以确保药物安全有效。
(完整word版)160519人体生物等效性试验豁免指导原则(2016年第87号通告附件)

附件人体生物等效性试验豁免指导原则本指导原则适用于仿制药质量和疗效一致性评价中口服固体常释制剂申请生物等效性(Bioequivalence)豁免。
该指导原则是基于国际公认的生物药剂学分类系统(Biopharmaceutics Classification System,以下简称BCS)起草。
一、药物BCS分类BCS系统是按照药物的水溶性和肠道渗透性对其进行分类的一个科学架构。
当涉及到口服固体常释制剂中活性药物成分(Active Pharmaceutical Ingredient,以下简称API)在体内吸收速度和程度时,BCS系统主要考虑以下三个关键因素,即:药物溶解性(Solubility)、肠道渗透性(Intestinal permeability)和制剂溶出度(Dissolution)。
(一)溶解性溶解性分类根据申请生物等效豁免制剂的最高剂量而界定。
当单次给药的最高剂量对应的API在体积为250ml(或更少)、pH值在1.0—6.8范围内的水溶性介质中完全溶解,则可认为该药物为高溶解性。
250ml的量来源于标准的生物等效性研究中受试者用于服药的一杯水的量。
(二)渗透性渗透性分类与API在人体内的吸收程度间接相关(指吸收剂量的分数,而不是全身的生物利用度),与API在人体肠道膜间质量转移速率直接相关,或者也可以考虑其他可以用来预测药物在体内吸收程度的非人体系统(如使用原位动物、体外上皮细胞培养等方法)对渗透性进行分类。
当一个口服药物采用质量平衡测定的结果或是相对于静脉注射的参照剂量,显示在体内的吸收程度≥85%以上(并且有证据证明药物在胃肠道稳定性良好),则可说明该药物具有高渗透性。
(三)溶出度口服固体常释制剂具有快速溶出的定义是:采用中国药典2015版附录通则(0931)方法1 (篮法),转速为每分钟100转,或是方法2(桨法),转速为每分钟50或75转,溶出介质体积为500ml(或更少),在溶出介质:(1)0.1mol/L HCl或是不含酶的模拟胃液;(2)pH4.5缓冲介质;(3)pH6.8缓冲介质或是不含酶的模拟肠液中,30分钟内API的溶出均能达到标示量的85%以上。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人体生物等效性试验豁免指导原则本指导原则适用于仿制药质量和疗效一致性评价中口服固体常释制剂申请生物等效性(Bioequivalence)豁免。
该指导原则是基于国际公认的生物药剂学分类系统(Biopharmaceutics Classification System,以下简称BCS)起草。
一、药物BCS分类BCS系统是按照药物的水溶性和肠道渗透性对其进行分类的一个科学架构。
当涉及到口服固体常释制剂中活性药物成分(Active Pharmaceutical Ingredient,以下简称API)在体吸收速度和程度时,BCS系统主要考虑以下三个关键因素,即:药物溶解性(Solubility)、肠道渗透性(Intestinal permeability)和制剂溶出度(Dissolution)。
(一)溶解性溶解性分类根据申请生物等效豁免制剂的最高剂量而界定。
当单次给药的最高剂量对应的API在体积为250ml(或更少)、pH值在1.0—6.8围的水溶性介质中完全溶解,则可认为该药物为高溶解性。
250ml的量来源于标准的生物等效性研究中受试者用于服药的一杯水的量。
(二)渗透性渗透性分类与API在人体的吸收程度间接相关(指吸收剂量的分数,而不是全身的生物利用度),与API在人体肠道膜间质量转移速率直接相关,或者也可以考虑其他可以用来预测药物在体吸收程度的非人体系统(如使用原位动物、体外上皮细胞培养等方法)对渗透性进行分类。
当一个口服药物采用质量平衡测定的结果或是相对于静脉注射的参照剂量,显示在体的吸收程度≥85%以上(并且有证据证明药物在胃肠道稳定性良好),则可说明该药物具有高渗透性。
(三)溶出度口服固体常释制剂具有快速溶出的定义是:采用中国药典2015版附录通则(0931)方法1 (篮法),转速为每分钟100转,或是方法2(桨法),转速为每分钟50或75转,溶出介质体积为500ml(或更少),在溶出介质:(1)0.1mol/L HCl或是不含酶的模拟胃液;(2)pH4.5缓冲介质;(3)pH6.8缓冲介质或是不含酶的模拟肠液中,30分钟API的溶出均能达到标示量的85%以上。
口服固体常释制剂具有非常快速溶出的定义是:在上述条件下15分钟API的溶出均能达到标示量的85%以上。
根据BCS分类系统,药品被分为以下四类:第一类:高溶解性、高渗透性(High Solubility- High Permeability)第二类:低溶解性、高渗透性(Low Solubility-High Permeability)第三类:高溶解性、低渗透性(High Solubility-Low Permeability)第四类:低溶解性、低渗透性(Low Solubility-Low Permeability)当口服固体常释制剂在体的溶出相对于胃排空时间快或非常快,并且具有很高的溶解度时,药物的吸收速率和吸收程度就不会依赖于药物的溶出时间或在胃肠道的通过时间。
因此,在这种情况下,对于BCS 分类1类和3类的药物,只要处方中的其他辅料成分不显著影响API的吸收,则不必证明该药物在体生物利用度和生物等效的可能性,即生物等效性豁免。
二、基于BCS的生物等效豁免(一)对于BCS 1类的药物需要证明以下几点:1.药物具有高溶解性;2.药物具有高渗透性;3.仿制和参比制剂均为快速溶出,并且制剂中不含有影响主药成分吸收速率和吸收程度的任何辅料。
(二)对于BCS 3类的药物需要证明以下几点:1.药物具有高溶解性;2.仿制和参比制剂均具有非常快速的溶出;3.仿制制剂和参比制剂应处方完全相同,各组成用量相似,当放大生产和上市后变更时,制剂处方也应完全相同。
对于上市后变更的有关要求参见《已上市化学药品变更研究的技术指导原则(一)》相关容。
(三)对于处方相同,活性成分及辅料成相似比例的不同规格同种样品,通常高剂量规格已做过BE试验的,低剂量规格可申请免做BE试验,有些品种由于安全性等原因,可选择较低剂量规格进行体生物等效性试验,不同品种有所差异,具体选择要求参见《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》相关容。
(四)生物等效豁免申请的其他影响因素当一个口服固体常释制剂申请基于BCS分类的生物等效性豁免时,应注意以下因素可能影响生物等效豁免:1.辅料BCS1类药物:辅料有时候可能会影响药物的吸收速率和吸收程度。
一般来说使用国家食品药品监督管理总局已经批准的常释制剂常用辅料,对于BCS1类快速溶出的常释制剂的药物吸收速率和吸收程度不会有影响。
为了支持生物等效豁免,常释制剂中辅料的用量应该和该辅料在处方中对应的功能保持一致(比如润滑剂)。
当使用新的辅料,或者非常规的大量使用常释制剂常用辅料,要补充提交该辅料的使用没有影响制剂生物利用度的证明资料。
可以通过将简单的水溶液作为参比制剂来开展生物利用度研究。
大量使用特定的辅料,例如表面活性剂(如聚山梨醇酯80)和甜味剂(如甘露醇或山梨醇),可能会有问题。
BCS3类药物:该类药物和BCS1类药物不同,如果想要申请生物等效豁免,必须有更充分的科学依据。
BCS3类药物制剂必须与参比制剂含有相同的辅料组成。
这主要是考虑辅料可能对低渗透性药物的吸收影响更显著。
因此,仿制制剂的辅料种类必须与参比制剂完全相同,辅料的用量应与参比制剂相似或相同。
2.前药(Prodrugs)前药的渗透性通常取决于转化药物的机理和(解剖学上的)部位。
若药物前体-药物的转化主要表现在肠道膜渗透之后,则应测定该药物前体的渗透性。
若转化表现在肠道膜渗透之前,则应测定该药物的渗透性。
药物前体和药物的溶出、pH溶解度数据也应与之相关。
3.复方制剂当口服固体常释的复方制剂中各活性组分均为BCS1类药物,可按BCS1类药物要求申请生物豁免,但应证明各组分之间以及各组分与所有辅料之间没有药物代动力学相互作用,否则不能申请豁免。
当口服固体常释的复方制剂中各组分均为BCS3类药物或有BCS1类和BCS3药物,应按BCS3类药物要求申请生物豁免,除证明各组分之间无药物代动力学相互作用外,还应证明所有辅料为国家食品药品监督管理总局已经批准的常释制剂常用辅料。
4.基于BCS 的生物豁免对下列情况不适用:(1)治疗围狭窄的药品受治疗药物浓度或药效监控的制约,按狭窄的治疗围设计的制剂,不适用生物等效性豁免。
如:地高辛、锂制剂、苯妥英、茶碱和华法林阻凝剂。
(2)口腔吸收制剂由于BCS分类是基于胃肠粘膜的渗透和吸收,因此不适用于口腔吸收制剂,如:类似舌下片或颊下片的制剂。
对于口含片、口腔崩解片等,如果该制剂从口腔吸收也不适用。
三、申请生物等效豁免应提供的资料(一)高溶解性的数据支持(或文献资料)1.测定方法的描述,包括分析方法和缓冲溶液的组成信息。
2.原料药的化学结构,分子量,性质(酸、碱、两性或中性)和解离常数(pKa)。
3.测试结果(平均值、标准偏差、变异系数)以表格的形式汇总,不同pH溶液、药物溶解度(如mg/ml)以及溶解最大规格需要的介质体积。
4.pH-溶解度的曲线图(二)高渗透性的数据支持(或文献资料)1.测定方法的描述,包括分析方法和缓冲溶液的组成。
2.人体药物代动力学研究(PK),包括设计方案和PK数据对应的方法。
3.对于直接渗透性研究方法,需要说明所用方法的适用性,包括研究方案的描述,受试者、动物和上皮细胞系的选择标准,供体液里的药物浓度,分析方法的描述,计算吸收程度或渗透性的方法等信息。
4.选择的模型药物的清单,应包含以下数据:说明研究方法适用性的人体的吸收度数据(平均值、标准偏差、变异系数),每个模型药物的渗透率值(平均值、标准偏差、变异系数),每个模型药物的渗透性分类,并根据渗透性数据(平均值±标准偏差或95%置信区间)给吸收程度按照渗透性分类上下限和所选标作出标示。
支持一个被测原料药高渗透性的信息包括:被测原料药的渗透性数据、标(平均值、标准偏差、变异系数)和稳定性信息,适当的时候包括支持主动转运机制的数据,以及确定被测原料药的高渗透性的研究方法。
(三)快速、非常快速溶出和曲线相似性的数据支持1.测定方法的描述,包括分析方法和缓冲溶液的组成描述,溶出测定使用样品的信息,包括批号、有效期、规格、重量等。
2.按上述的推荐试验方法,使用12个单剂量仿制制剂和参比制剂所得到的溶出数据。
应报告独立被测单元在每个规定时间点的标示量溶出百分数。
应将平均溶出百分数、溶出围和变异系数(相对标准偏差)制表。
在三种溶出介质中的仿制制剂和参比制剂的平均溶出曲线也应作图表示出来。
3.应提供支持仿制制剂和参比制剂在这三种溶出介质中的溶出曲线相似性的数据,使用f2法进行判断的结果。
四、推荐的原料药分类方法和制剂溶出特性测定方法(一)确定药物(API)的溶解性分类决定药物的BCS分类首先是测定API在生理pH条件下的平衡溶解度。
原料药pH-溶解性曲线的测定应该在37℃±1℃,pH1.0—6.8的水溶性介质中测定,该曲线上的pH值选择应该有充足的点,并且是在1.0—6.8的围,其测定点的选择可以参照药物的解离常数,包括pKa、pKa+1、pKa-1,以及1.0和6.8这几个点。
测定溶解度时每个pH值条件至少要平行测定三次,为保证溶解度数据的准确可靠,可能还需要更多次的重复测定。
可采用特定的标准缓冲溶液作为溶剂,测定药物的溶解度。
如果特定的标准缓冲溶液对药物的理化性质有影响,也可以使用其他的缓冲介质。
当原料药加入到作为溶剂的缓冲溶液中,此时溶剂的pH值需要进行验证。
预测药物平衡溶解度的方法,除了传统的摇瓶法,也可以使用酸碱滴定法及其他方法,但应证明所用方法的合理性,并且有方法学数据的支持。
在选定的缓冲介质中,应该使用经过验证的含量测定方法测定API的浓度,并能区分API和其降解产物。
若观察到原料药的降解是缓冲液成分或者pH值造成的,则也应该提交胃肠道稳定性研究部分的稳定性数据。
根据测量在pH值1.0—6.8围水溶性缓冲介质中药物溶解的最高剂量来确定药物的溶解度类别。
当某种药物的最大剂量能在pH值1.0—6.8的围、完全溶解在小于250ml的水溶性缓冲介质中,可认为该药物是高溶解性的。
(二)确定药物(API)的渗透性分类API的渗透性分类可以通过受试者体试验确定,比如质量平衡或是绝对生物利用度,也可以通过肠道灌注法来测定。
推荐的不涉及人体受试者的方法包括:在合适的动物模型的体或原位肠道灌注、离体肠道组织的渗透性检测或者合适的单层上皮细胞的渗透性测定等。
在很多情况下(例如,绝对生物利用度等于或大于85%;等于或大于85%的药物以原型药的形式从尿液中排出等),单一的检测方法可能已足够充分。
当一个单一的渗透性检测不足以充分说明药物的渗透性类别时,建议采用两种不同的分析方法。
