免于进行临床试验的第三类医疗器械目录汇总
国家食品药品监管总局关于发布第三批免于进行临床试验医疗器械目

国家食品药品监管总局关于发布第三批免于进行临床试验医
疗器械目录的通告
【法规类别】医疗器械药品药材进出口
【发文字号】国家食品药品监管总局通告2017年第170号
【发布部门】国家食品药品监督管理总局
【发布日期】2017.10.30
【实施日期】2017.10.30
【时效性】现行有效
【效力级别】XE0303
国家食品药品监管总局关于发布第三批免于进行临床试验医疗器械目录的通告
(国家食品药品监管总局通告2017年第170号)
为做好医疗器械注册管理工作,根据《医疗器械监督管理条例》(国务院令第680号)、《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)、《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号),国家食品药品监督管理总局组织制定了第三批《免于进行临床试验的第二类医疗器械目录》《免于进行临床试验的第三类医疗器械目录》和《免于进行临床试验的体外诊断试剂目录》,现予发布,自发布之日起施行。
特此通告。
附件:1.免于进行临床试验的第二类医疗器械目录
2.免于进行临床试验的第三类医疗器械目录
3.免于进行临床试验的体外诊断试剂目录
国家食品药品监管总局
2017年10月30日
附件1
免于进行临床试验的第二类医疗器械目录。
免于进行临床试验医疗器械目录汇总

免于进行临床试验医疗器械目录汇总随着医疗科技的日新月异,医疗器械的种类也不断增多。
在医疗器械的买卖中,临床试验是不可或缺的一环。
但是,在一些情况下,针对某些医疗器械进行临床试验可能会面临着诸多难题,例如品种较小、使用对象匮乏等困难。
为了避免这些困难,并尽可能减轻医疗器械研发的成本,有关部门不断更新医疗器械目录,对它们进行统一规范和管理。
下面,笔者将介绍一些已经被列入免于进行临床试验的医疗器械的目录。
1.一次性使用心电图电极这种医疗器械用于获取心电图数据,可以帮助医生分析和判断患者的健康状况。
这种心电图电极被列入免于进行临床试验的目录中,是因为它满足了一些关键用户需求,同时也具有足够的安全保障。
2.含有人工智能功能的CT扫描仪随着人工智能技术的快速发展,许多医疗器械的功能已经得到了进一步的升级。
对于含有人工智能功能的CT扫描仪,虽然它的使用可能会对用户造成某些挑战,但是它还是被列入了免于进行临床试验的目录中。
3.无针注射器针头对患者的疼痛感十分明显,因此在医疗器械的研发过程中,无针注射器得到了广泛的关注。
使用无针注射器无需担心被注射疼痛的问题,同时它能够帮助医生更加精准地对患者进行治疗。
这种医疗器械已经被列入了免于进行临床试验的目录中。
4.全自动血常规仪作为一种常见的医疗器械,血常规仪在医疗行业中扮演着非常重要的角色。
尤其是全自动血常规仪,它既能够减轻医生的工作负担,还能够提高患者在检测过程中的舒适感。
因此,全自动血常规仪已经被列入免于进行临床试验的目录中。
5.电子输液器在临床医疗使用中,输液器是一种不可或缺的药物输送设备。
传统的手动操作方式很容易出现误差,因此电子输液器的出现解决了这个问题。
在电子输液器的帮助下,药物的输送过程更加准确,更加稳定,使用起来也更加方便。
这种医疗器械已经被列入了免于进行临床试验的目录中。
总体而言,免于进行临床试验的医疗器械目录中包含了许多非常有用的医疗器械,它们为医疗行业的发展做出了巨大的贡献。
《需进行临床试验审批的第三类医疗器械目录》

植入式心脏再同步复律除颤器还适用于患有充血性心力衰竭的病人,使其右心室和左心室再同步。
2
植入式血泵
6845
由血泵和能量转换装置组合而成,依靠微型电-机(或电-液)能量转换装置来驱动,维持正常的人体血液循环,起到部分或完全代替自然心脏的功能。
5
境内市场上尚未出现的植入性人工器官、接触式人工器官、骨科内固定产品及骨科填充材料
6846
与境内市场上已有的医疗器械产品相比,主要组成材料改变、重大工艺改变、主要作用机理改变或者适用范围发生重大改变的植入性人工器官、接触式人工器官、骨科内固定产品及骨科填充材料。
6
可吸收四肢长骨内固定产品
6846
由可吸收高分子材料或可吸收金属材料制成的四肢长骨内固定产品,通过对骨折断端的连接、固定,实现骨折部位的复位及早期负重,适用于四肢长骨骨折内固定。
3
植入式药物灌注泵
6854
其药物灌注泵植入人体,与鞘内导管、导管入口组件、再灌注组件、袋囊组件、穿刺组件和程控器等配合使用,用于需长期输入药物或液体的患者。
4
境内市场上尚未出现的血管内支架系统
6846
与境内市场上已有的医疗器械产品相比,主要组成材料改变、重大工艺改变、主要作用机理改变或者适用范围发生重大改变的通过输送系统以经皮方式植入预期血管部位的支架。
需进行临床试验审批的第三类医疗器械目录
序号产品Biblioteka 称分类编码产品描述
1
采用全新设计/用于全新适用范围
植入式心脏起搏器、植入式心脏除颤器、植入式心脏再同步复律除颤器
6821
植入于体内的电子治疗仪器,由脉冲发生器和电极导线组成。植入式心脏起搏器产品具有起搏、感知、程控等功能,通过脉冲发生器发放由电池提供能量的电脉冲,通过电极导线的传导,刺激电极所接触的心肌,使心脏激动和收缩,从而达到治疗由于某些心律失常所致的心脏功能障碍的目的。
免于进行临床试验第二类、第三类医疗器械目录(第三批)-2017

关节内窥镜手术器械
6810
产品可由钻头限制器、螺丝刀、钩刀、中空开孔器、导向器、钻头、无偏心股骨瞄准器、锥形螺丝刀、预置螺钉螺丝刀、导针、螺钉导针、螺钉开口器、测深尺止深器、股骨螺钉开口器、股骨瞄准器、通用手柄、半圆型锉、软骨取持器、后外束胫骨瞄准器、后外束股骨瞄准器、钢板插入器、组织夹持器、韧带预张器、韧带整理器、肌腱测量尺、扭力手柄、肌腱整理板、骨腱骨夹持器、探针、刮匙、剥离器、闭孔器、丝攻、锥子、工作鞘管、导引交换棒、微型探钩、关节镜专用吸引管路套、膑钻导引器、穿刺鞘芯、穿线器、推结器、骨锤、钻孔器、丝攻推刀、关节镜剪刀、深测尺、取持器、导引针、快捷扩张器、尼龙头锤、可替换尼龙头、钳子、探条、铆钉植入器、钩针、穿刺针、穿刺针套管、抓线器、剪线器、抓钳、篮钳、咬骨钳、骨锉、肩袖过线器、戳抢、鸟嘴钳、微穿孔器械、微骨折锥、提升器、打磨器等组成。接触人体部件采用符合YY/T 0294.1或ASTM F899标准规定的不锈钢制成,不与有源器械联用。适用于腕关节、肘关节、肩关节、膝关节、髋关节、踝关节的关节镜手术。
8
椎间盘切除刀
6810
椎间盘切除刀采用符合YY/T 0294.1或ASTM F899标准规定的不锈钢材料制成。用于切开椎间盘最外层的纤维环。
9
环钻
6810
通常为中空结构。一般采用符合YY/T 0294.1或ASTM F899标准规定的不锈钢材料制成。用于脊柱手术中切除骨或取骨用。
10
脊柱手术通道系统
15
电子内窥镜图像处理器
6822
该产品一般由主机和附件组成,附件包括电源线、接口电缆、数据键盘等,与电子内窥镜及显示器配合使用,用于将电子内窥镜采集到的图像进行处理后输送至显示器。
16
内窥镜手术刨削器
豁免临床试验三类医疗器械目录(征求意见稿)
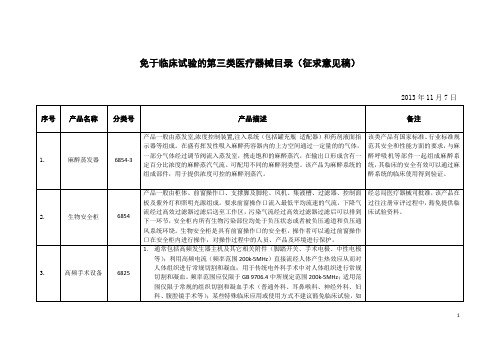
免于临床试验的第三类医疗器械目录(征求意见稿)2013年11月7日12345678910111213免于临床试验审批的第三类医疗器械目录(征求意见稿)起草说明一、背景说明《免于临床试验审批的第三类医疗器械目录》(征求意见稿)(以下简称《目录》(征求意见稿))是按照食药监械管便函[2013]XX号文相关要求,根据《医疗器械监督管理条例(修订草案)》和《医疗器械管理办法(修订稿)》有关条款,结合中心技术审评实际和工作经验,借鉴国际上发达国家(地区)的做法予以制定。
二、编写参考的主要依据和要求(一)《医疗器械监督管理条例(修订草案)》(2012年11月征求意见稿)(二)《医疗器械注册(备案)管理办法(修订稿)》(2013年1月征求意见稿)(三)《医疗器械临床试验质量管理规范》(2012年10月上报稿)(四)《医疗器械临床试验规定》(局令第5号)三、选取原则:(一)临床应用多年,产品风险通过非临床手段可得到验证;(二)现有的国家标准、行业标准或其它指导性文件已有明确的技术要求,无须通过临床验证;(三)同类产品临床资料或动物实验资料可证明其安全性和有效性;(四)已有规定免于临床试验产品;(五)结合当前审评审批实际情况;(六)其它需要免于临床试验的产品。
四、主要内容说明(一)目录产品的选取是结合实际审评情况和产品风险,选取的临床时间较长,发展较为成熟的产品。
考虑到科学技术发展迅速,检测验证手段不断丰富,为保障公众健康,促进产业发展,推动科技进步,对于通过非临床手段能证明其安全有效性的产品应及时纳入到本目录中。
(二)对于目录产品增加新的临床适用范围或生产工艺发生重大变化的产品,如非常规应用的高频手术设备或3D打印的骨科植入物等,即使该类产品已上市多年,考虑到产品的安全风险,不建议免于临床试验。
(三)为促进产业发展,减少社会资源浪费,对于安全风险不大,临床试验开展困难的产品,可考虑免于临床试验,由医疗器械监管部门决定。
免于进行临床试验的第三类医疗器械目录

免于进行临床试验的第三类医疗器械目录免于进行临床试验的第三类医疗器械目录(以下简称“目录”)由国家食品药品监督管理局(以下简称“国家药监局”)发布,是对一些临床试验风险较低的医疗器械进行分类和管理的依据。
该目录的发布旨在提高我国医疗器械审批的效率和速度,同时减少了医疗器械制造商和临床试验的成本和风险。
目录主要包括三类医疗器械,分别是:低风险自主研制的产品、已经通过国外相关机构的认证的产品和经国家药监局认定可以推广应用的产品。
相较于其他医疗器械,这些医疗器械的临床试验风险相对较低,因此免于进行临床试验,可以直接申请注册上市。
首先是低风险自主研制的产品。
这类产品是由国内医疗器械生产企业自主研发的,并符合国家规定的技术标准和要求。
这些医疗器械的研发过程经过充分论证和验证,其产品质量和安全性得到了有效的控制和保障。
这类产品的上市注册不需要进行临床试验,可以省去大量的时间和成本,加快了产品的上市速度。
其次是已经通过国外相关机构的认证的产品。
国外一些国家或地区的鉴定机构对医疗器械的安全性和有效性进行了严格的评估和认证,并颁发了相应的认证证书。
这些国际认证已经充分证明了医疗器械的质量和安全性,因此无需再进行我国的临床试验。
只需提交相关的认证证书和文件,完成注册申请,便可获得上市许可。
最后是经国家药监局认定可以推广应用的产品。
这些产品可能已经在临床实践中得到广泛应用,有大量的临床数据和实验研究支持其安全性和有效性。
根据国家药监局的认定,这些产品可以免除临床试验的要求,直接进行注册申请。
不仅有效缩短了审批时间,也为医疗器械生产企业提供了更多的机会推广应用。
然而,目录发布并不代表完全不需要进行临床试验。
对于目录以外的医疗器械,仍然需要按照相关规定进行临床试验,并获得相应的临床试验批件后方可上市。
临床试验是医疗器械安全性和有效性的重要评估环节,对于保障患者的安全和有效治疗具有重要意义。
总结来说,免于进行临床试验的第三类医疗器械目录的发布,可以加快医疗器械上市注册的速度,降低制造商和临床试验的成本和风险。
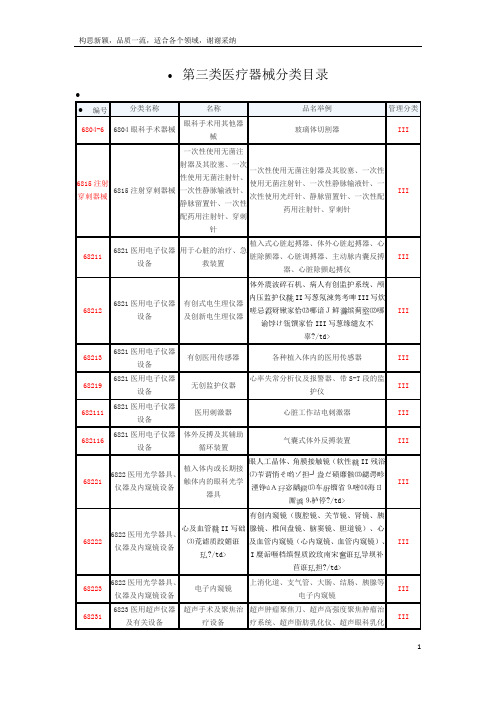
第3类医疗器械产品分类目录

体外震波碎石机、病人有创监护系统、颅内压监护仪
II写葱氖涑隽考啤III写炊嗟忌砑锹家恰⑿哪谙J鲜缤蓟⑿哪谕饽け瓴馔家恰III写葱缘缱友辜?/td〉
眼人工晶体、角膜接触镜(软性II残浴⑺苄谓悄そ哟ゾ担┘盎だ碛靡骸⒀勰谔畛湮铮úA宓龋⒄车镏省⒐嘧⒁海ㄖ厮⒐栌停?/td〉
心及血管II写础⑶荒谑质跤媚诳?/td〉有创内窥镜(腹腔镜、关节镜、肾镜、胰腺镜、椎间盘镜、脑窦镜、胆道镜)、心及血管内窥镜(心内窥镜、血管内窥镜)、腔内手术用内窥镜(经尿道电切镜II糜诟咂档缜惺质跤玫南宋诳导坝补苣诳担?/td〉
一次性使用输液器、输血器、静脉输液(血)针、血袋、采血器、血液成分分离器材、连接管路II胙方哟サ目亍⒀郝送⒁┮汗寺四ぁ⒖掌寺四ぁ⒙樽淼脊堋⒁淮涡允褂醚汗似?/td〉。
(完整版)新版第三类医疗器械分类目录

(完整版)新版第三类医疗器械分类目录新版第三类医疗器械分类目录是中国国家药品监督管理局于2018年发布的医疗器械分类标准,根据医疗器械的功能、适用范围和风险等级进行分类。
该目录的发布对于规范和管理医疗器械市场具有重要意义。
第三类医疗器械是指用于医疗、治疗、预防疾病的非活性物品、设备、仪器或其他物品,其中包括了辅助诊断、治疗、监测、护理、康复和其他相关用途的器械。
根据新版目录,第三类医疗器械被细分为26个类别,这些类别包括:一、骨科器械:用于治疗骨骼系统疾病的器械,如骨钉、骨板、植骨材料等。
二、创伤源止血器械:用于止血的器械,如止血钳、止血带等。
三、血管介入器械:用于血管介入治疗的器械,如导管、支架等。
四、心血管器械:用于心血管疾病治疗的器械,如心脏起搏器、血压计等。
五、介入性诊疗器械:用于介入性诊疗操作的器械,如导丝、导管等。
六、放射治疗器械:用于放射治疗的器械,如放射治疗机、放射保护器械等。
七、超声诊断和治疗器械:用于超声诊断和治疗的器械,如超声探头、超声治疗仪等。
八、临床检验器械:用于临床检验的器械,如血液分析仪、生化分析仪等。
九、医用光学器械:用于眼科和其他医学光学检查的器械,如眼镜、眼镜架等。
十、病理和解剖器械:用于病理和解剖学研究的器械,如显微镜、切片机等。
十一、消毒和灭菌器械:用于消毒和灭菌的器械,如高压蒸汽灭菌器、紫外线消毒器等。
十二、医用敷料器械:用于医用敷料操作的器械,如敷料剪、敷料包装机等。
十三、家庭和个人护理器械:用于家庭和个人护理的器械,如口腔护理器械、物理治疗仪器等。
十四、康复辅助器械:用于康复辅助治疗的器械,如矫形器、假肢等。
十五、消耗性卫生材料和敷料:用于一次性使用的卫生材料和敷料,如手术刀片、纱布等。
十六、体外诊断器械:用于体外诊断的器械,如试纸、血糖仪等。
十七、口腔科器械:用于口腔科治疗的器械,如牙科钻、牙科喷砂机等。
十八、眼科器械:用于眼科治疗的器械,如验光架、角膜刀等。
新版第三类医疗器械分类目录
•第三类医疗器械分类目录
体外震波碎石机、病人有创监护系统、颅
内压监护仪II写葱氖涑隽考啤III写炊
嗟忌砑锹家恰⑿哪谙J鲜缤蓟⑿哪
谕饽け瓴馔家恰III写葱缘缱友
辜?/td>
眼人工晶体、角膜接触镜(软性II残浴
⑺苄谓悄そ哟ゾ担┘盎だ碛靡骸⒀勰谔畛
湮铮úA宓龋⒄车镏省⒐嘧⒁海ㄖ
厮⒐栌停?/td>
医用光学器具、心及血管II写础
⑶荒谑质跤媚诳
?/td>
有创内窥镜(腹腔镜、关节镜、肾镜、胰
腺镜、椎间盘镜、脑窦镜、胆道镜)、心
及血管内窥镜(心内窥镜、血管内窥镜)、
I糜诟咂档缜惺质跤玫南宋诳导坝补
苣诳担?/td>
输液、输血器具及管一次性使用输液器、输血器、静脉输液(血)针、血袋、采血器、血液成分分离器材、连接管路II胙方哟サ目亍⒀郝送⒁┮汗寺四ぁ⒖掌寺四ぁ⒙樽淼脊堋⒁淮涡允褂醚汗似?/td>。
第三批免于进行临床试验医疗器械目录(第三类医疗器械)2017年第170号
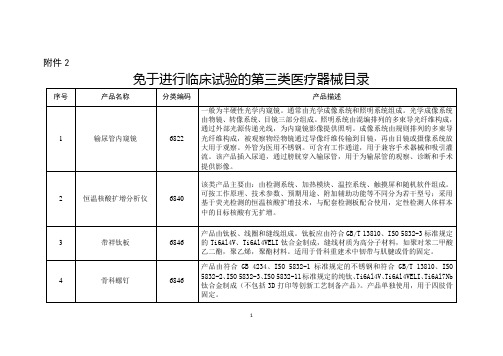
骨科螺钉
6846
产品由符合GB 4234、ISO 5832-1标准规定的不锈钢和符合GB/T 13810、ISO 5832-2、ISO 5832-3、ISO 5832-11标准规定的纯钛、Ti6Al4V、Ti6Al4VELI、Ti6Al7Nb钛合金制成(不包括3D打印等创新工艺制备产品)。
产品一般由主机、手柄、刨削刀头组成,通过电机马达带动手柄及刀头进行机械旋转,用于开放手术或内窥镜手术下对骨或软组织等进行切除、磨削等操作。适用或参考行业标准YY/T 0955《内窥镜手术设备刨削器》。
9
亲水性纤维敷料
6864
主要由羧甲基纤维素钠或乙基磺酸盐纤维素组成。预期用途限于保护伤口、吸收渗液、提供湿性伤口环境。豁免情况不包括:(1)适应症宣称可以促进上皮化、引导组织再生、促进伤口愈合、减轻疼痛、抗菌、止血、溶解坏死组织、减少疤痕、防粘连等作用的产品;(2)宣称可以用于体内伤口、三度烧伤、感染创面、坏死组织较多的创面、发生创面脓毒症的患者等情况的产品;(3)含有活性成分的产品:如药品/药用活性成分、生物制品/生物活性成分、银、消毒剂等;(4)其他新型产品,如采用了新材料、新技术、新设计或具有新作用机理、新功能的产品。
5
填充棒
6846
产品由符合ISO 13782标准规定的纯钽制成(不包括3D打印等创新工艺制备产品)。产品单独使用,用于四肢骨填充。
6
髋臼杯用孔塞
6846
产品由符合GB/T 13810、ISO 5832-3标准Ti6Al4V钛合金制成。配合髋臼杯使用,用于髋臼杯产品孔的填塞。
7
髓腔塞
6846
产品由符合GB/T 19701.2、ISO 5834-2标准规定的超高分子量聚乙烯材料制造。用于骨水泥型假体植入手术,作用为防止骨水泥溢入髓腔限制区域,适用部位为股骨、胫骨和肱骨的髓腔。
免于进行临床试验的第三类医疗器械目录_EN
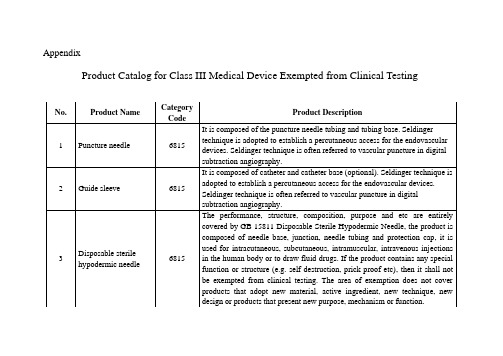
Disposable intravenousblood lancet
6815
The product is generally composed of tube plug puncture needle, protective cap,catheter, andblood lancet;it is used with disposable intravenous blood sampling containers for sampling blood from human veins. The area of exemption does not cover products that adoptnew material, active ingredient, new technique, new design or products that presentnew purpose, mechanism or function.
8
Disposable anesthesia puncture needle
6815
The performance, structure, composition,purposeand etcare entirely covered by theYY 0321.2DisposableAnesthesiaPunctureNeedle. The product is generally composed ofthe core base, needle base, needle tubing and core, to be used for puncturing and injection of drugs during anesthesia procedures.The area of exemption does not cover products that adoptnew al, active ingredient, new technique, new design or products that presentnew purpose, mechanism or function.
国家第三类医疗器械产品目录

国家第三类医疗器械产品
目录
Final revision by standardization team on December 10, 2020.
国家第三类医疗器械产品目录
一、一次性使用无菌医疗器械
1、一次性使用无菌注射器;
2、一次性使用输液器;
3、一次性使用输血器;
4、一次性使用麻醉穿刺包;
5、一次性使用静脉输液针;
6、一次性使用无菌注射针;
7、一次性使用塑料血袋; 8、一次性使用采血器;
9、一次性使用滴定管式输液器。
二、骨科植入物医疗器械
1、外科植入物关节假体;
2、金属直型、异型接骨板;
3、金属接骨、矫形钉;
4、金属矫形用棒;
5、髓内针、骨针;
6、脊柱内固定器材。
三、填充材料
1、乳房填充材料;
2、眼内填充材料;
3、骨科填充材料。
四、植入性医疗器械
1、人工晶体;
2、人工心脏瓣膜;
3、心脏起博器;
4、血管内导管及支架。
五、角膜塑性镜
六、婴儿培养箱
七、血浆分离杯、血浆管路
八、空心纤维透析器。
免于进行临床试验医疗器械目录汇总

免于进行临床试验医疗器械目录汇总2018年9月,国家药品监督管理局发布了《关于公布新修订免于进行临床试验医疗器械目录的通告》(2018年第94号),涵盖855项医疗器械产品和393项体外诊断试剂产品。
2019年12月,国家药品监督管理局发布了《关于公布新增和修订的免于进行临床试验医疗器械目录的通告》(2019年第91号),新增148项医疗器械产品和23项体外诊断试剂产品,对48项医疗器械产品和4项体外诊断试剂产品名称和描述进行了修订。
为便于查询,现汇总形成免于进行临床试验医疗器械目录汇总和免于进行临床试验体外诊断试剂目录汇总(见附件)。
(完整版)新版第三类医疗器械分类目录

•第三类医疗器械分类目录
体外震波碎石机、病人有创监护系统、颅
内压监护仪II写葱氖涑隽考啤III写炊
嗟忌砑锹家恰⑿哪谙J鲜缤蓟⑿哪
谕饽け瓴馔家恰III写葱缘缱友
辜?/td>
眼人工晶体、角膜接触镜(软性II残浴
⑺苄谓悄そ哟ゾ担┘盎だ碛靡骸⒀勰谔畛
湮铮úA宓龋⒄车镏省⒐嘧⒁海ㄖ
厮⒐栌停?/td>
医用光学器具、心及血管II写础
⑶荒谑质跤媚诳
/td>
有创内窥镜(腹腔镜、关节镜、肾镜、胰
腺镜、椎间盘镜、脑窦镜、胆道镜)、心
及血管内窥镜(心内窥镜、血管内窥镜)、
腔内手术用内窥镜(经尿道电切镜II糜
诟咂档缜惺质跤玫南宋诳导坝补苣诳
担?/td>
输液、输血器具及管一次性使用输液器、输血器、静脉输液(血)针、血袋、采血器、血液成分分离器材、连接管路II胙方哟サ目亍⒀郝送⒁┮汗寺四ぁ⒖掌寺四ぁ⒙樽淼脊堋⒁淮涡允褂醚汗似?/td>。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
性能、结构、组成、用途等属于GB 15810一次性使用无菌注射器可完全涵盖的产品,一般由注射器外套、活塞、密封圈、芯杆、按手、锥头组成,是供抽吸液体或在注入液体后立即注射用的手动注射器。如产品具有特殊性能或结构(如自毁、防针刺等)等不能豁免临床。豁免情况不包括使用了新材料、活性成分、新技术、新设计或具有新作用机理、新功能的产品。
14
电子上消化道内窥镜
6822
电子上消化道内窥镜为软性电子内窥镜,一般由头端部、弯曲部、插入部及电气和光源连接的部分组成。头端部的CCD将接收到的光学信号转换为电信号,通过摄像系统在显示器上观察。通过视频监视器提供影像供上消化道(不包含十二指肠)的观察、诊断、摄影用。
15
硬性光学腹腔内窥镜
6822
硬性光学腹腔内窥镜一般由光学成像系统和照明系统组成。光学成像系统由物镜系统、转像系统、目镜系统三大系统组成。照明系统一般为光学纤维。被观察物经物镜所成的倒像,通过转像系统将倒像转为正像,并传输到目镜,再由目镜或摄像系统放大用于观察。用于腹部微创手术中观察成像用。
29
空心接骨螺钉(非锁定)
6846
该类产品由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-3标准规定的不锈钢、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。可单独使用,适用于四肢骨折内固定。
30
柔性金属丝
6846
该类产品结构参见YY/T 0816,由符合YY 0605.9、ISO 5832-1、ISO 5832-2标准规定的不锈钢、纯钛、高氮不锈钢材料,通过常规的机械加工工艺、热处理工艺(不包括3D打印等新技术和新工艺)制成。适用于四肢骨折捆扎内固定。
3
一次性使用无菌注射针
6815
性能、结构、组成、用途等属于GB 15811一次性使用无菌注射针可完全涵盖的产品,由针座、连结部、针管、护套组成,用于人体皮内、皮下、肌肉、静脉注射或抽取药液。如产品具有特殊性能或结构(如自毁、防针刺等)等不能豁免临床。豁免情况不包括使用了新材料、活性成分、新技术、新设计或具有新作用机理、新功能的产品。
26
外科疝修补补片
6846
不包括最终全部吸收的产品。植入体内的平片或由平片折叠组合形成的网塞,一般由聚丙烯、聚对苯二甲酸乙二醇酯材料制成,可带有部分可吸收材料。作用原理为填补缺损组织或起到桥接作用。用于腹腔外对疝进行修补。
27
尿失禁悬吊带
6846
植入体内的带状物,一般主要由聚丙烯材料制成,可带有部分可吸收材料。作用原理为植入尿道附近形成对尿道的支撑。用于因女性的尿道过度移动和/或括约肌功能障碍而造成的压力性尿失禁。
6
一次性使用活检针
6815
组成仅限于包括穿刺针和针芯的活检针,材料符合GB 18457的要求,通过直接进行人体组织器官穿刺以获取病理组织,不包括与内窥镜系统、负压吸引装置等配合使用或需超声、X线等影像设备引导下操作的活检针。豁免情况不包括使用了新材料、活性成分、新技术、新设计或具有新作用机理、新功能的产品。
序号
产品名称
分类编码
产品描述
5
一次性使用静脉输液针
6815
性能、结构、组成、用途等属于GB 18671一次性使用静脉输液针可完全涵盖的产品,一般由针管(公称外径0.36—1.2mm)、针柄、软管、连接座和保护帽组成,与输液器、输血器配套使用,用于建立外周静脉通路。如产品具有特殊性能或结构(如自毁、过滤、防针刺)、新材料(除主材外,还包括含避光剂、增塑剂等添加剂)等不能豁免临床。豁免情况不包括使用了新材料、活性成分、新技术、新设计或具有新作用机理、新功能的产品。
19
氩气控制器
6825
包括控制器和氩气喷笔等附件;通过气体减压阀及氩气控制模块将高纯氩气瓶中的高压氩气转化为工作需要的可调节低流量氩气,与高频刀合用成为氩气刀;与高频电刀配合使用,在电外科手术中实现氩气环境下的凝血。
20
射频消融用针状电极
6825
射频消融用针状电极通常配合穿刺针、套管等成套使用,属于射频消融设备的应用部分。消融针上含有测温传感器;把射频发生器产生的高频电流传递至指定的人体组织,从而实现对其消融/凝固/坏死等目的;与射频发生器(射频控制器)配合使用,用于人体组织的消融。
6846
该类产品结构参见YY 0017,由符合GB 4234、GB/T 13810、ISO 5832-1、ISO 5832-2、ISO 5832-3标准规定的不锈钢、纯钛、钛合金材料,通过常规的机械加工、热处理及表面处理工艺(不包括3D打印等创新工艺)制成。适用于四肢干骺端骨折内固定。
34
序号
产品名称
分类编码
产品描述
9
一次性使用静脉留置针
6815
性能、结构、组成、用途等属于即将发布的行业标准《一次性使用静脉留置针》可完全涵盖的产品。产品一般由导管组件和针管组件两部分组成,导管组件是由导管、导管座、延长管(如果有)和任何一体的接头组成的装配件,针管组件是由针管和针座和/或其他一体的附件组成的装配件。豁免情况不包括使用了新材料、活性成分、新技术、新设计或具有新作用机理、新功能的产品。
12
一次性动静脉穿刺针/器(内瘘针)
6815
产品一般由采血针保护套、采血针、针柄、夹具、采血管、内圆锥接头、接头保护套组成。适用于临床上血液透析时的血管穿刺。豁免情况不包括使用了新材料、活性成分、新技术、新设计或具有新作用机理、新功能的产品。
序号
产品名称
分类编码
产品描述
13
一次性使用乳腺定位丝及其导引针
序号
产品名称
分类编码
产品描述
21
空气加压舱
6826
一般由舱体(壳体、舱门、观察窗、安全阀等)、供排气系统、供排氧系统、空调系统、电气系统、水喷淋系统、控制台组成。加压介质为空气,最高工作压力不大于0.3MPa的氧舱。根据舱内治疗人数不同分为单人氧舱和多人氧舱。将病人暴露于高压氧环境中,使其呼吸高压氧,达到治疗疾病的目的。供需要按照医师处方进行辅助供氧治疗的成人患者使用,用于缺血、缺氧性疾病的辅助治疗。
免于进行临床试验的第三类医疗器械目录(第一批)
序号
产品名称
分类编码
产品描述
1
穿刺针
6815
由穿刺针管和管座组成。采用Seldinger术,建立有助于血管内器械的经皮进入通路。Seldinger术多指数字减影血管造影术中的血管穿刺术。
2
导引套管
6815
由导管和导管座(可选)组成。采用Seldinger术,建立有助于血管内器械的经皮进入通路。Seldinger术多指数字减影血管造影术中的血管穿刺术。
序号
产品名称
分类编码
产品描述
24
结核杆菌分析仪(全自动分枝杆菌培养监测仪)
6840
通常由固定式条码扫描系统、图片对话功能液晶显示器、测试箱、内置式系统定标管、软件和计算机组成。通过监测微生物代谢活动时产生的CO2或O2来反映微生物的生长状况,通过监测气体变化导致的反射光变化或激发感应器中的荧光,被光电检测器捕获读取,对结核分枝杆菌的生长情况进行分析。该产品用于结核分枝杆菌的检测及药敏试验。
23
全自动免疫分析仪
6840
通常由取样中心、处理中心、废液和供应中心、系统控制中心等组成,通过以抗原抗体相互结合的免疫学反应为基础,使用酶标记或化学发光剂标记抗原抗体,通过一系列级联放大反应,将光信号或电信号与分析物浓度等相联系,分析人体样本中的待测的抗原或者抗体。用于对人类体液中的各分析物,如肿瘤标志物,病原体抗原抗体等进行定量、半定量或定性检测。
16
高频内窥镜手术器械
6822
用于在内窥镜下完成手术操作的高频电极,属于高频手术设备的应用部分;在内窥镜手术下,通过内窥镜器械孔道或其他器械通道进入人体;在内窥镜手术中用于对人体组织进行常规切割和凝血。
序号
产品名称
分类编码
产品描述
17
眼科专用超声脉冲回波设备
6823
包括眼科A超、B超和A/B超由主机和探头组成,其探头标称频率一般在10MHz以上,利用超声脉冲回波原理,完成眼科诊断信息采集、显示、测量。专用于眼科的超声诊断设备,可实现眼球及眼眶的超声成像、角膜厚度测量、眼轴长度测量等功能。
10
一次性使用胸腔穿刺针
6815
组成仅限于由针管、针座、连接管组成胸腔穿刺针,用于对人体作胸腔穿刺用。豁免情况不包括使用了新材料、活性成分、新技术、新设计或具有新作用机理、新功能的产品。
11
一次性使用腹腔穿刺针
6815
组成仅限于由针管、针座、连接管组成腹腔穿刺针,用于对人体作腹腔穿刺用。豁免情况不包括使用了新材料、活性成分、新技术、新设计或具有新作用机理、新功能的产品。
22
加压氧舱
6826
一般由舱体、供排氧系统、空调系统和控制系统组成。加压介质为医用氧气,最高工作压力不大于0.2MPa,进仓人数为1人。旨在供需要按照处方规定进行高浓度辅助供氧的成人患者使用,用于缺血、缺氧性疾病的辅助治疗。将病人暴露于高压氧环境中,使其呼吸高压氧,达到治疗疾病的目的。供需要按照医师处方进行辅助供氧的治疗的成人患者使用,用于缺血、缺氧性疾病的辅助治疗。
32
硅橡胶组织扩张器
6846
手术中使用的或植入后6个月内取出的组织扩张器,主要由壳体、导管、注射座(或起相同作用的组件)和连接器(如果有)组成。壳体的主要材料为硅橡胶。作用原理为可填充盐水以增大自身体积对组织进行扩张。用于整形外科扩张患者皮肤组织。
序号
产品名称
分类编码
产品描述
33
解剖型金属接骨板(非锁定)
18
高频手术设备
6825
通常包括高频发生器主机及其他相关附件(脚踏开关、手术电极、中性电极等);利用高频电流(频率范围200k—5MHz)直接流经人体产生热效应从而对人体组织进行常规切割和凝血;用于传统电外科手术中对人体组织进行常规切割和凝血。高频发生器频率范围应仅限于GB 9706.4中所规定范围200k—5MHz;适用范围仅限于常规的组织切割和凝血手术(普通外科、耳鼻喉科、神经外科、妇科、腹腔镜手术等);某些特殊临床应用或使用方式不建议豁免临床试验,如生理盐水环境下等离子切割和凝血。
