第07章 多环芳烃和非苯芳烃
有机化学第七章(多)
4 3 2 1
1
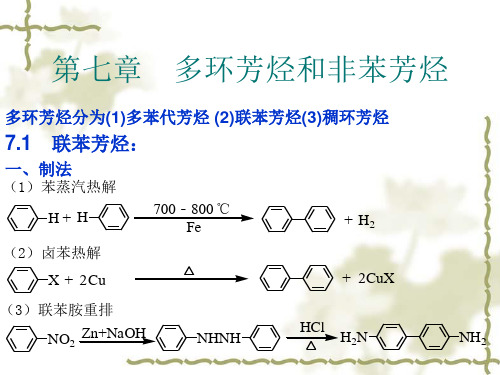
α-甲基萘 β-甲基萘 1-甲基萘 2-甲基萘
SO3H
5 4 NO2
SO3H 2 3
4 3 2 1 OH
CH3 5
4-甲基-1-萘磺酸 5-硝基-2-萘磺酸
5-甲基-1质: (1)性状:无色片状晶体,mp:80.2℃,bp:218 ℃,有特殊气味。 性状: 有特殊气味。 性状 无色片状晶体, ℃ 有特殊气味 (2)易升华,蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 易升华, 易升华 蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 萘的化学性质与苯相似,但由于离域的不太好, 萘的化学性质与苯相似,但由于离域的不太好,π电子云不是均匀 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 而且也较易进行加成和氧化反应。 而且也较易进行加成和氧化反应。 1.亲电取代反应 亲电取代反应 萘环上的π电子云不是均匀分布,据测定,它的α 萘环上的π电子云不是均匀分布,据测定,它的α位上电子云密度 最高, 位次之, 位最低, 最高,β位次之,γ位最低,所以萘的亲电取代反应一般发生在 特殊情况下也能在β位反应。 α位。特殊情况下也能在β位反应。
CH3
(2)原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时 位取代。 -位取代。如: NO
2
NO2
萘亲电取代的定位规律
但是,萘的亲电取代反应有的不遵循定位规律, 但是,萘的亲电取代反应有的不遵循定位规律,如:
H2 SO4 H2O
9,10-蒽醌和它的衍生物是蒽醌类染料的主要原料。 -蒽醌和它的衍生物是蒽醌类染料的主要原料。
多环芳烃和非

第七章多环芳烃和非苯芳烃7.1 稠环芳烃萘是有光亮的白色片状晶体,熔点80.2 o C ,沸点218 oC ,不溶于水,易溶于乙醇、乙醚和苯等有机溶剂。
燃烧时光亮弱、烟多。
萘挥发性大,易升华,有特殊气味,具有驱虫防蛀作用,过去曾用于制作“卫生球”。
近年来研究发现,萘可能有致癌作用,现使用樟脑取代萘制造卫生球。
萘在工业上主要用于合成染料、农药等。
萘的来源主要是煤焦油和石油。
1.萘的结构和萘的衍生物的命名 萘的分子式为C 10H 8,是由两个苯环共用两个相邻的碳原子稠合而成,两个苯环处于同一平面上。
萘分子中每个碳原子均以sp 2杂化轨道与相邻的碳原子形成碳碳σ键,每个碳原子的p 轨道互相平行,侧面重叠形成一个闭合共轭大π键,因此同苯一样具有芳香性。
但萘和苯的结构不完全相同,萘分子中两个共用碳上的p 轨道除了彼此重叠外,还分别与相邻的另外两个碳上的p 轨道重叠,因此闭合大π键电子云在萘环上不是均匀分布的,导致碳碳键长不完全等同,所以萘的芳香性比苯差。
萘分子中碳碳键长数据如下:萘的芳香性不如苯还可通过离域能数据看出。
苯的离域能为150.5kJ•mol -1,如果萘的芳香性和苯一样,萘的离域能应为苯的离域能的2倍,而事实上萘的离域能仅是250kJ•mol -1。
由于萘环上各碳原子的位置并不完全等同,因此萘的衍生物命名时,无论萘环上有几个取代基,取代基的位置都要注明。
萘环的编号方法如下: 其中,1、4、5、8位置相同,称做α-位;2、3、6、7位置相同,称做β-位。
2.萘的化学性质由于萘环上闭合大π键电子云密度分布不是完全平均化的,因此它的芳香性比苯差。
(1)取代反应 萘比苯更易发生亲电取代反应。
根据测定,萘环的α-位电子云密度比β-位高,因此亲电取代主要发生在α-位。
但由于β-位取代产物的热力学稳定性大于α-位取代产物,所以当温度较高时,主要为β-位取代产物。
在三氯化铁催化下,将氯气通入萘的苯溶液中,主要生成α-氯萘。
有机化学课件:7 多环芳烃和非环芳烃

二、 联苯亲电取代反应的定位规律
CH3 CH3
NO2
如:联苯的硝化反应:
HNO3 H2SO4
HNO3
H2SO4
O2N
钝化基团、 异环取代
O2N
NO2
4,4’-二硝基联苯(主要产物)
O2N
O2N
2,4’-二硝基联苯
三、 联苯化合物的异构体
由于两个环的邻位有取代基存在时,由于取代基的空间 阻碍联苯分子的自由旋转.从而使两个苯平面不在同一 平面上,产生异构体. 例:6,6’-二硝基-2,2’-联苯二甲酸的异构体
SO3H SO3H
OH NO2 HNO3
H2SO4
OH NO2
NO2
OH
H2SO4 HNO3
NO2
OH NO2
NO2
2、加成反应
Na , C2H5OH
H2 , Pt
3、氧化反应
O
CrO3
10-15oC
+ O2
V2O5 500℃
=
=
OO
CCO OO
COC 邻苯二甲酸酐 O
温和氧化剂得醌,强烈氧化剂得酸酐。
NO2
B:卤化:
Cl
+ Cl2
FeCl3 氯苯
C:傅克反应:
CH3COCl AlCl3
COCH3 +
75%
COCH3
25%
D: 磺化反应: 在较低温度下主要生成α-萘磺酸, 在较高温度下则产物为β-萘磺酸。
0~60 ℃
SO3H
速度控制
+ H2SO4
H2SO4 165 ℃
165 ℃
SO3H
平衡控制
SO3H
镜面
C7 多环芳烃和非苯芳烃

HOOC
(3) 加成反应 萘比苯容易发生加氢反应,在不同条件下可以发生部分加
氢或全部加氢,当用金属钠在液氨和乙醇的混合物中进行还
原时,得到1,4-二氢萘。
Na,液NH3,乙醇
在剧烈条件下加氢时,可生成四氢化萘或十氢化萘
H2 / Pd—C, ,加压 或Na—Hg,C2H5OH 四氢化萘
H2 ,Rh—C或Pd—C ,加压 十氢化萘
第七章多环芳烃和非苯芳烃
7-1联苯及其衍生物:制备、化性、重要的化合物 7-2稠环芳烃 7-3非苯芳烃
多环芳香烃命名
(1)联苯类:苯环间以一单键线的,例如:
3 2 1 1' 5 6 6' 2' 3' 4' 5' 2 3 4 6 5 1 2 6 5 4 3
H3C
4
CH3
1
4,4'-二 甲 基 联苯
1,4- 联三 苯
OCH3 NHCOCH3
若萘环上有一个间位定位基时, 由于其致钝作用, 第二个取代基进入到异环的5或8位。例如:
NO2 SO3H
萘环二元取代反应比苯环复杂得多,上述规则只 是一般情况,有些反应并不遵循上述规则,如2甲基萘的磺化反应:
CH3 浓H2SO4 90~100℃ HO3S CH3
(2) 氧化反应 萘比苯容易氧化。若在高温下,以五氧化二钒作催化剂,萘 的蒸气可被空气氧化生成邻苯二甲酸酐。
结论: 环多烯烃具有芳香性的条件 A、共轭体系为环状不间断共轭体系 B、环的所有碳原子都在同一平面上
C、∏电子数符合4n+2规则
注意: 对于奇数碳的环多烯不可能存在连续双键。 可以看成这个SP3杂化的碳和双键发生P-共轭,可 把它也看成一个轨道重叠单元(一个P轨道)来计算。
chem-7多环芳烃和非苯芳烃

β
β
Br
β
β
αα
β-溴萘
Br
α-溴萘
-NH2 ,-OH ,-CHO, -SO3H, -COOH OH
SO3H
βቤተ መጻሕፍቲ ባይዱ萘磺酸
α-萘酚
2.二取代物
8 7
6 5
1 2
3 4
C2H5
C2H5 1,6-二乙基萘
CH3
SO3H
4-甲基-1-萘磺酸
OH SO3H
C2H5 5-乙基-2-萘磺酸
NO2 4-硝基-1-萘酚
(三)萘的化学性质
1.亲电取代反应
α
α β
E+
β
EH
EH
+
+ 其它不稳定共振结构
+
+E H + 其它不稳定共振结构
⑴卤化
Cl
+ Cl2
I2 苯
Br
+ Br2 CCl4
⑵硝化
HNO3/H2SO4
N O2
⑶磺化(可逆反应)
< 80℃
浓 H2SO4
165℃
SO3H
96%
SO3H
165℃ / H2SO4
斥力较大
H SO3H
85%
H
SO3H
H
斥力较小
⑷付氏酰基化反应
AlCl3 + CH3COCl
CS2 或 C2H2Cl4 -15℃
硝基苯 200℃
COCH3 93%
COCH3 90%
⑸一取代萘的定位效应
由于邻对位定位基的致活作用,取代发生在同环,并且第 二个基团进入这个定位基的邻对位中的α位。
CH3
第07章 多环芳烃和非苯芳烃

AlCl3 CS2 -15oC
O + CH 3CCl
AlCl3 C6H5NO2 250oC
75%
COCH3
90%
13
⑶ 萘的硝化和卤代
Br Br2 CH3COOH Cl2 I2 C6H6 Cl
72-75%
HNO3,H2SO4 50oC NO2
92%
4-5% +
NO2
92%
14
三、 萘的定位规律:
SO3H Na2CO3 SO3Na
NaOH 。 300 C
O Na
H
+
OH
12
⑵ F-C反应:
● 烷基化实际意义不大,但在萘的α-位引入羧甲基则有实际意义。
CH2COOH + ClCH2COOH
FeCl3 , KBr 。 200 ~ 218 C
α
萘乙酸 简称:NAA
COCH3
植物生长激素,能 促使植物生根、开 花、早熟、高产, 对人畜无害。
8
γ
α
3 9 2β 3 7 6 5 4 3 8 10 1 6 2 5 4 2 1 10 8 9
9
1
10
或
7
4
5
10
4
萘
蒽
注意萘、蒽和菲的编号, 没有H的一般没有取代基, 也不编号。
菲
0.142 0.136 α β 0.140
一、萘的结构:
0.139
苯的共轭能:150 kj· -1; mol 萘的共轭能:225 kj· -1。 mol 芳香性:苯 > 萘 > 菲 > 蒽。
μ = 3.335 + 10-30 C m
4. 富烯类:
μ = 3.669 + 10-30 C m
有机化学课件:7 多环芳烃和非环芳烃

化学性质上:①容易起取代反应; ②不容易起加成反应; ③环不容易被氧化而破裂。
二、休克尔规则
判断单环共轭多烯烃CmHm是否具有芳香性: 成环原子在同一个平面上, 共轭体系为闭合的环状, 环上π电子数为4n+2。 (n=0、1、2‥‥‥)
(1) 整个分子共平面; (2) 具有环闭共轭体系; (3) 电子数符合Hückel规则。
0.141nm
C—C键键长并不完全相同 (苯的全为0.139nm)
α位的电荷密度大于β-位, 萘的一元取代物有两 种。萘的加成, 氧化, 亲电取代也比苯容易。
萘与苯的结构比较
分子结构 C的杂化
π键 π电子云密
度
离域能
苯(C6H6 ) 平面环状
sp2 6中心6电子大π键 高度对称, 处处相同
150.3kJ/mol
8 7
NO2
1 2
6
3
54
NO2
1,5-二硝基萘
参见多官能团化合物命名
SO3H
CH3
CH3 5-甲基-2-萘磺酸
Cl 6-甲基-1-氯萘
3、萘的化学性质:
1) 亲电取代
萘更易发生亲电取代反应。亲电取代首先在位。但1与8或4与5 位相距很近, 有大的取代基(如磺酸基)时在位较稳定。
A:硝化:
+ HNO3 H2SO4
二、 联苯亲电取代反应的定位规律
CH3 CH3
NO2
如:联苯的硝化反应:
HNO3 H2SO4
HNO3
H2SO4
O2N
钝化基团、 异环取代
O2N
NO2
4,4’-二硝基联苯(主要产物)
O2N
O2N
2,4’-二硝基联苯
第七章 多环芳烃,非环芳烃
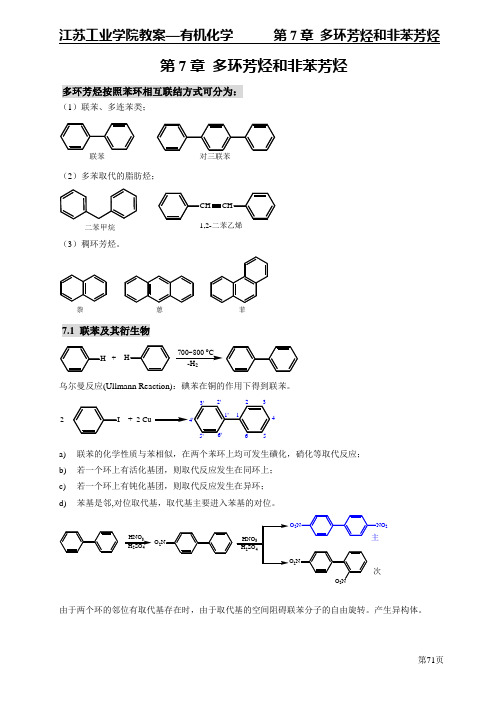
第7章 多环芳烃和非苯芳烃多环芳烃按照苯环相互联结方式可分为:(1)联苯、多连苯类;联苯 对三联苯(2)多苯取代的脂肪烃;二苯甲烷1,2-二苯乙烯(3)稠环芳烃。
萘 蒽 菲7.1 联苯及其衍生物+700~800C -H 2乌尔曼反应(Ullmann Reaction):碘苯在铜的作用下得到联苯。
+ 2 Cu24a) 联苯的化学性质与苯相似,在两个苯环上均可发生磺化,硝化等取代反应; b) 若一个环上有活化基团,则取代反应发生在同环上; c) 若一个环上有钝化基团,则取代反应发生在异环;d) 苯基是邻,对位取代基,取代基主要进入苯基的对位。
O 2HNO 3H SO 2222次由于两个环的邻位有取代基存在时,由于取代基的空间阻碍联苯分子的自由旋转。
产生异构体。
2对映体7.2 稠环芳烃7.2.1 萘及其衍生物(一) 萘的结构平面分子;每个碳原子采取sp 2杂化; 10个 电子;萘分子C 原子的编号:ββα'β3萘衍生物的命名:以奈为母体。
231-氯萘(α-氯萘)2-氯萘(β-氯萘)1,5-二硝基萘4-甲基-1-萘磺酸(对甲基萘磺酸)(二) 萘的性质萘具有255kJ/mol 的共振能(离域能,苯(高)具有152 kJ/mol ,所以萘的稳定性比苯弱,萘比苯容易发生加成和氧化反应,萘的取代反应也比苯容易进行。
(1)萘的亲电取代反应:一般发生在α-。
因为α-取代的σ络合物的共振式中有两个保持了苯环的结构,所以更稳定。
α-β-傅-克酰基化反应:3动力学控制热力学控制磺化和酰基化的时候低温生成动力学控制的α-取代产物;高温时生成热力学控制的更稳定的β-取代产物。
布赫雷尔(Bucherer)反应NH4HSO3o2NaHSO3这是一个可逆的反应。
(2) 萘环二取代的定位规则:1-位上有活化基,第二取代基进入4-位:3(主要产物)2-位有活化基,苯二取代基进入位:33324环上有致钝基,第二取代基进入另一环α-位。
第七章 多环芳烃和非

吸电子基
取代: 与一类定位基同环
9
(3)萘及其衍生物 萘的结构 平面型分子,闭合共轭体系,具有芳性.
α
α
0.142 0.137 0.139 0.140
β
萘的共振能为255KJ/mol,比苯的两倍低 , 萘的共振能为 ),萘的芳性比苯差 (152×2=304),萘的芳性比苯差. × ),萘的芳性比苯差.
10
β β
β
α
α
3,萘的化学性质 ⑴ 取代反应
Cl
取代在α位
Fe/ Cl2 NO2 Zn---HCl HNO3/H2SO4 [H] H2SO4 〈80℃ SO3H
165℃
NH2
SO3H
位阻
NaOH + 300℃, H OH (NH4)2SO3 P NaHSO3/H2O NH2
11
A 为一类定位基, 第二取代 与A同环α位
加氢还原 萘环芳性较差,可以发生加成反应.
H H
Na/乙醇 H H 1,4-二氢化萘 H2/Ni
1,2-二氢化萘
四氢化萘
H2/Pt-C
H 反十氢化萘 H
反式-十氢化萘 反式 十氢化萘
顺式-十氢化萘 顺式 十氢化萘
17
⑶ 氧化反应
, CrO3/HAc
10 _ 15 ℃
O
1,4-萘醌 O O
V2O5
O O
4
2,多苯代脂烃
COCl AlCl3
+
O C
Zn-Hg HCl
CH2
酰基化反应-----得到较纯的一取代产物
5
2,萘,蒽,菲 A,工业上-----来源于煤焦油
B,实验室制法------傅-克酰基化反应 ( Friedel-Crafts reaction )
优选第七章多环芳烃与非苯芳烃

40oC
SO3H CH2CH3
CH2CH3 + H2SO4
140oC
HO3S
主要
CH2CH3
主要
③ 萘环上原取代基为第二类定位------ 位有吸电子基或β位有吸电子基
W
E
钝化的环
W E
+
主要产物
W
E
次要产物
W E
钝化的环
E
W
W
+
E
主要产物
次要产物
例:
NO2
HNO3 H2SO4
NO2 NO2 +
优选第七章多环芳烃与非苯芳 烃
➢ 稠环芳烃
8 7
6 5
1 2
3 4
萘
8 7
6 5
9 1 2
3 10 4
蒽
3
4
2
5
6
1
7 8
10 9
菲
7.1 联苯类多环芳烃
1. 制备
2
X
Ullmann反应
NO2
2
I
2. 联苯的构象
45o
Cu
NO2 Cu
O2N
CO2H NO2
X = I, Br, Cl NO2 CO2H
① 萘环上原取代基为第一类定位基---a 位有给电子基
G
G
-
E
+
-
例:
E
活化的环 主要产物
OH
OH
HNO3
H2SO4
NO2
主要产物
G E
次要产物
试从反应中间 体稳定性解释 反应取向
② 萘环上原取代基为第一类定位基--- 位有给电子基
第七章 多环芳烃

Richard E. Smalley, 1943年生于Ohio的Akron, 1965年 密执安大学学士,1973普林斯顿大学博士;1976年后 一直在Rice大学任教并从事团簇化学研究和超声速流 激光光谱研究;1981年晋升该校化学教授;1990成为 该校物理学教授;1986-1996年任该校量子研究所主任 ;后任该校纳米科学技术中心主任。
[18] 轮烯
[18]轮烯有18个π电子,符合Hückel规律,是一个 典型的芳香大环化合物。
4)富勒烯(Fullerene)
Curl、 Kroto and Smalley 1996 Nobel Prize
Robert F. Curl, 1933年生于得克萨斯的Alice, 1954Rice 大学学士,1957伯克利分校博士;此后一直在Rice大 学任教并从事微波及红外光谱研究;1967年晋升教授 ;1992-1996年任系主任。
8 7
6 5
91 2
3 10 4
Anthracene 蒽
3
4
2
5 1
10 89
Phenanthrene
菲
1、萘及其衍生物
萘是白色晶体,熔点80.5℃,沸点218℃,有 特殊的气味,易升华。它不溶于水,而溶于热的乙 醇及乙醚,常用作防蛀剂。
1)萘的结构
sp2
萘的π分子轨道
2)命名Biblioteka α-位β-位Br O 2N
OH 混酸
OH +
OH NO 2
芳烃及非苯芳烃

1
2
3
联苯及其衍生物 (简讲)
工业: 2
3'
700~800℃ 4' 通过铁管 5'
2' 2 1' 1 6' 6
3 4
5 + H2
实验室: 2
I + 2 Cu
+ 2CuI
苯取代苯 :苯基为最弱的 O,P 基. 取代时,主要进入对位,也有少量邻位产物. 两苯环可饶 C-C 键自由旋转,当有取代基时旋转有 限制,形成异构体.
二 :萘的化学性质
无色片状,特殊臭味,常用卫生球为粗萘,
易取代,与苯相比易加成。
(一):取代反应 (比苯容易,芳香性比苯弱)
1: 卤代
Br
+ Br2 100℃
+ HBr
α -溴代萘
不用催化剂,比苯活泼.
2: 硝化
HNO3,H2SO4 室温
NO2
+
NO2
(苯硝化须加热)
95%
Zn/HCl 还原
5% NH2
α -萘胺
3: 磺化
60℃
SO3H α -萘磺酸
+ H2SO4
165℃
165℃
SO3H β -萘磺酸
α 位空间阻力大,不稳定,但生成速度快,低温以α 位 为主; 高温时,β 位也易生成,稳定,以β 位为主.
4: 付氏烷基化产率低,无价值.
(三) 氧化反应 (比苯容易)
O
+ O2 V2O5 400℃
§7-1 芳香性
芳香性:
化合物具有的环稳定,易亲电取代, 难加成,难氧化的性质,称为芳香性。
芳香性判椐---休克尔规则 (1)环状共平面,即原子SP2杂化; (2) ∏电子数符合(4n+2). 注:n=0,1,2……整数;二条件同时具备.
7多环芳烃与非苯芳烃

3*重氮盐的反应(参见芳胺一章)
4*联苯胺重排(参见P144 Or 芳胺一章)
7.2.3 化学性质
联苯可以看作是苯环上的一个氢原子被另一个 苯环所取代,因此,每一个苯环与单独苯环的行为 是类似的,苯基取代基是邻对位定位基。
7.3. 稠环化合物
7.3.1 定义:
两个或多个苯环公用两个邻位碳原子的化合物 称为稠环芳烃。 7.3.2. 重要稠环化合物的名称和结构
81
7
2
6
3萘
54
1,4,5,8称为位 2,3,6,7称为位
8 91
7
2
6
3蒽
5 10 4
1,4,5,8称为位
2,3,6,7称为位
9,10位称为中位
萘的结构
环闭共轭体系(大键); C-C键长不完全等同; 电子云不完全平均化; 离域能 ~255kJ/mol。
142.1 136.3pm
142.3
141.8
O
萘环比侧链更易氧化,所以不能用侧链氧化法制萘 甲酸。
NH2
<O>
NO2
<O>
COOH
COOH
NO2 COOH
电子云密度高 的环易被氧化。
COOH
(2) 萘的还原
H2 / pt 高温高压
H2 / 弱催化剂 高温高压
H2 / Ni (pd) Na C2H5OH 152oC
Na (or Li) NH3-C2H5OH (2mol)
结构特点
sp2杂化,平面结构,键长不均等(但与普通的单 双键又不同)。所以不能用一个完美的结构式来表达, 平时用最稳定的共振极限式来表达。
6 54 3
7
2
菲 有五种不同的位置1-8,
多环芳烃和非苯芳烃

07
稠环芳烃
08
萘
09
蒽
10
菲
(2) 多苯代脂烃类
7.1 联苯及其衍生物
700~800 ℃
+ H2
(2) 联苯的实验室制备
2
+ 2Cu
+ 2CuI
联苯为无色晶体,熔点70℃,沸点254℃,不溶于水而溶于有机溶剂.
联苯的工业制备
联苯可看成是苯的一个氢原子被苯基取代. 联苯的化学性质与苯相似,在两个苯环上均可发生磺化,硝化等取代反应.
7.2.3 菲
9,10-菲醌 菲的性质 CrO3 + CH3COOH
01
02
例: 菲的氧化:
菲的化学反应易发生在9,10位.
不完全由苯环稠合的稠环芳烃 例如苊和芴,它们都可以煤焦油洗油馏分中得到.
苊(e) 无色针状晶体
芴(wu) 无色片状结晶
芴的亚甲基上氢原子相当活泼,可被碱金属取代:
01
02
例1: 判断环丁二烯的芳香性?
电子数 = 4 . 两个电子占据能量最低的成键轨道,两个简并的非键轨道各有一个电子. 这是个极不稳定的双基自由基.
--凡电子数符合4n的离域的平面环状体系,基态下它们的组简并轨道都如环丁二烯那样缺少两个电子,也就是说,都含有半充满的电子构型,这类化合物不但没有芳香性,而且它们的能量都比相应的直链多烯烃要高的多,即它们的稳定性很差.所以通常叫做反芳香性化合物.
1
当第一个取代基是间位定位基时
例2:
例1:
01
02
邻对位定位基
复杂性(不符合规律)
7.2.2 蒽及其衍生物
(1) 蒽的来源和结构 蒽存在于煤焦油中, 分子式为C14H10
非苯芳烃yj.ppt

萘 电子数=10
蒽 电子数=14
菲 电子数=14
⑵. 环丙烯正离子
H-
芳香性
电子数=2
环丙烯正离子
+ π 电子数 4
-
.
6
5
பைடு நூலகம்
环戊二烯负离子 芳香性
环丁二烯的反芳香性
凡电子数符合4n的离域的平面环状体系, 这类化合物不但没 有芳香性,而且它们的能量都比相应的直链多烯烃要高的多, 即它们的稳定性很差.所以通常叫做反芳香性化合物.
十氢萘 。
b.p 191.7 C
十氢化萘的两种构象异构体
反式十氢化萘
反式构象比顺式稳定.
顺式十氢化萘
(C) 氧化反应
O + CrO3 CH3COOH
O
1,4-ÏÏ (ÏÏϱ ÏÏÏ)
õ« ʽ ½á ¹ £¬ · ¢ É« ÍÅ
+ O2 V2O5
O C
O C
O
ϱ ÏÏÏ ×Ï á Ï
(± ϱ ÏÏÏÏ ¨Ï)
休克尔(Hückel)规则(具有芳香性的条件): • 具有平面的离域体系的单环化合物 • π电子数若为4n+2 (n=0,1,2,…整数) 就具有芳香性。 非苯芳烃: 符合休克尔规则,又不含苯环的烃类化合物
环多烯(CnHn)的分子轨道能级和基态电子构型图
⑴. 苯、萘、蒽、菲的芳香性
苯 电子数=6
(3) 萘环的取代规律 致活基团,同环取代
OH
致钝基团,异环取代
N O2
CH3 N O2
7.2.2其它稠环芳烃
除了萘以外,其它比较重要的稠环芳烃还有蒽和菲等
89 7
6 5 10
1 2
3 4
7 稠合芳烃与非苯芳烃

+
苯甲酰萘 α α 苯甲酰萘 αα 苯甲酰萘 苯甲酰萘 苯甲酰萘
28
稠环化合物:萘
(3)F-C酰基化反应:
COCH3 AlCl3 CS2 -15oC
O + CH 3CCl
AlCl3 C6H5NO2 250oC
75%
COCH3
90%
29
稠环化合物:萘
4 萘的硝化和溴化
Br Br2 CH3COOH Cl2 I2 C6H6 Cl
Na (or Li) NH3-C2H5OH (4mol)
18
稠环化合物:萘
反式-十氢化萘
顺式-十氢化萘
19
4 蒽的伯齐还原
Na/NH3(液) C2H5OH Na/NH3(液) C2H5OH Na/NH3(液) C2H5OH
5 菲的氧化
KMnO4
COOH COOH
20
稠环化合物:萘
(3)萘的加成
1,4,5,8称为位 2,3,6,7称为位 9,10位称为中位
亲电取代反应最易在萘的位,蒽的中位,菲的9,10位发生。 14
稠环化合物
8 7 6 5
α
9 10
1 2β 3 7 6
8
γ
9
α
3 9 2β 3 7 6 5 4 3 8 10 1 2 5 6 4 2 1 10 8 9
1
或
4
5
10
4
7
萘
三苯甲基钠是很强的碱,可以夺取弱酸中的质子形成三苯甲烷, 是有机合成中常用的强碱。
三苯甲烷与溴反应生成三苯溴甲烷:
6
三苯甲烷氧化得到三苯甲醇:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH π电子数 4+2=6,符合4n+2规则,具有芳香性。
艹 ③ 环庚三烯正离子(卓正离子) sp2杂化共平面
H NCS
sp3杂化非共平面
-NCS
+
+
π电子数 7-1=6,符合4n+2规则,具有芳香性。
④ 环辛四烯双负离子
四氢呋喃பைடு நூலகம்
+ 2K
非共平面 正八边形
π电子8+2=10, 符合4n+2规则,具有芳香性。 ⑤薁
萘 电子数=10
蒽 电子数=14
菲 电子数=14
芘 电子数=16 (周边14)
神奇的全碳分子——富勒烯
C60
C70
二、 休克尔规则
① 分子共平面性 ② 闭合的环状共轭体系 ③ π电子数= 4n + 2 (n = 0, 1, 2, 3……)
例: 苯 有6个π电子, 符合4n+2 (n =1)规 则,具有芳香性。 有8个π电子,不符合4 n+2规则, 不具有芳香性。 有4 个π电子,不符合4n+2规则, 不具芳香性。 有10个π电子,符合4n+2 (n =2) 规则,具有芳香性。 有14个π电子,符合4n+2 (n =3) 规则,具有芳香性。
NO2
CH 3
5 10 4 α α
CH3
2-甲基萘(β-甲基萘)
1,5- 二硝基萘
NO2
对甲基萘磺酸
SO 3H
2. 萘的性质:白色片状晶体,熔点80℃,沸点218℃,
易升华;具有特殊气味,有灭菌性,常用卫 生球即是粗萘。 ① 亲电取代反应
H
取代α位
E
H
E 其他共振式不稳定
E+ 取代β位
H E
其他共振式不稳定
OH
(80%)
O2N
NO2 +
NO2
NO2 (45%)
上面所讨论的仅仅是一般原则,实际上影响萘环取代的因 素比较复杂。
CH 3 CH3 HO3S
H2SO4 加热
二. 蒽及其衍生物
蒽 分子式:C14H10
共平面。 闭合共轭体系,有芳香性,但不饱和性比萘更显著。 蒽具有蓝色荧光的晶体,熔点216℃;可发生双烯合成反应。
3 4 5 6 2 1 1' 6' 2' 3' 4' 1" 5' 6" 5" 2" 3" 4"
3 4
2'
3'
联苯
对联三苯
■ 联苯的制备 工业上联苯是由苯蒸气通过温度在700℃以上红热 的铁管、热解得到。
H + H
700 ~ 800ºC
+ H2
实验室中可由碘苯与铜粉共热而制得。
2 I + 2 Cu + 2 CuI
② 氧化反应
K2Cr2O7 H2SO4
O
9.10-蒽醌
O
• 9,10-蒽醌也可由傅-克酰基化反应合成:
-蒽醌磺酸(染料中间体)
三. 菲
4 5 6 7
分子式: C14H10
3 2 1 10
白色片状晶体,熔点100℃,沸点 340 ℃ ,易溶于苯和乙醚,溶液呈蓝 色荧光。 9.10—位电子云密度最高
◇ 亲电取代反应主要发生在α-位 ◇ 亲电取代活性大于苯。
Br 卤化 + Br2
CCl4
+ HBr NO2
不需催化剂 NO2
5%
硝化
HNO3 H2SO4 95%
+
α-位: 比苯快750倍 β-位: 比苯快50倍 α-硝基萘可用于制备α-萘胺 NO2
Zn + HCl [H] α-萘胺 合成偶氮染料中间体
存在斥力 存在斥力
[10] 轮烯 无芳香性
[14] 轮烯 无芳香性
环十八碳九烯------- [18] 轮烯的结构式为: 环内氢不存在斥力,具有芳香性
[18] 轮烯 • 平面分子 • 电子数为18,符合4n+2规则
[16]、[20]轮烯均为非芳香性化合物
3. 稠环化合物芳香性的判断 只计算成环原子外围(即周边)的电子数.
多苯代脂肪烃 如:
CH CH
三苯甲烷
1,2-二苯乙烯
稠环芳烃 如:
萘 蒽 菲
7.1 联苯及其衍生物
联苯为无色晶体,熔点70℃,沸点254℃,不溶于水而 溶于有机溶剂。 联苯的化学性质与苯相似,在两个苯环上均可发生磺化、 硝化等取代反应。 联苯环上碳原子的位置采用下式所示的编号来表示:
2 1 1' 4' 5 6 6' 5'
CH3 CH3
10-甲基-1,2-苯并蒽
H2C
CH2
6-甲基-1,2-苯并-5,10-次乙基蒽
CH3
2-甲基-3,4-苯并菲 1,2,3,4-四苯并菲
7.3 非苯芳烃
一、芳香性
苯系芳烃的特点: ◆ 分子共平面性 ◆ 键长趋于平均化 ◆ 有共轭能(即离域能) ◆ 化学活性——易发生亲电取代,难发生加成发应。 ◆ π电子数= 4n + 2 (n = 0, 1, 2, 3……)
第七章 多环芳烃和非苯芳烃
7.1 联苯及其衍生物 7.2 稠环芳烃 7.3 非苯芳烃
本章作业
习题 习题 习题 习题 1. (1), (2), (5), (6) 2. (1), (3), (4), (6) 3. 7.
按照苯环相互联结方式,多环芳烃可分为如下三种: 联苯和联多苯 如:
联苯 对联三苯
多环芳烃
NH2
SO3H 磺化 + H2O
α−萘磺酸 动力学控制 速度控制产物
+ H2SO4
96% 165℃ 85% β−萘磺酸
SO3H 热力学控制 + H2O 平衡控制产物
磺酸基的空间位阻
-萘磺酸位阻大
-萘磺酸位阻小
萘磺酸碱熔可得到萘酚。
SO3H
NaOH 300ºC H+
OH
布赫雷尔(Bucherer)反应 萘酚的羟基被氨基置换而生成萘胺的反应称为布赫雷尔反应。
α 8 β 7 β 6 5 α 10 γ 4 α γ 9 α 1 2β 3β
α:1、4、5、8—电子云密度次之 β:2、3、6、7—电子云密度最低 γ:9、10—电子云密度最高
主要化学性质
① 加成反应 + H2
Pd / C 或Na/乙醇
H
H
9,10-二氢蒽
H H Br + Br2 H Br
H
9,10-二氢-9,10-二溴蒽
■ 亲电取代反应——对位为主
混酸
NO2
混酸
O2N
NO2
4,4'-二硝基联苯(主)
■ 联苯型旋光异构 CO2H NO 2
NO2 CO2H
NO2 CO2H
HO2C NO 2
当同一苯环上有两个不同基团时,具旋光性,有对映异构
■ 联苯胺重排 氢化偶氮苯在强无机酸(盐酸或硫酸)下发生重排得到 联苯胺,称为联苯胺重排。
+ -
π电子数= 6 + 4 =10,符合4n+2规则,具有芳香性。
判断芳香性规则:
● 共平面闭合共轭体系 ● π电子数符合4n+2
2. 大环芳香体系——轮烯 具有交替单双键的单环多烯,叫轮烯 分子式:CnHn
n≥10
判断轮烯芳香性三个条件 ① 共平面性或接近于平面,平面扭转不大于0.1nm ② 处于轮内的氢原子之间没或很小有空间排斥作用 ③ π电子数具符合4n+2休克尔规则.
8
9
菲的共振能为381.6 kJ/mol,比蒽大,因此菲比蒽稳定。 化学反应易发生在9, 10位。将菲氧化可得9, 10-菲醌。
O
CrO3 + CH3COOH
O
9, 10-菲醌
四. 其他稠环烃
熔点: 沸点:
致癌烃多为蒽和菲的衍生物,最初在从事煤焦油工作人 员中发现,皮肤较易生癌,后来于煤焦油中提出致癌物质, 并合成了其中所含的致癌烃。 现已知的致癌芳烃大体可分两类: 1,2-苯并蒽的衍生物 3,4-苯并菲的衍生物
萘离域能(共振能)255.2 kJ · mol-1,小于苯离域能的 二倍[2 × 150.7 = 301.4 (kJ · mol-1)],稳定性比苯差。
α 8 β7 β6 9 α 1 2β 3β
α: 1、4、5、8 — 电子云密度最高 β: 2、3、6、7 — 电子云密度次之 9、10 — 电子云密度最低
2
HCl
NO2 H2N
Zn + NaOH
NH NH2
NH
氢化偶氮苯 (无色晶体,合成染料中间体, 因致癌,近来已少用)
联苯胺
7.2 稠环芳烃
一. 萘 C10H8 1. 萘的结构
0.141nm 0.142nm 0.136nm 0.142nm
0.1390nm
共平面、sp2杂化、闭合共轭体系
萘分子主要有三个共振结构式:
H2 , Pt , 200℃ 压力 四氢化萘(萘满) 沸点270.2℃的液体 十氢化萘(萘烷) 沸点191.7℃的液体
O
③ 氧化反应
CrO 3 / CH 3COOH 10~15 ℃
+ 9 O2
V 2 O5 385℃
O C C O
1,4-萘醌
邻苯二甲酸酐(俗称苯酐)
=
O
O + 4 CO2 + 4 H2O
=
3. 萘环上二元取代定位规律
Z
{
-取代
Z为活化基,活化同环,同环4-位定位 Z为钝化基,钝化同环,异环5,8-位定位 Z为活化基,活化同环,同环1-位定位 Z为钝化基,钝化同环,异环5,8-位定位
