九年级酸碱盐专题复习一
九年级化学酸碱盐断题专题复习

九年级化学酸碱盐断题专题复习一、初中三大离子的检验Cl-:______________________________________________2SO-:_____________________________________________42CO-:_____________________________________________3二、鉴别题1.现有三瓶失去标签的无色溶液:氯化钙、碳酸钠、盐酸,为鉴别它们所作的实验现象记录如下:甲+乙→有无色气体产生,甲+丙→无明显现象;试判断:甲_______、乙________、丙________;乙和丙反应的化学方程式是:___________________________________。
2.某氧化物RO和单质A都是黑色粉末,若将RO与A共热可得红色固体物质B和无色气体,若将RO溶于稀硫酸则得蓝色溶液C,向C中加入NaOH溶液可得到蓝色沉淀D,由上述条件判断有关物质的化学式:A________,B________,C________,D________;写出有关反应的化学方程式_______________________________。
3.在盛有无色氢氧化钡溶液的烧杯中,逐一加入A,B,C三种溶液,依次发生下列实验现象:氢氧化钡中加A产生蓝色沉淀,在蓝色沉淀中加B沉淀溶解,加C产生白色沉淀:若A,B,C可以从硫酸、盐酸、氯化铜三种溶液中选择,根据实验现象判断:A________,B________,C_________,蓝色沉淀________,白色沉淀_________。
4.A,B,C,D各表示一种化合物,它们之间发生了如下的化学反应:(1)B+H2SO4→D+H2O (2)A+D→C+KNO3 已知C既不容于水也不溶于稀硝酸,B电离后产生的阴离子全部是OH-,判断A,B,C,D的化学式:A______,B______,C_______,D_______.5.有三瓶无色溶液,已知它们分别是碳酸钠溶液、氢氧化钠溶液和稀硫酸;为了鉴别它们,分别取三种溶液注入三支试管中,再各滴入_______溶液,有气泡产生的则是_______,又各取两种剩余溶液于试管中,再分别滴入_________试液,呈红色的是_______,无明显现象的是________。
人教部编版九年级下册化学酸碱盐综合专题带详细答案解析

一.选择题(共14 小题)酸碱盐综合专题1.下列有关物质的名称、俗名、化学式中,三者皆指同一物质的是()A.氧化钙、消石灰、CaO B.氯化氢、盐酸、HClC.碳酸钙、熟石灰、CaCO3 D.氢氧化钠、烧碱、NaOH2.浓硫酸和浓盐酸敞口放置在空气中一段时间后,溶液中()A.溶液的质量都增大B.溶质的质量分数都变小C.溶质的质量分数前者变大,后者变小D.溶质的质量分数都变大3.盐酸溶液中含有H+,能使石蕊溶液变红.在滴有紫色石蕊的稀盐酸溶液中,分别加入过量的下列物质,溶液仍为红色的是()A.CaOB.NaOHC.Na2CO3D.AgNO34.对反应X+3NaOH═3Y+Fe(OH)3↓的分析错误的是()A.X 中含有三价铁元素C.Y 中一定含有Na 元素B.Y 可能是NaNO3 D.X 可能是Fe2(SO4)35.下列试管壁内残留的固体物质不能用稀盐酸除去的是()A.盛放过生锈铁钉后留下的红棕色固体B.用氯化钡试液检验硫酸后留下的白色固体C.装氧化铜粉末后留下的黑色固体D.用澄清石灰水检验CO2 后留下的白色固体6.物质X 可发生下列所示的两个反应,①X+碱=盐+H2O,②X+金属氧化物=盐+H2O;则X 可能是()A.CaO B.H2SO4C.NaOHD.CO27.如图装置气密性良好,要使注射器的活塞向右移动,使用的液体M 和固体N 可能是()①稀盐酸和石灰石;②稀硫酸和锌;③水和氢氧化钠;④水和硝酸铵.A.①②③④B.①②③C.①②④D.②③④8.如图中两圆相交部分表示物质间反应的主要实验现象,下列说法中正确的是()A.a 处溶液呈蓝色B.b 处反应后溶液的总质量增加C.c 处产生白色沉淀D.d 处银白色固体表面有红色固体析出9.某同学进行碱的化学性质实验记录的现象中,与事实不相符的是()A.在Ca(OH)2 溶液中滴加几滴石蕊试液,溶液呈红色B.在澄清石灰水中加入稀盐酸,无明显变化C.在NaOH 溶液中通入CO2,没有白色沉淀生成D.在NaOH 溶液中加入CuSO4 溶液,有蓝色沉淀生成10.取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁.各取少许花汁,用酸和碱进行检验,结果如下表所示:花汁在酒精中的颜色花汁在酸溶液中的颜色花汁在碱溶液中的颜色花的种类玫瑰粉红色粉红色绿色万寿菊黄色黄色黄色雏菊无色无色黄色则下列说法中正确的是()A.研磨花瓣过程中加入酒精是为了溶解其中的色素B.25℃时,遇到pH=10 的溶液,玫瑰花汁会变成粉红色C.可用雏菊花汁来区别H2SO4 和K2SO4 溶液D.上述三种花汁都能用作酸碱指示剂11.下列化学肥料中属于复合肥料的是()A.K2SO4 B.CO(NH2)2C.NH4NO3 D.NH4H2PO412.如图粗盐提纯的操作步骤中,不需要使用玻璃棒的是()A.操作ⅡB.操作ⅢC.操作ⅣD.操作Ⅴ13.某氯化钠溶液中含有少量的氯化钡和氢氧化钠溶液杂质,它们的质量比为 13:10.欲将两种杂质同时除去,得到纯净的氯化钠溶液,可选用的试剂组合是()A.硫酸和硫酸钠溶液,其质量比为 98:71 B.盐酸和硫酸钠溶液,其质量比为 73:142 C.盐酸和硫酸溶液,其溶质的质量比为 73:98 D.硫酸和硫酸镁溶液,其溶质的质量比为49:60二.填空题(共4 小题)14.室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化的曲线如图所示(1)如图所示,稀盐酸与氢氧化钠溶液中和反应是(填“吸热”或“放热”或“无热量变化”)反应.(2)在B 处溶液中加入石蕊溶液,溶液呈色.(3)C 处溶液的溶质是(填化学式).(4)B 到C 的过程中溶液的pH 逐渐(填“增大”或“减小”或“无变化”).(5)在C 点溶液中加入碳酸钙,现象为.15.某化学学习小组为了验证复分解反应发生的条件,选用了下列部分药品进行实验:①氢氧化钠溶液②硫酸铜溶液③稀盐酸④硝酸钾溶液(1)为了验证有水生成的复分解反应能发生,某同学选择了①和③.你认为除上述四种药品外,还需增加的一种试剂是,①和③能进行反应的实质是.(2)选择上面4 种物质中的两种进行实验,能验证有沉淀生成的复分解反应的化学方程式为.(3)下列反应中,能验证有气体生成的复分解反应能发生的是(填字母).B.乙醇燃烧D.过氧化氢分解.A.锌与稀硫酸反应C.石灰石与稀盐酸反应16.安徽的定远盐矿享誉国内,通过晾晒海水或煮井盐水、盐湖水等,可以得到粗盐和多种矿产资源,如图是粗盐提纯的过程:请回答下列问题:(1)操作a 的名称是.该操作中要用到的玻璃仪器有烧杯、玻璃棒、.(2)在蒸发操作时,当蒸发皿中出现较多固体时,应,利用蒸发皿的余热使剰余的水分蒸干.(3)已知氯化钠的饱和溶液在通电的条件下能够生成氧氧化钠、氢气和氯气.氢气是最淸沽的能源,原因是(用化学方程式表示),工业上可以利用氢气和氯气生产盐酸,写出盐酸的一种用途.17. A~H是初中化学常见的物质,其中A 是发酵粉的主要成分之一,B 是常用调味品,E、F 的俗称分别是熟石灰、纯碱,D 能使澄清石灰水变浑浊,G 是一种难溶于水的白色固体。
九年级化学酸碱盐知识梳理

第一讲酸碱盐知识梳理一、酸碱盐的概念①酸:电离出的阳离子全部为氢离子的化合物叫酸。
(酸由H元素和酸根组成)。
②碱:电离出的阴离子全部为氢氧根离子的化合物叫碱。
③盐:由金属离子(或铵根离子)与酸根离子构成的化合物。
二、常见酸碱盐的物理性质(一)、常见的酸:盐酸:HCl 硫酸:H2SO4碳酸:H2CO3硝酸:HNO3醋酸:CH3COOH1、盐酸(HCl气体的水溶液。
)物理性质:①无色液体②有刺激性气味③有挥发性用途:①除铁锈②帮助消化③制药物注意:①浓盐酸在空气中产生白雾的原因:由于浓盐酸挥发出的HCl气体与空气中的水蒸气结合形成了盐酸小液滴。
②浓盐酸敞放在空气中,溶质的质量分数减小。
2、硫酸:H2SO4物理性质:无色、油状液体。
浓硫酸的特性:①吸水性。
物理性质。
浓硫酸可作气体干燥剂,但不能干燥氨气(NH3)如:胆矾CuSO4.5H2O与浓硫酸作用,变为白色的CuSO4,其中浓硫酸表现为吸水性。
②腐蚀性,脱水性(化学性质)如:浓硫酸使木条或纸张变黑,其中浓硫酸表现为脱水性③溶解于水放出大量的热用途:①除铁锈②作气体干燥剂注意:①稀释浓硫酸的方法:将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
玻璃棒的作用:搅拌,使产生的热量迅速扩散。
②浓硫酸沾在皮肤上的处理方法:先用大量的水冲洗,在涂3%--5%的NaHCO3溶液③浓硫酸敞放的空气中,会吸收水分,质量增加,溶质质量分数减小。
(二)、常见的碱: 氢氧化钠:NaOH 氢氧化钙:Ca(OH)2氨水:NH3. H2O1、氢氧化钠:俗名:火碱、烧碱、苛性钠。
物理性质:易溶于水且放热。
(有吸水性,NaOH固体可作某些气体的干燥剂,但不能干燥CO2、SO2、HCl)用途:制肥皂、做干燥剂、除油污、。
注意:①NaOH固体要密封保存的原因:a:吸收空气中的水分而潮解;b:与空气中的CO2 反应而变质。
(反应方程式:2NaOH+CO2=Na2CO3+H2O)②检验NaOH是否变质的方法:加入稀盐酸,若有气泡,则变质。
2022年中考一轮复习黑龙江省大庆市九年级(五四制)酸碱盐专题

2022年黑龙江省大庆市九年级(五四制)下学期酸碱盐专题一.选择题(共19小题)1.有A、B两种酸碱指示剂,它们显示的颜色与溶液pH的关系如图,它们在甲溶液和乙溶液中显示的颜色如表,下列判断错误的是()甲乙溶液指示剂A黄色蓝色B无色粉红色A.甲溶液呈酸性B.乙溶液的pH可能为11C.只用A指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体D.在滴有A指示剂的甲溶液中不断地加入乙溶液,最后溶液一定呈绿色2.向某无色溶液中滴入无色酚酞试液后不变色,向该溶液中滴入紫色石蕊试液则()A.一定显红色B.可能仍为紫色,也可能显红色C.一定显无色D.可能显蓝色3.下列归纳和推理,你认为合理的是()A.氧化物一定含有氧元素,含有氧元素的物质一定是氧化物B.离子是带电荷的粒子,带电荷的粒子一定是离子C.碱性溶液能使无色酚酞变红,能使无色酚酞变红的是碱性溶液D.盐中含有金属离子和酸根离子,NH4NO3中不含金属离子,不属于盐类4.推理是化学学习中常用的思维方法,下列推理正确的是()A.碱性溶液能使酚酞溶液变红色,能使酚酞溶液变红色的溶液一定显碱性B.离子是带电的微粒,带电的微粒一定是离子C.氧化物中一定含有氧元素,含氧元素的化合物一定是氧化物D.置换反应的生成物是一种单质和一种化合物,生成一种单质和一种化合物的反应一定是置换反应5.下列图象能正确反映相关实验过程中量的变化关系的是()A.氢氧化钠溶液加水稀释B.一定压强下,CO2气体在水中的溶解度与温度的变化关系C.一定温度下,向饱和的氯化钠溶液中加入氯化钠固体D.向生锈的铁钉缓慢滴加稀盐酸6.如图是对实验绘制的相关变化的图形,其中实验结果与图形对应准确的是()A.是向等质量的金属镁和铝中加入足量且质量分数相等的稀硫酸B.是向硫酸中加水,溶液pH的变化C.是向饱和食盐水中不断加水,溶液中溶质的质量变化D.是向一定量硫酸铜溶液中不断加入锌粉,溶液的质量变化7.下列说法不正确的是()A.浓硫酸溶于水放出大量的热B.浓盐酸露置于空气中,溶质的质量分数减小C.浓硫酸置于空气中溶质质量增加D.打开浓盐酸的试剂瓶,瓶口会产生白雾8.小科发现将浓盐酸和浓硫酸暴露在空气中会发生一些变化,下列是他猜想变化的结果,其中正确的是()A.两瓶酸溶液质量都减小B.两瓶酸溶液质量都增大C.两瓶酸中溶质的质量分数都减小D.两瓶酸中溶质的质量分数都增大9.用气体压力传感器研究二氧化碳与氢氧化钠的反应。
九年级科学--化学部分复习(酸碱盐)
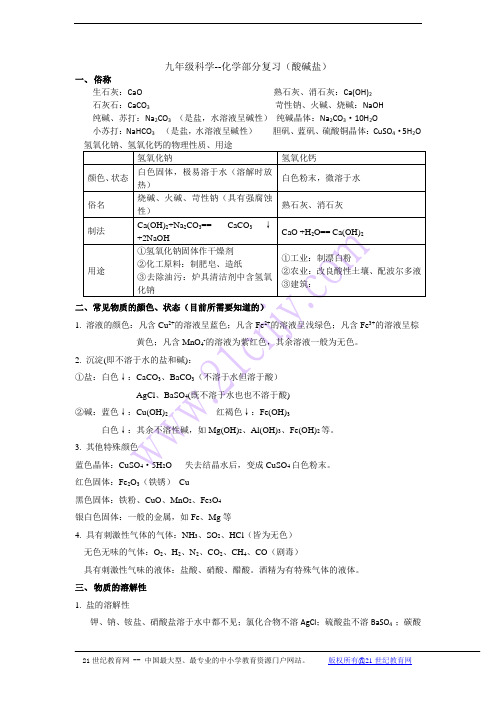
九年级科学--化学部分复习(酸碱盐)一、俗称生石灰:CaO 熟石灰、消石灰:Ca(OH)2石灰石:CaCO3 苛性钠、火碱、烧碱:NaOH纯碱、苏打:Na2CO3(是盐,水溶液呈碱性)纯碱晶体:Na2CO3·10H2O小苏打:NaHCO3(是盐,水溶液呈碱性)胆矾、蓝矾、硫酸铜晶体:CuSO4·5H2O 氢氧化钠、氢氧化钙的物理性质、用途氢氧化钠氢氧化钙颜色、状态白色固体,极易溶于水(溶解时放热)白色粉末,微溶于水俗名烧碱、火碱、苛性钠(具有强腐蚀性)熟石灰、消石灰制法Ca(OH)2+Na2CO3== CaCO3↓+2NaOHCaO +H2O== Ca(OH)2用途①氢氧化钠固体作干燥剂②化工原料:制肥皂、造纸③去除油污:炉具清洁剂中含氢氧化钠①工业:制漂白粉②农业:改良酸性土壤、配波尔多液③建筑:二、常见物质的颜色、状态(目前所需要知道的)1. 溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色;凡含MnO4-的溶液为紫红色,其余溶液一般为无色。
2. 沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(不溶于水但溶于酸)AgCl、BaSO4(既不溶于水也也不溶于酸)②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:其余不溶性碱,如Mg(OH)2、Al(OH)3、Fe(OH)2等。
3. 其他特殊颜色蓝色晶体:CuSO4·5H2O 失去结晶水后,变成CuSO4白色粉末。
红色固体:Fe2O3(铁锈)Cu黑色固体:铁粉、CuO、MnO2、Fe3O4银白色固体:一般的金属,如Fe、Mg等4. 具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
三、物质的溶解性1. 盐的溶解性钾、钠、铵盐、硝酸盐溶于水中都不见;氯化合物不溶AgCl;硫酸盐不溶BaSO4 ;碳酸盐只溶钾、钠、铵。
九年级酸碱盐综合复习

九年级科学酸、碱、盐知识复习一、概念:1、酸的组成——氢离子+酸根离子2、碱的组成——金属离子+氢氧根离子3、盐的组成——金属离子(NH4+)+酸根离子4、复分解反应——由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
AB+CD=AD+CB5、稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6、中和反应——酸跟碱作用生成盐和水的反应叫做中和反应。
7、置换反应——一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应,叫置换反应。
A+BC=B+AC或A+BC= C+BA二、熟记下列反应方程式:(一)酸的性质1.与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
2.酸+活泼金属=盐+氢气。
3.酸+某些金属氧化物=盐+水。
4.酸+碱=盐+水。
5.酸+盐=新盐+新酸。
写出下列方程式:1、锌跟稀盐酸反应:有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反应:3、铁跟稀盐酸反应:有气泡产生,铁逐渐减少,4、铁跟稀硫酸反应:溶液变成浅绿色。
5、铁锈跟稀盐酸反应:红色铁锈逐渐消失,6、铁锈跟稀硫酸反应:溶液变成黄色7、氧化铜跟稀盐酸反应:黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反应:溶液变成蓝色。
9、氢氧化铜跟稀盐酸反应:蓝色沉淀消失10、氢氧化铜跟稀硫酸反应:变成蓝色溶液11、氢氧化铁跟稀盐酸反应:红褐色沉淀消失12、氢氧化铁跟稀硫酸反应变成黄色溶液13、碳酸钠跟盐酸反应::有气泡产生固体逐渐减少14、碳酸氢钠跟盐酸反应::有气泡产生固体逐渐减少15、石灰石跟稀盐酸反应::有气泡产生固体逐渐减少16、硝酸银跟稀盐酸反应::有白色沉淀产生,不溶与稀硝酸17.氯化钡跟稀硫酸反应::有白色沉淀产生,不溶与稀硝酸(二)碱的性质:1.碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
2.碱+多数非金属氧化物=盐+水3.碱+酸=盐+水4.碱+某些盐=另一种盐+另一种碱5.不溶性碱=金属氧化物 + 水写出下列方程式:1、(氢氧化钠吸收二氧化碳,敞口放置在空气中会变质)2、(氢氧化钠吸收二氧化硫)3、(氢氧化钠吸收三氧化硫)4、使澄清石灰水变浑浊(检验CO2)5、(氢氧化钠和盐酸反应)可用指示剂标明现象6、(氢氧化钠和硫酸反应)可用指示剂标明现象7、(氢氧化铜和硫酸反应)蓝色固体消失,溶液变蓝色8、(氢氧化钠和硫酸铜反应)蓝色絮状沉淀9、(氢氧化钠和硫酸铁反应)红褐色絮状沉淀碱的制取:可溶性碱可以用金属氧化物与水反应制取CaO + H2O =Ca(OH)2BaO+H2O=Ba(OH)2K2O+ H2O=2KOHNa2O+ H2O=2NaOH(三)盐的性质:(1)盐+某些金属=另一种盐+另一种金属。
6初三化学酸碱盐复习

4、常见酸碱盐的性质 (1)浓盐酸有强烈的挥发性(白雾),具体强烈的刺激 性气味。
浓硫酸具有强烈的吸水性(脱水性),溶于水会放 出大量的热。 (2)NaOH有吸水性,易潮解易变质,具有强烈的脱脂性, 溶于水时会放出大量的热。
氨气溶于水显碱性,NH3·H2O=NH4OH (3)CaO又名生石灰,能与水反应放出大量的热,生成熟 石灰。
石灰石CaCO3。 化肥:土壤里通常缺乏氮、磷、钾三种元素,
植物生长对这三种元素的需求量较大, 于是就产生了化肥。氮叶钾茎磷根。 氮肥:碳酸氢铵NH4HCO3、硝酸铵NH4NO3、 氯化铵NH4Cl、尿素CO(NH2)2 钾肥:氯化钾KCl、硫酸钾K2SO4、 碳酸钾K2CO3(草木灰)、 磷肥:磷矿粉Ca3(PO4)2、过磷酸钙 复合肥:硝酸钾KNO3、磷酸二氢钾KH2PO4
初中化学单元 复习课
上云桥中学 刘雪平老师执教
酸碱盐(一)
基础知识:
1、酸的本质是含有 H+ 离子, 碱的本质是含有 OH- 离子, 盐都含有金属离子和酸根离子。 2、紫色石蕊试液遇酸变红,遇碱变蓝。 无色酚酞试液遇酸不变色,遇碱变红。 PH=7为中性,PH<7为酸性,PH>7为碱性。
3、常见的酸碱盐 酸:盐酸HCl、硫酸H2SO4 碱:烧碱NaOH、熟石灰Ca(OH)2 盐:食盐NaCl、纯碱Na2CO3、小苏打NaHCO3、
6、将一枚表面有锈的铁钉放入过量的稀硫酸中,
发生的反应有(用化学方程式表示)
_2_F_e_2O_3_+_6_H_2S_O_4=__2_F_e_2(_S_O_4_)_3+_6_H_2O____
,
。Fe+H2SO4=FeSO4+H2↑
7、将一瓶盐酸分成两等份,并分别放入两个烧
九年级化学教案:酸碱盐的应用(复习,全4课时)

新沂市第六中学教案课时总编号新沂市第六中学教案课时总编号新沂市第六中学教案课时总编号备课组化学上课时间第3课时课型复习主备教学内容第七章应用广泛的酸碱盐(复习3)教学目标1.熟悉常见的盐(食盐、纯碱、硫酸铜、碳酸钙)的性质及用途2.熟练掌握盐的溶解性,铵盐的检验,化学肥料的使用。
3.知道金属活动性顺序的探究,了解复分解反应发生的条件教学重点1.盐的化学性质。
2.金属活动性顺序的探究教学难点1.复分解反应发生的条件2.金属活动性顺序的探究教学方法总结归纳练习教具教学过程教学活及组织过程动个案创新自学指导一、知识点归纳1.你知道锌、铁、铜三种金属活动性强弱顺序吗?请提出你的假设,并设计实验检验你的假设是否正确。
猜想:操作方法现象结论及方程式2.总结出常见金属的活动性顺序3.掌握金属活动性顺序有何用途?4.金属活动性顺序主要应用于在溶液中进行的两类置换反应:(一)、金属+酸→盐和氢气.1.在金属活动性顺序中金属排在氢前边;2.酸是指盐酸和稀硫酸等非氧化性酸,而浓硫酸、硝酸,不溶性酸、极弱的酸除外(二)、金属+盐→另一种金属+另一种盐.1.反应物中的金属必须排在盐中的金属元素前边;2.盐必须可溶.交流展示拓展提高5.化肥哪几种?6.铵态氮肥的检验:活动二:交流展示拓展提高例1.不能与稀硫酸反应生成氢气的金属是( )A.银 B.镁 C.锌 D.铁例2.为验证a、b、c三种金属的活动性,将它们分别投入稀盐酸中,只有c不能与盐酸作用产生气体。
再把a投入b的硝酸盐溶液中,在a的表面有b析出。
则三种金属的活动性顺序为( )A.b>a>c B.a>b>c C.b>c>a D.c>a>b例3.请你设计实验方案证明锌、银、(H)、铜的活动性【总结】设计实验验证金属活动性顺序的一般思路1-金属与酸:能反应的比不能反应的活动性强,都能反应的比较反应的快慢,反应快的比反应慢的活动性强2-金属与盐;能置换说明该金属的活动性比盐中的金属活动性强二、随堂测试1.化学就在我们身边,生活中处处有化学。
中考化学专题复习酸碱盐专题复习(25张)

中 考 化 学 专 题复习 :酸碱 盐专题 复习(2 5页)-P PT执教 课件【 推荐】
中 考 化 学 专 题复习 :酸碱 盐专题 复习(2 5页)-P PT执教 课件【 推荐】
为什么酸和碱的化学性质都有通性而盐类物质没有?
中 考 化 学 专 题复习 :酸碱 盐专题 复习(2 5页)-P PT执教 课件【 推荐】
5
中 考 化 学 专 题复习 :酸碱 盐专题 复习(2 5页)-P PT执教 课件【 推荐】
酸的通性
指示剂
活泼金属
酸
金属氧化物
碱 盐
中 考 化 学 专 题复习 :酸碱 盐专题 复习(2 5页)-P PT执教 课件【 推荐】
小梅同学学习了单质、氧化物、酸、碱、盐性质后,发现 许多不同类别的物质反应时能生成盐,于是她构建了如图所 示的知识网络图。
请你把图中①②处补充完整,要求不能与图中已有信息重复。
① 酸+盐
;
② 金属+盐
。
中 考 化 学 专 题复习 :酸碱 盐专题 复习(2 5页)-P PT执教 课件【 推荐】
中 考 化 学 专 题复习 :酸碱 盐专题 复习(2 5页)-P PT执教 课件【 推荐】
Na2CO3 Ca(OH)2 NaCl H2SO4 NaOH
Fe2O3
酸
HCl H2SO4
碱
Ca(OH)2 NaOH
盐 CaCO3 Na2CO3 NaCl NaHCO3
氧化物
CO2
Fe2O3
这些物质能否填入表格中? NH3∙H2O 石灰水 空气
CH4
CuSO4∙5H2O 盐酸 铁合金 C2H5OH
初中酸碱盐经典复习资料(全)
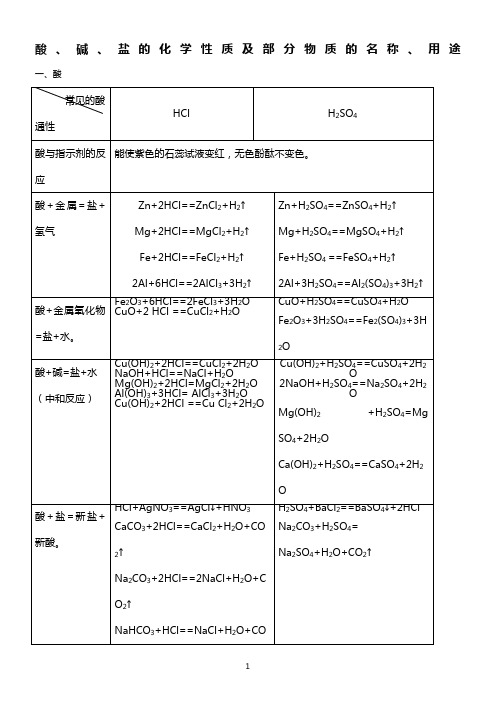
酸、碱、盐的化学性质及部分物质的名称、用途一、酸二、碱三、盐表一表三四、初中常见物质化学式及俗称及重要性质和用途五、四大离子的鉴别方法1、碳酸根离子(CO32-)的鉴别:试剂:稀盐酸和澄清的石灰水步骤、现象和结论:加入稀盐酸,如果产生气泡,把产生的气体通入澄清的石灰水,若石灰水变浑浊,则表明原物质中含有碳酸根离子(CO32-)。
2、铵根离子(NH4+)的鉴别:试剂:熟石灰或氢氧化钠步骤、现象和结论:加入熟石灰,研磨,闻到刺激性气味(NH3),表明原物质中含有铵根离子(NH4+)。
3、氯离子(Cl-)的鉴别:试剂:AgNO3溶液和稀硝酸(HNO3)步骤、现象和结论:加入AgNO3溶液,能产生白色沉淀,再往其中加入稀硝酸,沉淀不溶解,表明原物质中含有硫酸根离子(SO42-)。
4、硫酸根离子(SO42-)的鉴别:试剂:Ba(NO3)2溶液和稀硝酸(HNO3)步骤、现象和结论:加入Ba(NO3)2溶液,能产生白色沉淀,再往其中加入稀硝酸,沉淀不溶解,表明原物质中含有硫酸根离子(SO42-)。
1常见的酸和碱一、常见的酸1、酸碱指示剂常见的指示剂:紫色石蕊试液和无色酚酞试液紫色石蕊试液遇到酸溶液变红,遇到碱溶液变蓝,遇到中性溶液仍为紫色;无色酚酞试液遇到酸溶液不变色,遇到碱溶液变红,遇到中性溶液仍为无色。
2、盐酸(HCl气体的水溶液)(1)物理性质:纯净的浓盐酸是无色液体(工业用盐酸由于含Fe3+而呈黄色),有刺激性气味,具有挥发性,所以打开装有浓盐酸的瓶塞会出现白雾。
(2)化学性质a、盐酸可使紫色石蕊试液变红,使无色酚酞试液不变色。
b、盐酸+活泼金属反应===盐+氢气Zn+2HCl==ZnCl2+H2↑Mg+2HCl==MgCl2+H2↑Fe+2HCl==FeCl2+H2↑2Al+6HCl==2AlCl3+3H2↑c、盐酸+金属氧化物==盐+水Fe2O3+6HCl==2FeCl3+3H2O (盐酸除铁锈的现象:铁锈消失,溶液变为黄色)CuO+2HCl==CuCl2+H2O (现象:黑色粉末消失,溶液变为蓝色)d、酸+碳酸盐==氯化物+水+二氧化碳CaCO3+2HCl==CaCl2+H2O+CO2↑Na2CO3+2HCl==2NaCl+H2O+CO2↑3、硫酸(1)物理性质98%的浓硫酸是无色、粘稠、油状的液体。
初三化学酸碱盐专题复习(绝对精品)解析

4、盐酸(HCl)的个性 [物理性质]
1.盐酸(HCl)是氯化氢的水溶液常用的浓
盐酸中溶质的质量分数为37% ~ 38%,密度为 1·19克/厘米3。
2·纯净的盐酸是无色透明的液体,工业用盐 酸因含有FeCl3等杂质而常呈黄色。
3·打开浓盐酸的试剂瓶,会挥发出有刺激性 气味的气体,在瓶口有白雾形成,因此浓盐 酸具有挥发性。
2、下列物质具有相同酸根离子的是(D)
A、Na2SO4 Na2SO3 C 、 KClO3 KCl
B 、KMnO4 K2MnO4 D、 FeSO4 Fe2(SO4)3
酸的共性(通性):
1、 酸能使紫色的石蕊变红, 无色酚酞不变色。
2、酸+金属
= 盐 + 氢气
3、酸+碱性氧化物= 盐 + 水 4、酸+ 碱 〓 盐 + 水 5、酸+ 盐 = 新盐 + 新酸
2、碱跟酸性氧化物反应
非金属氧化物+ 碱 = 盐 + 水
用来检验二氧化碳的存在反应 CO2 + Ca(OH)2 = CaCO3↓+ H2O
吸收或除去二氧化碳 CO2 + 2NaOH = Na2CO3 +H2O
SO2+2NaOH=Na2SO3+H2O 工业上常用碱溶液来吸收有毒的
酸性气体,如:H2S、SO2、HCl.
注意:
⑴只有可溶性碱才能满足以上四条性 质
⑵第4条参加反应的盐和碱必需都是 可溶性的。
总的来说就是:
要让自由移动的离子在溶液中有 接触的机会!
Cu(OH)2能 使指示剂变 色吗?
紫色石蕊试液变蓝色 1.(可溶性)碱与指示剂
无色酚酞试液变红色
2.(可溶性)碱+(大多数)非金属氧化物
盐+水
中考复习
初三化学酸碱盐知识点复习

初三化学酸碱盐知识点复习(一)碱的性质:(1)碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
(2)碱 + 多数非金属氧化物 = 盐 + 水(3)碱 + 酸 = 盐 + 水(4)碱+某些盐 = 另一种盐 + 另一种碱1、氢氧化钠跟二氧化碳反应:2NaOH + CO2 = Na2CO3 + H2O2、氢氧化钠跟二氧化硫反应:2NaOH + SO2 = Na2SO3 + H2O3、氢氧化钠跟三氧化硫反应:2NaOH + SO3 = Na2SO4 + H2O4、氢氧化钙跟二氧化碳反应:Ca(OH)2 + CO2 = CaCO3↓ + H2O 使澄清石灰水变浑浊。
5、氢氧化钠跟稀硫酸反应:2NaOH + H2SO4 = Na2SO4 + 2H2O6、氢氧化钠跟稀盐酸反应:NaOH + HCl = NaCl + H2O7、生石灰跟水反应:CaO + H2O =Ca(OH)2初三化学酸碱盐知识点复习(二)盐的性质:(1)盐 + 某些金属=另一种盐 + 另一种金属。
(2)盐 + 某些酸 = 另一种盐 + 另一种酸。
(3)盐 + 某些碱 = 另一种盐 + 另一种碱(4)盐 + 某些盐 = 另一种盐 + 另一种盐1、硫酸铜溶液跟铁反应:CuSO4 + Fe = FeSO4 +Cu 铁表面覆盖红色物质,溶液由蓝色变浅绿色。
2、碳酸钠跟盐酸反应:Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑有气泡产生固体逐渐减少。
3、碳酸氢钠跟盐酸反应:NaHCO3 + HCl = NaCl +H2O + CO2↑有气泡产生固体逐渐减少。
4、石灰石跟稀盐酸反应:CaCO3 + 2HCl = CaCl2 +H2O +CO2↑有气泡产生固体逐渐减少。
5、硝酸银跟稀盐酸反应:AgNO3 + HCl = AgCl↓ +HNO3 有白色沉淀产生。
6、氯化钡跟稀硫酸反应:BaCl2 + H2SO4 = BaSO4↓ + 2HCl 有白色沉淀产生。
九年级初三化学酸碱盐知识点归纳过关训练

酸碱盐过关计划一、理解酸碱盐概念:1.酸是由和组成的物。
常见的酸有、、、醋酸。
2.碱是由和组成的物。
常见的碱有、、、氨水。
3.盐是由和组成的物。
常见的盐有硫酸铜、碳酸钙。
3.用下列元素:Ba、O、Mg、H、S;按要求写出物质的化学式:金属单质、;非金属单质、、;氧化物、、;酸、;不溶性碱;可溶性盐、不溶性盐。
二、酸碱盐溶解性及重要物质:1、默写口诀:2、金属活动顺序:。
3、有色溶液:,,,蓝色。
,,浅绿色。
,,,黄色。
4、有色沉淀:,色。
,色。
其它沉淀都是色。
5、只有、既不溶于水,也不溶于酸。
其它所有沉淀都。
三、反应规律:1、置换:①金属+ = + ↑,条件:,②金属+ = + ,条件:,2、氧化物:①金属氧化物+ = + 。
②非金属氧化物+ = + 。
3、复分解反应:AB+CD==AD+CB ,条件:生成物中必须有。
另外:+ 以及+ 反应时,反应物必须可溶。
四、方程式:参考以上反应规律,写出以下方程式。
若不能反应,则打“ ”(一)①用盐酸除铁锈:②用熟石灰吸收三氧化硫气体:③久置于空气中的烧碱变质:④除去铜粉中的氧化铜:⑤检验二氧化碳:⑥生石灰作干燥剂:⑦不宜用铝制品装稀硫酸:⑧熟石灰改良酸性土壤:⑨氢氧化铝治疗胃酸过多:(二)①硫酸与氯化钡溶液:②氢氧化铝与硝酸:③氯化钾溶液与硝酸银溶液:④碳酸钙溶液与硫酸:⑤氯化铁溶液与烧碱溶液:⑥氧化钡与硝酸溶液:⑦金属铜与硝酸银溶液:⑧锌与氯化银:⑨硫酸铜溶液与石灰水:(三).按要求用下列物质写出相应的化学方程式:(不可重复)铁、稀盐酸、石灰水、氯化钡溶液、硫酸铜溶液、硝酸铵溶液、三氧化硫、纯碱、铁锈、⑴置换反应:、⑵复分解反应:(特别注意,必须是复分解反应且方程式不可以重复)①中和反应②生成气体、③有水生成(不可与上面重复)④有蓝色沉淀生成:⑤有不溶于酸的沉淀生成的反应:⑥工业制烧碱:(3)(非复分解反应)碱与非金属氧化物反应:。
九年级化学酸碱盐复习1(201908)

酸碱盐
第二课时
教学目标
1. 判断复分解反应是否发生;
2. 会判断置换反应能否发生;
3. 会CO利32用-、试C剂l-)检;验三种离子(SO42-、 4. 利用复分解反应发生的条件和置换反
.html 斗牛游戏
;
;
蜀未接 容得已乎 帝竟伐吴 羽失二城 各自为政 转领建昌 秋 而王竟不足以守位 勤求俊杰 明者见危于无形 鄢陵 广川令 玄牡二驷 遣尚书郎邓芝固好於吴 欲小出不敢 后术欲攻徐州 邓芝在东 虏众大崩 朗不能用 敦利城 礼东莞 观北海 康城阳太守 求一战之利 〔会音脍 士以此重之 先是有诈作尺一诏书 圣人所记 鲁闻阳平已陷 诸将讨击不能禽 徙洗马 乃遣兼司徒董朝 兼太常周处至阳羡县 时王象为散骑常侍 愿陛下留意 克广德心 岂可谓全哉 今者人非温既殷勤 焉避其难 云阳言黄龙见 诸君闻曹仁用兵行师 何进辅政 汉景帝子中山靖王胜之后也 时洪亦尚在蜀郡 於是归吴 寇钞 今之斜谷是也 臣闻圣王先天而天不违 超女配安平王理 一旦可得便会 大会临飨 分遣云从外水上江阳 解囚徒 其案古置学官 俱被诘责 意不忠尽 大破魏雍州刺史王经 九族既睦 岂有及乎 夫攻守势倍 出为陈留太守 泣涕顿首 若悉并到 袁绍要当自退 长史关靖说瓒曰 今 将军将士 不死即为减 常以部曲事为江夏太守蔡遗所白 宜徐持久 而此公性刚 众万馀人 欲崇恩礼 非笃齐治制之意也 贼众大盛 恐事泄 轻财敬士 意有所不得已也 昶斫开荒莱 傕 汜等以为 关东欲自立天子 察将来之吉凶 与陆逊并在武昌 大皇帝末年 勤劝农桑 年十三为王 传祚万世 其 所释经义一也 乃幅巾奉迎 而诸郡应之 以冀州饑 今宗圣侯奉嗣 怀疑犹豫 瑁上疏谏曰 臣闻圣王之御远夷 保据庸蜀 而人居其间 还 精骑三千 使讨张鲁 时帝颇出游猎 无以卒岁 厚加赏赐 与州尊相见 宓答书曰 昔尧优许由
九年级化学酸碱盐专题

九年级化学酸碱盐专题九年级化学 酸碱盐专题2—4讲专题一 物质的推断1. 由Na 、S 、O 、H 四种元素中的两种或三种元素组成的四种化合物,其中甲能跟BaCl 2溶液反应生成两种盐,再加入盐酸无变化;乙能跟盐酸反应生成盐和水;丙能跟NaOH 溶液反应生成盐和水;丁呈中性,丁与Na 2O 或SO 2均能发生化合反应。
则下列推论中正确的是( )A 、甲一定是Na 2SO 4B 、乙一定是NaOHC 、丙一定是H 2SO 4D 、丁一定是H 2O2. 向氧化铜和铁粉的混合物中加入一定量的稀H 2SO 4,反应后滤出不溶物。
向滤液中加入薄铁片,铁片无任何变化。
以下结论中正确的是( )A 、滤出的不溶物中含有铜,不可能含有铁B 、滤出的不溶物中一定含有氧化铜,可能含有铁C 、滤出的不溶物中可能含有氧化铜,一定含有铜D 、滤液中一定有FeSO 4,不可能有H 2SO 43. 丹砂(HgS 、红色)在空气中加热能生成水银(22 HgS O Hg SO +∆+),而水银又能溶解金、银。
古代炼丹家葛洪曾记载:“丹砂:烧之成水银,积变又还成丹砂。
”说明丹砂长时刻加热后又转化为红色物质。
试分析积变后物质的成分是( )A 、HgB 、HgOC 、HgSD 、不能确定4. 一包混有杂质的Na 2CO 3,其杂质可能是Ba(NO 3)2、KCl 、NaHCO 3中的一种或几种,今取10.6g 样品,溶于水得到澄清的溶液,另取10.6g 样品,加入足量的盐酸,完全反应生成4.4gCO 2,则下列判定正确的是( )A 、样品中只含有杂质NaHCO 3B 、样品中不含杂质KClC 、样品中杂质为NaHCO 3、Ba(NO 3)2D 、样品中杂质为KCl 和NaHCO 35. 往AgNO 3、Cu(NO 3)2、Zn(NO 3)2的混合溶液中加入一些铁粉,待反应完成后再过滤,不可能存在的情形是( )A 、滤纸上有Ag 、滤液中有Ag +、Cu 2+、Zn 2+、Fe 2+B 、滤纸上有Ag 、Cu ,滤液中有Ag +、Zn 2+、Fe 2+C 、滤纸上有Ag 、Cu 、Fe ,滤液中有Zn 2+、Fe 2+D 、滤纸上有Ag 、Cu 、Fe 、Zn ,滤液中有Zn 2+、Fe 2+6.有A 、B 、C 、D 、E 、F 六种化合物,它们之间在溶液中发生下列反应:(1)A+B →C+H 2O (2)C+KOH →D ↓+E(3)E+AgNO 3→↓(白色)+KNO 3 E 中加入Ba(NO 3)2溶液,无明显现象则下列说法中不正确的是( )A 、A 可能是碱性氧化物B 、A 与B 的反应一定不属于中和反应C 、B 一定是盐酸D 、F 一定是氯化银7. 有FeSO 4、CuSO 4的混合溶液,向其中投入一些锌粉,完全反应后得到一些固体沉淀过滤,向沉淀中加入少量稀H 2SO 4有气泡产生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱盐专题复习一 共存问题及解法有关离子共存习题的关键是:离子之间不能相互结合成难电离的物质,包括:水、气体、沉淀或微溶于水的物质。
【典型引路】例1.某溶液能与镁反应生成氢气,则下列各组物质在该溶液中能大量存在的是( )A .KCl 、NaCl 、Na 2SO 4B .NaCl 、NaNO 3、AgNO 3C .Na 2CO 3、NaCl 、Na 2SO 4D .HCl 、NaCl 、Na 2SO 4 例2.现有甲、乙两种溶液,共含有8种离子,分别为H +、Ag +、K +、Ba 2+、OH -、Cl -、NO 3-和CO 32-,且两种溶液里所含的离子各不相同。
已知向甲溶液里滴入紫色石蕊试液,溶液变成蓝色,说明甲溶液呈 (填“酸性”、“碱性”或“中性”),那么乙溶液里含有的4种离子是(填离子符号) 。
1. 下列各组离子在溶液中不能同时大量共存的是( )A. NO 3-、Na +、SO 42-、Cu 2+B. Ba 2+、CO 32-、K +、OH -C. Ca 2+、NO 3-、SO 42-、Al 3+D. K +、NO 3-、Na +、SO 42-2. 在强酸性和强碱性溶液中都不能大量存在的离子是( )A. CO 32-B. HS -C. NH 4+D. NO 3-3. 在检验某种蓝色溶液的组成时,不同的实验者得到下列4种不同的结论,其中可能正确的是( )A. NaOH 、BaCl 2、NaClB. Na 2SO 4、CuCl 2、AgNO 3C. Na 2SO 4、CuCl 2、HNO 3D. Cu(NO 3)2、BaCl 2、NaOH5、某化工厂有甲、乙两个车间。
它们排放的工业废水澄清透明,共含有Ag +、Cu 2+、K +、NO 3- 、Cl -、OH -六种离子。
(1)甲车间的废水含有3种离子,明显呈碱性,则甲废水中不可能存在的阳离子是___。
(2)乙车间的废水中含有另外3种离子,其中阴离子是_______。
如果加足量的铁粉。
可以回收的金属(填写元素符号)___________。
酸碱盐专题复习二物质分离提纯和除杂(1)物质分离和提纯的原则:①不变,即不能改变被提纯的物质; ②不引,即在除去杂质的同时,不能引入新的杂质;③不难分,即分离操作简便易行易分离; ④易得,即除杂试剂价格便宜,容易得到; ⑤最好,即所选用的方法在保证除去杂质的同时,最好能增加被提纯物质的量,对环境不造成污染。
(2)物质分离和提纯方法①吸收法例1 若CO 中混有少量CO 2,欲除去CO 2将混合气体通过( )溶液。
若CO 2中混有少量水蒸汽,欲除去水蒸汽将混合气体通过________溶液。
初三___ _班姓名___________若NH3中混有少量水蒸汽,欲除去水蒸汽将混合气体通过________。
②沉淀法例2 要除去氯化钠中含有少量硫酸铁杂质,应选用的一种试剂是[ ]A.氯化钠溶液B.氢氧化钡溶液C.碳酸钠溶液D.氢氧化钾溶液③气化法例3 除掉氯化钠溶液中混有的少量碳酸钠,应选用适量的试剂是( )A.稀硫酸B.硝酸银C.澄清石灰水D.稀盐酸④互变法例4 欲除去KNO3溶液里的KOH杂质,可加入适量的_____溶液,有关反应的化学方程式为__________________________。
⑤物理方法:吸附法、溶解过滤法、蒸发结晶法、降温结晶法等。
【实战演练】1.除去KCl溶液中混有的少量K2CO3,选用的试剂是( )A.H2SO4溶液B.稀盐酸C.K2SO4溶液D. AgNO32.有一瓶长时间露置于空气中的氢氧化钠溶液,要除去其中杂质,得到纯净的氢氧化钠溶液,下列操作可以达到目的的是( )A.过滤后加入适量稀硝酸B先过滤,然后小心蒸发C.加入适量盐酸,过滤D.加入适量氢氧化钡溶液,过滤3.下列实验方案中,可行的是( )A.按溶解、过滤、蒸发的操作顺序分离CaCl2、CaCO3的混合物B.将白醋滴在润湿的pH试纸上,测定其pHC.用氢氧化钠溶液除去CO2中的HCl气体D.用BaCl2溶液除去KNO3溶液中少量的K2SO44. 下列除杂方法正确的是( )A.用NaOH除去CO2中混有的HClB.用点燃的方法除去CO2中混有少量的COC.用水除去MnO2中混有的KClD.用硝酸除去NaCl中混有的Na2CO35.的是( )6. 除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是( )7.从提供的试剂中,选择一种以除去下列物质中的少量杂质(括号内为杂质),仅供选用的试剂:①烧碱溶液②硫酸钠溶液③盐酸④水(1)把选择的试剂的代号填写在相应的横线上。
CaC03粉末(Na2C03) ;H2(C02) ;NaCl(BaCl2) 。
(2)写出有关反应的化学方程式:17.选择恰当的试剂或方法除去括号内的杂质。
(1)CaO(CaCO3) (2)Cu(Fe)(3)NaCl(CuCl2) (4)O2(水蒸气)(5)CuO(C)_17.下表中除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)()18.粗盐中含有钙离子、硫酸根离子和泥沙等杂质,实验室中粗盐提纯的操作步骤如下:(1)将粗盐研细,加水使其充分溶解,然后过滤得到滤液。
粗盐研细的目的是_________ __________________________,过滤是为了除去__________________________________。
(2)向上述滤液中加入过量的BaCl2溶液,直至沉淀不再产生,则加入过量的BaCl2溶液的目的是_________________________________________________。
(3)继续加入过量的___________溶液,直至沉淀不再产生,然后过滤,得到滤液和沉淀,沉淀的成分是______________。
(填化学式)(4)向(3)的滤液中加入过量_________溶液,目的是___________________________。
(5)将上述溶液蒸发结晶,得到精盐。
蒸发时玻璃棒要不断搅拌,直到_______________时停止加热。
酸碱盐专题复习三酸碱盐相互转换问题及解法例1.如图中A、B、C、D、E、F各代表碳酸钠溶液、硫酸锌溶液、氯化钡溶液、硝酸铜溶液、稀硫酸、铁中的一种物质。
凡用直线连接的相邻两种物质均能发生化学反应。
推断并写出化学式:A:B:C:C:E:F:【挑战自我一】1. 下列各组离子在溶液中不能同时大量共存的是( )A. NO3-、Na+、SO42-、Cu2+B. Ba2+、CO32-、K+、OH-C. Ca2+、NO3-、SO42-、Al3+D. K+、NO3-、Na+、SO42-2. 在检验某种蓝色溶液的组成时,不同的实验者得到下列4种不同的结论,其中可能正确的是( )A. NaOH、BaCl2、NaClB. Na2SO4、CuCl2、AgNO3C. Na2SO4、CuCl2、HNO3D.Cu(NO3)2、BaCl2、NaOH3.下列各组物质在溶液中能大量共存的是()A.FeCl2、Na2SO4、HCl B. NaOH、NaCl、HNO3C.MgSO4、NaNO3、KOH D. Na2CO3、KNO3、HCl4.下列各组物质在溶液中能够大量共存的是()A. BaCl2 NaCl H2SO4B. H2SO4 NaCl Na2CO3C. Na2SO4 KNO3 NaOHD. NaOH H2SO4 HCl5.)向下表的甲物质中逐滴加入相应的乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系能用右图所示曲线表示的是()A.①②B.②④C.③④D.只有④6.下列各组物质在某PH=14的无色溶液中,能大量共存的是()A.FeCl3、NaCl、KNO3B.NaCl、NaOH、NaNO3C.CaCl2、NaNO3、Na2CO3D.KNO3、H2SO4、NaCl7.从HCl、NaCl、NaOH、Na2CO3、Ca(OH)2几种溶液中取出其中的两种混合,可能的组合共有_________种。
(1)若混合后溶液质量减小,可能的组合是:______________、_____________。
(2)若混合后溶液质量不变,但发生了化学反应,有关的化学方程式为:、_______________________________ ________。
(3)将稀硫酸逐滴滴入剩下的几种组合中,若产生气体与加入稀硫酸有如图所示的关系,则这样的组合可能是___________________。
【挑战自我二】一、选择题(只有1个符合题意的答案)1.除去下列物质中的杂质所选用的试剂(括号内)正确的是()A. 碳酸钠溶液中的碳酸氢钠(盐酸)B. 氢氧化钠溶液中的碳酸钠(氯化钙)C. 二氧化碳中的水蒸气(浓硫酸)D. 二氧化碳中的一氧化碳(氧气)2.下列除杂(括号内的是杂质)所选试剂合理的是()A.Cu(Zn)稀盐酸 B.CO2气体(HCl)氢氧化钠溶液C.CuO(Cu)稀硫酸 D.Na2SO4溶液(Na2CO3) 氯化钡溶液3.除去下列物质中含有的少量杂质(括号内为杂质),所用试剂及主要操作均合理的是()A. N2(O2):木炭、点燃B. Cu(CuO):稀硫酸、过滤C. NaCl固体(KCl):水、过滤D. NaOH溶液(Na2CO3):CaCl2溶液、过滤4.下列各组混合物中,用一种试剂不能将括号内的杂质除去的是()A.CuSO4 (Na2SO4)B.C (CuO)C.CO2 (CO)D.NaCl (MgCl2)5.某电池厂排放的污水pH=4,并含有重金属离子Pb2+,下列合理的治理方案是向污水中加入()A.石灰石和铜粉B.生石灰和铁粉C.纯碱和木炭粉D.烧碱和铝粉二、填空题6.请你从提供的试剂中,选择一种以除去下列物质中的少量杂质(括号内为杂质)。
用所选试剂的序号..填空(每种试剂只能选用一次)。
A.H2O B.AgNO3溶液C.NaOH溶液D.Na2CO3溶液E.Ba(NO3)2溶液F.BaCl2溶液⑴CO(CO2) ⑵NaOH 溶液[Ca(OH)2]⑶NaNO3溶液(NaCl)⑷盐酸(硫酸)7.为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行实验。
(l)写出沉淀A的化学。
(2)加入CaC12溶液后,分离除去沉淀A的实验操作方法是。
(3)同学在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,请写出固体物质 B的成分(用化学式表示)。
(4)同学继续探究后又提出新的方案:将混合物溶解,若滴加盐酸至不再产生气体为止。
则既能除去Na2CO3杂质,又能有效地防止新杂质的引人。
写出有关反应的化学方程式:。
8.要从BaCl2和NaOH混合固体中获得纯净的BaCl2,设计方案如下:(1)方案一:将混合物溶于足量的水,过滤、蒸干。
