溶解度曲线中考题
2024年中考化学专题强化训练溶解度曲线
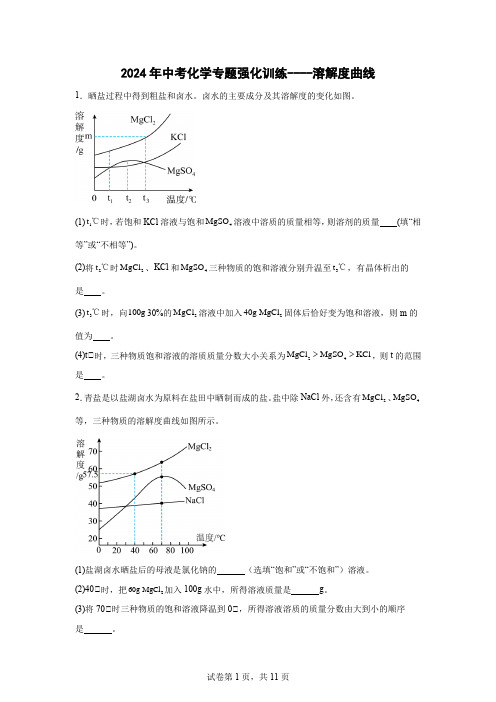
2024年中考化学专题强化训练----溶解度曲线1.晒盐过程中得到粗盐和卤水。
卤水的主要成分及其溶解度的变化如图。
(1)1t ℃时,若饱和KCl 溶液与饱和4MgSO 溶液中溶质的质量相等,则溶剂的质量 (填“相等”或“不相等”)。
(2)将2t ℃时2MgCl 、KCl 和4MgSO 三种物质的饱和溶液分别升温至3t ℃,有晶体析出的是 。
(3)3t ℃时,向100g 30%的2MgCl 溶液中加入240g MgCl 固体后恰好变为饱和溶液,则m 的值为 。
(4)t℃时,三种物质饱和溶液的溶质质量分数大小关系为24MgCl MgSO KCl >>,则t 的范围是 。
2.青盐是以盐湖卤水为原料在盐田中晒制而成的盐。
盐中除NaCl 外,还含有2MgCl 、4MgSO 等,三种物质的溶解度曲线如图所示。
(1)盐湖卤水晒盐后的母液是氯化钠的 (选填“饱和”或“不饱和”)溶液。
(2)40℃时,把260g MgCl 加入100g 水中,所得溶液质量是 g 。
(3)将70℃时三种物质的饱和溶液降温到0℃,所得溶液溶质的质量分数由大到小的顺序是 。
(4)氯化钠中含有少量硫酸镁,若要提纯氯化钠,可采用的方法是。
3.某同学进行了如图1所示实验,结合硝酸钾和氯化钠的溶解度曲线回答下列问题。
(1)20℃时,氯化钠的溶解度是g;(2)若氯化钠中混有少量硝酸钾,可采用的方法提纯氯化钠;(3)图1中烧杯℃为硝酸钾的(填“饱和”或“不饱和”)溶液;若通过升高温度使℃中固体继续溶解,则其溶液中溶质的质量分数(填“增大”“减小”或“不变”)。
4.如图是A、B、C三种固体物质的溶解度曲线,据图作答:(1)P点的意义是。
(2)A、B、C三种物质中,溶解度随着温度上升而减小的物质是。
(3)t2℃时,将30g A物质加入50g水中可形成g溶液。
5.如图是某苏打气泡水的标签。
(1)该气泡水中溶剂的化学式是。
C H O。
从赤藓糖醇的化学式中能获得与其有关的(2)赤藓糖醇是一种甜味剂,其化学式为4104信息是(任写一条)。
中考化学专题--溶解度附解析

中考化学专题--溶解度(附解析)溶解度一、选择题1.如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是()A.T℃时,甲、乙两物质的溶解度相等B.乙的饱和溶液降温时,溶质质量分数保持不变C.甲中混有少量乙,可采用降温结晶的方法提纯甲D.T℃时,甲的饱和溶液溶质质量分数为20%2.t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g 水,充分振荡后静置,烧杯底部仍有未溶解的白色固体.下列相关叙述正确的是()A.升高温度上层清液变为不饱和溶液B.t℃时,熟石灰的溶解度为0.3gC.烧杯中溶液的质量小于50.15gD.上层清液中溶质质量分数大于0.3%3.下列说法不合理的是()A.“卤面”制作时,加入氯化钠当调味剂B.大脖子病是人体缺乏铁元素引起的C.大部分物质的溶解度随温度的升高而增大D.水受热膨胀是由于水分子间的距离变大4.T℃时,将少量生石灰放入一定质量的饱和石灰水中,搅拌并冷却至原温度,得到的溶液与原溶液相比,下列物理量前后不变的是()①溶质的质量②溶剂的质量③溶液的质量④溶质的质量分数⑤溶解度.A.①③⑤B.②④⑤C.②④D.④⑤5.下列四个图象能正确反应对应实验操作的是()A.向一定量的饱和石灰水中不断加入生石灰B.向等质量的锌、铁中滴加等质量分数的稀盐酸C.向一定的氧化铁中通入一氧化碳气体并持续高温D.向一定量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸6.下表是KCl固体在不同温度时的溶解度.下列说法错误的是()温度/℃020406080溶解度/g27.634.040.045.551.1A.KCl固体的溶解度随温度的升高而增大B.80℃时,KCl固体的溶解度是51.1gC.60℃的KCl饱和溶液降温后会有晶体析出D.20℃时,KCl饱和溶液的溶质质量分数为34.0% 7.下列说法不正确的是()A.物质的溶解度一定随温度的升高而增大B.蔗糖水属于溶液C.在一定条件下,饱和溶液与不饱和溶液之间可以相互转换D.打开汽水瓶盖,汽水会自动喷出来,证明气体的溶解度和压强有关8.小张同学用某固体物质进行如图所示的实验,根据实验判断下列说法不正确的是()A.该固体物质的溶解度随温度的升高而增大B.溶液b一定是不饱和溶液C.溶液d中溶质质量一定大于溶液e中的溶质质量D.溶液d和溶液e的溶质质量分数可能相同9.下表列出了硝酸钾在不同温度时的溶解度.温度/℃10203040溶解度/g20.931.645.863.9某兴趣小组做了如图实验:下列说法中正确的是()A.①②③中溶液都为不饱和溶液B.②③中都含有末溶解的固体C.①②③中溶液的质量相等D.③中溶质质量分数最大10.在化学知识中有许多规律,下列具体物质的性质符合对应规律的是()A.某些非金属氧化物能和碱反应生成盐和水;例如:二氧化碳和三氧化硫B.一般固体物质的溶解度随温度的升高而增大;例如:氢氧化钙和氯化钠C.常温下金属一般为固态;例如:汞和金D.某些非金属单质可以将金属从其氧化物中还原出来;例如:氢气和一氧化碳11.如表是NaCl、KNO3在不同温度时的溶解度温度/℃1溶解度/gNaCl35.836.036.336.637.037.3KNO320.931.645.863.985.5110据此数据,下列有关说法中错误的是()A.在40℃时,100g水中最多可溶解KNO363.9g B.KNO3和NaCl的溶解度曲线在20℃~40℃温度范围内相交C.在60℃时,KNO3饱和溶液210g加入10g水后,溶质质量分数为50%D.在20℃时KNO3和NaCl的混合溶液100g,恒温蒸发,先析出的晶体一定是NaCl12.KCl与KNO3在不同温度的溶解度数据如表.则下列说法正确的是()温度/℃1020304050KCl30g33g35g38g41gKNO321g31g45g65g88gA.KNO3比KCl的溶解度大B.两物质的溶解度相等的温度在20~30℃之间C.在20℃时,10g水中加入5gKCl可得到33.3%的KCl 溶液D.在50℃时,两物质各5g分别加入10g水中,充分溶解,均有固体剩余13.Ca(OH)2在不同温度时的溶解度如下表:温度/℃020406080溶解度/g0.180.160.140.110.09根据表中信息,判断下列说法正确的是()A.Ca(OH)2的溶解度随温度的升高而增大B.20℃时,Ca(OH)2的溶解度为0.16gC.40℃时,降低Ca(OH)2饱和溶液温度会析出溶质D.60℃时,向100g水中加入0.20gCa(OH)2充分搅拌,固体完全溶解14.物质M在不同温度下的溶解度数据如下表所示,以下说法正确的是()温度(℃)020406080溶解度(g)12.615.320.025.038.2A.0℃时,15.9gM溶于150g水中形成饱和溶液B.20℃时,M形成饱和溶液的溶质质量分数是15.3% C.若要配制200.0g20.0%的M的饱和溶液,对应温度必须是60℃D.80℃时,M的饱和溶液138.2g降温至40℃,析出晶体的质量大于20.0g15.硝酸钾在不同的溶解度数据如表,下列说法错误的是()温度/℃0溶解度/g13.331.663.9110169246A.硝酸钾的溶解度受温度影响变化较大B.60℃时,饱和硝酸钾溶液中溶质与溶液质量之比为11:21C.20℃时,10g水中加入5g硝酸钾充分溶解后再加入5g 水,前后溶质的质量分数不变D.将溶质质量分数为28%的硝酸钾溶液从60℃降温至20℃,没有晶体析出16.下列有关量的变化图象与其对应叙述相符的是()A.常温下,向一定量的饱和石灰水中加入氧化钙B.t℃时,向等质量的甲、乙、丙三种物质中分别加水配成饱和溶液,所得溶液质量最小的是丙C.向一定质量的过氧化氢的水溶液中加入二氧化锰D.向等质量的铁和镁中分别加入足量的稀盐酸17.科学研究中常用图象来表示两个量(x,y)之间的关系,以使研究的间压变得直观明了.在某温度下.将少量氧化钙加入到一定量的饱和氢氧化钙溶液中.图甲表示整个过程中温度的变化,图乙表示氢氧化钙的溶解度与温度的关系.小阳同学要依据观察和思考,作出了如图丙所示的图象,此图象反映了该过程中()A.溶质的质量与时间的关系B.溶剂的质量与时间的关系C.溶质的溶解度与时间的关系D.溶质的质量分数与时间的关系二、填空题18.下表是NaCl、KNO3在不同温度(℃)时溶解度(g)温度(t)60708090100溶解度(s)NaCl35.735.836.036.336.637.037.337.838.439.039.8 KNO313.320.931.645.863.985.5116分析上表,回答问题(1)60℃时,KNO3的溶解度为g(2)溶解度受温度变化影响较小的是.(3)20℃时,NaCl饱和溶液溶质质量分数是(精确到0.1g).(4)温度为t℃时,NaCl和KNO3的溶解度相等且为S 克,则S的取值范围是.19.如图1是a、b、c三种物质的溶解度曲线,回答下列问题:(1)P点的含义是.(2)t2℃时,将50ga物质放入50g水中充分溶解得到溶液的质量为g.(3)将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数由大到小的顺序是.(4)t1℃时,将盛有c的饱和溶液的小试管放入盛水的烧杯中(如图2),向水中加入一定量的氢氧化钠固体后,试管中的溶液变浑浊,原因是.20.根据下表中的数据,回答下列问题:温度/℃20406080100溶解度/gKCl34.040.045.651.156.7KNO331.663.9110169246(1)20℃时KCl的溶解度是;(2)20℃时将20gKCl与50g水混合,充分溶解后,所得溶液为(填“饱和”或“不饱和”);(3)上表两种物质中,的溶解度受温度的影响大.21.下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)温度(℃)60708090100KNO313.320.93245.86485.5116NaCl35.735.83636.336.63737.337.838.43939.8①以上两种物质溶解度的变化受温度影响较小的是.②30℃时,KNO3的溶解度是g/100g水.③KNO3溶液中含有少量NaCl时,可通过的方法提纯.④对③析出的晶体剩余溶液描述正确的是(填写编号).I、剩余溶液一定是KNO3饱和溶液II、剩余溶液一定是NaCl不饱和溶液III、上述方法可以将两者完全分开IV、析出的晶体中只含有KNO3.22.下表是固体A和固体B在不同温度时的溶解度.温度/℃020406080溶解度/g固体A35.736.036.637.338.4固体B13.331.663.9110169(1)从表中数据可以看出固体A和固体B的溶解度随温度升高而(填“增大”或“减小”).(2)20℃时,把50g固体A放入100g水中,充分溶解后,所得溶液质量为g.(3)40℃时,A、B两种物质的饱和溶液中溶质的质量分数较大的是.(4)若B饱和溶液中有少量的A,可用下列法提纯B(填序号).①趁热过滤②蒸发结晶③冷却热饱和溶液.23.根据表中的数据,回答下列问题.温度/℃0溶解度/NaCl35.736.036.637.338.439.8KNO313.331.663.9110169246(1)40℃时,NaCl的溶解度是.(2)20℃时,称取31.6gKNO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是(填“饱和”或“不饱和”)溶液;称取31.6gKNO3固体时,发现托盘天平指针偏右,接下来的操作是.(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为.(4)将等质量KNO3的饱和溶液和NaC1的饱和溶液从60℃降温到20℃,对所得溶液的叙述正确的是(填序号).A、都是饱和溶液B、溶剂质量:KNO3>NaClC、溶液质量:KNO3<NaCl.24.下表是NaCl,KCl,KNO3三种物质在不同温度下的溶解度.温度/℃0溶解度/gNaCl35.736.036.637.338.439.8KCl27.634.040.045.551.156.7KNO313.331.663.9110169246(1)20℃时,NaCl的溶解度是g;(2)若NaCl和KCl的溶解度相等,对应表中最小温度范围应在℃之间;(3)三种物质中,溶解度受温度影响变化最大的是,在一定温度下,要将该物质从其饱和溶液中结晶析出,最好的办法是.25.下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)温度(℃)60708090100KNO313.320.93245.86485.5116NaCl35.735.83636.336.63737.337.838.43939.8(1)以上两种物质溶解度的变化受温度影响较小的是;(2)50℃时,KNO3的溶解度是g/100g水;(3)KNO3溶液中含有少量NaCl时,可通过的方法提纯;(4)对(3)析出的晶体和剩余溶液描述正确的是(填写编号)A.剩余溶液一定是KNO3饱和溶液B.剩余溶液一定不含有NaClC.剩余的溶液一定是纯净物D.析出的晶体中只含有KNO3.26.下表是KNO3的部分溶解度数据,请回答问题:(1)40℃时,将70gKNO3固体加入100g水中,充分搅拌,形成的溶液质量为g.(2)60℃时,KNO3的饱和溶液中得到晶体的一种方法是.(3)依据表中数据,请在如图坐标图中画出KNO3溶解度曲线的草图.温度/℃0204060溶解度/g13.331.663.9110三、解答题27.分析处理图表中的信息是学习化学的一种重要方法.(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:温度/℃10203040溶解度/g氯化钠35.836.036.336.6碳酸钠12.221.839.753.2①40℃时,氯化钠的溶解度为g.②碳酸钠的溶解度随温度的升高而(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为(计算结果精确到0.1%).③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是.(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是(填标号).28.已知某碱溶液的溶解度随温度升高而增大;温度一定时,该碱溶液的浓度越大,其碱性越强.(1)要使该碱饱和溶液的pH升高(溶质不变),可采取的方法是.(2)要使该碱饱和溶液的pH降低,在下列试剂中,哪些可选择加入?A.CO2B.CaCO3C.Fe(OH)3D.CuSO4.29.下表是KCl在不同温度时的溶解度.温度/℃60溶解度/g27.631.034.037.0x42.645.5小明为测定x的值,取4份40℃的水各50g,分别进行实验,并记录数据如下表.实验编号实验1实验2实验3实验4KCl质量/g5152535溶液质量/g5*******请回答下列问题.(1)实验中需要用到的仪器有(只写一种).(2)要使实验2的溶液达到饱和,可采取的方法是.(3)由实验可知,40℃时KCl的溶解度x为g.(4)小明现要配制质量分数为30%的KCl溶液100g,为达实验目的其主要操作是.30.下表是NaCl和KNO3在不同温度时的溶解度:温度/℃0溶解度/gNaCl35.736.036.637.338.439.8KNO313.331.663.9110169246(1)从表中数据可以看出NaCl和KNO3的溶解度随温度升高而(填“增大”或“减小”).(2)若将KNO3的不饱和溶液变为相同温度下饱和溶液,其方法为(填一种).若KNO3饱和溶液中含有少量NaCl 时,提纯的方法是(填一种).(3)下列有关说法正确的是.A.40℃时,KNO3溶液的溶质质量分数一定比NaCl溶液的溶质质量分数大B.KNO3饱和溶液中一定不能再溶解NaCl固体C.从表中数据可以判断NaCl和KNO3的溶解度相等的温度在20﹣40℃之间.溶解度参考答案与试题解析一、选择题1.如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是()A.T℃时,甲、乙两物质的溶解度相等B.乙的饱和溶液降温时,溶质质量分数保持不变C.甲中混有少量乙,可采用降温结晶的方法提纯甲D.T℃时,甲的饱和溶液溶质质量分数为20%【考点】固体溶解度曲线及其作用;结晶的原理、方法及其应用;溶质的质量分数、溶解性和溶解度的关系.【专题】溶液、浊液与溶解度.【分析】根据已有的溶解度曲线的意义进行分析解答,交点表示在该温度下二者的溶解度相等,根据物质的溶解度受温度的变化确定析出晶体的方法,根据溶质质量分数计算即可.【解答】解:A、据图可以看出,在T℃时,甲、乙两物质的溶解度相等,正确;B、乙物质的溶解度随温度的降低而增大,当乙的饱和溶液降温时,溶液的组成不变,故溶质质量分数保持不变,正确;C、甲的溶解度随温度的升高而增大明显,故甲中混有少量乙,可采用降温结晶的方法提纯甲,正确;D、T℃时,甲的饱和溶液溶质质量分数为,错误.故选D.【点评】本题考查的是溶解度曲线的应用,完成此题,可以依据已有的溶解度曲线的意义进行.2.t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g 水,充分振荡后静置,烧杯底部仍有未溶解的白色固体.下列相关叙述正确的是()A.升高温度上层清液变为不饱和溶液B.t℃时,熟石灰的溶解度为0.3gC.烧杯中溶液的质量小于50.15gD.上层清液中溶质质量分数大于0.3%【考点】固体溶解度的影响因素;固体溶解度的概念.【专题】压轴实验题;溶液、浊液与溶解度.【分析】解决此题时用到的知识点有:①氢氧化钙的溶解度随温度升高而减低;②溶液与溶质共存说明溶液是饱和状态;③溶质的质量是溶解在溶剂中的物质的质量;④计算溶质质量分数时溶质的量应该是溶解在水中的物质的质量.【解答】解:A、氢氧化钙的溶解度随温度升高而减低,升温会使溶解在水中的氢氧化钙析出,所剩溶液仍饱和,故A错误.B、t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g 水,充分振荡后静置,烧杯底部仍有未溶解的白色固体,所以t℃时100g水中溶解熟石灰的质量小于0.3g,所以t℃时,熟石灰的溶解度小于0.3g,故B错误.C、0.15g熟石灰的烧杯内加入50g水,烧杯管底部仍有未溶解的白色固体,说明氢氧化钙未全溶,溶质的质量应该小于0.15g,所以烧杯中溶液的质量小于50.15g,故C 正确.D、溶质的量小于0.15g,故溶质的质量分数小于0.3%,故D错误.故选C.【点评】一般情况下,固体的溶解度随温度的升高而增大,但氢氧化钙特殊,它的溶解度随温度的升高而降低.3.下列说法不合理的是()A.“卤面”制作时,加入氯化钠当调味剂B.大脖子病是人体缺乏铁元素引起的C.大部分物质的溶解度随温度的升高而增大D.水受热膨胀是由于水分子间的距离变大【考点】固体溶解度的影响因素;氯化钠与粗盐提纯;利用分子与原子的性质分析和解决问题;人体的元素组成与元素对人体健康的重要作用.【专题】物质的微观构成与物质的宏观组成;溶液、浊液与溶解度;常见的盐化学肥料;化学与生活.【分析】A、根据食盐有咸味分析;B、根据碘元素与人体健康之间的关系分析;C、根据物质的溶解性规律分析;D、根据分子间有间隔的特性分析.【解答】解:A、由于食盐有咸味,“卤面”制作时,加入氯化钠当调味剂.故A说法合理;B、大脖子病是人体缺乏碘元素引起的.故B说法不合理;C、大部分物质的溶解度随温度的升高而增大.故C说法合理;D、分子间有间隔,水受热膨胀是由于水分子间的距离变大.故D说法合理.故选B.【点评】本题所考查的知识属于课本的基础知识,加强基础知识的学习,是解答本类题的关键.4.T℃时,将少量生石灰放入一定质量的饱和石灰水中,搅拌并冷却至原温度,得到的溶液与原溶液相比,下列物理量前后不变的是()①溶质的质量②溶剂的质量③溶液的质量④溶质的质量分数⑤溶解度.A.①③⑤B.②④⑤C.②④D.④⑤【考点】固体溶解度的影响因素;溶质的质量分数;生石灰的性质与用途.【专题】溶液、浊液与溶解度.【分析】根据温度不变饱和石灰水不能再继续溶解氢氧化钙的特点,判断对于此溶液的说法中正确的选项.【解答】解:由于氧化钙与饱和溶液中的水发生反应而使水减少,饱和溶液的溶剂减少会造成溶质析出,因此溶液的溶质、溶剂都在减少,溶液的质量也减小;固体物质的溶解度只受温度的影响,由于溶液的温度不变,因此,溶质的溶解度也不变.根据相同温度下的同种溶质的饱和溶液的溶质质量分数相同,饱和溶液的溶质质量分数不变,故④⑤正确.答案:D.【点评】生石灰遇水生成的氢氧化钙因溶液已为饱和溶液,所以不能继续溶解,溶液中溶质质量不会增大.5.下列四个图象能正确反应对应实验操作的是()A.向一定量的饱和石灰水中不断加入生石灰B.向等质量的锌、铁中滴加等质量分数的稀盐酸C.向一定的氧化铁中通入一氧化碳气体并持续高温D.向一定量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸【考点】固体溶解度的影响因素;金属的化学性质;一氧化碳还原氧化铁;生石灰的性质与用途;酸的化学性质.【专题】元素化合物知识型.【分析】A、根据氧化钙能够和水反应分析;B、根据金属与酸反应产生气体的多少分析;C、根据一氧化碳和氧化铁反应生成铁和二氧化碳分析;D、根据硫酸和氯化钡反应立即产生硫酸钡分析.【解答】解:A、生石灰和饱和石灰水中的水反应,因此会使饱和溶液中的水减少,则会析出部分溶质,因此溶质的质量会减少,故坐标错误;B、横坐标代表稀盐酸,相等质量的酸提供的氢元素质量相等,则产生的氢气相等,因此是同一条斜率;向等质量的铁和锌中加入溶质质量分数相同的稀盐酸至过量,则铁和锌全部参加反应,Fe+2HCl═FeCl2+H2↑562Zn+2HCl═ZnCl2+H2↑652通过反应的化学方程式以及金属与酸反应生成氢气的质量关系可以看出,铁生成的氢气大于锌,故坐标正确;C、一氧化碳和氧化铁反应生成铁和二氧化碳,固体质量会减少但不会减少为0,故坐标错误;D、硫酸应该和氯化钡立即产生硫酸钡沉淀,因此起点应该是0,故坐标错误;故选:B.【点评】此题是过程与图象结合题,是对学生识图能力的考查,解题的关键是能正确的分析各个反应的过程,并结合图象分析问题,对培养学生分析问题的能力有一定帮助.6.下表是KCl固体在不同温度时的溶解度.下列说法错误的是()温度/℃020406080溶解度/g27.634.040.045.551.1A.KCl固体的溶解度随温度的升高而增大B.80℃时,KCl固体的溶解度是51.1gC.60℃的KCl饱和溶液降温后会有晶体析出D.20℃时,KCl饱和溶液的溶质质量分数为34.0%【考点】固体溶解度的影响因素;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系.【专题】溶液、浊液与溶解度.【分析】A、KCl溶解度随温度的升高而增大;B、由表格,可查出80℃时KCl的溶解度;C、根据氯化钾的溶解度随温度的变化特点确定是否析出固体;D、20℃时,100g水最多溶解KCl34.0g,34.0克为此温度下的溶解度.【解答】解:A、KCl溶解度随温度的升高而增大,正确;B、80℃时,KCl固体的溶解度是51.1g,正确;C、KCl溶解度随温度的升高而增大,故60℃的KCl饱和溶液降温后会有晶体析出,正确;D、20℃时,KCl饱和溶液的溶质质量分数为≈25.3%,错误;故选D.【点评】掌握溶质的质量分数、溶解性和溶解度的关系,掌握饱和溶液与不饱和溶液的相互转化的方法.7.下列说法不正确的是()A.物质的溶解度一定随温度的升高而增大B.蔗糖水属于溶液C.在一定条件下,饱和溶液与不饱和溶液之间可以相互转换D.打开汽水瓶盖,汽水会自动喷出来,证明气体的溶解度和压强有关【考点】固体溶解度的影响因素;溶液的概念、组成及其特点;饱和溶液和不饱和溶液相互转变的方法;气体溶解度的影响因素.【专题】溶液、浊液与溶解度.【分析】根据已有的溶解度的影响因素以及饱和溶液和不饱和溶液之间的转化和气体溶解度的影响因素进行分析解答即可.【解答】解:A、物质的溶解度不一定随温度的升高而增大,比如氢氧化钙的溶解度随温度的升高而减小,错误;B、蔗糖水属于溶液,正确;C、在一定条件下,饱和溶液与不饱和溶液之间可以相互转换,正确;D、打开汽水瓶盖,汽水会自动喷出来,是因为压强变小,气体的溶解度变小,证明气体的溶解度和压强有关,正确;故选A.【点评】本题考查的是溶液的知识,完成此题,可以依据已有的知识进行.8.小张同学用某固体物质进行如图所示的实验,根据实验判断下列说法不正确的是()A.该固体物质的溶解度随温度的升高而增大B.溶液b一定是不饱和溶液C.溶液d中溶质质量一定大于溶液e中的溶质质量D.溶液d和溶液e的溶质质量分数可能相同【考点】固体溶解度的影响因素;饱和溶液和不饱和溶液;溶质的质量分数.【专题】溶液、浊液与溶解度.【分析】根据溶液的转化以及溶液中溶质的质量变化对溶质质量分数的改变的影响进行分析解答即可.【解答】解:A、从溶液c和溶液d可以看出,降低温度则溶液中会析出晶体,说明该物质的溶解度随温度的升高而增大,正确;B、溶液b中加入20g固体得到的溶液c中没有未溶解的固体,说明加入的物质全部溶解,故溶液b一定是不饱和溶液,正确;C、溶液d变成溶液e的过程中没有发生化学变化,说明溶液d中的固体除掉,可能是升高温度使固体溶解,则溶液d中溶质质量可能大于溶液e中的溶质质量,错误;D、若是溶液d中的固体是经过过滤除去,则溶液d和溶液e的溶质质量分数可能相同,正确;故选C.【点评】本题考查的是溶解度的变化特点以及溶液的转化和溶质质量分数的知识,完成此题,可以依据已有的知识进行.9.下表列出了硝酸钾在不同温度时的溶解度.温度/℃10203040溶解度/g20.931.645.863.9某兴趣小组做了如图实验:下列说法中正确的是()A.①②③中溶液都为不饱和溶液B.②③中都含有末溶解的固体C.①②③中溶液的质量相等D.③中溶质质量分数最大【考点】固体溶解度的影响因素;饱和溶液和不饱和溶液;溶质的质量分数.【专题】溶液、浊液与溶解度.【分析】根据溶液中溶质溶剂的判断方法分析,根据饱和溶液与不饱和溶液的特征判断.【解答】解:20℃时硝酸钾的溶解度为31.6g,将30g硝酸钾溶于100g水中得到的溶液①为不饱和溶液,再加入5g时得到的溶液②为饱和溶液且有硝酸钾剩余30g+5g﹣31.6g=3.4g,将②溶液升温到30℃,因30℃时硝酸钾的溶解度为45.8g,因此得到的溶液③为不饱和溶液.A、①、③中溶液为不饱和溶液,②为饱和溶液,故A错误;B、②中含有末溶解的固体,而③中不含有末溶解的固体,故B错误;C、①②③中溶质的质量不相等,所以溶液的质量也不相等,故C错误;D、③中溶质质量最大,所以溶质质量分数最大,故D正确.故选:D.【点评】本题考查溶剂的判断及饱和溶液不饱和溶液的转化,析出晶体及溶质质量分数的计算,需认真分析图示中溶剂溶质的质量与溶解度的关系.10.在化学知识中有许多规律,下列具体物质的性质符合对应规律的是()A.某些非金属氧化物能和碱反应生成盐和水;例如:二氧化碳和三氧化硫B.一般固体物质的溶解度随温度的升高而增大;例如:氢氧化钙和氯化钠C.常温下金属一般为固态;例如:汞和金D.某些非金属单质可以将金属从其氧化物中还原出来;例如:氢气和一氧化碳【考点】固体溶解度的影响因素;一氧化碳的化学性质;金属的物理性质及用途;氢气的化学性质与燃烧实验.【专题】溶液、浊液与溶解度;氧气、氢气的性质与用途;金属与金属材料;常见的碱碱的通性.【分析】A、根据碱的化学性质进行分析判断;B、根据常见物质的溶解度受温度的影响的变化趋势进行分析判断;C、根据金属的物理性质进行分析判断;D、根据氢气和一氧化碳的化学性质进行分析判断.。
(完整)九年级化学中考溶解度曲线习题

A B C0 t 1 20 t 2 温度/℃ g 40溶解度全国中考化学汇编之溶解度曲线1.右图是a 、b 两种固体物质(不含结晶水)的溶解度曲线。
下列说法正确的是 A.b 的溶解度大于a 的溶解度B.t 1℃时,将a 、b 两种物质的饱和溶液分别恒温蒸发 等质量的水,析出晶体的质量一定相等C.将t 2℃时的b 的不饱和溶液降温至t 1℃, 一定能得到b 的饱和溶液D.t 2℃时,a 溶液的溶质质量分数一定小于 b 溶液的溶质质量分数2.右图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题: (1)t 1℃时,甲物质的溶解度 乙物质的溶解 度(填“>”、“=”或“<”)。
(2)甲、乙两种物质的溶解度受温度影响较小的是 物质。
(3)t 2℃时,把100g 乙物质放入100g 水中,充分搅拌, 所得溶液是 溶液(填“饱和”或“不饱和”)。
(4)t 2℃时,有一接近饱和的甲溶液,可采用 的方法(任写一种)使它变为饱和溶液。
3.右图是甲、乙两种物质的溶解度曲线,下列说法正确的是 A .甲的溶解度受温度影响比乙小 B .15℃时甲、乙的溶解度相等C .30℃时乙的溶解度为30gD .升高温度可使接近饱和....的甲溶液变为饱和.. 4.请根据图7中A 、B 两种固体物质的溶解度曲线,回答下列问题。
(l)在____℃时,A 、B 两种物质溶解度相同。
(2) t 2℃时,100g 水中溶解_ gA 物质恰好达到饱和,该饱和溶液中溶质的质量分数为_ ___,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 g 。
(3)将t 2℃时A 、B 两种物质的饱和溶液降温至t 1℃(其它条件不变),溶质的质量分数保持不变的是___ _。
5.(5分) 右图为A 、B 、C 三种物质的溶解度曲线,据图回答: ⑴ t 20C 时,A 、B 、C 三种物质的溶解度由大到小顺序是 ______。
⑵ 将t 20C 时三种物质等质量的饱和溶液分别降温到00C 时,析出溶质最多的是 ___ ,无溶质析出的是 __ 。
初三化学中考专题(5)溶解度曲线练习及答案

初三化学中考专题(5)溶解度曲线练习及答案1.a、b两种物质的溶解度曲线如图所示。
下列说法不正确的是A.将t1℃时b的饱和溶液加水可变为不饱和溶液B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变C.t2℃时,两种物质的饱和溶液中溶质质量分数a>bD.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等2.下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t1℃时,丙的饱和溶液中溶质的质量分数为40%3.下图是甲、乙、丙三种固体物质的溶解度曲线,将甲、乙、丙三种物质t2℃时的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系正确的是A.甲>乙>丙B.甲=乙=丙C.甲=乙>丙D.丙>甲=乙4.(多选)甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是A.t1℃时,甲物质的溶解度为20gB.t1℃时,30g甲加入到50g水中最多可得70g溶液C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液D.t2℃时,甲乙两物质的饱和溶液分别降温到t1℃时,所得溶液溶质质量分数的大小关系是:甲<乙5.(多选)甲、乙两种固体物质的溶解度曲线如图所示。
20℃时,进行了如下图所示的实验,下列叙述正确的是A.甲的溶解度大于乙的溶解度B.实验过程中,属于不饱和溶液的是A溶液和C溶液C.实验过程中,只有B溶液和D溶液属于饱和溶液D.实验过程中,B溶液与E溶液中溶质的质量分数相同6.(多选)甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少C.分别将t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数的大小关系是乙>甲>丙D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多丙溶液中无晶体析出7.甲、乙、丙三种物质的溶解度曲线如下图所示。
2021年中考化学专题复习:溶解度曲线
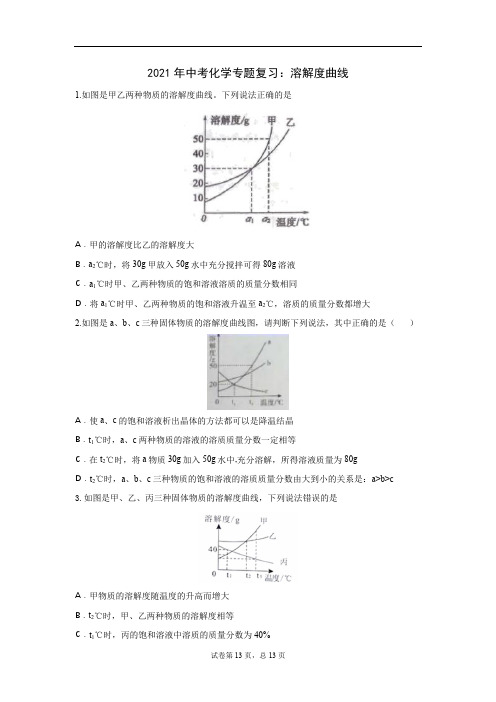
2021年中考化学专题复习:溶解度曲线1.如图是甲乙两种物质的溶解度曲线。
下列说法正确的是A.甲的溶解度比乙的溶解度大B.a2℃时,将30g甲放入50g水中充分搅拌可得80g溶液C.a1℃时甲、乙两种物质的饱和溶液溶质的质量分数相同D.将a1℃时甲、乙两种物质的饱和溶液升温至a2℃,溶质的质量分数都增大2.如图是a、b、c三种固体物质的溶解度曲线图,请判断下列说法,其中正确的是()A.使a、c的饱和溶液析出晶体的方法都可以是降温结晶B.t1℃时,a、c两种物质的溶液的溶质质量分数一定相等C.在t2℃时,将a物质30g加入50g水中,充分溶解,所得溶液质量为80gD.t2℃时,a、b、c三种物质的饱和溶液的溶质质量分数由大到小的关系是:a>b>c3.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.甲物质的溶解度随温度的升高而增大B.t2℃时,甲、乙两种物质的溶解度相等C.t1℃时,丙的饱和溶液中溶质的质量分数为40%D.当甲中混有少量丙时,可采用降温结晶的方法提纯4.如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是()A.a的溶解度大于b的溶解度B.P点表示t1℃时a、c两物质溶解度相等C.将t1℃饱和的c溶液升温到t2℃,得到的是不饱和溶液D.将t2℃,a、b、c三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质最分数由大到小的顺序为:b>a=c5.甲、乙两种固体的溶解度曲线如右图所示,下列说法正确的是A.甲的溶解度大于乙的溶解度B. t1°C时,甲乙饱和溶液中溶质的质量分数相等C. t2°C时,60g 甲的饱和溶液稀释到20%需加水10gD.将t1°C时相等质量的甲、乙的饱和溶液升温到t2°C,溶液中溶质的质量甲大于乙6.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是()A.阴影区域中,A、C均处于不饱和状态B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯BC.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>BD.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7% 7.甲、乙两种物质溶解度曲线如图所示。
初中中考化学常考专题提升练:溶解度曲线

中考化学常考专题提升练:溶解度曲线溶解度曲线专练1.在室温时,向氯化钠饱和溶液中加入少量的氯化钠晶体,则()①溶液质量增加②溶质质量增加③溶剂质量不变④晶体质量不变⑤晶体质量减少.A. B. C. D.2.要使固体物质的不饱和溶液变为饱和溶液,最简单最可靠的方法是()A. 增大压强B. 升高温度C. 降低温度D. 增加溶质3.如图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是()A. 时,甲物质的饱和溶液中溶质和溶剂的质量比为1:4B. P点表示甲、丙两种物质的饱和溶液质量相等C. 时,乙物质的饱和溶液,升温至时仍是饱和溶液D. 将三种物质的溶液从降至,析出晶体最多的是甲物质4.甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是()A. 时,甲和乙的溶解度相等,都是30B. 时,将甲、乙两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等C. 温度从降至,甲和乙的饱和溶液中析出晶体的质量甲大于乙D. 时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数5.a、b、c三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是()A. 时,a的饱和溶液65g中含有溶剂50gB. 将时a、b、c三种物质的饱和溶液,降温至时,C溶液中溶质的质量分数保持不变C. 要从b溶液中得到b,通常可采用蒸发溶剂使其结晶的方法D. 在时,a、b两种溶液中溶质的质量分数相同6.如图是甲、乙两种固体物质的溶解度曲线,下列叙述不正确的是()A. 甲、乙两种物质均属于易溶物质B. 甲物质的溶液度受温度变化影响较大C. 在时,甲、两种物质的饱和溶液中溶质的质量相等D. 当甲中含有少量的乙时,可用降温结晶法提纯甲7.将40℃时硝酸钾饱和溶液冷却到20℃,温度变化前后,保持不变的是()A. 溶质质量B. 溶液质量C. 溶剂质量D. 溶质的质量分数8.两个烧杯中分别盛装X、Y的饱和溶液,两只试管中分别装有NaOH和NH4NO3固体,向两只试管中分别滴加适量水,现象如图一所示,结合图二判断下列说法正确的是()A. Y的溶解度曲线为b曲线B. 降温可使X的饱和溶液变浑浊C. X的饱和溶液从降温到,溶质的质量分数变大D. 时,X、Y的饱和溶液质量相等,则溶剂质量9.20℃时,往50g蔗糖溶液中加入5g蔗糖固体充分搅拌后,尚有部分固体未溶解,加热后固体全部溶解,则下列说法正确的是()A. 搅拌后加热前的溶液一定不饱和溶液B. 搅拌后加热前一定是饱和溶液C. 加热后一定是饱和溶液D. 加热后一定是不饱和溶液10.向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤.下列说法正确的是()A.C. 的溶液为饱和溶液D. 中没有固体存在二、填空题11.如图是a、b、c三种物质的溶解度曲线,请据图回答:(1)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是______(填序号,下同);(2)t2℃时,将100g a物质加入到100g水中并充分搅拌,形成溶液的质量为______g;(3)将t2℃时a、b、c三种物质的饱和溶液降低温度到 t1℃时,这三种溶液中溶质质量分数的大小关系是______.12.甲、乙两种固体的溶解度曲线如图所示.(1)______℃时,甲和乙的溶解度相等;(2)40℃时,若将40g乙(不含结晶水)放入160g水中充分溶解,所得溶液的溶质质量分数为______,该溶液是______溶液(填“饱和”或“不饱和”);(3)40℃时,将甲、乙两物质的饱和溶液各100g降温至20℃,析出晶体(均不含结晶水)的质量关系是:m(甲)______m(乙)(填“>”、“﹦”或“<”).13.如图是A、B、C三种固体物质的溶解度曲线.(S单位:g/100g水,t单位:℃)回答以下问题:①20℃时,A物质的溶解度______(填>、=、<)B物质的溶解度。
中考化学《溶解度及溶解度曲线》专项练习题(附答案解析)

中考化学《溶解度及溶解度曲线》专项练习题(附答案解析)1. 甲、乙、丙三种固体物质的溶解度曲线如右图所示。
下列说法不正确的是()A. T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙B. T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲D. T2℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液2. 下图是甲、乙两种固体物质的溶解度曲线。
下列说法中错误的是( )A. 20℃时,甲、乙饱和溶液中溶质质量分数相等B. 40℃时,甲的溶解度大于乙的溶解度C. 40℃时,乙的饱和溶液中溶质的质量分数为40%D. 将40℃甲的饱和溶液降温到20℃,会有晶体析出3. KNO3与KCl的溶解度曲线如右图所示。
下列说法正确的是( )A. KNO3的溶解度比KCl的溶解度大B. t1温度下的KCl的饱和溶液升温至t2,有晶体析出C. A点所表示的KCl饱和溶液溶质的质量分数为29%D. 冷却热的KNO3饱和溶液可获得KNO3晶体4. ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。
下列说法正确的是( )A. N点对应的ZnSO4溶液升温或降温均都可能析出晶体B. M点对应的ZnSO4溶液是不饱和溶液C. ZnSO4饱和溶液的溶质质量分数随温度升高而增大D. 40℃时,ZnSO4的溶解度为41g5. 下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )A. 甲的溶解度大于乙的溶解度B. 降温可使接近饱和的丙溶液变为饱和溶液C. 将t2°C甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数℃乙>甲=丙D. P点表示t1℃时甲、丙两种物质的溶解度都是25g6. 下图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )A. 乙中含有少量甲,可用冷却热饱和溶液的方法提纯甲B. t3℃时,甲的溶液溶质质量分数一定大于乙的溶液溶质质量分数C. t3℃时,将等质量的甲、乙两种物质的饱和溶液分别降温至t2℃,析出晶体的质量甲一定大于乙D. t1℃时,乙的不饱和溶液只有通过蒸发溶剂的方法才能转变成饱和溶液7.甲、乙、丙三种固体物质的溶解度曲线如图所示。
中考化学溶解度曲线专题

② _______________________________________ 打开可乐瓶育气体猛出,说明原瓶中ff ]压强 <«=大于、小于戴爭于)瓶外大吒压强.(2)如圏是无结晶水會物的固你甲和乙在水中両解度曲线,谙根据该曲鏡图回答下列间题: ① 20弋时’13咫水中溶解 ___ 呂甲物I 质才能形成饱和溶液. ② 现有盹匸的乙的饱和潛襪,与该溶橄有关的重有:A*水的质重氐i 容液中溶质的质壘C. 溶液的质重D. 乙的质壘好数E. 60U 时乙的滔韶度保持温度不变,将该饱和溶液稀释,不变的重是(壇序号,下同);如果将该饱和溶破降蛊至MU,不变的重是20.张老师在讲授溶液时,用固体胡做了如下实验,图一中甲、乙、丙、丁是充分搅拌石静苴的现象,谛回答相关间题(忽略 水的挥捷);(3)甲、乙、丙烧杯中闌酒液一定呈饱和状态的是『划序号】.(4)根据图二,若要使丁烧杯中册:容液恰好这到艳和状态,还需要加入莒的\1固悴.g”门)以下是有关co 二气郎溶解度的几组馥据: CO :在水中的滔解度(单位I mL ) 压强夫气压 温度弋0 25 50 75 100 1 1.7P 0.752 0,423 0.3070.2311015.92 7.14 4.095 2.992.28 25 293016,205>,716,825,73①根据COz 在水中的溶解度表,叙述外畀条件是如何影响气体溶解度的?乙溶解虞S10O6U阪]—(2)上谨实验可以判断物质M 的溶解度曲线是图二对应的 (壇序号)(2) ①的溶簽中溶质质重分颤为_.(3)根据以上借患可推出R 是― 名称或化学式均可).(4) _______________________________________________ 关于图2中悽杯的的物质「苏几种说法正确的育 ________________________________ .A. ①、②、③中,貝有③中上层清播是饱和酒簽B. ③中的固妹福解,可采用加水或升濕的方法C. ①和②的倒液中,酒质质量相等D. ①的泪極中溶质质量分数一定比③的上展漕潑中滔质质童分数小. 10+ 时.将等质置的硝盟钾和氯化钾分别加入到各盛WiOQg 水的两个燒杯中・充分損拌石现象如图1所示,硝酸钾和孰优钿的溶解度曲践如图2所示.tl )烧杯②种的上层涓腹是否达到饱和状态? _______ (塡“是“否“或“无法列断T ;(2)烧杯①中溶辭的溶歸是 _____ (写名称或化学式)*⑶将时刃号硝酸钾的饱和沼液稀释成1只的溶痕,需加水 ___________ g!(4)关于图1中燒杯內的物质,F 列说袪正确的是 ____ .扎 烧杯①内溶液中落质的质堡分数〉疑杯②内上层濬漲中沼験的晓量分數B. 蒸发一定量的水,两悽杯中豁一宦有固体析出C. 将两个烧杯中的溶液混合,充分搅样后,烧杯中一定还有制余固陣10.甲、乙、丙三种固悴的溶解度曲线如图所示,据图冋答:①30C 时,丙的涪解度杲 ②弭I 时* aioog 水中啟入5傀乙物质,充分搅拌后所得稱液的溶质质壷分魏为 .【计貳结 果保帘至0.1%).③若将刘匸时甲、乙、丙三种物质朗饱和溶海升温至比匸(不考虑水的蒸发),可析出晶体的是 •④将况C 时甲、乙、丙三种物质的牠和溶液均降温至10C ,所得溶鮫的稻质质量分数从大到小的顺序是 ______ ・ (2)籌温下歆配厦10呃酒质质量分数淘10%的乙滔潢,操作如图所示. 请回答下列间题: fl E ①图中幔作有错涙的是 (垢对应孕母)一 ②量腕水时,若采用仰视的方法读数,会导致所配潘液的溶质质童分数 (壇“偏±T \ -fi 小”或诜彫HT ) 10. R 是硝酸钾或氧化铁中的一种,硝酸钾和孰化铃的浴解度曲绘如图1所示.某化学兴趣小组的同学迸行了如图二所示实验 心匸时,氮化镀的溶解度沏濬解度&tit 1驱水 ① ②1) g*D.将温度升高到仁9,两烧杯内溶液中洛腭的质臺分数:相等(不若虑水的蒸发)13, 时,将甲、乙各盹呂分别険在盛有ioog 水的两个烧杯中.充分溶解石,恢 复到现隸如图一.甲和乙的启解度曲雉如图二一话纯會图亲回答下列间 題:(1) __________________________ 固体甲对应的稻解度曲线是 (壇或飞“).(2) ____________ M 点的含义 ”(3) 向烧杯①酊滔液中罐缨加入I 也甲物质・充分搅拌,发现固陳先全部酒解「—段时间后又言部分甲析出,你认共r 全部溶解“的原因是 ______ .(4)将匕匸等质量的甲、乙饱和溶菠分别降温时,所得落液的有关说法正确的是 _____ (填宇母)“ 氛甲潜液仍为饱和沼播氐两启播质重甲v 乙c.两溶潑中溶剂质量甲=乙d.两潘液溶质质量分数甲>■乙.10. R 是硝酸钾或孰化皱中的一种,硝酿钾和孰化铁的潜解度曲线如图1所乔.某化学兴趣小组的同学迸行了如图]所丁实验温度匸 團1图2(1)卜匸时,凱化钱的溶解度为 _____ 別 ⑵①的潜薇中濬质质童分魏为^(3) ________________________ 恨寤以上信息可推出R 是 (写君称或化学式均可)•(4) ________________________________________________ 关于图2中烧杯内的物质,以下集中式说法正确的有 . A.①、②、③中,只有③中上层蓿液是饱和溶液B ・③中的固体穆解,可采用加水或升温的方法 C. ①和②的溶液中,潛质质壘相零D. ①的摺液中溶质质量分数一定比③的上层蓿液中溶质质壘分数小.4.海水晒懿提取囊盐晶带后留下的母權叫卤水,卤水中除會外,还含有MgC 咕MgSO 4^^质.它们的溶解度曲线如右图所示.下列说法正确的是()A. Of 时,三种物质的饱和溶液中,溶质质壘分故最大的杲MgSOi B, 三种物质的潛解度豁随温度升高而不断増大匚.将卤水加热到8吒以上蒸炭水分,逐渐析出的晶体是NCI 和应S6D.加匸时,向40gKK 【固体和加前运6固悴中分别加AlOOg 水充另溶解后,两种溶隈均能这晋饱和铁态升温并T —蒸发閃呂水|降温全 ---- "吕②让佃水① 右titi硝釀押(5040 溥解度g20溥解度£① ② 團_溶解度g温度-30604020 O2S , (!)效表是匚0’气体在水中的几组溶解度数据〈单位:tnL WOmL 水)濤解F2550 75 100i 1.79 0.752 0.42J 0.3070.2J110 15.92 7.14 4.095 2.99 2.232529.3016.209 716.325.73①根tgCO 2的諮解度表,可以得出吕棒的溶解度随外界杀件的变化规律是:②打开可乐粗有气体逸出.说瞄原瓶中的压强(填仇亠<“或瓶外丈气压强.(2>甲、乙两物质(均不含结晶水)的濬解度曲线如图,请回答.①“弋时,甲,乙葫物质落解度较丈的是^② 「匸时.Mg 水中加入兀g 乙,充分溶懈所得溶液的底量是 ____ g-③ tjC 时,将乙的不诧和溶液转化为锻和溶祓一定可行的方法是 _______ (填遍号〉. 丄加定量濬质乙不菱发濬剂至晶体析出㈡降温④ "乜吋,甲、乙溶液的溶质厦蛊分数相等且均为叔,则甲溶液一定対 ©填咆和“或怀览和->吉%的取值范囲为_ .⑤ ___________________________________________________________ 将氐©等墮量的甲、乙饱和溶液分别降温到虧乜,有关说法正确的是 _________________________________________________________A. ti©吋濬质质量:甲二二B. 时溶剂廣量:甲〉乙C.时溶液质呈;甲<乙卩 析出晶体质量:甲A 乙.1U 图兼法是一种常甲的数据处理右法,纯會所蜡图瞩回答下列间&氢重化钠、碳酸钠分别在水、酒精中的溶解度如表所示(2)20£时,宜甄化钠的酒解度 (坝”大于杯或“小于”)碳酸钠(3) 40TC 时,若将刃gMOH 分别投入到ICOgTK 和10眩酒精中,能懸成饱和溶液的是 ___液中,观察到的现象为 _____ .23.如图右^^]KXO :的溶解度曲线,弘b 在溶解度曲线上.(1)d 煤对应的滔浪量 ___ 脣帳+ (城■■饱和•'或肴■'不谊和T ) ⑵丸点对应的溶液的质点数是 ________ .〔只列计算式)氢輩化钢 黴酸钠20TJ40920X3401C水 l09g 129g21.8g酒楕17Jg斗佃不溶不溶再将CO 》通入所得?<sOH 的酒精溶t 诸解度g□温農匸濬解厦〔g 100g水)(1)上述图象表示 (壇--氢窜化钠R 或.碳酸钠0的溶解度曲线 030汕涓度匕(3)________________________________________ 将除对应的溶菴升温到70TD,其质重分数.(壇写-变大J "变屮“或亠不变T(4)麒極KXO’i容襪的狀态从b点转化为u点,可采取的措施是^16.两个疑杯中分别盛装念丫厨饱和潛鬲 两只试管中分别裝<XaOH 和黑固帕 向两只试管中分别滴JU 适壷水,现象如 圏一所示"结合團二判断下列说法正确的是<)A. Y 的落解度曲线为b 曲线 B*障温可便X 的饱和潜礦变澤浊C. X 的饱和溶犧从広C 降温到-J 潛质的质量分数变大D*匹f 时,X 、Y 的饱廂溶液筋星相春,则溶刑质量X>¥23・甲、乙固体的溶解度均随着温度的升高而増丸,数据如表:温度P 0 20 40 60 濟解度甲13331.663.9110.0(g/100g 水)乙35.736.036.6373① 20T?时,乙的溶解度是____ g 100g 水.该温度下,将4D 呂乙加入100g 水中,充分搅拌后可得到 _____ 呂溶液. ② 将接近饱和的甲浴礦转化为饱和溶液的一种方迭是 ______③ 甲中温有少量乙,提纯甲的方法是 _____ (垠“降温结晶”或、蒸境结晶"). ④ 刃。
中考化学经典题型专题练习之溶解性、溶解度和溶解度曲线
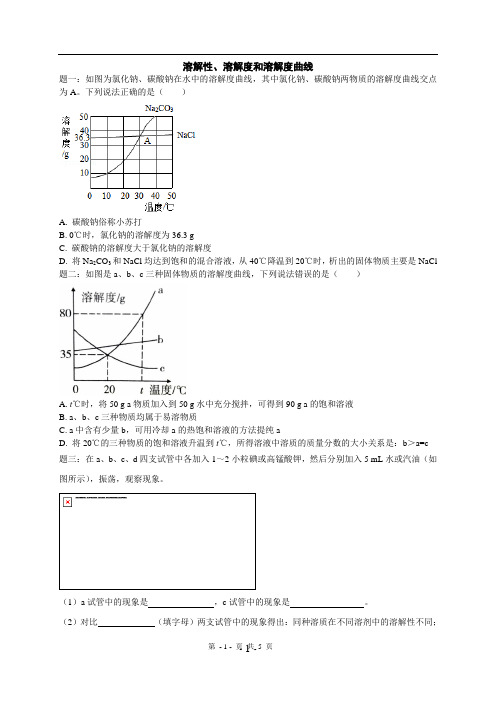
溶解性、溶解度和溶解度曲线题一:如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A。
下列说法正确的是()A. 碳酸钠俗称小苏打B. 0℃时,氯化钠的溶解度为36.3 gC. 碳酸钠的溶解度大于氯化钠的溶解度D. 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl 题二:如图是a、b、c三种固体物质的溶解度曲线,下列说法错误的是()A. t℃时,将50 g a物质加入到50 g水中充分搅拌,可得到90 g a的饱和溶液B. a、b、c三种物质均属于易溶物质C. a中含有少量b,可用冷却a的热饱和溶液的方法提纯aD. 将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a=c题三:在a、b、c、d四支试管中各加入1~2小粒碘或高锰酸钾,然后分别加入5 mL水或汽油(如图所示),振荡,观察现象。
(1)a试管中的现象是,c试管中的现象是。
(2)对比(填字母)两支试管中的现象得出:同种溶质在不同溶剂中的溶解性不同;对比a、c试管中的现象得出的结论是;(3)【提出问题】物质的溶解性除与溶质、溶剂的性质有关外,还与什么有关?【作出猜想】。
【设计方案】。
【观察现象】。
【得出结论】。
题四:小明陪妈妈到医院输液,不小心将护士手中的盘子打翻,其中的棉球落在了小明的白色衬衣上,白色衬衣上立即出现了一大片紫黑色痕迹。
为找到去掉白衬衣上的痕迹的最好方法,几位同学进行了讨论,提出了以下几个方案并进行实验:①用水洗;②用无水酒精洗;③用汽油洗;④用四氯化碳洗;⑤用肥皂水洗;⑥用淀粉溶液洗。
(1)你认为留在白色衬衣上的紫黑色物质是什么?(2)如果用白色布条进行实验,为使实验结果更加准确,你认为该实验中需要控制哪些实验条件?(3)一位同学按如图所示方法进行实验:结果是⑤、⑥几乎完全褪色;②略带颜色;③、④略微变浅;①几乎不变。
2024年中考化学复习专题9溶解度及溶解度曲线

专题9溶解度及溶解度曲线一、溶解度曲线(10年9考)例1[一题多设问] 根据如图所示溶解度曲线,回答下列问题。
命题角度1点的含义、溶解度大小的判断及比较(10年8考)(1)20 ℃时,NaCl的溶解度为________,含义是该温度下________g水中最多能溶解NaCl固体________g。
(2)图1中交点P表示________________________________。
(3)50 ℃时,KNO3、NaCl的溶解度大小关系为____________。
(4)当温度范围为____________时,NaCl的溶解度大于KNO3。
命题角度2物质溶解度受温度变化的情况(10年3考)(1)KNO3、NaCl、Ca(OH)2三种物质中,溶解度随温度升高而增大的物质是____________(填化学式,下同)。
(2)三种物质中________的溶解度受温度影响变化较大。
命题角度3饱和溶液与不饱和溶液的判断及转化(10年2考)(1)将50 ℃时KNO3的饱和溶液降温至t ℃,所得溶液为__________(填“饱和”或“不饱和”)溶液。
(2)20 ℃时,将15 g NaCl固体加入到50 g水中,充分溶解后,所得溶液为________(填“饱和”或“不饱和”)溶液。
(3)t℃时保持温度不变,将NaCl的不饱和溶液转化为饱和溶液的方法有____________。
(4)将接近饱和的Ca(OH)2溶液转化为饱和溶液的方法有____________________。
[方法指导]1.饱和溶液与不饱和溶液的判断:第1步:将溶剂的质量按比例关系转化为100 g。
第2步:将溶质的质量按同比例转化。
比如将15 g NaCl加入到50 g水中,相当于将30 g NaCl加入到100 g 水中。
第3步:比较30 g与NaCl在该温度下的溶解度(S)大小。
若30 g≥S,为饱和溶液;若30 g<S,为不饱和溶液。
2.饱和溶液与不饱和溶液的转化:(1)改变溶质或溶剂质量(适用于所有物质):饱和溶液不饱和溶液增加溶质或蒸发溶剂增加溶剂(2)改变温度,升温或降温取决于物质的溶解度曲线随温度的变化趋势:上升型:不饱和溶液降低温度升高温度饱和溶液下降型:不饱和溶液升高温度降低温度饱和溶液命题角度4物质结晶或提纯方法的判断(10年5考)(1)当KNO3中混有少量NaCl时,可采用________________的方法提纯KNO3。
中考化学考点专训:溶解度及溶解度曲线
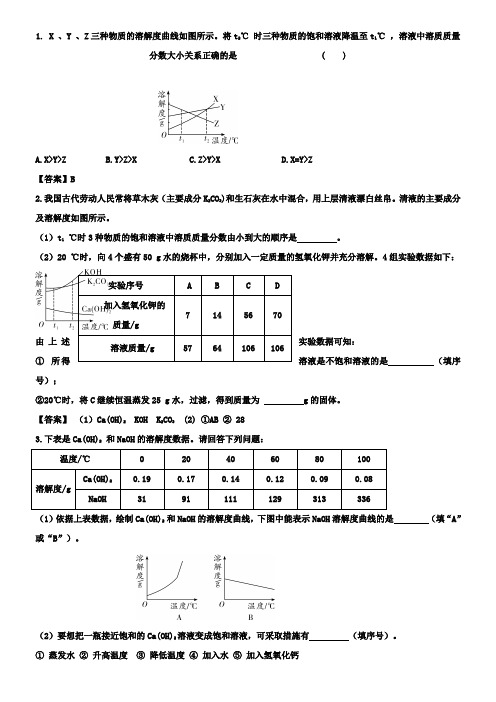
1. X 、Y 、Z三种物质的溶解度曲线如图所示。
将t2℃时三种物质的饱和溶液降温至t1℃,溶液中溶质质量分数大小关系正确的是 ( )A.X>Y>ZB.Y>Z>XC.Z>Y>XD.X=Y>Z【答案】B2.我国古代劳动人民常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白丝帛。
清液的主要成分及溶解度如图所示。
(1)t1℃时3种物质的饱和溶液中溶质质量分数由小到大的顺序是。
(2)20 ℃时,向4个盛有50 g水的烧杯中,分别加入一定质量的氢氧化钾并充分溶解。
4组实验数据如下:由上述实验数据可知:①所得溶液是不饱和溶液的是(填序号);②20℃时,将C继续恒温蒸发25 g水,过滤,得到质量为 g的固体。
【答案】(1)Ca(OH)2 KOH K2CO3 (2) ①AB ② 283.下表是Ca(OH)2 和NaOH的溶解度数据。
请回答下列问题:温度/℃0 20 40 60 80 100溶解度/gCa(OH)2 0.19 0.17 0.14 0.12 0.09 0.08NaOH 31 91 111 129 313 336(1)依据上表数据,绘制Ca(OH)2 和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是(填“A”或“B”)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可采取措施有(填序号)。
①蒸发水②升高温度③降低温度④加入水⑤加入氢氧化钙实验序号 A B C D加入氢氧化钾的质量/g7 14 56 70溶液质量/g 57 64 106 106(3)现有60 ℃时含有Ca(OH)2 和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是。
(4)现有20 ℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后恢复20 ℃,得到乙溶液,溶液中溶质的质量分数的关系为甲乙(填“>”、“<”或“=”)。
2023中考化学专题训练:溶解度曲线及其应用

甲 > (选填“>”“=”或“<”)丙。
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
(3)t2 ℃时分别把15 g甲、乙、丙固体加入50 g水中,能形成饱和溶液的
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
2.(2022•四川内江)我国航天员王亚平在太空演示“冰雪”实验时用到 了过饱和醋酸钠溶液。下图是醋酸钠的溶解度曲线图,下列说法正确的 是( B ) A.常温下,醋酸钠属于微溶物质 B.图中P点所表示的醋酸钠溶液是 不饱和的 C.40 ℃时,饱和醋酸钠溶液的溶质 质量分数是65.6% D.将A点的饱和溶液降温至20 ℃, 溶质质量分数增大
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
12.(2022•四川达州)t1 ℃时,将相同质量的KNO3和KCl分别加入盛有100 g
水的甲、乙烧杯中,充分搅拌后现象如图Ⅰ所示,图Ⅱ为两物质的溶解度曲D 线。以下说法正确的是D ( ) A.甲烧杯中的溶质为KNO3 B.将温度升高到t2 ℃时,乙烧杯中 仍然有固体剩余
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
4.(2022•江苏宿迁)“侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是 NaCl+NH4HCO3 NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线图,下列
初三化学中考专题溶解度曲线练习及答案

专题五溶解度曲线1.a、b两种物质的溶解度曲线如图所示。
下列说法不正确的是A.将t1℃时b的饱和溶液加水可变为不饱和溶液B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变C.t2℃时,两种物质的饱和溶液中溶质质量分数a>bD.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等2.下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t1℃时,丙的饱和溶液中溶质的质量分数为40%3.下图是甲、乙、丙三种固体物质的溶解度曲线,将甲、乙、丙三种物质t2℃时的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系正确的是A.甲>乙>丙B.甲=乙=丙C.甲=乙>丙D.丙>甲=乙4.(多选)甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是A.t1℃时,甲物质的溶解度为20gB.t1℃时,30g甲加入到50g水中最多可得70g溶液C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液D.t2℃时,甲乙两物质的饱和溶液分别降温到t1℃时,所得溶液溶质质量分数的大小关系是:甲<乙5.(多选)甲、乙两种固体物质的溶解度曲线如图所示。
20℃时,进行了如下图所示的实验,下列叙述正确的是A.甲的溶解度大于乙的溶解度B.实验过程中,属于不饱和溶液的是A溶液和C溶液C.实验过程中,只有B溶液和D溶液属于饱和溶液D.实验过程中,B溶液与E溶液中溶质的质量分数相同6.(多选)甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少C.分别将t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数的大小关系是乙>甲>丙D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多丙溶液中无晶体析出7.甲、乙、丙三种物质的溶解度曲线如下图所示。
中考化学溶解度曲线习题汇总含答案
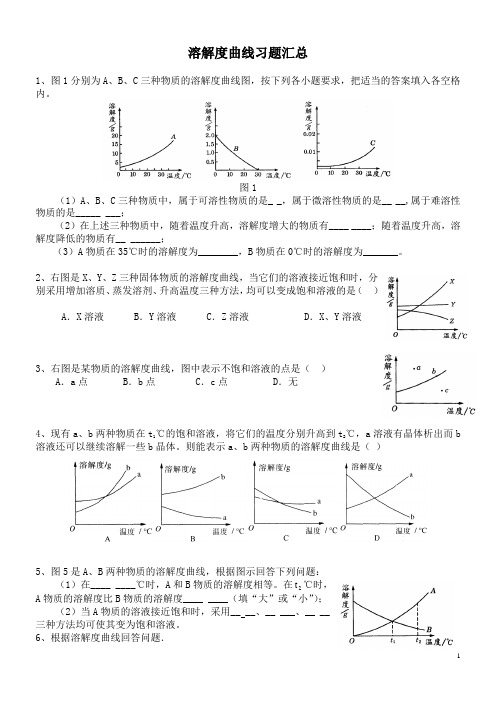
溶解度曲线习题汇总1、图1分别为A、B、C三种物质的溶解度曲线图,按下列各小题要求,把适当的答案填入各空格内。
图1(1)A、B、C三种物质中,属于可溶性物质的是_ _,属于微溶性物质的是__ __,属于难溶性物质的是_____ ___;(2)在上述三种物质中,随着温度升高,溶解度增大的物质有____ ____;随着温度升高,溶解度降低的物质有__ ______;(3)A物质在35℃时的溶解度为________,B物质在0℃时的溶解度为_______。
2、右图是X、Y、Z三种固体物质的溶解度曲线,当它们的溶液接近饱和时,分别采用增加溶质、蒸发溶剂、升高温度三种方法,均可以变成饱和溶液的是()A.X溶液B.Y溶液C.Z溶液 D.X、Y溶液3、右图是某物质的溶解度曲线,图中表示不饱和溶液的点是()A.a点 B.b点C.c点 D.无4、现有a、b两种物质在t1℃的饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体。
则能表示a、b两种物质的溶解度曲线是()5、图5是A、B两种物质的溶解度曲线,根据图示回答下列问题:(1)在____ ____℃时,A和B物质的溶解度相等。
在2t℃时,A物质的溶解度比B物质的溶解度____ ____(填“大”或“小”);(2)当A物质的溶液接近饱和时,采用__ __、__ ___、__ __三种方法均可使其变为饱和溶液。
6、根据溶解度曲线回答问题.(1)溶解度随温度升高而增大的物质是____ ____.(2)t2℃时,溶解度相等的是__ _____.(3)t2℃时,100 g水中加入20 g a物质,溶液不饱和,为使其饱和,可再加入a物质________g,或使其温度降到__ _____℃.7、右图是 a、b、c三种物质的溶解度曲线,据图回答:(1)当温度是℃,a、b两种物质的溶解度相等;℃时三种物质的溶解度由大到小的顺序是(2)t38、甲乙两种固体的溶解度曲线如右图所示。
微专题09 溶解度及溶解度曲线-备战2023年中考化学热点微专题专项突破训练(全国通用)(解析版)

微专题09溶解度及溶解度曲线1.(2022·贵州黔西·中考真题)如图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。
(1)t 3℃时,甲、乙、丙三物质溶解度由小到大的顺序是_____。
(2)t 2℃时,甲和丙两饱和溶液的溶质质量分数关系是_____。
(3)P 点对应混合物,甲、乙、丙中处于不饱和状态的是_____。
【答案】(1)丙<甲<乙(2)甲=丙(3)乙【解析】(1)如图所示,t 3℃时,甲、乙、丙三物质溶解度点在上的是乙表示乙的溶解度最大,其次是甲,最下面的是丙,表示丙的溶解度最小,因此三者溶解度小到大的顺序是:丙<甲<乙;(2)如图所示,t 2℃时,甲和丙的溶解度曲线交于一点,说明此温度下甲和丙的溶解度相等,则根据t 2℃时,甲和丙两饱和溶液的溶质质量分数可以用公式100%100g⨯+溶解度溶解度:计算,因此t 2℃时,甲和丙两饱和溶液的溶质质量分数关系是:甲=丙;(3)如图所示,P 点对应的甲和丙溶解度点都在P 点以下,说明此时甲和丙都处于饱和状态,而P 点在所对应的乙的溶解度点以下,说明此温度下乙是不饱和状态,故填:乙。
2.(2022·湖北襄阳·统考中考真题)如图为甲、乙、丙三种固体物质的溶解度曲线,据图回答问题。
突破一、溶解度曲线(1)t 1℃时,甲、丙两种物质的溶解度大小关系是甲______丙(填“>”“<”或“=”)。
(2)溶解度随温度的升高而减小的物质是______。
(3)t 2℃时,将甲、乙两种物质的饱和溶液降温至t 1℃,对所得溶液的叙述正确的是(填序号)。
A.甲溶液仍是饱和溶液,乙溶液变为不饱和溶液B.溶液中溶剂的质量甲<乙C.溶液中溶质的质量分数甲<乙【答案】(1)=(2)丙(3)C【解析】(1)由溶解度曲线可知,1t ℃时甲、丙两条曲线相交于一点,即1t ℃时,甲、丙两种物质的溶解度大小关系是甲=丙。
2021年中考化学真题分类:溶解度及溶解度曲线

操作
溶质质量
溶液质量
溶质的质量分数
硝酸钾的溶解度
A
从60℃升温至80℃
变大
变大
不变
变大
B
从60℃降温至40℃
变小
变小
不变
变小
C
恒温蒸发部分水
变小
变小
不变
不变
D
保持温度不变,再加入20g硝酸钾固体
不变
变大
变大
变大
【答案】C
13.(2021·潍坊)如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是()
C.将b点的硼酸溶液降温至t1℃时,有晶体析出
D. t2℃时,向50g水中加入20g硼酸后充分搅拌,可得70g溶液
【答案】C
16.(2021·河南)右图是KNO3和NaCl的溶解度曲线。下列说法正确的是( )
A.KNO3溶解度大于NaCl的溶解度
B.t℃时,两种物质的饱和溶液中溶质的质量分数相等
C.30 ℃时,30g NaCl加入100g水中可得到饱和溶液
A.甲、乙、丙三种物质的溶解度关系为S甲>S乙>S丙
B.乙物质的溶解度随温度变化最大
C.27℃时,往26g丙里加100g水,形成不饱和溶液
D.33℃时,甲、乙两种物质溶解度相等
【答案】D
15.(2021·广东)如图是硼酸的溶解度曲线,下列说法正确的是()
A. a点的硼酸溶液中溶质的质量分数为10%
B.将a点的硼酸溶液升温至t2℃时,仍是饱和溶液
B.图中p点表示10 ℃时丙的饱和溶液
C. 20 ℃时,向130 g乙的饱和溶液中加入20 g水,乙的质量分数变为20%
D. 50 ℃时,同质量的甲、乙、丙饱和溶液降温至10℃,丙溶液中析出固体最多
中考化学化学溶解度(大题培优-易错-难题)及答案解析

中考化学化学溶解度(大题培优易错难题)及答案解析一、初中化学溶解度1.下图为甲、乙、丙三种固体物质在水中的溶解度曲线,下列说法正确的是A.50℃时,分别将等质量的甲和乙溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大B.若甲中混有少量的乙,最好采用蒸发结晶的方法提纯甲C.将50℃甲、乙、丙三种物质的饱和溶液降温到10℃,析出晶体最多的是甲D.向100g 50℃的水中加入65g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出,可能是因为甲物质溶于水显著放热【答案】D【解析】A、50℃时,甲的溶解度大于乙的溶解度,分别将等质量的甲和乙溶于适量的水恰好配成饱和溶液,所需要的水甲比乙少,所得溶液的质量前者比后者小,错误;B、甲的溶解度随温度升高变化明显,当甲溶液中混有少量的乙时,可采用降温结晶提纯甲,错误;C、50℃,甲、乙、丙三种物质的饱和溶液降温到10℃时,不知三种溶液质量大小,故无法判断析出晶体质量多少,错误;D、向100g50℃的水中加入65g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出,由于甲的溶解度随温度升高而增大,先溶解则说明温度升高了,后析出则说明温度降低了,甲溶于水会放出显著热量,正确。
故选D。
2.下图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为错误的是()A.t1℃时,M、N两物质溶液的溶质质量分数相等B.N物质的溶解度随温度的升高而降低C.t2℃时,M物质的溶解度大于N物质的溶解度D.由t1℃升温到t2℃时,N物质溶液的溶质质量分数可能改变【答案】A【解析】试题分析:有溶解度曲线图可知A.t1℃时,M、N两物质溶液溶质质量分数相等是错误的叙述,没有说明溶液是否饱和;B选项N物质的溶解度随温度的升高而降低是正确的叙述;C选项t2℃时,M物质的溶解度大于N物质的溶解度D选项由t1℃升温到t2℃时,N物质溶液溶质质量分数可能改变是正确的叙述,看是否加入溶质;故选A考点:溶解度曲线3.在一定温度下,将少量生石灰放入一定的饱和石灰水中,搅拌并冷却、到原来的温度,下列说法中正确的是()A.溶剂质量不变B.溶质质量增加C.溶液浓度不变D.溶解度增加【答案】C【解析】试题分析:由于生石灰会与水反应生成氢氧化钙,同时还会放出大量的热,A、溶剂质量应变小,而不是不变,错误,B、由于饱和溶液水分减少,故溶质会结晶析出,故溶质质量也减少,而不是增加,错误,C、因为最后冷却到原来的温度,成为同温下的饱和溶液,故溶液浓度不变,正确,D、温度没变,溶解度也不变,错误,故选C考点:溶液的成分,氧化钙的化学性质,溶解度的影响因素,溶质质量分数的计算4.A、B、C三种物质的溶解度曲线如图所示,下列说法中正确的是()A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等B.t2C时,把50gA物质放入50g水中得到100g饱和溶液C.将t2℃时,A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=AD.将C的不饱和溶液变为饱和溶液,可采用升温的方法【答案】D【解析】【详解】A、t1℃时,A、C的溶解度相同,但并没有指出它们饱和溶液的质量,所以无法比较二者饱和溶液中溶质的质量,故A项错误;B、t2C时,A的溶解度为50g,也就是100g水最多能溶解A的质量为50g。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2018 年)14.(7 分)硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
温度/℃0 10 20 30 40
Li 2SO4 36.1 35.4 34.8 34.3 33.9 溶解度/ g
KNO 3 13.3 20.9 31.6 45.8 63.9
请回答下列问题:
(1)依据溶解度表,绘制溶解度曲线如图所
示,其中能表示Li 2SO4 溶解度曲线的
是。
(填“甲”或“乙”)
(2 )Li 2SO4 和KNO 3在某一温度时具有相同
的溶解度x,则x 的范围是。
(3)40℃时,有含少量Li 2SO4 的KNO 3 饱
和溶液,欲从中提纯KNO 3 晶体,方法
是。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li 2SO4 溶液中溶质的质量分数(填“>”、“<”
或“=”)KNO 3 溶液中溶质的质量分数。
(5)如图所示,20℃时,将盛有饱和Li2SO4 溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。
则加入的物质可以是_____(填字母序号)。
①浓硫酸②冰块③生石灰固体
④硝酸铵固体⑤氢氧化钠固体
A .②④B.①③⑤C.③④D.①②⑤
(2017 年)13.(4 分)20℃时,取18g KNO 3 和18g NaCl 分别放入两只烧杯中,各加入50mL 水(水
的密度为1g/mL ),充分溶解,现象如图甲所示;升温到50℃时,现象如图乙所示。
KNO 3 和NaCl 的溶解度曲线如图丙。
请回答下列问题:
(1)a 烧杯中加入的物质是(填化学式)。
(2)甲图中, a 烧杯溶液中溶质的质量分数__________(“>”、“<”或“=”)b 烧杯溶液中溶质的质量分数。
(3)要使乙图中的NaCl 溶液恰好变成饱和溶液,需要加入g NaCl 固体。
(4)除去NaCl 固体中混有的少量KNO 3,实验步骤:先加水溶解,再,然后过滤、洗涤、干燥。
(2016 年)13.(4 分)A、B、C 三种固体物质的溶解度曲线如右图所示,回答下列问题。
(1)t1℃时,A、B、C 三种物质的溶解度由大到小的顺序
是。
(2)t2℃时,在 A 物质的饱和溶液中溶质与溶剂的质量最简比
为。
(3)t3℃时,100g 水中溶解60gB 刚好饱和,那么50g 水中溶解g
C 也刚好达饱和。
(4)当A 中混有少量 B 时,可用__________(_填“降温结晶”或“蒸发结晶”)方法提纯A。
(2015 年)13.(4 分)亚硝酸钠(NaNO2)有毒、有咸味,外形与食盐相似。
人若误食会引起中毒。
NaNO 2、NaCl 的溶解度曲线如图所示。
请回答下列问题:
(1)某同学设计的鉴别NaNO2、NaCl 固体的方案如下:20℃时,取 6.0g NaNO2 和6.0g NaCl 分别放入两只小烧杯中,各加入10mL 水(水的密度为1g/mL ),用玻璃棒充分搅拌后,观察现象。
你认为此方案是否可行? (填“可行”或“不可行”)。
(2)除去NaNO2 固体中混有的少量NaCl,实验步骤:加水溶解,蒸发浓缩,,然后过滤、洗涤、干燥。
(3)20℃时,将182.2g NaNO 2 饱和溶液蒸发掉50g 水,再降温到20℃,可析出晶体的质量为。
(4)分别将60℃时等质量的NaNO2、NaCl 的饱和溶液降温到20℃,析出晶体最多的是( 填“NaNO2”或“NaCl”) 。
(2014 年)25.(6 分)NaCl、KNO 3、Ca(OH) 2 三种物质的溶解度曲线如图一与图二所示。
请回答:
图一图二图三
(1)由图一可知,20℃时,氯化钠的溶解度为。
(2)依据图一分析下列问题:50℃时,将氯化钠、硝酸钾固体各40g 分别加入两只各盛有100g 水的烧杯中,充分
搅拌,其中__________(填写物质化学式)得到饱和溶液;另一种物质的溶液中再加入__________g 该溶质,溶液恰好饱
和;若将温度都降到20℃,硝酸钾溶液中溶质的质量分数__________(“>”、“<”或“=”)氯化钠溶液中溶质的质量
分数。
(3)依据图一分析,要从含有少量硝酸钾的氯化钠溶液中,得到较纯净的氯化钠固体,可采用先__________再过
滤的物理方法。
(4)如图三所示,20℃时,将盛有饱和石灰水的小试管放入盛水的烧杯中,向水中加入氢氧化钠固体,结合图二分析
石灰水中可能出现__________的现象。
(2013 年)25.(6 分)下表是Ca(OH) 2 和NaOH 的溶解度数据。
请回答下列问题:
温度/℃0 20 40 60 80 100
溶解度/g Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
NaOH 31 91 111 129 313 336 (1)依据上表数据,绘制Ca(OH)2 和NaOH 的溶解度曲线,下图中能表示NaOH 溶解度曲线的是(填 A 或B)。
(2)要想把一瓶接近饱和的Ca(OH) 2 溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,
⑥加入生石灰。
其中措施正确的是。
A .②④⑥B.③④C.①③⑤⑥D.①②⑤⑥
(3)20℃时,191g 饱和NaOH 溶液,蒸发10g 水后,再降温到20℃,可析出NaOH 晶体的质量为。
(4)现有20℃时Ca(OH) 2 的饱和溶液(甲溶液),向其中加入一定量CaO 后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH) 2 和NaOH 两种溶质的饱和溶液,若要得到较纯净的NaOH 晶体,应采取的物理方法是。
(2012 年)23.(6 分)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(1)25℃时,将25g 甲固体加入到50g 水中,充分溶解并恢复到原温度后,得到
溶液的质量为g。
(2)要使35℃时接近饱和的甲溶液变成该温度下的饱和
溶液,可采用的一种方法是。
(3)现有操作步骤:a.溶解b.过滤c.降温结晶
d.加热浓缩;若甲固体中含有少量乙,则提纯甲的操作步骤是
(填字母序号)。
(4)将35℃时丙的饱和溶液降温到25℃,则其溶液的溶
质质量分数(填“变大”、“变小”或“不变”)。
(5)向100g35℃的水中加入45g 甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出。
你认为“全部溶解”的原因可能是。
(2011 年)23.(6 分)KNO 3 和KCl 在不同温度时的溶解度如下表所示。
请回答下列问题:
温度/℃0 10 20 30 40 50 60 70
KNO 3 13.3 20.9 31.6 45.8 63.9 85.5 110 138
溶解度/g
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3
(1)依据上表数据,绘制KNO 3 和KCl 的溶解度曲线,右图中能表示KNO 3 溶解度曲线的是。
(填m 或n)
(2)由表中数据分析可知,KNO 3 和KCl 在某一温度时具有相同的溶解度x,则x 的取值范围是。
(3)10℃时,131g 饱和KCl 溶液,蒸发10g 水后,再降温到10℃,可析出KCl 晶体的质量为。
(4)如右图所示,20℃时,将盛有饱和KNO 3 溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。
加入的物质可能是下列中的________(填字母序号)。
A.氢氧化钠固体B.生石灰固体C.冰块
D.硝酸铵固体E.浓硫酸。
