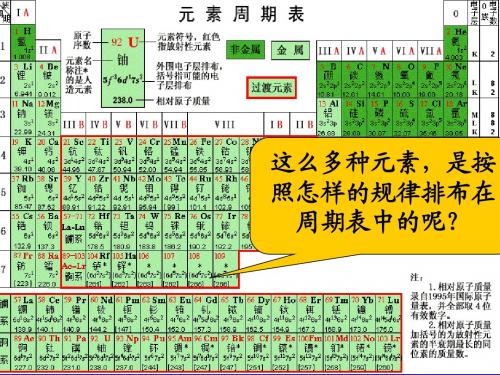
门捷列夫元素周期表.
元素周期律发现者门捷列夫

元素周期律发现者门捷列夫在化学教科书中,都附有一张“元素周期表”。
这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。
它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。
看到这张表,人们便会想到它的最早发明者、俄国化学家——门捷列夫(Dmitri Ivanovich Mendeleev,1834—1907)。
门捷列夫于1834年2月7日诞生在俄国西伯利亚的托波尔斯克市。
这个时代,正是欧洲资本主义迅速发展时期。
生产的飞速发展,不断地对科学技术提出新的要求。
化学也同其他科学一样,取得了惊人的进展。
门捷列夫正是在这样一个时代,诞生到人间。
他从小就热爱劳动,热爱学习。
他认为只有劳动,才能使人们得到快乐、美满的生活;只有学习,才能使人变得聪明。
门捷列夫的父亲是位中学教师。
在他出生后不久,父亲双目失明,一家的生活全仗着他母亲经营一个小玻璃厂而维持着。
1847年,双目失明的父亲又患肺结核而死去。
意志坚强而能干的母亲并没有因生活艰难而低头,她决心一定要让门捷列夫像他父亲那样接受高等教育。
门捷列夫自幼有出众的记忆力和数学才能,读小学时,对数学、物理、历史课程感兴趣,对语文、尤其是拉丁语很讨厌,因而成绩不好。
他特别喜爱大自然,曾同他的中学老师一起作长途旅行,搜集了不少岩石、花卉和昆虫标本。
他善于在实践中学习,中学的学习成绩有了明显的提高。
少年的门捷列夫在学校读书的时候,一位很有名的化学教师,经常给他们讲课。
热情地向他们介绍当时由英国科学家道尔顿始创的新原子论。
由于道尔顿新原于学说的问世,促进了化学的发展速度,一个一个的新元素被发现了。
化学这一门科学正激动着人们的心。
这位教师的讲授,使门捷列夫的思想更加开阔了,他决心为化学这门科学献出一生。
当门捷列夫展现出才能后,由于当地没有好的大学,母亲把家从西伯利亚先迁到莫斯科后又迁到彼得堡,在门捷列夫遭到莫斯科大学和彼得堡大学拒绝后,最终母亲把他送进了师范学院。
门捷列夫和第一张元素周期表

门捷列夫和第一张元素周期表门捷列夫和第一张元素周期表1829年德国化学家德贝莱(J.Dobereiner)发现当时已知的44种元素中有15种元素可分成5组,每组的三个元素性质相似,而且中间元素的相对原子质量约为较轻和较重的两个元素相对原子质量之和的一半。
例如,钙、锶、钡性质相似,锶的相对原子质量大约是钙和钡的相对原子质量之和的一半。
氯、溴、碘,锂、钠、钾等组元素的情况类似,由此提出了“三素组”的概念,为发现元素性质的规律性打下了基础。
1859年,24岁的俄国彼得堡大学年轻讲师门捷列夫来到德国海德堡大学本生的实验室进修。
当年,本生和基尔霍夫发明了光谱仪,用光谱发现了一些新元素,掀起一股发现新元素热。
次年,门捷列夫出席了在化学史上具有里程碑意义的德国卡尔斯鲁厄化学大会。
门捷列夫回忆道:“我的周期律的决定性时刻在1860年,我……在会上我聆听了意大利化学家康尼查罗的演讲……正是当时,元素的性质随原子量(相对原子质量)递增而呈现周期性变化的基本思想冲击了我。
”此后,门捷列夫为使他的思想信念转化为科学理论,作出了10年艰苦卓绝的努力,系统地研究了元素的性质,按照相对原子质量的大小,将元素排成序,终于发现了元素周期律——元素的性质随相对原子质量的递增发生周期性的递变。
在门捷列夫时代,没有任何原子结构的知识,已知元素只有63种,元素大家族的信息并不完整,而完整的元素周期表。
1880年,迈耶尔坦言道:“我没有足够的勇气去作出像门捷列夫那样深信不疑的预言。
”他之所以没有勇气,在他1870发表的有关元素周期性的文章里有答案,他说:“在差不多每天都有许多新事物出现的领域里,任何概括性的新学说随时都会碰到一些事实,它们把这一学说加以否定。
这种危险的确是存在的……因此我们必须特别小心。
”迈耶尔比门捷列夫早几年也在本生的实验室里工作过。
门捷列夫发表的第一张周期表对我们来说,已经不太好懂了,因为它并不完整。
例如,门捷列夫周期表里没有稀有气体。
第一节元素周期表
碱金属的物理性质的比较
颜色 硬度 密度 Li Na K Rb Cs 均为银白色(Cs略带金色) 柔软 较小
相 似
点
熔沸点
ⅠA
0
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
主族序数=最外层电子数
注 意
周 七 —— 2 种 第 1周期 总结: 期 主 短周期 第 2周期 —— 8 种 表 七 副 —— 8 种 里 和 第 3周期 —— 18 种 数 零 周期 第 4周期 周 族 (7个) —— 18 种 第 5周期 期 , 长周期 —— 32 种 第 6周期 , 最 后 第 7周期 —— 26 种 1 莫 2 忘 共 7 个主族,包括短周期和长周期元素 主族 3 第 副族 共 7 个副族,只包括在长周期中 4 族 5 族 第VIII族 包括第8、9、10 纵行 。 (16个) 6 0族 稀有气体元素 7 Ⅷ
(A) 2
3 11 19ຫໍສະໝຸດ 4(B)2 10 11 18 19
(C)
6 11 12 13 24
(D)
6 14 31 32
7
练习与思考:
3.在短周期元素中,原子最外电子层只 有1个或2个电子的元素是 (D ) A.金属元素 B.稀有气体元素 C.非金属元素 D.无法确定为哪一类元素
4.下列说法中正确的是(C ) A.每一周期的元素都是从碱金属开始, 最后以稀有气体结束 B.同一周期中(除第一周期外),从左 到右,各元素原子核的电子数都是从1 个逐渐增加到8个 C.第二、三周期上下相邻元素的原子 核外电子数相差8个 D.第七周期只有23种元素
元素周期表助记词
横行叫周期,共有七周期; 三四分长短,第七不完全。 纵行称作族,共有十六族; 二、三分主副,先主后副族; VIII族最特殊,三行是一族; 二次分主副,副后是主族。 一、八依次现,一、零再一遍。 锕、镧各十五,均属IIIB族。
无机化学元素的周期表

无机化学元素的周期表无机化学元素周期表是现代化学的基石之一。
它是由俄罗斯化学家门捷列夫在1869年首次提出。
周期表是对所有已知元素的排列,并以其物理和化学性质为依据。
在周期表中,元素被分为若干个周期,每个周期有一个主族和一些过渡元素。
周期表的基本结构周期表的基本结构是由元素周期和元素族两个基本概念构成的。
元素的周期是指在周期表中相邻元素的排列顺序;而元素的族则是指同一主族内的全部元素。
周期表中的元素周期周期表中的元素周期是指元素在周期表中从左到右排列的顺序。
周期表中的第一周期只有两个元素:氢和氦。
元素周期表中的其他周期分别是:第二周期:锂、铍、硼、碳、氮、氧、氟和氖;第三周期:钠、镁、铝、硅、磷、硫、氯和氩;第四周期:钾、钙、钪、钛、钒、铬、锰、铁、钴、镍、铜、锌、镓、锗、砷、硒、溴和氪;第五周期:铷、锶、钇、锆、铌、钼、锝、钌、铑、钯、银、镉、铟、锡、锑、碲、碘和氙等等。
周期表中的元素族元素周期表中的元素族是指具有相同物理和化学性质的元素。
元素周期表中的元素族分为主族元素、过渡元素、稀土元素和放射性元素。
主族元素是指周期表中1、2、13、14、15、16、17和18族元素,它们常常在化学反应中成为离子或共价化合物。
过渡元素是指元素周期表中的第3到第12族元素,它们有多达18个电子,有着独特的物理和化学性质。
稀土元素是指周期表中的第57到第71个元素,它们有着非常相似的化学性质,因此被归为一类。
放射性元素是指周期表中的最后一个元素类别,其中最著名的是铀和钚等,它们具有较高的放射性。
元素周期表中的特别元素元素周期表中存在一些特别的元素,这些元素在周期表中的位置有着特殊的意义。
其中最著名的是氢,它是第一周期中唯一一个元素,是宇宙中最基本的原子。
在周期表中,氢虽然在第一周期,但是它的化学性质非常特殊,可以与氧、氮、硫等元素形成非常复杂的化合物。
碳是另外一个特别的元素,在第二周期中,但是它的化学性质非常活跃,可以与氢、氧、氮等元素组成数百万种复杂的化合物。
俄国化学家门捷列夫制成了元素周期表.

6.4 週期表
1986年,俄國化學家門捷列夫製 成了元素週期表
元素性質具規律性
相似性質的元素放於表中同一族
現代的週期表
排列元素,建立週期表。
族 原子序
電子排佈
週 期
鹼 鹼土 金金 屬屬
過渡金屬
主族 金屬
過渡 金屬
半金屬 非金屬
氣體 液體
固體
主族
週期表
貴 氣 體
鹵 素
週期和族
週期表可分為 週期 和 族。
5.1 具有相似化學性質的元素
圖中鈣與稀氫氯酸的作用。
圖中鎂與稀氫氯酸的作用。
化學性質與電子排佈
元素的化學性質是取決於原子 最外層電子數目。
5.1 具有相似化學性質的元素
பைடு நூலகம்
具有相似化學性質的元素
不同元素的化學性質會否相似? A. 鉀、鈉和鐵分別與水的作用
鉀和鈉與水的反應相似。
5.1 具有相似化學性質的元素
圖中是--鉀與水的作用。
圖中是—鈉與水的作用。
具有相似化學性質的元素
不同元素的化學性質會否相似? B. 鈣、鎂和銅分別與稀氫氯酸的 作用 鈣和鎂與稀氫氯酸的反應相似。
(2) 最外層電子數目 = 元素的族數
氯原子的電子排佈
為電子佔用的電子層數目 =3 = 週期數
最外層電子數目 =7 = 族數 (VII)
圖中--元素的週期數和族數與其原子的電子排佈有 密切關係。
族—元素的家族
週期表中的同一族元素具 有相似的性質。 若知道一個元素的性質, 就可以預測同一族中,另 一元素的性質。
ir鐵on
zi鋅nc
si銀lver
co銅pper
g金old pla鉑tinum
门捷列夫和他的元素周期表

门捷列夫和他的元素周期表门捷列夫俄国化学家。
1834年2月7日生于西伯利亚托博尔斯克,1907年2月2日卒于彼得堡(今列宁格勒)。
1850年入彼得堡师范学院学习化学,1855年毕业后任敖德萨中学教师。
1857年任彼得堡大学副教授。
1859年他到德国海德堡大学深造。
1860年参加了在卡尔斯鲁厄召开的国际化学家代表大会。
1861年回彼得堡从事科学著述工作。
1863年任工艺学院教授,1865年获化学博士学位。
1866年任彼得堡大学普通化学教授,1867年任化学教研室主任。
1893年起,任度量衡局局长。
1890年当选为英国皇家学会外国会员。
门捷列夫的最大贡献是发现了化学元素周期律。
他在批判继承前人工作的基础上,对大量实验事实进行了订正、分析和概括,总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着原子量(现根据国家标准称为相对原子质量)的递增而呈周期性的变化。
这就是元素周期律。
他根据元素周期律编制了第一个元素周期表,把已经发现的63种元素全部列入表里,从而初步完成了使元素系统化的任务。
他还在表中留下空位,预言了类似硼、铝、硅的未知元素(门捷列夫叫它类硼、类铝和类硅,即以后发现的钪、镓、锗)的性质,并指出当时测定的某些元素原子量的数值有错误。
而他在周期表中也没有机械地完全按照原子量数值的顺序排列。
若干年后,他的预言都得到了证实。
门捷列夫工作的成功,引起了科学界的震动。
人们为了纪念他的功绩,就把元素周期律和周期表称为门捷列夫元素周期律和门捷列夫元素周期表。
元素周期律的发现激起了人们发现新元素和研究无机化学理论的热潮,元素周期律的发现在化学发展史上是一个重要的里程碑,它把几百年来关于各种元素的大量知识系统化起来形成一个有内在联系的统一体系,进而使之上升为理论。
门捷列夫因发现周期律而获得英国皇家学会戴维奖章(1882年)。
他还曾获英国科普利奖章(1905年)。
1955年科学家们为了纪念元素周期律的发现者门捷列夫,将101号元素命名为钔。
元素周期表(自制)

元素周期表(原子序数)——门捷列夫原子序数=核电荷数=质子数=核外电子书短周期(1-3)长周期(4-6)Ⅷ族(7)主族(A)副族(B)——Ⅷ族(8,9,10)(1)主族,副族,0族,Ⅷ族的位置(2)0族的序号(3)金属与非金属的分界线核素: X同位素:中子数不同的同一种元素同位素应用习题:1.判断位置2.应用选择元素周期律原子(原子核(A,Z),核外电子)电子层划分:K_M_N_O_P_Q→离核越来越远→能量越来越高核外电子排布的一些规律:(1)排满(2)最多容纳2n2个(n为电子层序数)(3)最外层不超过8,次外层不超过18倒数第三层不超过32非金属性,金属性变化研究:(1)原子序数增加,金属性,非金属性有周期性变化(2)原子序数增加,元素最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强。
元素周期律:(1)金属性与非金属性强弱(2)氧化还原性强弱(3)酸碱性强弱(4)元素的化合价(5)寻找新物质(6)粒子半径比较化学键:1.离子键——离子化合物2.共价键——共价化合物3.电子式4.极性键与非极性键5.分子间作用力6.氢键1~20号元素原子核外电子排布的特点:(1)最外层电子数和次外层电子数相等的原子有:(2)最外层电子数是次外层电子数2倍的原子是:(3)最外层电子数是次外层电子数3倍的原子是:(4)最外层电子数是次外层电子数4倍的原子是:(5)次外层电子数是最外层电子数2倍的原子有:(6)内层电子总数是最外层电子数2倍的原子有:(7)电子层数和最外层电子数相等的原子有:(8)电子层数是最外层电子数2倍的原子有:(9)最外层电子数是电子层数2倍的原子有:(10)最外层电子数是电子层数3倍的原子有:与He原子电子层结构相同的离子有____________________________________ 与Ne原子电子层结构相同的离子有____________________________________ 与Ar原子电子层结构相同的离子有____________________________________ (2)核外电子总数为10的粒子阳离子:____________________________________阴离子:____________________________________分子:____________________________________(3)核外电子总数为18的粒子阳离子:____________________________________阴离子:____________________________________分子:____________________________________核外电子总数及质子总数均相同的粒子____________________________________________________________________________________________________________。
门捷列夫与元素周期律

门捷列夫与元素周期律摘要:元素周期律的形成与发展,是化学发展史上最伟大的成就之一,它促进了化学体系特别是无机化学体系的形成,是化学史上一个重要的里程碑。
它的形成与发展离不开前人的艰苦探索与后人的修改完善,而在这其中门捷列夫对于元素周期律的形成的贡献一直受后人称颂,本文中将对元素周期律形成的历史背景,门捷列夫对其的最初想法,研究进程,不断修正至最后形成较完备体系的过程进行陈述,以及对他在元素周期律研究上所体现出的思想方法和探索精神进行深一步的挖掘。
关键词:化学,门捷列夫,元素周期律,思想方法。
一、引言门捷列夫的一生是伟大的,仅一项元素周期律的最初确立就为人类的发展做出了相当大的贡献。
但这一过程必然是艰难困苦的,而且难以用几个词语概括,期间有着难以计数的实验,大量的资料积累,不断地思考挖掘,反反复复地进行枯燥乏味的事情,正是有门捷列夫自身有的素质,不懈的坚持,不放弃,不抛弃,终于获得了成果,下文将对门捷列夫对于元素周期律的发现进行陈述。
二、元素周期律的历史背景19世纪初,自道尔顿的原子论提出以后,人们对化学元素的概念更加清晰了。
1811年,意大利物理学家阿伏伽德罗提出“分子”的概念,解决了之前因分不清分子和原子而造成的各种矛盾。
经过将近50年的反复曲折,19世纪60年代,物质的原子一分子论终于获得公认。
到1869年时,已经发现的元素达到了63种。
到19世纪中叶,他们积累了大量关于元素物理和化学性质的感性材料,同时,19世纪上半叶能量守恒定律、进化论和细胞学说三项重大发现,又从思想上促进了元素周期律的发现。
1829年,德国化学家德贝莱纳提出了“三元素组’的分类方法,把三种性质相似的元素划为一组,把十五种元素分为五组:铿、钠、钾; 钙、锶、钡; 磷、砷、锑; 硫、硒、碲;氯、溴、碘。
发现中间元素的原子量约等于前后两元素原子量的平均值。
1862年,法国化学家和地质学家尚古多按照原子量由小到大递增顺序排列了一个“螺旋图”来表现元素周期性,他将已发现的元素绘在一条带子上,然后将这条带子缠绕在一根柱子上,如果垂直地从上往下看,就会发现这些元素之间有某些相似的性质。
第一节元素周期表

物质结构、元素周期律 元素周期表
第一节
门捷列夫与元素周期表
第一张元素周期 表是俄国化学家 门捷列夫于1869 年绘制完成的。 他将元素按相对 原子质量由小到 大排列,化学性 质相似的元素放 在一个纵行。
第一章
物质结构、元素周期律
元素周期表
第一节
一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种 编号叫原子序数。
七个横行为七个周期
周期序数 = 原子电子层数 第1周期 2 种元素 短周期 (3个) (2)周期的分类 第2周期 8 种元素 第3周期 8 种元素 第4周期 18 种元素 第5周期 18 种元素
(若排满也 是32种)
第6周期 32 种元素 不完全周期 第7周期 26 种元素
长周期 (3个)
三长三短一不全
(二)卤族元素
Br2 I2
1、卤素单质的物理性质 递 变 性
颜色
F2 Cl2
状态
熔沸点 密度
相 似 性 都有颜色 熔沸点较低 不易溶于水(除F2) 易溶于有机溶剂
气
浅 → 深 低 →
小 →
→ 液 → 固
Br2
I2
高
大
注意:溴、碘单质在不同溶剂中的颜色 Br2 I2 水溶液 黄(稀)→ 橙色(浓) 深黄(稀)→褐色(浓) 油(CCl4、苯等)溶液 橙红色 紫红色
(2)卤素与水反应
与水反应 F2 Cl2 Br2
剧烈反应,生成氟化氢和氧气 2F2+2H2O=4HF+O2
与水缓慢反应 Cl2+H2O=HCl+HClO 与水反应更弱 Br2+H2O=HBr+HBrO 与水只微弱反应 I2+H2O=HI+HIO
元素周期律是1869年俄国科学家门捷列夫(DmitriMendeleev)首创的

元素周期表现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,元素周期表的雏形。
经过多年修订后才成为当代的周期表。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
[1]德米特里·伊万诺维奇·门捷列夫在化学教科书中,都附有一张“元素周期表(英文:periodic table of elements)”。
这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。
它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。
看到这张表,人们便会想到它的最早发明者——门捷列夫。
1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。
元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。
随着科学的发展,元素周期表中未知元素留下的空位先后被填满。
当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的核电荷数,形成现行的元素周期表。
按照元素在周期表中的顺序给元素编号,得到原子序数。
原子序数跟元素的原子结构有如下关系:原子数=原子序数=核外电子数=核电荷数利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列.后来又经过多名科学家多年的修订才形成当代的周期表。
门捷列夫第一份英文版本的元素周期表.元素周期表中共有119种元素。
将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列。
元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的

元素周期表现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,元素周期表的雏形。
经过多年修订后才成为当代的周期表。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
[1]德米特里·伊万诺维奇·门捷列夫在化学教科书中,都附有一张“元素周期表(英文:periodic table of elements)”。
这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。
它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。
看到这张表,人们便会想到它的最早发明者——门捷列夫。
1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。
元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。
随着科学的发展,元素周期表中未知元素留下的空位先后被填满。
当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的核电荷数,形成现行的元素周期表。
按照元素在周期表中的顺序给元素编号,得到原子序数。
原子序数跟元素的原子结构有如下关系:原子数=原子序数=核外电子数=核电荷数利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列.后来又经过多名科学家多年的修订才形成当代的周期表。
门捷列夫第一份英文版本的元素周期表.元素周期表中共有119种元素。
将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列。
化学元素周期表

化学元素周期表百科名片化学元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
现代化学的元素周期律是1869年的德米特里·伊万诺维奇·门捷列夫首创的。
19 13年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序数)排列,经过多年修订后才成为当代的周期表。
常见的元素周期表为长式元素周期表。
在长式元素周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族,最后有两个系。
除长式元素周期表外,常见的还有短式元素周期表,螺旋元素周期表,三角元素周期表等。
道尔顿提出科学原子论后,随着各种元素的相对原子质量的数据日益完善和原子价(化合价)概念的提出,就使元素相对原子质量与性质(包括化合价)之间的联系显露出来。
德国化学家德贝莱纳就提出了“三元素组”观点。
他把当时已知的54种元素中的15种,分成5组,每组的三种元素性质相似,而且中间元素的相对原子质量等于较轻和较重的两个元素相对原子质量之和的一半。
例如钙、锶、钡,性质相似,锶的相对原子质量大约是钙和钡的相对原子质量之和的一半。
法国矿物学家尚古多提出了一个“螺旋图”的分类方法。
他将已知的62种元素按相对原子质量的大小顺序,标记在绕着圆柱体上升的螺旋线上,这样某些性质相近的元素恰好出现在同一母线上。
这种排列方法很有趣,但要达到井然有序的程度还有困难。
另外尚古多的文字也比较暧昧,不易理解,虽然是煞费苦心的大作,但长期未能让人理解。
英国化学家纽兰兹把当时已知的元素按相对原子质量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一一个元素的性质相近。
第一节元素周期表
例:Cl元素相对原子质量的计算 同位素的相对原 同位素 子质量(Mi)
35 17 37 17
丰度(ai) 75.77%
24.23%
Cl Cl
34.969
36.966
Cl元素相对原子质量=M1×a1 + M2×a2
= 34.969×75.77% + 36.966×24.23% = 35.453 Cl元素近似相对原子质量= A1×a1 + A2×a2 = 35×75.77% + 37×24.23% = 35.485
Rb
Cs
与H2O反应
剧烈, 生成H2
更剧烈, 轻微的爆 遇水立即 遇水立即 炸,生成 燃烧,爆 燃烧,爆 生成H2 H2 炸 炸
结论
同一主族,自上而下,金属性增强。
(2)递变性:与氧气、与水反应的剧烈程度有所不 同;在同一族中,自上而下反应的剧烈程度逐渐增大 .
③碱金属物理性质
元素 名称 锂 钠 钾 铷 铯 元素 符号 核电 荷数 颜色和状态 密度 g/cm3 0.534 0.97 0.86 1.532 1.879 熔点 O C 沸点 O C
随着核电荷数的增加,原子半径 递增 试从卤素的原子结构讨论它们的化学性质
②卤素的化学性质
1)卤素与金属反应
2Na+X2=2NaX
X=F、Cl、Br、I
2)卤素与氢气反应
名称
F2 Cl2 Br2 I2
反应条件
冷暗处爆炸 光照或点燃 高温 高温、持续加热 缓慢进行
方程式
H2+F2====2HF H2+Cl2=====2HCl H2+Br2======2HBr H2+I2======2HI
化学元素周期表

化学元素周期表现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列,经过多年修订后才成为当代的周期表。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
元素周期表简介化学元素周期表元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,后来又经过多名科学家多年的修订才形成当代的周期表。
元素周期表中共有118种元素。
每一种元素都有一个编号,大小恰好等于该元素原子的核内电子数目,这个编号称为原子序数。
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
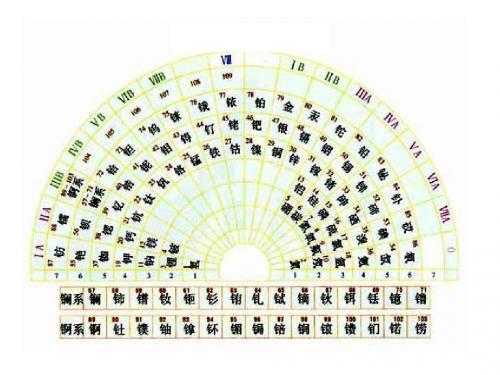
元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。
共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
元素周期表

第 周期(共 种元素) 第 周期,目前发现 26 种元素 不 完 全 周 期
( 1) 个 个
个)
2.族
主族( 个;用
表
族( 个纵行, 示副族)( 个;用
表
_个族)
示) 第 族( 个, 纵 列)
__ _族( 个, 纵 列)
※元素周期表结构记忆方法:
横行叫周期(现有一至七):三短三长一未完。
纵列称作族(18 纵行 16 族):7 主、7 副Ⅷ和“0”;Ⅷ族最贪婪(8、9、10 列占);
生成的溴化氢不如氯化氢稳定
不断加热才能 缓慢反应, 碘化氢不稳定同时发生分解,是 可逆 反应。
反应化学方程式
H2 +F2 错误!未找到引用源。 2HF
光照或点燃
H2+Cl2 ====== 2HCl
△
H2+Br2
2HI
△
H2+I2
2HI
【规律】从上到下: 卤素单质与 H2 的剧烈程度:依次
; 生成的氢化物的稳定性:依次
,原子得到电子的
能力
,所以从上到下非金属性逐渐
。
(2)应用:根据元素的非属性强弱的判断其性质(或根据其性质判断元素非金属性的强弱)
氧化性 强
单质
元素的非金属性强
与氢结合能力 增强
气态氢化物的稳定性 增强
化合物
最高价氧化物的水化物的酸性 强
(三)构、位、性之间的关系:
结构
决
决
定 映映 定
反
反
性质
反映
1.69g/l(15℃) -188.1
Cl2
黄绿色气体
3.214g/l(0℃) -34.6
Br2
深红棕色液体
3.119g/cm3(20℃) 58.78
【课外阅读】门捷列夫

门捷列夫在化学教科书中,都附有一张“元素周期表”。
这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。
它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。
看到这张表,人们便会想到它的最早发明者——门捷列夫。
德米特里·伊万诺维奇·门捷列夫生于一八三四年二月七日俄国西伯利亚的托波尔斯克市。
门捷列夫从小就热爱劳动,热爱学习。
他认为只有劳动,才能使人们得到快乐、美满的生活;只有学习,才能使人变得聪明。
门捷列夫在学校读书的时候,一位很有名的化学教师,经常给他们讲课。
热情地向他们介绍当时由英国科学家道尔顿始创的新原子论。
由于道尔顿新原于学说的问世,促进了化学的发展速度,一个一个的新元素被发现了。
化学这一门科学正激动着人们的心。
这位教师的讲授,使门捷列夫的思想更加开阔了,决心为化学这门科学献出一生。
门捷列夫在大学学习期间,表现出了坚韧、忘我的超人精神。
由于门捷列夫学习刻苦和在学习期间进行了一些创造性的研究工作,一八五五年,他以优异成绩从学院毕业。
毕业后,他先后到过辛菲罗波尔、敖德萨担任中学教师。
这期间,他一边教书,一边在极其简陋的条件下进行研究,写出了《论比容》的论文。
文中指出了根据比容进行化合物的自然分组的途径。
一八五七年一月,他被批准为彼得堡大学化学教研室副教授,当时年仅二十三岁。
攀登科学高峰的路,是一条艰苦而又曲折的路。
门捷列夫在这条路上,也是吃尽了苦头。
当他担任化学副教授以后,负责讲授《化学基础》课。
在理论化学里应该指出自然界到底有多少元素?元素之间有什么异同和存在什么内部联系?新的元素应该怎样去发现?虽然有些化学家如德贝莱纳和纽兰兹在一定深度和不同角度客观地叙述了元素间的某些联系,但由于他们没有把所有元素作为整体来概括,所以没有找到元素的正确分类原则。
年轻的学者门捷列夫也毫无畏惧地冲进了这个领域,开始了艰难的探索工作。
他不分昼夜地研究着,探求元素的化学特性和它们的一般的原子特性,然后将每个元素记在一张小纸卡上。
门捷列夫发现元素周期表

元素周期表是由俄国化学家门捷列夫发现的。
一天清晨,门捷列夫经过一个夜晚的研究后,疲倦地躺在书房的沙发上,他预感十五年来一直萦绕心头的问题即将迎刃而解,因此,这几个星期以来他格外地努力。
十五年来,从他学生时代开始就一直对"元素"与"元素"之间可能存在的种种关联感兴趣,并且利用一切时间对化学元素进行研究。
最近他感觉自己的研究大有进展,应该很快就能把元素间的关联和规律串在一起了。
由于过度疲劳,门捷列夫在不知不觉中睡着了。
睡梦中,他突然清晰地看见元素排列成周期表浮现在他的眼前,他又惊又喜,随即清醒过来,顺手记下梦中的元素周期表。
元素周期表的发现成了一项划时代的成就,而因为在梦中得到灵感,所以人们称为"天才的发现,实现在梦中。
"但门捷列夫却不这么认为,把这个累积十五年的成就归功于"梦中的偶然"让他忿忿不平。
他说:"在做那个梦以前,我一直盯着目标,不断努力、不断研究,梦中的景象只不过是我十五年努力的结果。
"
【人生智慧】天下没有任何成就是偶然的,只不过一般人只看到别人的成功而往往忽略了背后长期的努力和付出,而用运气好或是其它理由来加以解释,因而相较自己的表现"时运不济"就成了失败的最佳借口。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期表的内在性质
在《元素性质和原子量的关系》一文中,门捷列夫指出: • (1)按照原子量大小排列起来的元素,在性质上呈现明显的 周期性变化。 • (2)化学性质相似的元素,或者是原子量相近(如Pt,Ir, Os),或者是依次递增相同的数量(如K,Rb,Cs)。 • (3)各族元素的原子价(化合价)一致。 • (4)分布在自然界的元素都具有数值不大的原子量值,具有 这样的原子量值的一切元素都表现出特有的性质,因此可 以称它们是典型的元素。
• (5)原子量的大小决定元素的特征。
• (6)应该预料到许多未知元素将被发现,例如排 在铝和硅后面的、性质类似铝和硅的、原子量位 于65~75之间的两种元素。
• (7)当我们知道了某些元素的同类元素的原子量 后,有时可借此修正该元素的原子量。
• (8)一些类似的元素能根据其原子量的大小被发 现出来。
ห้องสมุดไป่ตู้
感谢您的关注!
门捷列夫元素周期表
材研1003
姚飞
元素周期表的起源
1829 年,德国的柏莱纳根据元素的性质,提出三色组的分 类方法,指出每组中间元素的原子量等于两端元素原子量的平 均值。 1864年,德国的迈耶按照元素的原子量顺序把元素分成六组, 使化学性质相似的元素排在一个纵行里。 1868年,英国的纽兰茨把元素按原子量增加的顺序排列,发
现它位置前后的七个元素有相似的性质,他将这个规律成为
“八音律”。 1868年,迈耶发表了著名的原子周期性图解。
1869年,门捷列夫编成了第一张元素周期表。
他指出,元素的物理和化学性质随着原子量的
递增而作周期性的变化。
1871年,他果断修正了前一个元素周期表。在 新表中,族是竖排,周期是横排,这样各族元素 的化学性质变化就更为清晰,那些性质尚不明确 的元素在表格的右侧,形成各族元素的副族。尚 未发现的元素有六个空格。
