医院临床项目研究违背方案报告表
医院临床研究伦理审查申请及报告指南

医院临床研究伦理审查申请及报告指南1.目的:为指导开展涉及人体研究项目的主要研究者、课题负责人递交伦理审查申请,以及研究过程中的跟踪审查申请、SAE报告、修改方案申请等,特制定本指南。
2.范围:开展的所有“涉及人体的研究〞,应依据本指南递交伦理审查申请,包括本院及外单位开展的研究项目。
2.1本院所有专业科室开展的项目。
2.1.1各期药物临床试验。
2.1.2医疗器械临床试验。
2.1.3涉及人的临床科研项目(包括涉及标本和病例记录的研究)。
2.1.4拟在本院开展的临床新技术新项目。
2.2外单位研究者利用本院资源/数据标本开展的研究。
3.定义:无。
4.权责:无。
5.制度内容5.1伦理审查申请/报告的类别(Ethical ReviewApplication/Review Category)5.1.1初始审查(Initial Review)初始审查申请:符合上述范围的研究项目,应在研究开始前提交伦理审查申请,经批准后方可实施。
“初始审查申请〞是指首次向伦理委员会提交的审查申请。
5.1.2跟踪审查(Follow-Up Review)5.1.2. 1修正案审查申请:研究过程中假设变更主要研究者,对临床研究方案、知情同意书、招募材料等的任何修改,应向伦理委员会提交修正案审查申请,经批准后执行。
5.1.2.2年度/定期跟踪审查报告:应按照伦理审查批件/意见规定的年度/定期跟踪审查频率,在截止日期前1个月提交年度r定期跟踪审查报告;申办者应当向组长单位伦理委员会提交各中心研究进展的汇总的报告;当出现任何可能显著影响研究进行或增加受试者危险的情况时,应以“研究进展报告〞的方式,及时报告伦理委员会。
5.1.2.3严重不良事件报告:严重不良事件是指临床研究过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡,导致先天畸形等事件。
发生严重不良事件,应及时向伦理委员会报告。
5.1.2.4违背方案报告:需要报告的违背方案情况包括:①重大的违背方案,研究纳入了不符合标准或符合排除标准的受试者,符合中止试验规定而未让受试者退出研究,给予错误治疗或剂量,给予方案禁止的合并用药等没有遵从方案开展研究的情况;或可能对受试者的权益、健康以及研究的科学性造成显著影响等违背GCP原则的情况。
临床试验伦理委员会对临床研中方案违背或偏离报告的管理

临床试验伦理委员会对临床研中方案不依从/违背或偏离报告的管理1、不依从/违背或偏离方案的定义目前国际国内法规中对不依从/违背或偏离方案没有明确的区分,《药物临床试验伦理审查工作指导原则》中称之为不依从/违背方案,定义为指对伦理委员会批准试验方案的所有偏离,并且这种偏离没有获得伦理委员会的事先批准,或者不依从/违背人体受试者保护规定和伦理委员会要求的情况。
而《医疗器械临床试验质量管理规范》中描述为方案偏离,且定义为指有意或者无意地未遵循临床试验方案要求的情形。
ICH E3则描述为偏离方案,其规定为研究者/研究机构应当依从由申办者同意、管理当局(如有要求)批准,并已获得伦理委员会批准的试验方案。
研究者/研究机构和申办者应在试验方案或类似的合同(如在美国,研究者要求签署FDA-1572表)上签字以确认对方案的依从。
如没有和申办者达成一致并事先得到伦理委员会的审查和书面同意,研究者不能有任何偏离方案的行为,除非必须立即消除对受试者的伤害,或只是涉及事务上的或管理方面的变化(如监查员变更、电话号码的变更)。
研究者/研究机构或申办者方面有不依从方案/SOP/现行法规的行为时,申办者应立即采取措施以保证对方案的依从。
不依从/违背方案的责任主体可以是研究者/研究机构、受试者、申办者或申办者委托的CRO相关人员,按严重程度一般分为轻微和重要两级。
2、不依从/违背或偏离方案报告范围ICH E3中对偏离方案的报告范围有一定要求,报告范围描述为与研究入选或剔除的标准、试验的实施、患者的管理或评估有关的重要偏差,具体分类为:① 患者不符合入选标准,但进入研究;② 患者符合退出标准,但没有退出;③ 患者接受错误的治疗和不正确的剂最;④ 患者使用了研究禁止的伴随药物。
我国的相关法规或指南如《药物临床试验伦理审查工作指导原则》(2010年)中写明不依从/违背方案的审查是指对临床试验进行中发生的不依从/违背方案事件的审查;而《医疗器械临床试验质量管理规范》(2016年)中对偏离方案的报告要求研究者应当及时向临床试验机构的医疗器械临床试验管理部门报告,并经其及时通报申办者、报告伦理委员会影响受试者权益、安全和健康或者临床试验科学性的临床试验方案偏离,包括请求偏离和报告偏离,在我国开展的临床试验应优先遵循我国的相应法规和指南要求对临床试验中发生的不依从/违背方案事件进行报告。
医院临床试验不良事件与严重不良事件处理标准操作规程

医院临床试验不良事件与严重不良事件处理标准操作规程目的建立不良事件及严重不良事件发现、处理、记录和报告的标准操作规程,保证不良事件和严重不良事件得到迅速的处理和报告,最大限度保障受试者的安全和权益。
适用范围适用于本机构所有药物临床试验中不良事件和严重不良事件的处理。
操作规程1.试验前要求:(1)申办者提供该药物的临床前安全性研究资料及其他与安全性有关的资料,并列入研究者手册;(2)在设计方案中对不良事件应作出明确的定义,并说明不良事件严重程度的判断标准,判断不良事件与试验药物关系的分类标准(如肯定有关、可能有关、可能无关、无关和无法判定);(3)方案中要求研究者必须如实填写不良事件记录表,记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归;(4)试验开始前,研究小组成员必须熟悉试验药物的相关安全性信息,熟悉试验方案,了解项目进行中可能发生的不良事件;(5)项目组制订急救预案,成立急救小组,小组成员熟悉急救预案内容并保证联系通畅;(6)将研究医生、护士或伦理委员会的联系方式告知患者。
2.研究者有义务采取必要的措施以保障受试者的安全,参与受试者治疗的研究人员均有正确记录不良事件和严重不良事件、迅速报告严重不良事件的义务和责任。
不论不良事件是否与试验药物有因果关系,研究者均应在原始记录中记录并填写到病例报告表中,同时在记录及报告上签名和注明日期。
4.不良事件的处理与记录(1)住院患者如受试者在住院期间发生不良事件,按以下程序处理:发现受试者出现不良事件后,管床医生或值班医生应及时告知研究者,如有必要,可先对症处理,由研究者初步评定不良事件的程度分级和与试验药物的相关性,并给予进一步处理意见:1)一般不良事件:可密切续观事件的转归或根据试验方案进行相应对症处理;2)重要不良事件:研究者应及时通报主要研究者,并根据方案要求暂停治疗、调整药物剂量和予以针对性治疗等措施,如有必要,PI可决定是否紧急揭盲;3)严重不良事件:按下述“5.严重不良事件(SAE)的处理和报告”的内容及时处理并按相应 SOP进行报告。
临床试验质量机构质控检查报告表.doc

威海市立医院药物临床试验机构文件编号:JG-form-017-1.0临床试验质量机构质控检查报告表质控人员:检查日期:药物试验项目名称:申办方:专业组:专业组负责人:检查的病例:检查内容1方案执行是否NA1)入选、排除标准是否符合方案要求?2)受试者是否按方案要求进行相关访视、检查(实验室、影像学、体格检查等) ?3)受试者用药是否符合方案要求 ?4)是否有对应临床试验方案的SOP?5)是否有方案偏离 /违背,并有相关记录和报告 ?6)交通补贴等是否及时发放 ?2人员和设施是否N/A1)研究人员发生变化 ?i.已获取简历 ?ii.研究人员职责分工与授权表已经更新?iii.新的研究人员已接受相关培训 ?3知情同意是否N/A1)受试者在开始试验之前(或由其法定代理人)签属了知情同意书并注明了知情同意的日期?2)进行知情同意说明的研究者也在知情同意书上签字并注明了日期?3)研究者在使用 IEC/IRB 批准的知情同意书?4)研究者保留了受试者的签字并标注日期完整的知情同意书原件?5)受试者签名真实性确认?4原始记录是否N/A1)获得知情同意过程的记录2)原始记录真实、完整、可溯源3)CRF 是否在一周内完成填写(特殊要求除外)4)所有退出失访均有说明5)错误或遗漏修改规范6)实验室检查有报告单或者复印件7)报告单是否及时签名、异常值判断8)方案偏倚 / 违背记录9)合并用药记录5试验用药及其他研究相关资料是否N/A1)试验药物的入库、出库登记是否完整规范?2)试验药物接受、使用、返还记录是否完整、规范(包括日期、试验药物名称、批号、编码、有效期、数量、交接记录、试验用药管理者签字)3)是否有试验用药发放记录?4)对于退回的剩余试验药物,交接记录是否完整,有误销毁或者返还机构办公室的记录?5)是否由专人管理,并定期清点?6)是否存放在带锁的临床试验专用药柜?7)药物存放温度是否符合标准,记录是否完整规范?8)注射药物是否有需要配置?9)注射药物是否有配置记录?10)注射药物是否有输注开始、结束时间记录及签名?11)药量与用法是否遵照试验方案?6 SAE记录报告是否N/A1)是否及时、准确、规范地填写《严重不良事件报告表》2)是否在获知 24 小时内报送 CFDA 、省食品药品监督管理局、申办方、伦理委员会、药物临床试验机构?3)对于正在持续的 SAE ,研究者是否密切跟踪并完成后续“随访报告”、“总结报告”,也需及时报送 CFDA 、申办方,伦理委员会,药物临床试验机构?7样本管理(中心实验室)是否N/A1)是否有采样记录(包括操作者签名)2)是否有样本保存记录3)是否有样本交接记录8专业组质控检查是否N/A1)是否有 ICF 检查记录2)是否有方案执行情况检查记录3)是否有原始数据检查记录4)是否有试验药品检查记录5)是否有试验用物品检查记录6)是否有 AE/SAE 检查记录7)是否有样品管理检查记录8)是否有合并用药记录9申办方监查是否N/A1)监查员是否对方案执行、原始文件、资料等进行检查2)监查的频率是否规范,每次来医院是否有相关的监查记录3)是否定期提交该实验的监查报告,报告中的内容是否与机构质控检查的结果相符4)监查员是否对试验药物定期核查,确保试验药物结存量并提前更换即将到期的药物补充备注及其它问题检查人员签字:主要研究者签字:日期:日期:。
临床设计研究病例报告表

合并××病、××病等:
精神或法律上的残疾患者。
怀疑或确有酒精/药物滥用病史。
根据研究者的判断、具有降低入组可能性或使人组复杂化的其他病变。如工作环境经常变动等易造成失访的情况。 治疗过程中合并使用其他治疗××疾病药物
临床设计研究病例报告表
病例入选
登记表
试验中心号二□
药物编号
患者姓名拼音-
就诊日期
年 月 日
一、入选标准
是
否
符合××病诊断、中医××证诊断标准者,
年龄在××~××岁之间.
病程在×××月以内。
知情同意,志愿受试。
如果以上任何一项回答“否”,则患者不能进入研究
二、排除标准
是
否
具有临床意义的心血管病变、肝脏病变、肾脏病变、胃肠道病变、血液学病变、肺脏疾病、严重神经系统疾病、肿瘤、艾滋病。
□
冂
□
□
□
如果以上任何一项回答“是”.则患者不能进入研究
观察医师签名:日期:年月日
医院临床研究项目开展情况自查报告

医院临床研究项目开展情况自查报告临床研究项目的开展是医院提升科技创新能力的重要途径,医院大力鼓励医务人员自主开展临床研究项目,并做好前期的伦理审查工作,现对医院临床研究项目开展情况进行梳理并汇报如下:一、临床研究开展情况1.伦理审查工作是临床研究项目开展的前提条件,对于促进涉及人的生物医学研究中保护受试者的生命和健康、维护受试者的合法权益方面有着至关重要的作用。
医院领导高度重视,根据国家、省、市各级文件要求,不断完善医院管理制度、成立领导小组、明确责任分工,保证医院伦理审查工作顺利开展。
2.根据世界医学协会《赫尔辛基宣言》、国家卫生和计划生育委员会《涉及人的生物医学研究伦理审查办法》(中华人民共和国国家卫生和计划生育委员会第11号令)等文件精神,医院印发了《涉及人的生物医学研究伦理审查制度的通知》《药物临床试验伦理委员会成员调整的通知》,设立伦理委员会,下设办公室,任命主任委员、副主任委员、委员,对受理的项目及时开展伦理审查,提供审查意见;对已批准的研究项目进行定期跟踪审查,确保项目研究不会将受试者置于不合理的风险之中。
3.2023年医院组织召开伦理审查会议近10次,包括初审项目12项、跟踪审查5项、方案违背审查4项、SAE审查8项、修正案审查3项、结题审查7项;快审项目26项。
无涉及干细胞、体细胞、基因治疗、异种移植等方面的临床研究项目。
二、存在问题及整改措施(一)存在问题医院伦理审查体系需要进一步完善。
医院现设有医学伦理委员会及药物临床试验伦理委员会,需根据不同项目类别,进一步细分,使伦理审查工作更加规范、高效。
(二)整改措施1.进一步完善伦理审查体系,完善、修订管理制度,规范管理。
2.在实践中不断探索、持续优化伦理审查流程,高效、高质量地完成伦理审查工作。
3.对伦理委员会成员加强岗位职责学习;对医院科研人员加大宣传及培训力度,深入了解伦理审查工作的重要性、必要性。
三、意见、建议建议上级部门对伦理审查体系建设给予指导,组织开展伦理审查管理人员培训及相关专业内容培训。
医院临床研究伦理审查申请及报告指南

医院临床研究伦理审查申请及报告指南1.目的:为指导开展涉及人体研究项目的主要研究者、课题负责人递交伦理审查申请,以及研究过程中的跟踪审查申请、SAE报告、修改方案申请等,特制定本指南。
2.范围:开展的所有“涉及人体的研究”,应依据本指南递交伦理审查申请,包括本院及外单位开展的研究项目。
2.1本院所有专业科室开展的项目。
2.1.1各期药物临床试验。
2.1.2医疗器械临床试验。
2.1.3涉及人的临床科研项目(包括涉及标本和病例记录的研究)。
2.1.4拟在本院开展的临床新技术新项目。
2.2外单位研究者利用本院资源/数据标本开展的研究。
3.定义:无。
4.权责:无。
5.制度内容5.1伦理审查申请/报告的类别(Ethical Review Application/Review Category)5.1.1初始审查(Initial Review)初始审查申请:符合上述范围的研究项目,应在研究开始前提交伦理审查申请,经批准后方可实施。
“初始审查申请”是指首次向伦理委员会提交的审查申请。
5.1.2跟踪审查(Follow-Up Review)5.1.2.1修正案审查申请:研究过程中若变更主要研究者,对临床研究方案、知情同意书、招募材料等的任何修改,应向伦理委员会提交修正案审查申请,经批准后执行。
5.1.2.2年度/定期跟踪审查报告:应按照伦理审查批件/意见规定的年度/定期跟踪审查频率,在截止日期前1个月提交年度r定期跟踪审查报告;申办者应当向组长单位伦理委员会提交各中心研究进展的汇总的报告;当出现任何可能显著影响研究进行或增加受试者危险的情况时,应以“研究进展报告”的方式,及时报告伦理委员会。
5.1.2.3严重不良事件报告:严重不良事件是指临床研究过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡,导致先天畸形等事件。
发生严重不良事件,应及时向伦理委员会报告。
5.1.2.4违背方案报告:需要报告的违背方案情况包括:①重大的违背方案,研究纳入了不符合标准或符合排除标准的受试者,符合中止试验规定而未让受试者退出研究,给予错误治疗或剂量,给予方案禁止的合并用药等没有遵从方案开展研究的情况;或可能对受试者的权益、健康以及研究的科学性造成显著影响等违背GCP原则的情况。
临床试验中违背方案问题的分析与建议

中国医学伦理学Chinese Mebicoi Ethics 2021年2月Feb.2021第34卷第2期Feb.34Nc.6临床试验中违背方案问题的分析与建议李树,赵t成程,陈向梅,张沂*(解放军总医院医疗保障中心药剂科,北京300432uay_ksPu@153.om)〔摘要〕通过对某三甲医院近6年受理的293份违背方案报告进行分类统计,从违背类型、严重程度、责任归属、对受试者及试验数据的影响等方面进行归纳和总结,剖析违背发生的原因,并提出建议。
结果显示,最常见的违背方案类型为实验室检验/检查缺失,其次为不符合入排标准、给予错误的治疗或错误的药量等。
责任主体主要为研究者,其次为监查员,受试者依从性差也是发生违背的原因之一。
因此,违背方案是临床试验过程中不可避免的问题。
加强研究者GCP培训,提高监查员工作质量,加强相关职能部门的有效协作和监管力度,以及保证受试者依从性等都是减少违背方案的有效措施。
伦理委员会应加大违背方案的审查力度和监督,切实保障受试者利益和临床试验质量。
〔关键词〕临床试验;违背方案;伦理委员会;受试者利益;临床试验质量〔中图分类号〕R_052〔文献标志码〕A〔文章编号〕301-8565(2021)02-0211-05 DOI:10.12020/j.isso.1001-5565我021.02.15Analysis and Suggestion on Issces of Protocai Violation in Clinicai TriaisLI SSu,ZHAO Churn,CHENG Cheng,CHEN Xiaagmet ,ZHANG Yt (Departmeni of Pharmacy^Menicai Supplins C p O s af Chinese People*'Army General Hospital:Bentng100048,Chta,E-mait5u P c_H s P u@)Abstrrct:Based on the classified statistics of293violation protocol reports received by a third-graOe hospital in the past6years:this paper analyzed and summauzeb the reasons for the violation fem the aspects of violation type,sevehty,Utridution of responsiPility,impact on subjects and test data,and put foevard feasible suag/tmos. The results showed that the most common types of protocol violation were missing ladoratoe tests/inspections: followed by failure to meet Inclusion/wxclusion chteha,giving wmog treatment or weng dosage,etc.The main bobivs of espoosidikm were researchers,followed by the inspectors.SuUjects'poor compliance was also one of the reasons for the violation.Therefore,protocol violation is an inevitaple problem in clinical tWals.SWwymwXg GCP training for researchers:improving the quality of inspectors'word,endaocing Wfective colladoration and supeeision of relevant fnocPonai dwutmwts:and ensuhng suUject compkaoco are ehective measurvs to reduce violaVoos.The ethics committee should intensify the review and supeeision of petocoi violations to ehectively protect the benefit of the suUjects and the quality of clinical twats.Keywoi'ds:ClUiol Thais;Protocol Violations;Ethics Committee;SuUject Benefit;Quality of Clinical Thai临床试验是医药创新研发的重要环节之一。
医院临床研究方案评估表【模板】

外资/合资企业
一、主要研究者评估(以下问题请主要研究者以书面形式回答,作为附件与评估表一起上交机构办)
1.方案的科学性:
a)入排标准是否合理?合理 □不合理□
b)主要疗效指标设计是否合理?合理□不合理□
c)随机、对照、盲法设计是否合理?合理□不合理□
2.方案的可行性评估:
a)是否有足够受试者满足方案入组要求?是□否□
b)访视周期能否按时完成?是□否□
c)安全性随访能否完成?是□否□
d)所有的检验检查本院能否执行?
e)试验药物/器械/试剂盒/生物样本的管理专业组能否按方案要求执行?是□否□
f)是否有足够的人力资源完成试验(研究团队包括研究医生、研究护士、质控员、技术员等)?
是□否□
二、评估意见:承接□,不承接□
主要评估者签字:日期:年月日
XX医院临床研究方案评估表
项目名称
(方案编号)
NMPA批件号/备案号注册分类试验分期Fra bibliotek□是□否
有样品/遗传数据出口
□是□否
需要“人类遗传资源”申报
项目总例数
中心数
本中心例数
□是□否
组长单位
专业组
专业组负责人
联系电话
主要研究者
联系电话
申办者名称
监查员
联系电话
□是□否
外资/合资企业
CRO名称
CRA
联系电话
专业组负责人签字:
日期:年月日
市妇幼保健院医疗质量(安全)不良事件报告表

市妇幼保健院医疗质量(安全)不良事件报告表*报告日期:年月日时分*事件发生日期:年月曰时分A.患者资料*1姓名: 2.性别:3.年龄4.门诊号/住院号5 .临床诊断:6 .在场相关人员或相关科室:B.不良事件情况♦7 .事件发生场所:口急诊口门诊□病房口医技部门口行政后勤部门口其它8 .不良后果:□无□有(请写出)9 .事件经过(可另加附页):10 .患者目前状况:C.不良事件类别♦口医护安全事件:包括针刺、锐器刺伤、接触化疗药、传染病等导致损害的不良事件□知情告知事件:如知情告知不准确、未行知情告知、未告知先签字、告知与书面记录不i致、告知书未签字等不良事件口设备器械使用事件:设备故障或使用不当导致的不良事件口输血事件:医嘱、备血、传送及输血不当引起的不良事件口药物调剂分发错误事件:医蝇、处方、给药、调剂等不良事件口基础护理事件:如摔倒、坠床、误吸、误咽、未按医嘱执行禁食/禁水、无约束固定、烧烫伤事件等口病案重大缺陷:包括未书写门诊病历、缺少手术记录、输血记录、出院记录;性别记录错误、血型记录错误、手术部位左右记录错误、单双胎记录错误、无资质人员书写记录等口治疗错误事件:患者、部位、器材、剂量等选择错误;不认真查对事件等□方法/技术错误事件:遗忘、未治疗、延期、时间或程序错误、不必要的治疗、灭菌/消毒错误、体位错误等口导管操作事件:静点滴漏/渗、导管脱落/断裂/堵塞、连接错误等口放射安全事件:如放射线泄露、放射性物品丢失、未行防护、误照射等口不作为事件:医疗护理工作中已发现问题,但未及时处理及汇报,导致的不良后果加重等事件口营养与饮食事件:如饮食类别错误、未按医嘱用餐或禁食等口物品运送事件:如延迟、遗忘、丢失、破损、未按急需急送、品种规格错误等□信息传递错误事件:医师、护理、医技判定意见错误、医嘱错误(口头及书面)、其它传递方式错误口医疗技术检查事件:检查人员无资质、标本丢失或弄错标本、试剂管理、医疗信息沟通错误:迟报、漏报、错报结果等□非预期事件:非预期重返ICU或延长住院时间口其它事件:非上列之异常事件D.不良事件的等级*□I级事件口∏级事件□In级事件□IV级事件E.事件发生后及时处理与分析*导致事件的可能原因:事件处理情况(提供补救措施或改善建议):F.不良事件评价(主管部门填写)主管部门意见:G.持续改进措施(主管部门或医疗质量管理委员会填写)。
山东中医药大学附属医院临床研究项目伦理审查申请表
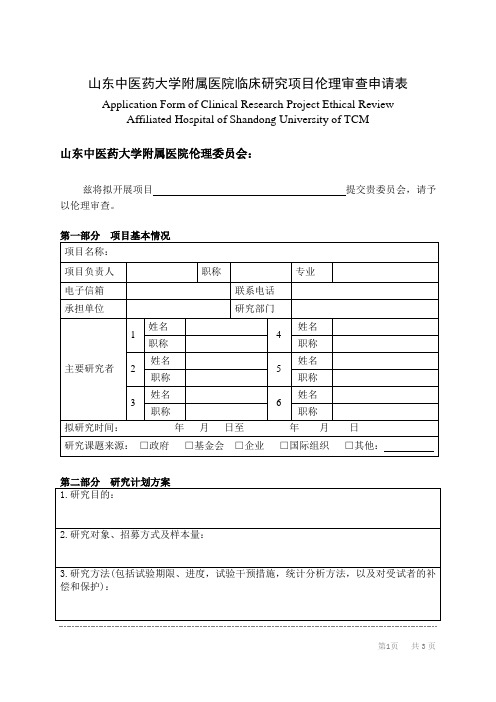
山东中医药大学附属医院临床研究项目伦理审查申请表Application Form of Clinical Research Project Ethical ReviewAffiliated Hospital of Shandong University of TCM山东中医药大学附属医院伦理委员会:兹将拟开展项目提交贵委员会,请予以伦理审查。
项目名称:项目负责人职称专业电子信箱联系电话承担单位研究部门主要研究者1姓名4姓名职称职称2姓名5姓名职称职称3姓名6姓名职称职称拟研究时间:年月日至年月日研究课题来源:□政府□基金会□企业□国际组织□其他:1.研究目的:2.研究对象、招募方式及样本量:3.研究方法(包括试验期限、进度,试验干预措施,统计分析方法,以及对受试者的补偿和保护):4.研究对象的选定:招募范围:健康者□病人□是否对研究对象说明研究目的?是□否□5.知情同意:将以何种形式获得研究对象的同意。
书面□口头□⑴不能以书面方式表达的原因:⑵由谁来向研究对象说明试验目的和要求:⑶是否在必要时提供口头翻译?是□否□⑷如研究对象(例:儿童)不能表达意愿,由谁来做决定?6.保密:⑴在研究期间及研究完成后,谁有权使用原始数据?⑵原始数据及资料如何保管?⑶在论文或研究报告等研究成果中是否保证不公开个人姓名及足以让人识别出受试者身份的信息?是□否□7.风险评估:⑴此研究是否可能导致对研究对象的精神伤害?是□否□⑵此研究是否可能导致对研究对象的躯体伤害?是□否□⑶此研究是否会增加研究对象的额外经济负担?是□否□⑷此研究是否涉及到个人隐私?是□否□研究如果导致伤害,如何处理?如果涉及到个人隐私,如何处理?8.此研究是否涉及以下特殊研究对象?⑴子宫中胎儿是□否□⑵无法成活的胎儿/流产的胎儿是□否□⑶婴儿(0~1岁)是□否□⑷儿童(1~13岁)是□否□⑸少年(13~18岁)是□否□⑹孕妇/哺乳期妇女是□否□⑺老人(60岁以上)是□否□⑻心智不全者是□否□如果涉及以上特殊研究对象,说明理由:如果涉及以上特殊研究对象,说明将如何采取特殊保护措施:1.利益:⑴研究是否可能给社会带来益处?是□否□⑵研究是否给研究对象带来直接利益?是□否□⑶给研究对象支付的补偿性报酬,是否足以对之造成经济上的诱导?是□否□2.潜在的危害:⑴研究否存在潜在危害?是□否□⑵如果存在潜在危害,采取哪些预防措施?⑶是否给研究对象提供研究人员电话,以备咨询?是□否□3.研究人员保证:⑴遵守世界医学协会(WMA)通过《赫尔辛基宣言》、世界卫生组织(WHO)国际医学科学理事会(CIOMS)合作的《涉及人的生物医学研究的国际伦理准则》,及其他相关规定的伦理要求。
临床研究病例报告表

XXX研究病例报告表(CRF表)受试者姓名:家庭地址:医院名称:填表单位:XXX医院临床负责科室:XXX科【受试者资格】匹兹堡睡眠质量指数(PSQI)指导语:下面一些问题是关于您最近1个月的睡眠状况,请选择或填写最符合您近1个月实际情况的答案。
请回答下列问题!1.近1个月,晚上上床睡觉通常是_点钟。
2.近1个月,从上床到人睡通常需要_分钟。
3.近1个月,通常早上_点起床.4.近1个月,每夜通常实际睡眠_小时(不等于卧床时间)。
对下列间题请选择1个最适合您的答案。
5.近1个月,因下列情况影响睡眠而烦恼:a.入睡困难(30分钟内不能人睡)(1)无;(2) <1次/周;(3) 1-2次/周;(4) ≥3次/周b.夜间易醒或早醒(1)无;(2) <1次/周;(3) 1-2次/周;(3) ≥3次/周;c.夜间去厕所(1)无;(2) <1次/周;(3) 1-2次/周;(4) ≥3次/周;d.呼吸不畅(1)无;(2) <1次/周;(3) 1-2次/周;(4) ≥3次/周;e.咳嗽或奸声高(1)无;(2) <1次/周;(3) 1-2次/周;(4) ≥3次/周;f.感觉冷(1)无;(2) <1次/周;(3) 1-2次/周;(4)≥3次/周;g.感觉热(1)无;(2) <1次/周;(3)1-2次/周;(4)≥3次/周;h.做恶梦(1)无;(2) <1次/周;(3) 1-2次/周;(4) ≥3次/周;I.疼痛不适(1)无;(2) <1次/周;(3) 1-2次/周;(4) ≥3次/周;j.其他影响睡眠的事情(1)无;(2) <1次/周;(3) 1-2次/周;(4) ≥3次/周;如有,请说明:6.近1个月,总的来说,您认为自己的睡眠质量(1)很好;(2)较好;(3)较差;(4)很差;7.近1个月,您用药物催眠的情况(1)无;(2) <1次/周;(3) 1-2次/周;(4) ≥3次/周;8.近1个月,您常感到困倦吗(1)无;(2) <1次/周;(3) 1-2次/周;(4) ≥3次/周;9.近1个月,您做事情的精力不足吗(1)没有;(2)偶尔有;(3)有时有;(4)经常有PSQI 总分=成份I +成份II +成份III +成份IV +成份V 十成份VI +成份VII 。
医院临床试验临床试验项目年度定期研究进展报告

临床试验项目(年度/定期)研究进展报告
项目名称
申办者/CRO
合同号
伦理批件号
科室
主要研究者
联系人/联系电话
PI/电话:CRA/电话:
本中心伦理批准日期
试验启动日期
首例知情日期
方案版本号(包含更 新,依次列出)
方案版本日期
知情同意书版本号(包 含更新,依次列出)
ICF版本日期
既往进展报告递交伦理审查委员会时间 (逐一列出,自行增减行数)
遗传资源合作
(请务必按照人遗 办批件所涉类目真 实填写,请根据需 要自行增加表格行 数)
是否涉及遗传资源国际合作(临床试验启动至今) 口是口否(如否,以下表格不填)
遗传资源名称
单位/规格
计 划 数 量
( 仅 本 中 心)
已采集数量
目前状态ห้องสมุดไป่ตู้
本中心:
口存于本院
口已送至中心实验室 口其他(请说明,如:在 本院检测后已销毁)
本中心:
口存于本院
口已送至中心实验室
口其他(请说明)
本中心:
口存于本院
口已送至中心实验室
口其他(请说明)
主要研究者签名:日期:
申办者代表签名:日期:
药物/医疗器械临床试验机构意见:
□同意继续进行试验
□暂停试验
□终止试验
□其他:(请说明)
签字:日期:
临床试验伦理审查委员会意见:
□同意继续进行试验
□暂停试验
第1次:
年月日
第2次:
年月日
第3次:
年月日
本次是否按时上报:口是□否(请附晚递交原因说明)
持续审查频率:口3个月口6个月口1年□不适用
临床方案偏离报告模板

临床方案偏离报告模板
背景
在医疗实践中,临床方案是指根据患者的病情和医学知识,制定出一个治疗方案。
然而,在实际实施过程中,由于患者身体状况、药物副作用等因素的影响,医生可能需要对原定的方案进行调整和修改,这就产生了临床方案的偏离。
为了掌握医生在实践中使用的临床方案偏离情况,医疗机构需要进行记录和统计。
因此,研发临床方案偏离报告模板就显得尤为必要。
报告内容
患者信息
•患者姓名
•年龄
•性别
•身高
•体重
•病情简述
原始方案描述
•原始方案内容
•方案制定时间
偏离情况描述
•偏离原因
•调整内容
•调整时间
治疗效果评估
•治疗效果
•对偏离方案的影响
•进一步治疗计划
使用方法
医生在进行方案调整时,需按照临床方案偏离报告模板进行填写,并提交给医
疗机构的管理人员。
医疗机构会根据报告内容进行临床方案偏离情况的统计和分析。
注意事项
临床方案偏离报告模板需按照医疗机构的要求进行编写,确保信息的全面、准
确和规范。
医生在填写时需尽可能详细地描述偏离情况,并注明对方案调整的建议或意见,以便医疗机构根据报告内容进行治疗效果的评估和治疗计划的进一步制定。
结论
临床方案偏离报告模板的制定,可以有效地记录和统计医生在临床实践中的临
床方案偏离情况,为医疗机构的风险管理和治疗效果评估提供有力支持。
然而,在使用报告模板时,医生需确保填写的内容准确全面、规范统一,以确保报告的质量和有效性。
临床试验年度进展报告
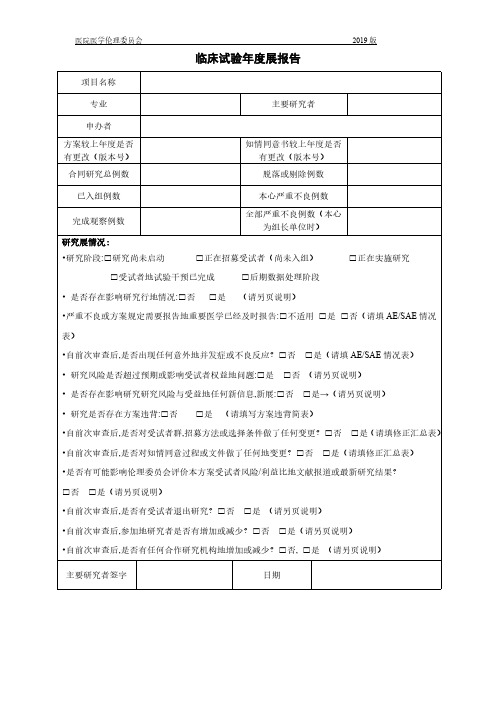
医院医学伦理委员会2019版
临床试验年度展报告
项目名称
专业主要研究者
申办者
方案较上年度是否有更改(版本号)知情同意书较上年度是否有更改(版本号)
合同研究总例数脱落或剔除例数已入组例数本心严重不良例数
完成观察例数全部严重不良例数(本心为组长单位时)
研究展情况:
•研究阶段:□研究尚未启动□正在招募受试者(尚未入组)□正在实施研究□受试者地试验干预已完成□后期数据处理阶段
• 是否存在影响研究行地情况:□否□是(请另页说明)
•严重不良或方案规定需要报告地重要医学已经及时报告:□不适用□是□否(请填AE/SAE情况表)
•自前次审查后,是否出现任何意外地并发症或不良反应?□否□是(请填AE/SAE情况表)
• 研究风险是否超过预期或影响受试者权益地问题:□是□否(请另页说明)
• 是否存在影响研究研究风险与受益地任何新信息,新展:□否□是→(请另页说明)
• 研究是否存在方案违背:□否□是(请填写方案违背简表)
•自前次审查后,是否对受试者群,招募方法或选择条件做了任何变更?□否□是(请填修正汇总表)•自前次审查后,是否对知情同意过程或文件做了任何地变更?□否□是(请填修正汇总表)
•是否有可能影响伦理委员会评价本方案受试者风险/利益比地文献报道或最新研究结果?
□否□是(请另页说明)
•自前次审查后,是否有受试者退出研究?□否□是(请另页说明)
•自前次审查后,参加地研究者是否有增加或减少?□否□是(请另页说明)
•自前次审查后,是否有任何合作研究机构地增加或减少?□否, □是(请另页说明)
主要研究者签字日期。
临床试验项目总结报告分中心小结表盖章申请表

临床试验项目名称
申办方/CRO
经办人/TEL:
专业科室
主要研究者
主要研究者意见:
报告中筛选、入组、脱落、剔除及完成例数等数据是否与实际发生一致?□是□否
报告中SAE、方案偏离/违背情况是否与实际发生一致?□是□否
其他需要说明情况:_____________________________________________________________
试验项目归档资料是否完整、规范?□是□否
责任人(签字)
年月日
机构办公室主任(签字)
年月日
盖章人(签字)
年月日
申请人上交申请表及总结报告后7个工作日联系机构办公室取回,联系人孟老师275572xx
责任人(签字)
年月日
伦理委员会意见:
中期报告、年度报告及总结报告是否上报伦理委员会且完整?□是□否
报告中SAE、方案偏离/违背情况是否与上报伦理委员会情况一致?□是□否
跟踪审查问题说明(如适用):_____________________________________________________
责任人(签字)
年月日
机构质控组意见:
知情同意书、研究病历及CRF是否记录完整,且数据可溯?□是□否
试验筛选、入组等是否执行试验方案?□是□否
质控发现问题是否及时解决并反馈?□是□否
责任人(签字)
年月日
机构财务管理员意见:ຫໍສະໝຸດ 试验经费到账情况是否与试验协议一致?□是□否
责任人(签字)
年月日
机构资料管理员意见:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
违背方案报告表AF/SQ-06/03.0
违背方案报告表
一、违背方案的情况
●重大违背方案:
♢纳入不符合纳入标准的受试者:□是□否
♢研究过程中,符合提前中止研究标准而没有让受试者退出:□是□否
♢给予受试者错误的治疗或不正确的剂量:□是□否
♢给予受试者方案禁用的合并用药:□是□否
♢任何偏离研究特定的程序或评估,从而对受试者的权益、安全和健康,或对研究结果产生显著影响的研究行为:□是□否
●持续违背方案(不属于上述重大违背方案,但反复多次地违背方案):□是□否
●研究者不配合监察/稽查:□是□否
●对违规事件不予以纠正:□是□否
二、违背方案的影响
●是否影响受试者的安全:□是□否
●是否影响受试者的权益:□是□否
●是否对研究结果产生显著影响:□是□否。
