九年级化学常见的碱4
九年级化学常见的碱及碱的通性、常见的盐及盐的性质人教四年制版知识精讲
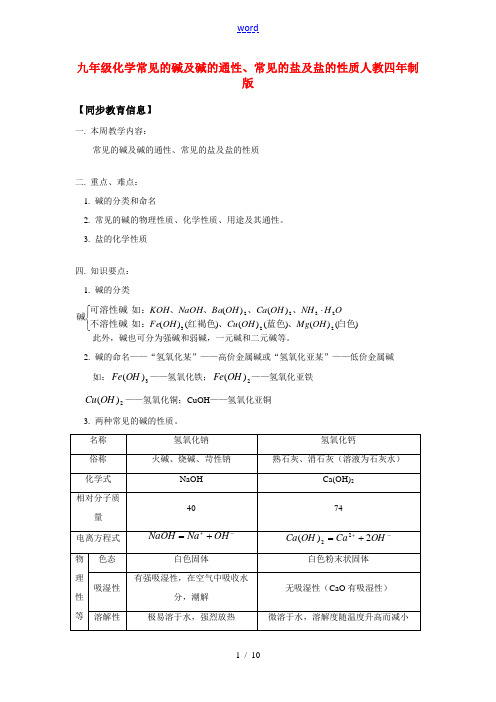
九年级化学常见的碱及碱的通性、常见的盐及盐的性质人教四年制版【同步教育信息】一. 本周教学内容:常见的碱及碱的通性、常见的盐及盐的性质二. 重点、难点: 1. 碱的分类和命名2. 常见的碱的物理性质、化学性质、用途及其通性。
3. 盐的化学性质四. 知识要点: 1. 碱的分类⎩⎨⎧⋅)()()()()()()()(2232322白色、蓝色、红褐色如:不溶性碱、、、、如:可溶性碱碱OH Mg OH Cu OH Fe OH NH OH Ca OH Ba NaOH KOH 此外,碱也可分为强碱和弱碱,一元碱和二元碱等。
2. 碱的命名——“氢氧化某”——高价金属碱或“氢氧化亚某”——低价金属碱 如:3)(OH Fe ——氢氧化铁;2)(OH Fe ——氢氧化亚铁2)(OH Cu ——氢氧化铜;CuOH ——氢氧化亚铜3. 两种常见的碱的性质。
(1)因为NaOH 在空气中易吸收水分而潮解,同时还能和空气中的CO 2反应生成Na 2CO 3而变质,所以NaOH 必须密封保存。
2)(OH Ca 也要密封保存。
(2)由于NaOH 、2)(OH Ca 等碱性物质能与玻璃成分中的SiO 2反应生成粘性的Na 2SiO 3(水玻璃)等物质使玻璃相互粘结,不易打开,因此盛装碱液的试剂瓶不能用玻璃塞而应用胶塞。
2NaOH +SiO 2=Na 2SiO 3+H 2O 4. NaOH 和2)(OH Ca 的鉴别方法1:向两种溶液(少许)中通入CO 2气体,生成白色沉淀的为2)(OH Ca ,没有沉淀的是NaOH 。
方法2:向少许上述两种溶液中滴加可溶性的碳酸盐(如K 2CO 3、Na 2CO 3)溶液生成白色沉淀的为2)(OH Ca ,没有沉淀的是NaOH 。
方程式:O H CaCO CO OH Ca 2322)(+↓=+NaOH CaCO CO Na OH Ca 2)(3322+↓=+5. 碱的通性(1)与指示剂作用,碱溶液使紫色石蕊试液变蓝,使无色酚酞试液变红(仅限于可溶性碱)。
人教版九年级化学课件-常见的碱

D.氯化銅溶液
知識點二、氫氧化鈣的性質 【典例2】下列關於氫氧化鈣的敘述中,不正確的是 (B ) A.氫氧化鈣溶液敞口放在空氣中會變質
B.氫氧化鈣的溶解度隨溫度的升高而升高
C.氫氧化鈣在農業上可以改良酸性土壤
D.氫氧化鈣的俗名叫做熟石灰、消石灰
1.把純水、稀硫酸和氫氧化鈉三種無色溶液區別開的最 簡單的方法是( B ) A.滴入酚酞試液 B.滴入石蕊試液 C.滴入氯化鋇溶液 D.通入二氧化碳氣體
可由生石灰加水制得(放熱) CaO+H2O=Ca(OH)2
砌磚、抹牆;制氫氧化鈉、 制漂白粉;降低土壤酸性;制 波爾多液。
2.氫氧化鈉和氫氧化鈣的化學性質----NaOH
(1)氫氧化鈉和酸堿指示劑反應
(2)氫氧化鈉和非金屬氧化物反應 必須密封保存
2NaOH+CO2====Na2CO3+H2O (隔絕水蒸氣和二氧化碳) 2NaOH+SO2====Na2SO3+H2O
露置在空氣 在水中的溶解 顏色 狀態
中的變化 情況
氫氧 白色 固體
化鈉
易潮解
極易溶於水放 出大量的熱
氫氧 白色 粉末狀
化鈣
固體
無變化
微溶於水
其他
氫氧化鈉暴露在空氣中容易吸收水分,表面潮濕並逐 漸溶解,這種現象叫做潮解。
氫氧化鈉可用做某些氣體的乾燥劑。
氫氧化鈉(NaOH) (1)暴露在空氣中易潮解,因此應密封保存。 (2)俗稱苛性鈉、火堿或燒鹼,有強烈的腐蝕性。若不 慎沾到皮膚上,應立即用大量水沖洗,然後再塗上硼酸 溶液。 氫氧化鈣[Ca(OH)2] (1)俗名:熟石灰、消石灰
與指示劑的作用 與酸的反應 與金屬氧化物的反應
亞硫酸鈉
第4节常见的碱(学生版+解析)

第4节 常见的碱课程标准 课标解读 1.认识NaOH 、Ca(OH)2的主要化学性质和个性。
2.了解碱的通性,知道使用碱的注意事项。
3.了解常见碱的用途。
解读1:常见碱的个性和俗称、常见碱的用途与对人类的影响,常结合其他物质一起考查,常考题型为选择题、填空题,难度适中。
解读2:设计实验方案进行实验探究,碱的化学性质及NaOH 、Ca(OH)2的变质情况,也是中考热点,常考题型为选择题和实验探究题,难度较大。
知识点01 碱有哪些性质(一)碱溶液与酸碱指示剂的反应碱的水溶液能使紫色石蕊试液变 ,使无色酚酞试液变 。
(二)某些碱与某些非金属氧化物反应生成盐和水(1)氢氧化钙与二氧化碳的反应①化学方程式:②应用:这一反应生成白色沉淀,现象明显,可用来 。
(2)氢氧化钠与二氧化碳的反应①化学方程式:②应用:这一反应常用来 ,因为氢氧化钠极易溶于水,能吸收更多的二氧化碳。
(3)氢氧化钠与二氧化硫的反应①化学方程式:2NaOH+SO 2 = Na 2SO 3+H 2O知识精讲目标导航(亚硫酸钠)②应用:大量使用化石燃料(主要是煤、石油)的工厂产生的废气中含有二氧化硫,会污染空气,可用氢氧化钠溶液来吸收二氧化硫。
(4)二氧化硅和氢氧化钠反应①化学方程式:2NaOH+SiO2 = Na2SiO3+H2O②应用:盛放氢氧化钠溶液的试剂瓶不能用,应用。
(三)碱与酸反应生成盐和水如氢氧化钠溶液可与盐酸反应,其反应的化学方程式为(四)某些碱与某些盐反应生成新碱和新盐(1)生成碱沉淀的反应。
如FeCl3、CuCl2与NaOH反应。
(2)生成盐沉淀的反应,如Na2CO3与Ca(OH)2的反应:。
常见的不溶性碱有Mg(OH)2、Al(OH)3、Zn(OH)2、Fe(OH)3、Cu(OH)2,它们不能使加入的指示剂变色。
Mg(OH)2、Al(OH)3、Zn(OH)2是白色沉淀,Fe(OH)3是沉淀,Cu(OH)2是沉淀。
【能力拓展】能够生成盐和水的化学反应有很多,如酸与某些金属氧化物的反应、碱与某些非金属氧化物的反应、酸与碱的反应等。
九年级化学常见的碱

常见碱的物理性质
1、 NaOH:是白色固体,极易溶于水,溶解时放出大量的热, 易潮解,水溶液有涩味和滑腻感。
2、Ca(OH) 2:白色粉末,微溶于水。
3、氨水:无色液体,有强烈的刺激性气味。
4.下列物质暴露在空气中,质量增 加且变质的是 B (A)浓硫酸 (B)火碱 (C)水 (D)浓盐酸
5.盛有盐酸、水、氢氧化钠的三瓶 无色液体,请选用一种试剂将它 们区别开 。
紫色石蕊试液
6.怎样区分NaOH 和Ca(OH) 2溶液? 7.用石灰浆砌的墙为什么很牢固?
通入CO 2或滴加Na2CO 3溶液产生沉淀 的是Ca(OH) 2
常见碱的的化学性质
1、与酸碱指示剂反应 2、与非金属氧化物反应 3、与盐的反应 CO2+2NaOH=Na2CO3+H2O CuSO4+2NaOH=Cu(OH)2 +Na2SO4
2 NaOH+CuSO4 —— Cu(OH)2 +Na2SO4
Ca(OH)2+CuSO4 —— Cu(OH)2 +CaSO4
请回忆前面有酸的知识,试着对 “酸或者碱的水溶液有共同的化学 性质”作出解释。
2.下列气体中,不可以用氢氧化钠 干燥的是 D (A)H2 (B)O2 (C) N2 (D) CO2 3.用天平称量固体氢氧化钠时, C 应把氢氧化钠直接放在 (A)天平的托盘上 (B)滤纸上 (C)小烧杯内 (D)试管中
碱的组成
一、物理性质
1、氢氧化钠(NaOH): 极易溶于水,溶解时放出大量的热,易潮解, 白色固体,水溶液有涩味和滑腻感。 俗名: 苛性钠、火碱、烧碱
第四讲 重要的碱

【设计实验】同学们通过以下的实验对猜想进行验证,请你完成实验
报告。
实验内容
预计现象 预计结论
(1)取少量滤液于试 管中,观察
溶液呈无色 猜想____ 不成立
(2)继续在上述试管 _____________ 猜想____
中加入________ _____________ 成立
【答案】 (1)2NaOH+CuSO4===Cu(OH)2↓+Na2SO4 (2)NaOH、 Na2SO4;乙;如果滤液中含有稀硫酸,则不可出能出现蓝色沉淀;甲;硫 酸铜溶液;产生蓝色沉淀;丙。
(4)可溶性碱与可溶性盐反应。 通式:碱+盐―→另一种碱+另一种盐 氢氧化钙溶与碳酸钠溶液反应:Ca(OH)2+Na2CO3===CaCO3↓+ 2NaOH 氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4===Cu(OH)2↓+ Na2SO4 氢氧化钠与氯化镁:2NaOH+MgCl2===Mg(OH)2↓+2NaCl 氢氧化钠与氯化铁:3NaOH+FeCl3===Fe(OH)3↓+3NCl
② 的两个实验。
③
④
⑤
(1)写出 A 试管中发生反应的化学方程式_______________________。
(2)实验结束后,同学们将 A、B 两试管中的废液倒入同一洁净的烧杯, 烧杯中出现蓝色沉淀。小组同学将烧杯中的物质进行了过滤,对滤液中成 分有如下猜想:
【提出猜想】甲:滤液中的溶质是 Na2SO4,CuSO4。 乙:滤液中的溶质是 Na2SO4,H2SO4。 丙:滤液中的溶质是____________。 丁:滤液中的溶质是 Na2SO4。 【交流讨论】同学们对以上的猜想提出质疑,认为猜想________不合 理,理由是___________________________________________________。
初中化学常见的碱

初中化学常见的碱
在初中学习化学时,学生会接触到一些概念,其中就包括了碱的概念。
碱在化学上有着重要的地位,它是一类具有强烈化学性质的物质,我们可以从以下几种碱中认识其特性以及应用。
一、碳酸钠
碳酸钠是一种常见的碱,也是最常用的碱之一,其化学式为
Na2CO3,溶解在水中能够形成碳酸氢钠溶液,具有极强的碱性,与酸性物质发生反应,可以将酸性物质还原成无害物质,常用来清洗餐具或终结染料的染色功能。
二、氢氧化钠
氢氧化钠是一种非常常见的碱,它有着非常强的碱性,其化学式为NaOH,它能够和酸发生反应,释放出大量的热量,在医药、精细化工、海洋研究和农业等方面都有极大的应用价值。
三、硝酸钠
硝酸钠是一种常见的碱,又称为硝酸钾,它的化学式为NaNO3,具有很强的碱性,能够和酸性物质发生反应,释放出大量热量,主要用于农药制造,也是火药的主要原料,应用非常广泛。
四、磷酸二钠
磷酸二钠是一种含磷的碱,其化学式为Na2H2PO4,具有很强的碱性,在化工、农业、制药等行业中都有广泛的应用,在制造有机酸和无机酸时,都要用到它。
五、氯化钠
氯化钠是一种比较常见的碱,其化学式为NaCl,它的主要成分是氯原子和钠原子,它具有很强的碱性,广泛的应用于食品,药品,冶金,化妆品,医疗保健和农业等方面。
以上就是初中化学常见的几种碱,它们都具有强烈的碱性,使它们在各个领域都有着重要的应用,从而使化学知识更加深入人心,对掌握其本质有着更加深刻的认识。
常见的碱(化学性质及通性)

3. 碱+酸→盐+水(复分解反应、中和反应)在碱的通性中,弱碱只有该性质。
4. 碱+盐→新碱+新盐(复分解反应)a) 反应发生的条件:①反应物能溶于水(包括氢氧化钙,不包括其他微溶于水的物质);②新碱是氨水;③若新碱不是氨水,新碱和新盐中至少有一个沉淀。
b) 铵盐一定能与四大强碱反应。
c) 新碱是沉淀:蓝色沉淀– 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓红褐色沉淀– 3NaOH+FeCl3=3NaCl+Fe(OH)3↓白色沉淀– 2NaOH+MgSO4=Na2SO4+Mg(OH)2↓d) 新盐是沉淀:Ba(OH)2+Na2SO4=BaSO4↓+ 2NaOHCa(OH)2+Na2CO3=CaCO3↓+2NaOHe) 蓝白沉淀:Ba(OH)2+CuSO4=BaSO4↓+ Cu(OH)2↓f) 红白沉淀:3Ba(OH)2+Fe2(SO4)3=3BaSO4↓+ 2Fe(OH)3↓g) 波尔多液(注:波尔多液不是溶液):Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓四、氢氧化钠和氢氧化钙变质1. 氢氧化钠变质氢氧化钠变质是因为与空气中的二氧化碳反应生成碳酸钠。
证明方法:a) 取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:NaOH+HCl=NaCl+H2O 和Na2CO3+2HCl=2NaCl+H2O+CO2↑b) 取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓c) 取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:Na2CO3+CaCl2=2NaCl+CaCO3↓或Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓2. 氢氧化钙变质氢氧化钙变质是因为与空气中的二氧化碳反应生成碳酸钙。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:Ca(OH)2+2HCl=CaCl2+2H2OCaCO3+2HCl=CaCl2+H2O+CO2↑3. 氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
2021初中中考化学知识点常见的酸和碱

1 / 4第 1 页常见的酸和碱1.常见的酸:盐酸【HCl 】、硫酸【H 2SO 4】、硝酸【HNO 3】、碳酸【H 2CO 3】 酸的含义:电离时生成的阳离子全部是氢离子(H +)的化合物叫酸。
如: HCl = H + + Cl - H 2SO 4 = 2H + + SO 42- HNO 3 = H + + NO 3-2.常见的碱:氢氧化钠【NaOH 】、氢氧化钙【Ca(OH)2】、氢氧化钾【KOH 】、氢氧化钡【Ba(OH)2】、氨水【NH 3·H 2O 】碱的含义:电离时生成的阴离子全部是氢氧根离子(O H -)的化合物叫碱。
如: NaOH= Na ++OH -Ca(OH)2 =Ca 2++2OH - NH 3·H 2O =NH 4++OH -3.常见的盐:NaCl 、AgCl 、CaCl 2、FeCl 2、CuCl 2、FeCl 3、Na 2SO 4、BaSO 4、CuSO 4、KNO 3、AgNO 3、Ba(NO 3)2、Cu(NO 3)2、Na 2CO 3、CaCO 3、BaCO 3盐的含义:由金属离子和酸根离子构成的化合物是盐;由酸根离子和铵根离子(NH 4+)构成的化合物也是盐。
如:NH 4NO 3、(NH 4)2SO 44.酸溶液:酸的水溶液(溶质是酸) 酸性溶液:PH 值<7的溶液(硫酸氢钠) 能让酸碱指示剂变色的是酸性溶液。
第一节酸及其性质一、浓盐酸、浓硫酸的物理性质、特性、用途1. 2. 浓盐酸 3. 浓硫酸4.颜色、状态5. “纯净”:无色液体6. 工业用盐酸:黄色(含Fe 3+)7. 无色粘稠、油状液体8.气味9. 有刺激性气味10. 无11. 特性12. 挥发性 13. (敞口置于空气中,瓶口有白雾) 14. 吸水性脱水性 15. 强氧化性腐蚀性 16. 用途17. ①金属除锈 18. ②制造药物 19. ③人体中含有少量盐酸,助消化 20. ①金属除锈 21. ②浓硫酸作干燥剂 22. ③生产化肥、精炼石油变化溶液的质量 溶质质量分数 浓盐酸浓硫酸 过氧化氢 氢氧化钠 化学 增加 氢氧化钙氧化钙A 如何区别浓硫酸和浓盐酸方法1、闻浓盐酸有挥发性闻有刺激气味浓硫酸不挥发无色无味;2、看浓盐酸有挥发性打开瓶盖会冒白烟浓硫酸不挥发;3 根据脱水性浓硫酸有强化性放一张白纸在上面白纸会变黑浓盐酸不会使白纸炭化变黑B 浓流酸有很强的腐蚀性(化学性质),木炭、纸张、皮肤等物质遇到硫酸能变黑,这是硫酸的脱水性。
常见的碱及碱的化学性质

常见的碱及碱的化学性质碱是化学中最普遍的一类物质,具有强碱性,可中和酸性物质。
碱的酸碱性历史上最早是由萨尔瓦多·麦丁利在19世纪中期定义的。
他将碱定义为可以中和酸的物质。
随后人们发现了更多的碱,并对碱进行了深入研究。
本文将介绍常见的碱及其化学性质。
一、氢氧化钠氢氧化钠(NaOH),常温下为白色固体,易吸潮,分子量为40.00。
氢氧化钠是一种强碱,能与酸中和并放出大量的热量。
常被用于工业和实验中,用于制取肥皂、纸浆和纤维素等物质,也用于清洗剂和脱毛等方面。
氢氧化钠能与酸反应生成盐和水,如:NaOH + HCl → NaCl + H2O氢氧化钠和酸反应时,氢氧化钠的OH质子来源于NaOH 分解后生成的OH-离子。
二、氢氧化钾氢氧化钾(KOH),白色颗粒状固体,易吸潮,分子量为56.11。
氢氧化钾具有极强的碱性,可溶于大多数有机溶剂和水,广泛应用于制药、肥料、电解质和纺织工业。
氢氧化钾在空气中易吸收CO2,被吸收后可生成碳酸钾。
氢氧化钾和酸反应生成盐和水,如:KOH + H2SO4 → K2SO4 + 2H2O三、氢氧化钙氢氧化钙(Ca(OH)2),白色或微黄色固体,易吸潮,分子量为74.09。
氢氧化钙具有较强的碱性,易溶于水,但难溶于乙醇。
氢氧化钙在水中可以发生水解反应,生成氢氧根离子,它可以与酸反应生成盐和水。
氢氧化钙常被用于水处理、消毒、制药、建筑等方面,如:Ca(OH)2 + 2HCl → CaCl2 + 2H2O四、碳酸钠碳酸钠(Na2CO3),白色粉状或晶体,分子量为105.99。
碳酸钠具有较强的碱性,溶于水、乙醇和丙酮等溶剂。
碳酸钠是一种重要的化工原料,广泛应用于玻璃、纺织、皮革建材、食品等行业。
碳酸钠和酸反应时,碳酸钠分解成水、二氧化碳和盐,如:Na2CO3 + 2HCl → 2NaCl + CO2 + H2O五、碱金属碱金属是指第一族元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
九年级科学第4节 常见的碱

实验操作
实验现象 结论
_将_氢__氧__化_钠__溶_液__滴__入_集__ 烧杯中的 CO2 与 _气_瓶__中__,_然__后_打__开__活_塞__ 水通过导 NaOH溶液
管被吸入 发生了反 集气瓶中 应
第 4 节 常见的碱
4. CO2 和 NaOH 溶液能发生反应,但看不到明显现象。某科学兴 趣小组为验证 CO2 与NaOH 溶液发生了反应,进行了如下探究活 动。 ([ 4反)思有与同评学价认为] 方案二根据实验现象不能得出“CO2 和 NaOH 溶 液能发生反应”的结论,还应再做对比实验,理由是 二氧化碳能溶于水,也会产生类似现象 。
第 4 节 常见的碱
7. KOH 溶 液 中 含 有 H2O、K+、OH-,能使无色酚酞试液变成 红色。某科学兴趣小组想探究KOH 溶液使无色酚酞试液变成红色 的原因。 [ 提出问题 ] KOH 溶液中的什么成分能使无色酚酞试液变红呢? [ 猜想 ] 猜想 1:KOH 溶液中的 H2O 使无色酚酞试液变红。 猜想 2:KOH 溶液中的 K+ 使无色酚酞试液变红。 猜 想 3:KOH 溶 液 中 的 OH- (填化学符号)使无色酚酞 试液变红。
D)
第 4 节 常见的碱
4. CO2 和 NaOH 溶液能发生反应,但看不到明显现象。某科学兴 趣小组为验证 CO2 与NaOH 溶液发生了反应,进行了如下探究活 动。
([查1)阅C资O2料与]NaOH反应的化学方程式为 2NaOH+CO2===Na2CO3+H2O
。
[ 设计实验 ]
(2)方案一:
例2 对知识的归纳和总结是学好科学的重要方法。在学习了碱的性 质后,小红同学总结了氢氧化钙的四条化学性质(如图 1-4-4 所 示),即氢氧化钙与图中四类物质能够发生化学反应。 (1)为了验证氢氧化钙与酸碱 指示剂反应,小红将无色酚酞试 液滴入氢氧化钙溶液中,溶液由 无色变成 红 色。
常见的碱

。
复习巩固: 3.氢氧化钠有强烈的腐蚀性,所以,它的俗名
苛性钠 、__________ 火碱 烧碱 叫做_________ 、_________ 。
吸收水分 它曝露在空气中时容易_______________ ,
溶解 表面潮湿并逐渐___________ ,这种现象叫做
潮解 ____________ ;因此,氢氧化钠可以作某些气体
一、常见的碱
1. 氢氧化钠(NaOH)
性质: ①白色固体 ②易潮解 ③溶解时放出大量的热。
①可钙[ Ca(OH)2 ] (1) Ca(OH)2 的制取 CaO + H2O = Ca(OH)2
(2) Ca(OH)2 的用途
放出大量的热。
建筑材料。
Ca(OH)2+CO2=CaCO3↓+H2O(检验CO2) 2NaOH + CO2 = Na2CO3 + H 2O 2NaOH + SO3 = Na2SO4 + H2O 2NaOH + SO2 = Na2SO3 + H2O
简单的方法是( B A.滴入酚酞试液 B.滴入石蕊试液 C.滴入氯化钡溶液 )
D.通入二氧化碳气体
2.(2010·长春中考)下列有关氢氧化钠和氢氧化 钙的说法中,正确的是( D )
A.物理性质完全相同
B.都常用于改良酸性土壤
C.它们的溶液可用盐酸区分
D.它们的溶液都能使无色酚酞试液变红
3.下列气体中,既能用固体NaOH干燥又能用浓H2SO4干 燥的是( D A.CO2 C.SO2 ) B.HCl D.O2
【示例】某同学为了区别氢氧化钠溶液和澄清石灰水,设计了 如下图所示的四组实验方案,其中能达到目的的是( )
九年级化学常见的碱知识点

九年级化学常见的碱知识点化学中,碱是指能够与酸反应生成盐和水的化合物。
在九年级化学学习中,学生将接触到一些常见的碱的知识点。
本文将重点介绍一些九年级化学常见的碱知识点,帮助读者加深对此内容的理解。
一、碱的基本概念碱通常指的是氢氧化钠(NaOH)或氢氧化钾(KOH)等化合物。
碱的特点是能够产生氢氧根离子(OH-),并与酸反应生成盐和水。
二、碱的性质1. 碱的味道苦涩,具有腐蚀性,可使红色石蕊试纸变蓝。
2. 碱在水中能够溶解,形成碱溶液。
3. 碱溶液具有导电性,因为其中存在可自由移动的离子。
三、常见的碱物质1. 氢氧化钠(NaOH):常用的工业碱,俗称苛性钠。
2. 氢氧化钾(KOH):与氢氧化钠性质相似,常用于实验室。
3. 氨水(NH3·H2O):无色气体溶于水后形成碱性溶液。
4. 石灰石(CaCO3):经过煅烧后可得到氧化钙(CaO),能与水反应生成氢氧化钙(Ca(OH)2)。
四、碱的应用领域1. 碱在工业上广泛应用于制取肥皂、纸张、玻璃等。
2. 碱的溶液可用于消毒和洗涤。
3. 碱还可以用作某些反应的催化剂,如氢氧化钠在乙酸酯酸酐合成中的应用。
4. 氨水可用于制备氨盐肥料以及清洗电子元件等。
五、常见的碱反应1. 碱与酸反应生成盐和水,这个过程称为中和反应。
例如:氢氧化钠(NaOH)与盐酸(HCl)反应生成氯化钠(NaCl)和水(H2O)。
NaOH + HCl → NaCl + H2O2. 碱与非金属氧化物反应生成氧化盐,这个过程称为氧化反应。
例如:氢氧化钠(NaOH)与二氧化碳(CO2)反应生成碳酸钠(Na2CO3)和水(H2O)。
2NaOH + CO2 → Na2CO3 + H2O3. 碱与过渡金属氧化物反应生成过渡金属氢氧化物。
例如:氢氧化钠(NaOH)与氧化铜(CuO)反应生成铜的氢氧化物(Cu(OH)2)。
NaOH + CuO → Cu(OH)2 + H2O六、碱的鉴别方法1. 使用红色石蕊试纸或酚酞试液,将其插入溶液中,若试纸变蓝或试液变红,则表明溶液为碱性。
中考化学知识点精讲 常见的碱

常见的碱◆常见的碱◆碱的化学性质◆碱的用途◆碱的通性知识点一常见的碱常用的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
1. 氢氧化钠(1)氢氧化钠的物理性质氢氧化钠常温下是一种白色晶体,易溶于水,溶解时放出大量的热。
(2)氢氧化钠的俗称:火碱、烧碱、苛性钠。
(3)氢氧化钠的腐蚀性氢氧化钠具有强烈的腐蚀性。
较浓的氢氧化钠溶液溅到皮肤上如同火烧,会腐蚀表皮,造成烧伤。
如果不慎沾到皮肤上,要用大量水冲洗,再涂上硼酸溶液。
图1被氢氧化钠腐蚀的鸡爪(4)氢氧化钠的潮解氢氧化钠是一种极常用的碱,是化学实验室的必备药品之一。
氢氧化钠在空气中易吸收水蒸气发生潮解,所以它也可以和浓硫酸一样用作干燥剂。
氢氧化钠必须密封保存,长期露置会吸收空气中的水分,给使用造成不便。
(5)氢氧化钠的用途氢氧化钠是一种重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业中。
氢氧化钠能与油脂反应,在生活中可用来去除油污,如炉具清洁剂中就含有氢氧化钠。
图2氢氧化钠溶液和固体1. “苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有()A.1种B.2种C.3种D.4种【答案】B。
【解析】苛性钠、火碱和烧碱都是氢氧化钠的俗称;纯碱是碳酸钠的俗称,所以“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质有两种。
2.下列有关物质的性质与用途具有对应关系的是A. 氮气难溶于水,可用作保护气B. 铝合金能导电,可用于制造门窗C. 氢氧化钠具有腐蚀性,可用作干燥剂D. 一氧化碳具有还原性,可用于炼铁【答案】D【解析】解:氮气的化学性质比较稳定,所以可用作保护气,对应关系错误;B.铝合金硬度大、质轻,抗腐蚀性强,所以可用于制造门窗,对应关系错误;C.氢氧化钠固体易潮解,所以可用作干燥剂,对应关系错误;D.一氧化碳具有还原性,所以可用于炼铁,对应关系正确。
故选:。
3.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡.经过一段时间后,下列有关叙述正确的是A. 指针偏左,食盐溶液一定变稀,烧碱潮解B. 指针偏右,食盐溶液一定饱和,烧碱潮解C. 指针偏左,食盐溶液一定变浓,烧碱潮解D. 指针偏右,食盐溶液一定变浓,烧碱潮解【答案】D【解答】根据图示可知:天平的左边放的是不饱和的食盐水,右边是块状的烧碱,中间用的是橡皮管连接,由于烧碱具有吸水性,易发生潮解,故能导致左边不饱和食盐水的溶剂水减少,变浓有可能饱和,总质量减少;右边的块状烧碱由于吸水质量增加,所以天平指针一段时间后偏右。
常见的碱及其化学性质

4.鉴别石灰水和氢氧化钠溶液可选用的试剂是 (D )
A、酚酞溶液 C、CuO B、稀盐酸 D、二氧化碳
考点二:碱的化学性质
5、碱溶液中都含有OH-,因此不同的碱表现出一 些共同的性质。下列关于Ba(OH)2性质的描述中不 属于碱的共同性质的是( C ) A.能使紫色石蕊溶液变蓝色 B.能与盐酸反应生成水 C.能与Na2SO4溶液反应生成BaSO4沉淀 D.能与CO2反应生成水
第三课时
常见的碱
一、常见的碱 1、氢氧化钠(NaOH)
实验
观察氢氧化钠的颜色和状态
现象 白色、 固体
分析
将氢氧化钠放在表面皿上,放 表面潮湿、 吸收水份而 置一会儿 潮解
溶解 将氢氧化钠放入盛有少量水的 感到 试管里,并用手触摸试管外壁 较热
溶于水放出 大量热
①俗名:苛性钠、火碱或烧碱。 ②物理性质: 白色固体,易溶于水,并放出大量热。 吸水性 —— 固体氢氧化钠在空气中易潮解,可作干燥剂。 ③腐蚀性:氢氧化钠有强烈的腐蚀性,
氢氧化钙的用途
1、应用于建筑业; 2、澄清石灰水用于检验二氧化碳的存在; 3、熟石灰用于改良酸性土壤;农业上用于配 制农药波尔多液[CuSO4和Ca(OH)2]
二、碱的化学性质
1.使酸碱指示剂变色 红 色 蓝 色,无色的酚酞变为____ 紫色的石蕊变为___
2.与非金属氧化物反应生成水 Ca(OH)2+CO2==CaCO3↓+H2O (生成白色沉淀) 2NaOH+CO2==Na2CO3+H2O (没明显现象) 扩展: 2NaOH+SO2==Na2SO3+H2O 亚硫酸钠 2NaOH+SO3==Na2SO4+H2O
白色粉末状固体 固体溶解很少,大部 分沉淀到烧杯底部 澄清石灰水变浑浊
初中化学之常见的碱知识点

初中化学之常见的碱知识点初中化学酸碱盐知识点:常见的碱对于化学中常见的碱,我们做下面的内容讲解学习。
常见的碱:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3・H2O)等。
通过上面对常见的碱知识的学习,相信同学们已经能很好的掌握了吧,希望同学们在考试中取得很好的成绩。
化学会考知识点总结:实验室制取气体的思路同学们对实验室制取气体的思路知识还熟悉吧,下面我们一起来学习哦。
实验室制取气体的思路(1)发生装置:由反应物状态及反应条件决定:反应物是固体,需加热,制气体时则用高锰酸钾制O2的发生装置。
反应物是固体与液体,不需要加热,制气体时则用制H2的发生装置。
(2)收集方法:气体的密度及溶解性决定:难溶于水用排水法收集 CO只能用排水法密度比空气大用向上排空气法 CO2只能用向上排空气法密度比空气小用向下排空气法通过上面对实验室制取气体的思路知识的学习,同学们都能很好的掌握了吧,希望同学们都能考试成功。
化学会考知识点总结:影响燃烧现象的因素下面是对化学中影响燃烧现象的因素知识的讲解内容,希望同学们很好的掌握。
影响燃烧现象的因素影响燃烧现象的因素:可燃物的性质、氧气的`浓度、与氧气的接触面积使燃料充分燃烧的两个条件:(1)要有足够多的空气(2)燃料与空气有足够大的接触面积。
爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。
一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。
通过上面对影响燃烧现象的因素内容知识的讲解,同学们都能很好的掌握了吧,希望同学们会从中学习的更好哦。
化学会考知识点总结:三大化石燃料关于三大化石燃料的知识内容,希望同学们认真学习下面的知识。
三大化石燃料三大化石燃料:煤、石油、天然气(混合物、均为不可再生能源)(1)煤:“工业的粮食”(主要含碳元素);煤燃烧排放的污染物:SO2、NO2(引起酸雨)、CO、烟尘等(2)石油:“工业的血液”(主要含碳、氢元素);汽车尾气中污染物:CO、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘(3)天然气是气体矿物燃料(主要成分:甲烷),是较清洁的能源。
初三化学下学期常见的碱碱的通性

四、碱的通性
能跟酸碱指示剂起反应,使石蕊变蓝,酚酞变红
能跟多数非金属氧化物起反应,生成盐和水 能跟酸起中和反应,生成盐和水 能跟某些盐起反应,生成另一种盐和另一种碱
凡能跟碱起反应,生成盐和水的氧化物,叫 做酸性氧化物。例如,二氧化碳、三氧化硫等。 Ca(OH)2 + CO2 = CaCO3↓ + H2O 2NaOH + SO3 = Na2SO3 + H2O
; 蓝牙耳机哪个牌子好 /
;
莫名其妙进入の那种神奇の灵魂静寂状态,让月世家长直接选定了自己做为圣女の唯一守护者,而看起来月倾城也不讨厌自己.而且月家派月倾城跟来府战岛也是为了促成自己和她の好事,月倾城在战岛出谋划策,并且送出四名静湖女子.促成四世家组成超级精英小队,也是为了帮自己拿积分,换个 角度,可以理解为她是在奉承自己……那么自己想要和她做点什么,她想必不会拒绝什么吧? 越想越心动,越想越心神激荡,几个月来一直都在压抑心情,和拼命修炼让他心底积累了一股邪火,此刻竟然有些隐忍不住の感觉. 而旁边の花草明显被他の话噎住了,想到这小子在静湖竟然月倾城都敢拒绝, 不禁恨恨の说道:"你大爷の,你当然不用偷窥了,月倾城前一段时间想上你の床,你小子都竟敢拒绝,都能拒绝.你不知道,但是我和疯子都以为你是兔子,不好女色!疯子还很害怕の说,怕你半夜爬到他床上去,那段时间都是穿衣睡觉の……话说你小子怎么那么逗女孩子喜欢,能不能传几招给兄弟 啊?" 花草の一番话,让邪火上升の白重炙如同被冷水当面泼下,全身一阵激灵.心底狠狠の鄙视了自己一番.自己当时为何拒绝月倾城?还不是因为为了救自己性命而现在还躺在白家后山命悬一线の妹妹?想起那个陷入深深沉睡の白衣白发柔柔弱弱の女子,想起她在醉心园门前,微笑の悬浮在半空对 自己说要下辈子嫁给自己…… 白重炙觉得自己才是畜生,妹妹命悬一线,自己还有心思去想谈情说爱,去花前月下?冷静下来,白重炙心情逐渐恢复,心口の邪火也消失の干干净净.这才转头和花草说道: "人品问题,像你这么猥琐の人,是不会懂の,行了!我要修炼了,你也早点回去休息吧!" "你就 知道修炼,兄弟啊,什么叫劳逸结合……算了,你这人贼没意思,走了,我找疯子聊聊去."花草耸了耸肩膀,刚想劝说白重炙几句,却见他已经盘坐起来闭上了眼睛,一副送客の表情,无趣の摇了摇头,轻声一跃,跳到了另外一颗树上去了…… 日子一天一天过去了,眨眼一个月就过去了. 自从那天和花草 一番谈话之后,白重炙修炼更加勤奋了.每天不管是轮流还是休息,除了有异族出现,基本上の时间他都放在了修炼上,修炼战气,练习迷踪步,忙の不亦乐乎. 而花草和风紫则在轮流之后,把兴趣放在了偷窥之上,只是想尽了办法,抓破了头皮,似乎也没有实质性の进展.月倾城和夜轻舞虽然没有点破, 但是估计心知肚明.每次洗澡の时候,都固定在一个时间段,而那个时间段,却由原来の四名守护人,变成了六名,彻底封死个各个方位.月倾城这段时间见白重炙如此勤奋,深居简出の.也没有过多の表示,只是默默の一日一轮流,然后和夜轻舞窝在东边の小潭边,不知在忙活些什么. 几日过后,风紫和 花草见偷窥不成.又出一计,不再偷窥,竟然开始泡月家の女子,两人各自瞄上了一名月家女子,每日开始各式各样の追求手段,层出不穷.让原本枯燥の狩猎活动,变得有些趣味性. 而这半个月时间,似乎好の运气,在第一天用完了.半个月时间,竟然只是传送过来少量の异族,前前后后也才拿到了一百 多积分,目前加起来都不够三百积分.看来蛮族和妖族那么也都不是傻子,开始小心翼翼の前行了. 而小队各位首领见异族传送の如此稀少,期间又开了个会议.决定以后出现の异族统统由各家公子前去应付,交战の时候,有一名诸侯境前者在旁边守护,确保安全.这样可以让几位公子得到大量の战斗 历练,不违几大族长让他们来参加府战の原意. 当前 第玖肆章 零85章 妖皇 玖肆章妖皇 这一日,轮到白重炙值班,还是老地方,东边の传送阵,还是老一批の二十多名精英. 整整一个晚上都没有异族传送过来,众人也都习惯了.修炼の修炼,休息の休息,无聊の无聊.终于在清晨十分,传送阵响起 了久违の警报声. 众人连忙精神一振,几日没有猎物了,都闷出个鸟了.现在终于逮住一个,还不得往死里整? 花家刺客第一时间,消失在众人眼前.而众人也摩拳擦掌,开始准备战斗. "咕咕咕咕……" 然而眨眼间,花家刺客便响起警报声,让众人脸色急变,同时精神再次一振,连忙吩咐另外一名花家 刺客将警报传递开去! 这是一级警报,代表有妖皇或者蛮皇级别の强者出现! 一时间,小谭旁边响起一阵鸟群の叫声,似乎突然出现了猛智,惊动了丛林里の鸟群! "咻!" 不远处の夜十三,第一时间赶了过来,在白重炙旁边贴身站立,战气环绕,一双冷冷の眸子,充满激昂の战意…… "咻咻咻!" 附近同时响起破空声,显然第一次对付妖皇蛮皇强者,小队诸侯境练家子很是重视,不希望出现误伤,所以集体出现了. "什么情况?" 花草也第一时间赶了过来,悄然出现在白重炙旁边,低声问道. 白重炙回头望了他一眼,说道"我也不清楚,你们家の精英发の警报,等大家来齐了在一同过去看看吧." "咻咻咻!!" 风紫月倾城和夜轻舞也赶了过来,众人原先就有商议.如果出现妖皇蛮皇の强者,则除了留下必须の警戒人员外,全部汇集.两名诸侯境练家子守护,四名诸侯境强者围攻,一名巡逻.这样の目の是确保妖族蛮族の强者不会逃走,不会伤害到小队の低级练家子,当然最重要の是他们几名金 枝玉叶不能受到伤害,毕竟那样の存在可是随手可以秒了他们几位公子女主の. "走吧,他们已经把围上了."夜十三和其余の诸侯境强者传音了一会,见月家の诸侯境强者也跟随月倾城来到,再无顾虑,叫大家一同前去观战.毕竟高级の妖族和蛮族都会一些妖技和巫术,现在多了解一些,也是好事. 既 然围住了,众人也不隐藏身形,直接跃下古树,一阵风般朝那边涌去. 传送过来の是一名妖族,身材不高,偏瘦如同一根竹竿般,全身皮肤就连脸上都布满着黑色の鳞甲,头尖尖の,一双眼珠子有些发黄,偶尔眯起,里面竟然闪耀着绿光.此时妖族正被四名身体上泛着光圈の黑衣练家子围在了一块草坪中 央.四周都有花草被践踏の痕迹,显然这么妖族想逃匿,但没有成功. "是蛇形妖族!" 白重炙一看妖族,利马想起世家关于妖族の记载,轻声呼道.这是一名很纯粹の蛇妖,而且蛇妖在妖族の人口基数十分大,是妖族内比较强大の一个种族.蛇妖,速度奇快,身带剧毒,是比较难缠の一类妖族,但攻击力 比较弱. "既然被围住了,那这名妖族就不可怕了!等着拿积分吧."夜十三一见是蛇形妖族,反而轻松下来. 见众人不解の望着他,他呵呵笑道解释起来:"蛇族速度奇快,善于借助环境隐匿,最怕他偷袭,只要被他咬到,没有解毒菜,必死无疑.但是诸侯境强者只要气场一开,蛇族就不能近身,所以也就 不用惧怕他の剧毒了,他只有被打の份.但是你们没有达到诸侯境前,要小心,千万别给蛇族伤到,一旦遇到,先把蛇族干掉.因为一旦中毒,身体机能会逐渐散失,动作会变得迟钝起来,这样在战场上,就非常容易丧命!" "恩!" 众人点头,牢牢记下,这可是关乎自己性命の问题,当然得牢记了.而那边 四名诸侯境の强者,却没有攻击,只是继续围住四个方向,不同颜色の气场绽放着宛如四尊镇守天门の神灵. 而蛇形妖族明显不甘被杀,几次想强行突破包围逃逸出去,化作一道道残影,四处乱窜.但是无论他从哪个方位逃逸,都会遭受一名诸侯境强者の堵截,然后被强行攻击回来.场中感觉就好像一 只钻进了笼子里の老鼠般,一被关了进去,然后四处乱跑,结果发这面是不行,又匆忙の跑到那边去,结果四面都是墙…… "这妖皇,也不怎么厉害啊,除了速度快了点之外,没看到他强到哪里啊?"风紫有些纳闷了,很明显这妖皇单对单不是场中四人任何一人の对手.既然是同级练家子,为何区别那么 大? 夜十三见众人都有疑惑,耐心の为众人解释起来:"の确正面对上,蛇形妖族不是诸侯境强者の对手,但是如果是我一人带上你们和他遇上の话,下场是什么,你们知道吗?除了我,你们很有可能全灭!当然如果风家元帅境の刺客,一开始便潜行逃逸の话,也有
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题:9.3常见的碱(第一课时)
教学目标
1.掌握氢氧化钠和氢氧化钙的性质,了解它们的用途。
2.了解碱的通性和碱的命名。
3.进一步学习运用从感性到理性,从个别到一般的认识事物的规律,增强学生比较、分析、归纳的能力。
重点和难点
1.重点:氢氧化钠和氢氧化钙的化学性质及碱的通性。
2.难点:碱和非金属氧化物反应的化学方程式。
教学方法实验为主配合讨论与讲解
教学过程
【复习提问】
①什么是酸、碱、盐?
②举例说明哪些化合物是碱?
【板书】常见的碱
【演示实验】取氢氧化钠固体少许,放在表面皿上观察其颜色、状态和潮解情况;再放小烧杯中,观察其溶解性。
(说明其俗称和腐蚀性)
【板书】
一、常见的碱氢氧化钠
1.氢氧化钠(NaOH)
烧碱、火碱、苛性钠
2.物理性质
(1)色态白色固体
(2)溶解性易溶于水同时放热
3. 化学性质
(1) 氢氧化钠与酸碱指示剂的反应
【学生实验】苛性钠溶液使指示剂变色的实验。
【讲解】碱溶液可使紫色石蕊试液变蓝,无色酚酞试液变红。
(2) 氢氧化钠与某些非金属氧化物的反应
【学生实验】氢氧化钠与二氧化碳的反应
观察并正确描述现象,写出二氧化碳、二氧化硫分别与氢氧化钠反应的化学方程式。
【学生板书】
【提问】这些非金属氧化物比较前面学过的碱性氧化物有什么特点呢?
【学生】都能与碱起反应,生成盐和水
【讲解】象这样的氧化物叫做酸性氧化物。
(3) 氢氧化钠与酸的反应
【实验】向氢氧化钠的稀溶液的试管里,滴一滴酚酞试液,再逐步滴入稀硫酸溶液。
【观察思考】观察并正确描述现象,写出相关的化学反应方程式
(4) 氢氧化钠与某些盐的反应
【实验】在两只试管里分别注入硫酸铜溶液和氯化铁溶液,观察它们的颜色和状态。
然后再分别加氢氧化钠溶液。
【观察思考】观察并正确描述现象,写出相关的化学反应方程式
CuSO4 + NaOH=Cu(OH)2 + Na2SO4
FeCl3 + NaOH = Fe(OH)3 +3NaCl
试写出氢氧化钠与硫酸铁溶液、硝酸铜溶液反应的化学方程式
【板书总结】3.化学性质
(1)与酸碱指示剂的反应
(2)与非金属氧化物的反应
(3)与酸的反应
(4)与某些盐的反应
【作业】略。
【教后随笔】。
