辅助性T细胞亚群在小鼠EAE模型视神经中的变化
EAE小鼠模型的构建及其免疫学机制的探讨

剂盒按照公司提供的实验指南操作 ,检测不同发病 状态小鼠外周血血清中的 IFN2γ含量 。 1. 7 MTT 法检测小鼠脾脏 T 淋巴细胞增殖 具体 操作如下 : ①在无菌条件下 ,分别取正常组小鼠和免 疫 10 d 的 EAE 组小鼠的脾脏 ,制成脾细胞悬液 ,用 淋巴细胞分离液分离小鼠脾脏 T 淋巴细胞 ; ②调整 细胞数为 4 ×106 mL - 1 ,将细胞加入到 96 孔细胞培 养板中 ,100μLΠ孔 ,分别加入不同浓度的 MOG35255 多 肽使其终浓度为 0 、0. 5 、2. 5 、5 、15 、25 、50μgΠmL ,各浓 度设立 3 个复孔 ,每孔总体积用培养基补足到 200 μL ; ③将培养板放入 37 ℃、50 mLΠL CO2 培养箱中培 养48 h ; ④取出培养板 ,每孔加入 20 μL MTT (5 mgΠ L) ,继续培养 4 h 后 ,以 2 000 rΠmin 离心 10 min ,小心 去除上清液 ; ⑤每孔加入 100 μL 二甲基亚砜 (DM2 SO) ,37 ℃放置 15 min ,用酶标仪于波长 490 nm 测定 各孔的光密度值 (OD) 。MTT 法检测细胞增殖活性 , 用刺激指数 ( stimulating index ,SI) 表示 。SI = 刺激组 ODΠ空白组 OD 。 1. 8 小 鼠 外 周 血 血 清 抗 MO G35255 Ig G 抗 体 的 检 测 按ELISA 常规方法操作 ,具体如下 : ① MOG35255 多肽用包被液稀释为 1 μgΠmL ,每孔 100 μL ,包被酶 标板 ,4 ℃放置过夜 ; ②次日洗涤液洗涤 ,3 minΠ次 ,共 3 次 ,洗后拍干 ; ③用 0. 3 gΠL 的 BSA 封闭 ,37 ℃孵育 1 h ,充 分 洗 涤 ; ④待 测 血 清 按 1 ∶100 稀 释 , 每 孔 100μL ,37 ℃孵育 1 h ,充分洗涤 ; ⑤ HRP 标记山羊抗 小鼠 IgG按 1∶5000 稀释 ,每孔 100μL ,37 ℃孵育 1 h , 充分洗涤 ; ⑥加入显色液 ,每孔 100 μL ,37 ℃避光显 色15 min ,终止液终止反应 ,于波长 450 nm 处测定各 孔的光密度值 ; ⑦结果判定 :以大于阴性对照 OD 值 的 2. 1 倍为阳性结果 。 1. 9 统计学处理 采用 SPSS12. 0 软件进行统计分 析 ,各项指标以均数 ±标准差表示 。
辅助性T细胞亚群分化机制及临床意义研究进展

D O I :10.3969/j.i s s n .2096-6113.2020.04.023引用格式:唐㊀洁,蒲姝陶.辅助性T 细胞亚群分化机制及临床意义研究进展[J ].巴楚医学,2020,3(4):103G107,116.基金项目:绵阳市中心医院孵化课题(N o :2019F H 05)作者简介:唐㊀洁,女,硕士,副主任医师,主要从事临床检验诊断G血液免疫检验研究.E Gm a i l :24971874@q q.c o m 辅助性T 细胞亚群分化机制及临床意义研究进展唐㊀洁㊀蒲姝陶(绵阳市中心医院检验科,四川绵阳㊀621000)摘要:辅助性T 淋巴细胞是机体免疫系统的重要组成部分,由来源于胸腺的C D 4+纯真T 细胞,在不同强度抗原刺激㊁不同细胞因子以及其他一些内环境因素的共同作用下,进一步分化出的多个功能亚群的混合体.这些功能亚群根据其激活所需的特异性转录因子㊁表达的不同细胞因子和归巢受体而定义.它们在机体感染㊁炎症反应㊁肿瘤㊁自身免疫性疾病以及过敏性疾病的发生发展中发挥重要的调节作用.本文将就辅助性T 淋巴细胞亚群的分化机制㊁临床意义做一综述.关键词:辅助性T 淋巴细胞亚群;㊀分化机制;㊀临床意义中图分类号:R 392.12㊀㊀㊀文献标识码:A㊀㊀㊀文章编号:2096G6113(2020)04G0103G05㊀㊀辅助性T (Th e l pe r ,T h )淋巴细胞亚群是机体适应性免疫系统的关键组分,包括了在分子特征㊁产细胞因子㊁效应功能及组织分布上有所差异的一群细胞[1].T h 亚群细胞由胸腺C D 4+N a ïv eT 细胞(纯真T 细胞)在不同强度抗原刺激因素㊁不同内细胞因子及转录信号等诱导作用下进一步分化而来,并根据分化过程中激活的转录因子㊁表达的不同细胞因子和归巢受体而定义.目前研究较多的T h 亚群主要是T h 1㊁T h 2㊁T h 17㊁T r e g㊁T h 22㊁T h 9和T 滤泡辅助细胞(Tf o l l i c u l a rh e l p e r ,T f h )亚群[2,3].T h 细胞亚群是机体免疫系统重要的调节器,在适应性免疫调节反应中,它们既参与细胞毒性细胞免疫应答调节,又介导B 细胞依赖性抗体的产生,还能与固有免疫系统组分相互作用.研究显示,与树突状细胞(d e n d r i t i cc e l l ,D C )接触进而产生的细胞因子决定了T h 细胞亚群的分化方向[4].T h 细胞亚群是宿主免疫防御的关键因素,也是免疫介导疾病的主要驱动分子,其通过产生一系列细胞因子,参与感染㊁炎症㊁过敏性疾病㊁自身免疫性疾病以及肿瘤等疾病的发生发展[2,5,6].细胞因子决定了T h 亚群的分化方向,而分化的亚群细胞通过产生不同的细胞因子参与疾病进展;各亚群之间保持平衡维持了机体健康状态,失衡则将导致疾病状态[6].本文将就T h 亚群特点㊁分化机制㊁效应机制及其与临床疾病的关系进行综述,以期了解T h 细胞亚群的临床价值.1㊀T h 细胞亚群的分化机制1.1㊀T h 1细胞白细胞介素(i n t e r l e u k i n ,I L )G12是N a ïv eT 细胞向T h 1分化的关键因子,γ干扰素(i n t e r f e r o nga m m a ,I F N Gγ)也同样发挥了重要的作用,并且I F N Gγ还在消除I L G12促分化极化,维持亚群数量平衡方面发挥了作用[7].机体感染细菌㊁真菌和病毒,均可诱导N a ïv eT 细胞分化为T h 1.在D C 细胞吞噬病原体后提取和递呈抗原肽给T 细胞时,即产生和分泌I F N Gγ和I L G12,二者调动和协调机体固有免疫和适应性免疫应答反应的同时,也促使N a ïv eT 向T h 1细胞分化.最初,T h 1的分化主要依赖D C 分泌的I F N Gγ和I L G12,分别通过S T A T1和S T A T4信号转导和转录因子通路介导实现.随后,分化出的T h 1细胞在上述细胞因子及其胞内信号通路作用下,激活调节转录因子T Gb e t 进而产生大量的I F N Gγ,二者相互作用的正反馈调节环路,产生T h 1分化的级联放大效应[8].在T h 1分化后期,借助I L G12/S T A T4信号通路,T h 1细胞膜表面I L G18R α受体上调,进一步促进了I F N Gγ的产生进而分化出更多的T h 1细胞.上述通过细胞因子及其信号通路促进T h 1细胞分化的过程,是不依赖于T 细胞受体的,这种非抗原依赖的纯301 巴楚医学㊀2020年第3卷第4期㊀B A C H U M E D I C A L J O U R N A L ,2020,V o l 3,N o 4细胞因子效应途径是T h1分化的重要机制.T h1主要产生I F NGγ,通过活化巨噬细胞介导机体细胞免疫调节.1.2㊀T h2细胞促使N aïv eT细胞向T h2分化的细胞因子是I LG4,其通过S T A T6信号通路介导T h2细胞的分化,主要受转录调节因子G A T A3调控.这条控制细胞分化的信号通路也同T h1的S T A T1和S T A T4信号通路一样,具有自我激活的正反馈调节效应,表现为T h2分化的级联放大反应[9].当D C细胞表达配体J a g g e dG1时,就会触发N aïv eT细胞产生I LG4.此外,研究发现,被蠕虫感染的动物肠道中的肥大细胞和巨噬细胞,以及肺上皮细胞均能产生I LG25,其能进一步诱导动物N aïv eT细胞产生I LG4,进而引发T h2极化[10].T h2细胞可以产生I LG4㊁I LG5和I LG13,前两者可诱导趋化㊁激活嗜酸性粒细胞和肥大细胞,进而导致组胺㊁前列腺素㊁白三烯等炎症因子的触发和释放,这些炎症因子作用于局部使血管扩张和渗漏㊁支气管收缩以及肠蠕动增强,即发生过敏反应,此种类型的过敏反应又称为即时超敏反应.即时超敏反应对于消除肠道蠕虫非常重要,实际上蠕虫卵能够强烈的诱导T h2分化[11].T h2也参与机体变态反应和过敏反应,例如哮喘和过敏.1.3㊀T h17细胞T h17细胞系是近年来发现的独立于T h1及T h2以外的新T细胞亚群,由N aïv eT细胞在I LG6和转化生长因子(t r a n s f o r m i n g g r o w t h f a c t o r, T G F)Gβ作用下分化而来,该过程主要受S T A T3㊁S m a d信号通路和视黄酸受体相关孤儿受体R O Rγt 等转录因子调控[12].此外还有其他一些细胞因子参与调节T h17的生成,如I LG1β㊁T N FGα能够增强I LG6和T G FGβ对T h17的促分化作用,I LG23也在T h17的增殖和维持方面发挥了正向作用[13];与此相反, T h1㊁T h2产生的细胞因子如I F NGγ和I LG4以及其他一些S T A T1激活途径生成的细胞因子如I LG27,均能抑制T h17的分化.T h17亚群本身以分泌I LG17家族细胞因子(主要是I LG17A及I LG17F)为特点,同时也能产生I LG22和粒细胞巨噬细胞刺激因子(g r a n u l o c y t eGm a c r o p h a g e c o l o n yGs t i m u l a t i n g f a c t o r, G MGC S F),后者对中性粒细胞和单核细胞有趋化效应.1.4㊀T r e g细胞T r e g细胞即调节T细胞(t h er e g u l a t o r y T c e l l),由N aïv eT在T G FGβ单独诱导作用下,主要通过转录因子F o x p3调控分化而来.T r e g和T h17两个亚群相互对抗,若T G FGβ和I LG6同时存在,T r e g 分化受抑,T h17会成为优势亚群.对T r e g的免疫识别研究显示,T r e g细胞强表达C D4,同时表达C D25㊁C D127l o w和胞浆F o x p3,可以利用这些胞内外标志物对其识别和研究[14,15].T r e g细胞的稳定性受其来源影响,一般来源于胸腺的T r e g细胞较为稳定;而来源于外周血经T G FGβ诱导而来的i T r e g稳定性欠佳.T r e g的功能主要是维持免疫耐受,它可以通过细胞间接触,释放如I LG10㊁T G FGβ等抑制性细胞因子的方式抑制效应T细胞及抗原递呈细胞的功能,从而发挥免疫抑制效应[14,15].机体的T r e g和T h17保持着动态平衡以维持机体免疫自稳.1.5㊀T h22细胞T h22是在对I LG22来源细胞的研究中发现的新C D4+T细胞亚群,起初被认为是T h17的一个分支群,但实际上T h22是不同于T h17的一个独立亚群.一项对T h22和经典的T h17转录组比对分析结果表明,二者有超过600个差异基因表达,T h22转录组与以往被描述为 致病性T h17 细胞高度相似,以高表达I LG23R㊁S T A T4和TGb e t等致病相关基因为特点,而经典的T h17则与过去所谓的 非致病性T h17 类似[16].I LG22是I LG10因子家族成员,通过作用于皮肤㊁呼吸道及消化道上皮细胞介导机体的皮肤粘膜屏障抗感染效应.过去普遍认为I LG22主要由T h17细胞产生,但D u h e n等[17]在一项人类皮肤免疫的研究中发现,一群大量产生I LG22但不产生I LG17的非T h17细胞,即T h22细胞.上述研究均证实T h22细胞群的独立性.T h22的诱导因子也是T G FGβ和I LG6,但N aïv eT细胞发育为T h22还是T h17主要由T G FGβ和I LG6的相对浓度决定.在高浓度I LG6和低浓度T G FGβ环境下,N aïv eT细胞更易分化为T h22,反之则为T h17.借助I LG22㊁I LG13㊁T N FGα以及皮肤归巢受体C C R10等细胞因子的产生,T h22主要在调节皮肤稳态,参与呼吸道㊁消化道等腔道免疫保护,以及调控上皮组织免疫相关炎症中起作用[18].1.6㊀T h9细胞T h9细胞是一群以产生细胞因子I LG9为主要特点的辅助T细胞亚群,于20世纪80年代末首次被报道[19].T h9的体内诱导机制复杂,目前仍不十分明确,但体外实验显示,T h9主要由N aïv e T细胞在T G FGβ和I LG4的作用下诱导分化而来,但仅有一小部分细胞对此种诱导敏感,因此T h9细胞群数量极少[20].在仅有T G FGβ或I LG4存在的情况下,N aïv e T细胞分化为T r e g或T h2;而当二者同时作用于N aïv eT细胞时,I LG4通过负调节F O X3转录因子抑401 巴楚医学㊀2020年第3卷第4期㊀B A C H U M E D I C A L J O U R N A L,2020,V o l 3,N o 4制T r e g分化,T G FGβ又抑制T h2亚群分化,在同时抑制T r e g和T h2分化机制下,T h9分化得以实现[21].也有研究发现,有部分T h2通过自我关闭I LG4的表达而转化为T h9,这说明T h2与T h9之间有着某种潜在的联系[22].与前述辅助性T细胞亚群都有明确的诱导信号通路不同,目前尚未发现T h9转化相关特异性信号通路,故推测T h9的转化是多条信号通路叠加参与的结果.目前已明确肿瘤坏死因子受体(t u m o rn e c r o s i s f a c t o r r e c e p t o r,T N F R)超家族的共刺激分子,如O x40㊁糖皮质激素诱导的肿瘤坏死因子受体(g l u c o c o r t i c o i dGi n d u c e dt u m o rn e c r oGs i s f a c t o r r e c e p t o r,G I T R)和死亡受体(d e a t hr e c e pGt o r,D R)3等参与了T h9的诱导分化过程[23].1.7㊀T f h细胞T滤泡辅助细胞(Tf o l l i c u l a rh e l p e r c e l l s,T f h)是一种特殊类型的C D4+T细胞,在生发中心反应中发挥维持B细胞记忆和辅助B细胞产生抗体的作用.T f h细胞主要特点为表达C X C趋化因子受体(C X Cc h e m o k i n e r e c e p t o r,C X C R)5㊁诱导共刺激分子(i n d u c e dc o s t i m u l a t o r y m o l e c u l e s,I C O S)㊁程序化死亡因子(p r o g r a mm e dd e a t h f a c t o r,P D)G1㊁B c lG6和I LG21[24].T f h的分化受B c lG6㊁I R F4㊁cGM a f㊁B a t f 以及S T A T3/5等主要转录因子参与的复杂转录网调节,其也可由其他效应T细胞转化而来,例如在病毒感染期间T h1细胞就可转化为T f h细胞[24,25].效应T细胞转化为T f h的具体机制尚不清楚.2㊀T h细胞亚群功能与临床疾病2.1㊀T h1/T h2T h1㊁T h2功能细胞亚群是最早被描述的辅助性T细胞亚群,在过去的数十年里得到了较为充分的研究.T h1主要参与细胞免疫调节,通过产生高水平的I F NGγ,参与吞噬细胞的活化,通过调理吞噬作用以及补体固定抗体,在机体抗病毒或胞内病原微生物感染以及消除肿瘤细胞中发挥用.此外T h1也介导机体炎症反应和迟发型超敏反应,与一些自身免疫疾病,如自身免疫性脑炎和机体慢性炎症反应,如胶原相关关节炎和炎症性肠病有关[26].T h2主要介导体液免疫调节,通过促进抗体的产生对抗胞外病原体(如寄生虫感染),并在过敏反应的发生发展以及异种移植和妊娠过程中的免疫耐受方面发挥作用.T h1主要通过产生I F NGγ发挥其生理功能,T h2则主要产生I LG4发挥效应.生理情况下二者相对稳定,受到相互抑制和自分泌的转录和信号因子的调节.病理情况下稳态打破,表现为某亚型优势参与疾病发展.在病毒感染性疾病中,H B V感染所致慢性肝炎㊁活动性肝炎后肝硬化及慢性重症肝炎等情况下常表现为T h1亚群优势[27],而H C V隐匿性感染和H I V 感染后A I D S进展后期则以T h2应答为主[28,29].在细菌性脓毒血症患者中,表现为T h2优势应答的患者临床进展更快㊁死亡率更高[30].在机体抗肿瘤免疫方面,适应性免疫细胞中的T h细胞通过产生I F NGγ直接杀伤或招募激活N K或巨噬细胞等间接方式对抗肿瘤细胞,以T h1应答为主的患者预后更好[31].2.2㊀T h17/T r e gT h17主要诱导机体的炎症反应,参与自身免疫性疾病的发生发展.T r e g则主要发挥免疫抑制作用,在机体免疫自稳过程中意义重大,机体T r e g不足将更容易发生自身免疫性疾病.正常情况下,T h17/ T r e g保持着动态平衡,在机体免疫防御㊁炎症反应和免疫耐受等方面发挥效应.在机体细菌和真菌感染后,T h17能通过直接产生GMGC S F招募和激活中性粒细胞和单核细胞,或间接诱导患者C S F和C X C L8发挥抗感染作用,而在特应性皮炎㊁克罗恩病㊁牛皮癣和多发硬化症的患者中发现升高的T h17,均提示其参与了自身免疫性疾病和炎症反应[13].研究对T h17在肿瘤免疫方面的作用结论不一,患者的转归与肿瘤类型有关,有可能成为未来肿瘤免疫治疗的靶点[32].而T r e g则是明确的肿瘤免疫障碍成分,是肿瘤细胞免疫逃逸的重要帮凶.在肿瘤发生早期,T r e g通过直接抑制实体瘤局部的免疫效应细胞帮助肿瘤进展;在肿瘤发生后期,T r e g通过自身系统上调,抑制机体对转移瘤的免疫效应,促进肿瘤转移.因此,减少T r e g细胞和控制其功能以增加抗肿瘤免疫应答是肿瘤免疫治疗领域潜在的靶点[33].机体T h17/T r e g相互作用调节,维持机体免疫稳态,在疾病状态下二者调节失衡,疾病则表现出进展状态.如在肿瘤患者中表现出T r e g优势的患者更易复发和转移[33].在细菌性脓毒血症患者中,外周血T r e g细胞升高㊁T h17减少者更易进展为创伤性休克[34].2.3㊀T h22㊁T h9和T f h细胞T h22主要通过产生I LG22发挥生物学效应.I LG22是I LG10家族成员,通过作用于上皮细胞㊁胰腺细胞㊁肝细胞和某些类型的成纤维细胞,介导宿主防御侵袭性病原体.在炎症性肠病㊁哮喘㊁系统性硬化症和类风湿性关节炎等自身免疫病或过敏性疾病中均可见I LG22的升高,但效应不一,既可能抑制炎症501巴楚医学㊀2020年第3卷第4期㊀B A C H U M E D I C A L J O U R N A L,2020,V o l 3,N o 4反应,也可能促进疾病进展,这取决于内环境和疾病阶段[35,36].此外有研究报道在肿瘤患者中也观察到T h22和其效应分子I LG22的变化,提出其可能是未来肿瘤免疫治疗的潜在靶点[37].T h9通过I LG9主要参与自身免疫性疾病和过敏性疾病的发生发展[38].I LG9在免疫系统中具有许多重要的功能,它促进T细胞和肥大细胞的存活和增殖,刺激多种细胞因子的产生,并调节B细胞的反应,其在抗肿瘤中也有一定作用[39,40].T h9细胞也能产生I LG10和I LG21,但其功能尚待阐明.T f h与其他T辅助细胞亚群不断迁移出淋巴结生发中心区不同,它驻留原处发挥维持B细胞记忆和辅助B细胞产生抗体的效应,C X C R5受体可能与此有关,其也是T f h独特的免疫标志物[24].目前T f h 与其他淋巴亚群的关系尚不清楚,还需要更多研究.3㊀小结在不同刺激因素或细胞因子作用下,胸腺C D4+N aïv eT细胞分化为不同的T h亚群,这些亚群进一步分泌不同细胞因子产生多种免疫效应(见图1).生理状态下,机体内的T h细胞亚群保持着动态平衡,维持正常免疫调节功能.当感染㊁炎症㊁肿瘤等疾病发生时,T h亚群受到抗原刺激,在细胞因子作用下亚群分化平衡被打破,免疫调节功能失调,疾病进展;经过治疗,亚群平衡恢复,疾病好转(见表1).通过对亚群表面标志物和其产生的细胞因子的检测,能够了解健康和疾病状态下亚群的分布状态,有助于疾病诊断,病情的严重程度和疗效判断.积极开展淋巴细胞亚群在不同疾病状态下的深入研究,对于深入认识疾病发展规律以及新治疗策略的探索极具意义.图1㊀T h细胞亚群分化机制及细胞功能示意图表1㊀T h亚群与临床疾病T h亚群相关的临床疾病T h1病毒㊁胞内病原微生物感染㊁肿瘤㊁自身免疫性脑炎㊁胶原相关关节炎和炎症性肠病等T h2寄生虫感染㊁过敏性疾病㊁异种移植和妊娠免疫耐受T h17真菌感染㊁炎症性疾病(如特应性皮炎和克罗恩病)㊁自身免疫性疾病(如牛皮癣和多发硬化症)㊁肿瘤等T r e g免疫抑制㊁参与肿瘤的发展和转移T h22过敏性疾病(如哮喘和变应性皮炎)㊁自身免疫病(如系统性硬化症㊁银屑病和类风湿性关节炎)㊁炎症性肠病㊁肿瘤等T h9可能参与自身免疫性疾病和过敏性疾病有关,功能尚未完全明了T f h维持B细胞记忆和辅助B细胞抗体产生,功能尚未完全明了601 巴楚医学㊀2020年第3卷第4期㊀B A C H U M E D I C A L J O U R N A L,2020,V o l 3,N o 4参考文献:[1]㊀R e a dK A,P o w e l lM D,S r e e k u m a r BK,e t a l.I n v i t r od i f fe r e n t i a t i o no fef f e c t o rC D4+T h e l p e rc e l ls u b s e t s[J].M e t h o d sM o l B i o l,2019,1960:75G84.[2]㊀Z h u J.T H e l p e r c e l l d i f f e r e n t i a t i o n,h e t e r o g e n e i t y,a n d p l a s t i c i t y[J].C o l dS p r i n g H a r bP e r s p e c t B i o l,2018,10(10):a030338.[3]㊀M o r e lP A.D i f f e r e n t i a lTGc e l l r e c e p t o rs i g n a l sf o rTh e l p e r c e l l p r o g r a mm i n g[J].I mm u n o l o g y,2018,155(1):63G71.[4]㊀S c h m i t tN,U e n oH.R e g u l a t i o no f h u m a nh e l p e rTc e l l s u b s e td i f f e r e n t i a t i o nb y c y t o k i n e s[J].C u r r O p i nI mGm u n o l,2015,34:130G136.[5]㊀R a p h a e l I,N a l a w a d eS,E a g a rT N,e t a l.Tc e l l s u bGs e t s a n d t h e i r s i g n a t u r e c y t o k i n e s i n a u t o i mm u n e a n d i nGf l a mm a t o r y d i s e a s e s[J].C y t o k i n e,2015,74(1):5G17.[6]㊀I v a n o v aE A,O r e k h o vA N.Th e l p e r l y m p h o c y t e s u bGs e t s a n d p l a s t i c i t y i n a u t o i mm u n i t y a n d c a n c e r:a no v e rGv i e w[J].B i o m e dR e s I n t,2015,2015:327470.[7]㊀Z h a ng Y,Zh a n g Y,G uW,e t a l.T H1/T H2c e l l di f f e rGe n t i a t i o na n dm o l e c u l a r s i g n a l s[J].A d vE x p M e dB i o l,2014,841:15G44.[8]㊀E s p i n o s aV,R i v e r aA.C y t o k i n e sa n dt h e r e g u l a t i o no ff u ng u sGs p e c i f i cC D4Tc e l l d i f f e r e n t i a t i o n[J].C y t o k i n e,2012,58(1):100G106.[9]㊀O u y a n g W,Löh n i n g M,G a oZ,e t a l.S t a t6Gi n d e p e n dGe n t G A T AG3a u t o a c t i v a t i o n d i r e c t s I LG4Gi n d e p e n d e n tT h2d e v e l o p m e n t a n d c o mm i t m e n t[J].I mm u n i t y,2000,12(1):27G37.[10]O w y a n g A M,Z a p hC,W i l s o nE H,e ta l.I n t e r l e uGk i n25r e g u l a t e s t y p e2c y t o k i n eGd e p e n d e n t i mm u n i t y a n d l i m i t s c h r o n i c i n f l a mm a t i o ni nt h e g a s t r o i n t e s t i n a l t r a c t [J].JE x p M e d,2006,203(4):843G849.[11]P e a r c eEJ,C a s p a r P,G r z y c h JM,e t a l.P i l l a r s a r t i c l e:d o w n re g u l a t i o no fT h1c y t o k i n e p r o d u c t i o na c c o m p a n i e si n d u c t i o no fT h2r e s p o n s e s b y a p a r a s i t i c h e l m i n t h[J].JI mm u n o l,2012,189(3):1104G1111.[12]K o r nT,B e t t e l l iE,O u k k a M,e t a l.I LG17a n dT h17C e l l s[J].A n n uR e v I mm u n o l,2009,8(1):485G517.[13]G i r o l o m o n i G,S t r o h a l R,P u i g L,e t a l.T h e r o l e o f I LG23a n d t h e I LG23/T H17i mm u n e a x i s i n t h e p a t h o g e n eGs i s a n d t r e a t m e n t o f p s o r i a s i s[J].JE u rA c a dD e r m a t o l V e n e r e o l,2017,31(10):1616G1626.[14]A b b a sA K,B e n o i s t C,B l u e s t o n e JA,e t a l.R e g u l a t oGr y Tc e l l s:r e c o mm e n d a t i o n s t os i m p l i f y t h en o m e n c l aGt u r e[J].N a t I mm u n o l,2013,14(4):307G308.[15]S a k a g u c h i S,M i y a r aM,C o s t a n t i n oC M,e t a l.F O X P3+r e g u l a t o r y Tc e l l s i n t h eh u m a n i mm u n e s y s t e m[J].N a tR e v I mm u n o l,2010,10(7):490G500.[16]C o o m b e s JL,S i d d i q u i KR,A r a n c i b i aGC r c a m oCV,e ta l.A f u n c t i o n a l l y s p e c i a l i z e d p o p u l a t i o n o f m u c o s a lC D103+D C s i n d u c e sF o x p3+r e g u l a t o r y Tc e l l sv i aaT G FGb e t a a n dr e t i n o i ca c i dGd e p e n d e n tm e c h a n i s m[J].JE x p M e d,2007,204(8):1757G1764.[17]D u h e nT,G e i g e rR,J a r r o s s a y D,e t a l.P r o d u c t i o no fi n t e r l e u k i n22b u tn o t i n t e r l e u k i n17b y as u b s e t o fh uGm a ns k i nGh o m i n g m e m o r y T c e l l s[J].N a tI mm u n o l,2009,10(8):857G863.[18]B a s uR,H a t t o nR D,W e a v e rC T.T h eT h17f a m i l y:f l e x i b i l i t y f o l l o w sf u n c t i o n[J].I mm u n o l R e v,2013,252(1):89G103.[19]L i J,C h e nS,X i a oX,e t a l.I LG9a n dT h9c e l l s i n h e a l t ha n dd i s e a s e sGf r o m t o l e r a n c et oi mm u n o p a t h o l o g y[J].C y t o k i n eG r o w t hF a c t o rR e v,2017,37:47G55.[20]M a l i k S,A w a s t h iA.T r a n s c r i p t i o n a lc o n t r o lo f T h9c e l l s:r o l e o fF o x o1i n i n t e r l e u k i nG9i nd u c t i o n[J].F r o n tI mm u n o l,2018,9:995.[21]D a r d a l h o nV,A w a s t h iA,K w o nH,e t a l.I LG4i n h i b i t s T G FGb e t aGi n d u c e dF o x p3+Tc e l l sa n d,t o g e t h e rw i t h T G FGb e t a,g e n e r a t e s I LG9+I LG10+F o x p3(-)e f f e c t o r Tc e l l s[J].N a t I mm u n o l,2008,9(12):1347G1355.[22]V e l d h o e n M,U y t t e n h o v eC,v a nS n i c kJ,e t a l.T r a n sGf o r m i n gg r o w t hf a c t o rGb e t a'r e p r o g r a m s'th edi f f e r e n t i aGt i o no fT h e l p e r2c e l l sa n d p r o m o t e sa ni n t e r l e u k i n9Gp r o d u c i n g s u b s e t[J].N a tI mm u n o l,2008,9(12):1341G1346.[23]K a p l a n M H.T h et r a n s c r i p t i o nf a c t o rn e t w o r ki nT h9c e l l s[J].S e m i n i mm u n o p a t h o l,2017,39(1):11G20.[24]J o gd a n dG M,M o h a n t y S,De v a d a s S.R e g u l a t o r o fTf hc e l ld i f fe r e n t i a t i o n[J].F r o n t I mm u n o l,2016,7:520.[25]L i uX,N u r i e v aRI,D o n g C.T r a n s c r i p t i o n a l r e g u l a t i o n of f o l l i c u l a r TGh e l p e r(T f h)c e l l s[J].I mm u n o lR e v,2013,252(1):139G145.[26]H i r a h a r aK,P o h o l e kA,V a h e d iG,e t a l.M e c h a n i s m s u n d e r l y i n g h e l p e rTGc e l l p l a s t i c i t y:i m p l i c a t i o n s f o r i mGm u n eGm e d i a t e dd i s e a s e[J].J A l l e r g y C l i nI mm u n o l,2013,131(5):1276G1287.[27]L iM H,Z h a n g D,Z h a n g L,e t a l.R a t i o s o fTGh e l p e r2c e l l s t o TGh e l p e r1c e l l sa n dc y t o k i n e l e v e l s i n p a t i e n t sw i t hh e p a t i t i sB[J].C h i n M e dJ(E n g l),2017,130(15):1810G1815.[28]M o u s aN,E l d a r s W,E l d e g l a H,e ta l.C y t o k i n e p r oGf i l e s a n dh e p a t i c i n j u r y i no c c u l t h e p a t i t i sCv e r s u s c h r oGn i ch e p a t i t i sCv i r u s i n f e c t i o n[J].I n tJI mm u n o p a t h o l P h a r m a c o l,2014,27(1):87G96.(下转第116页)701巴楚医学㊀2020年第3卷第4期㊀B A C H U M E D I C A L J O U R N A L,2020,V o l 3,N o 4[22]S h e f f e rCE,B i c k e lW K,B r a n d o nT H,e t a l.P r e v e nGt i n g r e l a p s e t o s m o k i n g w i t h t r a n s c r a n i a lm a g n e t i c s t i mGu l a t i o n:f e a s i b i l i t y a n d p o t e n t i a l e f f i c a c y[J].D r u g A l c oGh o lD e p e n d,2018,182:8G18.[23]N a q v iN H,R u d r a u fD,D a m a s i o H,e t a l.D a m a g e t o t h e i n s u l ad i s r u p t sa d d i c t i o nt oc i g a r e t t es m o k i n g[J].S c i e n c e,2007,315(5811):531G534.[24]F i s h e rDJ,D a n i e l sR,J a w o r s k aN,e t a l.E f f e c t s o f aGc u t en i c o t i n e ad m i n i s t r a t i o n o n re s t i n g E E G i n n o n s m o kGe r s[J].E x p C l i nP s y c h o p h a r m a c o l,2012,20(1):71G75.[25]K n y a z e v G G.E E G d e l t ao s c i l l a t i o n sa sac o r r e l a t eo fb a s i ch o m e o s t a t i ca n d m o t i v a t i o n a l p r oc e s s e s[J].N e uGr o s c i B i o b e h a vR e v,2012,36(1):677G695.[26]L iX,H a r t w e l lKJ,B o r c k a r d t J,e t a l.V o l i t i o n a l r eGd u c t i o no f a n te r i o r c i n g u l a t e c o r t e x a c t i v i t yp r o d u c e s d eGc r e a s e dc u ec r a v i n g i ns m o k i n g c e s s a t i o n:a p r e l i m i n a r yr e a lGt i m e f M R Is t u d y[J].A d d i c tB i o l,2013,18(4):1369G1600.[27]H a n l o nC A,H a r t w e l lKJ,C a n t e r b e r r y M,e t a l.R eGd u c t i o no fc u eGi n d u ce dc r a v i n g t h r o u g hr e a l t i m en e u r oGf e e d b a c k i nn i c o t i n eu s e r s:t h e r o l eo f r eg i o no f i n t e r e s ts e l e c t i o na n d m u l t i p l ev i s i t s[J].P s y c h i a t r y R e s,2013,213(1):79G81.[28]H a r t w e l lKJ,H a n l o nC A,L iX,e t a l.I n d i v i d u a l i z e d r e a lGt i m ef M R In e u r o f e e d b a c kt o a t t e n u a t ec r a v i n g i n n i c o t i n eGd e p e n d e n t s m o k e r s[J].JP s y c h i a t r y N e u r o s c i,2016,41(1):48G55.[29]D i a n aM,R a i j T,M e l i sM,e t a l.R e h a b i l i t a t i n g t h e a dGd i c te db r a i nw i t ht r a n s c r a n i a lm a g n e t i cs t i m u l a t i o n[J].N a tR e vN e u r o s c i,2017,18(11):685G693.[30]沈竹静.烟草成瘾与戒烟治疗的多模态磁共振成像研究[D].浙江大学,2018.[31]何㊀怡,徐东群.人体生物样品中尼古丁及其代谢物可替宁测定的前处理方法研究进展[J].中国卫生检验杂志,2011,21(8):2110G2113.[收稿日期㊀2020G03G10](上接第107页)[29]G o r e n e cL,Z i d o v e cL e p e j S,G r g i c I,e t a l.T h ec o mGp a r i s o no fT h1,T h2,T h9,T h17a n d T h22c y t o k i n e p r o f i l e s i n a c u t e a n d c h r o n i cH I VG1i n f e c t i o n[J].M i c r o b P a t h o g,2016,97:125G130.[30]G u p t aD L,B h o iS,M o h a n T,e ta l.C o e x i s t e n c eo f T h1/T h2a n d T h17/T r e g i m b a l a n c e si n p a t i e n t s w i t h p o s t t r a u m a t i c s e p s i s[J].C y t o k i n e,2016,88:214G221.[31]V e s e l y M D,K e r s h a w M H,S c h r e i b e rRD,e t a l.N a tGu r a l i n n a t ea n da d a p t i v e i mm u n i t y t oc a n c e r[J].A n n u R e v I mm u n o l,2011,29:235G271.[32]C h a n g SH.Th e l p e r17(T h17)c e l l s a n d i n t e r l e u k i nG17(I LG17)i nc a n c e r[J].A r c hP h a r m R e s,2019,42(7):549G559.[33]O h u eY,N i s h i k a w a H.R e g u l a t o r y T(T r e g)c e l l s i nc a n c e r:c a nt r e g c e l l sb ean e wt h e r a p e u t i ct a r g e t[J].C a n c e r S c i,2019,110(7):2080G2089.[34]L a n c aT,S i l v aGS a n t o sB.T h e s p l i t n a t u r e o f t u m o rGi n f lGt r a t i n g l e u k o c y t e s:i m p l i c a t i o n sf o rc a n c e rs u r v e i l l a n c ea n d i mm u n o t h e r a p y[J].O n c o l I mm u n o l,2012,1(5):717G725.[35]T a n g M S,B o w c u t tR,L e u n g JM,e t a l.I n t e g r a t e d aGn a l y s i s o f b i o p s i e s f r o mi n f l a mm a t o r y b o w e l d i s e a s e p aGt i e n t s i d e n t i f i e sS A A1a sal i n k b e t w e e n m u c o s a l m iGc r o b e sw i t hT H17a n dT H22c e l l s[J].I n f l a mm B o w e lD i s,2017,23(9):1544G1554.[36]T a m a s a u s k i e n eL,S i t k a u s k i e n eB.R o l eo fT h22a n dI LG22i n p a t h o g e n e s i so fa l l e r g i ca i r w a y d i s e a s e s:p r oGi n f l a mm a t o r y o ra n t iGi n f l a mm a t o r y e f f e c t[J].P e d i a t rN e o n a t o l,2018,59(4):339G344.[37]J i aL,W uC.T h eb i o l o g y a n df u n c t i o n so fT h22c e l l s [J].A d v aE x p M e dB i o l,2014,841:209G230.[38]D e n g Y,W a n g Z,C h a n g C,e t a l.T h9c e l l s a n d I LG9i na u t o i mm u n ed i s o r d e r s:p a t h o g e n e s i s a n d t h e r a p e u t i c p oGt e n t i a l s[J].H u mI mm u n o l,2017,78(2):120G128.[39]K o c hS,S o p e lN,F i n o t t oS.T h9a n d o t h e r I LG9Gp r o d uGc i n g c e l l s i na l l e r g i ca s t h m a[J].S e m i nI mm u n o p a t h o l,2017,39(1):55G68.[40]C h a u h a nSR,S i n g h a l PG,S h a r m aU,e t a l.T h9c y t oGk i n e s c u r bc e r v i c a l c a n c e r p r o g r e s s i o na n d i mm u n ee v aGs i o n[J].H u mI mm u n o l,2019,80(12):1020G1025.[收稿日期㊀2020G08G10]611 巴楚医学㊀2020年第3卷第4期㊀B A C H U M E D I C A L J O U R N A L,2020,V o l 3,N o 4。
最新T细胞亚群的分类及功能

T细胞亚群的分类及功能12更新时间:2004-4-29 3:56:003T细胞是不均一的群体,按其抗原识别受体,可将T细胞分为二大类。
4一类是TCRαβ、T细胞,另一类是TCRγδ细胞(表8-2)。
5表8-2 TCRαβ+T细胞与TCRγδT细胞的特性6TCRαβT细胞也是不均一的群体,根据其表型(phenotype)即其细胞7表面的特征性分子的不同,可将成熟T细胞分为二个亚类(subsets)即CD4+T8细胞和CD8+细胞。
9根据TCRαβT细胞的功能可将其分为二类。
一类为调节性T细胞,可10包括辅助性T细胞(helper T lymphocte,TH)和抑制性T细胞(suppressor T11lymphocyte,Ts)。
另一类为效应性T细胞(effector T cell),可包括杀伤性12T细胞(eytolytie T cell,CTL,或TC)和迟发型超敏性T细胞(delayed type13hypersensitivity T lymphoctye,TDTH)。
14(一)TCRαβT细胞15二类T细胞表型分子均呈CD2+、CD3+阳性,但γδT细胞为CD4-、CD8-16双阴性细胞(double negative cell,DN)或CD8+,而αβT细胞其表型为CD4+17或CD8+单阳性细胞(single positive cell,SP)。
18在末梢血主要为αβT细胞可占95%,而γδT细胞只占1%~10%。
αβT19细胞为主要参予免疫应答的T细胞,而对γδT细胞功能不十分了解,可能是20具有原始受体的第一防线的防御细胞,与抗原感染有关。
21(二)CD4+细胞22TCRαβTCD4+细胞(简称为CD4+细胞)的分子表型为CD2+、CD3+、CD4+、23CD8-。
其TCR识别抗原是MHCⅡ类分子限制性。
CD4+T细胞也是不均一的细胞群,按其功能可包括二种T细胞,即辅助性T细胞(TH),和迟发型超敏性T细胞2425(TDTH)。
F—VEP在监测EAE大鼠视神经病变中的作用

p t oo ia a ay i wih HE a d LF t i i g me h d ) Re u t Die s n ie c f EAE s 9 a h l g c l n l ss( t n B s an n t o s . s ls s a e i cd n e o wa 0
经免疫学和神经病学杂志 21 年 ! 笙 ! 00 鲞笙 塑
!!
! !
!
: ! :E AE大 鼠视 神 经 病 变 中 的作 用
朱 潇 颖 宫 媛 媛 解 正 高 赵 永 波
摘 要 : 目的 研 究 闪 光 视 觉 诱 发 电 位 ( - P 在 监 测 实 验 性 自身 免 疫 性 脑 脊 髓 炎 ( AE 视 神 经 病 变 中 的 F VE ) E )
作 用。方法
制 作 Witr 鼠 E sa 大 AE模 型 , 对 照 组 大 鼠 F VE 以 - P检 测 值 确 定 正 常 参 考 值 范 围 。模 型 组 大 鼠 于 豚
鼠脊 髓 匀浆 乳 化 剂 免 疫 后 不 同时 间点 进 行 F V P检 测 , 病 大 鼠 于 发 病 后 第 6天 行 电生 理 检 查 后 取 视 神 经 、 -E 发 脑 、 髓 等 通 过 伊 红 ( ) 色 和 I 焦 油 紫 染 色 法 进 行 病 理 检 查 。结 果 发 病 大 鼠 均 出 现 不 同 程 度 F V P 脊 HE 染 F -E 异 常和 视 神 经病 理 表 现 异 常 : P异 常 主 要 表 现 为 P波 和 / N1波 潜 伏 期 延 长 , 长 延 长 分 别 为 5 . 8 和 F VE 或 最 95 G 3 . 3 ; 神 经 病 理 改 变 主 要 表 现 为 髓 鞘 脱 失 和 炎性 反 应 。 F VE 5 3 视 - P检 测 大 鼠视 神 经 病 变 的 灵 敏 度 达 到 1 0 , 0 特 异 度 为 5 。结论 O F VE - P可 用 于 评 价 视 觉 系 统 损 伤 。
T细胞亚群及其功能(思维导图)
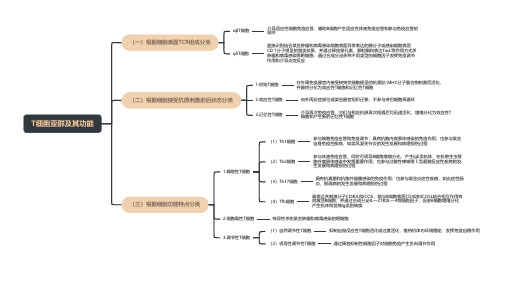
T细胞亚群及其功能(一)根据细胞表面TCR组成分类αβT细胞介导适应性细胞免疫应答,辅助B细胞产生适应性体液免疫应答和参与免疫应答的调节γδT细胞直接识别结合某些肿瘤和病毒感染细胞表面异常表达的膜分子或感染细胞表面CD 1分子提呈的脂类抗原,并通过释放穿孔素、颗粒酶和表达FasL等作用方式杀肿瘤和病毒感染等靶细胞;通过合成分泌多种不同类型的细胞因子发挥免疫调节作用和介导炎症反应(二)根据细胞接受抗原刺激前后状态分类1.初始T细胞在外周免疫器官内接受树突状细胞提呈的抗原肽-MHC分子复合物刺激而活化,并最终分化为效应性T细胞和记忆性T细胞2.效应性T细胞向外周炎症部位或某些器官组织迁移,不参与淋巴细胞再循环3.记忆性T细胞介导再次免疫应答,它们与相应抗原再次相遇后可迅速活化、增殖分化为效应性T细胞和产生新的记忆性T细胞(三)根据细胞功能特点分类1.辅助性T细胞(1)Th1细胞参与细胞免疫应答和免疫调节,具有抗胞内病原体感染的免疫作用;也参与某些自身免疫性疾病,如类风湿关节炎的发生发展和病理损伤过程(2)Th2细胞参与体液免疫应答,同时可诱导B细胞增殖分化,产生IgE类抗体,在抗寄生虫等胞外病原体感染中发挥重要作用;也参与过敏性哮喘等Ⅰ型超敏反应性疾病的发生发展和病理损伤过程(3)Th17细胞具有抗真菌和抗胞外细菌感染的免疫作用;也参与某些炎症性疾病,如炎症性肠炎,银屑病的发生发展和病理损伤过程(4)Tfh细胞高表达共刺激分子CD40L和ICOS,能与B细胞表面CD40和ICOSL结合相互作用有效激活B细胞;并通过合成分泌IL—21和lL—4等细胞因子,促进B细胞增殖分化产生抗体和发烧Ig类别转换2.细胞毒性T细胞特异性杀伤某些肿瘤和病毒感染的靶细胞3.调节性T细胞(1)自然调节性T细胞抑制自身反应性T细胞活化或过度活化,维持机体内环境稳定,发挥免疫自稳作用(2)诱导性调节性T细胞通过释放抑制性细胞因子对细胞免疫产生负向调节作用。
t细胞的分类方法及各亚群的功能

t细胞的分类方法及各亚群的功能T细胞,这个名字听起来有点科幻,像是从未来穿越过来的超级战士,但其实它们在我们身体里非常常见,简直就是我们免疫系统的超级英雄!说到T细胞,它的分类方式和功能也挺有意思的。
你要是搞清楚了,整个免疫系统就像一个精密的机器,每个部分都有自己的职责,毫不马虎。
咱们就来聊聊这些T细胞的“职能”,顺便看看它们是怎么分类的。
首先啊,T细胞可以分为很多种,有些是“特种部队”,负责找出并清除体内的坏蛋(比如细菌、病毒、癌细胞这些)。
有些呢,是“指挥官”,它们负责组织其他免疫细胞的行动,确保大家协同作战。
再有,就是那些看起来好像没啥大用,实际上非常关键的“后勤部队”,负责调节免疫反应,防止免疫系统失控,给自己带来麻烦。
T细胞的种类有点多,所以我就挑几个比较典型的跟你聊聊。
首先得说的是最有名的——辅助性T细胞(CD4+)。
这些家伙就像免疫系统的“指挥官”,它们的任务是帮忙调动免疫系统里的其他细胞,像是B细胞、巨噬细胞这些,告诉它们该做什么,不该做什么。
如果说免疫反应是一个大战,那么这些T细胞就是指挥官,发号施令。
如果没有了它们,免疫系统基本就成了“散兵游勇”,完全没法协调行动。
所以啊,你要是把它们比作导演,那就是没导演的电影,估计最后场面就乱套了。
接下来是细胞毒性T细胞(CD8+)。
它们的任务就是直接“动手”清理那些被感染了的细胞,或者是突变成癌细胞的敌人。
你想,身体里一旦有“坏蛋”,这些细胞就像“特种部队”一样,精准打击,打得敌人毫无还手之力。
它们的作用,简直比超级英雄还厉害,不管是病毒、细菌还是癌细胞,看到这些坏蛋,简直毫不手软,一刀切。
要是没有它们,感染或者癌细胞的扩散速度,估计比兔子还快,身体根本没法抗衡。
然后,还有一种你可能不太了解的T细胞——调节性T细胞(Treg)。
这群家伙呢,其实是免疫系统里的“和平使者”。
免疫系统有时候就像那种不太靠谱的队伍,一激动就冲上去什么都干,完全不管后果,结果可能会把身体自己给伤害了。
EAE小鼠模型的构建以及NKT细胞和Th1Th2细胞因子的作用研究的开题报告

EAE小鼠模型的构建以及NKT细胞和Th1Th2细胞因子的作用研究的开题报告一、研究背景和意义自体免疫性脑炎(EAE)是一种由自身免疫反应引起的中枢神经系统(CNS)炎症性疾病,类似于多发性硬化症(MS)的病理特征和临床表现。
EAE小鼠模型是对EAE病理机制研究的重要手段之一,通过诱导EAE小鼠模型可以模拟出体内自身免疫反应引起的炎症反应和所导致的病理改变。
因此,研究EAE小鼠模型的构建以及NKT细胞和Th1Th2细胞因子的作用对于揭示EAE发病机制、探究自身免疫性疾病发生和发展的分子和细胞生物学机制等具有重要意义。
二、研究内容和方法1. EAE小鼠模型的构建方法:将小鼠用完全弗氏佐剂或免疫佐剂混合获得的抗原佐剂混合物免疫,一般使用myelin基质蛋白(MBP)或proteolipid蛋白(PLP)等神经元特异性蛋白质制备抗原佐剂混合物诱导小鼠发生EAE模型。
2. NKT细胞和Th1Th2细胞因子的作用研究:(1)采用流式细胞术检测EAE小鼠中CD4+T细胞的亚群;(2)采集小鼠脾脏,测定NKT细胞的含量;(3)利用ELISA检测小鼠血清中的Th1Th2细胞因子的水平;(4)采用Western blotting检测小鼠脑组织中相关免疫分子的表达水平。
三、预期成果和意义通过构建EAE小鼠模型和研究NKT细胞和Th1Th2细胞因子的作用,可以对EAE发病机制进行探究,并为MS等自身免疫性疾病的发病和治疗提供一定的参考依据。
同时,该研究还可以为开发新型抗自身免疫性疾病的治疗药物提供实验基础。
四、研究计划和进度安排1.前期工作(1个月):收集相关文献,深入了解EAE模型和NKT 细胞和Th1Th2细胞因子的作用机制。
2.实验室操作(3个月):(1)EAE小鼠模型的构建;(2)对小鼠进行免疫学指标的检测;(3)对小鼠进行神经病理学检查。
3. 数据分析和文献阅读(1个月):收集和整理实验数据,并阅读相关文献对实验结果进行分析和评价。
CD4+T细胞亚群在系统性红斑狼疮发病机制中的研究进展

CD4+T细胞亚群在系统性红斑狼疮发病机制中的研究进展系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多系统损害的慢性自身免疫性疾病,其特征是自身抗体及免疫复合物沉积。
在系统性红斑狼疮的慢性炎症过程中,CD4+T细胞亚群免疫平衡被破坏,尤其是Th1/Th2及Th17/Treg细胞失衡在系统性红斑狼疮的发生和发病机制中发挥关键作用。
本文以免疫紊乱为切入点,分别从细胞计数、细胞因子、基因水平等方面综述系统性红斑狼疮与CD4+T细胞亚群的关系,希望为全面理解系统性红斑狼疮的发病机制以及免疫治疗提供更系统的理论支持。
[Abstract] Systemic lupus erythematosus(SLE)is a chronically autoimmune disease with multiple systemic damages. It is characterized by deposition of autoantibodies and immune complexes. In the process of chronic inflammation of systemic lupus erythematosus,the immune balance of CD4+ T cell subsets is destroyed,especially the imbalance of Th1/Th2 and Th17/Treg cells plays a key role in the occurrence and pathogenesis of systemic lupus erythematosus. In this paper,taking the immune disorders as the starting point,from the cell count,cytokines,gene levels and other aspects respectively,we reviewed the relationship between systemic lupus erythematosus and CD4+ T cell subsets,hoped to provide a comprehensive understanding of the pathogenesis of systemic lupus erythematosus and a more systematic theoretical support for immunotherapy.[Key words] Systemic lupus erythematosus;CD4+ T cellsubsets;Imbalance;Related系統性红斑狼疮(systemic lupus erythematosus,SLE)是一种全身性的自身免疫性疾病,其特征是对抗原的免疫应答和免疫复合物沉积,引起靶器官炎症和组织损伤。
EAE发病机制中MALT1、IL—17作用的探讨

EAE发病机制中MALT1、IL—17作用的探讨目的:通过建立实验性自身免疫性脑脊髓炎(EAE)小鼠模型,观察小鼠脑组织中黏膜相关淋巴组织淋巴瘤转运蛋白1与血清白介素-17(Interleukin-17)的表达情况,并探讨两者在EAE发病机制中的作用。
进一步探究MALTI是否可以作为多发性硬化(MS)的治疗靶点,以便寻找治疗MS的新手段。
方法:将36只C57BL/6雌性小鼠按照随机数字表法分为EAE组和佐剂组各18只,EAE 组采用MOG与完全弗氏佐剂的沫状混合物制备EAE模型,佐剂组仅给予弗氏佐剂。
观察每只实验动物发病情况并每隔2 d进行一次神经功能评分。
分别于免疫后14 d、24 d、40 d两组小鼠随机各取6只,心脏取血并4%多聚甲醛灌注取脑组织。
取小鼠脑组织石蜡切片,免疫组化方法检测各组小鼠脑组织中MALT1并用ELISA法检测血清IL-17表达。
结果:EAE组与佐剂组的小鼠神经功能评分、体重、血清中IL-17含量和脑组织中MALT1蛋白阳性细胞数比较差异均有统计学意义(P<0.05)。
EAE组中24 d组小鼠的神经功能评分(2.50±0.55)分明显高于14 d组的(0.83±0.41)分和40 d组的(1.50±0.32)分,体重(17.04±0.41)g明显少于14 d组的(18.33±0.49)g和40 d组的(18.15±0.13)g,且血清中IL-17含量(288.00±26.45)pg/mL明显高于14 d组的(122.60±10.11)pg/mL和40 d 组的(184.40±29.51)pg/mL,脑组织中MALT1蛋白阳性细胞数(183.80±9.25)个明显多于14 d组的(78.25±9.47)个和40 d组的(133.50±19.87)个,差异均有统计学意义(P<0.05)。
【学前教育】小鼠t 细胞亚分群流式

小鼠t 细胞亚分群流式1️⃣ 引言:T细胞亚群的重要性在免疫学研究中,T细胞作为适应性免疫系统的重要组成部分,扮演着至关重要的角色。
它们不仅能够识别并清除外来病原体,还能调节机体内部的免疫反应,维持免疫稳态。
小鼠作为生物医学研究的常用模型动物,其T细胞亚群的研究对于理解人类免疫系统的功能、疾病机制及免疫治疗策略的开发具有重要意义。
流式细胞术作为一种高效、多参数的细胞分析技术,成为研究小鼠T细胞亚群不可或缺的工具。
2️⃣ 小鼠T细胞亚群分类与流式分析原理小鼠T细胞主要根据CD4和CD8分子的表达被分为两大亚群:CD4⁺ T细胞和CD8⁺ T细胞。
进一步细分,CD4⁺ T细胞包括辅助性T细胞(Th细胞)、调节性T细胞(Treg细胞)等;而CD8⁺ T细胞则主要为细胞毒性T细胞(CTL细胞)。
流式细胞术通过标记细胞表面的特异性抗原或胞内分子,利用激光激发荧光染料,对细胞进行多参数的同时检测。
该技术能够区分不同亚群的T细胞,并分析其活化状态、增殖能力、细胞因子产生等特性,为深入研究T细胞功能提供了强有力的手段。
3️⃣ 小鼠T细胞亚群流式分析的步骤与注意事项步骤概述:样本制备:从小鼠脾脏、淋巴结或血液中分离淋巴细胞,确保细胞活性良好。
抗体标记:根据研究目的选择合适的荧光标记抗体,对细胞进行表面标记和或胞内染色。
流式检测:将标记好的细胞悬液注入流式细胞仪,通过激光激发荧光信号,收集并分析数据。
数据分析:利用专业软件对收集到的数据进行门控分析,识别并区分不同T细胞亚群,进一步分析其功能特性。
注意事项:抗体选择:确保抗体特异性高、交叉反应少,且适合所研究的细胞类型。
样本处理:避免细胞在处理过程中受损,保持细胞活性,减少非特异性染色。
仪器校准:定期进行流式细胞仪的校准和维护,确保数据准确性。
数据分析标准化:建立统一的数据分析流程,确保不同批次实验结果的可比性。
综上所述,小鼠T细胞亚群流式分析技术为研究T细胞功能、疾病机制及免疫治疗策略提供了强有力的支持。
β-榄香烯对EAE小鼠视神经炎治疗作用的研究

β-榄香烯对EAE小鼠视神经炎治疗作用的研究张荣伟;周志可;禹红梅;张惠敏;陈蕾【期刊名称】《中国免疫学杂志》【年(卷),期】2011(027)004【摘要】目的:研究β-榄香烯(β-elemene)对实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠视神经炎的治疗作用;明确β-榄香烯如何通过对辅助性T细胞亚群的分化调节及其特异性细胞因子的转录调节实现其治疗作用.方法:通过行为学、组织形态学技术观察β-榄香烯对EAE 小鼠脱髓鞘性视神经炎的治疗作用,进一步通过ELISA及定量PCR技术观察β-榄香烯对辅助性T细胞亚群特异性细胞因子及转录因子的蛋白及mRNA表达的影响.结果:β-榄香烯能改善EAE小鼠的神经功能评分(与对照组比较,P<0.05);β-榄香烯能减轻EAE小鼠视神经轴索及髓鞘损伤;免疫后11天,β-榄香烯可减少EAE小鼠视神经细胞因子白细胞介素-17(IL-17)、转录因子孤儿核受体(RORγt)的蛋白及mRNA的表达(与对照组比较,P<0.05);同时增加叉头蛋白3(Foxp3)mRNA的表达(与对照组比较,P<0.05).免疫后19天,β-榄香烯可减少EAE小鼠视神经细胞因子γ-干扰素(IFN-γ)、转录因子T-bet的蛋白及mRNA的表达(与对照组比较,P<0.05);并维持Foxp3mRNA的较高水平表达(与对照组比较,P<0.05).结论:β-榄香烯可减轻EAE小鼠视神经的炎症损伤;β-榄香烯可通过调节辅助性T细胞亚群的分化维持机体的免疫平衡.【总页数】5页(P342-346)【作者】张荣伟;周志可;禹红梅;张惠敏;陈蕾【作者单位】中国医科大学附属第一医院老年病干诊科,沈阳,110001;中国医科大学附属第一医院老年病干诊科,沈阳,110001;中国医科大学附属第一医院神经内科,沈阳,110001;中国医科大学附属第一医院老年病干诊科,沈阳,110001;中国医科大学附属第一医院眼科,沈阳,110001【正文语种】中文【中图分类】R741【相关文献】1.榄香烯对肝癌腹水瘤细胞系Hca—F25/CL—16A3抗肿瘤作用机理的实验研究Ⅲ.榄香烯对小鼠血清脂肪酸组分相对百分浓度变化的影响 [J], 左云飞;张红;等2.SPK1基因转染的UCMSC移植对EAE小鼠的治疗作用 [J], 许春阳;张辉;张玉镇;王运良;段海峰;薛鹏;花琳琳;李金凤;刘新珊;张达矜;徐志秀;王姗姗;尹红蕾3.一种新型融合免疫球蛋白-mGE对慢性小鼠EAE治疗作用的分析评估 [J], 程秀丽;张志红;刘风英;马云亭;华冰;周翔鱼4.榄香烯在HuPBL-SCID小鼠体内对人脑胶质瘤协同免疫治疗作用的研究 [J], 黄强;衣服新;兰青;周丽英;王爱东;孙志方5.β-榄香烯对早期实验性变态反应性脑脊髓炎小鼠视神经炎的治疗作用 [J], 张荣伟;陈蕾因版权原因,仅展示原文概要,查看原文内容请购买。
辅助T细胞亚群分化调控机制研究进展

doi:10.3969/j.issn.1000⁃484X.2020.24.020辅助T 细胞亚群分化调控机制研究进展①张笑梅 刘春燕 邵宗鸿② (天津医科大学总医院血液科,天津300052) 中图分类号 R392.12 文献标志码 A 文章编号 1000⁃484X (2020)24⁃3045⁃10①本文为天津市自然科学基金(16JCZDJC35300)项目㊂②通讯作者,E⁃mail:shaozhonghong@㊂作者简介:张笑梅,女,在读硕士,主要从事骨髓衰竭性疾病发病机制方面的研究,E⁃mail:zhangxiaomei_9@㊂[摘 要] 辅助T 细胞在哺乳动物免疫系统中发挥着重要作用,CD4+T 细胞分化为不同的辅助T 细胞对正常免疫调节和宿主防御至关重要㊂这些精心调控的分化过程由不同细胞因子㊁转录因子㊁表观遗传修饰及代谢等参与控制,从而产生多个CD4+T 细胞亚群,包括Th1㊁Th2㊁Th9㊁Th17㊁滤泡辅助性T 细胞(Tfh)㊁Th22和调节性T 细胞(Treg)㊂辅助T 细胞的异常分化可能参与炎症和自身免疫性疾病的发病机制㊂本文探讨不同细胞因子㊁转录因子㊁表观遗传修饰及代谢在决定特定Th 细胞分化中的作用,包括IL⁃2在促进或抑制Th 分化中的作用,并讨论了不同亚群分化造成的免疫功能紊乱而引起的自身免疫性疾病,从而为开发新的疾病治疗方法提供思路㊂[关键词] 辅助T 细胞;细胞因子;转录因子;表观遗传修饰;代谢;自身免疫性疾病Progression in regulatory mechanism of helper T cell subsetsZHANG Xiao⁃Mei ,LIU Chun⁃Yan ,SHAO Zong⁃Hong .Department of Hematology ,General Hospital of Tianjin Medical University ,Tianjin 300052,China[Abstract ] Helper T cells play an important role in the immune system of mammals,and the differentiation of CD4+T cells intodifferent helper T cells is essential for normal immune regulation and host defense.These well⁃regulated differentiation processes are controlled by different cytokines,transcription factors,epigenetic modifications and metabolism,resulting in multiple CD4+T cell subsets,including Th1,Th2,Th9,Th17,follicular helper T cells (Tfh),Th22,and regulatory T cells (Treg).Abnormal differentiation of helper T cells may be involved in the pathogenesis of inflammatory and autoimmune diseases.In this review,we discusses the different cytokines,transcription factors,epigenetic modifications and metabolism in determining specific Th the role of cell differentiation,including IL⁃2to promote or inhibit the role of Th differentiation,and discusses the different subgroup differentiation caused by immunedysfunction of autoimmune disease,which provide ideas for the development of new diseases treatment.[Key words ] Helper T cells;Cytokines;Transcription factors;Epigenetic modifications;Metabolism;Autoimmune diseases 在过去20年里,Th 亚群家族不断扩大,目前包括Th1㊁Th2㊁Th9㊁Th17㊁滤泡辅助性T 细胞(Tfh)㊁调节性T 细胞(Treg)和Th22细胞㊂这些亚群主要由每个亚群表达的细胞因子㊁转录因子㊁表观遗传修饰及代谢等复杂的调控网络参与诱导㊂原始CD4+T 细胞分化在很大程度上取决于与淋巴器官树突状细胞(DCs)的相互作用,其中细胞因子在Th 细胞分化的早期阶段起着重要的监管作用;为了更好地了解CD4+T 细胞分化的复杂机制,有必要了解在分化过程中的转录因子结合谱,讨论T 细胞分化中的转录因子,包括STAT 蛋白,主调控因子及IRF4复合物等;表观遗传调控指的是不改变DNA 序列通过DNA 甲基化㊁组蛋白修饰和非编码RNA 介导的调控等多种修饰而改变基因表达的行为㊂越来越多的证据表明表观遗传修饰能够通过与转录因子之间的合作来确定不同亚群T 细胞的分化;另外为适应环境应缴源,T 细胞进行代谢重塑,通过调整其细胞代谢,来调节淋巴细胞信号传导,并影响其分化和功能,如发育或分化㊁细胞因子的产生和细胞迁移㊂因此,本文旨在总结目前关于Th 细胞亚群在细胞因子㊁转录因子㊁表观遗传学及代谢水平上发育和分化的分子调控知识,阐明Tfh 细胞生物学,探讨不同亚群分化造成的免疫功能紊乱而引起的自身免疫性疾病及相关药物研发进展,为今后的临床干预提供潜在靶点㊂1 T 细胞亚群分化机制1.1 Th1细胞分化机制1.1.1 细胞因子 Th1细胞主要产生IFN⁃γ帮助宿主防御细胞内病原体(包括病毒㊁细菌)㊂IL⁃12通过上调T⁃bet使得原始CD4+T细胞向Th1方向发展;同时,IL⁃12激活STAT4,活化的STAT4与T⁃bet 结合促进INF⁃γ产生㊂研究表明,由于IL12B(编码IL⁃12p40亚单元,如IL⁃12和IL⁃23)㊁IL12RB1(编码β1链作用于IL⁃12和IL⁃23受体)㊁IRF8(与产生IL⁃12的树突状细胞有关)和ISG15(与IL⁃12协同作用的分子)突变,受试者缺乏功能性IL⁃12和/或IL⁃12受体的表达,导致Th1细胞传代严重受损[1]㊂INF⁃γ是Th1细胞产生的主要细胞因子,INF⁃γ通过STAT1激活进一步促进T⁃bet的表达,形成正反馈回路,共同促进Th1细胞的分化[1]㊂INFγ⁃STAT1⁃T⁃bet通路是促进Th1体外分化的一种强有力的扩增机制㊂IL⁃2也参与调节Th1细胞分化[2],它通过诱导IL⁃12Rβ2链(IL⁃12受体的组成部分,增强对IL⁃12的反应)的表达导致Th1分化;IL⁃2也上调Tbx21的表达,从而稳定Th1系[3]㊂1.1.2 转录因子 T⁃bet是参与Th1分化的主要转录因子,其表达同时受TCR㊁IFN⁃γ和IL⁃12R信号转导途径的控制㊂T⁃bet能够促进IFN⁃γ表达,同时抑制Th2㊁Th17细胞分化㊂与促进Th1细胞分化相比,T⁃bet分别通过抑制GATA3和RORγt的功能来抑制Th2和Th17的分化[4]㊂同时T⁃bet可以与其他转录因子形成复合物,进一步增强Th1基因的表达㊂T⁃bet可以与Bcl⁃6形成抑制复合物,通过负调控Socs1㊁Socs3和Tcf7促进Th1细胞发展[5];此外, T⁃bet与runt相关转录因子3(RUNX3)协同诱导Ifng表达,同时抑制Th1细胞中Il4表达;T⁃bet与RUNX1相互作用,阻止RUNX1与RORγt结合从而抑制Th17分化[5];T⁃bet能够诱导HLX(一种同源框蛋白)并与之相互作用促进Th1细胞表达IFN⁃γ㊂T⁃bet本身并没有抑制Tfh细胞分化的功能,但它可以降低Tfh对B细胞提供辅助功能的作用㊂另外, STAT1和STAT4也是参与Th1分化的重要转录因子,它们分别被IFN⁃γ和IL⁃12激活,诱导Tbx21基因,编码T⁃bet,T⁃bet进一步驱动Th1分化,促进IFN⁃γ表达,从而形成正反馈循环㊂1.1.3 表观遗传修饰 表观遗传修饰可以通过DNA甲基化调节Th1细胞因子表达来指导Th1细胞分化㊂IFN⁃γ基因位点可实现DNA去甲基化和组蛋白H3乙酰化或三甲基组蛋白H3赖氨酸4 (H3K4me3)等修饰,T细胞免疫球蛋白和黏蛋白域蛋白3(TIM⁃3)偶尔在Th1细胞中发现,提示一些潜在机制可能与TIM⁃3和Th1细胞有关㊂DNA甲基化分析确定TIM⁃3启动子内的CpG岛受DNA甲基化的调控㊂体外诱导分化的Th1细胞在TIM⁃3启动子的特定区域均表现出DNA去甲基化,提示TIM⁃3启动子区域编码的某些基因表达增加,促进了Th1细胞的分化[6]㊂新近研究生长因子独立性1(Gfi1)在Th1细胞中的作用,发现与Th1相关的转录因子Gfi1呈负相关㊂Gfi1与Th1细胞的转录因子结合,使得与基因抑制密切相关的组蛋白H3K4甲基化表达降低[7]㊂Dicer是获得成熟miRNA所必需的RNaseⅢ酶,在缺乏Dicer的Th细胞中,IFN⁃γ和T⁃bet的强烈分泌表明miRNAs在分化阶段起负作用㊂miR⁃29在原始T细胞中的表达增加,对Th1细胞的分化有明显的抑制作用,miR⁃29a在转基因小鼠中的表达降低可提高血清IFN⁃γ水平,提示miR⁃29a 通过调节IFN⁃γmRNA的表达而发挥作用㊂1.1.4 代谢调节 CD4+T细胞向效应细胞的激活和分化伴随着从氧化磷酸化到糖酵解的代谢转变㊂有氧呼吸在Th1CD4+T细胞功能中的重要性也通过CD4+T细胞中乳酸脱氢酶(LDHA)的缺失得到了证实,激活的细胞调控其新陈代谢水平回到氧化磷酸化水平,随后通过影响组蛋白乙酰化来降低IFN⁃γ产生㊂从糖酵解到氧化磷酸化的转变使乙酰⁃CoA 进入TCA途径,从而减少可用性的组蛋白乙酰化作用和激活IFN⁃γ位点[8]㊂Th1CD4+T细胞对糖酵解的依赖减少了通过线粒体氧化磷酸化(OxPhos)产生的有害ROS的累积㊂虽然CD4+T细胞激活需要较低水平的活性氧,但长期暴露于活性氧会通过改变DNA修复和信号通路的成分导致细胞死亡[9]㊂Th1CD4+T细胞的糖酵解和氧化能力也依赖于转录因子IRF4㊂在Th1CD4+T细胞,IRF4缺失会导致GLUT3和己糖激酶2表达降低,同时降低IFN⁃γ+ CD4+T细胞的表达[10]㊂在最近的一项研究中, CD4+T细胞的氨基酸代谢以及糖酵解和OxPhos依赖于ATF4,这是一种被氧化和内质网应激激活的转录因子[11]㊂ATF4缺乏症可以扰乱包括细胞ROS 水平在内的多种途径㊂在体外Th1极化条件下, ATF4缺乏的CD4+T细胞在氧化还原㊁增殖分化㊁细胞因子产生方面存在缺陷,使得INF⁃γ降低;T⁃bet 表达更低而Foxp3的表达更高[11]㊂在实验性自身免疫性脑炎(EAE)小鼠模型中,ATF4缺乏降低了Th1,但增加了Th17CD4+T细胞的分化,导致疾病严重程度的增加[11]㊂1.2 Th2细胞分化机制1.2.1 细胞因子 Th2细胞参与对细胞外寄生虫包括蠕虫的过敏反应和宿主防御[12],能够产生IL⁃4㊁IL⁃5㊁IL⁃6和IL⁃13等细胞因子㊂Th2细胞的分化是在IL⁃4存在下通过TCR刺激诱导的㊂IL⁃4是参与Th2细胞分化的主要细胞因子,它通过阻断IL⁃12和IFN⁃γ来增强Th2分化㊂同时,IL⁃4激活STAT6进而诱导GATA3表达,可以促进Th2细胞分化,也有助于维持Th2表型㊂在大部分CD4+T细胞亚群中,IL⁃2的作用是促进增殖,而在Th2细胞中,IL⁃2在驱动原始T细胞向Th2细胞分化中起着重要的驱动作用,IL⁃2激活STAT5信号通路,通过调节TCR诱导的IL⁃4Rα表达,进而调节Th2细胞的早期分化㊂在体外Th2细胞分化8h内,与Il4ra位点结合的STAT5A和STAT5B明显,通过诱导IL⁃4Ra的表达,增强IL⁃4的反应,导致IL⁃2到IL⁃4信号级联[2,13]㊂此外,IL⁃2促进STAT5A和STAT5B在Il4/ Il13Th2细胞因子基因座的多个位点结合,从而增加Th2细胞的产生[13]㊂1.2.2 转录因子 GATA3是指导Th2细胞分化的主要转录因子,IL⁃4以STAT6依赖的方式诱导GATA3表达,GATA3进一步促进IL⁃4⁃IL⁃5⁃IL⁃13位点向开放构象发展㊂使得其他转录因子能够进入该位点参与Th2细胞分化㊂IL⁃4高水平表达和GATA3表达的自激活形成了正反馈回路,进一步诱导了GATA3的表达和Th2的分化㊂同时,GATA3诱导c⁃Maf表达,刺激c⁃Maf促进Th2分化[14]㊂STAT6作为参与Th2细胞分化的另一个重要的转录因子,在细胞因子IL⁃4的激活下诱导GATA3表达,进而促进Th2细胞分化;同时通过抑制STAT4表达和RUNX3介导的Ifng表达进而抑制Th1细胞标志性细胞因子IFN⁃γ转录㊂另外,其他转录因子也参与Th2细胞分化,转录因子DEC2在Th2细胞中表达,并通过与启动子结合来增强GATA3表达[15]㊂IRF4与NFATc2协同调控Il4基因表达,进而促进Th2细胞分化[16]㊂1.2.3 表观遗传修饰 DNA甲基化也可以通过调节Th2细胞因子的表达来指导Th2细胞分化㊂Th2细胞因子位点可获得抑制性组蛋白修饰和DNA甲基化㊂同样体外诱导分化的Th2细胞在TIM⁃3启动子的特定区域均表现出DNA去甲基化,提示TIM⁃3启动子区域编码的某些基因表达增加,促进了Th2细胞的分化[6]㊂Th2细胞分化受Il4位点组蛋白修饰和顺式调节元件的参与控制㊂组蛋白高乙酰化可能与记忆性Th1和Th2细胞中Ifng和IL4基因启动子区的开放染色质状态有关㊂大量研究报道了组蛋白H3乙酰化㊁Lys⁃4三甲基化(H3K4me3)和trithorax G(TrxG)在Th2细胞分化中的重要作用㊂TrxG复合物的产生是在GATA3启动子区激活STAT6时发生的㊂与Th1细胞相比,miRNA对Th2细胞分化的调控仍需进一步研究㊂研究证实了miR⁃21在T细胞体外促进Th2细胞分化的作用[17],而在miR27或miR128的调控下,IL⁃4和IL⁃5的分泌减少[18]㊂1.2.4 代谢调节 活化的Th2CD4+T细胞也依赖糖酵解进行分化并发挥功能㊂RhoA是Rho家族小分子量G蛋白的成员之一,具有GTP酶活性,与GTP结合作用于细胞内的效应因子,是Th2CD4+T 细胞糖酵解潜在的关键调节器㊂RhoA缺失T细胞使得Th2分化缺陷从而减少过敏性气道炎症,这与IL⁃4R㊁GATA3和磷酸化STAT6水平较低有关[19]㊂mTORC1通路也调节活化Th2CD4+T细胞的糖酵解能力,但与Th1CD4+T细胞不同,Rheb的缺失并没有减少Th2CD4+T细胞的糖酵解[20],相反,IL⁃4R㊁IL⁃2Ra和GATA3的表达减少证明了Raptor缺失的mTORC1抑制显著减少了Th2CD4+T细胞的糖酵解,并削弱了Th2的分化[21]㊂但是当前研究对于糖酵解和相关调节因子如何影响Th2CD4+T细胞相关的细胞因子㊁受体和转录因子的表达仍不清楚㊂1.3 Th9细胞分化机制1.3.1 细胞因子 Th9细胞作为辅助T细胞的一种亚型,能够产生IL⁃9,参与自身免疫性疾病㊁过敏性反应和抗肿瘤免疫[22]㊂原始CD4+T细胞在TGF⁃β和IL⁃4同时存在的情况下分化为产生IL⁃9的Th9细胞,而不产生其他Th2类细胞因子,从而发现TGF⁃β和IL⁃4在Th9细胞分化中发挥重要作用㊂其中IL⁃4是诱导Th9细胞最重要的一种细胞因子, IL⁃4通过下游转录因子如STAT6㊁PU.1和IRF4促进Th9细胞分化㊂在仅有IL⁃4存在的条件下,诱导原始CD4+T细胞向Th2细胞分化,IL⁃4联合TGF⁃β能够刺激原始CD4+T细胞向Th9细胞分化㊂而在IL⁃4缺失的情况下,TGF⁃β能够诱导其向Treg分化[23]㊂当IL⁃4与其受体结合,进而激活STAT6,促进BATF和IRF4表达[24,25]㊂TGF⁃β信号通路在Th9细胞中可诱导Smad活化和PU.1的表达[25]㊂IL⁃2也对Th9细胞的分化及IL⁃9的产生有重要作用,IL⁃2与受体结合后诱导STAT5的活化,从而促进Th9细胞的分化,阻断IL⁃2或抑制STAT5可导致IRF4和PU.1的表达下降,抑制Th9细胞的分化[24⁃26]㊂1.3.2 转录因子 PU.1和IRF4是参与Th9细胞分化的主要转录因子㊂ETS家族转录因子富含嘌呤盒1(PU.1)是Th9特异性转录因子[25]㊂PU.1通过与Il9启动子结合以及PU.1招募组蛋白乙酰转移酶调控Il9位点的染色质重构发挥调控作用[25],通过调节GATA3抑制Th2的表达,促进Th9的发育, PU.1缺失小鼠CD4+T细胞IL⁃9的产生会受到影响[27]㊂IRF4是Th2细胞中IL⁃4的作用靶点,同时对Th9的发育也有影响,IRF4与Il9基因直接作用, IRF4缺陷小鼠原始CD4+T细胞在Th9极化过程中抑制了IL⁃9的表达,而siRNA介导的IRF4沉默则减弱了IL⁃9的表达㊂AP⁃1家族成员BATF直接与Il9基因结合,表现出与IRF4的协同作用㊂在IL⁃4/ STAT6信号缺失的情况下,IRF4的异位表达未能挽救IL⁃9的表达,提示了Th9细胞发育需要IL⁃4下游其他转录因子㊂另外STAT5与STAT6也是Th9分化的重要转录因子㊂最近IL⁃2⁃JAK⁃STAT5信号通路被证明对Th9分化至关重要㊂在Il9启动子上具有关键的STAT5结合位点,IL⁃2通过诱导STAT5与Irf4启动子结合,从而促进IRF4的表达;除IL⁃2,细胞因子TSLP也能激活STAT5,已经证实TSLP诱导Th9分化过程中活化STAT5的表达,从而导致IL⁃9的产生㊂STAT6在Th9发育中的作用已经确定:IL⁃4介导的STAT6激活通过抑制Foxp3和T⁃bet的表达来促进Th9发育,而Foxp3和T⁃bet则可以抑制IL⁃9的产生,STAT6也促进了IRF4表达,如上所述, IRF4促进Th9分化;磷酸化的STAT6还能促进GATA3表达,在缺少STAT6的情况下,IL⁃9的产生受到严重损害㊂1.3.3 表观遗传修饰 最近一项研究显示通过抑制甲基化诱导Th9特异性PU.1表达,相反,阻止组蛋白乙酰化降低IL⁃9诱导刺激后PU.1的表达,表明PU.1的表观遗传修饰在调节Th9分化方面是独特的[28]㊂Smad2或Smad4缺乏可导致T细胞IL⁃9表达受损,这可能是由于抑制染色质修饰组蛋白H3K27三甲基化和增强EZH2与IL⁃9细胞的结合所致[29]㊂最近的一项研究发现,ETS转录因子ETS 变异体5(ETV5)需要在Il9基因启动子内富集组蛋白乙酰转移酶(HATs)来增强IL⁃9+Th9细胞㊂体外研究表明,在没有ETV5的情况下p300降低,同时IL⁃19启动子中富含组蛋白H3乙酰化和H4K16乙酰化[30]㊂1.4 Th17细胞分化机制1.4.1 细胞因子 Th17细胞作为辅助T细胞的一种亚型,能够介导抗真菌感染和细胞外细菌免疫㊂2006年首次报道小鼠CD4+T细胞在IL⁃6和TGF⁃β联合作用下表达IL⁃17㊂然而,人们发现这两种细胞因子组合不会诱导人类CD4+T细胞表达IL⁃17㊂通过TCR刺激TGF⁃β㊁IL⁃6㊁IL⁃23㊁IL⁃21㊁IL⁃1β及STAT3信号驱动诱导原始CD4+T细胞分化为Th17细胞产生标志性的细胞因子IL⁃17A㊁IL⁃17F㊁IL⁃21㊁IL⁃22以及GM⁃CSF[31],促进免疫反应的发生,也易引起自身免疫性疾病[31,32]㊂在TGF⁃β和IL⁃6诱导下,初始Th17细胞发生极化㊂IL⁃23通过STAT3激活介导的IL⁃23受体信号进一步调节Th17细胞极化,为Th17细胞的维持㊁扩张和正常功能提供一个正反馈通路㊂近年研究发现,TGF⁃β在人类Th17细胞发育中确实发挥着至关重要的作用,TGF⁃β通过SMADS磷酸化诱导RORγt及原始T细胞㊁IL⁃23R 和IL⁃1R表达,使其对IL⁃23和IL⁃1β敏感;IL⁃6与其受体IL⁃6R结合,激活STAT3信号通路和IL⁃21表达,然后IL⁃21和IL⁃6进一步维持RORγt和RORa表达所必需的STAT3信号通路,Foxp3的过表达导致IL⁃17A的表达降低,IL⁃6能够抑制Foxp3的表达,从而间接促进IL⁃17的表达㊂IL⁃21是Th17细胞分泌的一种效应细胞因子,它通过一个自放大环促进Th17的发育㊂相关研究表明,在STAT3激活的细胞因子中,IL⁃6在小鼠中占据主导地位,而IL⁃23在人类Th17细胞中发挥重要作用,IL⁃23在小鼠体内与Th17成熟为炎症细胞有关,既往研究表明,IL⁃2抑制小鼠体外及体内IL⁃17表达,其机制作用在IL⁃2⁃STAT5信号通路:①STAT5与STAT3竞争结合到IL17a基因位点上;②IL⁃2抑制IL⁃6受体表达;③IL⁃2促进T⁃bet表达,从而抑制RORγt的表达[33]㊂然而IL⁃2可以在体外促进人Th17细胞发育,此机制目前还有待研究[34]㊂1.4.2 转录因子 RORγt作为维甲酸相关孤儿核激素受体家族是Th17细胞的特异性转录因子㊂RORγt对Th17起主要调节作用,RORγt直接结合到IL⁃17A的启动子区域,从而调节其转录[35⁃37]㊂在RORγt缺失小鼠中IL⁃17的产生减少,但RORγt的表达本身不足以驱动Th17细胞分化,STAT3激活对IL⁃17和IL⁃21的正常表达至关重要[36,37]㊂在IL⁃6和TGF⁃β的共同作用下,STAT3被激活,激活的STAT3诱导RORγt的表达进而促进Th17细胞分化[38]㊂1.4.3 表观遗传修饰 IL⁃17A启动子区域的DNA 在原始或Th1细胞中高度甲基化,这些细胞都与IL⁃17A的非活性状态一致[39]㊂许多研究都提到了DNA甲基化在维持Foxp3基因稳定表达与Treg细胞功能相关方面的关键作用㊂最近的研究表明, TET酶家族与TGF⁃β诱导的Treg细胞中Foxp3的长期表达呈正相关㊂某些特定分子(如Vitamin c)靶向TET酶,促进5mC氧化为5hmC,这与DNA去甲基诱导的Foxp3基因过表达密切相关[40]㊂Treg特异性去甲基化区(TSDR)是Foxp3基因的一个特征性片段㊂新的证据证明TSDR只能在稳定的Treg细胞表型中被检测到㊂研究还发现,自然Treg细胞中聚集了一个整体去甲基化的轮廓,但效应T细胞除外,显示TSDR是检测Treg细胞的有效生物标记物[41]㊂最近的研究已经破译了一系列的低甲基化基因(Foxp3㊁Ctla4㊁Ikzf4和Ikzf2)也受到Foxp3启动子区允许的组蛋白修饰的调节[42⁃45]㊂另外研究显示DNA低甲基化可能增加Foxp3等调控基因的表达[46]㊂CBP和p300是两种组蛋白乙酰转移酶,在稳定Treg细胞系和分化方面发挥了重要作用[47]㊂组蛋白脱乙酰酶(HDACs)是产生组蛋白脱乙酰的重要酶,当CD4+T细胞缺乏HDAC5时,细胞产生减少,Treg细胞减少[48]㊂1.4.4 代谢调节 通过液相色谱和气象色谱分析表明,Th17CD4+T细胞中丙酮酸和乳酸水平更高而在Treg细胞亚群中柠檬酸中间体水平更高但长链脂肪酸的水平较低,表明了糖酵解㊁OxPhos和FAO 在不同T细胞亚群之间的差异[49]㊂通过抑制或去除PDH抑制剂PDHK1[丙酮酸脱氢酶(PDH)激酶1]来增加丙酮酸氧化,增加OxPhos产生的ROS 水平,选择性地将Th17CD4+T细胞的分化转移到Treg表型[49]㊂Franchi等[50]发现Th17细胞体内糖酵解和PDHK1生成的水平更低,体内Th17细胞在产生细胞因子后主要依靠OxPhos㊂Cdc42是Rho家族的GTPase,是Th17CD4+T细胞糖酵解的另一修饰因子㊂Cdc42缺失使得致病Th17细胞的分化增强,表现为RORγt㊁IL⁃17㊁IL⁃23R和IFN⁃γ增加;同时减少Treg发展和稳定降低,并增加对肠道的损伤和炎症[51]㊂除了葡萄糖,Th17CD4+T细胞也可以通过谷氨酰胺分解利用谷氨酰胺作为能量来源㊂这个过程是由转录因子ICER调节,通过控制表达GLS1(一种酶,能够使谷氨酰胺转化为谷氨酸和天冬氨酸,随后转化为丙酮酸㊁α酮戊二酸)完成[51]㊂另外一些信号蛋白和转录因子也对Th17细胞反应的代谢变化进行了精细的调控,例如IL⁃23通过下调清道夫受体CD5L的表达引起Th17细胞致病; Th17CD4+T细胞利用的生物能途径也依赖于环境,并受到环境因素的影响,高脂肪饮食的小鼠体内Th17CD4+T细胞的频率更高,对自身免疫性疾病的易感性也更高,如EAE或DSS诱发的结肠炎在肥胖小鼠体内加重[52,53]㊂1.5 Tfh细胞分化机制1.5.1 细胞因子 Tfh细胞是一种新型的辅助T细胞,能够促进B细胞分化成熟,诱导生发中心,促进浆细胞和记忆B细胞的成熟[54]㊂最近研究表明, IL⁃6㊁IL⁃12㊁IL⁃21等细胞因子在Tfh细胞发育中起着至关重要的作用㊂在小鼠中,IL⁃6㊁IL⁃21通过激活STAT3调节Tfh细胞,IL⁃12参与其中的早期过程㊂而在人体中,IL⁃12通过激活STAT4促进Bcl⁃6表达,并且诱导原始CD4+T细胞高表达IL⁃21㊁ICOS㊁CXCR5的作用更加明显[55,56]㊂缺乏IL12Rβ1 (IL⁃12受体β1链,是IL⁃12和IL⁃23的一种常见受体)的受试者显示出血液中记忆Tfh细胞和记忆B 细胞减少以及淋巴结GC形成的改变[56]㊂另外, TGF⁃β在人类Tfh分化中也起着重要作用,首先在TGF⁃β的参与下,IL⁃12与IL⁃23通过刺激原始CD4+ T细胞促进多种Tfh分子(包括CXCR5㊁IL⁃21和Bcl⁃6)的表达[55,56];另外TGF⁃β也通过强烈抑制Blimp⁃1(一种抑制Bcl⁃6功能的转录抑制因子)的表达促进Tfh的产生[55]㊂然而在小鼠模型的研究中TGF⁃β抑制IL⁃21㊁ICOS以及Bcl⁃6的表达[55];另外,TGF⁃β通过miR⁃10a负性调节影响Bcl⁃6表达[57]㊂表明TGF⁃β的正向调节可能局限于人体体外研究㊂1.5.2 转录因子 Bcl⁃6是识别Tfh的标志之一, Bcl⁃6缺失的CD4+T细胞不能分化为Tfh细胞,提示Bcl⁃6是Tfh特异性转录因子㊂Bcl⁃6在Tfh中的强制表达可促进CXCR5㊁CXCR4和PD⁃1的表达㊂一项研究显示Bcl⁃6以IL⁃21和IL⁃6独立的方式调控Tfh细胞早期分化㊂Bcl⁃6可以与多种迁移相关基因的启动子和增强子结合(如CCR7㊁CCR6㊁CXCR5㊁CCR4㊁PD⁃1㊁PSGL⁃1)[58]㊂Blimp⁃1在Tfh细胞分化中起拮抗作用,并且是其他效应细胞如Th1㊁Th2㊁Th17及Treg的重要转录因子㊂在小鼠研究中, Blimp⁃1缺失的CD4+T细胞在体内优先发育为Tfh 细胞,而Blimp⁃1表达的CD4+T细胞不能帮助生发中心的形成㊂因此,与其他效应细胞由Blimp⁃1参与调控分化不同,Tfh细胞分化是由Bcl⁃6调控[59]㊂此外,Blimp⁃1表达的同时能够抑制Bcl⁃6的表达,表明Bcl⁃6和Blimp⁃1是Tfh细胞的拮抗调节因子㊂STAT3被发现对Tfh分化至关重要,小鼠STAT3缺失T细胞中IL⁃21减少,STAT3突变也减少了体内Tfh细胞的产生[59]㊂同时,在CD4+T细胞STAT3敲除小鼠中,在KLH免疫后,发现几个CXCR5+Tfh细胞有GCs缺陷以及IgG和IgM抗体减少[60]㊂在STAT3缺失小鼠中,Cxcr5和Icos基因表达下调而Blimp⁃1的表达上调[61]㊂更直接的证据是,STAT3可以与Ikaros锌指转录因子Aiolos形成复合物调节Bcl⁃6的表达[62]㊂如上所述,已经发现TGF⁃β对STAT3和STAT4启动Tfh细胞分化提供了重要信号,强调了STAT3在Tfh细胞发育中的重要作用㊂1.5.3 表观遗传修饰 Tfh细胞的分化同样受到表观遗传修饰调控㊂通过DNA去甲基化,与基因位点结合的Bcl⁃6分别与转运甲基胞嘧啶双加氧酶1 (TET1:一种羟甲基转移酶)和5⁃羟甲基胞嘧啶(5⁃hmC)减少有关[63],而IL⁃21增加TET2在Bcl⁃6启动子区的富集,从而解释了狼疮T细胞中Bcl⁃6水平的升高[64]㊂甲基化的H3K27已被报道可以阻止基因表达,而H3K27me3去甲基化酶UTX可以维持细胞和抗体的产生[65]㊂Tfh细胞的Bcl⁃6位点检测到了阳性组蛋白修饰,但其他Th亚群的Bcl⁃6位点则是阴性标记㊂在Tfh细胞中,miR⁃17⁃92簇下调,这可能导致Bcl⁃6的过度表达,而miR⁃155能调节miR⁃146a缺陷小鼠Tfh细胞的积累,导致Tfh细胞的异常积累[66]㊂miR⁃146a可直接靶向ICOS,miR⁃146a的丢失介导ICOS的过度表达导致Tfh细胞的自发和自主积累[67]㊂越来越多的证据表明,Tfh细胞具有可塑性,这可以通过表观遗传调控来解释㊂1.6 Th22细胞分化机制1.6.1 细胞因子 Th22细胞是一类参与固有免疫和适应性免疫的新型辅助T细胞㊂Th22细胞最初在2009年被发现,能够分泌多种细胞因子,最重要的是IL⁃22㊂另一方面,Th22细胞可以表达趋化因子受体CCR4㊁CCR6㊁CCR10和成纤维细胞生长因子亚型㊂Th22细胞不表达IL⁃17㊁IFN⁃γ和IL⁃4等细胞因子[68],在人类中,细胞因子IL⁃23㊁IL⁃12㊁IL⁃6及TNF⁃α促进IL⁃22的表达,而TGF⁃β抑制其表达,这可能归因于TGF⁃β激活的转录因子c⁃Maf的抑制功能[69]㊂1.6.2 转录因子 如上所述,Th22细胞不表达IFN⁃γ㊁IL⁃17及IL⁃4等细胞因子,也不表达T⁃bet (Th1相关转录因子)㊁GATA3(Th2相关转录因子),仅表达少量RORγt(Th17相关转录因子),然而,转染RORγt并不促进人类CD4+T细胞表达IL⁃22㊂已经发现一种独特的转录因子芳烃受体(AHR)介导Th22细胞的发育[70]㊂研究表明,刺激AHR可以通过notch信号促进IL⁃22产生[71]㊂1.6.3 表观遗传修饰 当前关于表观遗传修饰调控Th22细胞分化的研究还没有一个明确的进展,有待深入研究,挖掘之间的相互关系,从而为Th22细胞分化调控机制的多方面了解提供基础,为Th22细胞在自身免疫性疾病的发病机制研究提供帮助㊂1.7 Treg细胞分化机制1.7.1 细胞因子 Treg细胞的作用是限制免疫反应,从而防止自身免疫和其他有害的免疫反应㊂根据起源不同,Treg被分成两个不同的子集,包括自然Treg(nTreg)细胞和适应性Treg(iTreg)细胞,nTreg细胞来自胸腺,iTreg细胞来自外周T细胞㊂胸腺发育依赖于TCR联合CD28共刺激,CD28对周围nTreg稳态增殖和存活也至关重要㊂相比之下, iTreg的发展需要IL⁃2和TGF⁃β参与㊂TGF⁃β信号转导磷酸化激活转录因子SMAD2和SMAD3,然后与Foxp3位点结合,诱导Foxp3基因的表达,促进Treg细胞分化;IL⁃2信号磷酸化STAT5,STAT5与Foxp3位点结合,诱导Foxp3表达,维持Treg细胞的稳定㊂1.7.2 转录因子 Foxp3是Treg的重要转录因子,对维持Treg的功能和谱系特征至关重要㊂Foxp3的转录能够被STAT5激活,IL⁃2激活的STAT5通过直接与Foxp3基因结合并诱导其表达,在维持Treg分化过程中发挥重要作用㊂TGF⁃β减少Foxp3基因中关键CpG岛甲基化,从而使Foxp3的表达增加㊂另外Foxp3可以绑定并阻止RORγt功能,进而减少Th17细胞的发展㊂RUNX1通过与Foxp3结合促进诱导Treg,形成RUNX1/Foxp3复合物维持Foxp3表达㊂在缺乏Foxp3的情况下,RUNX1和RORγt相互作用占据优势,增强Th17细胞分化和IL⁃17表达㊂近年来,多项研究发现一些转录因子可以通过作用于Foxp3基因调节Treg表达㊂NF⁃κB家族成员c⁃Rel绑定到Foxp3启动子上一个保守的非编码序列CNS3,促进Foxp3基因的表达㊂NFAT和SMAD3是诱导Foxp3基因表达并调控CD4+CD25+Treg分化的关键转录因子,两者都是Foxp3增强子区域组蛋白乙酰化和Foxp3表达诱导的重要因素㊂转录因子BACH2作为免疫激活的广泛调节因子,帮助维持Treg细胞,同时抑制与CD4+T细胞其他效应群分化相关的基因[72,73],缺失BACH2的情况下,Treg细胞的FOXP3表达数量减少[73]㊂Nr4a核受体也被证明对Treg细胞的发育至关重要,Nr4a核受体激活Foxp3启动子[74],Nr4a缺陷小鼠由于严重的自身免疫而早亡㊂GATA⁃3通过直接结合和促进Foxp3基因顺式调控元件的活性来控制Foxp3的表达[75]㊂转录因子ETS⁃1可与Foxp3内含子增强子相互作用,是nTreg细胞发育所必需的[76]㊂1.7.3 表观遗传修饰 与Tconv细胞相比,Treg细胞具有独特的增强子结构和DNA甲基化模式,它与Tconv细胞共享大多数活性增强子和DNA低甲基化区域,但只有少数Treg特征基因周围被发现是Treg细胞特异性的,如Foxp3㊁Il2ra和Ctla4[77,78]㊂。
浅论不同神经功能评分标准在小鼠EAE模型评价中的比较

浅论不同神经功能评分标准在小鼠EAE模型评价中的比较【摘要】目的:比较不同的神经功能损伤评分标准对小鼠实验性自身免疫性脑脊髓炎运动功能障碍评估的效能。
方法:应用MOG35-55多肽加完全福氏佐剂乳化后免疫20只C57BL/6小鼠,复制EAE小鼠模型,并使用3种不同的评分标准观察和评估实验动物的发病情况,对实验小鼠在发病初期、高峰期的神经功能障碍进行定量的功能损伤评价。
结果:3种评分标准比较,在发病初期,15分法和7分法评估神经损伤症状的敏感性相当,比5分法高;高峰期,以症状评分与病理评分的相关性程度来比较3种评分法的效度,15分法效度最高,7分法次之。
结论:Weaver’s 15分法评价EAE模型神经功能损伤症状,具有明显的优势,推荐作为今后EAE研究的首选评分法。
【关键词】实验性自身免疫性脑脊髓炎动物模型评分标准Abstract: Objective: To compareseveral methods of clinical assessment standards in mice model of EAE. Methods: The mice models of experimental autoimmune encephalomyelitis (EAE) were established,and the neural symptoms and pathological changes were observed. Three clinical assessment methods,including 5-point,7-point and 15-point,were used to assess neurological function. Results: On the early onset,7-point,the 15-point disease score scales were more sensitivity than5-point score scale to the incidence of disease. And the 15-point disease score scale was strongly correlated with pathological changes on EAE model and had good validity. Conclusion: The15-point disease score scale has a obvious dominance for the assessment of the sympton of the neurological function. Therefore,the 15-point disease score scale is recommended as the first methodto select.Key words: experimental autoimmune encephalomyelitis ;animal model;mice ;clinical as-sessment实验性自身免疫性脑脊髓炎模型是国际公认的多发性硬化(multiple sclerosis,MS)动物模型,被广泛用于MS发病机制和评价免疫调节药物的实验研究。
探讨EAE模型中小胶质细胞对小鼠脊髓神经的保护作用

探讨EAE模型中小胶质细胞对小鼠脊髓神经的保护作用王喜春;马冲【摘要】目的总结EAE模型中小胶质细胞对小鼠脊髓神经的保护作用。
方法将60只健康小鼠随机分组,对照组为30只EAE模型小鼠,皮下注射生理盐水,观察组30只小鼠实施干预,主要采取皮下注射500μMTuftsin,对比不同时间段小鼠神经功能评分以及炎症因子含量水平。
结果观察组、对照组小鼠均在研究后第9d开始发病,对照组小鼠神经功能评分大于观察组,数据对比存在统计学意义(P<0.05);观察组小鼠与对照组小鼠在TNF-α、IL-10以及TGF-β指标方面存在差异(P<0.05),有统计学意义。
结论EAE模型中小胶质细胞对小鼠脊髓神经具有明显的保护作用,通过Tuftsin干预可延缓发病,且提高抗炎因子,降低炎症因子。
【期刊名称】《临床检验杂志(电子版)》【年(卷),期】2019(008)003【总页数】2页(P45-46)【关键词】EAE模型;小胶质细胞;小鼠脊髓神经;保护作用【作者】王喜春;马冲【作者单位】[1]黑龙江省医院,黑龙江哈尔滨150036;[1]黑龙江省医院,黑龙江哈尔滨150036;【正文语种】中文【中图分类】R743.31为进一步明确小胶质细胞对EAE脊髓神经的保护作用[1],本文通过建立EAE小鼠模型,探讨EAE模型中小胶质细胞对小鼠脊髓神经的保护作用,相关内容分析如下。
1 资料与方法1.1 一般资料选取60只健康小鼠进行研究,小鼠体质量18 g-23 g,平均体质量(20.12±2.01)g;年龄7周-9周、平均年龄(8.0±1.0)周,随机分组后命名为观察组与对照组,两组小鼠在体质量、年龄等方面满足可比性要求(P>0.05)。
1.2 方法小鼠分组后做好标记,同时对两组小鼠皮下注射CFA以及MOG35-55混合液,免疫后第一天对小鼠采取不同处理方法,其中观察组小鼠使用微泵在背部皮下注射浓度为500 μmol/L的Tuftsin,每次用量20 μL,连续注射10 d,共使用Tuftsin 200 μL。
疫苗研制中辅助性T淋巴细胞功能的优化

疫苗研制中辅助性T淋巴细胞功能的优化
沈诚诚
【期刊名称】《《国外医学:预防.诊断.治疗用生物制品分册》》
【年(卷),期】1999(022)004
【摘要】辅助性T淋巴细胞(HTL)应答在诱导体液和细胞免疫中起着重要作用,
故HTL表位应是预防和治疗性疫苗的重要组成部分。
基因工程制备的泛DR辅助
T细胞表位(PADRE)以高亲和力与常见HLA-DR分子结合,发挥了强免疫原作用。
含PADRE-B细胞表位的线性肽能诱导显著抗体应答,主要是IgG抗体应答,而且PADRE表位能增强疫苗激发细胞免疫的能力。
含PADRE-CTL表位的脂肽也能在
转基因小鼠模型中打破CTL耐受。
因此采用合成或病原体衍生的有广泛交叉反应
性的HTL表位,使HTL功能最优化,为高效疫苗的产生开辟了光辉前景。
【总页数】4页(P149-152)
【作者】沈诚诚
【作者单位】
【正文语种】中文
【中图分类】R392-33
【相关文献】
1.阿奇霉素对支气管哮喘患儿外周血辅助性T淋巴细胞功能的影响 [J], 李静;张秋业;林荣军;王娟
2.食物过敏动物模型中辅助性T淋巴细胞1/辅助性T淋巴细胞2相关细胞因子变
化 [J], 吴群;邵洁;俞善昌;李云珠
3.阿奇霉素对支气管哮喘患儿外周血辅助性T淋巴细胞功能的影响 [J], 王伟烈;白莉
4.HspX的功能及其在结核疫苗研制中的应用进展 [J], 梁正敏;宋银娟;董玉慧;屈孟锦;周向梅
5.己酮可可碱对慢性充血性心力衰竭患者CD4^+辅助性T淋巴细胞功能的调节[J], 曾芳;许心纯;高卫华;刘萍
因版权原因,仅展示原文概要,查看原文内容请购买。
维生素E对小鼠胸腺、脾脏T淋巴细胞及亚群的影响

维生素E对小鼠胸腺、脾脏T淋巴细胞及亚群的影响
高宁;杨家驹;朱俊东;叶建锋
【期刊名称】《营养学报》
【年(卷),期】1994(16)2
【摘要】五组初断奶小鼠分别饲喂生育酚(VE)缺乏,合有Vh1/3、正常、3倍及20倍需要量的膳食,8周后观察T淋巴细胞及亚群的变化。
结果表明:补充VE后,小鼠脾脏指数显著增高,胸腺指数仅略有上升,并提高T细胞、T_H亚群百分率,降低T_s亚群百分率,使T_H/T_s比值增高。
提示:VE刺激脾脏细胞增生更为显著,VE促进T细胞的成熟、分化。
VE影响免疫反应的作用可能是通过提高T_H/T_s比值而进行调节的。
除20倍需要量组外,饲料中VE重与T细胞及亚群的提高相关,认为3倍需要量为合适剂量。
【总页数】5页(P144-148)
【关键词】维生素E;T淋巴细胞;胸腺;脾脏
【作者】高宁;杨家驹;朱俊东;叶建锋
【作者单位】重庆第三军医大学营养卫生教研室
【正文语种】中文
【中图分类】R151.2
【相关文献】
1.抗痨颗粒剂对小鼠胸腺皮质厚度、胸腺和脾脏淋巴细胞数及迟发型超敏反应的影响 [J], 秦俊莲;张卫红;王红伟
2.TCA对小鼠脾脏T B淋巴细胞和T淋巴细胞亚群变化的影响 [J], 王彩云;李培锋;刘明强;李成应;关红
3.抗痨颗粒剂对小鼠胸腺皮质厚度、淋巴细胞数及脾脏淋巴细胞数的影响 [J], 秦俊莲;张卫红
4.维生素E对小鼠胸腺和脾脏T淋巴细胞转化及MΦ诱导IL-1的影响 [J], 高宁;杨家驹;朱俊东;叶建锋
5.免疫抑制剂对小鼠胸腺及外周血、脾脏T淋巴细胞亚群的影响 [J], 李霞;李殿俊;富东旭
因版权原因,仅展示原文概要,查看原文内容请购买。
SEA毫微粒对小鼠T细胞亚群的影响及抗肝癌作用的研究

SEA毫微粒对小鼠T细胞亚群的影响及抗肝癌作用的研究叶菁;隋延仿;吴道澄;李增山;陈广生;张秀敏【期刊名称】《癌症(英文版)》【年(卷),期】2003(022)006【摘要】背景与目的:葡萄球菌肠毒素 A( staphylococcal enterotoxin A, SEA)是一种研究广泛的超抗原,它在肿瘤的治疗方面具有很好的应用前景,但是其毒副作用在一定程度上限制了其应用.本研究拟采用纳米技术制备超抗原 SEA毫微粒( nanoparticle- encapsulated SEA, NSEA),并观察其对小鼠 T淋巴细胞亚群的影响及其抗肿瘤作用.方法:以界面聚合法制备 NSEA;将 BALB/c小鼠分成 3组(每组12只),每组 12只,分别注射0 1 ml NS( NSⅠ组)、0 1 ml 2 mg/L SEA( SEAⅠ组)、0 1 ml 2 mg/L NSEA( NSEAⅠ组),观察小鼠 CD4+与 CD8+ T细胞亚群的百分比及绝对值的变化;建立小鼠肝癌 H22模型,于小鼠皮下分别注射0 1 ml NS( NSⅡ组)、0 1 ml 2 mg/L SEA( SEAⅡ组)、0 1 ml 2 mg/L NSEA( NSEAⅡ组),并比较各组小鼠肿瘤大小及生存时间长短。
结果: SEA与 NSEA对小鼠 CD4+与 CD8+ T细胞亚群的比例均没有明显影响( P >0. 05),但是两者可以显著提高 T细胞亚群的绝对数量( P< 0. 01);NSEAⅠ组 CD4+与 CD8+ T细胞亚群的数量均在 72 h时达到高峰,分别为(8. 26± 1. 46)× 109/L与(5. 53± 0. 91)× 109/L;而SEAⅠ组 CD4+ T细胞数量在 48 h时达到高峰,为(8. 61± 1. 59)× 109/L, CD8+ T细胞在 72 h时达到高峰,为(6. 05± 1. 31)× 109/L,两者 96 h时都已经恢复到正常水平。
视神经脊髓炎谱系疾病患者循环滤泡辅助性T细胞和滤泡调节性T细胞的变化

视神经脊髓炎谱系疾病患者循环滤泡辅助性T细胞和滤泡调节性T细胞的变化赵聪;李宏增;马超;许波;郭鹏;赵代弟;郭俊;李柱一【期刊名称】《实用医学杂志》【年(卷),期】2017(33)3【摘要】Objective To study the changes and significance of the frequencies of circulating follicular helper T cells (cTfh) and circulating regulatory follicular T cells (cTfr) as well as the cTfh/cTfr ratio in neuromyelitis optica spectrum disorder (NMOSD).Methods The frequencies of cTfh,cTfr and B cells in patients with NMOSD and health controls(HCs) were measured by flow cytometry.Enzyme-linked immunosorbent assay was used to detect the level of IL-21 and AQP4-Ab in patients and HCs.Results The frequencies of cTfh and B cells,thecTfh/cTfr ratio and the plasma level of IL-21 werc significantly higher in the relapsing patients than those in the remitting patients and HCs(P <0.05),and the cTfr level in the relapsing patients was lower than that in the remitting patients and healthy population (P < 0.05).But no statistical differences were observed in the above indexes between the remitting paticnts and HCs.There was also no significant difference in AQP4-Ab level between the patients with relapse and remission (P > 0.05).The frequency of cTfh in the patients wasc positively correlated with the level of B cells and IL-21(P < 0.05),and the frequency of cTfr was negatively correlatedwith B cells and IL-21 (P < 0.05).The ratio of cTfh/cTfr was positively correlated with B cell frequency and IL-21 level (P < 0.05).AQP4-Ab level had no correlation with the frequencies of cTfh cells and B cells,cTfh/cTfr ratio and IL-21 concentration (P > 0.05).Conclusion The changes in the frequencies of cTfh and cTfr as well as the imbalanced cTfh/cTfr ratio may promote the activation of humoral immunein NMOSD and participate in the pathogenesis of this disease.%目的:探讨循环滤泡辅助性T细胞(cTfh)、循环滤泡调节性T细胞(cTfr)以及cTfh/cTfr比值在视神经脊髓炎谱系疾病(NMOSD)病程中的变化及意义.方法:流式细胞术检测15例复发期、16例缓解期NMOSD 患者及18例健康对照者的cTfh、cTfr及外周血B细胞比率;酶联免疫吸附试验检测3组受试者血浆IL-21以及患者血浆抗水通道蛋白4抗体(AQP4-Ab)水平.结果:与缓解期患者和健康人相比,复发期患者cTfh和B细胞比率、cTfh/cTfr比值以及IL-21水平均升高,cTfr比率降低;而缓解期患者与健康人的上述指标相比差异无统计学意义.复发期和缓解期患者AQP4-Ab无明显差异.患者的cTfh比率与B细胞比率、血浆IL-21水平呈正相关,而cTfr比率与IL-21水平之间呈负相关.患者cTfh/cTfr比值与B细胞比率和IL-21之间亦呈正相关,但AQP4-Ab水平与cTfh 比率、B细胞比率、cTfh/cTfr比值以及IL-21没有相关性.结论:NMOSD患者cTfh和cTfr比率的变化以及cTfh/cTfr比值失衡可能促进机体内体液免疫应答异常活化,从而参与NMOSD的发病.【总页数】5页(P379-383)【作者】赵聪;李宏增;马超;许波;郭鹏;赵代弟;郭俊;李柱一【作者单位】710038西安市,第四军医大学唐都医院神经内科;710038西安市,第四军医大学唐都医院神经内科;710038西安市,第四军医大学唐都医院心脏内科;710032西安市,第四军医大学校务部门诊部;710038西安市,第四军医大学唐都医院神经内科;710038西安市,第四军医大学唐都医院神经内科;710038西安市,第四军医大学唐都医院神经内科;710038西安市,第四军医大学唐都医院神经内科【正文语种】中文【相关文献】1.滤泡辅助性T细胞与特发性视神经炎和视神经脊髓炎谱系疾病关系的研究 [J], 吴茜;杨彬彬;王佳伟2.补肾益髓胶囊对缓解期视神经脊髓炎谱系疾病滤泡辅助性T细胞的影响 [J], 杨涛;康越之;仝延萍;程翠翠;王静文;樊永平3.滤泡辅助性T细胞和滤泡调节性T细胞在骨肉瘤患者中的数量变化及临床意义[J], 郭中凯; 刘丽君4.视神经脊髓炎谱系疾病患者血清和脑脊液尿酸水平变化观察 [J], 李雪晶;常生辉;齐媛;杨丽;刘广宇;孙丽莎5.托法替尼对实验性自身免疫性脑脊髓炎大鼠滤泡调节性T细胞/滤泡辅助性T细胞平衡及CXCL13、转化生长因子-β1表达的影响 [J], 李玲;李作孝因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠视神经的炎症损伤 。 [ 关键词 ] E E 视 神经 ; A; 白介素 1 ; 7 干扰素 、 白介素 4 叉头蛋 白 3 ;
Ale a i n o hep r c l s b e s i he o tc n r e o x e i e t la t i m u t r to f T l e el u s t n t p i e v f e p rm n a u o m ne e e h l m y l i nc p a o ei s t
张荣 伟 田阿 勇② 禹红 梅③ 陈
中国图书分类号 [ 摘 R 4 71
蕾④ ( 国医科大 学 附属 第一 医院老 年 病干诊 科 , 阳 100 ) 中 沈 10 1
A 文章编号 10.8x(o0 1.110 0 044 21 )210.5
文献标识码
要 ] 目的 : 讨 辅 助 性 T细 胞 亚 群 1 1 T2 1 1 探 1 、h 、h 7及 Te 小 鼠 E E模 型 视 神 经 炎 发 病 机 制 中 的 意 义 。 方 法 : 1 r g在 A
张荣伟等
辅助性 T细胞亚群在小 鼠 E E模型视神经中的变化 A
第 l 2期
di1 .9 9 ji n 10 — 8 X.0 0 1 . 1 o :0 3 6 / . s .0 04 4 2 1 .2 0 0 s
・
神 经 内分 泌 与 免 疫 ・
辅 助 性 T细 胞 亚 群 在 小 鼠 E E 模 型 视 神 经 中 的 变 化 ① A
C7 L 6 鼠随机分为佐剂对照组 ( 5B / 小 n=1 )E E模型组( 6、A n=4 ) 免疫 后第 1 、5 1 8, 1 1 、9天分批处 死小 鼠 , 察视神 经组织 的病 观 理改变 。E I LS A方法检测视神经 IN 、 、 -7的蛋 白含量 ; elieP R方法检 测视 神经组织 IN 7 I 、 -7 Fx3的 F一 I I 1 L4 L R a t C —m F一、 4 I 1 和 op L 基 因表达 。结果 : 免疫后第 1 天 I 1 1 L 7的蛋 白及 m N - R A的表达比正常对照组 明显增高(4 254 .9 0 65 .6 ; . 8 1. - 70v 1.1 ±0640 7 ± 5 - 0 s 9 0 17v 0 03 - .1 , P< .5 , .3 s .8 0 03均 4 0 0 )免疫后第 1 IN 7的蛋 白及 m N 9天 F 一 R A的表达 比对照组 明显增 高(100 .2 s1. 5 2 . ±181v 28 ± 6 4
090 067± .7 s .8 ±004 均 P < .5 , .7 ;.1 0 00v 09 .1 , 0 0 0 )I L4的 蛋 白及 m N 的表 达 与 对 照 组 比较 减 少 (027±077v 4 28 RA 1 .2 .6 s1 .5 ± 085 009± .1 s .5 ±00 7均 P < .5 。Fx3r N 的表 达 由免 疫 后 1 天 、5天 至 1 与对 照 组 比较 均 明 显 减 .8 ;.8 0 04v 0 20 .4 , 0 0 ) op R A n 1 l 9天 少 ( .6 ±0 11045± .6 ,.0 ± .2 s .8 ±0 14 10 8 .2 ,.9 0 040 6 5 0 0 1v 30 7 .9 ,P<0 0 )。结 论 :A .1 E E小 鼠视 神 经 Fx3和 Te 表 达 减 少 可 op r g 能 为 视 神 经 炎 发 生 发展 的 重 要 因 素 ; - I1 L 7在 E E小 鼠视 神经 炎 的 早 期 阶 段 介 导 炎 症 损 伤 , N 7在 发 病 的 高 峰 期 加 重 了 E E A I - F A
Z A GR n — e , I A yn Y ogMe, H N Li Dp r et fG r tc , H N og W i T N —0g, U H n - i C E e. eat n o e ars A m i i
C ia M e ia hn dc l t S e y n 】1 0 1. i y. h n a g O0 C n h a
a df k ed wn e e xt n c pi c r 3 F x 3 no t e eadfr e t epo erl o T hle cl sbe uh a h , n r a / igd hl a s i o f t ( op )i pi nr n t r o x l et e f e r e u st sc s l oh i r r tn a o p c v uh r h o p l s T T 2 T l , r ep t gn s f p cnuis f x r e t u i m n n e hl y li E E . to s Mi 5 BJ6b c — h , h 7 T e i t a oe ei o t er i o pi na at m u e cp a m e t ( A ) Me d : c i C 7 I a k gn h h s oi t ee m l o e o is h en
Fr f l t o i l it f ie H s t sA a d pa o i f
l bt cj Obet e T e c p tnadgn xr snoitl kn1( -7 ,neeo- m aIN , t eln ( 厂 ) A s at r jci :odt t re n ee pe i fn ru i 7 I 1) i r r g m (F 一) ie u - I 4 v e o i e so ee - L tf n a nd d 4 I
