螯合值的测定
螯合能力-钙镁离子-铁离子
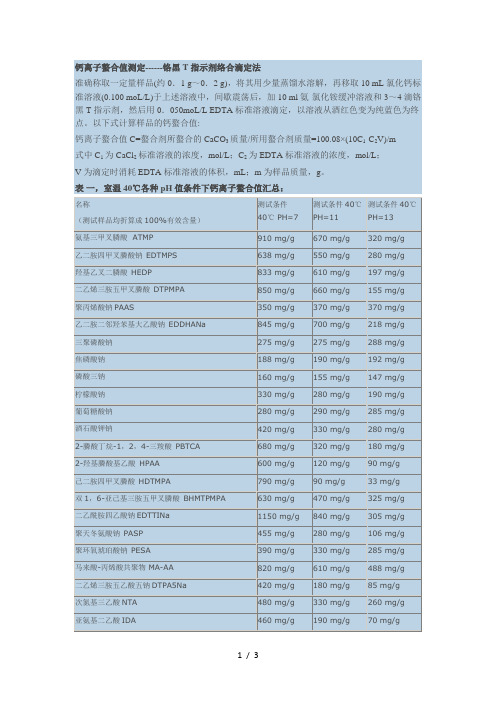
钙离子螯合值测定------铬黑T指示剂络合滴定法
准确称取一定量样品(约0.1 g~0.2 g),将其用少量蒸馏水溶解,再移取10 mL氯化钙标准溶液(0.100 moL/L)于上述溶液中,间歇震荡后,加10 ml氨-氯化铵缓冲溶液和3~4滴铬黑T指示剂,然后用0.050moL/L EDTA标准溶液滴定,以溶液从酒红色变为纯蓝色为终点。
以下式计算样品的钙螯合值:
钙离子螯合值C=螯合剂所螯合的CaCO3质量/所用螯合剂质量=100.08×(10C1-C2V)/m
式中C1为CaCl2标准溶液的浓度,mol/L;C2为EDTA标准溶液的浓度,mol/L;
V为滴定时消耗EDTA标准溶液的体积,mL;m为样品质量,g。
表一,室温40℃各种pH值条件下钙离子螯合值汇总:。
螯合值的测定

山东化友化学实验方法(五)鳌合力的测定方法5.9 鳌合力的测定5.9.1 试剂溶液2%的Na2C2O2水溶液NH4Cl—NH3缓冲溶液(PH值=10)5.9.2 0.1mol/L乙酸钙标准溶液标定与制备5.92.1 0.1mol/L乙酸钙标准溶液标定方法用10ml移液管准确移取待标定乙酸钙溶液10ml于250ml三角瓶中,加入1mol/L的NaOH溶液5ml,再加入钙指示剂0.1g(钙指示剂:NaCl=1:100经研磨备用),以0.05mol/LEDTA标准溶液进行滴定,滴定至溶液由紫红色变成纯蓝色即为终点。
5.9.2. 计算C EDTA mol/L×V EDTA ml乙酸钙mol/L=-----------------------------------------------V乙酸钙ml5 .9.3 NH4Cl—NH3缓冲溶液的制备称取54gNH4Cl加入350mlNH3·.H2O稀释至1000ml即可。
5. 9. 4 仪器试验室常用仪器5. 9. 5 分析方法迅速准确称取5. 5. 2干燥后的样品0.5±0.0001g(精确至0.1mg)于50ml烧杯中,用除CO2的蒸馏水溶解。
全部移入100ml容量瓶中稀释至刻度,摇匀备用。
用25ml移液管,准确移取上述溶液25ml于100ml三角瓶中,加入2%Na2 C2O4溶液4—5滴,加入NH4Cl—NH3缓冲溶液5ml调节PH值为10.0—10.5,然后用0.1mol/L乙酸钙溶液滴定至产生永久性白色沉淀为终点。
5. 9. 6 计算V ×C ×100螯合力CaCO3mg/g(干基)=——————————————F ×M ×25%式中:V—滴定样品消耗乙酸钙标准溶液体积(ml)C—乙酸钙标准溶液的浓度100—1ml的1mol/l乙酸钙溶液相当于CaCO3量(mg)m—样品重量(g)25%—分取样品系数F—给定的有效成分含量(%)5. 10 分散力的测定(CaCO3法)5. 10. 1 试剂和溶液乙酸钙标准溶液: C乙酸钙=0.1mol/L C NaOH=1mol/L实验室常用仪器5. 10. 3 分析方法称取1g试样(精确至0.0001g) ,于250ml锥形瓶中, 加入100ml去离子水充分溶解, 再加入10ml10%碳酸钠溶液摇匀, 用1mol/L氢氧化钠调PH值至11, 然后用0.1mol/L的乙酸钙标准溶液滴至产生永久性白色沉淀。
螯合分散剂的检测

螯合分散剂的检测一.实验准备1.仪器设备:滴定架,容量瓶(500mL),三角瓶(250mL),碘量瓶(250mL),量筒(100mL),移液管(10mL),温度计,称量瓶,恒温烘箱,电子天平(1/1000),磁力搅拌器2.染化药品:EDTA(二钠),固体氢氧化钠,三氯化铁,氯化钙,螯合分散剂,钙指示剂,中性皂片3.溶液制备:(1)C(EDTA)=L标准溶液:准确称取(100%)于烧杯中,加少量水充分溶解后,洗入500mL容量瓶中,加水至刻度,标定后使用。
(2)200g/L氢氧化钠溶液:用30%氢氧化钠(400g/L)稀释一倍。
(3)C(NaOH)=L氢氧化钠溶液:准确快速称取10g固体氢氧化钠,溶解冷却,并稀释至100mL。
(4)C(CaCl2)=L氯化钙标准溶液(5)C(CaCl2)=L氯化钙标准溶液(6)C(FeCl3)=L的三氯化铁溶液(7)%钙指示剂溶液二.操作步骤1.钙离子螯合值或螯合能力测试。
(1)精确称取试样(以100%计)于称量瓶中,加蒸馏水溶解后,洗入500mL容量瓶中,加入C(CaCl2)=L氯化钙标准溶液50mL,加蒸馏水稀释至刻度,充分振荡摇匀,放置20min后,用定性滤纸干过滤。
(2)吸取上述滤液50mL于250mL三角烧瓶中,加入C(NaOH)=L氢氧化钠溶液2mL,加钙指示剂2-3滴,用EDTA标准溶液滴至由酒红色变为蓝色为终点。
(3)计算钙螯合值或钙螯合能力E。
平行测试3次,取平均值。
E=*(50*C0-10*C1*V)/m*p式中:E-钙螯合值或螯合能力,mg/g; -碳酸钙的毫摩尔质量; C0-氯化钙的摩尔浓度L; C1-EDTA标准溶液浓度,mol/L; m-试样重g; p-试样的有效浓度(4)记录测试结果,并填写测试报告。
试样编号1# 2# 3# 平均值耗用EDTA溶液(mL)E(mg/g)2.铁离子螯合能力测试(1)样品溶液制备:精确称取螯合分散剂样品于500mL烧杯中,加入400mL去离子水,摇动使之完全溶解后用200g/L烧碱调节PH值至-。
掩蔽与解蔽法螯合滴定测定钙镁

3. 1 HAA 的用量与反应 用 HAA 掩蔽 Mg2 + 、螯合滴定 Ca2 + ,而 Mg2 + 与
HAA 生成 Mg (AA) 2 螯合物 : Mg2 + + 2 HAA →Mg (AA) 2 + 2 H +
在加热条件下 ,乙酰丙酮的羰基与铵氨发生加 成 、脱水反应〔5〕:
2 实验方法
2. 1 主要试剂与仪器 钙 、镁标准溶液均为 2. 00 mg/ ml 。 掩蔽剂 :50 ml 三乙醇胺 ( TEA) 溶液 (1 + 2) 中 ,
加入 2 g 酒石酸钾钠 ( Tart rate) 、1 g KF 、2 ml 乙二胺 和 20 ml MPA (巯基丙酸或巯基丁二酸 MSA) ,摇匀 , 用 NaOH 溶液 (10 %) 调整 p H 9. 5 左右 。
10 ml 掩蔽剂 ,效果最佳 。本实验选用 5 ml 掩蔽剂 , 4 实际应用
极为适宜 。
3. 4 指示剂的选择与用量 文献提出“三色激励彩色对螯合滴定钙常用五种
指示剂”〔10〕和“螯合滴定 Mg2 + 指示剂颜色变化与筛 选〔11〕的启发下 ,进行了实验研究 。实验结果表明 ,选 用铬黑 T 、甲基红 、百里酚酞 ,其配比为 7∶1∶1 的乙醇 溶液 ,作混合指示剂 ,比文献〔10~11〕三色激励彩色作 指示剂更加优越 。实验也表明 ,在 50 ml 乙醇中加入 0. 35 g 铬黑 T 、0. 05 g 甲基红和 0. 05 g 百里酚酞为 混合指示剂 ,加入 2~5 滴混合指示剂 ,终点颜色变化 更加敏锐 、清晰 。本实验选用 4 滴混合指示剂 ,非常 适宜 。 3. 5 Ca2 + 、Mg2 + 的量与 ED TA 标准溶液消耗量的 线性关系
钙螯合值的测定

钙螯合值的测定钙螯合值的测定1.0方法提要钙螯合值(mg/L)系指每克试样螯合的碳酸钙的毫克数。
在试液中加入碳酸钠,滴加氢氧化钠溶液维持溶液的PH值为11、用钙标准溶液滴定至显现不消失的混浊。
2.0试剂和材料2.1碳酸钠:20g/L溶液2.2氢氧化钠:40g/L溶液2.3氢氧化钾:200g/L溶液2.4乙二胺四乙酸二钠:(EDTA)约0.05mol/L标准滴定溶液。
2.5钙—羧酸指示剂:将1.00g钙—羧酸与100g氯化钠研磨混匀。
2.6钙标准滴定溶液:1mL约10.0mgCa。
2.6.1制:称取27.72g无水氯化钙,用水溶解,稀释到1000mL。
2.6.2标定:移取5.00mL钙标准溶液,置于250mL锥形瓶中,加入30mL水、5mL氢氧化钾溶液、约0.1g钙—羧酸指示剂、用乙二胺四乙酸二钠(EDTA标准溶液滴定,溶液由紫红色变为蓝色即为尽头。
1.6、3计算:以mg/L表示的Ca(C1)按以下公式计算:式中:V―滴定中消耗的乙二胺四乙酸二钠(EDTA)标准滴定溶液的体积,mL;C―乙二胺四乙酸二钠(EDTA)标准滴定溶液的实际浓度,mol/L;0.04―与1.00mL乙二胺四乙酸二钠:(CEDTA=1.00 mol/L)相当的以克表示的钙的质量。
2.0仪器、设备(除一般试验室仪器外)3.1酸度计:配有饱和甘汞参比电极和玻璃测量电极或复合电极。
3.2电磁搅拌器:配有搅拌子。
3.0分析步骤称取2.0g试样,**至0.01g,置于250mL烧杯中,加入100mL 水。
将烧杯置于电磁搅拌器上,放入搅拌子,开动搅拌。
试样混合均匀后加入10mL碳酸钠溶液。
将电极插入到溶液中,滴加氢氧化钠溶液至PH为11、提起电极,加水至150mL,再插入电极。
用钙标准溶液滴定,边滴定边加入氢氧化钠溶液,维持溶液的PH为11、溶液显现明显而长期的混浊即为尽头。
5.0分析结果的表述以mg/g表示的钙螯合值(X)按以下公式计算:式中:C1—钙标准滴定溶液的实际浓度,mg/ml;V—滴定中消耗的钙标准滴定溶液的体积,mL;m—试样质量,g;2.50—钙换算成碳酸钙系数。
螯合能力 钙镁离子 铁离子
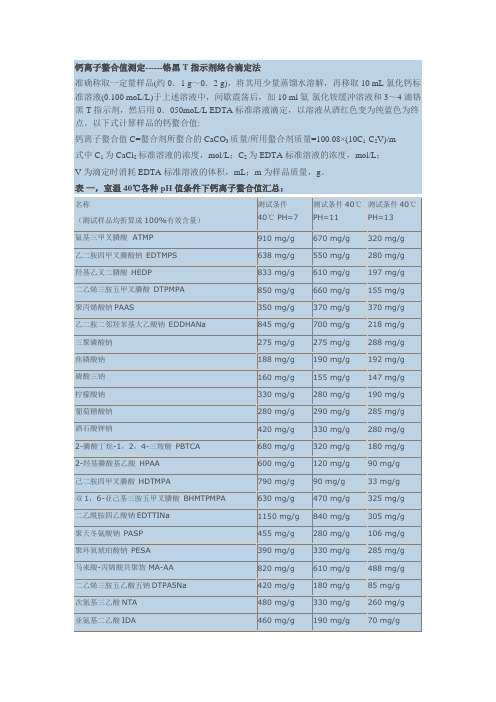
钙离子螯合值测定------铬黑T指示剂络合滴定法
准确称取一定量样品(约0.1 g~0.2 g),将其用少量蒸馏水溶解,再移取10 mL氯化钙标准溶液(0.100 moL/L)于上述溶液中,间歇震荡后,加10 ml氨-氯化铵缓冲溶液和3~4滴铬黑T指示剂,然后用0.050moL/L EDTA标准溶液滴定,以溶液从酒红色变为纯蓝色为终点。
以下式计算样品的钙螯合值:
钙离子螯合值C=螯合剂所螯合的CaCO3质量/所用螯合剂质量=100.08×(10C1-C2V)/m
式中C1为CaCl2标准溶液的浓度,mol/L;C2为EDTA标准溶液的浓度,mol/L;
V为滴定时消耗EDTA标准溶液的体积,mL;m为样品质量,g。
表一,室温40℃各种pH值条件下钙离子螯合值汇总:。
钙螯合值的测定

钙螯合值的测定集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-钙螯合值的测定1、方法提要在螯合剂的溶液中,加入过量的碳酸根离子,在溶液PH值为11时,慢慢加入钙标准溶液至溶液出现清晰、永久的轻微浑浊。
2、试剂和溶液碳酸钠:20g/L氢氧化钠标准溶液:约1mol/L钙标准溶液:1ml约含10.0mgCa2+钙-羧酸指示剂:1.0g钙-羧酸指示剂与100g氯化钠研磨,混匀。
氢氧化钾溶液:200g/L3、钙标液的配制:a、配制:准确称取27.7g无水氯化钙,在烧杯中溶解,转入1000ml的容量瓶中,用水稀释至刻度备用。
b、标定:移取5.00ml钙标准溶液,置于250ml锥形瓶中,加30ml水,5ml氢氧化钾溶液、约0.1g钙-羧酸指示剂。
用0.05mol/L乙二胺四乙酸二钠标准溶液滴定,溶液由紫红色变为亮蓝色即为终点。
c、计算:)按式(1)计算以mg/ml表示的Ca2+的浓度(C1==(1)C1式中V----滴定中消耗的乙二胺四乙酸二钠标准溶液的体积,ml)=0.05mol/L]的实际浓度。
C----乙二胺四乙酸二钠标准溶液[C(EDTANa20.04008----与1.00ml乙二胺四乙酸二钠[C(EDTANa)=0.05mol/L]相当的以克表2示的钙的质量。
4、仪器和设备酸度计:配有饱和甘汞参比电极和玻璃电极或复合电极的酸度计。
电磁搅拌器5、分析步骤称取约2g试样(精确至0.0002g),于250ml烧杯中,加入100ml水,置于电磁搅拌器上,开动搅拌,再加入10ml碳酸钠溶液,将酸度计电极(用PH=9.18的标准缓冲溶液校正)插入上述溶液中,用约1mol/L氢氧化钠标准溶液调节PH至11,将电极移出液面,加水至烧杯150ml刻度处,再将电极插入溶液中,用钙标液确定至出现清晰、永久的轻微浑浊。
(在滴定过程中溶液的PH值应严格控制在11左右)。
以CaCOmg/g表示的钙螯合值(X)按式(2)计算:3X==(2)钙标准溶液的实际浓度,mg/ml式中C1-----V滴定时所消耗的钙标准滴定溶液的体积,ml1-----2.5—钙换算成碳酸钙的系数2011-10-10。
螯合剂铁螯合值测定方法简介及评价_洪焱根

洪焱根,王魁,冯彬,马俊,栾志乾(黎明化工研究院,河南洛阳471001)摘要:介绍了目前常用螯合剂铁螯合值测定方法[络合滴定法、Fe(OH)3沉淀法、碘量法]及原理;采用这3种方法测定乙二胺四乙酸二钠(EDTA-2Na)铁螯合值,并对测定结果与理论值进行比较.结果表明:络合滴定法精密度及准确度均最高,操作简便,不受放置时间、溶液颜色的影响,且测定结果与理论值相符.Fe(OH)3沉淀法和碘量法误差大、准确度低,测定结果随样品质量变化而变化.因此,络合滴定法是测定螯合剂铁螯合值的最适宜方法.关键词:铁螯合值;络合滴定法;Fe(OH)3沉淀法;碘量法中图分类号:TQ317文献标识码:C文章编号:1004-0439(2010)10-0053-04螯合剂铁螯合值测定方法简介及评价Introduction and assessment on measurement methods ofFe(III)chelation value of chelating agentHONG Yan -gen,WANG Kui,FENG Bin,MA Jun,LUAN Zhi -qian(Liming Research Insitute of Chemcial Industry,Luoyang 471001,China)Abstract :The methods (complexometric titration method,ferric hydroxide precipitation method and iodo -metric method)commonly used to determine Fe(III)chelation value and the measurement mechasim were intro -duced.The three methods were used to test Fe(III)chelation values of disodium edta (EDTA-2Na),and the mea -sured values were compared with theoretical values.The results showed that complexometric titration method had the highest precision and accuracy.And this method was simple,convenient and was not influenced by the placing time and sample color,and the measured value was in accord with the theoretical value.Both ferric hy -droxide precipitation method and iodometric method had big system error and low accuracy.And their measured values varied with the sample weight.Therefore,complexometric titration method was the most feasible method to determine Fe(III)chelation value of chelating agents.Key words :Fe(III)chelation value;complexometric titration method;ferric hydroxide precipitation method;iodometry method收稿日期:2009-12-24作者简介:洪焱根(1981-),男,江西景德镇人,工程师,学士,主要从事过氧化氢生产工艺技术和造纸助剂开发工作近年来,随着科学技术日益发展,螯合剂已得到广泛的应用,特别是在印染、造纸、纺织、工业清洗、水处理等方面.造纸工业中螯合剂常用作过氧化氢稳定剂,可减少过氧化氢发生无效催化分解,降低漂白成本,提高漂白效率.[1]在染整加工时金属螯合剂用作硬水软化剂,也可在过氧化氢漂白中用作稳定剂.[2]螯合剂一般为多种有效成分(如氨基羧酸盐、有机磷酸盐、无机磷酸盐、有机高分子聚合物等)的复配物,具有较强螯合Ca 2+、Mg 2+、Fe 3+的能力,能有效去除溶液中金属离子,获得较好的使用效果.螯合力是指1g 螯合剂可螯合多少mg 金属离子的能力.螯合容量越高,其螯合能力越强.目前,测定螯合剂钙螯合值和镁螯合值的方法较成熟[3],但测定铁螯合值的方法较多,依测定原理,可分为EDTA 络合滴定法、碘量法、Fe(OH)3沉淀法[4-6]、磺基水杨酸显色分光光度法[7]等.这些方法测定结果不尽相同[4,7],存有争印染助剂TEXTILE AUXILIARIES Vol.27No.10Oct .2010第27卷第10期2010年10月印染助剂27卷议.本文主要叙述络合滴定法、碘量法、Fe(OH)3沉淀法的测定原理,并以工业上最常用的乙二胺四乙酸二钠(EDTA-2Na)作为螯合剂样本,分别对它们的测定结果进行分析与评价.1测定原理1.1络合滴定法在酸性条件下,Fe3+可与磺基水杨酸反应形成红色配合物.故可在酸性溶液中,以磺基水杨酸作指示剂,用Fe3+标准溶液滴定螯合剂样品溶液,当螯合剂反应完全后,微过量的Fe3+即可与磺基水杨酸反应生成红色配合物,此即为滴定终点.1.2Fe(OH)3沉淀法在碱性条件下,Fe3+可与OH-反应形成稳定红褐色Fe(OH)3沉淀.因此,控制螯合剂样品溶液的pH值较高,用Fe3+标准溶液进行滴定,过量的Fe3+与OH-反应致溶液中出现红褐色絮状沉淀即为滴定终点.1.3碘量法Fe3+具有氧化性,可将I-氧化成I2.利用这一性质,用间接碘量法进行铁螯合值测定,即向一定质量螯合剂溶液中加入过量硫酸铁铵溶液,螯合剂与Fe3+作用,向剩余的Fe3+溶液中加入过量KI,生成的I2以淀粉作指示剂用Na2S2O3溶液滴定.为消除Fe3+水解对测定结果的影响,滴定反应溶液pH≤2.2.铁离子与碘化钾氧化还原反应式如下:硫代硫酸钠与碘反应式如下:2试验2.1试剂及仪器试剂:乙二胺四乙酸二钠(EDTA-2Na)、磺基水杨酸、淀粉、氢氧化钠、硫酸铁铵、碘化钾、硫代硫酸钠等均为分析纯;螯合剂HPC-1(黎明化工研究院).仪器:电子天平,精度0.0001g;PHS-25型pH计,分辨率0.01pH,配有复合电极.2.2滴定溶液配制EDTA-2Na样品溶液(0.01mol/L):按GB/T601-2002《化学试剂标准滴定溶液的制备》制备0.1mol/L 标准溶液,用移液管准确吸取25mL于250mL容量瓶中,用去离子水定容.Fe3+滴定溶液(0.01mol/L):参考GB/T602-2002《化学试剂杂质测定用标准滴定溶液的制备》,准确称取4.822g(精确至0.0001g)硫酸铁铵[FeNH4(SO4)2·12H2O]溶于水中,加1mL98%浓硫酸后,移至1000mL容量瓶中,定容.Na2S2O3滴定溶液(0.01mol/L):按GB/T601-2002中所示方法制备0.1mol/L标准溶液,用移液管准确吸取25mL于250mL容量瓶中,用去离子水定容.2.3铁螯合值表示方法铁螯合值为1g螯合剂螯合Fe3+的质量,以Y表示,单位为mg/g.2.4铁螯合值测定2.4.1络合滴定法用移液管准确移取20mL EDTA-2Na样品溶液于250mL三角瓶中,用去离子水稀释至100mL,滴加2mL磺基水杨酸指示剂(5%),用Fe3+滴定溶液进行滴定,至黄色变成淡红色为滴定终点.滴定在60℃恒温水浴中进行.铁螯合值计算如式(1):式(1)中,c为Fe3+滴定溶液浓度,mol/L;V为滴定消耗的Fe3+标准溶液体积,mL;M为样品质量,g;56为铁原子摩尔质量,g/moL.2.4.2Fe(OH)3沉淀法用移液管准确移取20mL EDTA-2Na样品溶液于250mL三角瓶中,加去离子水稀释至100mL,用20% NaOH溶液调pH=12,然后用Fe3+滴定溶液进行滴定,至溶液中出现絮状沉淀即为终点.滴定过程中用NaOH 溶液维持试样pH=12.铁螯合值计算同式(1).2.4.3碘量法用移液管准确移取20mL EDTA-2Na样品溶液于250mL碘量瓶中,加入50mL Fe3+滴定溶液,反应一段时间以后,加入5mL0.1mol/L的KI溶液,封盖,于暗处放置0.5h后,用Na2S2O3滴定溶液进行滴定.至溶液呈浅黄色时加入5滴淀粉指示剂(0.5%),继续滴定至溶液蓝色消失变成无色为终点.铁螯合值计算如式(2):式(2)中,C1为加入的Fe3+滴定溶液浓度,mol/L;V1为加入的Fe3+滴定溶液体积,mL;C2为Na2S2O3滴定溶液浓度,mol/L;V2为滴定消耗的Na2S2O3滴定溶液体积,mL; 56为铁原子摩尔质量,g/moL.3结果与讨论3.1EDTA-2Na理论铁螯合值乙二胺四乙酸二钠(EDTA-2Na)摩尔质量为3362Fe3++2I-→2Fe2++I2 I2+2S2O32-→2I-+S4O62-(1) Y=56×c×V/m(2) Y=56×(C1V1-C2V2)/m5410期g/mol,分子式为C 10H 14N 2Na 2O 8,与Fe 3+可以生成稳定的螯合物(螯合物的稳定常数[8]146:lg β=24.23),螯合反应[n (EDTA-2Na)∶n (Fe 3+)=1∶1],据此可计算出EDTA-2Na 理论铁螯合值:式(3)中,56为铁原子摩尔质量,g/mol.3.2精密度不同方法测定结果及相对标准偏差(RSD)见表1.由表1可知,络合滴定法相对标准偏差(RSD)最小,精密度最高,测定结果与理论值相符;Fe(OH)3沉淀法精密度最差,原因是其沉淀物在试样溶液中形成较慢,且受溶液本身颜色影响而不易观察.3.3放置时间如图1所示,络合滴定法和Fe(OH)3沉淀法测定结果基本不受放置时间的影响.碘量法测定值随放置时间延长而逐渐减小,原因是在碘量法测定过程中,过量的I -在酸性条件下逐渐被空气氧化生成I 2;同时体系中生成的Fe 2+在酸性条件下被空气氧化成Fe 3+,继续氧化溶液中过量的I -,导致测定结果随放置时间延长逐渐减小.3.4准确度由图2可知,络合滴定法测定结果不受样品质量影响,准确度较高;Fe(OH)3沉淀法和碘量法测定结果均与样品质量的倒数呈线性关系,且与所测平均值(表1)相对误差太大,准确度较差,故均不适合作为铁螯合值测定方法.其原因:(1)Fe(OH)3沉淀法,EDTA 与Fe 3+所生成配合物稳定常数lg K =24.23,在pH 值为12时EDTA 酸效应系数[8]149:lg α(H)=0.01、Fe 3+水解副反应系数[9]482:lg αM(OH)=17.7,故其条件稳定常数lg K ′=lg K -lg α(H)-lg αM(OH)=6.52;OH -与Fe 3+所生成配合物Fe(OH)的累积稳定常数[8]142:lg β1=11.87,大于前者的条件稳定常数,故OH -先于EDTA 与Fe 3+发生络合反应.滴定时,为保持试样溶液pH 值不变而不断补加OH -,即溶液中OH -浓度始终保持不变,则加入的Fe 3+不与EDTA 发生络合反应(或相对于OH -,发生络合反应的EDTA 太少,可忽略不计).因此,在滴定过程中,Fe 3+只与OH -进行络合反应生成Fe(OH)3胶体,继续滴定,溶液中Fe(OH)3胶体浓度逐渐增大,至一定浓度时凝聚成沉淀,从而到达滴定终点.三角瓶中试样溶液初始体积不变(100mL),即溶液中OH -数量不变,且EDTA 对Fe(OH)3胶体凝聚成沉淀的浓度影响不大,故滴定消耗的Fe 3+溶液体积保持不变,依据铁螯合值计算式(1),测定结果与所取样品质量的倒数呈线性关系.当螯合剂本身性质对Fe(OH)3胶体凝聚成沉淀的浓度有影响时,铁螯合值测定结果与样品质量的倒数就会偏离线性关系.(2)碘量法,在酸性溶液中,用淀粉作指标剂进行碘量法滴定,在滴定完成后蓝色重现的原因:溶液中存在痕量Fe 3+,促进了I -被空气氧化[10](即痕量Fe 3+起催化作用),引起蓝色重现的最低Fe 3+质量浓度为0.1mg/75mL.文献[11]进一步证实了水中Fe 3+为碘量法的干扰物质(催化I -被空气氧化),并求出了出现滴定终点“重蓝”现象的最低Fe 3+质量浓度0.11mg/70mL.2.4.3所述碘量法中,碘量瓶中试样溶液Fe 3+质量浓度垌0.11mg/70mL,故滴定过程中,与Na 2S 2O 3反应的I 2是溶液Y ==166.67mg/g1g ×56g/mol ×1000336g/mol(3)表1不同方法测定结果及RSD测定方法铁螯合值/(mg ·g -1)测定值络合滴定法168.75373.17378.19平均值167.73RSD/%与理论值相对误差/%0.330.64375.58375.10213.33碘量法377.03375.820.46125.49213.75212.50Fe(OH)3沉淀法210.42212.600.5527.56213.33167.42167.17167.50167.83放置时间/min■—络合滴定法;●—Fe(OH)3沉淀法;▲—碘量法图1放置时间对测定结果的影响铁螯合值/(m g ·g -1)40425400375350225200175150302010●▲■●▲■●▲■●▲■●▲■洪焱根,等:螯合剂铁螯合值测定方法简介及评价55印染助剂27卷中I -在Fe 3+催化作用下被空气氧化生成,而并非被Fe 3+氧化生成,即滴定结果与溶液中Fe 3+质量浓度无关,只与空气氧化时间(即试样溶液在滴定前放置时间)有关.放置时间越长,I -被空气氧化生成的I 2越多(直至I -被全部氧化),消耗Na 2S 2O 3滴定溶液体积也相应增多,测定结果就越小,这与3.3试验结果一致.当放置时间一定时,滴定消耗Na 2S 2O 3滴定溶液体积为一定值,依据铁螯合值计算公式(2)可知,测定结果与样品质量的倒数呈线性关系.因滴定消耗Na 2S 2O 3滴定溶液体积只与试样溶液放置时间有关,而与试样溶液种类无关,故不同螯合剂在样品质量相同时测定结果相同.3.5准确度验证采用有机膦酸复配型螯合剂HPC-1,按2.4所述方法,对3.4结果进行验证,并与EDTA-2Na 进行对比.结果见图3、图4.由图3~4可以看出,试验结果符合3.4推论,即对于Fe(OH)3沉淀法,测定结果受样品质量影响,若不同螯合剂对Fe(OH)3胶体凝聚成沉淀的浓度影响程度不同,则其测定结果受样品质量的影响程度也不同;对于碘量法,放置时间相同时,不同螯合剂测定结果与样品质量的倒数呈同一线性关系,与螯合剂本身性质无关.3.6测定方法综合比较(1)络合滴定法操作简单、快速,滴定终点突跃明显,精密度及准确度均最高,测定结果与理论值相符.(2)Fe(OH)3沉淀法滴定突跃不明显,终点不易观察,且易受样品本身颜色影响,平行测定相对误差大;因pH=12时Fe 3+与OH -形成Fe(OH)配合物的累积稳定常数比与EDTA-2Na 形成配合物的条件稳定常数大,且在滴定时溶液OH -浓度保持不变,故测定结果随样品质量变化而变化,方法误差大,准确度低.(3)碘量法滴定突跃明显,平行测定相对误差较小;但在酸性条件下,与Na 2S 2O 3反应的I 2是溶液中的I -在Fe 3+催化作用下被空气氧化生成,而并非被Fe 3+氧化生成,故放置时间一定时,测定结果与样品质量的倒数呈线性关系,方法误差大,准确度低.4结论(1)在3种方法中,络合滴定法精密度及准确度均最高,测定结果不受放置时间及样品质量的影响,且与理论值相符,是测定螯合剂铁螯合值最适宜的方法.(2)Fe(OH)3沉淀和碘量法方法误差大、准确度低,测定结果随样品质量变化而变化,均不适合作为螯合剂铁螯合值的测定方法.参考文献:[1]李海明,杨立宏.制浆和漂白技术的进展[J].国际造纸,2004,23(6):22-24.[2]叶金鑫.应用于染整加工的金属螯合剂[J].现代纺织技术,2002,10(1):46-50.[3]俞英珍,金鲜花,傅佳亚.钙离子螯合力测试方法及比较[J].印染助剂,2006,23(12):40-42.[4]沈淑英,魏艳,赵梅,等.螯合铁离子能力测定方法比较[J].印染助剂,2009,26(7):50-52.[5]邢富强,刘学.新型螯合分散剂的研制与应用[J].印染助剂,2006,23(6):43-46.[6]蒲宗耀,黄玉华,蒲实.无磷耐碱高效螯合分散稳定剂的研制及应用[J].纺织科技进展,2006(6):20-24.[7]魏艳,沈淑英,赵梅,等.磺基水杨酸显色分光光度法测定螯合剂螯合铁能力的研究[J].清洗世界,2009,25(3):23-26.[8]李梦龙.化学数据速查手册[M].北京:化学工业出版社,2003.[9]华东理工大学分析化学教研组等.分析化学[M].北京:高等教育出版社,2001.[10] B.曼努兴等著,王子云摘译.碘量法滴定终点的改进[J].化学世界,1956(7):314.[11]李秀珍.碘量法滴定终点为什么出现“重蓝”现象[J].大学化学,1998,3(4):46-47.样品质量的倒数/g -1■—HPC-1;●—EDTA-2Na图3Fe(OH)3沉淀法测定不同螯合剂的铁螯合值铁螯合值/(m g ·g -1)6020005000300●■●■●■1509012010001500■样品质量的倒数/g -1■—HPC-1;●—EDTA-2Na图4碘量法测定不同螯合剂的铁螯合值铁螯合值/(m g ·g -1)602500500020●■80100100020001500■■●●■40样品质量的倒数/g -1■—络合滴定法;●—Fe(OH)3沉淀法;▲—碘量法图2取样质量不同样品测定值铁螯合值/(m g ·g -1)401500120090060030003020●▲■●▲■●▲■10605056。
各种螯合剂的螯合值对照表
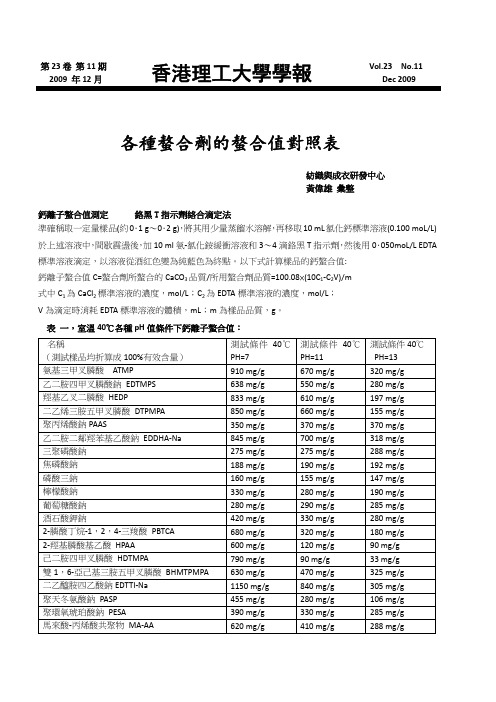
第23卷第11期2009 年12月香港理工大學學報 Vol.23 No.11 Dec 2009各種螯合劑的螯合值對照表紡織與成衣研發中心黃偉雄彙整鈣離子螯合值測定------鉻黑T指示劑絡合滴定法準確稱取一定量樣品(約0.1 g~0.2 g),將其用少量蒸餾水溶解,再移取10 mL氯化鈣標準溶液(0.100 moL/L)於上述溶液中,間歇震盪後,加10 ml氨-氯化銨緩衝溶液和3~4滴鉻黑T指示劑,然後用0.050moL/L EDTA 標準溶液滴定,以溶液從酒紅色變為純藍色為終點。
以下式計算樣品的鈣螯合值:鈣離子螯合值C=螯合劑所螯合的CaCO3品質/所用螯合劑品質=100.08×(10C1-C2V)/m式中C1為CaCl2標準溶液的濃度,mol/L;C2為EDTA標準溶液的濃度,mol/L;V為滴定時消耗EDTA標準溶液的體積,mL;m為樣品品質,g。
表一,室溫40℃各種pH值條件下鈣離子螯合值:名稱(測試樣品均折算成100%有效含量)測試條件40℃PH=7測試條件40℃PH=11測試條件40℃PH=13氨基三甲叉膦酸ATMP 910 mg/g 670 mg/g 320 mg/g 乙二胺四甲叉膦酸鈉EDTMPS 638 mg/g 550 mg/g 280 mg/g 羥基乙叉二膦酸HEDP 833 mg/g 610 mg/g 197 mg/g 二乙烯三胺五甲叉膦酸DTPMPA 850 mg/g 660 mg/g 155 mg/g 聚丙烯酸鈉PAAS 350 mg/g 370 mg/g 370 mg/g 乙二胺二鄰羥苯基乙酸鈉EDDHA-Na 845 mg/g 700 mg/g 318 mg/g 三聚磷酸鈉275 mg/g 275 mg/g 288 mg/g 焦磷酸鈉188 mg/g 190 mg/g 192 mg/g 磷酸三鈉160 mg/g 155 mg/g 147 mg/g 檸檬酸鈉330 mg/g 280 mg/g 190 mg/g 葡萄糖酸鈉280 mg/g 290 mg/g 285 mg/g 酒石酸鉀鈉420 mg/g 330 mg/g 280 mg/g 2-膦酸丁烷-1,2,4-三羧酸PBTCA 680 mg/g 320 mg/g 180 mg/g 2-羥基膦酸基乙酸HPAA 600 mg/g 120 mg/g 90 mg/g 己二胺四甲叉膦酸HDTMPA 790 mg/g 90 mg/g 33 mg/g 雙1,6-亞己基三胺五甲叉膦酸BHMTPMPA 630 mg/g 470 mg/g 325 mg/g 二乙醯胺四乙酸鈉EDTTI-Na 1150 mg/g 840 mg/g 305 mg/g 聚天冬氨酸鈉PASP 455 mg/g 280 mg/g 106 mg/g 聚環氧琥珀酸鈉PESA 390 mg/g 330 mg/g 285 mg/g 馬來酸-丙烯酸共聚物MA-AA 620 mg/g 410 mg/g 288 mg/g第23卷第11期2009 年12月香港理工大學學報 Vol.23 No.11 Dec 2009馬來酸-丙烯酸共聚物MA-AA 620 mg/g 410 mg/g 288 mg/g二乙烯三胺五乙酸五鈉DTPA5Na 420 mg/g 180 mg/g 85 mg/g次氮基三乙酸NTA 480 mg/g 330 mg/g 260 mg/g亞氨基二乙酸IDA 460 mg/g 190 mg/g 70 mg/g矽酸鈉模數=1 270 mg/g 280 mg/g 320 mg/g矽酸鈉模數=3 380 mg/g 335 mg/g 360 mg/g鐵離子螯合值----磺基水楊酸顯色測定待測樣品溶液配製:準確稱取待測樣品5.000 g,加去離子水溶解,移至500mL容量瓶中定容至刻度,搖勻備用待測。
氨基酸金属离子螯合物合成条件及测定方法的研究

氨基酸金属离子螯合物合成条件及测定方法的研究一、本文概述氨基酸金属离子螯合物是一类重要的生物无机化合物,具有广泛的应用价值,包括在医药、农业、食品、环境科学等领域。
这些化合物是由氨基酸分子中的羧基、氨基和侧链功能团与金属离子通过配位键形成的稳定结构。
由于氨基酸的种类繁多,以及金属离子的多样性,使得氨基酸金属离子螯合物的种类非常丰富,其合成条件及测定方法也具有独特性和复杂性。
本文旨在深入研究氨基酸金属离子螯合物的合成条件及测定方法。
我们将探讨不同氨基酸与金属离子形成螯合物的最佳反应条件,包括反应温度、pH值、反应时间、溶剂种类等因素对螯合物形成的影响。
我们将研究氨基酸金属离子螯合物的表征方法,如红外光谱、紫外光谱、核磁共振等,以及测定其稳定性、溶解性等物化性质的方法。
我们还将探讨氨基酸金属离子螯合物的生物活性及其潜在的应用价值。
通过本文的研究,我们期望能够为氨基酸金属离子螯合物的合成提供理论依据和技术支持,为其在各个领域的应用提供基础数据和实验依据。
我们也期望通过本文的研究,能够推动氨基酸金属离子螯合物领域的研究进展,为相关领域的学者和从业者提供有价值的参考信息。
二、氨基酸金属离子螯合物的合成条件研究氨基酸金属离子螯合物的合成是一个涉及多种因素的过程,包括反应温度、pH值、反应时间、氨基酸与金属离子的摩尔比等。
为了优化合成条件,本研究对这些因素进行了系统的研究。
反应温度对螯合物的形成有显著影响。
一般来说,适当的提高温度可以加速反应速率,但过高的温度可能导致反应失控或生成不稳定的副产物。
因此,我们在室温至沸腾温度范围内设置了多个温度点,观察其对螯合物生成的影响。
实验结果显示,在60-80℃的温度范围内,氨基酸与金属离子的螯合反应进行得较为顺利,产物的生成速度和纯度均达到较优水平。
pH值也是影响螯合物合成的重要因素。
氨基酸在不同pH值下具有不同的电离状态,这直接影响其与金属离子的配位能力。
我们通过调整反应溶液的pH值,观察其对螯合物生成的影响。
螯合力及分散力方法汇总

分散剂之螯合力及分散力的测定一、螯合力的测定:1. 乙酸钙滴定法a.迅速准确称取刚干燥后的试样0.5g(准确至0.1mg)于50ml烧杯中。
b.用无CO2的蒸馏水溶解,全部转移至100ml容量瓶中,稀释至刻度,摇匀。
c.用移液管移取25ml上述试样溶液于250ml三角烧瓶中,加入4-5滴Na2C2O4溶液(20g/L),加入5mlNH4Cl-NH3缓冲溶液(PH=10)。
d.用乙酸钙标准溶液{c[Ca(Ac)2]=0.1mol/L}滴定至产生永久性的白色沉淀为终点。
e.样品的钙螯合力x(mg CaCO3/g)计算:x=(V*C*100.08)/(mx*25/100)式中V——滴定样品消耗乙酸钙标准溶液的体积,ml;c——乙酸钙标准溶液的实际浓度,mol/L;m——试样的的质量,g;100.08——碳酸钙的摩尔质量[M(CaCO3)]g/mol。
2. 草酸钙滴定法a.准确称取样品5g(精至0.1mg)于500ml的烧杯中。
b.用无CO2 的蒸馏水溶解稀释,转移至100ml的容量瓶里,补水至刻度,摇匀备用。
c.用25ml的移液管准确量取该溶液25ml于锥形瓶中,加入3%的草酸钠溶液2~3滴,用5ml左右的氨-氯化铵缓冲溶液调节pH 值至10.0~10.5。
d.然后用0.1mol/L的草酸钙标准溶液滴定至出现永久性沉淀为止。
e.按下式计算样品的螯合力:螯合力A(mgCaCO3/g)= V*C*100/ [G*X*(25/100)]式中: V- 滴定样品消耗草酸钙标准溶液的体积,ml;C - 草酸钙标准溶液的浓度,mol/L;G-样品重量, g;X- 样品的含固量,%。
3.氯化钙滴定法a.称取5g螯合剂样品,溶于80mL水中,再加入30%氢氧化钠溶液调节pH值为10一12。
b.加人碳酸钠指示剂(2gNa2CO3溶于100 mL蒸馏水中)2mL,用0.25mol/L氯化钙标准溶液滴定到持久浑浊出现即为终点。
羟基蛋氨酸铁(铜、锰、锌)玫合率的测定

羟基蛋氨酸铁(铜、锰、锌)螯合率的测定长沙兴嘉生物工程有限公司质检中心氨基酸微量元素螯合物的生物利用率比无机离子的利用率高2~3倍,使用氨基酸微量元素螯合物是解决过量添加无机盐造成环境污染这一难题的有效方法,同时也防止了无机盐产生的不良影响及对维生素的拮抗作用。
但氨基酸微量元素螯合物在饲料生产中应用还比较滞后,其原因除了价格因素外,缺乏合适的质量检测方法,也是推广应用的一个重要障碍,目前在产品标签保证值中大多仅明示矿物元素和氨基酸的百分含量,用户无法客观地评价螯合物产品质量。
本研究旨在为羟基蛋氨基酸螯合物的质量检验提供一种简便实用的方法。
1 原理试样经加热溶解、离心分离,分成沉淀态螯合元素、可溶性螯合元素及游离态金属离子。
可溶性螯合元素及游离态金属离子经过凝胶色谱,在规定条件下洗脱,实现可溶性螯合态金属元素和游离态金属离子的分离,从而可分别测得螯合态金属元素和游离态金属离子的含量,分别用原子吸收光谱法测定沉淀态螯合元素、可溶性螯合元素及游离态金属离子的含量,即可计算出相应的氨基酸螯合物的螯合率。
2 试剂和材料实验用水应符合GB6682中三级用水的规格,使用试剂除特殊规定外,均为分析纯。
2.1 克拉克—鲁布斯(Clark—lubs)缓冲溶液的配制2.1.1 pH7.0的克拉克—鲁布斯(Clark—lubs)缓冲液的配制分别量取1.0mL氢氧化钠(0.1mol/L)溶液,12.5mL硼酸(0.4mol/L)溶液,12.5mL氯化钾(0.4mol/L)溶液,注入100mL容量瓶,稀释至刻度。
2.1.2 pH9.0的克拉克—鲁布斯(Clark—lubs)缓冲液分别量取20.8mL氢氧化钠(0.1mol/L)溶液,12.5mL硼酸(0.4mol/L)溶液,12.5mL氯化钾(0.4mol/L)溶液,注入100mL容量瓶,稀释至刻度。
2.1.3 pH10.0的克拉克—鲁布斯(Clark—lubs)缓冲液分别量取43.7mL氢氧化钠(0.1mol/L)溶液,12.5mL硼酸(0.4mol/L)溶液,12.5mL氯化钾(0.4mol/L)溶液,注入100mL容量瓶,稀释至刻度。
各种水处理药剂单体螯合值
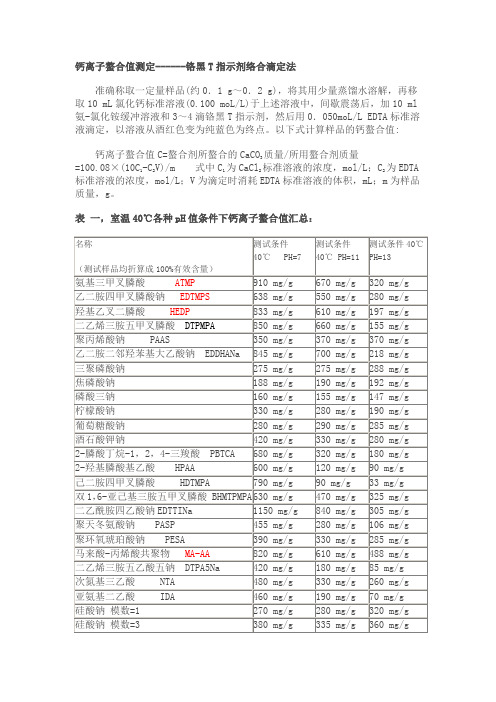
钙离子螯合值测定------铬黑T指示剂络合滴定法准确称取一定量样品(约0.1 g~0.2 g),将其用少量蒸馏水溶解,再移取10 mL氯化钙标准溶液(0.100 moL/L)于上述溶液中,间歇震荡后,加10 ml 氨-氯化铵缓冲溶液和3~4滴铬黑T指示剂,然后用0.050moL/L EDTA标准溶液滴定,以溶液从酒红色变为纯蓝色为终点。
以下式计算样品的钙螯合值:钙离子螯合值C=螯合剂所螯合的CaCO3质量/所用螯合剂质量=100.08×(10C1-C2V)/m 式中C1为CaCl2标准溶液的浓度,mol/L;C2为EDTA标准溶液的浓度,mol/L;V为滴定时消耗EDTA标准溶液的体积,mL;m为样品质量,g。
表一,室温40℃各种pH值条件下钙离子螯合值汇总:铁离子螯合值----磺基水杨酸显色测定待测样品溶液配制:准确称取待测样品5.000 g,加去离子水溶解,移至500mL 容量瓶中定容至刻度,摇匀备用待测。
Fe3+滴定法(磺基水杨酸显色)移取配制好的样品溶液2 mL于250 mL锥形瓶中,加30 mL水和5滴2%磺基水杨酸,用0.01 mol/L硫酸铁铵标准溶液滴定至溶液由无色变成微红色为终点.计算公式如下: X=Vcx159.6 x250/m式中,V为样品消耗硫酸铁铵溶液的体积(mL);c为硫酸铁铵溶液的浓度(mol/L);m为样品质量(g).表二,100℃各种pH值条件下铁离子螯合值汇总:增稠剂:(1)无机增稠剂(气相法白炭黑、钠基膨润土、有机膨润土、硅藻土、凹凸棒石土、分子筛、硅凝胶)。
(2)纤维素醚(甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、羟乙基纤维素)。
(3)天然高分子及其衍生物(淀粉、明胶、海藻酸钠、干酪素、瓜尔胶、甲壳胺、阿拉伯树胶、黄原胶、大豆蛋白胶、天然橡胶、羊毛脂、琼脂)。
(4)合成高分子(聚丙烯酰胺、聚乙烯醇、聚乙烯吡咯烷酮、聚氧化乙烯、卡波树脂、聚丙烯酸、聚丙烯酸钠、聚丙烯酸酯共聚乳液、顺丁橡胶、丁苯橡胶、聚氨酯、改性聚脲、低分子聚乙烯蜡)。
不同pH值条件下螯合剂对铁、钙、镁等离子的螯合常数

不同pH值条件下螯合剂对铁、钙、镁等离子的螯合常数一,螯合分散剂用途纺织工业:1,退浆在退浆液中添加螯合剂,不管使用哪种退浆方法,可使退浆效率大大提高。
这是因为它把与浆料反应的金属离子络合以后,提高了浆膜的可溶胀性,也提高了浆料与退浆剂的可反应性,从而很容易从织物上去除。
2,前处理主要用作双氧水漂白的稳定剂,控制双氧水缓慢平稳的分解,提高双氧水利用率;同时防止金属离子导致的局部剧烈分解,引起织物纤维断裂形成破洞。
3,染色染色过程使用的水、芒硝、纯碱、氯化钠等都含有一定的杂质,在杂质的影响下,染料会引起沉淀。
特别是鲜艳的色系染色时,加入螯合剂可使色泽更加鲜艳,而对染料的磨擦牢度及匀染没有不良影响。
在染硫化染料时,更可防止起铜镜面的效果出现。
造纸工业:金属离子在纸浆漂白过程中引起的反应沉淀结垢,漂白剂无效分解,纸浆返黄等不良后果,纸浆漂白工艺中也需要使用螯合剂减少漂白的副作用,避免Fe3+离子与纸浆中的酚基团反应形成深颜色的复合物,保护纤维,提高纸浆白度,减少纸浆返黄。
循环水阻垢:在水处理中需要螯合剂用作循环冷却水和锅炉水的阻垢缓蚀剂,特别是针对含碳酸钡高的油田注水和冷却水、锅炉水的阻垢缓蚀剂。
清洗领域:无论是在工业清洗还是民用洗衣粉等日化产品,都需要螯合剂改善水质,提高净洗效果。
二,螯合剂的选用螯合剂种类繁多,如何选择适合的螯合剂则是我们最头疼和迷惑的地方,螯合力-稳定系数K是重要的参考指标,稳定系数K值越大,表明螯合剂对该离子的螯合能力越大。
下图为不同螯合剂对铁、钙、镁离子的螯合常数K值。
酸碱(pH值)对螯合剂螯合力影响在大多数使用螯合剂的工艺里面,工作液往往为酸性或碱性,因此pH值对螯合剂的影响对于螯合剂的选择与应用,尤为重要。
因此绘制出不同pH值条件下的螯合力曲线图,具有重要的实际意义,从而可以根据实际应用工艺条件,选择适合的螯合剂。
图表1铁离子螯合值(螯合值K)与pH曲线图表2钙离子螯合值(螯合值K)与pH曲线图表3镁离子螯合值(螯合值K)与pH曲线三,几种螯合剂的综合应用评价无机磷酸盐类:三聚磷酸钠以及焦磷酸钠是常用的螯合剂,自身带有弱碱性质,多用于洗衣粉添加剂。
铁离子螯合能力与还原力测定

铁离子螯合能力测定
1.溶液配制
2mM FeCl2:
称取0.02g FeCl2.4H2O,定容至50mL。
5mM 菲洛嗪
称取0.05g 菲洛嗪,定容至20mL。
10% 柠檬酸
称取5g柠檬酸,定容至50mL
2.测定步骤
在试管中分别加入1mL样品,加蒸馏水至5mL,同时加入0.1mL 2mM的FeCl2和0.2mL 5mM的菲洛嗪溶液,反应10min后于562nm下测定吸光值。
以0.1mg/mLBHA、BHT及10%的柠檬酸作为阳性对照。
还原力测定
1.溶液配制
2M磷酸缓冲液(pH6.6):
1.95g NaH2PO4.2H2O,
2.68g Na2HPO4.12H2O,定容至100mL。
1%铁氰化钾
0.5g铁氰化钾,定容至50mL。
10%三氯乙酸
5g三氯乙酸,定容至50mL。
0.1%三氯化铁
0.05g三氯化铁,定容至50mL。
2.测定步骤
在试管中分别加入0.5mL的样品。
同时加入2.5mL的磷酸缓冲液(0.2mol/L,pH6.6)和2.5mL 1%的铁氰化钾溶液。
混合物50℃水浴20min 后加入2.5mL 10%的三氯乙酸,室温静置10min。
取2.5mL反应液,加入2.5mL 蒸馏水和0.5mL 0.1%氯化铁溶液。
反应10min后测定700nm处吸光值,该值越高说明样品的还原性越强。
以0.1mg/mL的BHA和BHT为阳性对照。
THANKS !!!
致力为企业和个人提供合同协议,策划案计划书,学习课件等等
打造全网一站式需求
欢迎您的下载,资料仅供参考。
谷氨酸二乙酸四钠的螯合值

谷氨酸二乙酸四钠的螯合值
摘要:
I.谷氨酸二乙酸四钠概述
- 谷氨酸二乙酸四钠的定义
- 谷氨酸二乙酸四钠的用途
II.谷氨酸二乙酸四钠的螯合值
- 谷氨酸二乙酸四钠的螯合值定义
- 谷氨酸二乙酸四钠的螯合值重要性
- 谷氨酸二乙酸四钠的螯合值测量方法
III.谷氨酸二乙酸四钠的应用领域
- 在食品工业中的应用
- 在农业中的应用
- 在医药行业中的应用
IV.谷氨酸二乙酸四钠的展望
- 谷氨酸二乙酸四钠的未来发展趋势
- 谷氨酸二乙酸四钠的潜在应用领域
正文:
谷氨酸二乙酸四钠(英文名:Sodium Glutamate Diacetate Tetrahydrate)是一种多功能的螯合剂,广泛应用于食品、农业和医药行业中。
作为一种无磷、生物降解性高的螯合剂,谷氨酸二乙酸四钠可以有效提高产品的稳定性和品质。
谷氨酸二乙酸四钠的螯合值是其特性的一种重要表现,能够反映其在特定条件下与其他物质的结合能力。
螯合值的大小直接影响到谷氨酸二乙酸四钠在实际应用中的效果。
因此,准确测量谷氨酸二乙酸四钠的螯合值具有重要意义。
在食品工业中,谷氨酸二乙酸四钠常被用作调味剂,能够增强食物的鲜味,改善口感。
此外,它还可以作为防腐剂,延长食品的保质期。
在农业领域,谷氨酸二乙酸四钠可以作为植物生长调节剂,提高农作物的产量和品质。
在医药行业,谷氨酸二乙酸四钠被用于制造药物,具有很高的药用价值。
总之,谷氨酸二乙酸四钠作为一种具有广泛应用前景的螯合剂,其螯合值的研究对于指导实际应用具有重要意义。
强碱条件下如何滴定螯合剂的螯合能力
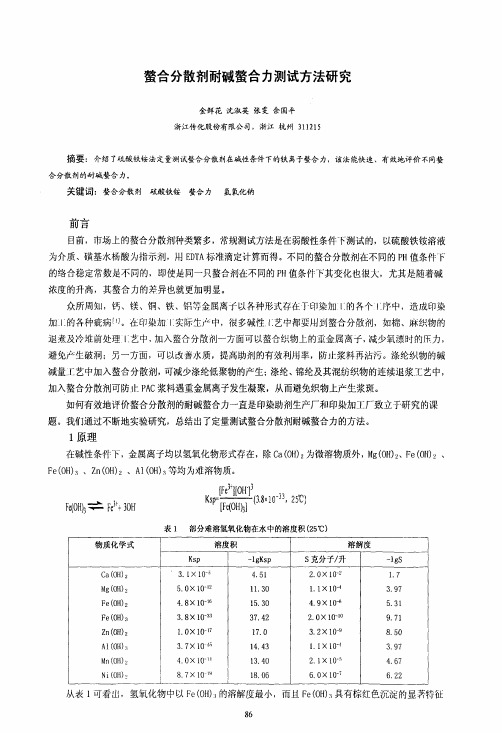
第13卷第21期2009 年12月香港理工大學學報 Vol.13 No.21 Dec 2009各種螯合劑的螯合值對照表紡織與成衣研發中心黃偉雄彙整鈣離子螯合值測定------鉻黑T指示劑絡合滴定法準確稱取一定量樣品(約0.1 g~0.2 g),將其用少量蒸餾水溶解,再移取10 mL氯化鈣標準溶液(0.100 moL/L)於上述溶液中,間歇震盪後,加10 ml氨-氯化銨緩衝溶液和3~4滴鉻黑T指示劑,然後用0.050moL/L EDTA 標準溶液滴定,以溶液從酒紅色變為純藍色為終點。
以下式計算樣品的鈣螯合值:鈣離子螯合值C=螯合劑所螯合的CaCO3品質/所用螯合劑品質=100.08×(10C1-C2V)/m式中C1為CaCl2標準溶液的濃度,mol/L;C2為EDTA標準溶液的濃度,mol/L;V為滴定時消耗EDTA標準溶液的體積,mL;m為樣品品質,g。
表一,室溫40℃各種pH值條件下鈣離子螯合值:名稱(測試樣品均折算成100%有效含量)測試條件40℃PH=7測試條件40℃PH=11測試條件40℃PH=13氨基三甲叉膦酸ATMP 910 mg/g 670 mg/g 320 mg/g 乙二胺四甲叉膦酸鈉EDTMPS 638 mg/g 550 mg/g 280 mg/g 羥基乙叉二膦酸HEDP 833 mg/g 610 mg/g 197 mg/g 二乙烯三胺五甲叉膦酸DTPMPA 850 mg/g 660 mg/g 155 mg/g 聚丙烯酸鈉PAAS 350 mg/g 370 mg/g 370 mg/g 乙二胺二鄰羥苯基乙酸鈉EDDHA-Na 845 mg/g 700 mg/g 318 mg/g 三聚磷酸鈉275 mg/g 275 mg/g 288 mg/g 焦磷酸鈉188 mg/g 190 mg/g 192 mg/g 磷酸三鈉160 mg/g 155 mg/g 147 mg/g 檸檬酸鈉330 mg/g 280 mg/g 190 mg/g 葡萄糖酸鈉280 mg/g 290 mg/g 285 mg/g 酒石酸鉀鈉420 mg/g 330 mg/g 280 mg/g 2-膦酸丁烷-1,2,4-三羧酸PBTCA 680 mg/g 320 mg/g 180 mg/g 2-羥基膦酸基乙酸HPAA 600 mg/g 120 mg/g 90 mg/g 己二胺四甲叉膦酸HDTMPA 790 mg/g 90 mg/g 33 mg/g 雙1,6-亞己基三胺五甲叉膦酸BHMTPMPA 630 mg/g 470 mg/g 325 mg/g 二乙醯胺四乙酸鈉EDTTI-Na 1150 mg/g 840 mg/g 305 mg/g 聚天冬氨酸鈉PASP 455 mg/g 280 mg/g 106 mg/g 聚環氧琥珀酸鈉PESA 390 mg/g 330 mg/g 285 mg/g 馬來酸-丙烯酸共聚物MA-AA 620 mg/g 410 mg/g 288 mg/g第13卷第21期2009 年12月香港理工大學學報 Vol.13 No.21 Dec 2009馬來酸-丙烯酸共聚物MA-AA 620 mg/g 410 mg/g 288 mg/g二乙烯三胺五乙酸五鈉DTPA5Na 420 mg/g 180 mg/g 85 mg/g次氮基三乙酸NTA 480 mg/g 330 mg/g 260 mg/g亞氨基二乙酸IDA 460 mg/g 190 mg/g 70 mg/g矽酸鈉模數=1 270 mg/g 280 mg/g 320 mg/g矽酸鈉模數=3 380 mg/g 335 mg/g 360 mg/g鐵離子螯合值----磺基水楊酸顯色測定待測樣品溶液配製:準確稱取待測樣品5.000 g,加去離子水溶解,移至500mL容量瓶中定容至刻度,搖勻備用待測。
谷氨酸二乙酸四钠的螯合值

谷氨酸二乙酸四钠(又称EDTA四钠)是一种广泛应用于工业、医药和环境领域的重要螯合剂。
它具有优异的络合性能,在配位化学中发挥着重要作用。
本文将详细介绍谷氨酸二乙酸四钠的螯合值,包括其定义、测定方法、影响因素以及应用领域等方面。
一、谷氨酸二乙酸四钠的定义谷氨酸二乙酸四钠是一种有机螯合剂,化学式为Na4C10H12N2O8,相对分子质量为380.17。
它是由谷氨酸和乙醇酸反应生成的四钠盐,具有六个配位位点,可与金属离子形成络合物。
二、螯合值的概念螯合值是指单位螯合剂与金属离子形成1:1络合物所需的螯合剂的用量。
对于谷氨酸二乙酸四钠而言,其螯合值即为与金属离子形成1:1络合物所需的谷氨酸二乙酸四钠的用量。
三、螯合值的测定方法谷氨酸二乙酸四钠的螯合值可以通过滴定法进行测定。
具体步骤如下:1. 准备样品溶液:将待测金属离子的溶液与适量的谷氨酸二乙酸四钠加入容器中,使其达到一定的浓度。
2. 加入指示剂:通常使用金属指示剂,如巴西木素(Br-PADAP)。
加入适量的指示剂后,样品溶液会发生颜色变化。
3. 滴定:以含有已知浓度的谷氨酸二乙酸四钠的溶液作为滴定剂,滴定至颜色变化消失为止。
4. 计算螯合值:根据滴定剂消耗的体积和浓度,计算出螯合值。
四、影响谷氨酸二乙酸四钠螯合值的因素1. pH值:谷氨酸二乙酸四钠的螯合能力受pH值的影响。
在不同pH值下,其螯合值可能存在差异。
2. 金属离子的种类和浓度:不同金属离子对谷氨酸二乙酸四钠的络合能力不同。
一般来说,过渡金属离子的络合能力较强。
3. 温度:温度对谷氨酸二乙酸四钠的螯合值也有一定影响,通常情况下,提高温度可以增加络合反应的速率。
五、谷氨酸二乙酸四钠的应用领域1. 工业应用:谷氨酸二乙酸四钠可用作工业废水处理、金属清洗剂、电镀添加剂等,通过与金属离子形成络合物,从而达到去除有害金属离子、防止金属腐蚀等目的。
2. 医药应用:谷氨酸二乙酸四钠在医药领域中被广泛应用于螯合剂、钙离子拮抗剂、防止血液凝固剂等制剂的配方中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验方法
鳌合力的测定方法
1.1 鳌合力的测定
1.1.1 试剂溶液
2%的Na2C2O2水溶液
NH4Cl—NH3缓冲溶液(PH值=10)
1.1.2 0.1mol/L乙酸钙标准溶液标定与制备
1.1.
2.1 0.1mol/L乙酸钙标准溶液标定方法
用10ml移液管准确移取待标定乙酸钙溶液10ml于250ml三角瓶中,加入1mol/L的NaOH溶
液5ml,再加入钙指示剂0.1g(钙指示剂:NaCl=1:100经研磨备用),以0.05mol/LEDTA标
准溶液进行滴定,滴定至溶液由紫红色变成纯蓝色即为终点。
1.1.
2.2 计算
C EDTA mol/L×V EDTA ml
乙酸钙mol/L=-----------------------------------------------
V乙酸钙ml
1 .1.3 NH4Cl—NH3缓冲溶液的制备
称取54gNH4Cl加入350mlNH3·.H2O稀释至1000ml即可。
1. 1. 4 仪器
试验室常用仪器
1. 1. 5 分析方法
迅速准确称取5. 5. 2干燥后的样品0.5±0.0001g(精确至0.1mg)于50ml烧杯中,用除CO2的蒸馏水溶解。
全部移入100ml容量瓶中稀释至刻度,摇匀备用。
用25ml移液管,准确移取上述溶液25ml于100ml三角瓶中,加入2%Na2 C2O4溶液4—5滴,加入NH4Cl—NH3缓冲溶液5ml调节PH值为10.0—10.5,然后用0.1mol/L乙酸钙溶液滴定至产生永久性白色沉淀为终点。
1. 1. 6 计算
V ×C ×100
螯合力CaCO3mg/g(干基)=——————————————
F ×M ×25%
式中:V—滴定样品消耗乙酸钙标准溶液体积(ml)
C—乙酸钙标准溶液的浓度
100—1ml的1mol/l乙酸钙溶液相当于CaCO3量(mg)
m—样品重量(g)
25%—分取样品系数
F—给定的有效成分含量(%)
1. 3 分散力的测定(CaCO3法)
1. 3. 1 试剂和溶液
乙酸钙标准溶液: C乙酸钙=0.1mol/L C NaOH=1mol/L
实验室常用仪器
1. 3. 2 分析方法
称取1g试样(精确至0.0001g) ,于250ml锥形瓶中, 加入100ml去离子水充分溶解, 再加入10ml10%碳酸钠溶液摇匀, 用1mol/L氢氧化钠调PH值至11, 然后用0.1mol/L的乙酸钙标准溶液滴至产生永久性白色沉淀。
1. 3.3 结果计算
分散力按下列公式计算:
V ×C ×100
分散力CaCO3mg/g(干基)=————————————————
m ×F
V—乙酸钙标准溶液消耗体积,ml
C—乙酸钙标准溶液的摩尔浓度,mol/L
m—试样的质量,g
100—碳酸钙的摩尔质量,g/mol
F—给定的有效成分的含量(%)
实验样品::ATMP,HEDP,HEDP固体,ATMP固体,HPMA,复合阻垢剂,ATMP,HEDP,DTPMP,PBTC,HPMA,EDTMP,DTPMP,PBTCA,PAA(S),HPMA,HEDP钠,ATMP 钠,MA/AA共聚物,AA/AMPS共聚物,分散剂,缓蚀阻垢剂。
