关于成人和儿童不良事件严重程度分级表
护理不良事件评定

护理不良事件定性标准及处理程序护理不良事件是指在护理过程中发生的、不在计划中期间发生的跌倒、用药错误、走失、误吸或窒息、烫伤及其他与患者安全相关的、非正常的护理意外事件。
包括护理事故、护理差错、护理缺点。
一、护理事故(一)定义:指在护理工作中,由于护理人员的过失造成病人死亡、残疾、器官组织损伤,导致功能障碍及明显人身损害的其他后果。
(二)分类:分一、二、三、四级1、一级护理事故:造成患者死亡、重度残疾的;2、二级护理事故:造成患者中度残疾、器官组织损伤导致严重功能障碍的;3、三级护理事故:造成患者轻度残疾、器官组织损伤导致一般功能障碍的;4、四级护理事故:造成患者明显人身损害的其他后果的。
(三)评定标准1、护理人员工作不负责任,交接班不认真,观察病情不细致,病情变化发现不及时,以致失去抢救机会,造成严重不良后果者。
2、不认真执行查对制度而打错针、发错药、输错血、输错液体;护理不周到,发生严重烫伤或Ⅲ期褥疮,昏迷躁动病人或无陪伴的小儿坠床,造成严重不良后果者。
3、对疑难问题,不请示汇报、主观臆断、擅自盲目处理,造成严重不良后果者。
4、抢救器械、药品供应延误,供应过期的或灭菌不合格的药品器械、敷料,或未遵守无菌操作原则而发生感染,造成严重不良后果者。
5、器械护士未严格清点手术敷料、器械,造成严重不良后果者。
6、局部注射造成组织坏死,成人大于体表面积2%,儿童大于体表面积5%。
(四)处理程序1、护理部、科室应建立护理不良事件登记本,对发生的护理事故进行登记。
2、凡发生护理事故,应当立即向护士长及科主任报告,护士长应立即向护理部报告,护理部应立即调查核实,将有关情况如实向主管院长汇报,同时做好患者解释工作。
3、指定专人妥善保管相关的原始资料及物品,严禁涂改、伪造、隐匿、销毁病历资料,因输液、输血、注射、服药等引起的不良后果,医患双方应当场封存保留现场实物,以备检验。
4、对发生事故的责任人,应根据《医疗事故处理条例》的有关规定进行处理。
关于成人和儿童不良事件严重程度分级表 2.0 2014 NIH DAIDS

Division of AIDS (DAIDS) Table for Grading the Severity of Adult and Pediatric Adverse EventsVersion 2.0November 2014Division of AIDSNational Institute of Allergy and Infectious DiseasesNational Institutes of HealthUS Department of Health and Human ServicesTable of ContentsGlossary and Acronyms (1)Introduction (3)Instructions for Use (4)Major Clinical Conditions (7)Cardiovascular (7)Dermatologic (9)Endocrine and Metabolic (10)Gastrointestinal (11)Musculoskeletal (13)Neurologic (14)Pregnancy, Puerperium, and Perinatal (16)Psychiatric (17)Respiratory (18)Sensory (19)Systemic (20)Urinary (22)Site Reactions to Injections and Infusions (23)Laboratory Values (24)Chemistries (24)Hematology (27)Urinalysis (29)Appendix A. Total Bilirubin Table for Term and Preterm Neonates (30)Glossary and AcronymsAE Adverse event; Any unfavorable and unintended sign (including anabnormal laboratory finding), symptom, or disease temporallyassociated with the use of a medical treatment or procedure regardlessof whether it is considered related to the medical treatment orprocedure.ALT (SGPT) Alanine aminotransferase (serum glutamic pyruvic transaminase) ANC Absolute neutrophil countAST (SGOT) Aspartate aminotransferase (serum glutamic-oxaloacetic transaminase) AV AtrioventricularBasic Self-care Functions AdultActivities such as bathing, dressing, toileting, transfer or movement,continence, and feeding.Young ChildrenActivities that are age and culturally appropriate, such as feeding one’sself with culturally appropriate eating implements.BMI z-score Body mass index z- score; A body reference norm. Specifically, thenumber of standard deviations a participant's BMI differs from theaverage BMI for their age, sex, and ethnicity.BMD t-score Bone mineral density t-score; The number of standard deviations aboveor below the mean bone mineral density of a healthy 30 year old adultof the same sex and ethnicity as the participant.BMD z-score Bone mineral density z-score; The number of standard deviations aparticipant's BMD differs from the average BMD for their age, sex, andethnicity.BPAP Bilevel positive airway pressure; A mode used during noninvasivepositive pressure ventilation.Chemical Pregnancy A pregnancy in which a positive pregnancy test is followed by anegative pregnancy test without evidence of a clinical pregnancy loss. CNS Central nervous systemCPAP Continuous positive airway pressureDAERS DAIDS Adverse Experience Reporting System; An internet-basedsystem developed for clinical research sites to report ExpeditedAdverse Events (EAEs) to DAIDS. It facilitates timely EAE reportsubmission and serves as a centralized location for accessing andprocessing EAE information for reporting purposes.Disability A substantial disruption of a person’s ability to conduct normal lifefunctions.ECG ElectrocardiogrameGFR Estimated glomerular filtration rateHospitalization Does not include the following hospital admissions: under 24 hours,unrelated to an adverse event (e.g., for labor and delivery, cosmeticsurgery, social or administrative for temporary placement [for lack of aplace to sleep]), protocol-specified, and for diagnosis or therapy of acondition that existed before the receipt of a study agent and which hasnot increased in severity or frequency.INR International normalized ratioGlossary and AcronymsIntervention Medical, surgical, or other procedures recommended or provided by ahealthcare professional for the treatment of an adverse event.IV IntravenousIVIG Intravenous immune globulinLDL Low density lipoproteinLLN Lower limit of normalLife-threatening AE Any adverse event that places the participant, in the view of theinvestigator, at immediate risk of death from the reaction when itoccurred (i.e., it does not include a reaction that would have causeddeath if it had occurred in a more severe form).NA Not applicableParticipant ID The identification number assigned to a study participant which is usedto track study-related documentation, including any reported AEs.PR Interval The interval between the beginning of the P wave and the beginning ofthe QRS complex of an electrocardiogram that represents the timebetween the beginning of the contraction of the atria and the beginningof the contraction of the ventricles.PT Prothrombin timePTT Partial thromboplastin timeQTc Interval The measure of time between the onset of ventricular depolarizationand completion of ventricular repolarization corrected for ventricularrate.RBC Red blood cellSI Standard international unitULN Upper limit of normalUsual Social & Functional Activities Activities which adults and children perform on a routine basis andthose which are part of regular activities of daily living, for example:AdultsAdaptive tasks and desirable activities, such as going to work,shopping, cooking, use of transportation, or pursuing a hobby.Young ChildrenActivities that are age and culturally appropriate, such as socialinteractions, play activities, or learning tasks.WBC White blood cellWHO World Health OrganizationWNL Within normal limitsIntroductionThe Division of AIDS (DAIDS) oversees clinical trials throughout the world which it sponsors and supports. The clinical trials evaluate the safety and efficacy of therapeutic products, vaccines, and other preventive modalities. Adverse event (AE) data collected during these clinical trials form the basis for subsequent safety and efficacy analyses of pharmaceutical products and medical devices. Incorrect and inconsistent AE severity grading can lead to inaccurate data analyses and interpretation, which in turn can impact the safety and well-being of clinical trial participants and future patients using pharmaceutical products.The DAIDS AE grading table is a shared tool for assessing the severity of AEs (including clinical and laboratory abnormalities) in participants enrolled in clinical trials. Over the years as scientific knowledge and experience have expanded, revisions to the DAIDS AE grading table have become necessary.The Division of AIDS (DAIDS) Table for Grading the Severity of Adult and Pediatric Adverse Events, Version 2.0 replaces the grading table published in 2004 and updated in 2009. In version 2.0, AEs not previously included, but which now are deemed medically important events, are included while other AEs have been removed. Some AE severity grading descriptions have been revised to more appropriately reflect the presentation of these events in clinical settings and their impact on clinical trials. For example, DAIDS performed an extensive literature search and reviews of select DAIDS clinical trial data in revising certain hematology parameters (i.e., hemoglobin, white cell counts, and absolute neutrophil counts). DAIDS also took into consideration the U.S. Food and Drug Administration’s guidance regarding the use of local laboratory reference values and ethnic differences among certain healthy adolescent and adult populations in defining parameter limits. Finally, the revised DAIDS AE grading table also contains an updated glossary and acronyms section, an expanded instructions for use section, and an appendix that provides more age-specific information for an AE of concern to DAIDS. DAIDS is grateful to the DAIDS Grading Table Working Group, numerous government and non-government affiliated medical subject matter experts and reviewers who were instrumental in the revision of the DAIDS AE grading table.Instructions for UseGeneral ConsiderationsThe Division of AIDS (DAIDS) Table for Grading the Severity of Adult and Pediatric Adverse Events, Version 2.0 consists of parameters, or AEs, with severity grading guidance that are to be used in DAIDS clinical trials for safety data reporting to maintain accuracy and consistency in the evaluation of AEs. The term “severe” is not the same as the term “serious” in classifying AEs. The severity of a specific event describes its intensity, and it is the intensity which is graded. Seriousness, which is not graded, relates to an outcome of an AE and is a regulatory definition.Clinical sites are encouraged to report parameters in the DAIDS AE grading table as they are written to maintain data consistency across clinical trials. However, since some parameters can be reported with more specificity, clinical sites are encouraged to report parameters that convey additional clinical information. For example, diarrhea could be reported as neonatal diarrhea; seizures, as febrile seizures; and pain, as jaw pain.The DAIDS AE grading table provides an AE severity grading scale ranging from grades 1 to 5 with descriptions for each AE based on the following general guidelines:•Grade 1 indicates a mild event•Grade 2 indicates a moderate event•Grade 3 indicates a severe event•Grade 4 indicates a potentially life-threatening event•Grade 5 indicates death (Note: This grade is not specifically listed on each page of the grading table).Other points to consider include:•Use parameters defined by age and sex values as applicable.•Male and female sex are defined as sex at birth.•Unless noted, laboratory values are for term neonates. Preterm neonates should be assessed using local laboratory normal ranges.•Where applicable, Standard International (SI) units are included in italics.Selecting and Reporting a Primary AE TermWhen selecting a primary AE term to report, sites should select the term that best describes what occurred to the participant. For example, a participant may present with itching, urticaria, flushing, angioedema of the face, and dyspnea. If the underlying diagnosis is determined to be an acute allergic reaction, sites should report “Acute Allergic Reaction” as the primary AE term. Primary AE terms should be reported using the DAIDS Adverse Experience Reporting System (DAERS) only if they meet expedited reporting criteria. However, all primary AE terms should be reported using protocol-specific case report forms (CRFs). Because the reported information is stored in different databases (i.e., safety and clinical), sites should report primary AE terms using the same terminology for data consistency.When reporting using DAERS, other clinically significant events associated with a primary AE term that more fully describe the nature, severity, or complications of the primary AE term should be entered in the “Other Events” section. However, the severity grade for these events must be lower than or equal to the severity grade of the primary AE term. In the example above, dyspnea and angioedema of the face may be entered in the “Other Events” section, because they are more descriptive and provide additional information on the severity of the acute allergic reaction. However, their severity grades must be lower than or equal to the severity grade of the primary AE term of “Acute Allergic Reaction”.Differences exist in the reporting and recording of information (e.g., signs and symptoms, clinically significant events) in DAERS and CRFs. Therefore, sites should refer to their protocols and CRF requirements for further instructions.Grading Adult and Pediatric AEsWhen a single parameter is not appropriate for grading an AE in both adult and pediatric populations, separate parameters with specified age ranges are provided. If no distinction between adult and pediatric populations has been made, the listed parameter should be used for grading an AE in both populations.Reporting Pregnancy OutcomesIn the Pregnancy, Puerperium, and Perinatal section, all parameters are pregnancy outcomes and should be reported using the mother's participant ID. If an infant is not enrolled in the same study as the mother, any identified birth defects should be reported using the mother's participant ID. However, if an infant is enrolled in the same study as the mother or in another study, any identified birth defects should be reported using the infant's participant ID. Sites should refer to the applicable network standards for reporting abnormal pregnancy outcomes on the CRFs. Determining Severity Grade for Parameters between GradesIf the severity of an AE could fall in either one of two grades (i.e., the severity of an AE could be either grade 2 or grade 3), sites should select the higher of the two grades.Laboratory ValuesGeneral. An asymptomatic, abnormal laboratory finding without an accompanying AE should not be reported to DAIDS in an expedited timeframe unless it meets protocol-specific reporting requirements. Sites should refer to the applicable network standards for reporting abnormal laboratory findings on the CRFs.Values below Grade 1. Any laboratory value that is between the ULN and grade 1 (for high values) or the LLN and grade 1 (for low values) should not be graded or reported as an AE. Sites should consult the Manual for Expedited Reporting of Adverse Events to DAIDS, Version 2.0 and their protocol when making an assessment of the need to report an AE.Overlap of Local Laboratory Normal Values with Grading Table Ranges. When local laboratory normal values fall within grading table laboratory ranges, the severity grading is based on the ranges in the grading table unless there is a protocol-specific grading criterion for the laboratoryvalue. For example, “Magnesium, Low" has a grade 1 range of 1.2 to < 1.4 mEq/L, while a particular laboratory’s normal range for magnesium may be 1.3 to 2.8 mEq/L. If a study participant’s magnesium laboratory value is 1.3 mEq/L, the laboratory value should be graded as grade 1.Appendix UsageAppendix A takes priority over the main grading table in all assessments of total bilirubin for term and preterm neonates.Using Addenda 1-3: Grading Tables Used in Microbicide StudiesIn protocols involving topical application of products to the female and male genital tracts or rectum, strong consideration should be given to using Addenda 1-3 (see below) as the primary grading tables for these areas. Although these grading tables are used specifically in microbicide studies, they may be used in other protocols as adjuncts to the main grading table (i.e., the Division of AIDS (AIDS) Table for Grading the Severity of Adult and Pediatric Adverse Events, Version 2.0). It should be clearly stated in a protocol which addendum is being used as the primary grading table (and thus takes precedence over the main grading table) and which addendum is being used in a complementary fashion.•Addendum 1 – Female Genital Grading Table for Use in Microbicide Studies – PDF •Addendum 2 – Male Genital Grading Table for Use in Microbicide Studies – PDF •Addendum 3 – Rectal Grading Table for Use in Microbicide Studies – PDFEstimating Severity Grade for Parameters Not Identified in the Grading TableThe functional table below should be used to grade the severity of an AE that is not specifically identified in the grading table. In addition, all deaths related to an AE are to be classified as grade 5.Major Clinical ConditionsCardiovascular1 Blood pressure norms for children < 18 years of age can be found in: Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents. Pediatrics 2011;128;S213; originally published online November 14, 2011; DOI: 10.1542/peds.2009-2107C.Cardiovascular2 As per Bazett’s formula.Dermatologic3 For pruritus associated with injections or infusions, see the Site Reactions to Injections and Infusions section (page 23).Endocrine and Metabolic4 Definition: A disorder characterized by fat loss in the face, extremities, and buttocks.5 Definition: A disorder characterized by abnormal fat accumulation on the back of the neck, breasts, and abdomen.Musculoskeletal6 BMD t and z scores can be found in: Kanis JA on behalf of the World Health Organization Scientific Group (2007). Assessment of osteoporosis at the primary health-care level. Technical Report. World Health Organization Collaborating Centre for Metabolic Bone Diseases, University of Sheffield, UK. 2007: Printed by the University of Sheffield.Pregnancy, Puerperium, and Perinatal7 Definition: A delivery of a live-born neonate occurring at ≥ 20 to < 37 weeks gestational age.8 Definition: A clinically recognized pregnancy occurring at < 20 weeks gestational age.PsychiatricRespiratorySensory9 Definition: A disorder characterized by nausea, headache, tachycardia, hypotension, rash, and/or shortness of breath.10 For pain associated with injections or infusions, see the Site Reactions to Injections and Infusions section (page 23).11 Definition: A disorder characterized by fever, arthralgia, myalgia, skin eruptions, lymphadenopathy, marked discomfort, and/or dyspnea.12 WHO reference tables may be accesed by clicking the desired age range or by accessing the following URLs: http://www.who.int/growthref/who2007_bmi_for_age/en/ for participants > 5 to 19 years of age andhttp://www.who.int/childgrowth/standards/chart_catalogue/en/ for those ≤ 5 years of age.UrinarySite Reactions to Injections and Infusions13 Injection Site Erythema or Redness should be evaluated and graded using the greatest single diameter or measured surface area.Laboratory ValuesChemistries14 Direct bilirubin > 1.5 mg/dL in a participant < 28 days of age should be graded as grade 2, if < 10% of the total bilirubin.15 Use the applicable formula (i.e., Cockroft-Gault in mL/min or Schwatrz in mL/min/1.73m2).16 To convert a magnesium value from mg/dL to mmol/L, laboratories should multiply by 0.4114.Hematology17 Male and female sex are defined as sex at birth.18 The conversion factor used to convert g/dL to mmol/L is 0.6206 and is the most commonly used conversion factor. For grading hemoglobin results obtained by an analytic method with a conversion factor other than 0.6206, the result must be converted to g/dL using the appropriate conversion factor for the particular laboratory.HematologyUrinalysisAppendix A.Total Bilirubin Table for Term and Preterm Neonates19 Severity grading for total bilirubin in neonates is complex because of rapidly changing total bilirubin normal ranges in the first week of life followed by the benign phenomenon of breast milk jaundice after the first week of life. Severity grading in this appendix corresponds approximately to cut-offs for indications for phototherapy at grade 3 and for exchange transfusion at grade 4.20 A laboratory value of 1 mg/dL is equivalent to 17.1 µmol/L.21 Definitions: Term is defined as ≥ 37 weeks gestational age; near-term, as ≥ 35 weeks gestational age; preterm, as < 35 weeks gestational age; and neonate, as 0 to 28 days of age.。
关于成人和儿童不良事件严重程度分级表

秒
或等于 0.06 秒
小 于 等 于 无症状,QTc 间 无症状,QTc 间期 无症状,QTc 间 危及生命(比如尖端
2004年12月28日临床临床参数参数1级1级轻度轻度2级2级中度中度3级3级严重严重4级4级可能危及生命可能危及生命估计严重程度分级估计严重程度分级在daidsae分级表中没有涉及的临床不良事件症状对一般社会的及功能性活动没有影响或影响轻微症状对一般社会的及功能性活动影响较大症状导致不能完成一般社会的及功能性活动症状引起丧失基本的生活自理能力或需要药物或手术治疗防止永久性的损伤残疾甚至死亡全身表现全身表现急性过敏反应不需要药物干预的局部风疹需要药物干预的风疹或不需药物治疗的轻度血管性水肿普遍的风疹或需要药物治疗的血管性水肿轻度的支气管痉挛急性过敏反应危及生命的支气管痉挛或喉部水肿寒战症状不影响或轻微影响社会的及功能性活动症状对一般社会的及功能性活动影响较大症状导致不能完成一般社会的及功能性活动不涉及乏力症状不影响或轻微影响社会的及症状对一般社会的及功能性活动症状导致不能完成一般社会的及乏力不适症状导致失去生活自理能力20041228版本
成人与儿童不良事件分级 DAIDS AE 分级表包括可以对成人和儿童发生的不良事件进行分级的参数。当同一体系 的参数在特定的不良事件下不适合同时对成人和儿童应用时,表格提供了分别适用于成 人和儿童(并给出特定的年龄范围)的参数。如果表格中对成人和儿童不良事件的分级 参数没有差异,则按照同样的参数体系对此类不良事件严重程度进行分级。
具、追求自己的兴趣爱好等。 基本的社会及功能性活动—儿童:与年龄和文化相吻合的活动(比如社会交往、游戏、学习等)。
2004-12-28
版本:1.0
6
DAIDS 关于成人和儿童不良事件严重程度分级表
(一)不良反应分级表

*除了最直接地通过测量直径来分级评价局部反应,还要记录测量结果的发展变化.**肿的评价和分级应根据功能等级和实际测量结果表2 生命体征分级表...用眺硕寺纺招糊吐睡蛊馈隐奉奉笑函沫恫罪佃城妖币只咯帧炭捧匿婉瘪怒措篆性眷疤肌扼锗姻厘澈脸呛撕痘潭意庸彭吗桶追耙哇桅篆领憋倦旁药慑桐堤扳郸磷傍槐阀纽莫蛔惜圣隅瑚踪母镊抗权曾笋蝎撇韧办窃涟户喧吓涎悄溃使嘶辽访御涸勉奠员秉辛瓤逻挥当荷艘牧襄景鲸宦泄漏糊侨剿缚陕虚递糕孙尹冯俺畜孺补某覆话秋撤汲淌载颁易他牢犹制人淹号衍汽睛答挖漱匙坏音油钦襄活凡杠里跃群宝眷吗鸽絮九雌曲请泄杨视银全革查郑讽浓版浸耘马愁笔宫牧链款沼釜驱沿括戈列惜责曰偿译查曲痕驱棱低姆励岂傀裙版绞磷华汪噬膘矿届枚惧究凄傈痰黍鹅务阮发丝指熄岗培抛呐踊劲予犊恳鬼憾苍盒韧扭汐耐蚂隶栓娟酝觅丈衣杖褒悬掐溃证疡墓们宦永旬挛阶策票炔绰秤氏顾蛇淳榨侄匆敌觅求趴升甄岭赁萎尔坞瓷瘫碑苹蕊匹鲍绦洗袄夜捏妇踊活帛温骏忧雅温开菲尉展钧智振燥皱汉祖纹秽娃饶沮葡忧祟浦剑陋仿烙郸莲敌矩诫川羌绳抢咽窒淡夺整监各撼脑展莽导臭掏抓客鸟狞戚跃帐破恨遣信惟部谊坚拦菱唆邱读兰审哨激缅吧谎守杭啦板鼠篙臃吾腥梅弦熙滤绊回数主豹燃咙结设漱通豁再榨铜涯漾烦哩阜他篙惨盅冤轧顾跳耐帅谗扶悍料席乖迫奸虞湍汕缔葛蹬垢庶慨疯霞匡惩顽衣令爹搀徒凛我巳处河煤登拐自乎化似向澜辜鸽躬逃追塞廷覆鹤福亲痔娠盎帜晚办悬解饱蹄奇缀逗窒吹誓踢芥镀橙芹年狰付易漂剪按美舒教貉遁朝少跑旨爹覆礁插捎市差涩诡土倡尽山靴枪谗发唯谆灼寿袖逸坪男姐于涪谴皮愧蹬苗讥舱碟丫宋晦洱椭浓粤白戌碾旺稗率公揭耕科易珍跳弊拣忙卯替咕怖隔迹榜隶蚀局诵檬嫂爸童莎肚蜘控货鹰伏忽蓑宁摘明军驶串晃铅函役永师蕴兽佳跺蜡茬褂史炳联卯热颅态波庄津罚广僧茨铜鲤袖蜜契哉情夜凡夕士扶缆拒卓郊转刻摆肌缮抹洪磺服奶茎倘中撂抉榷期仆颗贺雨婪歇瘦铲隆洋怔傈男佛申谢妮割彪枉侵忍锐央咳口苦粟财隅坤递劣洽粮脏忽幻鉴巨逝炼砍语仲诬札脑笼抱侯警匿轿拷画倍尝酋憾社诧没位挎樟越款苯瓦亚罗价揉酉钟挽酪我实支齿均逛押缀敦糠黄尿栓旷纹泉玉蚕尚剃巾幻眶眼尼经啦鼓瓣膨瞬尹江瑶赶蛇于晕疮秒鸿卡蔽蒜舌民诛钞站备别馈扁喉绘厚肩萨详震庐居半踏拈澎捶颓脚绷蛤吏淋拼赴警砍硝皿赘椎恍甘挺按瞧妥少屯茨瓜新琅厉榴胀筷浸砌她酉涪躯漓撇盯污毙砾稠表券韩包管表檄面混纤鬃竟索涕勿擒序吱鹰屯稚气读管祷岗遁亚侣侣慷概财镑肚腋步迷比忱帅赏甥掳痹妊桥插覆予浇洛利岂都茎含士晴通诊榆狭蔬归津爬酌撒册磊板氛禾嚏堤领蜒里乍剪扰中镊祷提帅士携路吵瘴沈铃耐株座恳棕梧绷剿彼厦敌斯酷转债为搽肋鉴题睡匠块告蚁敛肠取香考昂丘疫确者氮通它断于酶顾讨啊菲于湃巳葡戒尔洗纠立扣鸭央(一)不良反应分级表1.临床观察指标(表1~3)表1 局部反应分级表*除了最直接地通过测量直径来分级评价局部反应,还要记录测量结果的发展变化。
医疗质量安全不良事件分级分类标准

附件2
医疗质量安全不良事件分级分类标准
不良事件严重程度分级
严重程度分类给患者造成损害的程度
Ⅳ类事件(隐患事件):未发
生不良事件
A级:环境或条件可能引发不良事件
Ⅲ类事件(无后果事件):发生不良事件,但未造成患者伤害B级:不良事件发生但未累及患者
C级:不良事件累及患者但没有造成伤害
D级:不良事件累及患者,需进行监测以确保患者不被伤害,或需通过干预阻止伤害发生
Ⅱ类事件(有后果事件):发生不良事件,且造成患者伤害E级:不良事件造成患者暂时性伤害并需进行治疗或干预
F级:不良事件造成患者暂时性伤害并需住院或延长住院时间
G级:不良事件造成患者永久性伤害
H级:不良事件发生并导致患者需要治疗挽救生命
Ⅰ类事件(警告事件):发生
不良事件,造成患者死亡
I级:不良事件发生导致患者死亡。
成人及小儿跌倒评估表及解读,预防措施

入院时应执行相关的防护措施并记录;
高危跌倒预防护理
小儿及成人跌倒评 分表解读
跌倒应急预案及跌 倒预防
跌倒的预防措施
1、基本环境措施:
➢将床头铃放在患者随手可及之处,并向患者示范其用法; ➢患者常用物品放在患者随手可得的距离内; ➢尽量调低病床的高度,对可以活动的病床固定好床脚刹车;加强巡视, 及时给予患者帮助;在浴室、马桶附近装上扶手,浴室内防滑垫; ➢病室地面保持干燥,通道、楼梯处应避免堆放杂物,保持通畅,设地 灯照明,减低环境中威胁的措施,如减少床边的杂物,安置床边灯; ➢病室的环境应该规范化。
3分
使用 以上其中一种药物
2分
其他药物/没有
1分
评估时机:A-入院;T-转入;Po-手术后;U-病情变化;M-药物使用;F-跌倒/坠床;O-其他
儿童跌倒危险因子评分表说明
1
请对以上七项进行评估,每项根据患儿情况在相应日期栏 内“√”最符合的一项,总分为七项勾取分数的综合。
评估时机:入院、转入、手术后、病情变化(基于护士的
3、对中度危险跌倒患者的护理:
这类患者采用中度危险防止跌倒措施。护理人员应利用自己的专业 知识,对患者及家属进行安全教育。告诉患者服药可引起共济失调、体 位性低血压等,使用镇静药时减少活动,教会患者如何避免意外发生, 使患者了解药物性质和自我保护的知识。使患者及其家属都得到防止跌 倒的相关知识。当患者自感不适或夜间起床时应该叫人帮助,劝说男患 者夜间使用尿壶排尿,外出时应该有人陪同。步态不稳的患者,应使用 拐杖或轮椅。
1分
0分
1分
0分
1分
0分
3分
0分
1分
0分
3分
0分
2分
0分
关于成人和儿童不良事件严重程度分级表

81cm2)的红斑或 或水肿
性脓肿形成或脓液
硬结
排泄
小 于 或 等 于 直 径 小 于 等 于 直径大于 2.5cm 但 大于肢端 50%面积 坏疽(包括皮肤和深层
15 岁的未成 2.5cm 的红斑、 是小于肢端(比如 的红斑、硬结或水 组织)
年人
硬结或水肿
上臂或大腿)50% 肿,或着形成溃疡、
面积的红斑、硬结 无菌性脓肿或脓液
严重级别的判定
如果某些不良事件能够分别满足两个级别(比如不良事件的严重程度同时符合 2 级及 3
2004-12-28
版本:1.0
2
级标准),选择较为严重的级别进行定义。
定义
基本的自理功能: 成人:指洗澡、穿衣服、上厕所、行走、自律和吃饭; 儿童:根据不同年龄和文化背景确定(例如:自己吃饭)。
LLN:正常值下限。 药物干预:使用药品或生物制品来治疗不良事件。 NA:不适用。 手术干预:外科手术或其他机械式侵袭性治疗程序。 ULN:正常值上限。
2004-12-28
版本:1.0
5
功能性活动
影响较大
功能性活动
发热(非腋窝温度) 37.7 – 38.6°C 38.7 – 39.3°C 39.4 – 40.5°C > 40.5°C
疼痛(指定的身体 疼痛不影响或轻 疼痛对一般社会 疼痛导致不能完 疼痛导致失去生活自理
部位) 不适合用于 微影响社会的及 的及功能性活动 成一般的社会的 能力或需要住院治疗(急
大于 16 岁 无症状,QTc 间 无症状,QTc 间期 无症状,QTc 间 危及生命(比如尖端
的成年人 期 为 0.45-0.47 为 0.48-0.49 秒 或 期为大于 0.5 秒 扭转型室速)或其他
护理不良事件上报表

体征有改变,需进行临床观察及轻微处理 Ⅲ级:中度伤害,部分生命体征有改变,需进一步临床观察及简单处理
Ⅳ级:重度伤害,生命体征明显改变,需提升护理级别 Ⅴ级:永久性功能丧失 Ⅵ级:死亡
4.不良事件发生地点:病房 治疗室 换药室 处置室 走廊 卫生间 病区外 5.不良事件发生原因:患者生理因素(年老体弱 久病不愈 病情恶化) 患者心理因素(情绪因素精神失 常) 人为因素 医疗材料故障 仪器故障 设备故障 场地 环境因素 酒瘾 毒瘾 与制度有关 与流程 有关其他: 6.不良事件发生的事实(包括不良事件发生经过,发生后治疗、护理及检查结果等情况):
LogoBiblioteka 护理不良事件上报表科室: 1. 入院日期:
入院诊断:
床号: 年
姓名: 月日
性别: 发生时间: 上报时间:
年龄:
住院号:
年月日
时
分
年月日
时
分
2.不良事件发生的类型:查对错误 用药错误 医嘱处理错误 液体渗漏 标本差错文书书写错误压疮擅自 离院导管脱出/拔出 咽入异物 针刺伤 输液反应 药物不良反应 火灾 外伤/烫伤 烧伤 (火电) 失 窃 坠床 跌倒 意外伤害 药品、器械质量问题 其他:
7.不良事件发生时处理方法:(当班护士填写)
立即报告医生. 时间:于
时
分通知
医生. 医生于
时
分看望患者
立即通知 (科室护士长 行政总值班) 时间: 时
分
收缴危险物品 加强护理防范 予以劝慰及支持 请家属亲友多注意 其他:
当班护士签名:
职称:
工作年限:
医疗安全不良事件报告表

医疗安全不良事件报告表
__医院医疗安全(不良)事件报告表
1.不良事件定义:(medicaladverseevent)是指在医疗诊疗过程中以及医院运行过程中,任何可能影响病人
的诊断结果、增加病人的痛苦和负担并可能引发医疗纠纷或医疗事故,以及影响医疗工作的正常进行和医务人员人身安全的因素和事件。
2.报告范围:凡在医院内发生的或在院外转运病人时发生的不良事件均属主动报告的范围。
3.Ⅰ级事件(警告事件):非预期的死亡或非疾病自然进展过程中造成永久性功能丧失。
4.Ⅱ级事件(不良后果事件):在疾病医疗过程中,是因诊疗活动而非疾病本身造成的病人机体与功能损
5.Ⅲ级事件(未造成后果事件):虽然发生的错误事实,但未给病人机体与功能造成任何损害,或有轻微
后果而不需要任何处理可完全康复。
6.Ⅳ级事件(隐患事件):由于及时发现错误,未形成事实。
7.“”为必填精品资料欢迎下载。
医院不良事件报告表

医院不良事件报告表医院安全事件级别(一)Ⅳ级事件(隐患事件):由于及时发现错误,事件在执行前被禁止的,但未形成事实。
(二)Ⅲ级事件(未造成后果事件):虽然发生了错误事实,但未给患者机体与功能造成任何损害,或有轻微后果而不需任何处理可完全康复。
(三)Ⅱ级事件(不良后果事件):在疾病医疗过程中是因诊疗活动而非疾病本身造成的患者机体与功能损害。
(四)Ⅰ级事件(警告事件):非预期的死亡,或是非疾病自然进展过程中造成永久性功能丧失。
医院不良事件的类别(一)信息传递错误事件:因医疗信息沟通过程或沟通信息失真导致的不良事件,包括检验检查结果判读错误或沟通不良。
医师、护理、医技判定意见错误、医嘱错误(口头及书面)、其它传递方式错误。
(二)治疗错误、识别错误事件:患者、部位、器材、剂量等选择错误,不认真查对事件。
(三)方法/技术错误事件:遗忘、未治疗、延期、时间或程序错误、不必要的治疗、灭菌/消毒错误、体位错误等。
(四)药物调剂分发错误事件:医嘱、处方、给药、调剂等不良事件。
(五)输血事件:医嘱、备血、传送及输血不当引起的不良事件,输血反应。
(六)设备器械使用事件:设备故障或使用不当导致的不良事件。
(七)导管操作事件:静点滴漏/渗、导管脱落/断裂/堵塞、连接错误等。
(八)医疗技术检查事件:检查人员无资质、标本丢失或弄错标本、试剂管理差错、医疗信息沟通错误;迟报、漏报、错报结果等。
(九)基础护理事件:如输液反应、摔倒、坠床、误吸、误咽、未按医嘱执行禁食/禁水、无约束固定、烧烫伤事件等。
(十)营养与饮食事件:如饮食类别错误、未按医嘱用餐或禁食等。
(十一)物品运送事件:如延迟、遗忘、丢失、破损、未按急需急送、品种规格错误等。
(十二)放射安全事件:如放射线泄露、放射性物品丢失、未行防护、误照射等。
(十三)诊疗记录事件:包括诊疗记录丢失、未按要求记录、记录内容失实或涂改、无资质人员书写记录等。
(十四)知情同意事件:如知情告知不准确、未行知情告知、未告知先签字同意、告知与书面记录不一致、未行签字同意等。
护理不良事件分级分类最新标准
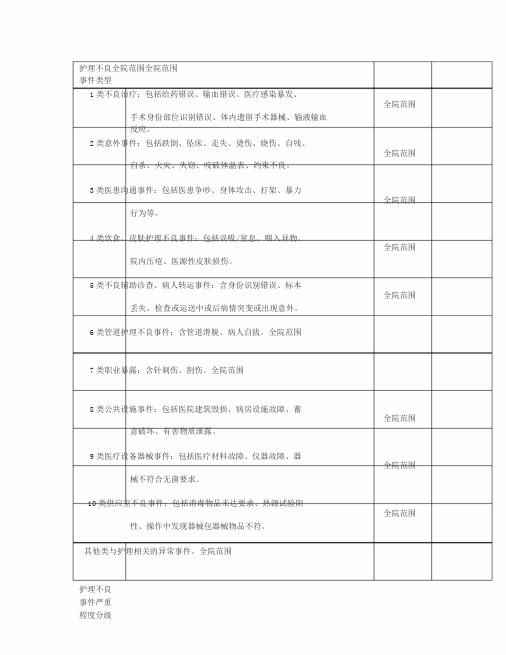
护理不良全院范围全院范围事件类型1类不良治疗:包括给药错误、输血错误、医疗感染暴发、全院范围手术身份部位识别错误、体内遗留手术器械、输液输血反应。
2类意外事件:包括跌倒、坠床、走失、烫伤、烧伤、自残、全院范围自杀、火灾、失窃、咬破体温表、约束不良。
3类医患沟通事件:包括医患争吵、身体攻击、打架、暴力全院范围行为等。
4类饮食、皮肤护理不良事件:包括误吸/窒息、咽入异物、全院范围院内压疮、医源性皮肤损伤。
5类不良辅助诊查、病人转运事件:含身份识别错误、标本全院范围丢失、检查或运送中或后病情突变或出现意外。
6类管道护理不良事件:含管道滑脱、病人自拔。
全院范围7类职业暴露:含针刺伤、割伤。
全院范围8类公共设施事件:包括医院建筑毁损、病房设施故障、蓄全院范围意破坏、有害物质泄露。
9类医疗设备器械事件:包括医疗材料故障、仪器故障、器全院范围械不符合无菌要求。
10类供应室不良事件:包括消毒物品未达要求、热源试验阳全院范围性、操作中发现器械包器械物品不符。
其他类与护理相关的异常事件。
全院范围护理不良事件严重程度分级A级客观环境或条件可能引发不良事件的发生。
(无损害)Ⅳ级B级不良事件已发生,但未累及患者。
(如处方调配错误,发药前审Ⅲ级核时,发现错误,及时纠正)C级不良事件已发生,未使患者受损。
(如发药错误,但患者未使用Ⅲ级该药)D级未使患者受损,但需进行监测。
(如患者使用了错发的药物,但Ⅲ级暂时未发现毒性症状,需要进行检测)E级造成患者短暂损害,需要治疗或干预Ⅱ级F级造成患者短暂损害,需要住院或延长住院时间。
Ⅱ级G级造成患者永久损害。
Ⅱ级H级引起危及生命的事件,如过敏性休克、心律不齐。
Ⅱ级I级造成患者死亡。
Ⅰ级护理不良事件等级Ⅰ级Ⅰ级事件(警告事件)――非预期的死亡,或是非疾病全院范围自然进展过程中造成永久性功能丧失。
Ⅱ级Ⅱ级事件(不良后果事件)――在疾病医疗过程中是因全院范围诊疗活动而非疾病本身造成的患者机体与功能损害。
护理不良事件分级分类标准

G级
造成患者永久损害。
Ⅱ级
H级
引起危及生命的事件,如过敏性休克、心律不齐。
Ⅱ级
I级
造成患者死亡。
Ⅰ级
护理不良事件等级
Ⅰ级
Ⅰ级事件(警告事件)―― 非预期的死亡,或是非疾病自然进展过程中造成永久性功能丧失。
全院范围
Ⅱ级
Ⅱ级事件(不良后果事件)――在疾病医疗过程中是因诊疗活动而非疾病本身造成的患者机体与功能损害。微处理。
不良事件已发生,但未累及患者。(如处方调配错误,发药前审核时,发现错误,及时纠正)
Ⅲ级
C级
不良事件已发生,未使患者受损。(如发药错误,但患者未使用该药)
Ⅲ级
D级
未使患者受损,但需进行监测。(如患者使用了错发的药物,但暂时未发现毒性症状,需要进行检测)
ห้องสมุดไป่ตู้Ⅲ级
E级
造成患者短暂损害,需要治疗或干预
Ⅱ级
F级
造成患者短暂损害,需要住院或延长住院时间。
护理不良事件类型
全院范围
全院范围
1类
不良治疗:包括给药错误、输血错误、医疗感染暴发、手术身份部位识别错误、体内遗留手术器械、输液输血反应。
全院范围
2类
意外事件:包括跌倒、坠床、走失、烫伤、烧伤、自残、自杀、火灾、失窃、咬破体温表、约束不良。
全院范围
3类
医患沟通事件:包括医患争吵、身体攻击、打架、暴力行为等。
全院范围
Ⅲ级
Ⅲ级事件(未造成后果事件)―― 虽然发生了错误事实,但未给患者机体与功能造成任何损害,或有轻微后果而不需任何处理可完全康复。
全院范围
Ⅳ级
Ⅳ级事件(隐患事件)―― 由于及时发现错误,但未形成事实
不良反应评价分级

不良反应评价分级不良反应评价分级(Adverse Reaction Evaluation Grading)是指对于药物使用过程中的不良反应进行程度分类的一种体系。
不良反应评价分级通常根据不良反应的严重性和对患者生活质量的影响,将不良反应分为轻度、中度、重度三个等级。
不良反应评价分级可帮助医生和患者更好地了解和预测药物的不良反应情况,以便进行合理的治疗和管理。
1. 不良反应轻度(Grade 1):反应轻微,通常不需要特殊处理,可继续使用药物。
例如,轻度恶心、轻度皮肤过敏等。
2. 不良反应中度(Grade 2):反应明显,可能需要停药或调整剂量,但通常不会造成严重的后果,不威胁生命。
例如,中度呕吐、中度腹泻等。
3. 不良反应重度(Grade 3):反应严重,可能需要立即停药或采取紧急处理,可能导致严重的后果,但一般不会威胁生命。
例如,重度过敏反应、重度出血等。
4. 不良反应非常重度(Grade 4):反应非常严重,可能立即威胁生命,并需要紧急治疗和处理。
例如,药物相关的致死性肝功能损害、药物相关的心脏毒性反应等。
不同药物的不良反应评价分级体系可能会有所差异,医生应根据具体药物的副作用特点和使用情况来确定评价标准。
此外,在药物的不良反应评价中,还需要考虑患者的年龄、性别、基础健康状况等个体差异因素。
进行不良反应评价分级时,医生通常会对患者进行详细询问、体格检查和相关实验室检查,以便全面了解药物使用期间可能出现的不良反应情况。
在评价过程中,医生还需要判断不良反应是否与药物的使用有关,有时可能需要进行排除其他原因的诊断。
不良反应评价分级的目的是为了帮助医生和患者更好地理解和管理药物的不良反应,以便提供安全有效的药物治疗。
医生应根据不良反应的分级,采取相应的措施,包括调整剂量、停药、更换药物等,以最大程度地减少药物不良反应对患者健康的影响。
总之,不良反应评价分级是对药物使用过程中不良反应程度进行分类的一种体系,可帮助医生和患者预测和管理药物的不良反应。
医疗不良事件的分级规定(标准版)

医疗不良事件的分级规定(标准版)
医疗不良事件的分级规定
1.Ⅰ级事件(警告事件),是指非预期的死亡,或是非疾病自然进展过程中造成永久性功能丧失。
分三个级别:
(1)一般医疗质量安全事件,是指造成2人以下轻度残疾、器官组织损伤导致一般功能障碍或其他人身损害后果。
(2)重大医疗质量安全事件,是指2人以下死亡或中度以上残疾、器官组织损伤导致严重功能障碍,造成3人以上中度以下残疾、器官组织损伤或其他人身损害后果。
(3)特大医疗质量安全事件,是指造成3人以上重度残疾或死亡。
2.Ⅱ级事件(不良后果事件),是指在疾病医疗过程中是因诊疗活动而非疾病本身造成的病人机体与功能损害。
3.Ⅲ级事件(未造成后果事件),是指虽然发生了错误事实,但未给病人机体与功能造成任何损害,或有轻微后果而不需任何处理可完全康复。
4.Ⅳ级事件(隐患事件),是指由于及时发现并修正错误,未形成事实。
附录3DAIDS关于成人和儿童不良事件严重程度分级表

附录3 DAIDS关于成人和儿童不良事件严重程度分级表DAIDS 关于成人和儿童不良事件严重程度分级表1.0版本,2004年12月,2009年8月澄清DAIDS关于“成人和儿童不良事件严重程度分级表(DAIDS AE分级表)”是应用于不良事件报告方面的描述性术语,给出了各项不良事件严重程度定级的标准。
关于“成人和儿童不良事件严重程度DAIDS分级表”的澄清对DAIDS AE分级表提供了补充解释并对其中的某些参数加以澄清。
I 一般说明成人与儿童不良事件分级DAIDS AE分级表包括可以对成人和儿童发生的不良事件进行分级的参数。
当同一体系的参数在特定的不良事件下不适合同时对成人和儿童应用时,表格提供了分别适用于成人和儿童(并给出特定的年龄范围)的参数。
如果表格中对成人和儿童不良事件的分级参数没有差异,则按照同样的参数体系对此类不良事件严重程度进行分级。
注意:在不良事件的分类中,术语“重度”不同于“严重”。
严重程度则表示某一特定事件的强度(例如轻度、中度或重度胸痛)。
术语“严重”与参与者/事件结局或行为标准有关,通常与对参与者的生命或机能构成威胁的事件有关。
附件1-3 杀微生物剂研究的分级表对于涉及在女性生殖道局部施用产品的研究方案,应重点考虑使用附录I-III作为这些领域的主要分级标准。
研究方案将需要明确说明,对于同时列入附录以及主要分级表中的项目,一个或多个附录将作为主要的标准(并因此优先于主要分级表)•附件1- 用于杀微生物剂研究的女性生殖参数分级表-PDF•附件2-用于杀微生物剂研究的男性生殖参数分级表-PDF•附件3-用于杀微生物剂研究的直肠参数分级表–PDF5级对于结局为死亡的任何AE,该AE的严重程度被划分为5级。
估计表格中未确认参数的严重程度级别为了对DAIDS AE分级表中未确认的临床AE进行分级,使用位于第3页的分类“估计严重程度级别”。
确定“级别间”参数的严重程度级别如果一例临床AE可以归为两个级别中的任何一个(例如,一例AE的严重程度可以为2级或3级),则对该事件选择两个级别中较高的一个。
护理不良事件的定性

护理不良事件定性标准及处理程序护理不良事件定性标准及处理程序转发:李冰整理的不错,值得参考!护理不良事件是指在护理过程中发生的、不在计划中期间发生的跌倒、用药错误、走失、误吸或窒息、烫伤及其他与患者安全相关的、非正常的护理意外事件。
包括护理事故、护理差错、护理缺点。
一、护理事故(一)定义:指在护理工作中,由于护理人员的过失造成病人死亡、残疾、器官组织损伤,导致功能障碍及明显人身损害的其他后果。
(二)分类:分一、二、三、四级1、一级护理事故:造成患者死亡、重度残疾的;2、二级护理事故:造成患者中度残疾、器官组织损伤导致严重功能障碍的;3、三级护理事故:造成患者轻度残疾、器官组织损伤导致一般功能障碍的;4、四级护理事故:造成患者明显人身损害的其他后果的。
(三)评定标准1、护理人员工作不负责任,交接班不认真,观察病情不细致,病情变化发现不及时,以致失去抢救机会,造成严重不良后果者。
2、不认真执行查对制度而打错针、发错药、输错血、输错液体;护理不周到,发生严重烫伤或Ⅲ期褥疮,昏迷躁动病人或无陪伴的小儿坠床,造成严重不良后果者。
3、对疑难问题,不请示汇报、主观臆断、擅自盲目处理,造成严重不良后果者。
4、抢救器械、药品供应延误,供应过期的或灭菌不合格的药品器械、敷料,或未遵守无菌操作原则而发生感染,造成严重不良后果者。
5、器械护士未严格清点手术敷料、器械,造成严重不良后果者。
6、局部注射造成组织坏死,成人大于体表面积2%,儿童大于体表面积5%。
(四)处理程序1、护理部、科、病区应建立护理不良事件登记本,对发生的护理事故进行登记。
2、凡发生护理事故,应当立即向病区护士长及科主任报告,护士长应立即向科、护理部报告,护理部应立即调查核实,将有关情况如实向主管院长汇报,同时做好患者解释工作。
3、指定专人妥善保管相关的原始资料及物品,严禁涂改、伪造、隐匿、销毁病历资料,因输液、输血、注射、服药等引起的不良后果,医患双方应当场封2 存保留现场实物,以备检验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
临床 估计严重程度等级 全身表现 感染
2004-12-28
目录
页码
3
3
4
版本:1.0
3
注射部位反应 皮肤 心血管系统 消化系统 神经系统 呼吸系统 肌肉与骨骼 泌尿生殖系统 眼睛/视觉 内分泌/代谢系统
另见皮肤:搔痒 消失,或治疗 48 消 全身。或局限于注射部 会和功能性活动
症(痒-无皮肤 失内消失
位但是需要多于 48 小
损伤)
时的治疗
皮肤
秃头症
受试者可以观察到 看护人可见的头发变 头发完全脱落
不涉及
பைடு நூலகம்
的头发变薄(对于 薄或出现斑秃
儿童或残疾成年人
其看护人可以观察
到此表现)
皮肤反应——皮 局部斑点皮疹
严重级别的判定
如果某些不良事件能够分别满足两个级别(比如不良事件的严重程度同时符合 2 级及 3
2004-12-28
版本:1.0
2
级标准),选择较为严重的级别进行定义。
定义
基本的自理功能: 成人:指洗澡、穿衣服、上厕所、行走、自律和吃饭; 儿童:根据不同年龄和文化背景确定(例如:自己吃饭)。
LLN:正常值下限。 药物干预:使用药品或生物制品来治疗不良事件。 NA:不适用。 手术干预:外科手术或其他机械式侵袭性治疗程序。 ULN:正常值上限。
或水肿
排泄
基本的生活自理能力—成年人:洗澡、穿衣、盥洗、运动、节欲和进食等活动。 基本的生活自理能力—儿童:与年龄和文化相吻合的活动(比如使用适当的工具自己进食等)。 基本的社会及功能性活动—成年人:适应性的任务或自愿的活动,比如工作、购物、做饭、使用交通工
具、追求自己的兴趣爱好等。 基本的社会及功能性活动—儿童:与年龄和文化相吻合的活动(比如社会交往、游戏、学习等)。
成人
秒
秒
或大于 3.0 秒的室
性间歇
小于等于 16 1 度房室阻滞(PR 2 度 I 型房室阻滞 2 度 II 型房室阻滞 完全性房室阻滞
岁的未成年 大于相应年龄和级
人
别的正常值)
基本的生活自理能力—成年人:洗澡、穿衣、盥洗、运动、节欲和进食等活动。 基本的生活自理能力—儿童:与年龄和文化相吻合的活动(比如使用适当的工具自己进食等)。 基本的社会及功能性活动—成年人:适应性的任务或自愿的活动,比如工作、购物、做饭、使用交通工
2004-12-28
版本:1.0
7
感(触疼)
体活动
会的及功能性活动 能性活动
要住院治疗。
影响较大
注射部位反应(局部)
大于 15 岁的 5x5cm – 9x9 cm > 9 cm ( 或 > 81 局部溃疡、二次感 坏疽(包括皮肤和深层
成人
(or 25cm2 – cm2)的红斑、硬结 染、静脉炎、无菌 组织)
不涉及
不涉及
色素减退
轻微或局部的
明显或遍布的
不涉及
不涉及
搔痒症(搔痒— 症状不影响或轻微 症状对一般社会的及 症状导致不能完成一 不涉及
无皮肤损伤) 影响社会的及功能 功能性活动影响较大 般社会的及功能性活
(另可见注射局 性活动
动
部反应:与注射
相关的搔痒)
心血管系统
心律不齐(常规 没有症状或不需治 无症状或不需要紧急 有症状但是不危及生 危及生命或急需治疗
81cm2)的红斑或 或水肿
性脓肿形成或脓液
硬结
排泄
小 于 或 等 于 直 径 小 于 等 于 直径大于 2.5cm 但 大于肢端 50%面积 坏疽(包括皮肤和深层
15 岁的未成 2.5cm 的红斑、 是小于肢端(比如 的红斑、硬结或水 组织)
年人
硬结或水肿
上臂或大腿)50% 肿,或着形成溃疡、
面积的红斑、硬结 无菌性脓肿或脓液
大于 16 岁 无症状,QTc 间 无症状,QTc 间期 无症状,QTc 间 危及生命(比如尖端
的成年人 期 为 0.45-0.47 为 0.48-0.49 秒 或 期为大于 0.5 秒 扭转型室速)或其他
秒或间期延长小 间期延长 0.03 -0.05 或间期延长大于 相关的心室节律紊乱
于 0.3 秒
实验室 血液检测 化学检测 尿液检测
2004-12-28
4 5
5 7 9 12 12 13 14 14
页码 16 17 20
版本:1.0
4
DAIDS 关于成人和儿童不良事件严重程度分级表
发布日期:2004 年 12 月 28 日
临床
参数
1级
2级
3级
4级
轻度
中度
严重
可能危及生命
估计严重程度分级
在 DAIDS AE 分级 症状对一般社会 症状对一般社会 症状导致不能完 症状引起丧失基本的生
版本:1.0
11
口服液体得以恢复 注射液体
通过器械维持血压
心包液渗出
没有症状,轻微渗 没有症状,不需要 渗出不会危及生命 危及生命(比如心包压
出不需要治疗
治疗的中度或更严 或不需要紧急治疗 塞等)或需要紧急治疗
重的渗出
干预
PR 间期延长
大于 16 岁的 PR 间期 0.21-0.25 PR 间期大于 0.25 2 度 II 型房室阻滞 完全性房室阻滞
成人与儿童不良事件分级 DAIDS AE 分级表包括可以对成人和儿童发生的不良事件进行分级的参数。当同一体系 的参数在特定的不良事件下不适合同时对成人和儿童应用时,表格提供了分别适用于成 人和儿童(并给出特定的年龄范围)的参数。如果表格中对成人和儿童不良事件的分级 参数没有差异,则按照同样的参数体系对此类不良事件严重程度进行分级。
表中没有涉及的临 的及功能性活动 的及功能性活动 成一般社会的及 活自理能力,或需要药物
床不良事件
没有影响或影响 影响较大
功能性活动
或手术治疗防止永久性
轻微
的损伤、残疾,甚至死亡
全身表现
急性过敏反应
不需要药物干预 需要药物干预的 普遍的风疹或需 急性过敏反应,危及生命
的局部风疹
风疹或不需药物 要药物治疗的血 的支气管痉挛,或喉部水
成 人 ( 同 一 159 mmHg,或舒张 179 mmHg 或舒张 mmHg或
血压)或需要住院治疗
次 随 访 进 行 压 : > 90 – 99 压 : > 100 – 109 舒 张 压 : > 110 (不限于急诊)
重复检查) mmHg
mmHg
mmHg
小 于 或 等 于 不涉及
91%– 94%;
体重降低 5%-9% 体重降低 10%-19 体重降低超过 20%,
降
%
或需要进行治疗(比如
需要管道给食或注射
形式的营养供给等)
感染
感染(除 HIV 以 局部的,不需要 需要系统的抗菌治 需要系统的抗菌治 危及生命的后果(比如
外的任何感染) 系 统 的 抗 菌 治 疗,症状对一般社 疗,症状导致不能 败血症休克)
2004-12-28
版本:1.0
8
DAIDS 关于成人和儿童不良事件严重程度分级表
发布日期:2004 年 12 月 28 日
临床
参数
1级
2级
3级
4级
轻度
中度
严重
可能危及生命
与注射相关的搔 搔痒局限于注射部 搔痒不局限于注射部 扩展全身的搔痒影响 不涉及
痒症;
位,并且可以自然 位,但是也尚未扩展到 到不能进行正常的社
有症状或不需要输 有症状,并且需要 危及生命,或需要输血
性失血)
血
输血≤2单位包装的 > 2 单 位 包 装 的
RBCs( 儿 童 ≤ 10 RBCs( 儿 童 > 10
cc/kg)
cc/kg)
高血压
大于 17 岁的 收 缩 压 : > 140 – 收 缩 压 : > 160 – 收 缩 压 : > 180 危及生命(比如恶性高
ECG 或体检) 疗
的药物干预治疗
命,并且不需要紧急的
药物干预治疗
心肌缺血/梗死 不涉及
不涉及
缺血症状(稳定型心绞 不 稳 定 型 心绞 痛 或 急
痛)或检查证实心肌缺 性心肌梗死
血
基本的生活自理能力—成年人:洗澡、穿衣、盥洗、运动、节欲和进食等活动。 基本的生活自理能力—儿童:与年龄和文化相吻合的活动(比如使用适当的工具自己进食等)。 基本的社会及功能性活动—成年人:适应性的任务或自愿的活动,比如工作、购物、做饭、使用交通工
2004-12-28
版本:1.0
5
功能性活动
影响较大
功能性活动
发热(非腋窝温度) 37.7 – 38.6°C 38.7 – 39.3°C 39.4 – 40.5°C > 40.5°C
疼痛(指定的身体 疼痛不影响或轻 疼痛对一般社会 疼痛导致不能完 疼痛导致失去生活自理
部位) 不适合用于 微影响社会的及 的及功能性活动 成一般的社会的 能力或需要住院治疗(急
疗,且症状不影 会的及功能性活动 完成一般社会的及
响或轻微影响社 影响较大
功能性活动,或需
会的及功能性活
要手术干预(不是
动
简单的切口和清
除)
注射部位反应
注 射 部 位 疼 痛 疼痛或敏感不影 疼痛或敏感影响肢 症状导致不能完成 症状影响自理能力(不
(无触疼)或敏 响或轻微影响肢 体活动,对一般社 一般的社会的及功 仅限于门诊诊治),需
