5 静注乙型肝炎人免疫球蛋白
注射用人血免疫球蛋白说明书

注射用人血免疫球蛋白说明书
注射用人血免疫球蛋白是一种用于治疗免疫抑制症(Immune Deficiency Syndrome,IDS)的药物,主要通过补充免疫系统的抗血清微球蛋白,提高机体免疫力,帮助患者达到恢复正常的抗感染能力为目的。
注射用人血免疫球蛋白的组成广泛,主要由两种因子:抗血清学微球蛋白(IgG)和抗免疫缺少条件因子(IDFs)构成,其中IgG有着很高的毒性抗体作用,能够大量凝聚血清中的病毒抗体、抗原,进而抑制病毒的生长和繁殖;IDF能够补充免疫系统遭破坏的部分,让免疫系统恢复正常工作状态。
注射用人血免疫球蛋白的目的在于向机体补充过度消耗的免疫成分,提高机体免疫系统的功能,增强抗感染的能力,有效的减轻疾病的发病率,从而改善患者的健康状况,减少治疗成本。
注射用人血免疫球蛋白使用非常安全,可以在家里自己注射,不需要找专业人员就可以完成注射操作,而且几乎没有任何副作用。
注射完成后,患者可以继续通过饮食和休息维持身体机能,以便尽快恢复正常。
总之,注射用人血免疫球蛋白是一种有效的治疗IDS的方法,有助于恢复正常的免疫功能,而且使用安全方便,几乎没有副作用。
关于静注人免疫球蛋白的几个小知识

关于静注人免疫球蛋白的几个小知识一、什么是免疫球蛋白?免疫球蛋白是一种由人体免疫系统产生的蛋白质,也被称为抗体。
它主要由B细胞分泌,能够识别和结合到入侵人体的病原体,帮助免疫系统消灭这些病原体,起到保护身体免受感染的作用。
二、为什么需要静注免疫球蛋白?有些人由于先天性或后天获得性免疫系统缺陷,无法产生足够的免疫球蛋白来对抗病原体。
这些人对感染的敏感度增加,易患多种传染病。
静注人免疫球蛋白就是为了补充这些人体内缺乏的免疫球蛋白,提高其免疫力,预防感染。
三、静注人免疫球蛋白的来源静注人免疫球蛋白通过从多名健康人体中提取血浆制备而成。
这些健康人体经过严格的筛选和检测,确保其没有感染HIV、丙型肝炎等传染病。
其血浆经过病毒灭活或纳滤等处理,制备成静脉注射用的免疫球蛋白制剂。
四、静注人免疫球蛋白的适应症静注人免疫球蛋白适用于先天性或获得性免疫缺陷病人,如原发性免疫缺陷病、继发性免疫缺陷病、严重烧伤、骨髓移植等。
它还可以用于预防某些传染病,如乙型肝炎、狂犬病等。
此外,静注人免疫球蛋白还可以用于治疗某些自身免疫性疾病,如免疫性血小板减少性紫癜等。
五、静注人免疫球蛋白的剂型和用法静注人免疫球蛋白主要有液体和冻干粉剂两种剂型。
液体剂型常见于日常临床使用,可以直接静脉注射或滴注给药。
冻干粉剂需要加入适量的溶剂后再静脉注射。
用法和剂量需根据个体情况而定,一般由专业医生根据病情和免疫球蛋白水平来决定。
六、静注人免疫球蛋白的不良反应静注人免疫球蛋白一般耐受性好,不良反应较少。
常见的不良反应有头痛、发热、皮疹等,多为轻度和自限性,不需要特殊处理。
极少数病人可能会出现过敏反应,如过敏性休克、呼吸困难等,这时需要立即停药并采取相应的急救措施。
七、静注人免疫球蛋白的注意事项在使用静注人免疫球蛋白时,应首先进行过敏试验,以排除过敏反应的风险。
同时,对于有严重过敏史的患者,尽量避免使用人免疫球蛋白。
用药时要遵循医嘱,按时按量使用,不得随意更改剂量或停药。
国药中生简介

根除
消除
极大减少
明显减小
控制
关爱生命 呵护健康
科研开发 -----人才队伍
中国医药集团
中国工程院院士
1
药典委员会委员
14
SFDA 新药评审专家
70
国家自然科学基金委委员
10
6.7% 6.3%
7.7%
国药中生 CNBG
8.1%
7.9%
享受政府津贴的专家
170
? 近1000人的研发团队 ? 致力于疫苗、血制、生物医药和诊断试剂的科研开发工作 ? 国家第一批博士、硕士研究生学位授予单位
手足口(EV71)灭活疫苗 痢疾结合疫苗 无细胞百白破-基因乙肝四联疫苗 新型艾滋病疫苗 重组戊型肝炎疫苗 甲型副伤寒杆菌多糖蛋白质结合疫苗 伤寒Vi多糖蛋白质结合疫苗 霍乱O1/O139 口服疫苗 治疗性乙型肝炎疫苗
b型流感嗜血杆菌结合疫苗 乙型脑炎减毒活疫苗 口服脊髓灰质炎减毒活疫苗 无硫柳汞流感病毒裂解疫苗
? 中国最大疫苗供应商(一类疫苗市场54份% 额约85%,二类疫苗
市场份额约40%)
? 血液制品投浆规模全国第一
超过1000吨
? 承担国家中央医药储备任务
% 14%
28%
关爱生命 呵护健康
中国医药集团
产品品种
国药中生 Rotavirus CNBG JIanHpHflaeuinpbeeanstzeitaiEsnBc2ep3h-VvaaalilrteiicnsetHlPlaenpeuAmo
重组人干扰素 α2a 软膏 注射用重组人干扰素β 1b 注射用抗肾综合征出血热病毒单抗
关爱生命 呵护健康
中国医药集团
科研开发----核心技术平台
国药中生 CNBG
血液制品临床应用指导原则1

血液制品临床应用指导原则(征求意见稿)目录前言2第一章血液制品临床应用基本原则 (2)一、严格掌握适应证和应用指征 (2)二、血液制品的选择 (2)三、避免输注血液制品的不良反应 (2)第二章血液制品临床应用管理 (2)一、管理要求 (2)(一)临床应用管理要求。
(2)医疗机构应当设立由医院领导、业务主管部门及相关科室负责人组成的管理委员会,做好临床用血分级管理。
(2)(二)血浆源医药产品的管理要求。
(2)1.来源的管理。
(2)2.应用的管理。
(2)二、落实与督查 (2)第三章各类血液制品使用的适应证和注意事项 (3)二、免疫球蛋白 (3)(一)肌注人免疫球蛋白。
(3)(二)静注人免疫球蛋白。
(4)(三)乙型肝炎人免疫球蛋白。
(4)(四)狂犬病人免疫球蛋白。
(4)(五)破伤风人免疫球蛋白。
(5)三、纤维蛋白原 (5)四、凝血酶原复合物 (5)五、凝血因子Ⅷ (6)第四章常见的药物不良反应 (7)一、急性输血反应 (7)(一)轻度反应。
(7)(二)中重度反应。
(7)(三)有生命危险的反应。
处理方法如下。
(7)前言血液制品在临床各科多种疾病的治疗上广泛应用。
但临床存在不合理应用问题非常突出,给患者的健康乃至生命造成重大影响。
为规范血液制品的临床应用,提高临床医师和输血工作者对血液制品的认识,保障医疗质量和医疗安全,控制不合理医药费用,特制定《血液制品临床应用指导原则》(以下简称《指导原则》)。
在临床诊疗工作中应参考和遵循本《指导原则》,说明如下:1.本《指导原则》为临床应用血液制品获取最佳疗效并最大程度避免或减少不良反应而制定。
临床医师应结合患者具体情况,制定个体化应用方案。
2.本《指导原则》仅涉及临床常用的血液制品,重点介绍各类血液制品的适应证和注意事项。
3.本《指导原则》涉及临床各科部分常见和重要疾病。
4.除本《指导原则》所列常用血液制品种类外,临床医师可根据患者临床情况及当地血液制品供应情况,选用最合适的血液制品。
静注人免疫球蛋白(IVIG)儿科临床应用

• 剂量和使用时间:
– 用于急性儿童ITP一线治疗时,首剂量0.8-1 g/kg, 如果血小板没有 上升到20×109/L,则于48小时完成第二次注射。
– 用于有生命威胁出血的儿童ITP:每天1 g/kg,注射2天。 – 用于慢性ITP儿童时,首剂量0.8-1 g/kg,如果血小板没有上升到
20×109/L,则于48小时完成第二次注射。 – 新生儿ITP,每天1 g/kg,注射2天。第2天的注射只有在血小板低
• 王同显等对该病一次性大剂量IVIG1. 0 g/kg/d治疗, 所 有病例均在用药第2 d BPC 开始上升, 总有效率为 100%, 随访至1 个月BPC 平均为126. 2 ×109/L , 随访 至3 个月BPC 平均为87. 6 ×109/L未见不良反应。
儿童特发性血小板减少性紫癜(ITP)
坐标轴标题
大剂量IVIG(1g/kg.d, 2d)联合地塞米松治疗效果最好
不同剂量IVIG治疗对极重度ITP血小板的作用
350 300 250 200 150 100 50
0
冲击组 中剂量组 小剂量组
PLT≥50×109/L(h) 25.6 60.5 95.4
PLT≥100×109/L(天) 2.8 5.9 7.3
静注人免疫球蛋白(IVIG) 儿科临床应用
主要介绍疾病
• 血液科 – 小儿ITP – 新生儿溶血
• 风湿免疫科 – 川崎病 – 小儿SLE – 免疫缺陷病
• 神经科 – 小儿GBS – 难治型癫痫
• 小儿感染 • 其它疾病
小儿ITP
小儿ITP
• ITP 是出血及外周BPC 减少, 骨髓巨核细 胞增多或正常伴有成熟障碍为主要表现的 最常见免疫性出血性疾病, 占小儿出血性疾 病的70%, 其发病机理与免疫功能异常有 关。
6 冻干静注乙型肝炎人免疫球蛋白

冻干静注乙型肝炎人免疫球蛋白(pH4)Jingzhu Yixing Ganyan Ren Mianyiqiudanbai (pH4)Human hepatitis B Immunoglobulin (pH4) for Intravenous Injection,Freeze-dried本品系由含高效价乙型肝炎表面抗体的健康人血浆,经低温乙醇蛋白分离法或经批准的其他分离法分离纯化,并经病毒去除和灭活处理、冻干制成。
含适宜稳定剂,不含防腐剂和抗生素。
1 基本要求生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
生产过程中不得加入防腐剂或抗生素。
2 制造2.1 原料血浆2.1.1血浆的采集和质量应符合“血液制品生产用人血浆”的规定。
采用经批准的乙型肝炎疫苗和免疫程序进行免疫,或从健康供血浆者筛选抗体效价符合要求的血浆。
原料血浆混合后抗-HBs效价应不低于10IU/ml。
2.1.2每批应由100名以上供血浆者的血浆混合而成。
2.1.3 组分Ⅱ、组分Ⅱ+Ⅲ沉淀或组分Ⅰ+Ⅱ+Ⅲ沉淀应冻存于-30℃以下,并规定其有效期。
2.2 原液2.2.1 采用低温乙醇蛋白分离法或经批准的其他分离法制备。
所采用的生产工艺应能使制品中IgG亚类齐全,其值与正常人血清IgG亚类分布相近;应能保留IgG的Fc段生物学活性(附录Ⅹ P)。
2.2.2 经纯化、超滤、除菌过滤后即为静注乙型肝炎人免疫球蛋白原液。
2.2.3 原液检定按3.1项进行。
2.3半成品2.3.1 配制制品中可加适宜的稳定剂。
按成品规格以注射用水或静注人免疫球蛋白原液稀释至抗-HBs效价不低于50IU/ml。
2.3.2 半成品检定按3.2项进行。
2.4 成品2.4.1 分批应符合“生物制品分批规程”规定。
2.4.2 分装及冻干应符合“生物制品分装和冻干规程”及附录ⅠA有关规定。
分装后应及时冻结,冻干过程制品温度不得超过35℃,真空封口。
2.4.3 规格按标示量复溶后每瓶含抗-HBs效价500IU(10ml)、2000 IU(40ml)、2500IU (50ml)。
国药中生简介

大规模细胞培养与病毒纯化技术 (轮状疫苗,狂犬疫苗,灭活脊灰,EV71,重组蛋白)
基因重组技术 (前S抗原乙肝疫苗,宫颈癌疫苗,CRM197,白介素-6,P64K)
新型佐剂技术 (前S抗原乙肝疫苗,Vero狂犬,流感疫苗,抗癌症疫苗 )
关爱生命 呵护健康
中国医药集团
发展战略
国药中生 CNBG
集团愿景:国际知名的中国生物制药行业领军企业 集团使命: 行业科技创新的推动者
行业质量标准的引领者 行业产品市场的主导者 行业社会责任的践行者 企业精神:负责、成熟、规范、优质、卓越 企业理念:生命航程 、中生护卫
关爱生命 呵护健康
永泰免疫 2005年成立
北京所&微谷 1919年成立
上海所 1949年成立
兰州所 1934年成立
武汉所 1950年成立
成都所 1953年成立
长春所 1934年成立
关爱生命 呵护健康
母公司 (国药集团)概况
中国医药集团
国务院国资委管理的央企
国药中生 CNBG
2011年销售收入超过1200亿元(在央企中排名50名以内)
中国医药集团
国药中生 CNBG
关爱生命 关爱生命 呵护健康 呵护健康
单克隆抗体技术
关爱生命 呵护健康
中国医药集团
科研开发 ---成就
国药中生 CNBG
国家首批“创新型企业”(超过90%在中国生产 的疫苗和血液制品均由中生首创)
获得新药证书和生产文号共计175个(2011年临 床批件15个)
国家级科学技术进步奖26项 省部级奖项110项(2011年8项) 获得专利52项(2011年10项) 2011年发表论文191篇(国外核心期刊19篇)
静注人免疫球蛋白(pH4)对人补体系统的体外影响

国家药监局重点实验室专栏[重点实验室简介]国家药品监督管理局血液制品质量控制重点实验室于2019年4月通过国家药监局评审ꎬ成为首批正式挂牌运行的药物质量控制重点实验室ꎮ实验室依托湖北省药品监督检验研究院联合武汉生物技术研究院筹建而成ꎬ现任实验室主任姜红教授ꎬ学术委员会主任邓子新院士ꎮ重点实验室拥有实验场地1.5万平方米ꎬ配置各类质谱仪㊁各类液相色谱仪等总价值2亿元的设备ꎮ配套设施齐全ꎬ拥有生物技术基础仪器平台㊁分析检测平台㊁药理药效评价平台㊁实验动物中心等多个技术平台ꎮ重点实验室面向科学前沿ꎬ面向国家重大需求ꎬ面向药品监管需求ꎬ主攻国产血液制品基础研究不够㊁血浆利用率低㊁重组产品开发不够㊁质量控制方法研究不足等问题ꎬ以血浆病毒㊁蛋白组分及活性㊁微生物污染追溯控制为研究对象ꎬ聚焦蛋白分离鉴定技术开发㊁病毒残留检测技术研究㊁环境微生物鉴定技术研究㊁血液制品风险评价及控制研究㊁重组血浆蛋白质控技术研究ꎬ为提高我国血液制品及原料血浆的全程质量控制㊁应用开发㊁监督管理提供关键理论㊁技术与基础信息支撑ꎮ实验室主任:姜红ꎬ女ꎬ湖北省药品监督检验研究院院长ꎬ二级教授ꎬ享受国务院特殊津贴ꎬ华中科技大学㊁湖北中医药大学硕士生导师ꎬ主要从事血液制品批签发及质量研究工作ꎬ为国家生物制品批签发授权签字人ꎬ第九㊁十㊁十一届国家药典委员会委员ꎮ目前兼任中国药学会药物分析专业委员会委员ꎬ担任«药物分析»«医药导报»«中国医院用药评价与分析»等杂志常务编委或编委ꎮ为湖北省突出贡献中青年专家ꎬ中国药学发展奖食品药品质量检测技术突出成就奖获得者ꎬ获湖北省科技进步奖2项ꎬ撰写专业论著12部ꎬ发表各类论文40篇ꎮ㊀基金项目:湖北省科技厅自然科学基金科研课题(No.2022CFB521)作者简介:柯兵兵ꎬ男ꎬ硕士ꎬ工程师ꎬ研究方向:血液制品质量控制ꎬE-mail:bknifdc@163.com通信作者:郭江红ꎬ女ꎬ硕士ꎬ正高级工程师ꎬ研究方向:血液制品质量控制ꎬTel:027-87705366ꎬE-mail:guojh26@hotmail.com静注人免疫球蛋白(pH4)对人补体系统的体外影响柯兵兵ꎬ王德蓉ꎬ李世兴ꎬ程梦兰ꎬ郭江红(湖北省药品监督检验研究院ꎬ湖北省药品质量检测与控制工程技术研究中心ꎬ国家药品监督管理局血液制品质量控制重点实验室ꎬ湖北武汉430075)摘要:目的㊀采用体外补体孵育实验评价静注人免疫球蛋白是否能激活补体系统ꎬ探讨本品给药过程中补体系统与类过敏反应之间的关联性ꎮ方法㊀分别选取4家企业产品ꎬ另加热制备多聚体升高的样品ꎬ在体外与人血清共同孵育1h后ꎬ采用ELISA试剂盒测定补体系统激活代表性中间产物及终末复合物Sc5b-9的含量ꎮ结果㊀与生理盐水对照组相比ꎬ实验组中补体分子C3a㊁C4a㊁C5a㊁Bb㊁Sc5b-9基本呈下降趋势ꎻ制剂经加热处理后ꎬ上述补体分子并未出现显著性升高现象ꎮ结论㊀静注人免疫球蛋白不能通过激活补体系统进而引发类过敏反应ꎬ相反ꎬ对补体系统存在一定程度抑制ꎮ关键词:静注人免疫球蛋白ꎻ多聚体ꎻ补体系统ꎻ抑制ꎻ类过敏反应中图分类号:R979.5㊀文献标志码:A㊀文章编号:2095-5375(2024)01-0040-005doi:10.13506/j.cnki.jpr.2024.01.008EffectofHumanImmunoglobulin(pH4)forIntravenousInjectiononcomplementsysteminvitroKEBingbingꎬWANGDerongꎬLIShixingꎬCHENGMenglanꎬGUOJianghong(HubeiEngineeringResearchCenterforDrugQualityControlꎬNMPAKeyLaboratoryofQualityControlofBloodProductsꎬHubeiInstituteforDrugControlꎬWuhan430075ꎬChina)Abstract:Objective㊀ToevaluatewhetherHumanImmunoglobulinforIntravenousInjectioncanactivatethecomple ̄mentsystembycomplementincubationexperimentsinvitroandtostudythecorrelationbetweenthecomplementsystemandanaphylactoidreactionsduringtheadministrationofthisproduct.Methods㊀Productsfromfourenterpriseswereselectedꎬandalsowereheatedtoobtainsampleswithelevatedlevelsofpolymers.Afterincubatingthesampleswithhumanserumfor1hourinvitroꎬthecontentsoftherepresentativeintermediateproductsofthecomplementsystemactivationꎬandtheterminalcomplexSc5b-9weredeterminedbyELISAkits.Results㊀Comparedwiththenormalsalinecontrolꎬthecomplementmole ̄culesC3aꎬC4aꎬC5aꎬBbꎬandSc5b-9intheexperimentalgroupbasicallyshowedadownwardtrendꎻAfterheatingtheprod ̄uctsꎬtherewasnosignificantincreaseinthecomplementmoleculesdescribedabove.Conclusion㊀HumanImmunoglobulinforIntravenousInjectioncannotcauseanaphylactoidreactionsbyactivatingthecomplementsystem.Onthecontraryꎬitinhib ̄itedthecomplementsystemtoacertainextent.Keywords:HumanImmunoglobulinforIntravenousInjectionꎻPolymerꎻComplementsystemꎻInhibitionꎻAnaphylactoidreactions㊀㊀静注人免疫球蛋白是一种临床上常用于治疗免疫缺陷㊁重症感染以及器官移植排斥等疾病的血液制剂ꎬ临床需求量极大ꎮ然而ꎬ据临床用药经验显示ꎬ本品的不良反应发生率较高[1-4]ꎬ因此ꎬ阐释本品可能引起不良反应的发生机制ꎬ对于安全用药及患者生命健康具有重要的意义ꎮ在前期小鼠耳郭蓝染试验中ꎬ动物实验结果显示不同企业之间的产品引发小鼠发生类过敏反应的潜力有明显差异ꎬ且多聚体含量高的产品ꎬ耳郭蓝染发生率以及耳郭蓝染面积越高ꎬ初步提示静注人免疫球蛋白制品中的多聚体与本品的类过敏反应有一定的关联性ꎮ多聚体是一种由球蛋白聚集而成的聚合物ꎬ这种高分子聚合物含有多个IgG分子ꎬ理论上具有多个Fc端补体结合位点ꎬ可以与补体分子结合ꎬ进而对补体系统产生重要影响ꎮ本研究旨在探讨ꎬ静注人免疫球蛋白中的IgG聚合物是否可能模拟免疫复合物ꎬ与补体分子结合ꎬ激活补体系统ꎬ产生具有过敏效应的过敏毒素分子C3a㊁C5aꎬ进而引发类过敏反应症状ꎬ考察补体系统是否与本品的不良反应存在关联性ꎮ1㊀仪器与材料1.1㊀实验仪器㊀5804R型高速冷冻离心机(Eppendorf公司)ꎻTW20型恒温水浴锅[优博莱技术(北京)有限公司]ꎻPURA22型振摇恒温水浴锅(优博莱)ꎻXP205型电子天平(梅特勒-托利多仪器有限公司)ꎻGHP-9080型隔水式恒温培养箱(上海一恒科学仪器厂)ꎻXmark型多通道酶标仪(BioRad公司)ꎮ1.2㊀试剂与耗材㊀静注人免疫球蛋白(企业A㊁B㊁C㊁Dꎻ规格均为5%ꎬ批号分别为20221223㊁202302004㊁20230631㊁202212034)ꎻ多聚体含量升高的静注人免疫球蛋白:各企业产品50ħ恒温水浴分别加热10min㊁30minꎻ氯化钙㊁氯化镁㊁氯化钠㊁巴比妥钠㊁盐酸㊁四乙酸乙二胺二钠(EDTA-2Na)均为国产分析纯ꎮ0.9%氯化钠溶液(批号:220807K01ꎬ武汉滨湖双鹤药业有限责任公司)ꎻ人补体分子C3aELISA试剂盒(批号:ml1980523Vꎬ上海酶联生物科技有限公司)ꎻ人补体分子C5aELISA试剂盒(批号:ml1999253Vꎬ上海酶联生物科技有限公司)ꎻ人补体分子Sc5b~9ELISA试剂盒(批号:ml062554Vꎬ上海酶联生物科技有限公司)ꎻ人补体分子BbELISA试剂盒(批号:ml038432Vꎬ上海酶联生物科技有限公司)ꎻ人补体分子C4aELISA试剂盒(批号:ml935026Vꎬ上海酶联生物科技有限公司)ꎮ1.3㊀试剂溶液的配制㊀冰PBS溶液:称取700mgEDTA-2Na粉末ꎬ加PBS溶液(pH=7.4)20mL使溶解ꎬ制成EDTA-2Na浓度为100mmoL L-1的溶液ꎬ4ħ冰箱冷藏ꎮ镁-钙贮备液:称取氯化钙1.103g㊁氯化镁(MgCl2 6H2O)5.083gꎬ加水溶解并稀释至25mLꎮVBS缓冲液:称取氯化钠41.5g㊁巴比妥钠5.1gꎬ加水800mL溶解ꎮ用1moL L-1盐酸溶液调pH值至7.3ꎬ加镁-钙贮备液2.5mLꎬ加水稀释至1000mLꎬ用0.45μm膜滤过ꎬ4ħ保存ꎮ临用前ꎬ加水5倍稀释ꎮ2㊀实验方法2.1㊀人血清制备㊀使用一次性采血针ꎬ从20位健康志愿者左前臂静脉采血4~6mLꎬ室温下静置30minꎬ3000r min-14ħ离心15minꎬ分离血清ꎬ1.5mL离心管进行分装ꎬ1mL/管ꎬ-80ħ冰箱保存备用ꎮ健康志愿者纳入标准:18~55岁ꎬ性别不限ꎬ无重大疾病及近期急慢性感染病史ꎮ2.2㊀体外补体孵育试验㊀量取40μL静注人免疫球蛋白制剂ꎬ加60μLVBS缓冲液ꎬ再加入200μL人血清ꎬ混匀ꎬ置于37ħ80r min-1振荡孵育1hꎬ孵育结束后ꎬ加30μL冰PBS溶液终止反应ꎬ按人C3a㊁C4a㊁C5a㊁Sc5b-9㊁BbELISA试剂盒说明书测定孵育后各反应体系中各相应补体分子的含量ꎮ另取40μL的生理盐水ꎬ同法操作ꎬ作为阴性对照ꎮ2.2.1㊀不同供试品浓度下C3a㊁C5a㊁Sc5b-9的变化趋势㊀为考察供试品浓度对补体系统的影响ꎬ设置了不同的供试品浓度ꎬ用VBS溶液将静注人免疫球蛋白制剂稀释至浓度为50㊁25㊁12.5㊁5㊁2.5mg mL-1的溶液ꎮ取上述各溶液100μLꎬ加入200μL人血清ꎬ置于37ħ振荡孵育1hꎮ孵育结束后ꎬ分别测定450nm波长处C3a㊁C5a㊁Sc5b-9的变化趋势ꎮ2.2.2㊀不同反应比例对C3a㊁C5a㊁Sc5b-9㊁C4a㊁Bb含量的影响㊀为考察供试品-人血清体积比对补体系统的影响ꎬ设置了不同的反应体积比(供试品/血清比例为1/1㊁1/2㊁2/1)ꎬ置于37ħ振荡孵育1小时ꎮ孵育结束后ꎬ分别测定C3a㊁C5a㊁Sc5b-9㊁C4a㊁Bb的含量ꎬ操作同 2.2 项下ꎮ2.2.3㊀不同企业产品对C3a㊁C5a㊁Sc5b-9㊁C4a㊁Bb含量的影响㊀为考察不同企业产品对补体系统的影响ꎬ分别选取4家企业产品以及加热处理的产品与人血清反应ꎬ置于37ħ振荡孵育1hꎬ孵育结束后ꎬ分别测定C3a㊁C5a㊁Sc5b-9㊁C4a㊁Bb的含量ꎬ操作同 2.2 项下ꎮ2.3㊀数据处理㊀使用SPSS统计软件进行分析ꎬ实验数据均以(xʃs)表示ꎬ采用单因素方差分析比较各组之间补体分子变化是否有差异ꎬPɤ0.05时认为差异有统计学意义ꎮ3㊀结果3.1㊀不同供试品浓度下C3a㊁C5a㊁Sc5b-9的变化趋势㊀与生理盐水组相比ꎬ随着供试品浓度增加ꎬ补体分子C3a和Sc5b-9的吸光度值几乎无变化ꎬ呈一条直线ꎬ而补体分子C5a随着供试品浓度增加ꎬ吸光度值呈缓慢下降趋势ꎬ结果见图1ꎮ结果初步表明ꎬ不同浓度下供试品溶液对补体系统无激活作用ꎬ相反ꎬ可能存在抑制作用ꎮ图1㊀不同供试品浓度下补体分子C3a㊁C5a㊁Sc5b-9的吸光度变化(n=2)3.2㊀不同反应比例条件下C3a㊁C5a㊁Sc5b-9㊁C4a㊁Bb的变化趋势㊀供试品与人血清在体外共同孵育时ꎬ当两者体积比分别为1ʒ2㊁1ʒ1㊁2ʒ1时ꎬ与相应体积比的阴性对照相比ꎬ所有组中C3a㊁C5a㊁Sc5b-9㊁C4a㊁Bb的含量均出现下降(除2ʒ1体积比组中Bb略有上升外)ꎬ结果见表1ꎮ表明在上述3种体积比条件下ꎬ供试品均不能激活补体系统ꎬ且呈现出一定程度抑制ꎮ表1㊀不同反应体积比条件下补体分子C3a㊁C5a㊁Sc5b-9㊁C4a㊁Bb的变化趋势(xʃsꎬn=3)组别C3a/ng mL-1C5a/pg mL-1Sc5b-9/ng mL-1C4a/μg mL-1Bb/ng mL-1阴性对照(1ʒ1)4.64ʃ0.258646.904ʃ14.53116.127ʃ5.94694.935ʃ3.7877.365ʃ0.596实验组(1ʒ1)3.829ʃ0.128533.686ʃ10.065∗∗10.253ʃ3.05385.565ʃ1.9495.914ʃ0.329阴性对照(1ʒ2)6.032ʃ0.408851.780ʃ72.47125.667ʃ1.123123.404ʃ3.8138.633ʃ0.959实验组(1ʒ2)5.238ʃ0.199658.234ʃ18.320∗∗20.009ʃ1.629113.494ʃ2.4526.398ʃ0.555阴性对照(2ʒ1)3.52ʃ0.062437.069ʃ20.406-∗56.826ʃ0.7804.967ʃ0.602实验组(2ʒ1)3.354ʃ0.168394.640ʃ8.395∗∗-∗55.384ʃ3.9385.756ʃ0.353㊀注:∗吸光度低于标准曲线最低浓度点的吸光度ꎬ未计算ꎻ与相应的阴性对照组相比ꎬ∗∗P<0.01ꎮ3.3㊀不同企业产品对补体系统的影响㊀4家企业的静注人免疫球蛋白制剂与人血清体外孵育时ꎬ相比于生理盐水对照组ꎬ补体分子C3a(3/4组)㊁C5a(4/4组)㊁C4a(4/4组)㊁Bb(4/4组)㊁Sc5b-9(2/4组)出现下降ꎬ仅A企业产品组中C3a㊁Sc5b-9以及B企业产品组中Sc5b-9有一定程度上升ꎬ但差异不具有统计学意义(P>0.05)ꎮ4家企业的静注人免疫球蛋白制剂经50ħ加热处理后ꎬ与人血清体外孵育ꎬ相比于生理盐水对照组ꎬ补体分子C3a(3/4组)㊁C5a(4/4组)㊁C4a(2/4组)㊁Bb(4/4组)㊁Sc5b-9(3/4组)出现下降ꎬ仅部分企业产品组中C3a㊁C4a以及Sc5b-9有一定程度上升ꎮ与相应的未加热产品组相比ꎬ在经过加热的产品组中ꎬ上述补体分子并未出现统计学意义变化ꎮ图2㊀不同企业产品与人血清孵育后补体分子的变化(n=3)㊀注:与阴性对照组相比ꎬ∗P<0.05ꎬ∗∗P<0.01ꎮ4㊀讨论静注人免疫球蛋白是一种在临床上广泛应用的血液制品ꎬ需求量较大ꎬ临床用药过程中ꎬ绝大部分不良反应报告发生在给药后30min内ꎮ与补体系统激活相关的类过敏反应(complementactivation-relatedpseudoallergyꎬCARPA)被认为是速发型药物过敏反应的重要类别之一[5-6]ꎬ其机制是补体系统激活后ꎬ产生了诸如C3a㊁C5a等过敏毒素ꎬ与相应的细胞受体结合后ꎬ继而引发一系列的类过敏反应症状[7-8]ꎮ体外补体孵育试验是一种快速评价药物类过敏反应的非临床研究方法[9-13]ꎬ通过将供试品与正常人血清按一定比例混合ꎬ在37ħ孵育一段时间后ꎬ采用ELISA试剂盒检测血清中补体分子及补体终末产物的变化ꎬ由此判断供试品是否具有激活补体系统进而引发类过敏反应的能力ꎮ在本研究中检测了补体系统激活及效应阶段的多个补体分子ꎮC3a/C5a是补体系统激活的中间代表性产物ꎬ具有强烈的过敏效应ꎮSc5b-9是补体激活的最终产物ꎬ反映补体系统最终激活程度ꎮC4a是经典激活途径㊁甘露糖凝集素途径的特征性中间产物ꎬBb是旁路途径的特征性中间产物ꎮ孵育后ꎬ通过分析各指标的变化趋势ꎬ可进一步确定供试品是通过何种途径激活补体以及激活程度ꎮ本研究通过考察供试品浓度㊁供试品/血浆比例㊁孵育时间(1h和4hꎬ结果未显示)对上述补体分子的影响ꎮ发现在所考察的影响因素范围内ꎬ与相应的生理盐水对照组相比ꎬ补体分子浓度基本呈降低趋势ꎬ未出现显著升高现象ꎬ表明供试品与补体体外孵育后ꎬ并未激活补体ꎮ本研究中的体外补体孵育评价实验包括两个关键影响因素:一是供试品与血浆比例ꎬ二是补体系统激活所需的钙镁离子ꎮ研究显示ꎬ不同供试品/血浆比例条件下ꎬ与生理盐水对照组相比ꎬ绝大部分补体分子均呈下降趋势(2ʒ1比例时Bb分子除外)ꎮ为最大程度模拟体内给药比例ꎬ根据药品说明书ꎬ70kg体重成人的剂量为400mg kg-1ꎬ人体血浆体积约为2.75Lꎬ折合给药比例为10mgʒ1mL血浆ꎮ同时考虑到钙镁离子是补体系统激活所必需的离子ꎬ因此采用VBS稀释液稀释供试品ꎬ使供试品与血浆接近临床用药比例ꎮ保障血液制品用药安全ꎬ降低用药过程中的不良反应发生率是临床用药安全的关注重点ꎮ本研究以静注人免疫球蛋白为研究对象ꎬ考察产品对补体系统的影响ꎬ并验证所提出的假设 IgG聚合物可能通过激活补体系统引发类过敏反应 ꎮ结果提示ꎬ静注人免疫球蛋白不能激活补体系统ꎬ同时IgG聚合物增加后ꎬ补体系统并未出现激活增加现象ꎮ结合免疫球蛋白浓度增加ꎬC5a浓度随之出现下降ꎬ提示存在剂量依赖性抑制作用ꎮ至于静注人免疫球蛋白是否与补体系统结合但不激活ꎬ值得进一步深入探讨ꎮ(下转第49页)的生物等效性研究提供了数据参考ꎬ适用于阿普斯特的血药浓度检测及其药代动力学研究ꎬ为阿普斯特制剂一致性评价提供依据ꎮ研究结果表明ꎬ空腹和餐后口服阿普斯特片受试制剂和参比制剂的Cmax㊁AUC0~t㊁AUC0~ɕ几何均值比的90%CI均在80.00%~125.00%等效区间内(包括边界值)ꎬ符合生物等效性评价标准ꎮ此外ꎬ本试验中空腹和餐后给药后阿普斯特Cmax㊁AUC0~t㊁AUC0~ɕ的个体内变异CV均小于30%ꎬ不属于高变异药物ꎮCmax㊁AUC0~t㊁AUC0~ɕ经对数转换后的多因素方差分析结果显示给药周期㊁给药序列㊁个体间㊁制剂间的差异均具有统计学意义(P<0.05)ꎮ研究结果表明两种制剂在空腹和餐后条件下口服给药符合生物等效ꎮ另外ꎬ由药动学参数AUC0-t可知阿普斯特餐后条件下口服给药生物利用度较空腹条件下高ꎬ为临床提供更合理的用药指导ꎬ为患者提供更好的治疗效果ꎮ参考文献:[1]㊀中华医学会皮肤性病分会银屑病学组.中国银屑病治疗专家共识(2014版)[J].中华皮肤科杂志ꎬ2014ꎬ47(3):213-215.[2]王丽玮ꎬ杨莹ꎬ崔盘根.抗白细胞介素17生物制剂治疗银屑病的疗效和安全性[J].国际皮肤性病学杂志ꎬ2016ꎬ42(3):149-152.[3]中华医学会皮肤性病学分会银屑病专业委员会.国银屑病诊疗指南(2018简版)[J].中华皮肤科杂ꎬ2019ꎬ52(4):223-230.[4]BLAUVELTA.Ixekizumab:anewanti-IL-17Amonoclonalantibodytherapyformoderate-tosevereplaquepsoriasis[J].ExpertOpinBiolTherꎬ2016ꎬ16(2):255-263.[5]陈茜茜ꎬ李军霞ꎬ扶晓兰ꎬ等.白塞病遗传学研究进展[J].中华风湿病学杂志ꎬ2017ꎬ21(1):63-66. [6]SCHAFERPHꎬPARTONAꎬGANDHIAKꎬetal.Aprem ̄ilastꎬacAMPphosphodiesterase-4inhibitorꎬdemonstratesanti-inflammatoryactivityinvitroandinamodelofpso ̄riasis[J].BrJPharmacolꎬ2010ꎬ159(4):842-855. [7]SCHETTGꎬSLOANVSꎬSTEVENSRMꎬetal.Apremilast:anovelPDE4inhibitorinthetreatmentofau ̄toimmuneandinflammatorydiseases[J].TherAdvMus ̄culoskeletDisꎬ2010ꎬ2(5):271-278.[8]POOLERMꎬBALLANTYNEAD.Apremilast:FirstGlobalApproval[J].Drugsꎬ2014ꎬ74(7):825-837. [9]ANIꎬHARMANMꎬIBILOGLUI.CaseReportBullousHemorrhagicDermatosisInducedbyEnoxaparin[J].IndianDermatolOnlineJꎬ2017ꎬ8(5):347-350.[10]KULKARNIPꎬDESHPANDEA.AnalyticalMethodsforDeterminationofApremilastfromBulkꎬDosageFormandBiologicalFluids:ACriticalReview[J].CritRevAnalChemꎬ2021ꎬ51(3):258-268.[11]国家药典委员会.中华人民共和国药典2020年版(四部)[S].北京:中国医药科技出版社ꎬ2020:466-472.(收稿日期:2022-03-24)(上接第43页)参考文献:[1]㊀GUOYꎬTIANXꎬWANGXFꎬetal.AdverseEffectsofImmu ̄noglobulinTherapy[J].FrontImmunolꎬ2018(9):1299. [2]STIEHMER.Adverseeffectsofhumanimmunoglobulintherapy[J].TransfusMedRevꎬ2013ꎬ27(3):171-178. [3]SUTOVAIꎬCHOVANCOVAZꎬLITZMANJ.Adverseeffectsofimmunoglobulintherapy[J].VnitrLekꎬ2019ꎬ65(2):131-132.[4]AZIZIGꎬABOLHASSANIHꎬASGARDOONMHꎬetal.Managingpatientswithsideeffectsandadverseeventstoimmunoglobulintherapy[J].ExpertRevClinPharmacolꎬ2016ꎬ9(1):91-102.[5]SZEBENIJ.Complementactivation-relatedpseudoallergy:anewclassofdrug-inducedacuteimmunetoxicity[J].Toxi ̄cologyꎬ2005ꎬ216(2/3):106-121.[6]ZHANGBꎬLIQꎬSHICYꎬetal.Drug-InducedPseudoal ̄lergy:AReviewoftheCausesandMechanisms[J].Phar ̄macologyꎬ2018ꎬ101(1/2):104-110.[7]SZEBENIJꎬALVINGCRꎬMUGGIAFM.ComplementActivationbyCremophorELasaPossibleContributortoHypersensitivitytoPaclitaxel:anInVitroStudy[J].JNatlCancerInstꎬ1998ꎬ90(4):300.[8]MOGHIMISMꎬSIMBERGDꎬPAPINIEꎬetal.Complementactivationbydrugcarriersandparticulatepharmaceuticals:Principlesꎬchallengesandopportunities[J].AdvDrugDelivRevꎬ2020(157):83-95. [9]冯彩霞ꎬ修宪ꎬ田伟ꎬ等.补体活化的体外评价模型建立及应用[J].药学学报ꎬ2017ꎬ52(5):722-728.[10]张嘉ꎬ李贻奎ꎬ李连达ꎬ等.补体系统激活在吐温80导致类过敏反应中的作用[J].毒理学杂志ꎬ2009ꎬ23(6):457-459.[11]刘春琰ꎬ窦德强.血塞通注射液对人血清补体系统影响的体外研究[J].辽宁中医杂志ꎬ2015ꎬ42(4):808-810. [12]王珏ꎬ江颖ꎬ肖新月ꎬ等.生物制品用辅料蔗糖中颗粒杂质体外补体激活研究[J].药学研究ꎬ2022ꎬ41(3):149-152. [13]陈莉婧ꎬ廖国平ꎬ汪艳ꎬ等.清开灵注射液对人血清补体和RBL-2H3细胞影响的体外研究[J].中国中药杂志ꎬ2011ꎬ36(14):1884-1888.(收稿日期:2023-08-23)。
生物制品37℃热稳定性试验标准
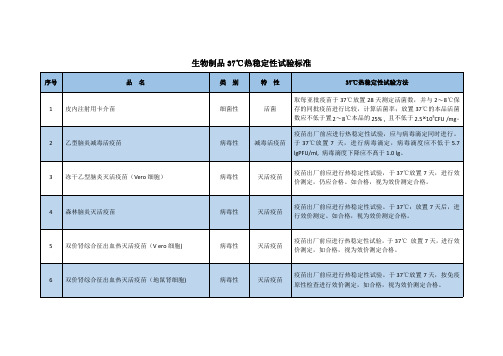
序号 品 名 类 别 特 性 37℃热稳定性试验方法 取每亚批疫苗于 37℃放置 28 天测定活菌数,并与 2〜8℃保 存的同批疫苗进行比较,计算活菌率;放置 37℃的本品活菌 数应不低于置 2〜8℃本品的 25% , 且不低于 2.5×105CFU /mg。 疫苗出厂前应进行热稳定性试验,应与病毒滴定同时进行。 于 37 ℃放置 7 天,进行病毒滴定,病毒滴度应不低于 5.7 lgPFU/ml, 病毒滴度下降应不髙于 1.0 lg。 疫苗出厂前应进行热稳定性试验,于 37℃放置 7 天,进行效 价测定,仍应合格。如合格,视为效价测定合格。于 37℃放置 7 天,按免疫 原性检查进行效价测定,如合格,视为效价测定合格。 疫苗出厂前应进行热稳定性试验。于 37℃放置 28 天后,进行 效价测定,效价测定应不低于 2.5IU/剂,如合格,视为效价测 定合格。 疫苗出厂前应进行热稳定性试验,应与病毒滴定同时进行。 于 37 ℃放置 72 小时后,进行病毒滴定,病毒滴度应不低于 6.50lgCCID50/剂,病毒滴度下降应不髙于 0.50 lg。 疫苗出厂前应进行热稳定性试验,应与病毒滴定同时进行。 于 37℃放置 7 天后, 进行病毒滴定, 病毒滴度应不低于 3. 3 lg CCID50/ml,病毒滴度下降应不高于 1.0 lg。 疫苗出厂前应进行热稳定性试验,应与病毒滴定同时进行。 于 37℃放置 7 天后,进行病毒滴定,病毒滴度应不低于 4.0 lg CCID50/ml,病毒滴度下降应不高于 1.0 lg。 疫苗出厂前应进行热稳定性试验,应与病毒滴定同时进行。 于 37℃放置 7 天后, 进行病毒滴定, 病毒滴度应不低于 3.5 lg CCID50 /ml,病毒滴度下降应不高于 1.0 lg。 疫苗出厂前应进行热稳定性试验,应与病毒滴定同时进行。 于 37°C 放置 7 天后,进行病毒滴定,病毒滴度应不低于 3.6 lg PFU/ml,病毒滴度下降应不髙于 1.0 lg。
静注人免疫球蛋白的临床应用

性溶血和肾功能减退,国内尚无如此严重的副作用报告。 2.对策
a.控制IVIG的输注速度和剂量 推荐静脉点滴2.5%浓度的IVIG溶液以0.5-5.0mg/kg.min为宜。 每天剂量为400mg/kg.
10
五、不良反应与对策
16
17
2、应用丙种球蛋白有一定的适应症,因为该药随所含抗体量 的不同而预防效果各异。普通的丙种球蛋白主要用于预防麻疹、 甲肝、流行性腮腺炎等,想用丙种球蛋白来预防各种疾病是不 可能的。
3、如果反复注射丙种球蛋白,因其本身可作为抗原,刺激人 体产生一种对抗丙种球蛋白的抗体,即抗抗体,一旦再注射丙 种球蛋白,就会被抗体中和,不能发挥其抗病作用。
分类:按给药途径分为:静注人免疫球蛋白和肌肉注射人免疫球蛋白。
我
我院现用为静注人免疫球蛋白(IVIG)
3
二、药理作用:
1.抗感染 I IVIG中含有多价抗原特异性IgG抗体。具有抗病毒、抗细菌和抗巨细胞病毒抗原多 种功能,IVIG中还存在抗链球菌致热性外毒素(SPD-A)和抗葡萄球菌肠毒素抗体, 可直接中和毒素使其血浓度下降,从而改善临床症状。
是由IgG型溶血性抗体导致的自身免疫性溶血效果尤为显著。 剂量:1000mg/kg.d,每2天1次,共2次或400mg/kg.d,连用5
天。
7
四、临床应用:
3.血液系统疾病 d.慢性淋巴细胞性白血病 IVIG能有效的降低感染,改善出血和贫血症状,使病情得到好
转。 剂量:400mg/kg.d,每隔3周1次,共6次。
5
四、临床应用:
1.细菌感染性疾病 a.新生儿及早产儿败血症 早产儿因胎盘转移输送的母体IgG不足,血清IgG水平较低,故 可考虑用IVIG预防治疗。 方法:新生儿细菌感 500mg/kg.d,每周一次,共4次。 早产儿细菌感染 500-750mg/kg.d.每2周1次,共3次。 b.烧伤脓毒败血症 细菌所致的脓毒败血症是导致烧伤病人死亡的主要原因,免疫 球蛋白的水平与烧伤面积的烧伤后的时间在关,烧伤后48小时 内IgG水平下降,主要与IgG的分解有关,而与合成速度无关。 常用剂量为400mg-750mg/kg.d。
静注人免疫球蛋白药品标准

静注人免疫球蛋白药品标准
一、药品名称
药品名称:静注人免疫球蛋白
二、成分
本品主要成分为人免疫球蛋白。
三、性状
本品为无色或淡黄色的澄清液体,含适量稳定剂,不含防腐剂。
四、适应症
静注人免疫球蛋白适用于:
1.预防和治疗各种免疫缺陷病,如重症感染、新生儿败血症、重症川崎病等。
2.用于治疗自身免疫性疾病,如原发性血小板减少性紫癜、系统性红斑狼疮
等。
3.用于治疗继发性免疫缺陷病,如晚期癌症患者免疫力低下等。
五、用法用量
本品只能由医生指导使用,以下为一般使用方法:
1.静脉注射:将本品以5%葡萄糖溶液或生理盐水稀释1-2倍后,缓慢静脉注
射,注射时间不少于30分钟。
注射时应避免血液返流。
2.剂量:根据患者的具体情况和医生的指导来确定,一般为每日20-
40mg/kg体重。
六、规格
本品的规格为2.5g/瓶、5g/瓶、10g/瓶。
七、贮藏
本品应贮藏在2-8℃的暗处,避免冷冻和阳光直射。
八、有效期
本品的效期为2年。
九、生产商
本品的生产商为XXXX制药有限公司。
十、进口/国产
本品为国产药品。
《中国药典》2020版—人血白蛋白等制品纯度测定方法

附件 1:人血白蛋白等制品纯度测定方法《中国药典》2015年版三部拟增修订内容人血白蛋白 3.1.2 纯度 3.1.2 纯度应不低于蛋白质总量的96.0% 应不低于蛋白质总量的96%(供(通则0541 第二法)。
试品溶液的蛋白质浓度为5%,按通则0541 第二法、第三法进行)。
3.3.3.3 纯度 3.3.3.3 纯度应不低于蛋白质总量的96.0% 应不低于蛋白质总量的96%(供(通则0541 第二法)。
试品溶液的蛋白质浓度为5%,按通则0541 第二法、第三法进行)。
冻干人血白蛋白 3.1.2 纯度 3.1.2 纯度应不低于蛋白质总量的96.0% 应不低于蛋白质总量的96%(供(通则0541 第二法)。
试品溶液的蛋白质浓度为5%,按通则0541 第二法、第三法进行)。
3.3.3.4 纯度 3.3.3.4 纯度应不低于蛋白质总量的96.0% 应不低于蛋白质总量的96%(供(通则0541 第二法)。
试品溶液的蛋白质浓度为5%,按通则0541 第二法、第三法进行)。
人免疫球蛋白 3.1.2 纯度 3.1.2 纯度应不低于蛋白质总量的90.0% 应不低于蛋白质总量的90.0%(通则0541 第二法)。
(供试品溶液的蛋白质浓度为5%,按通则0541 第二法、第三法进行)。
3.3.3.3 纯度 3.3.3.3 纯度应不低于蛋白质总量的90.0% 应不低于蛋白质总量的90.0%(通则0541 第二法)。
(供试品溶液的蛋白质浓度为5%,按通则0541 第二法、第三法进行)。
冻干人免疫球蛋白 3.1.2 纯度 3.1.2 纯度应不低于蛋白质总量的90.0% 应不低于蛋白质总量的90.0%(通则0541 第二法)。
(供试品溶液的蛋白质浓度为5%,按通则0541 第二法、第三法进行)。
3.3.3.4 纯度 3.3.3.4 纯度应不低于蛋白质总量的90.0% 应不低于蛋白质总量的90.0%(通则0541 第二法)。
(供试品溶液的蛋白质浓度为5%,按通则0541 第二法、第三法进行)。
《中国药典》2020版—人血白蛋白铝离子残留量测定方法,人血白蛋白等制品纯度测定方法

附件:人血白蛋白铝离子残留量测定方法,人血白蛋白等制品纯度测定方法增修草案公示稿一、3208 人血白蛋白铝残留量测定法第一法原子吸收分光光度法(略)(无增修订)第二法电感耦合等离子体质谱法(增订)本法系用电感耦合等离子体质谱法测定人血白蛋白制品中铝的残留量。
照电感耦合等离子体质谱法(通则0412)测定。
仪器参数的设置应根据选用的电感耦合等离子体质谱仪型号的特点,合理设置仪器参数,并通过开启碰撞反应池等手段消除质谱型干扰。
一般参考条件;射频功率为1400-1600W,采样深度6-10mm,雾化器/载气流速0.65-1.30 L/min,载气补偿气流速0-0.65 L/min, 蠕动泵转速0. L rps, 氦气模式,积分时间0.3-1.5秒,重复次数为3次。
试剂 5% (v/v) 硝酸溶液量取硝酸(65%-68%) 25m1,用超纯水稀释至500 m1, 混匀,即得。
内标溶液的制备精密量取杭标准品适量,用5%硝酸溶液稀释制成适宜的浓度,使进样浓度为50μg/L。
标准品溶液的制备精密量取铝标准品适量,用5%硝酸溶液稀释制成1000 μg/L 的溶液,作为铝标准品贮备液。
精密量取铝标准品贮备液适量,用5%硝酸溶液分别稀释制成0μg/L、2.5μg/L、5μg/L、lOμg/L、2Oμg/L、40μg/L 的溶液。
供试品溶液的制备精密量取供试品1ml,加5%硝酸溶液9m1, 涡旋混匀后静置4 小时以上,以每分钟4000转离心30分钟,取上清液用0.45μm 滤膜滤过,取续滤液作为供试品溶液。
测定法分别取标准品溶液,供试品溶液和内标溶液注入电感耦合等离子体质谱仪,记录铝元素及内标元素的响应值。
以标准品溶液铝浓度为横坐标,对其相应铝元素与内标元素响应值的比值为纵坐标作直线回归,求得直线回归方程,直线回归相关系数应不低于0.999;将测得的供试品溶液铝元素与内标元素响应值的比值带入直线回归方程,计算供试品溶液中铝残留量,再乘以稀释倍数,即为供试品中铝残留量。
《中国药典》2015年版生物制品质控要点

通用性技术要求—凡例General notices
(十章31条修订为十章34条)
章节
内容
2015版增修订
总 则:
6项(1-6),药典结构、内容、使用 标准体系中明确生物制品通则(原通则)和通则(原附录),并在生物制品通
原则的一般说明
则与各论之间增加总论的相关描述
正文(各论)
2项(7-8),各论内容、体例框架
生物制品生产检定用动物细胞基质制备及检定规程修订一对生产用细胞基质总的要求一细胞系株历史资料二细胞培养操作要求三细胞库四细胞检定五生产细胞培养二连续传代细胞系的特殊要求verochons0细胞等三人二倍体细胞株的特殊要求mrc52bskmb17等五原代细胞的要求一动物组织来源和其他材料二原代细胞培养物的检查phk六检定用细胞的要求一细胞资料二细胞检定附录1逆转录酶活性检查法附录2成瘤性检查法附录3致瘤性检查法17一供血浆者的选择一供血浆者体格检查二供血浆者血液检验三有下列情况者不能供血浆四有下列情况者暂不供血浆五供血浆者接受免疫接种后采集血浆的规定二血浆的采集一单采血浆站要求二采集血浆器材的要求三采集血浆的频度及限量三血浆检验一单人份血浆二合并血浆六特异性免疫血浆制备及其供血浆者免疫要求一血浆二供血浆者三供血浆者免疫18生物物免疫血浆 人血浆
未修订:
生物制品分批规程 生物制品包装规程
生物制品通则: 生物制品分批规程--无修订
1. 批号审定的组织管理
2. 批号(批、亚批)确定的原则:同一批号的制 品,应来源一致、质量均一,按规定要求抽样检验 后,能对整批制品作出评定。
3. 生物制品批号和亚批号编制的具体规则;
9203 药品微生物实验室质量管理指导原则
8005 指示剂与指示液
《中国药典》2022年版目录(三部四部)

《中国药典》2022年版目录(三部四部)《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(附件三部生物制品通则1生物制品生产检定用菌毒种管理规程2生物制品国家标准物质制备和标定规程3生物制品生产用原材料及辅料质量控制规程4生物制品分批规程5生物制品分装和冻干规程6生物制品包装规程7生物制品贮藏和运输规程8免疫血清生产用马匹检疫和免疫规程9血液制品生产用人血浆10生物制品生产检定用动物细胞基质制备及检定规程总论1人用疫苗总论2人用重组DNA蛋白制品总论3人用重组单克隆抗体制品总论4微生态活菌制品总论Ⅰ预防类1伤寒疫苗2伤寒甲型副伤寒联合疫苗3伤寒甲型乙型副伤寒联合疫苗4伤寒Vi多糖疫苗5重组B亚单位/菌体霍乱疫苗(肠溶胶囊)6A群脑膜炎球菌多糖疫苗7A群C群脑膜炎球菌多糖疫苗8A群C群脑膜炎球菌多糖结合疫苗10b型流感嗜血杆菌结合疫苗11吸附白喉疫苗12吸附白喉疫苗(成人及青少年用)13吸附破伤风疫苗14吸附白喉破伤风联合疫苗15吸附白喉破伤风联合疫苗(成人及青少年用)16吸附百日咳白喉联合疫苗17吸附百白破联合疫苗18吸附无细胞百白破联合疫苗19皮上划痕用鼠疫活疫苗20皮上划痕人用炭疽活疫苗21皮上划痕人用布氏菌活疫苗22皮内注射用卡介苗23钩端螺旋体疫苗24乙型脑炎减毒活疫苗25冻干乙型脑炎灭活疫苗(Vero细胞)26森林脑炎灭活疫苗27双价肾综合征出血热灭活疫苗(Vero细胞)28双价肾综合征出血热灭活疫苗(地鼠肾细胞)29双价肾综合征出血热灭活疫苗(沙鼠肾细胞)30冻干人用狂犬病疫苗(Vero细胞)31冻干甲型肝炎减毒活疫苗32甲型肝炎灭活疫苗(人二倍体细胞)33重组乙型肝炎疫苗(酿酒酵母)34重组乙型肝炎疫苗(CHO细胞)35重组乙型肝炎疫苗(汉逊酵母)36甲型乙型肝炎联合疫苗37麻疹减毒活疫苗38腮腺炎减毒活疫苗39风疹减毒活疫苗(人二倍体细胞)40水痘减毒活疫苗41麻疹腮腺炎联合减毒活疫苗42麻疹风疹联合减毒活疫苗43麻腮风联合减毒活疫苗44流感全病毒灭活疫苗45流感病毒裂解疫苗46口服脊髓灰质炎减毒活疫苗(猴肾细胞)《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(47脊髓灰质炎减毒活疫苗糖丸(人二倍体细胞)48脊髓灰质炎减毒活疫苗糖丸(猴肾细胞)Ⅱ治疗类1白喉抗毒素2冻干白喉抗毒素3破伤风抗毒素4冻干破伤风抗毒素5多价气性坏疽抗毒素6冻干多价气性坏疽抗毒素7肉毒抗毒素8冻干肉毒抗毒素9抗蝮蛇毒血清10冻干抗蝮蛇毒血清11抗五步蛇毒血清12冻干抗五步蛇毒血清13抗银环蛇毒血清14冻干抗银环蛇毒血清15抗眼镜蛇毒血清16冻干抗眼镜蛇毒血清17抗炭疽血清18抗狂犬病血清19人血白蛋白20冻干人血白蛋白21人免疫球蛋白22冻干人免疫球蛋白23乙型肝炎人免疫球蛋白24冻干乙型肝炎人免疫球蛋白25静注乙型肝炎人免疫球蛋白(pH4)26冻干静注乙型肝炎人免疫球蛋白(pH4)27狂犬病人免疫球蛋白28冻干狂犬病人免疫球蛋白29破伤风人免疫球蛋白30冻干破伤风人免疫球蛋白31静注人免疫球蛋白(pH4)32冻干静注人免疫球蛋白(pH4)33人凝血因子Ⅷ34人纤维蛋白原35人纤维蛋白粘合剂36人凝血酶原复合物37抗人T细胞猪免疫球蛋白38抗人T细胞兔免疫球蛋白39注射用重组人促红素(CHO细胞)40重组人促红素注射液(CHO细胞)41注射用重组人干扰素α1b42重组人干扰素α1b注射液43重组人干扰素α1b滴眼液44注射用重组人干扰素α2a45重组人干扰素α2a注射液46重组人干扰素α2a栓47注射用重组人干扰素α2a(酵母)48注射用重组人干扰素α2b49重组人干扰素α2b注射液50重组人干扰素α2b滴眼液51重组人干扰素α2b栓52重组人干扰素α2b乳膏53重组人干扰素α2b凝胶54注射用重组人干扰素α2b(酵母)55注射用重组人干扰素α2b(假单胞菌)56重组人干扰素α2b注射液(假单胞菌)57重组人干扰素α2b喷雾剂(假单胞菌)58重组人干扰素α2b软膏(假单胞菌)59注射用重组人干扰素γ60注射用重组人白介素-261重组人白介素-2注射液62注射用重组人白介素-2(Ⅰ)63注射用重组人白介素-1164注射用重组人白介素-11(酵母)65重组人粒细胞刺激因子注射液66注射用重组人粒细胞巨噬细胞刺激因子67重组牛碱性成纤维细胞生长因子外用溶液68外用重组牛碱性成纤维细胞生长因子69重组牛碱性成纤维细胞生长因子凝胶70重组牛碱性成纤维细胞生长因子滴眼液71外用重组人表皮生长因子72重组人表皮生长因子外用溶液(Ⅰ)73重组人表皮生长因子凝胶(酵母)74重组人表皮生长因子滴眼液(酵母)75注射用重组链激酶76尼妥珠单抗注射液77注射用鼠神经生长因子78注射用A型肉毒毒素Ⅲ体内诊断类1结核菌素纯蛋白衍生物2卡介菌纯蛋白衍生物3布氏菌纯蛋白衍生物4锡克试验毒素-3-《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(Ⅳ体外诊断类1乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)2丙型肝炎病毒抗体诊断试剂盒(酶联免疫法)3人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)4梅毒螺旋体抗体诊断试剂盒(酶联免疫法)5梅毒快速血浆反应素诊断试剂6梅毒甲苯胺红不加热血清试验诊断试剂7抗A抗B血型定型试剂(单克隆抗体)四部药用辅料1乙交酯丙交酯共聚物(5050)(供注射用)2乙交酯丙交酯共聚物(7525)(供注射用)3乙交酯丙交酯共聚物(8515)(供注射用)4乙基纤维素5乙基纤维素水分散体6乙基纤维素水分散体(B型)7乙酸乙酯8乙醇9二丁基羟基甲苯10二甲基亚砜11二甲硅油12二氧化钛13二氧化硅14二氧化碳15十二烷基硫酸钠16十八醇17十六十八醇18十六醇19丁香茎叶油20丁香油21丁香酚22三乙醇胺23三油酸山梨坦(司盘85) 24三硅酸镁25三氯叔丁醇26三氯蔗糖27大豆油28大豆油(供注射用) 29大豆磷脂30大豆磷脂(供注射用) 31小麦淀粉32山梨酸33山梨酸钾34山嵛酸甘油酯35门冬氨酸36门冬酰胺37马来酸38马铃薯淀粉39无水亚硫酸钠40无水枸橼酸41无水碳酸钠42无水磷酸氢二钠43无水磷酸氢钙44木薯淀粉45D-木糖46木糖醇47牛磺酸48月桂山梨坦(司盘20)49月桂氮酮50月桂酰聚氧乙烯(12)甘油酯51月桂酰聚氧乙烯(32)甘油酯52月桂酰聚氧乙烯(6)甘油酯53月桂酰聚氧乙烯(8)甘油酯54巴西棕榈蜡55玉米朊56玉米淀粉57正丁醇58甘油59甘油(供注射用)60甘油三乙酯61甘油磷酸钙62甘氨酸63可可脂64可压性蔗糖《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(65可溶性淀粉66丙二醇67丙二醇(供注射用)68丙氨酸69丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体70丙酸71石蜡72卡波姆73卡波姆共聚物74甲基纤维素75白凡士林76白陶土77白蜂蜡78亚硫酸氢钠79西黄蓍胶80色氨酸81冰醋酸82交联羧甲纤维素钠83交联聚维酮84羊毛脂85异丙醇86红氧化铁87纤维醋法酯88麦芽酚89麦芽糊精90麦芽糖91壳聚糖92低取代羟丙纤维素93谷氨酸钠94肠溶明胶空心胶囊95辛酸96辛酸钠97没食子酸98尿素99阿司帕坦100阿拉伯半乳聚糖101阿拉伯胶102纯化水103环甲基硅酮104环拉酸钠105苯扎氯铵106苯扎溴铵107苯甲酸钠108苯甲醇109DL-苹果酸110L-苹果酸111果胶112果糖113明胶空心胶囊114依地酸二钠115乳糖116单糖浆117油酰聚氧乙烯甘油酯118油酸乙酯119油酸山梨坦(司盘80)120油酸钠121油酸聚氧乙烯酯122泊洛沙姆188123泊洛沙姆407124组氨酸125枸橼酸126枸橼酸三乙酯127枸橼酸三正丁酯128枸橼酸钠129轻质氧化镁130轻质液状石蜡131氢化大豆油132氢化蓖麻油133氢氧化钠134氢氧化钾136亮氨酸137活性炭(供注射用)138浓氨溶液140氧化钙141氧化锌142氧化镁143氨丁三醇144倍他环糊精145胶态二氧化硅146胶囊用明胶147粉状纤维素148烟酰胺149烟酸150DL-酒石酸151酒石酸钠152海藻酸5《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(153海藻酸钠154海藻糖155预胶化羟丙基淀粉156预胶化淀粉157黄凡士林158黄原胶159黄氧化铁160硅化微晶纤维素161硅酸镁铝162甜菊素163脱氧胆酸钠164羟乙纤维素165羟丙甲纤维素166羟丙甲纤维素邻苯二甲酸酯167羟丙纤维素168羟丙基倍他环糊精169羟丙基淀粉空心胶囊170羟苯乙酯171羟苯丁酯172羟苯丙酯173羟苯丙酯钠174羟苯甲酯175羟苯甲酯钠176羟苯苄酯177混合脂肪酸甘油酯(硬脂)178液状石蜡179淀粉水解寡糖180蛋黄卵磷脂181蛋黄卵磷脂(供注射用)182维生素E琥珀酸聚乙二醇酯183琥珀酸184琼脂185棕氧化铁186棕榈山梨坦(司盘40)187硬脂山梨坦(司盘60)188硬脂酸189硬脂酸钙190硬脂酸锌191硬脂酸聚烃氧(40)酯192硬脂酸镁193硝酸钾194硫酸195硫酸钙196硫酸铝197硫酸铵198硫酸羟喹啉199紫氧化铁200黑氧化铁201氯化钙202氯化钠(供注射用) 203氯化钾204氯化镁205氯甲酚206稀盐酸207稀醋酸208稀磷酸209焦亚硫酸钠210焦糖211滑石粉212富马酸213酪氨酸214硼砂215硼酸216微晶纤维素217微晶蜡218腺嘌呤219羧甲纤维素钙220羧甲纤维素钠221羧甲淀粉钠222聚乙二醇1000223聚乙二醇1500224聚乙二醇300(供注射用)225聚乙二醇400 226聚乙二醇400(供注射用)227聚乙二醇4000 228聚乙二醇600229聚乙二醇6000230聚乙烯醇231聚山梨酯20232聚山梨酯40233聚山梨酯60234聚山梨酯80235聚山梨酯80(供注射用)236聚丙烯酸树脂Ⅱ237聚丙烯酸树脂Ⅲ238聚丙烯酸树脂Ⅳ239聚甲丙烯酸铵酯Ⅰ240聚甲丙烯酸铵酯Ⅱ《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(241聚氧乙烯242聚氧乙烯(35)蓖麻油243聚维酮K30244蔗糖245蔗糖八醋酸酯246蔗糖丸芯247蔗糖硬脂酸酯248碱石灰249碳酸丙烯酯250碳酸氢钠251碳酸氢钾252精制玉米油253精氨酸254橄榄油255醋酸256醋酸纤维素257醋酸钠258醋酸羟丙甲纤维素琥珀酸酯259糊精260缬氨酸261薄荷脑263磷酸二氢钾264磷酸钙265磷酸氢二钠266磷酸氢二钾267磷酸氢二钾三水合物268磷酸氢二铵269磷酸淀粉钠270麝香草酚通则和指导原则序号编码目录10100制剂通则20221片剂30102注射剂40103胶囊剂50104颗粒剂60105眼用制剂70106鼻用制剂80107栓剂100109软膏剂乳膏剂110110糊剂120221吸入制剂130112喷雾剂140113气雾剂150114凝胶剂160115散剂170116糖浆剂180117搽剂190118涂剂200119涂膜剂210120酊剂220221贴剂230122贴膏剂240123口服溶液剂口服混悬剂口服乳剂250124植入剂260125膜剂270126耳用制剂280127洗剂290128冲洗剂300129灌肠剂310181合剂320222锭剂330183煎膏剂(膏滋)340184胶剂350185酒剂360186膏药370187露剂380188茶剂390189流浸膏剂与浸膏剂400200其他通则410211药材和饮片取样法420222药材和饮片检定通则430213炮制通则440251药用辅料450261制药用水460291国家药品标准物质通则470300480301一般鉴别试验500401紫外-可见分光光度法510402红外分光光度法7《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(520405荧光分光光度法530406原子吸收分光光度法540407火焰光度法550411电感耦合等离子体原子发射光谱法560412电感耦合等离子体质谱法570421拉曼光谱法580431质谱法590441核磁共振波谱法600451某射线衍射法610500色谱法620501纸色谱法630502薄层色谱法650512高效液相色谱法660513离子色谱法670514分子排阻色谱法680521气相色谱法690531超临界流体色谱法700532临界点色谱法710541电泳法720542毛细管电泳法730600物理常数测定法740601相对密度测定法750611馏程测定法760612熔点测定法770613凝点测定法780621旋光度测定法790622折光率测定法800631pH值测定法810632渗透压摩尔浓度测定法820633黏度测定法830661热分析法840681制药用水电导率测定法850682制药用水中总有机碳测定法860700其他测定法870701电位滴定法与永停滴定法880702非水溶液滴定法890703氧瓶燃烧法900704氮测定法910711乙醇量测定法920712甲氧基、乙氧基与羟丙氧基测定法930713脂肪与脂肪油测定法940721维生素A测定法950722维生素D测定法960731蛋白质含量测定法970800限量检查法980801氯化物检查法990802硫酸盐检查法1000803硫化物检查法1010804硒检查法1020805氟检查法1030806氰化物检查法1040807铁盐检查法1050808铵盐检查法1060821重金属检查法1070822砷盐检查法1080831干燥失重测定法1090832水分测定法1100841炽灼残渣检查法1110842易炭化物检查法1120861残留溶剂测定法1130871甲醇量检查法1140872合成多肽中的醋酸测定法11508732-乙基己酸测定法1160900特性检查法1170901溶液颜色检查法1180902澄清度检查法1190903不溶性微粒检查法1202204可见异物检查法1210921崩解时限检查法1220922融变时限检查法1230923片剂脆碎度检查法1240931溶出度与释放度测定法1250941含量均匀度检查法1260942最低装量检查法1270951吸入制剂微细粒子空气动力学特性测定法1280952黏附力测定法1290981结晶性检查法1300982粒度和粒度分布测定法1310983锥入度测定法1321100生物检查法《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(1331101无菌检查法1341105非无菌产品微生物限度检查:微生物计数法1361107非无菌药品微生物限度标准1371121抑菌效力检查法1381141异常毒性检查法1401143细菌内毒素检查法1411144升压物质检查法1421145降压物质检查法1431146组胺类物质检查法1441147过敏反应检查法1451148溶血与凝聚检查法1461200生物活性测定法1471201抗生素微生物检定法1481202青霉素酶及其活力测定法1491205升压素生物测定法1501206细胞色素C活力测定法1511207玻璃酸酶测定法1521208肝素生物测定法1531209绒促性素生物测定法1541210缩宫素生物测定法1551211胰岛素生物测定法1561212精蛋白锌胰岛素注射液延缓作用测定法1571213硫酸鱼精蛋白生物测定法1581214洋地黄生物测定法1591215葡萄糖酸锑钠毒力检查法1601216卵泡刺激素生物测定法1611217黄体生成素生物测定法1621218降钙素生物测定法1631219生长激素生物测定法1641401放射性药品检定法1651421灭菌法1661431生物检定统计法1672000中药其他方法1682001显微鉴别法1692101膨胀度测定法1702102膏药软化点测定法1712201浸出物测定法1722202鞣质含量测定法1732203桉油精含量测定法1742204挥发油测定法1752301杂质检查法1762302灰分测定法1772303酸败度测定法1782321铅、镉、砷、汞、铜测定法1792322汞和砷元素形态及其价态测定法1802331二氧化硫残留量测定法1812341农药残留量测定法1822351黄曲霉毒素测定法1832400注射剂有关物质检查法1843000生物制品相关检查方法1853100含量测定法1863101固体总量测定法1873102唾液酸测定法(间苯二酚显色法)1883103磷测定法1893104硫酸铵测定法1903105亚硫酸氢钠测定法1913106氢氧化铝(或磷酸铝)测定法1923107氯化钠测定法1933108枸橼酸离子测定法1943109钾离子测定法1953110钠离子测定法1963111辛酸钠测定法1973112乙酰色氨酸测定法1983113苯酚测定法1993114间甲酚测定法2003115硫柳汞测定法2022116对羟基苯甲酸甲酯、对羟基苯甲酸丙酯含量测定法2023117O-乙酰基测定法2033118己二酰肼含量测定法2043119高分子结合物含量测定法2053120人血液制品中糖及糖醇测定法2063121人血白蛋白多聚体测定法2073122人免疫球蛋白类制品IgG单体加二聚体测定法2083123人免疫球蛋白中甘氨酸含量测定法2093124重组人粒细胞刺激因子蛋白质含量测定法9《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(2103125组胺人免疫球蛋白中游离磷酸组胺测定法2113126IgG含量测定法2123127单抗分子大小变异体测定法(CE-SDS)2133200化学残留物测定法2143201乙醇残留量测定法2153202聚乙二醇残留量测定法2163203聚山梨酯80残留量测定法2173204戊二醛残留量测定法2183205磷酸三丁酯残留量测定法2193206碳二亚胺残留量测定法2203207游离甲醛测定法2213208人血白蛋白铝残留量测定法2223209羟胺残留量测定法2233300微生物检查法2243301支原体检查法2253302外源病毒因子检查法2263303鼠源性病毒检查法2273304SV40核酸序列检查法2283305猴体神经毒力试验2293306血液制品生产用人血浆病毒核酸检测技术要求2303400生物测定法2313401免疫印迹法2323402免疫斑点法2333403免疫双扩散法2343404免疫电泳法2353405肽图检查法2363406质粒丢失率检查法2373407外源性DNA残留量测定法2383408抗生素残留量检查法(培养法)2393409激肽释放酶原激活剂测定法2403410抗补体活性测定法2413411牛血清白蛋白残留量测定法2423412大肠杆菌菌体蛋白质残留量测定法2433413假单胞菌菌体蛋白质残留量测定法2443414酵母工程菌菌体蛋白质残留量测定法2453415类A血型物质测定法2463416鼠IgG残留量测定法2473417无细胞百日咳疫苗鉴别试验(酶联免疫法)2483418抗毒素、抗血清制品鉴别试验(酶联免疫法)2493419A群脑膜炎球菌多糖分子大小测定法2503420伤寒Vi多糖分子大小测定法2513421b型流感嗜血杆菌结合疫苗多糖含量测定法2523422人凝血酶活性检查法2533423活化的凝血因子活性检查法2543424肝素含量测定法2553425抗A、抗B血凝素测定法2563426人红细胞抗体测定法2573427人血小板抗体测定法2583500生物活性/效价测定法2593501重组乙型肝炎疫苗(酵母)体外相对效力检查法2603502甲型肝炎灭活疫苗体外相对效力检查法2623504吸附破伤风疫苗效价测定法2633505吸附白喉疫苗效价测定法2643506类毒素絮状单位测定法2653507白喉抗毒素效价测定法2663508破伤风抗毒素效价测定法2673509气性坏疽抗毒素效价测定法2683510肉毒抗毒素效价测定法2693511抗蛇毒血清效价测定法2743516抗人T细胞免疫球蛋白效价测定法(淋巴细胞毒试验)2753517人凝血因子Ⅱ效价测定法2763518人凝血因子Ⅶ效价测定法2773519人凝血因子Ⅸ效价测定法2783520人凝血因子Ⅹ效价测定法2793521人凝血因子Ⅷ效价测定法2823524重组人白介素-2生物学活性测定法2833525重组人粒细胞刺激因子生物学活性测定法《中国药典》2022年版目录(三部):生物制品通则(总论、Ⅰ预防类、Ⅱ治疗类、Ⅲ体内诊断类、Ⅳ体外诊断类、)(四部):药用辅料、通则和指导原则(制剂通则等、检查检测方法等、试剂与标准物质、指导原则等)(2843526重组人粒细胞巨噬细胞刺激因子生物学活性测定法2853527重组牛碱性成纤维细胞生长因子生物学活性测定法2863528重组人表皮生长因子生物学活性测定法2923600特定生物原材料/动物2933601无特定病原体鸡胚质量检测要求2943602实验动物微生物学检测要求2953603实验动物寄生虫学检测要求2963604新生牛血清检测要求2973605细菌生化反应培养基29837002993701生物制品国家标准物质目录3008000试剂与标准物质3018001试药3028002试液3038003试纸3048004缓冲液3058005指示剂与指示液3068006滴定液3078061对照品对照药材对照提取物3088062对照品标准品3099000指导原则3109001原料药物与制剂稳定性试验指导原则3119011药物制剂人体生物利用度和生物等效性试验指导原则3159015药品晶型研究及晶型质量控制指导原则3169101药品质量标准分析方法验证指导原则3179102药品杂质分析指导原则3189103药物引湿性试验指导原则3199104近红外分光光度法指导原则3209105中药生物活性测定指导原则3219106基于基因芯片的药物评价技术与方法指导原则3229107中药材DNA条形码分子鉴定法指导原则3239201药品微生物检验替代方法验证指导原则3249202非无菌产品微生物限度检查指导原则3259203药品微生物实验室质量管理指导原则3269204微生物鉴定指导原则3279205药品洁净实验室微生物监测和控制指导原则3289206无菌检查用隔离系统验证指导原则3299301注射剂安全性检查法应用指导原则3309302中药有害残留物限量制定指导原则3319303色素测定法指导原则3329304中药中铝、铬、铁、钡元素测定指导原则3339305中药中真菌毒素测定指导原则3349501正电子类放射性药品质量控制指导原则3359502锝[99mTc]放射性药品质量控制指导原则3369601药用辅料功能性指标研究指导原则3379621药包材通用要求指导原则3389622药用玻璃材料和容器指导原则3399901国家药品标准物质制备指导原则11。
《中国药典》2015年版(三部)血液制品增修订内容

《中国药典》2015年版(三部)血液制品增修订内容目录:一、各论品种拟增修订项目及内容二、拟增订通则 3428 人免疫球蛋白类制品IgA残留量测定法三、拟增订品种:猪纤维蛋白粘合剂一、各论品种拟增修订项目及内容二、3428 人免疫球蛋白类制品IgA残留量测定法本法用于测定人免疫球蛋白类制品中IgA残留量,包括紫外-可见分光光度法、酶联免疫法和散射比浊法。
首次采用本法检测供试品中IgA残留量时,应根据不同样品基质及IgA残留量的水平选择适宜的测定方法并做相应方法学验证。
紫外-可见分光光度法和酶联免疫法中IgA残留量的效价单位可根据标准品标签说明换算成质量单位。
第一法紫外-可见分光光度法(仲裁法)本法系依据免疫球蛋白A (IgA) 与相应的抗体特异性结合后,在适宜的电解质、温度、pH条件下,产生凝集反应,形成抗原-抗体复合物,用比浊法测定供试品中IgA的残留量。
试剂(1)缓冲液称取三羟甲基氨基甲烷(Tris) 12.42 g 、氯化钠9g、聚乙二醇6000 50g、牛血淸白蛋白(BSA) lg、叠氮化钠(NaN3) l g,加水适量使溶解,用lmol/L盐酸溶液调节pH 值至7.4,用水稀释至1000ml。
如缓冲液中不添加叠氮化钠,应临用新制。
(2)抗人IgA血清取抗人IgA血清(应为全血清经过一定纯化技术分离制得的特异性抗体)适量,加缓冲液稀释至抗体最终效价为1 : 4 (例如抗人IgA血清效价为1:100,量取原液2ml加抗体缓冲液48ml),充分混匀,0.45μm滤膜滤过,作为工作抗体液,4°C保存备用。
IgA标准品溶液的制备按IgA标准品使用说明书加水复溶,精密量取适量,用0.9%氯化钠溶液定量稀释制成每1ml中含IgA25 IU、12.5 IU、6.25 IU、3.125 IU、1.5625IU的溶液。
供试品溶液的制备取供试品原液或将供试品用0.9%氯化钠溶液定量稀释制成适当浓度,作为供试品溶液,使其IgA残留量在标准曲线范围内。
静注人免疫球蛋白的临床应用 PPT

分布:主要存在于血浆中,也见于其他体液、组织和一些分泌液中。
人 人血浆内的免疫球蛋白有五类,即IgG、IgA、IgM、IgD、IgE。其中IgG是 最主要的免疫球蛋白,约占人血浆丙种球蛋白的70%。
制备:用乙型肝炎疫苗免疫健康人后,取其血浆或血清,经低温乙醇法纯化制备
的免疫球蛋白制剂,含有10%的蛋白质,其中90%以上为人血丙种球蛋白,并含有 一定量乙肝表面抗体及白喉抗体。由于丙种球蛋白含有各种抗体,故可在短期内 为机体提供被动免疫,加强其免疫状态,从而达到预防及提高疗效的作用。
分类:按给药途径分为:静注人免疫球蛋白和肌肉注射人免疫球蛋白。
我
我院现用为静注人免疫球蛋白(IVIG)
二、药理作用:
1.抗感染 I IVIG中含有多价抗原特异性IgG抗体。具有抗病毒、抗细菌和抗巨细胞病毒抗原多 种功能,IVIG中还存在抗链球菌致热性外毒素(SPD-A)和抗葡萄球菌肠毒素抗体, 可直接中和毒素使其血浓度下降,从而改善临床症状。
4、肾脏疾病,如lgA肾病、肾病综合征、狼疮性肾炎等。
四、临床应用:
1.细菌感染性疾病 a.新生儿及早产儿败血症 早产儿因胎盘转移输送的母体IgG不足,血清IgG水平较低,故 可考虑用IVIG预防治疗。 方法:新生儿细菌感 500mg/kg.d,每周一次,共4次。 早产儿细菌感染 500-750mg/kg.d.每2周1次,共3次。 b.烧伤脓毒败血症 细菌所致的脓毒败血症是导致烧伤病人死亡的主要原因,免疫 球蛋白的水平与烧伤面积的烧伤后的时间在关,烧伤后48小时 内IgG水平下降,主要与IgG的分解有关,而与合成速度无关。 常用剂量为400mg-750mg/kg.d。
常用剂量:400mg/kg.d,连用5天。亦可用1000-2000mg/kg.d, 用1-2天。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
静注乙型肝炎人免疫球蛋白(pH4)
Jingzhu Yixing Ganyan Ren Mianyiqiudanbai (pH4)
Human hepatitis B Immunoglobulin (pH4) for Intravenous Injection
本品系由含高效价乙型肝炎表面抗体的健康人血浆,经低温乙醇蛋白分离法或经批准的其他分离法分离纯化,并经病毒去除和灭活处理制成。
含适宜稳定剂,不含防腐剂和抗生素。
1.基本要求
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
生产过程中不得加入防腐剂或抗生素。
2 制造
2.1 原料血浆
2.1.1血浆的采集和质量应符合“血液制品生产用人血浆”的规定。
采用经批准的乙型肝炎疫苗和免疫程序进行免疫,或从健康供血浆者筛选抗体效价符合要求的血浆。
原料血浆混合后抗-HBs效价应不低于10IU/ml。
2.1.2每批应由100名以上供血浆者的血浆混合而成。
2.1.3 组分Ⅱ、组分Ⅱ+Ⅲ沉淀或组分Ⅰ+Ⅱ+Ⅲ沉淀应冻存于-30℃以下,并规定其有效期。
2.2 原液
2.2.1 采用低温乙醇蛋白分离法或经批准的其他分离法制备。
所采用的生产工艺应能使制品中的IgG亚类齐全,其值与正常人血清IgG亚类分布相近,其值与正常人血清IgG亚类分布相近;应;能保留IgG的Fc段生物学活性(附录Ⅹ P)。
2.2.2 经纯化、超滤、除菌过滤后即为静注乙型肝炎人免疫球蛋白原液。
2.2.3 原液检定
按3.1项进行。
2.3半成品
2.3.1 配制
制品中可加适宜的稳定剂。
按成品规格以注射用水或静注人免疫球蛋白原液稀释至抗-HBs效价不低于50IU/ml。
2.3.2 半成品检定
按3.2项进行。
2.4 成品
2.4.1 分批
应符合“生物制品分批规程”规定。
2.4.2 分装
应符合“生物制品分装和冻干规程”及附录ⅠA有关规定。
2.4.3 规格
每瓶含抗-HBs效价500IU(10ml)、2000 IU(40ml)、2500IU(50ml)。
2.4.4 包装
应符合“生物制品包装规程”及附录ⅠA有关规定。
2.5 病毒去除和灭活
生产过程中应采用经批准的方法去除和灭活病毒。
如用灭活剂(如有机溶剂、去污剂)灭活病毒,则应规定对人安全的灭活剂残留量限值。
3 检定
3.1 原液检定
3.1.1 蛋白质含量
依法测定(附录VI B)。
3.1.2 纯度
应不低于蛋白质总量的95.0%(附录Ⅳ A)。
3.1.3 pH值
用生理氯化钠溶液将供试品蛋白质含量稀释成10g/L,依法测定(附录Ⅴ A),pH值应为3.8~4.4。
3.1.4残余乙醇含量
可采用康卫扩散皿法(附录Ⅵ D),应不高于0.025%。
3.1.5 抗-HBs效价
采用经验证的酶联免疫或放射免疫方法进行检测,应大于成品规格。
3.1.6 抗补体活性
应不高于50%(附录ⅨK)。
3.1.7热原检查
依法检查(附录ⅫD),注射剂量按家兔体重每1kg注射0.5g蛋白质,应符合规定。
以上检定项目亦可在半成品检定时进行。
3.2 半成品检定
无菌检查
依法检查(附录Ⅻ A),应符合规定。
如半成品立即分装,可在除菌过滤后留样做无菌检查。
3.3 成品检定
3.3.1 鉴别试验
3.3.1.1 免疫双扩散法
依法测定(附录Ⅷ C),仅与抗人血清或血浆产生沉淀线,与抗马、抗牛、抗猪、抗羊血清或血浆不产生沉淀线。
3.3.1.2 免疫电泳法
依法测定(附录Ⅷ D),与正常人血清或血浆比较,主要沉淀线应为IgG。
3.3.2 物理检查
3.3.2.1 外观
应为无色或淡黄色澄明液体,可带轻微乳光,不应出现浑浊。
3.3.2.2可见异物
依法检查(附录Ⅴ B),应符合规定。
3.3.2.3不溶性微粒检查
依法检查(附录ⅤI),应符合规定。
3.3.2.4渗透压摩尔浓度
应不低于240 mOsmol/kg(附录ⅤH)
3.3.2.5装量
依法检查(附录Ⅰ A),应不低于标示量。
3.3.2.6热稳定性试验
将供试品置57℃±0.5℃水浴中保温4小时后,用可见异物检查装置,肉眼观察应无凝胶化或絮状物。
3.3.3 化学检定
3.3.3.1 pH值
用生理氯化钠溶液将供试品蛋白质含量稀释成10g/L,依法测定(附录Ⅴ A),pH值应为3.8~4.4。
3.3.3.2 蛋白质含量
应不高于70 g/L(附录Ⅵ B第一法)。
3.3.3.3 纯度
应不低于蛋白质总量的95.0%(附录Ⅳ A)。
3.3.3.4 糖及糖醇含量
如制品中加麦芽糖,应为90~110 g/L;如加葡萄糖,则应为40~60 g/L(附录Ⅵ P)。
3.3.3.5 分子大小分布
IgG单体与二聚体含量之和应不低于95.0%(附录Ⅵ R)。
3.3.4 抗-HBs效价
采用经验证的酶联免疫或放射免疫方法进行检测,应不低于50IU/ml,根据每1ml抗-HBs效价及标示装量计算每瓶抗-HBs效价,应不低于标示量。
3.3.5 激肽释放酶原激活剂
应不高于35IU/ml(附录Ⅸ F)。
3.3.6 抗补体活性
应不高于50%,(附录Ⅸ K)。
3.3.7 抗A、抗B血凝素
应不高于1∶64(附录Ⅸ J)。
3.3.8 无菌检查
依法检查(附录Ⅻ A),应符合规定。
3.3.9 异常毒性检查
依法检查(附录Ⅻ F),应符合规定。
3.3.10 热原检查
依法检查(附录ⅫD),注射剂量按家兔体重每1kg注射10ml成品,应符合规定。
3.3.11 根据病毒灭活方法,应增加相应的检定项目。
4 保存、运输及有效期
于2~8℃避光保存和运输。
自生产之日起,按批准的有效期执行。
5 使用说明
应符合“生物制品包装规程”规定和批准的。
