columbia大学有机化学06 (3)
美国留学盘点有机化学领域的大牛教授

在整个美国留学申请过程中,一定要了解该领域的大学教授。
作者申请了美国的有机化学专业,所以将自己了解的一些有机化学方向的美国大学教授进行简单介绍。
其实这些资料大家仔细去读各位教授的主页和paper都会了解的很清楚,这里相当于起到一个汇总以及抛砖引玉的作用。
再次声称本文观点为个人观点,各种信息来自于互联网以及文献。
学校的排序参考了US News 2011版本的Organic Chemistry 的排名,不代表本人观点。
所有查阅的教授的研究方向均为有机化学方向,chemical biology 以及biochemistry 不在范围之内。
大体来看,有机化学方向的申请主要集中在全合成以及方法学这两个小方向上面,而很多group 的研究方向都是同时涵盖了这两个方向,所以选择的余地相对较大。
一些常见的缩写列举如下。
JACS = the Journal of American Chemical SocietyACIE = Angewandte Chemie International EditionCNS paper = Cell paper、Nature paper and Science paperAP = Associate Professor or Assistant Professor,这两个词本身有很大区别。
Harvard UniversityHarvard is Harvard。
即便我已然非常满意自己今年的申请结果,每当说这句话的时候,我还是会多少有那么一点点的不甘心。
当然,这句话第一次从别人那里听到是在当时UPenn 的某个宣讲会上。
Prof. Kozlowski (postdoc 跟的是Evans)说到这句话的语气似乎透着无限的羡慕与怨念。
所以,就算当年看着Harvard CCB 的faculty list 里面那为数不多的几个做有机的教授的时候,你还是很难抵挡得住Harvard 这个词本身所带来的太多诱惑。
【有机】哥伦比亚大学Tomisl...
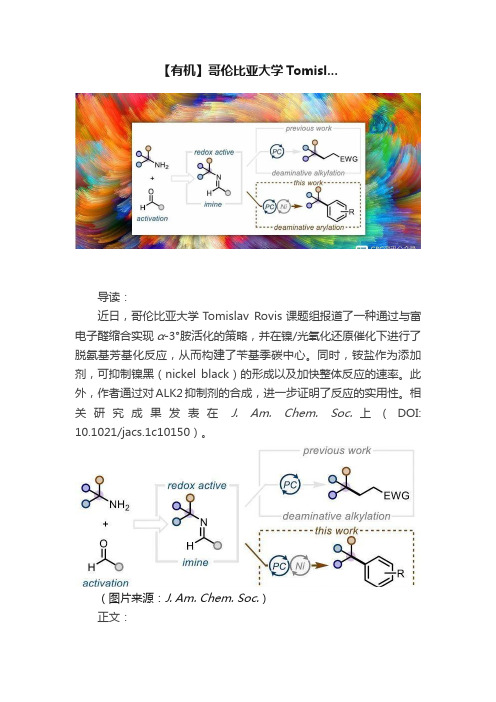
【有机】哥伦比亚大学Tomisl...导读:近日,哥伦比亚大学Tomislav Rovis课题组报道了一种通过与富电子醛缩合实现α-3°胺活化的策略,并在镍/光氧化还原催化下进行了脱氨基芳基化反应,从而构建了苄基季碳中心。
同时,铵盐作为添加剂,可抑制镍黑(nickel black)的形成以及加快整体反应的速率。
此外,作者通过对ALK2抑制剂的合成,进一步证明了反应的实用性。
相关研究成果发表在J. Am. Chem. Soc.上(DOI: 10.1021/jacs.1c10150)。
(图片来源:J. Am. Chem. Soc.)正文:伯胺是有机合成中常见的结构单元,其中伯烷基胺也是一种具有吸引力的烷基化试剂。
因此,许多研究者将伯胺作为偶联底物进行相关的偶联反应。
2017年,Watson课题组报道了一种镍催化非活化伯胺的Suzuki-Miyaura偶联反应,该反应涉及Katritzky盐的形成(Scheme 1A)。
随后,研究人员又报道了类似过渡金属催化和光氧化还原催化的脱氨基反应,但底物仅限于α-1°和α-2°伯胺。
α-3°伯胺由于空间位阻较大,导致其无法与三苯基-吡喃鎓盐进行缩合(Scheme 1B)。
为了解决这一问题,作者通过与富电子醛的活化基团缩合来活化α-3°伯胺的C-N 键,其中通过单电子氧化生成的亲核碳自由基可与缺电子烯烃进行偶联生成Giese产物(Scheme 1C,top)。
在此,Tomislav Rovis课题组报道了一种光氧化还原/镍催化的双重策略,可实现α-3°伯胺与芳基卤化物的偶联反应,从而构建苄基季碳中心(Scheme 1C,bottom)。
(图片来源:J. Am. Chem. Soc.)首先,作者以1与2作为模型底物,对反应条件进行了大量的筛选(Table 1)。
筛选结果表明,以Ir cat A为光催化剂,Ni(TMHD)2为镍催化剂,n Bu4NCl为添加剂,K2HPO4为无机碱,DMSO为溶剂,底物在室温下456 nm LEDs照射下反应,可获得94%收率的产物3。
哥伦比亚教授有机化学Olefination

PPh3 + X R1
Wittig Olefination: Background and Principles
2. Ph3P=CH2, THF, -20 °C
N N N
HO HO N
O NH
Cl H N
O
HO2C
O N H
H N HO
O NH2
OH O
N H
H N
Me Me
Me
Br
Br (86% overall) Br
Br
HO
OH OH
Wittig reaction
Ph
major kinetic product
Ph3P O
H
H
EtO2C
Ph
rotation possible
RDS
Ph EtO2C
EtO2C Ph
thermodynamically most stable;
predominant or only product
Wittig Olefination: Applications in Total Synthesis
+ Ph3P
Me
O
PPh3H O R HR
As the size of the R groups increases, selectivity for Z-alkene increases Nonpolar solvents favor initial addition Polar solvents favor the elimination
大学有机化学_教案

授课对象:化学专业本科生学时安排:4学时教材:《有机化学》教材,高等教育出版社教学目标:1. 掌握醇、酚、醚的分类、结构特点及命名规则。
2. 理解醇、酚、醚的化学性质,包括反应机理和反应条件。
3. 熟悉醇、酚、醚在有机合成中的应用。
教学内容:一、醇1. 醇的分类:脂肪醇、芳香醇、环醇等。
2. 醇的结构特点:羟基的邻位、对位效应,立体效应等。
3. 醇的命名规则:IUPAC命名法、习惯命名法。
4. 醇的化学性质:(1)与金属反应:醇钠、醇钾的制备及性质。
(2)与无机含氧酸反应:成酯反应、氧化反应。
(3)脱水反应:醇的分子内脱水、分子间脱水。
(4)取代反应:醇的亲电取代反应。
二、酚1. 酚的分类:芳香酚、醇酚、酚醛等。
2. 酚的结构特点:酚羟基的邻位、对位效应,立体效应等。
3. 酚的命名规则:IUPAC命名法、习惯命名法。
4. 酚的化学性质:(1)酸性:酚的酸性及酸碱滴定。
(2)氧化反应:酚的氧化反应及产物。
(3)亲电取代反应:酚的亲电取代反应。
三、醚1. 醚的分类:脂肪醚、芳香醚、环醚等。
2. 醚的结构特点:醚键的稳定性,立体效应等。
3. 醚的命名规则:IUPAC命名法、习惯命名法。
4. 醚的化学性质:(1)醚键的断裂:醚的水解、酸催化、碱催化。
(2)醚的氧化:醚的氧化反应及产物。
(3)取代反应:醚的亲电取代反应。
教学方法:1. 讲授法:讲解醇、酚、醚的分类、结构特点、命名规则及化学性质。
2. 案例分析法:通过典型实例分析,使学生掌握醇、酚、醚的化学性质及反应机理。
3. 实验教学法:指导学生进行醇、酚、醚的实验操作,观察现象,加深对理论知识的理解。
教学重点:1. 醇、酚、醚的分类、结构特点及命名规则。
2. 醇、酚、醚的化学性质,包括反应机理和反应条件。
教学难点:1. 醇、酚、醚的化学性质,特别是亲电取代反应的机理。
2. 醚键的断裂及取代反应。
教学过程:一、导入1. 简要介绍醇、酚、醚在有机合成中的重要性。
大学有机化学全部课程

大学有机化学全部课程目录•绪论•烃类化合物•烃的衍生物•含氮化合物•杂环化合物和生物碱•有机合成与反应机理•有机化学与日常生活及环境保护的关系01绪论研究碳氢化合物(烃)的结构、性质、合成和反应机理。
碳氢化合物研究含有特定官能团(如羟基、羰基、羧基等)的有机化合物的性质、合成和转化。
官能团化合物研究生物体内的糖类、脂类、蛋白质、核酸等生命物质的结构和功能。
生命体系中的有机化合物1 2 3从18世纪末到19世纪初,有机化学开始从无机化学中独立出来,主要研究天然有机物的提取、分离和性质。
早期有机化学19世纪中叶,凯库勒等化学家提出碳原子的四价学说和苯的环状结构理论,奠定了有机化学的结构基础。
结构理论的建立20世纪初,合成化学开始兴起,人们通过合成方法制备出大量自然界中不存在的有机化合物,推动了有机化学的飞速发展。
合成化学的发展掌握基本概念和原理理解反应机理多做习题和实验关注前沿动态理解有机化学反应的机理对于预测反应结果和设计新的合成路线至关重要。
学习有机化学需要掌握基本概念如分子结构、化学键、反应机理等,以及基本原理如电子效应、空间效应等。
关注有机化学领域的最新研究成果和动态,了解学科发展趋势和前沿方向。
通过大量的习题练习和实验操作,加深对有机化学知识的理解和应用。
02烃类化合物烷烃的定义和命名介绍烷烃的基本概念和命名规则,包括普通命名法和系统命名法。
烷烃的结构和性质详细阐述烷烃的结构特点,包括碳原子的杂化状态、分子构型和键角等,以及烷烃的物理和化学性质,如熔沸点、密度、溶解性、稳定性等。
烷烃的反应介绍烷烃的主要反应类型,包括自由基取代反应、氧化反应和裂解反应等,以及这些反应的条件、机理和应用。
烯烃的定义和命名01介绍烯烃的基本概念和命名规则,包括普通命名法和系统命名法。
烯烃的结构和性质02详细阐述烯烃的结构特点,包括碳碳双键的杂化状态、分子构型和键角等,以及烯烃的物理和化学性质,如熔沸点、密度、溶解性、稳定性等。
哥伦比亚教授有机化学课件Pericyclic

5
Ene Reactions in Total Synthesis: Ene/Retro-Ene Sequence to Protect Indole
H CO2Me NAc +
N H MeMTAD
C H 2C l2, 0 °C , 1 m in
1 5 0 °C , 1 m in
TBDPSO H
H H
H
O Me
L. Barriault, D. H. Deon, Org. Lett. 2001, 3, 1925. 9
Ene Reactions in Total Synthesis: Tandem Oxy-Cope/Carbonyl Ene Sequence
Me H
OH Me
A Panoply of Pericyclic Processes
Lecture Notes
Key Reviews: Ene Reaction H. M. R. Hoffmann, Angew. Chem. Int. Ed. Engl. 1969, 8, 556. W. Oppolzer, Angew. Chem. Int. Ed. Engl. 1978, 17, 476. J. M. Conia, Synthesis 1975, 1. [2+2]-Cycloadditions Org. React. 1993, 44, 297. W. Dermuth, Synthesis 1989, 152. Cyclopropanation H. E. Simmons, Org. React. 1973, 20, 1. S. Burke, P. A. Grieco, Org. React. 1979, 26, 361.
Pauson-Khand Reaction W. Pauson, Tetrahedron 1978, 41, 5855.
哥伦比亚教授有机化学课件Metathesis

Alkene Metathesis Reactions: What are Effective Initiators for the Process?
1980 Ti
1985
1990
1995
2000
Ph W(CO)5
R
R = Ph or R = OMe (Katz, 1976)
Cp
Me
Ti Al
Cp Cl Me
reactivity profiles from the original catalysts.
M. L. Snapper and co-workers, J. Am. Chem. Soc. 1997, 119, 7157.
Alkene Metathesis Reactions: What are Effective Initiators for the Process?
Aldehydes Ketones Olefins
Esters, Amides
Acids Alcohols, Water
Aldehydes Ketones
Esters, Amides Olefins
Acids Alcohols, Water
Aldehydes Olefins Ketones
Esters, Amides
X n
n
Versions of the olefin metathesis reaction:
RCM = ring-closing metathesis ROM = ring-opening metathesis ADMET = acyclic diene metathesis polymerization ROMP = ring-opening metathesis polymerization
哥伦比亚教授有机化学课件ProtectingGroups

Troc = trichloroethoxycarbonyl
6. -elim ination O O M ild base R 2N O -[C O 2 ] R 2N H 2 +
O R 2N
Fm oc = 9-fluorenylm ethyl carbam ate
Protective G roups: O rthogonal Sets of Protecting G roups
TESO Me O rthogonal Set #1 Me TB SO TB D PSO Me
OBz Me
H PvO
O OAc
O rthogonal Set #2
In practice this concept is incredibly difficult to reduce to practice, but it is a useful fram ew ork and organizing principle to think about protecting group regim es for a com plex m olecule synthesis.
16,000
100,000
Protective G roups: O rthogonal Sets of Protecting G roups
1. Cleavage by basic solvolysis
O RO Me
O OH ROH RO k rel 1 Me RO
O Cl RO
O Cl Cl RO
Protective G roups: Tem porary Protection
Li O O O M eO Ph Li N Me M eO Ph N O O O Li Me Li aqueous w ork-up HO O O M eO
大学《有机化学》课后习题答案

2. (1) (2) (5)4.80*45%/12=3第一章易溶于水;(3) (4) (6) 难溶于水。
80*7.5%/1=6 80*47.5%/19=2 C 3H s F2第二章有机化合物的结构本质及构性关系1. (1) sp 3 (2) sp ⑶sp 2 ,、,一、(4) sp (5)sp3 (6)sp 2第四章开链1.(1) 2-甲基-4,5-二乙基庚烷(4)( 顺)-3-甲基-3-己烯or Z-3-2.(2)3-甲基戊烷甲基-3-己烯煌(3) 2,4- 二甲基-3-乙基戊烷(12) 3- 甲基-1-庚烯-5-快11. CH3CH3CH2CHCH(CH2)4CH3 (2) (CH3)2CHCH2CH2CH3 C2H5CH3 CH3 (CH3)2CHC CH(CH3)2C2H5(CH 3)2CHC —CH(CH 2)3CH3C2H5⑺(9 )7./H、CH3(4)(6)(8)CH3CH2CH— C(CH2)3CH3H3cA /H/C-C\CH2CH2CH3(C H3)2CH C= C C= CCH(CH3)2H5c入/(10)H3C/C=C、C2H5CH3Br(1) CH3CHCH2CH2CH3 (2) (CH3)2CCH2CH3Br(3) (CH3)2CCH(CH3)2BrCH3(4)CH3CH2CC2H5Br Br12.(1) (CH3)2CCH2CH3 (2) CH3cH2cH2cH3(3) CH3cHCH2cH3C l OH(4) CH3COOH + H3c、C -OH3C'(5) CH3CH2CHCH3OSO3HCH3CH2CHCH3OH(6) CH3CH2CH2CBr2CH3 (7)CH3CCH2CH3Br(8)(CH 3)2CCH —CH 2 + (CH 3)2C —CHCH 2BrCH —CH 2(9) (CH 2C —CHCH 2) n + (CH 2—C) nClKMnO 4/H(10) (1) CH-CH=CHCHCOOH(2) CH-OCH+HBr( 2mol> CHQBr z CH HBr(1mol)Br 2(3) CH-O CHCH-C=CHCHCBr z CHBrBr第四章环煌2.14. (5) > (3)>(2) CH=CHCHCH >(CH3)3C +>(4) 即: 16. (1)1-戊烯 1-戊快 (2)1-丁快 2-丁快1,3-丁二烯 1-己快17.21>CHCH 2CHCH>CH€HCHC +H2>Br 2/CCl 4室温,避光.,澳褪色■,灰白色JAg(NH 3)2+卜 -----------------► X(2)CH —CHBr 2/CCl 4H 2O (CH 3)2CHCrtAg(NH 3)2+XBr 2/CCl 4,澳褪色室温,避光’ x澳褪色 澳褪色H 2so 4,HgSOAg(NH 3)2+ XA [CH 2—CHOH]4>CH 3CHOCHOCl(10)I6-3HHCH.OH CH.OH Cl ---- Br Br ——Cl—H H —L OCH 5 CH 5CII 3 CH? S- R-S ・R-2. (1) X (2) X (3) X (4) V (5) V (6) VC(CH 3)34. ⑴ Br(6) (CH83C COOHCOOH⑷H 3c CH 3 O 2N(2)Cl \'>Cl + 履 / Cl、ClBr(3) (CH 3)2C CH(CH 3)2Br⑸+ BrC 2H 5C 2 H 5 (7) CH 3COCH 3(8) ImolCl 2 / h , 苯/无水 A1C13第六章旋光异构6、[ ]20 18.8D c l 5.678 20 1(IJCiIhCHBrCI l 2Br C2H5c =CII C2H5CCH3(2)C1CH=CHCH 2OCH3 (3)C 6H 5CH=CHCH 2CH 3 (4)NCCH 2(CH2)I CH 2CNC (CH 3)3(5)C 6H 5CIb-^3^-C(CII 3)3 + C 6H 5C1I 2-<Z)>(6)< >(7) (CH3hCHOCnHs + CH<H=CH 2 (8) C 6H 5CH 2ONO2 + AgBr第八章醇、酚、醛1. (1) 3-甲基-3-戊烯-1-醇(2) 2- 甲基苯酚 (3) 2,5- 庚二醇(4) 4- 苯基-2-戊醇(5) 2-澳-1-丙醇(6)1- 苯基乙醇⑺2-硝基-1-蔡酚 (8) 3-甲氧基苯甲(9)1,2- 二乙氧基乙烷(乙二醇二乙醛)3、⑴2、4、66.27.Cl⑵:第七章卤代煌OH 浓硫酸,△OHH3+O,A浓硫酸,△OH10、B第九章醛、酮、醍、命名下列化合物。
大学有机化学知识点

大学有机化学知识点引言有机化学是一门研究有机化合物的结构、性质、合成和反应机理的学科。
在大学化学专业中,有机化学是一个重要的学科领域,涵盖了许多基本概念和知识点。
本文将介绍一些大学有机化学的基本知识点,帮助读者更好地理解和掌握这一学科。
1. 有机化合物的命名有机化合物的命名是有机化学中的基础内容,它是对化合物命名规则和体系的应用。
有机化合物的命名通常遵循一定的规则,例如,按照官能团、官能团的位置、取代基的数量和位置等进行命名。
•按照官能团:有机化合物的命名通常以官能团为基础进行命名,如醇、醛、酮等。
•官能团的位置:当一个官能团出现在分子中的不同位置时,需要使用编号来标识其位置。
•取代基的数量和位置:当分子中存在多个相同的取代基时,需要使用多位数和位置编号来表示。
有机化合物的命名需要熟悉命名规则和命名反应的原理,掌握它们可以帮助我们正确地命名和理解有机化合物的结构。
2. 反应类型和机理有机化学研究的重要内容是有机化合物的反应类型和机理。
掌握不同反应类型和机理有助于理解有机化合物的性质和行为,以及预测反应的产物。
以下是一些常见的有机化学反应类型和机理:•加成反应:两个或多个分子中的原子、离子或官能团结合形成一个新的化学键。
•消除反应:一个分子中的原子、离子或官能团与另一个分子中的原子、离子或官能团之间的键断裂,生成双键或三键。
•双键的加成:在两个碳原子之间形成一个新的σ键(饱和键)。
•亲电取代:一个原子或官能团离开,另一个原子或官能团接替其位置,并改变分子的结构。
•游离基的取代:一个游离基(通常是卤素原子)被另一个取代基取代。
通过学习这些反应类型和机理,我们可以理解有机化合物之间的转化过程和反应规律,为有机合成和有机化学应用提供基础。
3. 水溶液中的酸碱和pH值酸碱性质是有机化合物的重要特征之一。
在水溶液中,酸和碱的反应会产生一个平衡的离子产物,这一平衡通常由pH值表示。
pH值是水溶液中氢离子(H+)浓度的负对数,它是一个指示溶液酸碱性的常用指标。
哈佛大学有机化学卷3

C. Nucleophilic ring closures sub-classified according to hybridization state of electrophilic component: (tetrahedral = tet; trigonal = trig; digonal = dig) D. Nucleophilic ring closures further subclassified according to size of the fomed ring. For example:
predominant inversion
predominant retention
Stereochemistry frequently determined by electrophile structure
See A. Basu, Angew. Chem. Int. Ed. 2002, 41, 717-738 (PDF)
SO3CH3
(CH3)3N
+
SO3
–
X
What is the absolute requirement for the Nu–C–X bond angle?? 180° +/– ??
Me N Me
H
R
H
O S O O
exclusively intermolecular
C
H
Eschenmoser: Tether Nu and X
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
The more stable the carbocation, the faster it is formed, and the faster the reaction rate.
Principle of Microscopic Reversibility H3C C H3C CH2 + H2O CH3 CH3 C OH CH3
hydration of alkenes
regioselectivity opposite to Markovnikov's rule no rearrangement stereospecific syn addition
Example
1. B2H6, diglyme 2. H2O2, HO–
OH
syn-Addition H and OH become attached to same face of double bond
H
CH3 H 1. B2H6 2. H2O2, NaOH
CH3 HO
H
only product is trans-2-methylcyclopentanol (86%) yield
Add hydrogen peroxide
OH replaces B on same side
trans-2-Methylcyclopentanol
6.11 Hydroboration-Oxidation of Alkenes
Synthesis
Suppose you wanted to prepare 1-decanol from 1-decene?
OH
Synthesis
Suppose you wanted to prepare 1-decanol from 1-decene?
H+
In an equilibrium process, the same intermediates and transition states are encountered in the forward direction and the reverse, but in the opposite order.
CH3
CH3
H
+
H :O: H
C
: +O H
CH3
fast CH3
CH3 C CH3 .. O: H + H H
+ O:
H
Relative Rates Acid-catalyzed hydration ethylene propene 2-methylpropene CH2=CH2 CH3CH=CH2 (CH3)2C=CH2 1.0 1.6 x 106 2.5 x 1011
1. hydroboration 2. oxidation
OH
Hydroboration Step
C
C
+
H—BH2
H
C
C
BH2
Hydroboration can be viewed as the addition of borane (BH3) to the double bond. But BH3 is not the reagent actually used.
H3C
H3C
Mechanism
Step (2) Capture of carbocation by water H3C H + C CH3 + :O:
H3C
fast CH3
CH3 C CH3 H + O: H
H
Mechanism
Step (3) Deprotonation of oxonium ion
Needed: a method for hydration of alkenes with a regioselectivity opposite to Markovnikov's rule.
OH
Synthesis
Two-step reaction sequence called hydroborationoxidation converts alkenes to alcohols with a regiochemistry opposite to Markovnikov's rule.
Hydroboration Step
C
C
+
H—BH2
H
C
C
BH2
Hydroboration reagents: H Diborane (B2H6) normally used in an ether- like solvent called "diglyme"
H2B
H
BH2
Hydroboration Step
6.10 Acid-Catalyzed Hydration of Alkenes
Acid-Catalyzed Hydration of Alkenes
C
C
+
H—OH
H
C
C
OH
reaction is acid catalyzed; typical hydration medium is 50% H2SO4-50% H2O
involves a carbocation intermediate
is the reverse of acid-catalyzed dehydration of alcohols to alkenes
H3C C CH2 + H2O CH3
H+ CH3
C
OH
CH3
H3C
Mechanism
Step (1) Protonation of double bond H3C C CH2 + H H + O: H slow H3C H + C CH3 + :O: H
C
C
+
H—BH2
H
C
C
BH2
Hydroboration reagents: Borane-tetrahydrofuran complex (H3B-THF)
+O
– BH3
••
Oxidation Step
H2O2, HO–
H C C
BH2
H
C
C
OH
Organoborane formed in the hydroboration step is oxidized with hydrogen peroxide.
6.13 Mechanism of Hydroboration-Oxidation
1-Methylcyclopentene + BH3
syn addition of H and B to double bond B adds to less substituted carbon
Organoborane intermediate
Example
1. B2H6, diglyme 2. H2O2, HO–
OH
(93%)
Example
H3C
C H3C C
CH3
H 1. H3B-THF 2. H2O2, HO– CH3 C
OH
C CH3
H
CH3 H (98%)
Features of Hydroboration-Oxidation
Follows Markovnikov's Rule
H3C C C
H 50% H2SO4 CH3
50% H2O CH3
CH3 C OH (90%)
CH2CH3
H3C
Follows Markovnikov's Rule
CH2
50% H2SO4
50% H2O
CH3
OH (80%)
Mechanism
(82%)
6.12 Stereochemistry of Hydroboration-Oxidation
Features of Hydroboration-Oxidation
hydration of alkenes
regioselectivity opposite to Markovnikov's rule no rearrangement stereospecific syn addition
