肿瘤预后相关免疫抑制分子概述
肿瘤分子病理学

肿瘤分子病理学肿瘤分子病理学:诊断和治疗的新前沿肿瘤是一种以异常细胞增生为主要特征的疾病,由于其生物学特性多样性,导致了诊断和治疗的复杂性。
近年来,随着分子生物学的迅猛发展,越来越多的分子手段得以应用于肿瘤的诊断和治疗中,这些方法的应用极大促进了肿瘤分子病理学的研究和发展,为临床治疗提供了新思路。
一、肿瘤分子病理学概述肿瘤分子病理学指的是以分子生物学技术为核心,研究肿瘤发生、发展以及预后分析的一门学科。
其研究主要集中于癌症早期诊断、分子标记的筛查、药物治疗的靶点识别等领域。
二、肿瘤分子病理学在肿瘤诊断中的应用1. 液态生物标本检测液态生物标本包括血液、尿液、脑脊液等,其检测其实质是检测其中循环肿瘤细胞(CTC)、细胞自由DNA(cfDNA)、外泌体、miRNA等分子,这些都是肿瘤的生物标记物。
这种方法无创,样本容易采集,能及早发现和监测很多癌症。
2. 组织学诊断新一代分子诊断技术如基因芯片、原位杂交、RNA干扰技术等,已经成为组织细胞学检测的必要手段。
通过对肿瘤组织中某些靶点或者蛋白质的检测,可以明确病理类型、测定临床分期、评估预后、筛查靶向药物的应用对象等。
三、肿瘤分子病理学在肿瘤治疗中的应用1. 靶向治疗靶向治疗是一种针对肿瘤分子在转录或翻译水平上的特异性干扰,从而以更低的毒性达到治疗效果的策略。
比如针对HER2的单抗治疗,EGFR-TKI,阿法替尼抑制B型慢病毒和TEL-JAK2等。
2. 免疫治疗提高肿瘤细胞的免疫识别、增强免疫攻击、抑制免疫抑制是当前免疫治疗的主要研究方向。
阻断PD-1和PD-L1抗体联合疗法、T细胞刺激剂类药物VARLILUMAB,以及针对KRAS突变肿瘤、靶向IDO1和ARG1进行的免疫治疗,这些在临床治疗中都已经取得显著的进展。
四、肿瘤分子病理学的发展与展望在分子生物学和生物信息学发展的背景下,肿瘤分子病理学的应用前景非常广阔。
正如目前研究肿瘤基因组学重点还需加强实现肿瘤的“精准治疗”,由于肿瘤分子学的重要性逐渐被认识,以及大量的分子检测技术已经应用到肿瘤分子学中,因此使得肿瘤分子学技术得以进一步发展和普及。
肿瘤免疫治疗中的免疫检查点分子研究

肿瘤免疫治疗中的免疫检查点分子研究引言:随着肿瘤免疫治疗的迅速发展,免疫检查点分子作为重要的调控剂,逐渐成为癌症治疗的新靶点。
本文将介绍肿瘤免疫治疗中的免疫检查点分子相关的基础知识、最新发展以及其在临床应用中的前景。
一、免疫检查点分子概述1.1 免疫检查点分子的定义和作用机制在正常情况下,人体免疫系统能够辨识并清除异常细胞,但肿瘤细胞往往通过抑制或干扰免疫反应来逃避被杀伤。
而免疫检查点分子则是一类参与调节免疫活性的蛋白质,能够通过其与配体之间结合而负向调节T细胞活性,从而抑制对肿瘤细胞的有效攻击。
1.2 典型免疫检查点分子目前被广泛关注和应用的免疫检查点分子主要有CTLA-4(抗细胞毒T淋巴细胞相关抗原4)、PD-1 (程序性死亡受体1)以及其配体PD-L1(程序性死亡配体1)。
CTLA-4主要在活化初期的T细胞表面表达,通过与CD80/86 结合而抑制自身的杀伤活性。
PD-1则广泛表达于多种免疫细胞表面,与PD-L1结合后发挥免疫调节作用。
二、免疫检查点分子与肿瘤相关的研究进展2.1 免疫检查点分子与肿瘤逃避机制肿瘤细胞通过高表达PD-L1等免疫检查点分子,通过与PD-1连接来使活化状态的T细胞功能受损,进而导致肿瘤逃避免疫监视。
此外,还有一些突变基因如JAK2和BRAF增强了肿瘤细胞对免疫抑制通路的依赖性。
2.2 肿瘤免疫治疗中的免疫检查点抑制剂由于免疫检查点分子在肿瘤逃避机制中的重要作用,科学家们设计出了一类叫做免疫检查点抑制剂的药物,能够通过阻断PD-1/PD-L1等配对结合来解除T细胞活性的抑制,并促进有效的抗肿瘤免疫反应。
这些抑制剂经过多个临床试验后,显示出可能成为癌症治疗领域的重大突破。
三、肿瘤免疫治疗中免疫检查点检测与预测3.1 免疫检查点分子表达与预后关联性一些近期的临床观察性和前瞻性实验室结果发现,患者肿瘤组织中免疫检查点分子如PD-L1高表达可以作为预后不良的标志,并提示针对该检查点进行治疗可能会有积极效果。
肿瘤的分子生物学研究

肿瘤的分子生物学研究肿瘤的分子生物学研究已经成为现代医学领域的重要一部分。
通过分析肿瘤细胞的分子水平变化,可以帮助我们了解肿瘤的发生机制、诊断与治疗的靶点以及预后的评估等方面的问题。
本文将从肿瘤的基因突变、信号通路异常和肿瘤免疫学三个方面阐述肿瘤的分子生物学研究。
首先,肿瘤的基因突变是肿瘤分子生物学研究的重要内容之一、它通常包括肿瘤抑制基因(Tumor Suppressor Gene)的缺失、缺陷或功能丧失以及肿瘤促进基因(Oncogene)的激活等变化。
这些基因突变会导致细胞生长和分化的异常,从而促进肿瘤的发生和发展。
例如,TP53(又称为p53)是一个常见的肿瘤抑制基因,它的突变被认为是许多肿瘤的主要原因之一、另外,EGFR(表皮生长因子受体)是一个常见的肿瘤促进基因,它的过度激活与多种癌症的发生相关。
通过深入研究这些基因突变,可以更好地理解肿瘤的发生机制,并为肿瘤的治疗提供潜在的靶点。
其次,肿瘤的分子生物学研究还包括肿瘤细胞信号通路异常的研究。
肿瘤细胞的生长和分化受到多种信号通路的调控,而这些信号通路往往在肿瘤中发生异常。
例如,PI3K/Akt/mTOR信号通路在多种肿瘤中表现出过度激活的状态,这会导致细胞周期的异常和抗凋亡能力的增强。
此外,Wnt/β-catenin信号通路在一些肿瘤中也发挥重要作用。
通过研究这些信号通路的异常,可以探索肿瘤的发生机制,寻找新的治疗靶点。
例如,一些抗癌药物就是通过干扰肿瘤细胞信号通路的功能来抑制肿瘤的生长。
最后,肿瘤的分子生物学研究还包括肿瘤免疫学的研究。
肿瘤免疫学研究的核心是探索免疫系统对抗肿瘤细胞的活性和调节机制。
近年来,免疫治疗成为了肿瘤治疗的重要手段之一、例如,PD-L1抗体和CAR-T细胞疗法等都是肿瘤免疫治疗的重要代表。
通过分子生物学的研究,可以深入了解肿瘤免疫逃避机制、肿瘤微环境的免疫抑制作用以及免疫治疗的机制等问题。
综上所述,肿瘤的分子生物学研究是深入了解肿瘤发生机制和寻找新的治疗靶点的重要手段。
肿瘤免疫治疗关键因子的分子特性及作用机制

肿瘤免疫治疗关键因子的分子特性及作用机制肿瘤免疫治疗是目前肿瘤治疗领域中备受瞩目的一种新型治疗方式。
相较于传统的肿瘤治疗手段,如化疗、放疗等,免疫治疗能够更准确地攻击癌细胞,同时减少对正常细胞的伤害,有效提高疗效和生存质量。
本文将探讨肿瘤免疫治疗关键因子的分子特性及其作用机制。
一、PD-1/PD-L1途径PD-1(programmed death-1,程序性死亡-1)是一种T细胞表面上的抑制性共刺激分子,已经被证明与多种肿瘤的发生和发展有关。
PD-1能够结合PD-L1(programmed death ligand-1,程序性死亡配体-1)等配体,抑制T细胞的活性和增殖,从而影响机体的免疫功能。
肿瘤细胞可以通过表达PD-L1来使T细胞失活、减少肿瘤免疫反应,从而逃避免疫攻击。
目前,PD-1/PD-L1抑制剂已经在临床上得到广泛应用。
它们通过抑制PD-1与PD-L1的结合,激活抗肿瘤免疫反应,改善患者的治疗效果和生存率。
二、免疫检查位点的作用除了PD-1/PD-L1途径之外,免疫检查位点(immune checkpoint)也是肿瘤免疫治疗中不可忽视的重要因子。
在正常情况下,免疫检查位点通过控制自身正常的免疫反应维持机体内环境稳定。
但是,在肿瘤的存在下,肿瘤细胞可以通过表达特定的免疫检查位点来干扰T细胞的活性,从而逃避免疫攻击。
目前,已经有许多免疫检查位点可供选择。
除了PD-1/PD-L1途径之外,还包括CTLA-4(cytotoxic T-Lymphocyte-Associated protein 4),TIM-3(T cell immunoglobulin and mucin domain-3)、LAG-3(lymphocyte-activation gene 3)等。
其中,抗CTLA-4单抗已经在黑色素瘤、肺癌等多种肿瘤中得到了广泛应用。
三、肿瘤微环境的作用肿瘤微环境指的是肿瘤周围的细胞、基质、因子等环境因素。
临床常用免疫组化标记物及意义

临床常用免疫组化标记物及意义免疫组化(immunohistochemistry,IHC)是一种广泛应用于临床病理学领域的技术,用于检测组织样本中特定蛋白质的表达和定位信息。
这种技术的基本原理是使用特异性的抗体与目标蛋白质结合,然后通过化学反应或荧光染色方法来显示出蛋白质的表达情况。
在临床实践中,免疫组化常用于诊断肿瘤包括癌细胞的分类、分级以及分子靶向治疗的预测。
下面将介绍一些常用的免疫组化标记物及其意义。
1. 细胞角蛋白(Cytokeratin,CK)2.细胞膜蛋白(CD)细胞膜蛋白是细胞膜上的免疫组化标记物,常用于诊断和分类各种肿瘤。
例如,CD20和CD3是血液系统恶性肿瘤(如淋巴瘤)的诊断标记物;CD34用于判断肿瘤的血管生成和预后。
3. 平滑肌肌动蛋白(Smooth Muscle Actin,SMA)平滑肌肌动蛋白是平滑肌组织中的一个标志性蛋白,常用于诊断和分类平滑肌源性肿瘤,如平滑肌肉瘤和恶性纤维组织细胞瘤。
4. 雌激素受体和孕激素受体(Estrogen Receptor,ER和Progestrone Receptor,PR)雌激素受体和孕激素受体的阳性表达在乳腺癌诊断和治疗中具有重要的价值。
ER和PR的表达程度可以预测乳腺癌对内分泌治疗的敏感性,指导治疗方案的选择。
5. 肿瘤抑制基因(Tumor Suppressor Gene,TSG)蛋白常用的TSG蛋白包括p53、PTEN、BRCA1等。
这些蛋白的突变或缺失与肿瘤的发生和进展密切相关。
免疫组化检测这些TSG蛋白的表达情况可以帮助评估肿瘤的分子异常,对于预测预后和指导治疗具有重要意义。
6.基因突变相关蛋白近年来,免疫组化也逐渐应用于检测肿瘤常见的基因突变或扩增,其中包括EGFR、HER-2、ALK、BRAF等。
这些突变和扩增与肿瘤的治疗反应和预后关系密切。
免疫组化检测这些基因突变相关蛋白的表达情况可以为肿瘤靶向治疗的选择和预后评估提供重要信息。
foxp3免疫组化指标__概述说明以及解释

foxp3免疫组化指标概述说明以及解释1. 引言1.1 概述引言部分将对整篇文章的主题进行概述,介绍关键的背景信息和目的。
Foxp3免疫组化指标是一项用于评估免疫调节功能的重要指标。
在生物体中,免疫系统通过一系列复杂的调节机制来保持免疫平衡并抵御外界病原体。
其中,Foxp3作为调节性T细胞(Treg)特异性转录因子,在免疫调节过程中发挥着重要作用。
因此,准确、可靠地检测和定量Foxp3蛋白的表达水平对于深入了解免疫调节机制以及相关疾病的发生和发展具有重要意义。
本文旨在系统地介绍Foxp3免疫组化指标的定义、作用、检测方法和临床应用。
同时,还将探讨该指标在免疫调节中的关键作用机制以及其异常表达与相关疾病之间的关联性。
1.2 研究背景在过去几十年里,人们对于免疫系统及其功能具有了更深入、更全面的认识。
然而,在理解免疫调节的分子机制方面仍存在许多未解之谜。
特别是对于调节性T 细胞,其重要性在免疫平衡中的作用日益受到重视。
Foxp3基因最早于2001年被发现,并被证明在调节型T细胞(Treg)中高度表达。
随着对Foxp3功能的进一步研究,人们逐渐认识到该转录因子在调节免疫反应、维持自身耐受以及预防异常免疫应答中的重要性。
1.3 目的本文的目标是系统地介绍Foxp3免疫组化指标和相关技术方法,并探讨其在临床应用中的潜力。
我们将首先介绍Foxp3指标的定义和作用,包括该指标在评估免疫调节状态中的重要性。
接着,我们将详细描述Foxp3免疫组化染色技术的原理与流程,并阐述数据分析与解读方法。
此外,本文还会解析Foxp3在免疫调节中的作用机制,包括它如何影响调节性T细胞活性和功能。
最后,在结论部分我们将总结已有的研究成果,展望Foxp3免疫组化指标研究的未来发展方向,以及该指标在临床诊断和治疗中的潜在价值。
通过本文的阅读,读者将能够全面了解Foxp3免疫组化指标的重要性、技术原理以及其在免疫调节领域中的作用机制。
肺癌的预后指标解析

肺癌的预后指标解析肺癌是一种严重的恶性肿瘤,其预后指标对患者的治疗和生存率有重要影响。
了解肺癌的预后指标对于患者和医生来说都是至关重要的。
本文章将对肺癌的预后指标进行详细解析,以帮助读者更好地了解和面对这一疾病。
一、肺癌的预后指标概述肺癌预后指标是指用于评估患者疾病进展、复发风险和生存率的指标。
这些指标可以帮助医生制定个性化治疗方案,以提高患者的治疗效果和生存质量。
以下是一些常见的肺癌预后指标:1. TNM分期:TNM分期是评估肺癌预后的重要指标,其中T表示肿瘤大小和侵袭程度,N表示淋巴结转移情况,M表示是否存在远处转移。
TNM分期越低,预后越好。
2. 组织学类型:肺癌可以分为多种不同的组织学类型,如鳞状细胞癌、腺癌和小细胞肺癌等。
不同类型的肺癌对治疗反应和预后有不同的影响。
3. 基因突变:某些基因突变与肺癌的预后密切相关。
例如,EGFR、ALK和ROS1等基因的突变可影响患者对特定靶向治疗的反应。
4. 血液标志物:肺癌患者的血液中可能存在一些特定的标志物,如癌胚抗原(CEA)和神经元特异性烯醇化酶(ENOA)等。
这些标志物的水平可以用于评估患者的预后。
二、影响肺癌预后的因素除了上述常见的预后指标外,还有一些其他因素也会对肺癌的预后产生影响。
以下是一些常见的影响肺癌预后的因素:1. 年龄:年龄是影响肺癌预后的重要因素。
通常来说,年轻患者预后较好,因为他们一般身体较强,免疫力较高。
2. 性别:研究发现,女性患者在某些情况下具有较好的预后。
这可能与雌激素对肿瘤生长抑制的作用有关。
3. 健康状况:肺癌患者的整体健康状况对预后有很大影响。
患者如果有其他慢性疾病或合并感染等情况,预后可能较差。
4. 扩散程度:肺癌的扩散程度越广泛,预后越差。
当肿瘤侵犯到周围组织或远处器官时,治疗难度增加,预后较差。
三、肺癌的预后评估方法为了更准确地评估肺癌的预后,医生可能会采用多种方法和工具。
以下是一些常见的肺癌预后评估方法:1. 生存率统计分析:通过统计大量肺癌患者的生存情况,可以得出不同预后因素对生存率的影响程度。
肿瘤中可溶性免疫检查点sPD-1的相关研究进展
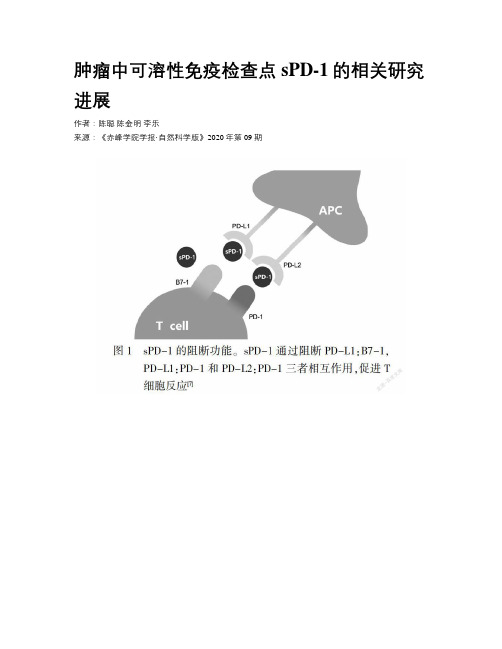
肿瘤中可溶性免疫检查点sPD-1的相关研究进展作者:陈聪陈金明李乐来源:《赤峰学院学报·自然科学版》2020年第09期摘要:程序性死亡蛋白1(PD-1)是免疫系统中的膜结合型免疫检查点,可双重抑制T 细胞的活化,在治疗感染、癌症和自身免疫性疾病中发挥了关键作用。
可溶性PD-1(sPD-1)是以可溶性形式存在的检查点,作为内源性分子,不仅不会引起人体发生免疫排斥反应,弥补单克隆抗体的不足,并且存在于外周血,具有易于获得的特点。
另外sPD-1能够竞争性阻断PD-1/PD-L1通路、促进树突状细胞(DC)成熟、增强T细胞的功能、具有肿瘤生物标志物及预测预后的潜能,还与癌性疼痛有关。
因此,越来越需要研究sPD-1的功能及开发相关治疗方法。
本文将从可溶性免疫检查点sPD-1的产生机制和功能及其在生物标志物、治疗方法等方面的相关研究进展做以简要综述。
关键词:可溶性免疫检查点;sPD-1;免疫治疗;肿瘤中图分类号:R730.3 文献标识码:A 文章编号:1673-260X(2020)09-0066-05程序性死亡蛋白1(programmed death-1,PD-1)可通过双重抑制T细胞活化,在免疫反应调节中发挥着重要的作用,是重要的免疫检查点。
近年来,相关抗PD-1等单克隆抗体发展迅速,但由于制备成本过高及存在大部分患者发生了治疗后未经历完全反应或根本无反应的治疗效果等原因,使得抗PD-1抗体发展受到了限制。
可溶性程序性死亡蛋白1(soluble programmed death-1, sPD-1)是一种可溶性免疫检查点,可竞争性阻断PD-1与配体PD-L1(programmed death ligand-1)形成的PD-1/PD-L1通路进而能够提高抗肿瘤免疫力。
sPD-1是以可溶性形式存在的检查点,作为内源性分子,不仅不会引起人体发生免疫排斥反应,弥补单克隆抗体的不足,并且存在于外周血,具有易于获得的特点,已成为新的研究热点,并被认为是可用于治疗肿瘤的一种新的生物标志物及有效的潜在免疫治疗靶点。
肿瘤免疫治疗中的免疫调控机制

肿瘤免疫治疗中的免疫调控机制隐藏在人体内部的免疫系统,是我们身体抵御病毒、细菌入侵的重要屏障。
然而,肿瘤的发生与发展往往能够逃避免疫系统的监测和攻击,导致治疗困难和远期预后不良。
为了解决这个难题,肿瘤免疫治疗成为近年来备受瞩目的领域。
而在肿瘤免疫治疗中,了解免疫系统的调控机制变得至关重要。
免疫系统由一系列细胞和分子组成,相互协作以保护机体。
其中,T细胞是调控抗肿瘤免疫应答的关键细胞。
免疫治疗中最常用的策略之一,就是通过增强T细胞的抗肿瘤功能来抑制恶性肿瘤的生长。
这一策略的关键在于正确认识和调控免疫系统中的免疫抑制和免疫激活机制。
免疫抑制机制在肿瘤发展中发挥重要作用。
肿瘤细胞可利用多种途径抑制T细胞的作用,以逃避免疫系统的攻击。
例如,肿瘤细胞可释放出免疫抑制分子,如PD-L1,与T细胞上的PD-1结合,抑制T细胞的活化和增殖。
此外,肿瘤微环境中存在大量的免疫抑制性细胞,如Treg细胞和MDSC细胞,它们能够通过抑制其他免疫细胞的活化,抑制抗肿瘤免疫应答。
除此之外,肿瘤还可以通过抑制免疫细胞的迁移和侵入,减弱T细胞对肿瘤的识别和攻击能力。
为了解决免疫抑制的问题,研究人员提出了多种免疫治疗策略。
一种策略是通过抑制肿瘤与T细胞PD-1/PD-L1通路的结合,来恢复T细胞的活化。
这种方法已经在多种肿瘤中显示出了显著的疗效,如恶性黑色素瘤和非小细胞肺癌。
另一种策略是通过抑制免疫抑制性细胞的功能,来增强T细胞的抗肿瘤能力。
例如,通过靶向抑制Treg细胞和MDSC细胞或者调节它们的功能,可以显著改善免疫治疗的效果。
除了免疫抑制机制外,免疫激活机制也是理解肿瘤免疫治疗的重要内容。
免疫活化机制是指通过激活免疫细胞以增加对肿瘤的攻击能力。
肿瘤细胞中经常存在肿瘤相关抗原(tumor-associated antigens,TAA),它们能够被免疫系统识别并激活T细胞的应答。
一种方法是使用抗体或疫苗来增强T细胞对这些肿瘤抗原的识别能力,以提高肿瘤免疫治疗的效果。
趋化因子CXCL9、10、11及CXCR3在晚期NSCLC患者免疫治疗监测中的临床意义演示稿件

采用SPSS软件进行数据分析,比较免疫治疗组和对照组在CXCL9、10、11及CXCR3表达方面的差异;分析趋化 因子表达与患者生存期的关系。
04
结果分析
CXCL9、10、11及CXCR3的表达水平与免疫治疗的关系
CXCL9、10、11及CXCR3的表达水 平与免疫治疗的效果密切相关。在 接受免疫治疗的晚期NSCLC患者中 ,CXCL9、10、11及CXCR3的表达 水平越高,治疗效果越好,患者的 生存期也越长。这可能是因为这些 趋化因子能够吸引更多的免疫细胞 到肿瘤组织中,增强免疫反应,从 而更有效地控制肿瘤的生长和扩散 。
个性化治疗策略
通过监测趋化因子水平,可以为患者制定更个性化的免疫治疗方案。对于CXCL9、10、11及CXCR3表达水平较高的 患者,可能需要探索更有效的免疫治疗方案或联合其他治疗手段。
加强与基础研究的结合
为了更深入地理解趋化因子在肿瘤免疫中的作用机制,建议加强临床与基础研究的合作,开展更多针对 趋化因子的机制研究,为未来的治疗策略提供理论支持。
05
讨论和结论
CXCL9、10、11及CXCR3在晚期NSCLC患者免疫治疗监 测中的意义
趋化因子CXCL9、10、11及CXCR3 与免疫治疗的关系:CXCL9、10、11 及CXCR3在肿瘤免疫中发挥重要作用 ,它们能够调节T细胞的迁移和浸润 ,影响抗肿瘤免疫反应。在晚期 NSCLC患者中,这些趋化因子可能作 为监测免疫治疗反应和预测预后的生 物标志物。
感谢您的观看
THANKS
监测免疫治疗反应:通过监测趋化因 子水平,可以评估免疫治疗的效果。 如果CXCL9、10、11及CXCR3的表 达水平在治疗后显著降低,可能表明 免疫治疗有效,肿瘤生长受到抑制, 浸润的T细胞减少。反之,如果这些 趋化因子水平持续高表达,可能提示 免疫治疗反应不佳或肿瘤进展。
PD-L1在急性髓系白血病中的表达及临床意义

PD-L1在急性髓系白血病中的表达及临床意义【摘要】PD-L1是免疫检查点分子,在急性髓系白血病中的表达与临床意义备受关注。
研究表明,PD-L1与急性髓系白血病的发生发展密切相关,其表达水平可用于预测患者的预后。
PD-L1抑制剂作为新型治疗策略在临床试验中显示出潜在的治疗效果。
PD-L1在急性髓系白血病中的潜在机制也值得进一步探究,以更深入了解疾病的发生发展机制。
PD-L1在急性髓系白血病中的表达具有重要的临床意义,其治疗可能成为未来治疗该疾病的新策略,而进一步研究PD-L1在该病中的作用有助于深入了解疾病的发生机制。
【关键词】PD-L1, 急性髓系白血病, 表达, 临床意义, 关系, 预后预测, 抑制剂, 治疗, 临床试验, 进展, 潜在机制, 值得重视, 新型治疗策略, 研究, 机制.1. 引言1.1 PD-L1在急性髓系白血病中的表达及临床意义PD-L1,即程序性死亡配体1(Programmed Death-Ligand 1),是一种重要的免疫检查点分子,其在调控T细胞免疫反应和免疫耐受性中起着重要作用。
最近的研究表明,PD-L1在急性髓系白血病(AML)中的表达与疾病的发生和发展密切相关。
在AML患者的骨髓样本中,PD-L1的表达水平往往明显升高。
这种现象可能是由于AML细胞本身表达PD-L1,也可能是由于在AML微环境中存在PD-L1表达的免疫细胞,如肿瘤相关巨噬细胞等。
PD-L1的高表达可能有助于AML细胞逃避免疫系统的攻击,同时还可能与AML细胞的增殖、侵袭和转移等恶性生物学行为有关。
临床研究表明,AML患者的PD-L1表达水平与预后密切相关。
一些研究发现,PD-L1高表达的AML患者往往具有较差的预后,包括较短的生存期和较高的复发率。
这提示PD-L1可能成为评估AML患者预后的重要生物标志物,为临床治疗决策提供重要参考。
综合以上研究结果,PD-L1在急性髓系白血病中的表达具有重要的临床意义,可能成为未来AML治疗的新靶点。
肿瘤的免疫学变化与免疫治疗

肿瘤的免疫学变化与免疫治疗自从肿瘤免疫疗法(immunotherapy)问世以来,它已经显示出对某些类型的癌症的显着治疗效果。
与传统的化疗和放疗不同,肿瘤免疫疗法利用人体免疫系统来打击癌症。
然而,成功的免疫治疗需要对基于肿瘤免疫学的相关变化有深入的了解。
本文将介绍肿瘤的免疫学变化以及免疫治疗的发展和应用研究。
免疫系统是如何察觉和消灭肿瘤的?免疫系统的核心是淋巴细胞,包括T细胞和B细胞。
它们可以辨认人体内异常的细胞,例如癌症细胞。
一种T细胞被称为CD8+ T细胞,它们可以杀死包括癌症细胞在内的细胞。
另一种T细胞被称为CD4+ T细胞,它们可以激活其他免疫细胞,如B细胞、巨噬细胞和树突状细胞,以消灭异常的细胞。
B细胞可以分泌特异性抗体定向杀死癌症细胞。
免疫耐受是什么,并如何存在抗肿瘤免疫应答?肿瘤可以通过培训免疫细胞使它们失去认出和排除癌症细胞的能力。
其他免疫系统组成部分、如调节性T细胞、T疲劳细胞和免疫抑制分子,也可以帮助肿瘤逃避免疫监视。
这样的调节也存在于健康人群中,这意味着我们的身体需要平衡消除异常细胞和不要攻击健康组织之间的调节。
但是当肿瘤发展时,它会破坏这种平衡以逃避免疫系统的监测。
免疫治疗的类型目前有几种免疫治疗策略可以恢复抗肿瘤免疫应答。
免疫检查点(blockade) 抑制剂是一种最成功的策略之一。
它在几种癌症,如黑色素瘤、髓母细胞瘤和肺癌等,中显示出潜在的治疗效果。
免疫检查点抑制剂可以阻止肿瘤细胞和肿瘤微环境中的免疫抑制分子,例如PD-L1和CTLA-4。
另一个方法是通过低剂量辐射免疫疗法。
这通过释放分子型危险信号分子来引导并扩大免疫应答的方式。
单克隆抗体疗法(monoclonal antibody therapy) 是指通过融合细胞以创造高度特异性的抗体,让抗体受体与细胞表面的受体结合来定向杀死奇异的癌细胞。
几种单克隆抗体已经被批准用于癌症治疗,和同类的药物仍在研发中。
肿瘤免疫治疗的前景肿瘤免疫治疗受欢迎的原因在于它不同于传统的治疗方法,如放射治疗和化疗,这些方法不具有显著的治愈优势或在一段时间后会出现耐药性。
肿瘤免疫相关基因研究

肿瘤免疫相关基因研究随着生物信息技术和分子生物学的发展,研究人员逐渐认识到了肿瘤免疫相关基因对肿瘤发生和治疗的重要性。
肿瘤免疫相关基因是指在肿瘤免疫过程中发挥重要作用的基因。
这些基因包括参与免疫反应的细胞因子、免疫调节分子和受体,以及介导免疫细胞与肿瘤细胞的相互作用的分子。
肿瘤免疫相关基因的研究对于了解肿瘤的免疫学特征,推动肿瘤的个体化治疗具有重要意义。
1. 肝癌和肺癌中PD-L1和CTLA-4基因的研究进展PD-L1和CTLA-4是目前研究较为深入的肿瘤免疫相关基因。
PD-1(programmed cell death protein 1)是一种细胞表面的免疫抑制分子,PD-L1(programmed death-ligand 1)则是其配体。
当PD-L1与PD-1结合时,它会抑制T细胞的活化,从而导致肿瘤细胞逃避免疫监视。
而CTLA-4(cytotoxic T-lymphocyte-associated protein 4)是T细胞表面的另一种抑制分子,它通过竞争性结合B7分子抑制T细胞的活化,从而减弱抗肿瘤免疫反应。
因此,抑制PD-L1、PD-1或CTLA-4,可以增强T细胞反应,达到抗肿瘤的作用。
目前,抗PD-1和抗PD-L1抗体已经在多种癌症中得到广泛应用。
一项针对肝癌患者的临床试验发现,抗PD-1抗体nivolumab的治疗效果显著,且安全性良好。
同时,也有研究表明,肝癌中CTLA-4的表达水平与肝癌的预后相关。
另外,一项对于肺癌中PD-L1表达和CTLA-4多态性的Meta分析表明,PD-L1表达与恶性程度和淋巴结转移显著相关,并且高CTLA-4表达或基因多态性与恶性程度、不良预后和肺癌的生存率显著相关。
2. T细胞检查点抑制剂的研究与应用除了PD-L1和CTLA-4,还有一些其他的T细胞检查点分子,如LAG3(lymphocyte-activation gene 3)、TIM3(T-cell immunoglobulin domain and mucindomain 3)和TIGIT(T-cell immunoreceptor with Ig and ITIM domains)等,也被研究人员关注。
肿瘤免疫.

根据诱导肿瘤产生的方法分类
理化因素诱发的肿瘤抗原 病毒诱发的肿瘤抗原 自发性肿瘤抗原 胚胎性抗原或分化抗原
肿瘤特异性抗原(tumor specific antigen,TSA)
肿瘤特异性移植抗原(TSTA) 肿瘤排斥抗原(TRA)
肿瘤相关抗原(tumor associated antigen,TAA)
体液免疫机制
CDC、ADCC、调理作用:
通过补体、巨噬细胞、NK细胞、中性粒细胞 介导杀伤肿瘤细胞
体液免疫机制
封闭抗体: 抑制:
与肿瘤细胞恶性转化、增殖、转移有关的抗 原 如 p185可抑制增殖、转铁蛋白受体可抑
制生长、粘附分子可阻止克隆形成与转移
增强抗体(enhancing antibody):
定义:细胞癌变过程中新出现的抗原 以及过度表达的抗原物质的总称。
产生机制
新的蛋白质 基因突变或重排使蛋白结构发生改变 蛋白的特殊降解产物 隐蔽的抗原表位暴露 多种膜蛋白分子的异常聚集 胚胎抗原或分化抗原的异常高表达
(一)根据肿瘤抗原的特异性,可分为二大类
肿瘤特异性抗原 (Tumor specific antigen , TSA) 肿瘤细胞特有,正常细胞不存在
肿瘤相关抗原 (Tumor associated antigen , TAA)
正常细胞组织也存在,但肿瘤细 胞中含量明显增高
(二)根据肿瘤诱发和发生的分类
• 化学或物理因素诱发的肿瘤抗原 • 病毒诱发的肿瘤抗原 • 自发性肿瘤抗原 • 胚胎抗原或分化抗原
根据特异性分类 肿瘤特异性抗原
肿瘤相关抗原
激活巨噬细胞和 NK 细胞 (通过细胞因子)
非特异性免疫治疗
中药及其有效成分
黄芪多糖、人参多糖、枸杞子多糖、刺五加多糖
肿瘤细胞免疫分型-概述说明以及解释

肿瘤细胞免疫分型-概述说明以及解释1. 引言1.1 概述概述肿瘤细胞免疫分型是指通过对肿瘤细胞免疫特征的分类和划分,将肿瘤分为不同的亚型或类型。
肿瘤细胞免疫分型的目的是为了更好地了解肿瘤发展和治疗的机制,为个体化精准医疗提供理论依据。
在过去的几十年里,人们对肿瘤的认识不断深入,逐渐发现肿瘤不仅仅是由异常增殖的细胞构成,免疫系统在肿瘤的发生和发展中也起着重要作用。
肿瘤细胞免疫分型正是基于这一认识,通过对肿瘤细胞表面的免疫标志物以及免疫相关基因的表达水平进行分析,区分不同类型的肿瘤细胞免疫特征。
肿瘤细胞免疫分型可以帮助医生更好地预测肿瘤的发展趋势和预后,指导治疗方案的选择。
通过对肿瘤细胞免疫特征的分析,可以了解肿瘤细胞与免疫系统的相互作用机制,进而探索肿瘤的免疫治疗策略。
此外,肿瘤细胞免疫分型还有助于对抗肿瘤免疫逃逸和免疫治疗抵抗的问题,提高免疫治疗的有效性。
随着肿瘤细胞免疫分型研究的不断深入,越来越多的研究者开始关注肿瘤免疫学领域的研究,在这一领域的发展和应用也取得了显著的进展。
然而,肿瘤细胞免疫分型仍然是一个新兴的领域,仍然存在许多待解决的问题和挑战。
未来的研究将着重于深入探索肿瘤细胞免疫分型的机制,寻找更准确和可靠的指标,进一步拓展肿瘤免疫治疗的研究和应用范围。
综上所述,肿瘤细胞免疫分型作为肿瘤免疫学领域的一个重要研究方向,对于了解肿瘤的发展和治疗具有重要意义。
通过充分挖掘和利用肿瘤细胞免疫特征,可以为临床个体化治疗提供新的思路和策略,为肿瘤患者带来更好的治疗效果和生存质量。
1.2 文章结构文章结构:本文分为引言、正文和结论三个部分。
引言部分主要概述本文的研究背景和目的,引入肿瘤细胞免疫分型的概念,并介绍本文的结构。
正文部分包括肿瘤细胞免疫分型的定义和意义两个方面。
2.1 肿瘤细胞免疫分型的定义部分将介绍肿瘤细胞免疫分型的含义和方法,包括什么是肿瘤细胞免疫分型、为什么需要进行肿瘤细胞免疫分型,以及常用的肿瘤细胞免疫分型的手段和技术。
什么是免疫检查点抑制剂治疗

什么是免疫检查点抑制剂治疗恶性肿瘤是目前人类生命健康的最大威胁之一,其发病率及致死率高,治疗手段有限,治疗效果尚不尽人意,使得人们曾经谈癌色变。
因此,针对肿瘤的基础临床科学研究一直是生命科学和医学研究的重点。
尽管目前我们仍无法全面认识这种疾病,但随着研究的不断深入,抗肿瘤的新型药物不断涌现,给肿瘤患者带来了新的希望。
免疫检查点抑制剂就是近些年出现的为部分肿瘤患者带来良好临床预后的新型抗肿瘤药物,本文将就其抗肿瘤的机制及其临床使用中可能出现的问题做一科普论述。
T淋巴细胞,简称T细胞,是维持人体正常“免疫力”的重要细胞,也是抗肿瘤免疫中最重要的效应细胞。
当机体受到病原体入侵或者自身产生畸变的细胞后,会被一类叫做抗原呈递细胞的免疫细胞所识别,这位“探长”摸清楚犯罪分子的特点后将其以抗原的形式呈递给“警长”——效应T细胞,抗原信号激活T细胞变身全副武装的勇士,开始逮捕并消灭犯罪分子,为了防止这个过程中误伤“群众”(正常组织),“探长”会不断地给与“警长”特殊信号以提示“警长”要及时收兵,防止盲目扩大清除范围,与此同时,部分“群众”也会表达一些特殊的信号分子,以使得“警长”能够认识到他们是自己人从而避免被误伤。
这样,机体就能够维持正常的免疫功能,消灭病原体及畸变细胞并维持适度的免疫反应。
T细胞用于接收“防止扩大清除信号”的蛋白质分子,就是我们医学上说的免疫检查点;而来自“探长”和“群众”的“防止扩大清除信号的分子”被称为免疫检查点的配体。
免疫检查点及其配体就像是“刹车锁”和“钥匙”的关系,特定的钥匙才能开启特定的锁,从而踩下T细胞效应功能的刹车键,使免疫系统的活化保持在正常范围内。
“锁钥关系”的异常会导致各种疾病的发生,当钥匙不能正常开启刹车锁,则T细胞过度激活造成正常组织损伤(误伤“群众”),导致例如自身免疫性疾病等疾病;而当钥匙过度激活刹车锁,则出现免疫抑制状态,使得免疫系统失去对致病因素的免疫监视,导致比如肿瘤等疾病的发生。
肝癌的肿瘤免疫细胞浸润与预后评估

肝癌的肿瘤免疫细胞浸润与预后评估肝癌是一种常见的恶性肿瘤,其预后评估一直是临床研究的热点之一。
肿瘤免疫细胞浸润是肝癌免疫治疗的重要指标之一,也与患者的预后密切相关。
本文将探讨肝癌的肿瘤免疫细胞浸润与预后评估的相关内容。
一、肝癌的肿瘤免疫细胞浸润概述肝癌的发展与免疫系统密切相关,其中肿瘤免疫细胞浸润起到重要作用。
肝癌组织中常见的免疫细胞包括免疫活化细胞、T淋巴细胞、B 淋巴细胞、自然杀伤细胞等。
这些免疫细胞参与了免疫反应的调节与执行,直接影响了肝癌的发展和预后。
二、肿瘤免疫细胞浸润与肝癌预后评估1. 免疫细胞浸润与肝癌的临床特征研究发现,肝癌患者的肿瘤组织中免疫细胞的浸润情况与患者的临床特征密切相关。
高度浸润的免疫细胞提示免疫系统对肿瘤具有较强的识别和清除能力,通常与较好的预后相关。
而低度浸润或无浸润的免疫细胞则可能表示免疫逃逸或抑制,与恶性肿瘤的发展和预后不利相关。
2. 免疫细胞浸润与肝癌的预后评估指标在肝癌患者的预后评估中,免疫细胞浸润可作为重要的预测指标之一。
研究发现,免疫细胞的类型、数量和分布等特征与肝癌的预后密切相关。
例如,T淋巴细胞的浸润与患者的存活期和无复发的风险呈正相关。
而免疫抑制细胞(如调节性T细胞)的浸润则可能增加肿瘤的侵袭和转移风险。
3. 肝癌免疫细胞浸润与免疫治疗近年来,免疫治疗成为肝癌治疗的重要手段之一。
免疫细胞浸润情况可以作为免疫治疗效果的预测指标。
研究发现,在肿瘤组织中浸润大量活化的免疫细胞,对免疫检查点抑制剂等免疫治疗药物的反应通常较为显著。
三、肿瘤免疫细胞浸润与肝癌预后评估的临床应用1. 免疫细胞浸润的检测方法目前,常用的免疫细胞浸润检测方法包括免疫组织化学染色、流式细胞术和免疫组化等。
这些方法可以直观地观察和定量免疫细胞在肿瘤组织中的分布和数量。
2. 免疫细胞浸润的预后评估模型为了更准确地评估患者的预后,不少研究致力于建立免疫细胞浸润的预后评估模型。
这些模型通常将免疫细胞的类型、数量和分布等因素结合起来,通过统计学方法进行预测。
负性共刺激分子B7-H4与肿瘤免疫信号通路的研究进展

负性共刺激分子B7-H4与肿瘤免疫信号通路的研究进展【摘要】肿瘤免疫治疗是当前肿瘤治疗领域的研究热点之一,负性共刺激分子B7-H4在肿瘤免疫信号通路中发挥着重要作用。
本文综述了B7-H4的发现与特征、其在肿瘤免疫逃逸中的作用、与肿瘤免疫治疗的关联、潜在临床应用以及调节机制。
研究发现B7-H4可通过抑制T 细胞活化和增加免疫抑制细胞的抑制功能来促进肿瘤免疫逃逸。
B7-H4作为潜在的肿瘤免疫治疗靶点备受关注,并在肿瘤免疫研究中具有重要意义。
未来研究应进一步明确B7-H4在肿瘤发生发展中的作用机制,为开发新的肿瘤免疫治疗策略提供理论基础。
【关键词】肿瘤免疫、共刺激分子B7-H4、肿瘤免疫逃逸、肿瘤免疫治疗、临床应用、信号通路、调节机制、治疗靶点、研究方向。
1. 引言1.1 研究背景B7-H4是一种负性共刺激分子,最初在2003年被发现。
它属于B7家族的一员,在免疫调节中起着重要作用。
随着对肿瘤免疫逃逸机制的研究不断深入,B7-H4的角色逐渐凸显出来。
B7-H4在肿瘤微环境中被广泛表达,与肿瘤的逃逸和发展密切相关。
研究表明,B7-H4通过抑制T细胞的活化和增殖,抑制NK细胞对肿瘤细胞的杀伤作用,以及促进调节性T细胞的生成和活化,起着重要作用。
这些功能使B7-H4成为肿瘤免疫逃逸的重要因素。
了解B7-H4在肿瘤免疫中的作用机制,探索其在肿瘤免疫治疗中的应用潜力,对于开发新的肿瘤治疗策略具有重要意义。
深入研究B7-H4与肿瘤免疫信号通路的交互作用,是当前肿瘤免疫研究领域的热点之一。
通过对B7-H4的深入了解,有望为肿瘤免疫治疗提供新的靶点和策略,为癌症患者的治疗带来新的希望。
1.2 研究意义探究B7-H4与肿瘤免疫信号通路的关联,不仅有助于深入了解肿瘤免疫逃逸的机制,还为开发新的肿瘤免疫治疗靶点提供了重要线索。
通过研究B7-H4在肿瘤免疫治疗中的潜在应用,可以为个性化治疗提供更多可能性,并提高治疗效果。
通过探究B7-H4与肿瘤免疫信号通路的调节机制,有望揭示肿瘤免疫逃逸的新机理,为肿瘤免疫治疗的进一步发展提供理论基础。
lgals9分子量

lgals9分子量lgals9是一种重要的蛋白质,分子量为约30kDa。
它属于半胱氨酸蛋白家族,是一种低亲和力的胞外基质蛋白。
在人体内,lgals9的表达与多种生理和病理过程密切相关。
lgals9在免疫调节过程中发挥着重要作用。
研究表明,lgals9可以调节T细胞的分化和功能。
它能够促进抗病毒和抗肿瘤免疫反应,并抑制炎症反应。
这一发现使得lgals9成为免疫治疗的潜在靶点。
研究人员通过调控lgals9的表达水平,可以增强或抑制免疫反应,从而治疗免疫相关的疾病。
lgals9还参与了肿瘤发生和发展过程。
研究发现,lgals9在多种肿瘤中的表达水平升高,并与肿瘤的恶性程度和预后相关。
lgals9通过与肿瘤细胞表面的配体结合,调节细胞增殖、迁移和侵袭能力,从而促进肿瘤的生长和转移。
因此,lgals9也被认为是肿瘤治疗的潜在靶点。
研究人员正在努力寻找lgals9的抑制剂,以抑制肿瘤的生长和转移。
除了免疫和肿瘤调节外,lgals9还参与了许多其他生理和病理过程。
例如,研究发现lgals9在心血管疾病、神经退行性疾病和炎症性肠病等疾病中的表达水平发生变化,并与疾病的发生和发展密切相关。
此外,lgals9还参与了细胞凋亡、细胞黏附和细胞迁移等生物学过程。
这些发现表明,lgals9在维持正常生理功能和疾病发生过程中具有重要作用。
为了进一步研究lgals9的功能和机制,研究人员还开展了大量的实验和临床研究。
他们通过基因敲除、过表达和药物干预等手段,研究lgals9在细胞和动物模型中的作用。
通过这些研究,人们对lgals9的功能和调控机制有了更深入的了解。
这些研究为开发lgals9相关疾病的治疗策略提供了重要的理论依据。
lgals9作为一种重要的蛋白质,分子量约为30kDa,参与了免疫调节、肿瘤发生和发展以及其他许多生理和病理过程。
研究人员通过实验和临床研究,揭示了lgals9的功能和调控机制,并为相关疾病的治疗提供了新的思路。
pd-l1表达量范围

pd-l1表达量范围PD-L1是一种免疫检查点分子,其表达量在肿瘤免疫治疗中扮演着重要的角色。
PD-L1表达量的范围涉及到肿瘤的免疫逃逸机制、预后预测和治疗效果等方面。
本文将从不同角度探讨PD-L1表达量的范围及其相关意义。
一、PD-L1表达量的测定方法PD-L1的表达量通常通过免疫组化(IHC)技术来测定。
这一技术可以通过染色反应来显示肿瘤细胞或免疫细胞中PD-L1的存在与否,并根据染色程度和范围进行评分。
根据IHC评分,可以将PD-L1表达分为阴性、低表达、中等表达和高表达等不同水平。
二、PD-L1表达与免疫逃逸机制PD-L1的高表达通常与肿瘤的免疫逃逸机制密切相关。
肿瘤细胞通过高表达PD-L1,可以与T细胞表面的PD-1结合,从而抑制T细胞的活化和增殖,使肿瘤逃避免疫系统的攻击。
因此,PD-L1高表达往往与肿瘤的免疫逃逸和耐药性相关。
三、PD-L1表达与预后预测PD-L1的表达水平在某些肿瘤类型中与预后有关。
研究发现,PD-L1高表达往往与肿瘤的恶性程度、淋巴结转移和预后不良相关。
例如,在非小细胞肺癌中,PD-L1高表达的患者通常具有较差的预后。
因此,PD-L1的表达量可以作为预测肿瘤预后的一个指标。
四、PD-L1表达与肿瘤免疫治疗PD-L1的表达水平也与肿瘤免疫治疗的疗效相关。
PD-L1抗体药物可以与PD-1或PD-L1结合,阻断PD-1/PD-L1信号通路,从而恢复T 细胞对肿瘤的攻击能力。
临床研究发现,PD-L1高表达的肿瘤通常对PD-L1抗体药物具有更好的疗效。
因此,PD-L1的表达量可以作为选择肿瘤免疫治疗的一个依据。
五、PD-L1表达的调控机制PD-L1的表达受多种信号通路的调控,包括JAK-STAT、PI3K/Akt、MAPK等。
这些信号通路可以通过转录因子、翻译后修饰和稳定性调控等机制影响PD-L1的表达。
深入研究PD-L1的调控机制有助于理解肿瘤免疫逃逸的分子机制,为开发新的免疫治疗策略提供理论依据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Advances in Clinical Medicine 临床医学进展, 2015, 5, 78-83Published Online June 2015 in Hans. /journal/acm/10.12677/acm.2015.52014The Overview of Tumor-RelatedImmunosuppressive MoleculesDongyun Zhang1*, Ran Liu2, Anli Liu1, Yin Li1, Jing Wang11Department of Basic Medicine, Nanyang Medical College, Nanyang Henan2Oncology Department, The First Affiliated Hospital of Nanyang Medical College, Nanyang HenanEmail: *zhangdy79@Received: May 21st, 2015; accepted: Jun. 9th, 2015; published: Jun. 12th, 2015Copyright © 2015 by authors and Hans Publishers Inc.This work is licensed under the Creative Commons Attribution International License (CC BY)./licenses/by/4.0/AbstractTumorigenesis was closely related to the states of immune tumor suppressor cells and immuno-suppressive molecules. In the paper, we overviewed current functional situation and newly re-search progress of immunosuppressive molecules, e.g. programmed death-1, cytotoxic T lympho-cyte-associated antigen-4, T cell immunoglobulin domain and mucin domain-3, B and T lympho-cyte attenuator, LAG-3, CD160, which took part in the tumor immune escape in the process of tu-mor immunity.KeywordsTumor, Immune, Immunosuppressive Molecules, Overview肿瘤预后相关免疫抑制分子概述张冬云1*,刘冉2,刘安丽1,李寅1,王静11南阳医学高等专科学校,基础医学部,河南南阳2南阳医学高等专科学校,第一附属医院肿瘤科,河南南阳Email: *zhangdy79@收稿日期:2015年5月21日;录用日期:2015年6月9日;发布日期:2015年6月12日*通讯作者。
肿瘤预后相关免疫抑制分子概述摘要肿瘤机体内免疫抑制细胞、免疫抑制分子状态与肿瘤发生、发展密切相关。
本文综述了肿瘤免疫过程中参与肿瘤免疫逃逸的免疫抑制分子PD-1,CTLA-4,TIM-3,LAG-3,CD160,BTLA的功能状况及最新研究进展。
关键词肿瘤,免疫,免疫抑制分子,综述1. 引言目前针对大量的动物模型及人体方面肿瘤研究均表明机体免疫系统能有效识别、杀伤肿瘤细胞,发挥免疫监视及维持机体自稳态作用。
不解的是机体在怎样的情况下、在何时、又是如何导致了疾病和肿瘤的发生。
Schreiber RD等[1]于2002年提出了“免疫编辑学说”,其包括免疫监视、免疫自稳、免疫逃逸三个阶段。
免疫监视过程中,癌细胞被识别、清除。
随着肿瘤的缓慢生长,机体免疫系统再次激活,一些癌细胞再次被清除,此循环在体内周而复始进行,即为免疫平衡。
免疫监视后的免疫逃逸阶段主要是一些以前不被认知的免疫抑制细胞、免疫抑制分子等综合作用抑制T细胞活化。
因此对肿瘤相关免疫抑制分子的研究已成为临床研究热点,有望为临床肿瘤靶向治疗提供理论依据。
现就近几年来医学领域对肿瘤相关免疫抑制分子研究作一简要综述。
2. PD-1分子程序性死亡分子-1 (programmed death-1, PD-1)又名CD279,由于其和细胞凋亡相关而被命名,该分子定位于2号染色体2q37.3,属I型跨膜糖蛋白,由胞外区、跨膜区和胞内区组成。
其胞外区有4个重要的N连接糖基化位点,在与其配体结合中起重要作用; 胞内区包含两个络氨酸抑制基序(ITIM),均参与了受体磷酸化过程,第二个络氨酸抑制基序磷酸化后募集SHP-1、SHP-2到胞浆区,促使TCR相关信号分子脱磷酸化,TCR/CD28信号传导衰竭。
PD-1分子表达于活化的CD4+CD8+T细胞、NK细胞、T 细胞、B细胞、单核细胞上,其配体PD-L1分子(CD274)定位于染色体9p24,由胞外区、疏水性跨膜结构域、胞内区组成,可负向调节免疫应答。
PD-1/PD-L1结合可以增强机体细胞免疫抑制信号表达,对抗由TCR-CD28调节的磷脂酰肌醇-3激酶活性,降低AKt磷酸化和葡萄糖代谢,抑制T细胞活化。
PD-1最初发现表达在SIV特异性CD8 T+细胞上,体内阻止PD-1/PD-L1途径可促进T细胞增殖,细胞因子产生及SIV特异性B细胞应答[2]。
其它研究者也发现HIV相关疾病严重程度、病毒载量、CD4+T细胞数量下降均与HIV特异性CD8+T细胞上PD-1表达水平相关。
研究发现PD-1在多种实体肿瘤组织中均有表达,且与部分肿瘤患者预后相关。
Ghebeh [3]发现在乳腺癌肿瘤细胞中PD-l表达水平与肿瘤组织学类型、孕酮受体、雌激素受体水平呈显著性相关。
Konishi [4]等检测到PD-1在非小细胞肺癌中表达水平增高。
但研究还发现并不是所有的实体肿瘤组织中均高表达PD-1,肾癌组织中肿瘤细胞内PD-1表达阴性,但肿瘤浸润性淋巴细胞内PD-1高表达。
Karim [5]等报道PD-1仅在19%的宫颈癌组织中有表达,与病人预后无关。
Gadiot [6]等研究显示PD-1表达水平对恶性黑色素瘤患者生存期没有影响。
肿瘤预后相关免疫抑制分子概述3. CTLA-4分子细胞毒性T淋巴细胞相关抗原4 (cytotoxic T lymphocyte-associated antigen-4, CTLA-4)又名CD152,是一种白细胞分化抗原,为T细胞上一种跨膜糖蛋白,其胞浆区有免疫受体络氨酸抑制基序,主要表达于活化的T细胞上,可稳定表达于调节性T细胞(Treg)表面,调控Treg功能并使吲哚胺2,3-过氧化酶高表达,从而抑制机体对肿瘤细胞产生免疫反应。
CTLA-4分子与CD28有31%氨基酸同源性,二者共同享有CD80/CD86配体,其与配体结合的亲和力高于CD28,可竞争性结合APC表面CD80/CD86,并向活化T细胞传递抑制信号[7]。
早期研究[8]证实CTLA-4拮抗剂可以降低动物模型中肿瘤发生率。
Lute [9]研究也证实抗CTLA-4抗体可诱导机体产生免疫毒素,发挥抗肿瘤效应。
临床疾病研究中也发现CTLA-4 Ig在寻常银屑病、类风湿性关节炎等临床试验中的抗肿瘤效应[10] [11]。
4. TIM-3分子T细胞免疫球蛋白及粘蛋白结构域分子-3 (T cell immunoglobulin domain and mucin domain-3, Tim-3)是TIM基因家族成员之一,该基因定位于5号染色体5q33.2 [12]。
主要表达于Th1细胞上[13],与其配体-半乳糖凝集素-9 (Gal-9)、S型植物血凝素结合后相互作用能介导T细胞免疫耐受、诱导Th1细胞死亡[14]。
实验动物模型中阻断TIM-3与Gal-9结合可打破免疫耐受,诱发自身免疫性疾病[15]。
近年来小鼠实验研究证明小鼠中TIM-3可促进CD8+T细胞免疫耐受,导致骨髓来源抑制性细胞增加[16]。
黑色素瘤中免疫组化检测发现,TIM-3分子在黑色素瘤细胞及周围肥大细胞中均有表达,可通过抑制免疫促进黑色素瘤细胞存活[17];优先表达于淋巴瘤内皮组织中的TIM-3可通过介导免疫逃逸促使肿瘤进展[18]。
但也有研究表明,在移植肿瘤的小鼠模型中,给予Gal-9处理可增强T细胞抗肿瘤活性[19]。
由此可见,TIM-3在不同肿瘤发生、发展过程中的作用不尽相同,具体机制还不甚清楚。
5. LAG-3分子淋巴细胞活化因子-3 (LAG-3)又名CD223,是一种跨膜糖蛋白,由470个氨基酸构成。
该基因包含8个外显子,定位于12号染色体12p13,与CD4基因有一定同源性(<20%)。
LAG-3分子由胞外区、跨膜区和胞内区3部分组成,是MHC II类分子的配体,从属于Ig超家族成员,选择性表达在活化的T淋巴细胞、NK细胞和树突状细胞上,细胞因子IL-2、IL-7和IL-12可上调其表达[20]。
LAG-3结合CD3/TCR 复合物可抑制CD3/TCR信号传递及TCR受体诱导的Ca2+流量,从而抑制T细胞功能[21]。
与PD-1分子相比,LAG-3分子的诱导只需弱免疫原性信号刺激即可激活其表达。
动物模型研究表明LAG-3分子的表达可抑制T细胞功能,这与持续感染中CD8+T细胞功能耗竭相关[22]。
但LAG-3分子对肿瘤作用结论尚未统一。
有研究表明LAG-3表达的肿瘤细胞、肿瘤浸润CD8+T 细胞(TIL)和可溶性LAG-3分子均可通过与MHC II类分子结合活化APC,诱导机体抗肿瘤免疫应答,抑制肿瘤细胞生长[23] [24]。
但另有研究显示LAG-3分子抑制机体抗肿瘤免疫应答,促进肿瘤发生发展。
Grosso等[25]研究显示,LAG-3在活化的CD8+T细胞上高水平表达,抑制其活化、增殖及抗肿瘤应答能力。
6. CD160分子CDl60最早命名为BY55,是由Bensussan实验室在用人源NK细胞系VI2C2反复免疫BALB/C小鼠过程中发现的NK细胞表面分子,是含单个IgV结构域的糖基化磷脂酰肌醇(GPI)锚定蛋白,从属于B7/CD28家族,最初是作为NK细胞上MHC-I类分子被鉴定出来[26]。
CD160和BTLA两者都可与活化T细胞上的配体HVEM结合,主要表达在CD56+CD16–NK细胞、NKT细胞、γδT细胞、CD8+CD28–T 细肿瘤预后相关免疫抑制分子概述胞、和部分外周CD4+、CD8+T细胞上,负向调控细胞周期。
