实验七亲和层析纯化和SDS-PAGE鉴定目的蛋白质(GST、SDS-PAGE)
蛋白 SDS-PAGE纯度鉴定与分子量测定
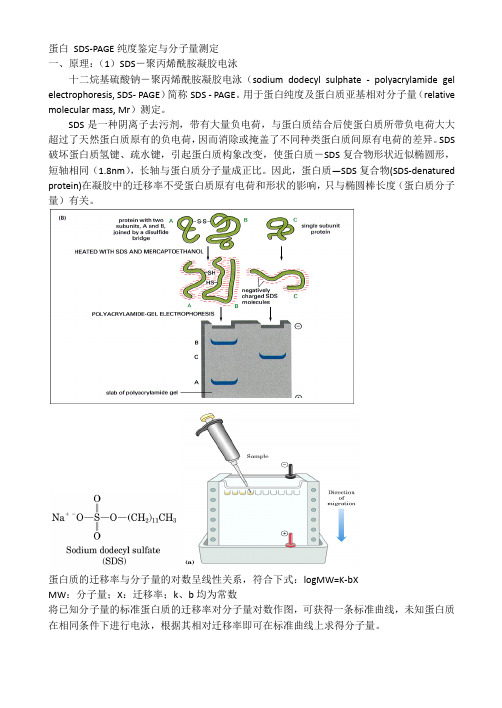
蛋白SDS-PAGE纯度鉴定与分子量测定一、原理:(1)SDS-聚丙烯酰胺凝胶电泳十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate - polyacrylamide gel electrophoresis, SDS- PAGE)简称SDS - PAGE。
用于蛋白纯度及蛋白质亚基相对分子量(relative molecular mass, Mr)测定。
SDS是一种阴离子去污剂,带有大量负电荷,与蛋白质结合后使蛋白质所带负电荷大大超过了天然蛋白质原有的负电荷,因而消除或掩盖了不同种类蛋白质间原有电荷的差异。
SDS 破坏蛋白质氢键、疏水键,引起蛋白质构象改变,使蛋白质-SDS复合物形状近似椭圆形,短轴相同(1.8nm),长轴与蛋白质分子量成正比。
因此,蛋白质—SDS复合物(SDS-denatured protein)在凝胶中的迁移率不受蛋白质原有电荷和形状的影响,只与椭圆棒长度(蛋白质分子量)有关。
蛋白质的迁移率与分子量的对数呈线性关系,符合下式:logMW=K-bXMW:分子量;X:迁移率;k、b均为常数将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据其相对迁移率即可在标准曲线上求得分子量。
(2)分离效应:PAGE根据其有无浓缩效应,分为:连续电泳(continuous electrophoresis):采用相同孔径的凝胶和相同的缓冲系统不连续电泳(discontinuous electrophoresis):采用不同孔径的凝胶和不同缓冲体系连续PAGE:电荷效应;分子筛效应不连续PAGE:电荷效应;分子筛效应;浓缩效应不连续聚丙烯酰胺凝胶电泳:凝胶由上、下两层凝胶组成,两层凝胶的孔径不同,上层为大孔径的浓缩胶,下层为小孔径的分离胶。
①浓缩效应:使样品在浓缩胶中被浓缩成一条窄带,然后再进入分离胶进行分离。
②电荷效应:分离胶中,蛋白质表面净电荷不同,迁移率不同。
蛋白共纯化实验报告

1. 学习蛋白质纯化的基本原理和方法。
2. 掌握利用亲和层析法进行蛋白质共纯化的技术。
3. 通过实验验证蛋白质共纯化的效果。
二、实验原理蛋白质共纯化是指从混合蛋白质样品中同时分离和纯化两种或两种以上的目的蛋白。
亲和层析法是蛋白质共纯化常用的技术之一,其原理是利用蛋白质与特定配体的亲和力,通过柱层析将目的蛋白从混合样品中分离出来。
三、实验材料1. 试剂:亲和层析柱、亲和配体、洗脱液、样品缓冲液、SDS-PAGE凝胶、考马斯亮蓝染色液等。
2. 仪器:离心机、层析柱、凝胶成像仪等。
四、实验方法1. 准备亲和层析柱:将亲和配体固定在层析柱上,制成亲和层析柱。
2. 样品处理:将混合蛋白质样品加入亲和层析柱,进行预平衡。
3. 亲和层析:将样品溶液通过亲和层析柱,目的蛋白与亲和配体结合,其他蛋白质通过柱。
4. 洗脱:用洗脱液洗脱亲和配体上的目的蛋白,收集洗脱液。
5. 检测:将洗脱液进行SDS-PAGE分析,观察目的蛋白的纯度。
6. 收集目的蛋白:将SDS-PAGE凝胶上的目的蛋白条带切割下来,进行后续处理。
五、实验结果与分析1. 亲和层析柱制备成功,亲和配体固定在层析柱上。
2. 样品溶液通过亲和层析柱,目的蛋白与亲和配体结合,其他蛋白质通过柱。
3. 用洗脱液洗脱亲和配体上的目的蛋白,收集洗脱液。
4. SDS-PAGE分析结果显示,洗脱液中含有目的蛋白,且纯度较高。
通过亲和层析法进行蛋白质共纯化实验,成功分离和纯化了两种目的蛋白,验证了实验方法的有效性。
七、实验注意事项1. 亲和层析柱制备过程中,要注意配体的固定量和固定效果。
2. 样品处理过程中,要确保样品溶液的浓度适宜,避免样品过浓或过稀。
3. 亲和层析过程中,要注意控制洗脱液的pH值和离子强度,以保证目的蛋白的稳定性。
4. 实验过程中,要注意层析柱的清洗和保存,避免污染。
5. 实验结束后,要对实验数据进行整理和分析,总结实验结果。
(完整版)SDS-PAGE检测蛋白质纯度

SDS-PAGE检测蛋白质纯度1.电泳的基本原理许多生物分子都带有电荷,其电荷的多少取决于分子性质及其所在介质的pH及其组成。
由于混合物中各组分所带电荷性质、电荷数量以及分子量的不同,在同一电场的作用下,各组分泳动的方向和速度也各异,因此,在一定时间内,由于各组分移动距离的不同,而达到分离鉴定各组分的目的。
2.影响电泳的主要因素2.1 电泳介质的pH当介质的pH等于某种两性物质的等电点时,该物质处于等电状态,即不向正极或负极移动。
当介质pH小于其等电点时,则呈正离子状态,移向负极;反之,介质pH大于其等电点时,则呈负离子状态,移向正极。
因此,任何一种两性物质的混合物电泳均受介质pH的影响,即决定两性物质的带电状态及其量,为了保持介质pH的稳定性,常用一定pH的缓冲液,如分离血清蛋白质常用pH8.6的巴比妥或三羟甲基氨基甲烷(Tris)缓冲液。
2.2 缓冲液的离子强度离子强度对电泳的影响是:离子强度低,电泳速度快,分离区带不易清晰;离子强度高,电泳速度慢,但区带分离清晰。
如离子强度过低,缓冲液的缓冲量小,不易维持pH的恒定;离子强度过高,则降低蛋白质的带电量(压缩双电层)使电脉速度减慢。
所以常用离子强度为0.02-0.2之间。
2.3 电场强度电场强度和电泳速度成正比关系。
电场强度以每厘米的电势差计算,也称电势梯度。
如纸电泳的滤纸长15cm,两端电压(电势差)为150V,则电场强度为150/15=10V/cm,电场强度愈高,则带电粒子的移动愈快。
电压增加,相应电流也增大,电流过大时易产生热效应可使蛋白质变性而不能分离。
2.4 电渗作用在电场中,液体对固体的相对移动,称为电渗。
如滤纸中含有表面带负电荷的羧基,溶液则向负极移动。
由于电渗现象与电泳同时存在,所以电泳的粒子移动距离也受电渗影响,如纸上电泳蛋白质移动的方向与电渗现象相反,则实际上蛋白质泳动的距离,等于电泳移动距离减去电渗距离。
如电泳方向和电渗方向一致,其蛋白质移动距离,等于二者相加。
sdspage实验报告

sdspage实验报告SDS-PAGE实验报告引言:SDS-PAGE(聚丙烯酰胺凝胶电泳)是一种常用的蛋白质分离和分析技术。
通过SDS(十二烷基硫酸钠)的作用,可以使蛋白质在电泳过程中带有负电荷,从而使其按照分子量大小在凝胶上进行分离。
本实验旨在通过SDS-PAGE技术分离和分析不同来源的蛋白质样品,探究其分子量和纯度。
材料与方法:1. 样品制备:从不同来源(如细菌、植物、动物)获得蛋白质样品,并进行样品的提取和纯化。
2. SDS-PAGE凝胶制备:根据所需分离范围选择合适的凝胶浓度,并制备上胶液和下胶液。
3. 样品处理:将样品与样品缓冲液混合,并加入还原剂和SDS。
4. 电泳条件:将样品加载到凝胶孔中,进行电泳操作。
设置适当的电压和时间。
5. 凝胶染色:将电泳后的凝胶进行染色,以可视化蛋白质带。
结果与讨论:通过SDS-PAGE技术,我们成功地分离和分析了不同来源的蛋白质样品。
在电泳过程中,蛋白质样品在电场作用下向阳极迁移,其迁移速率与其分子量成反比。
因此,我们可以根据蛋白质在凝胶上的迁移距离来推测其分子量。
观察到的凝胶图像显示出多个蛋白质带,每个带代表一个具有特定分子量的蛋白质。
通过与已知分子量标准品进行比较,我们可以推断出样品中蛋白质的分子量范围。
同时,通过比较不同来源的样品,我们可以观察到它们之间的差异。
在某些情况下,我们可能观察到一些额外的带,这可能是由于蛋白质的不同修饰或附加物所致。
例如,糖基化的蛋白质可能会在凝胶上显示出多个带,每个带代表不同程度的糖基化。
此外,我们还可以通过观察蛋白质带的强度来推断其纯度。
如果某个蛋白质带非常明亮且没有其他杂质带的干扰,那么可以认为该蛋白质具有较高的纯度。
相反,如果某个带非常弱或有其他带的干扰,那么可能表示该样品中存在其他蛋白质或杂质。
结论:通过SDS-PAGE技术,我们成功地分离和分析了不同来源的蛋白质样品。
通过观察蛋白质带的位置、分子量范围和强度,我们可以推断蛋白质的分子量和纯度。
SDS-PAGE蛋白质纯度分析

SDS-PAGE蛋白质纯度分析十二烷基硫酸钠聚丙烯酰胺凝胶电泳(英语:sodium dodecyl sulfate polyacrylamide gel electrophoresis,简称SDS-PAGE)是较常用的一种蛋白纯化分析技术。
SDS-PAGE可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离。
如果蛋白质样品中含有多个蛋白质或者纯化蛋白样品中含有其他杂蛋白,经过SDS-PAGE分离后不同的蛋白质会被分离成多个蛋白条带。
如果纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,则只显现一条蛋白条带。
由此SDS-PAGE技术可以对蛋白质样品的纯度进行分析。
SDS-PAGE分析原理SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS复合物在电泳时的迁移速度仅由蛋白质分子量决定,不同的蛋白质由于分子量的差异经过SDS-PAGE电泳后分离,再经由蛋白质染色对蛋白质分离结果进行分析。
蛋白质SDS-PAGE分析流程1. 蛋白质浓度检测2. 样品处理: 在蛋白样品中加入等量含有B-巯基乙醇的2x loading buffer,煮沸10分钟3. 电泳准备: 配置合适浓度的SDS分离胶,安装电泳槽,注入1x 电泳液4. 蛋白质样品上样:根据蛋白质浓度,取适量处理过的蛋白样品依次加入电泳孔槽内,另外取适量蛋白标准marker加入其他空余孔槽内。
5. 开始电泳: 接通电源,将电压调至120v,保持恒定电压。
6. 电泳结束剥离胶: 当溴酚蓝迁移至凝胶底部,停止电泳;将蛋白胶取出,并切去浓缩胶和分离胶底部的溴酚蓝胶条。
7. 染色: 使用R250染色液对蛋白胶染色1小时8. 脱色: 使用脱色液对染色的蛋白胶脱色至背景干净,蛋白条带清晰可见9. 拍照分析中/英文项目报告在技术报告中,百泰派克会为您提供详细的中英文双语版技术报告,报告包括:1. 实验步骤(中英文)。
蛋白质sdspage电泳实验报告

蛋白质sdspage电泳实验报告蛋白质SDS-PAGE电泳实验报告引言:蛋白质是生命体中最基本的分子之一,它们在细胞的结构和功能中起着重要的作用。
为了研究蛋白质的性质和功能,科学家们开发了许多技术和方法。
其中,SDS-PAGE电泳是一种常用的蛋白质分析方法,它通过电泳的方式将蛋白质按照其分子量大小进行分离和定量。
实验目的:本实验旨在通过SDS-PAGE电泳技术对不同来源的蛋白质进行分析,了解其分子量和纯度,并探讨其应用于蛋白质研究中的意义。
实验步骤:1. 样品制备:收集不同来源的蛋白质样品,如乳清蛋白、鸡蛋清蛋白等。
将样品加入SDS-PAGE样品缓冲液中,加热至100摄氏度,使蛋白质完全变性。
2. 准备电泳胶:根据实验需要,配制相应浓度的聚丙烯酰胺凝胶,加入TEMED和过硫酸铵使其聚合。
3. 装载样品:将变性后的蛋白质样品注入电泳胶槽中,注意不要产生气泡。
4. 电泳:将电泳胶槽连接至电源,设置合适的电压和时间,进行电泳分离。
5. 凝胶染色:将电泳胶取出,用凝胶染色剂染色,使蛋白质带可见。
6. 图像分析:使用分子量标准品作为参照,通过图像分析软件测量蛋白质带的迁移距离,计算其分子量。
实验结果:通过SDS-PAGE电泳实验,我们成功地将不同来源的蛋白质样品分离出来,并得到了清晰的蛋白质带。
根据分子量标准品的迁移距离,我们计算出了各个蛋白质样品的分子量。
讨论:1. 分子量测定:通过SDS-PAGE电泳实验,我们可以准确地测定蛋白质的分子量。
这对于研究蛋白质的结构和功能非常重要,因为不同分子量的蛋白质可能具有不同的生物活性和相互作用方式。
2. 纯度分析:通过观察电泳胶上的蛋白质带的清晰度和数量,我们可以初步评估样品的纯度。
纯度高的样品通常只有一个清晰的蛋白质带,而纯度低的样品则可能有多个模糊的带。
因此,SDS-PAGE电泳可以帮助我们选择纯度较高的蛋白质样品进行后续实验。
3. 应用前景:SDS-PAGE电泳技术在生物医学研究中有着广泛的应用前景。
sds-page测定蛋白质纯度

百泰派克生物科技
sds-page测定蛋白质纯度
SDS-PAGE是一种根据分子量分离蛋白质的凝胶电泳分析技术。
当蛋白质通过凝胶
基质电泳分离时,较小分子量的蛋白质受到来自凝胶基质的阻力更小,电泳时迁移速度更快。
影响蛋白质在凝胶基质中的迁移速率的其他因素还包括蛋白质的结构和电荷,在SDS-PAGE中,十二烷基硫酸钠(SDS,又称十二烷基硫酸钠)和聚丙烯酰胺凝胶的使用很大程度上消除了结构和电荷的影响,蛋白质的分离完全基于多肽链的长度。
蛋白质经SDS-PAGE电泳后按分子量大小分离开来,如果蛋白样品只含有一种蛋白质,那么其电泳后只会显现一个唯一的蛋白条带;但如果一个蛋白样品中含有多种大小不同的蛋白,那么电泳后不同的蛋白质会被分离成大小不同的蛋白条带。
于是,可以据此利用SDS-PAGE的分离作用进行蛋白纯度的鉴定,不仅可以分析一个未知
蛋白样品的纯度,还可以验证蛋白样品纯化后的效果。
百泰派克生物科技使用Bio-Rad Mini-PROTEAN® Tetra凝胶系统,提供基于1D和
2D的 SDS-PAGE分析服务技术包裹,用于多种蛋白质组学分析,包括蛋白质样品纯度分析、分子量测定、蛋白质鉴定、二硫键鉴定以及蛋白质定量等,欢迎免费咨询。
SDS-PAGE测定蛋白质

缓冲液
浓缩胶 分离胶
分子筛效应
分离胶的孔径小, 分离胶的孔径小,各分子由 于大小和形状不同, 于大小和形状不同,所受阻 力不同, 力不同,表现出不同的泳动 速度,即分子筛作用。 速度,即分子筛作用。分子 量小, 量小,形状为球形的泳动速 度最快。 度最快。
分离胶 浓缩胶 缓冲液
【操作方法】 操作方法】
【实验原理】 实验原理】
电泳 带电颗粒在电场作用下, 带电颗粒在电场作用下,向着与其电荷相反的电
极移动的现象。 极移动的现象。 PAGE 聚丙烯酰胺凝胶(PAG)是由单体丙烯酰胺(Acr) 聚丙烯酰胺凝胶(PAG)是由单体丙烯酰胺(Acr) 单体丙烯酰胺 和交联剂甲叉双丙烯酰胺(Bis)在加速剂四甲基乙二胺 交联剂甲叉双丙烯酰胺(Bis)在加速剂四甲基乙二胺 甲叉双丙烯酰胺(Bis) (TEMED)和催化剂过硫酸铵(AP) 的作用下聚合交联而成 TEMED) 催化剂过硫酸铵(AP) 的作用下聚合交联而成 过硫酸铵 的三维网状结构的凝胶。 的三维网状结构的凝胶。以此凝胶作为支持介质的电泳 称为PAGE PAGE具有电泳和分子筛的双重作用 PAGE。 具有电泳和分子筛的双重作用。 称为PAGE。 PAGE具有电泳和分子筛的双重作用。
4、加样 用移液器分别取10 样品液, 用移液器分别取 µl样品液,小心将样品加到凝 胶凹形样品槽底部。 做好标记。 胶凹形样品槽底部。并做好标记。 5、电泳 将电泳仪的正极与下槽连接,负极与上槽连接, 将电泳仪的正极与下槽连接,负极与上槽连接,打开 电泳仪开关,开始时电流为10 mA, 电泳仪开关,开始时电流为10 mA,待样品进入分离胶 后,将电流调至20-30 mA,当溴酚蓝染料距硅胶框1cm 将电流调至20mA,当溴酚蓝染料距硅胶框1cm 20 时,停止电泳,关闭电源。 停止电泳,关闭电源。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亲 和 层 析 原 理
GSH-Sepharose 4B
GSH- Sepharose 4B
GSH-Sepharose 4B
亲和层析流程
第一部分 实验步骤
一、细胞破碎
3600 mL诱导的菌液,离心分装到12只50 mL 离心管,-20℃保存;(每个班用2管)
每管加30 mL PBS缓冲液,混匀; 超声3S,暂停5S,持续15 min; 4℃,10000 rpm,离心10 min; 取50 uL上清,作为纯化前的样品; 每组取3-5 mL上清液,上柱纯化。
亲和层析试剂
50 mM Tris-HCl(pH 8.0): Tris(121.14)6.055 g,溶于900 mL水,用 HCl调pH到8.0,用水定容至1000 mL。
洗脱液: 还原型谷胱甘肽(307.32) 0.15366 g,溶于 50 mL 50 mM Tris-HCl(pH 8.0)中。
二、装GSH-Sepharose 4B柱
1. 清洗和装好层析柱,封闭出口; 2. 加入2 mL PBS; 3. 取1-2 mL GSH-Sepharose 4B,加入柱子中; 4. 打开柱子出口,使PBS缓慢流出。
注意:始终保持柱内的液面高于 GSH-Sepharose 4B
三、纯化目的蛋白
1. 用5 mL PBS缓冲液洗柱子,重复3遍。 2. 将混合蛋白质溶液2-3 mL加到柱子中。 3. 用5 mL PBS缓冲液洗柱子,重复3遍。 4. 加入1.0 mL 洗脱液。 5. 用1.5 mL离心管收集洗脱液,每管收集 0.2 mL(3-4
滴),共收集5管。 6. 用5 mL PBS 缓冲液洗柱子3遍,关闭出口。 7. SDS-PAGE检测第2和3管中的目的蛋白。
四、SDS-PAGE样品制备
1号:过柱前的蛋白溶液80 uL 2号:收集的蛋白溶液(2号管)80 uL 3号:收集的蛋白溶液(3号管)80 uL
1-3号分别加入20 uL 5×上样缓冲液, 混匀后在沸水中加热3 min。
量的对数呈线性关系: logMW=K-bm
连续系统:电泳体系中缓冲液pH值及凝胶浓 度相同。(电荷效应、分子筛效应)
不连续系统:缓冲液离子成分、pH、凝胶浓 度及电位梯度的不连续性。
(电荷效应、分子筛效应、浓缩效应)
浓缩效应
1. 凝胶孔径的不连续性(2种孔径) 2. 缓冲液离子成分及pH值的不连续性(2种 缓冲体系,3种pH):浓缩胶,pH6.8,蛋白 质分子的迁移率比Cl- 低,比Gly高。
纯化前
纯化后 Marker
实验试剂
蛋白质分子量标准
兔磷酸化酶B
97400
牛血清白蛋白 66200
兔肌动蛋白
43000
牛碳酸酐酶
31000
胰蛋白酶抑制剂 20100
鸡蛋清溶菌酶 14400
实验结果
绘制标准曲线:log MW = K - bm
蛋白质区带中心至分离胶上沿距离
12%分离胶
试剂名称
ddH2O 30% Acr-Bis(29:1) 1.5 mol/L Tris-HCl(pH8.8)
10% SDS TEMED(加速剂) 10% AP(催化剂,最后加)
总体积
加液量
2.5 mL 3.0 mL 2.0 mL 75 uL 10 uL 75 uL 7.5 mL
5%浓缩胶
1 2 3M 1 2 3M
样品加30 uL Marker加10 uL
亲和层析试剂
PBS(pH 7.4): NaCl(58.5)40 g;KCl(74.5)1.0 g; KH2PO4(136.09)1.2 g; Na2HPO4·12H2O (358.14)18.1 g; 加水定容到5000 mL。
浓缩效应
3. 电位梯度不连续性:快离子( Cl- )后面形 成高电位梯度区,慢离子(Gly)前面形成低 电位梯度区,高电位梯度和低电位梯度之间 的地方,形成一个稳定而不断向阳极移动的 界面,蛋白质分子在界面处浓缩成一个狭小 的中间层。
实验步骤ห้องสมุดไป่ตู้
1. 洗净玻璃板,吹干,安装制胶器; 2. 制作12%分离胶。按下表顺序加试剂,混匀,加入 玻璃板间,加液高度与电泳槽中的横杠上沿等高; 3. 用1 mL蒸馏水封住液面,室温30 min,分离胶与水 之间出现分界线,倒掉水层,用滤纸吸干残余的水; 4. 配制5%浓缩胶,混匀,加入玻璃板间,插入梳子, 静置30 min;
第二部分 SDS-PAGE检测目的蛋白质
实验目的
掌握SDS-PAGE检测蛋白原理和方法 掌握垂直板电泳的实验方法
实验原理
蛋白质与SDS按1:1.4比例形成复合物,消除 了各种蛋白质分子之间原有的电荷差异。
蛋白质的迁移速度只取决于分子大小。 在15-200 KD之间,蛋白质的迁移率和分子
6. 点样:每个样点30 uL,Marker点15 uL; 7. 电泳:100 V,约20 min,样品进入分离胶后,将电
压调到130 V,继续电泳。溴酚蓝接近胶底部时,停 止电泳;
实验步骤
8. 拆开玻璃板,切除浓缩胶,将分离胶放入塑 料盒内,加入染色液,振荡30 min; 9. 回收染色液,加水清洗,用微波炉高火煮 4-5 min,重复2-3次; 10. 观察胶中的蛋白质条带。
试剂名称 ddH2O
30% Acr-Bis(29:1) 1.5 mol/L Tris-HCl(pH6.8)
10%SDS TEMED 10%AP(最后加) 总体积
加液量 3.4 mL 0.86mL 0.62mL 50 uL 20 uL 50 uL 5.0 mL
实验步骤
5. 将胶板放入电泳槽,加入1×Tris-Gly电泳缓冲液, 轻轻拔掉梳子;
实验七 亲和层析纯化和SDS-PAGE
鉴定目的蛋白质
实验目的
掌握GST亲和层析纯化目的蛋白的原理 和实验方法(第一部分)
掌握SDS-PAGE检测目的蛋白原理和方 法(第二部分)
第一部分 GST亲和层析纯化目的蛋白
亲和层析原理
生物大分子与配体特异非共价结合。 酶-底物或底物类似物(竞争性抑制剂) 抗体-抗原 激素-受体 外源凝集素-多糖、糖蛋白、细胞表面受体 核酸-互补序列(Oligo-dT)
