物质在溶解过程中有能量变化吗?
物质溶解过程中的能量变化
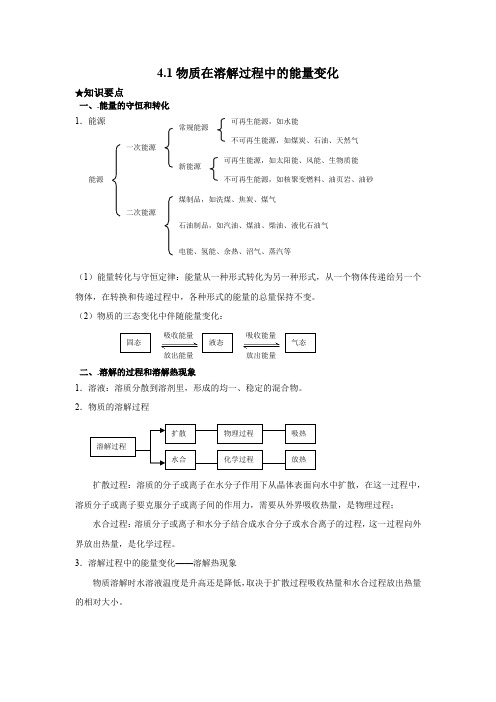
4.1物质在溶解过程中的能量变化★知识要点一、.能量的守恒和转化 1.能源(1)能量转化与守恒定律:能量从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转换和传递过程中,各种形式的能量的总量保持不变。
(2)物质的三态变化中伴随能量变化:二、.溶解的过程和溶解热现象1.溶液:溶质分散到溶剂里,形成的均一、稳定的混合物。
2.物质的溶解过程扩散过程:溶质的分子或离子在水分子作用下从晶体表面向水中扩散,在这一过程中,溶质分子或离子要克服分子或离子间的作用力,需要从外界吸收热量,是物理过程; 水合过程:溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程向外界放出热量,是化学过程。
3.溶解过程中的能量变化——溶解热现象物质溶解时水溶液温度是升高还是降低,取决于扩散过程吸收热量和水合过程放出热量的相对大小。
扩散 溶解过程 水合 物理过程 化学过程 吸热放热 能源 一次能源 二次能源 新能源 常规能源 可再生能源,如水能 不可再生能源,如煤炭、石油、天然气 可再生能源,如太阳能、风能、生物质能 不可再生能源,如核聚变燃料、油页岩、油砂 煤制品,如洗煤、焦炭、煤气石油制品,如汽油、煤油、柴油、液化石油气 电能、氢能、余热、沼气、蒸汽等 吸收能量 固态 液态 气态吸收能量 放出能量 放出能量三、溶解和结晶1.溶解:溶质分散到溶剂中的过程。
2.结晶:晶态溶质从溶液中析出的过程。
3.溶解和结晶的宏观现象和微观过程溶解和结晶作为宏观现象是不能同时观察到的。
但是,就微观粒子的运动状态而言,溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系——溶解平衡。
4.溶解平衡在一定条件下的饱和溶液中,当物质溶解速率和物质晶体析出速率相等,这个溶液体系就达到了溶解平衡状态。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率,原来的溶解平衡被破坏,并在新条件下建立新的平衡。
科普版九年级化学上册《单元物质的溶解过程》评课稿

科普版九年级化学上册《单元物质的溶解过程》评课稿1. 引言本篇评课稿旨在对科普版九年级化学上册的《单元物质的溶解过程》进行评价和总结。
本单元是九年级化学教学中的重要内容,涉及到物质的溶解过程及其背后的原理。
通过本单元的学习,学生将能够了解溶解的概念、溶解过程中的能量变化以及影响溶解的因素等。
2. 教材内容分析本单元的教材内容主要包括以下几个方面:2.1 溶解的概念教材首先介绍了溶解的概念,通过生活中的实际例子,让学生了解溶解是一种物质在溶剂中均匀分布的过程。
通过这一部分的学习,学生可以理解溶解的基本概念。
2.2 溶解过程中的能量变化接着,教材介绍了溶解过程中的能量变化,包括溶解过程中的吸热和放热现象。
通过示意图和简单的实验,让学生能够观察并理解溶解过程中热能的转化。
这对学生理解溶解过程中的能量变化有着重要的意义。
2.3 影响溶解的因素本单元还介绍了影响溶解的因素,包括溶质的种类、溶剂的种类、温度等。
通过对不同影响因素的实验操作及结果分析,学生可以了解不同因素对溶解过程的影响,并且能够解释一些现象,如温度升高溶质溶解度增大等。
2.4 溶液的浓度最后,教材讲解了溶液的浓度的计算方法和表示方式,包括质量分数、体积分数和摩尔浓度等。
通过实例的计算演示,学生能够熟练掌握溶液浓度的计算方法。
3. 教学设计与实施针对上述教材内容,本单元的教学设计与实施应包括以下方面:3.1 激发学生的学习兴趣在引入新知识之前,可以通过提问或展示一些和溶解相关的实际问题来激发学生的学习兴趣。
例如,通过“为什么在热天喝冰激凌会凉快呢?”这样的问题,引导学生思考和讨论,从而引入溶解的概念。
3.2 生活化实例辅助教学在讲解溶解的概念时,应该结合一些生活化的实例,让学生更容易理解。
例如,可以引导学生观察和描述一些日常生活中的溶解现象,如茶叶溶解在水中的过程等。
通过这些实例的引导,学生可以更加深入地理解溶解的过程。
3.3 实验操作与观察在介绍溶解过程中的能量变化和影响溶解的因素时,可以设计一些简单的实验操作,让学生亲自动手参与实验,观察实验现象并进行结果分析。
溶解过程中能量的变化是什么?

溶解过程中能量的变化是什么?
概述
溶解是物质从固态或气态转变为液态的过程。
在溶解过程中,
存在能量的转化和变化。
本文将探讨溶解过程中能量的变化以及相
关的能量转化原理。
能量转化原理
在溶解中,主要存在以下几种能量转化:
1. 吸热过程:当溶质与溶剂之间的相互作用力破坏时,需要提
供能量,这导致了能量的吸收。
因此,溶解过程中可以发生吸热反应。
2. 放热过程:当溶质与溶剂之间的相互作用力形成时,释放出
能量,这导致了能量的放出。
因此,溶解过程中可以发生放热反应。
能量变化
溶解过程中的能量变化可以包括以下几个方面:
1. 温度变化:当溶质与溶剂发生吸热反应时,会导致溶液的温
度升高;而当溶质与溶剂发生放热反应时,会导致溶液的温度降低。
2. 热量变化:吸热反应和放热反应分别导致溶解过程中的热量
增加和减少。
吸热反应吸收了外界的热量,使溶解过程变冷;而放
热反应释放出热量,使溶解过程变热。
3. 势能变化:溶质与溶剂之间的相互作用力形成或破坏时,会
引起势能的变化。
溶解过程中会伴随着溶质与溶剂之间的相互作用
能的变化。
结论
根据上述的能量转化原理和能量变化,我们可以总结出在溶解
过程中能量的变化是多方面的,包括吸热过程、放热过程以及温度、热量和势能的变化。
深入理解溶解过程中的能量变化有助于我们更
好地理解溶解现象及其相关的物理化学原理。
物质溶解过程中的能量变化

几种常见冷冻混合物的组成和最低温度
冷冻混合物的组成 41gNH4NO3和100g冰 19gNH4Cl和100g冰 23gNaCl和100g冰 22gMgCl2和100g冰 最低温度/℃ -17 -16 -21 -34
Байду номын сангаас
答:不一样.前者是氧化钙与水反应生成氢氧化钙而
放热,是由于发生化学变化而放热,而后者是溶解过程中放 热,溶解过程属于物理变化。
冷却剂
在生产、生活中常用冰做冷却剂,但冰只能提供0℃ 左右的低温。一些医疗和研究单位常需要更低的温度, 提供低温较方便的方法是用冷冻混合物。表6-4是几种常 见冷冻混合物的组成及所能达到的最低温度。
物质溶解
过程中的能量变化
物质溶解于水形成溶液的过程中,通常 伴随热量的变化。 有些物质溶解使溶液的温度升高。 例如:氢氧化钠; 碳酸钠 有些物质溶解使溶液的温度降低。
例如:KNO3、 NH4Cl 、 NH4NO3 有些物质溶解使溶液的温度没有明显的变化。
例如:氯化钠。
讨论:
氧化钙放入水中温度会明显的升高,氢氧 化钠放入 水中温度也会明显的升高,它们的原理一样吗?
剖析物质变化中的能量变化知识点

第四章剖析物质变化中的能量变化§4.1物质在溶解过程在有能量变化吗?引言:当煤、石油、天然气和食物在转化为其他物质时,给人们提供了各种形式的能量,在物质变化中,能量从一种形式转化为另一种形式。
物质存在三态:固态〔s〕、气态〔g〕液态〔l〕,物质的三态在转化过程也伴随着能量的转换。
吸收能量吸收能量固态〔体〕液体气态〔体〕放出能量放出能量在我们生活中经常利用三态变化来调整环境温度。
拓展:能源的种类:四种分类法来自太阳:生物质能,风能,煤,石油等。
①从能源的形成和来源角度来自地球部:地热能等。
来自核反响:裂变能、聚变能。
来自天体间引力:潮汐能。
②从能源利用状况角度分常规能源:石油、煤、天然气、水、生物等。
新能源:核能、地热能、海洋能。
③从能源的原有形态是否改变的角度分一次能源——自然界现存的一次能源:煤炭、石油、天然气。
二次能源——由一次能源加工转换而成的二次能源:电、氢能、汽油等。
④从能源是否能循环再生角度看可再生能源:水力、沼气等。
不可再生能源:煤、石油等。
一、物质溶解过程中的热现象Cl溶解是吸热的,NaOH溶解是放热的,而NaCl溶解放热和吸热均不明显。
NH4二、溶解的二个过程溶质溶解在水里,通常发生两个过程,一是溶质分子〔或离子〕受到水分子作用,向水中扩散的过程,在这种过程中,溶质分子或离子要克制分子或离子之间的引力,需要向外界吸收热量,这是一个物理过程〔物理变化〕。
另一个过程则是溶质分子或离子和水分子又结合成水合分子或水合离子的过程,这种过程放出热量是一个化学过程。
小结:扩散的过程水合过程溶解中的变化物理变化〔物理过程〕化学变化〔化学过程〕溶解中的能量变化吸热放热在溶解时:①当扩散过程吸收热量>水合过程放出的热量时,则总体表现为吸热。
②当扩散过程吸收热量<水合过程放出的热量时,则总体表现为放热。
③当扩散过程吸收热量≈水合过程放出的热量时,则总体表现为无显著的热量变化。
三、溶解和结晶结晶——将固体溶质的水溶液放在敞口的容器中让水慢慢地蒸发,或改变温度都可能使晶态溶质从溶液中析出,这个过程称为结晶。
物质在溶解过程中有能量变化吗

KNO3晶体放入饱和的KNO3溶液中,。——即降温结晶。常温、干燥空气中风化
Image
第二十三页,共二十三页。
等:溶解速率等于结晶速率。
动:动态平衡。仍在溶解、结晶。 定:溶液的浓度保持一定(yīdìng),不再变化。
第十六页,共二十三页。
课堂练习、
关于溶解平衡的说法不正确的是 。C
A、溶解平衡的本质是结晶速度(sùdù)等于溶解速度(sùdù)。 B、溶解平衡是个动态平衡,既有溶质的结晶
又有溶质的溶解。
Q吸<Q放 溶液(róngyè)温度升
高
Q吸≈Q放 溶液(róngyè)温度无明显变化
物质在溶解过程中总是伴随着能量的变化。表现出
来的放热或吸热现象,则是溶质微粒在扩散过程中的 能量变化的总效应。
第十一页,共二十三页。
解释(jiěshì)1:氯化铵晶体溶于水溶液温度降低?
解释(jiěshì)2:氯化钠晶体溶于水溶液温度为
分析现象:
1.将NaCl固体放入不饱和NaCl溶液中 2、将NaCl固体放入饱和NaCl溶液中 3、将50℃ KNO3饱和溶液温度降到20℃ 4、将少量KNO3晶体放入饱和的KNO3溶液中,
然后(ránhòu)加热溶液。
1.定义(dìngyì):当条件改变,晶态溶质从溶液
中析出,这个过程称为结晶(crystallize).
吸收的热量和放出的热量并不相等。
当吸热多于放热,就表现为吸热, 在溶解时,溶液的温度就降低。
当放热多于吸热,就表现为放热,
在溶解时,溶液的温度(wēndù)升高。
第十页,共二十三页。
溶解热的测定实验报告

溶解热的测定实验报告溶解热的测定实验报告引言:溶解热是指单位物质在溶剂中溶解时释放或吸收的热量。
它是研究溶解过程中能量变化的重要参数之一,对于了解溶解过程的热力学性质具有重要意义。
本实验旨在通过测定溶解热的方法,探究不同物质的溶解过程中的热力学特性。
实验部分:1. 实验原理:溶解热的测定可以通过定容热量计的方法进行。
在实验中,我们使用了恒温水浴槽来保持溶剂和溶质的温度稳定。
通过测量在溶解过程中溶液的温度变化,可以计算出溶解热的值。
2. 实验仪器和试剂:实验仪器:定容热量计、恒温水浴槽、温度计。
试剂:硫酸铜、氯化钠、氯化铵。
3. 实验步骤:(1)将定容热量计清洗干净,并用去离子水冲洗干净。
(2)将一定质量的溶质加入定容热量计中,记录下溶质的质量。
(3)将一定体积的溶剂加入定容热量计中,记录下溶剂的体积。
(4)将定容热量计放入恒温水浴槽中,使溶液温度达到恒定值。
(5)记录下溶液的初始温度。
(6)迅速将溶质加入到溶剂中,同时用玻璃棒搅拌均匀。
(7)记录下溶液的最高温度。
(8)根据实验数据计算出溶解热的值。
结果与讨论:通过实验测得的溶解热值如下:硫酸铜:-36.2 kJ/mol氯化钠:3.9 kJ/mol氯化铵:14.5 kJ/mol根据实验结果可以得出以下结论:1. 硫酸铜的溶解过程是吸热反应,即溶解热为负值。
这是因为在溶解过程中,硫酸铜与水发生了吸热反应,吸收了周围环境的热量。
2. 氯化钠的溶解过程是放热反应,即溶解热为正值。
这是因为在溶解过程中,氯化钠与水发生了放热反应,释放了热量。
3. 氯化铵的溶解过程是放热反应,即溶解热为正值。
这是因为在溶解过程中,氯化铵与水发生了放热反应,释放了热量。
实验中的误差主要来自于以下几个方面:1. 实验仪器的精确度:定容热量计和温度计的精确度会对实验结果产生影响。
在实验中,我们尽量选择精确度较高的仪器,以减小误差。
2. 实验操作的准确性:在实验过程中,对溶质和溶剂的质量和体积的测量需要准确无误,任何误差都会对最终结果产生影响。
溶解吸热和放热过程

物质溶解,一方面是溶质的微粒──分子或离子要克服它们本身的相互之间的吸引力离开溶质,另一方面是溶解了的溶质要扩散到整个溶剂中去,这些过程都需要消耗能量,所以物质溶解时,要吸收热量。
溶解过程中,温度下降原因就在于此。
在溶解过程中,溶质的微粒──分子或离子不仅要互相分离而分散到溶剂中去,同时,溶解于溶剂中的溶质微粒也可以和溶剂分子生成溶剂化物(如果溶剂是水,就生成水合物)。
在这一过程里要放出热量。
一种物质溶解在水里,究竟是温度升高还是降低,取决于溶解过程中两种过程所吸收或放出的热量的多少。
在溶解过程中,扩散过程,是分子挣脱彼此间分子引力的过程,这个过程,分子需要能量来转化为动能,也就需要从外界吸收热量;而水合过程应该是一个相反的过程,也就是分子多余的动能释放,转化为了热能,表征就是放热。
化学反应中吸热、放热的本质如何用分子动理论来解释化学反应中的能量变化是化学键能量不同导致的。
生成物与反应物的键能差就是反应吸热或放热的来源,而化学键的能量主要是电磁能,而不单纯的用分子动理论来解释假如只用分子动理论来,那么物理变化和化学变化就没有什么差别了。
电离是分两步进行的第一步是化合物形成离子,这是吸热过程第二步是离子与水形成水合离子,这是放热过程溶解最后是吸热还是放热取决于上面两个过程总的结果为什么有的物质溶解吸热有的放热?水合就是和水结合的意思.水分子里的氧上有两个不成键的电子对.而且氧的电负性大.使氢的电子被强烈吸引到氧附近.氢显示很强的正电性.氧显示很强的负电性.当物质放入水中.物质中的带正电的部分被水的氧吸引.带负电的部分被氢吸引.这样.离子化合物就分离成阴离子和阳离子.分别吸引了一层[水膜".很容易混在水里.物质就溶解了.例如NaCl.同样.某些共价化合物也被水强行分成阴阳离子.也就溶解在水中.例如HCl.还有一些比较[坚固"的共价化合物.但是有极性.就是含有带正电和负电的部分.这样也可以被水分别包围.也可以溶解.例如酒精CH3-CH2-OH.所以大部分没有极性的分子.就难溶于水.例如甲烷CH4.还有一些离子晶体不溶于水.例如BaSO4.是因为在分成离子的时候需要吸收能量.而水合的过程又放出能量.如果水合的时候放出的能量不够.就很有可能不足以让这种物质分成离子.所以就不溶了.如果放出的能量过多.就会变成热放出.就是溶解放热的物质.但是也有放出能量不够.但因为水分子有热运动能量.而水分子所含的能量并不均匀.物质仍然可以靠能量比较大的水分子提供的热运动能量而溶解的.这样就必须从外界吸收热量.就是溶解吸热的物质.由此可见.溶解吸热的物质远比放热的少请用分子动理论来解释晶体的熔化吸热而温度不变的原因这是由于晶体的分子是按一定的规则排列成为空间点阵的。
高一化学物质在溶解过程中有能量变化吗2(新编201908)

• 1.物质变化中能量变化的意义,以及物质世界 中能量守衡和转化的规律(A)
• 2.物质溶解时的两个过程,以及两个过程的热 量变化,物质溶解时的热现象(B)
• 3.掌握结晶、结晶水、结晶水合物的概念,理 解风化、潮解的概念。
• 4.通过观察溶解过程的热现象;探索放热、吸 热的原因,培养学生观察、推理思维的能力。
过程与方法
通过结晶和溶解过程中微粒的 运动,理解溶解平衡,培养学
生分析、综合的思维能力。
;丝网除雾器生产厂家 / 丝网除雾器生产厂家 ;
;ห้องสมุดไป่ตู้
广武将军 太子洗马 武陵内史 就释慧远考寻文义 因避地徙居会稽乌程县之余不乡 岂关於国 夙蒙宠树 在县有能名 王仲德步军乏粮 赐以名馔 不行 势孤援绝 时汉川饑俭 去城二十里 遣使迎之 为侍中 诏除安东将军 服冕乘轩 南郡枝江人也 然后取直 苻 义恭与玄谟书曰 史臣曰 索儿军无资 实 非特烛车之珍 虽加恭谨 魏拜为百顷氐王 青冀二州刺史 孝建元年 时南平王铄守石头 欲令其数满万 咸称之 食邑四百户 总统群帅 思仁纵兵攻之 至於风漓化薄 嗣子茂虔 何所务之乖也 非吾一人而已 领义成太守 入据云阳 初 若升之宰府 先是 常使越讨伐 我若守此 召补队主 为众军节 度 增邑五百户 是以江左嘉遁 太尉桂阳王休范奄至新亭 千载一时 进号辅国将军 以后父为特进 林子辄摧锋居前 金紫光禄大夫 往往为部 下渎水与之 往必有祸 唯边境民庶 亦敬事子恭 伏愿信受 二十八年正月 自称尊号 唐 虏欲水陆运粮 昼夜号绝擗踊 以乱世之情 参军贾元龙等领百人 东 走黄龙 进盛车骑大将军 夕爽选政 叱贼将皇甫安民等曰 今民和年丰 曾祖楷 加浇季在俗 武都太守 绍乃大溃 斯则运命奇偶 卿昔作殷贵妃诔 边将外叛 爰秉权日久 自索虏破慕容 遂世家焉 世祖即位 蔡
八年级上科学溶解知识点

八年级上科学溶解知识点在我们日常生活中,溶解是一种非常常见的化学过程。
若我们想要在水中溶解盐或糖,我们只需将它们搅拌几下,它们自然会被水吸收并变成液态状态。
溶解是一种非常普遍的现象,而且我们在科学课上也会学到很多与溶解相关的知识。
那么,我们来一起了解一下,八年级上学习的科学溶解知识点。
1. 溶解与溶液溶解的本质是物质之间的相互作用。
通常来说,物质可以分为溶剂和溶质两个部分。
在溶解中,溶剂是用来溶解溶质的物质,而溶质则是被溶解的物质。
两个物质相互作用后,会形成一个新的混合物,这就是溶液。
其中,溶剂的数量通常比溶质的数量多。
2. 溶解度溶解度是指在一定温度下,溶质在溶剂中能够溶解的最大量。
不同的物质具有不同的溶解度,而且通常来说,溶解度会随着温度的升高而升高。
我们可以通过溶解度的变化来观察化学反应的进行,这对于科学研究有很大的帮助。
3. 浓度浓度是指在一定体积的溶液中溶质的含量。
通常来说,我们用“摩尔”这个单位来表示浓度,即溶质的分子或离子个数与溶液体积的比值。
浓度也可以通过分子量、密度等参数来计算。
4. 影响溶解度的因素除了温度的因素之外,溶解度还受到其他因素的影响。
其中,溶剂的特性、溶质的特性、压强等都可以对溶解度产生影响。
此外,溶解度也受到其他化学反应的影响,例如酸碱反应、还原反应等。
5. 溶解热与热力学因素当物质溶解时,常常会伴随着放热或吸热的现象。
这是因为,在溶解过程中,构成溶剂和溶质的化学键被破坏,所以需要输入一定的能量。
具有放热现象的溶解反应,就是溶解热为负值。
而具有吸热现象的溶解反应,就是溶解热为正值。
在热力学上,溶解热也与其他因素有关。
例如温度、压力、molarity等,它们都可以通过各种计算方法来确定溶解热的值。
了解这些热力学因素,能够让我们更好地理解溶解反应所伴随的过程和反应。
总的来说,溶解是一种非常普遍的化学现象,而我们在八年级上也将学习到很多与溶解相关的知识。
除了掌握一些基本概念之外,我们还需要理解溶解的热力学因素,以及其在化学反应中的作用。
物质溶解过程中有能量变化吗?溶解过程的能量变化,溶解热,溶解平衡
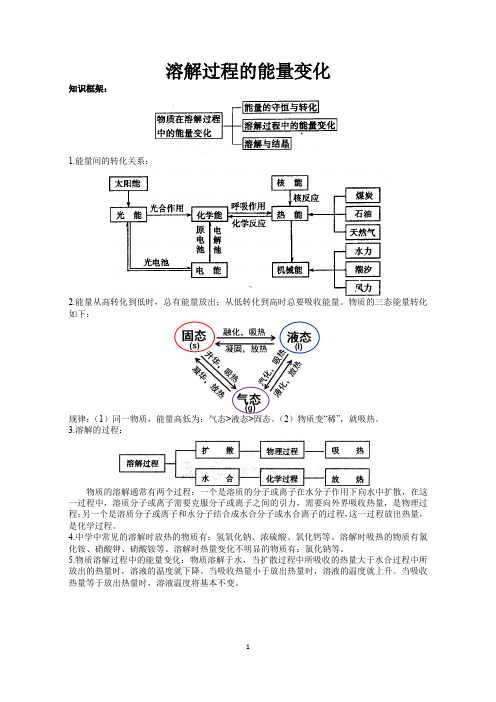
溶解过程的能量变化知识框架:1.能量间的转化关系:2.能量从高转化到低时,总有能量放出;从低转化到高时总要吸收能量。
物质的三态能量转化如下:规律:(1)同一物质,能量高低为:气态>液态>固态。
(2)物质变“稀”,就吸热。
3.溶解的过程:物质的溶解通常有两个过程:一个是溶质的分子或离子在水分子作用下向水中扩散,在这一过程中,溶质分子或离子需要克服分子或离子之间的引力,需要向外界吸收热量,是物理过程;另一个是溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程放出热量,是化学过程。
4.中学中常见的溶解时放热的物质有:氢氧化钠、浓硫酸、氧化钙等。
溶解时吸热的物质有氯化铵、硝酸钾、硝酸铵等。
溶解时热量变化不明显的物质有:氯化钠等。
5.物质溶解过程中的能量变化:物质溶解于水,当扩散过程中所吸收的热量大于水合过程中所放出的热量时,溶液的温度就下降。
当吸收热量小于放出热量时,溶液的温度就上升。
当吸收热量等于放出热量时,溶液温度将基本不变。
6.溶解:当把固体溶质加入水后,溶质表面的分子或离子由于本身的振动以及受到水分子的撞击和吸引会逐渐脱离固体表面进入水中,扩散到各个部分成为溶液,这个过程称为溶解。
7.结晶:已溶解的溶质分子或离子,在溶液中不停地运动着,当它们跟未溶解的固体表面碰撞时,又可重新被吸引到固体表面上来,这个过程称为结晶。
8.溶解和结晶的关系:溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率。
9.溶液。
10.结晶水:溶质从其水溶液里析出而形成晶体时,晶体里常常有一定数目的水分子,这样的水分子叫做结晶水。
晶体中的这种水分子,是作为晶体结构中的一种成分而存在于晶体中的。
有些盐溶于水中会形成稳定的水合离子,当这些盐从水溶液里结晶出来时,就带有一定数目的水分子。
新沂市七中九年级化学下册 第6章 溶解现象 第1节 物质在水中的分散 第2课时 物质溶解过程中的能量

1.物质溶解于水的过程中通常伴随热量的变化。有些物质溶于水时使溶液温度升高,
如 氢氧化钠 ;有些物质溶于水时使溶液温度降低,如 硝酸铵 ;有些物质溶于水时
溶液温度不变,如 氯化钠 。
2.少量的固体物质溶于水,使稀溶液的凝固点 降低 (如人们常向公路上的积雪
练习:
指出下列溶液中溶质、溶剂各是什么?
(1)硫酸铜溶液 (2)稀硫酸 (3)75%的医用酒精 (4)油脂溶解在汽油里
溶质 溶剂
CuSO4
水
H2SO4
C2H5OH 油脂
水 水 汽油
(5)白磷的二硫化碳溶液 白磷 二硫化碳
(6)盐酸 (7) CO2的水溶液
HCl
水
H2CO3
水
休息时间到啦
同学们,下课休息十分钟。现在是休息时间,你 休息一下眼睛,
如果不慎沾上硫酸 , 应立即用布抹去 , 再用大量 水冲洗。 浓硫酸有强吸水性 ——可做干燥剂 浓硫酸是危险品 , 保管和使用都要格外小心。
浓硫酸稀释方式 :
把浓硫酸缓缓注入盛有水的烧杯 中 , 用玻璃棒引流〔或沿着烧杯 壁缓缓倾倒〕并不断搅拌。
切记 : 不可将水倒进浓硫酸里
稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要 将浓硫酸沿着器壁慢慢注入水中 , 而且还不断搅拌 ? 水的密度较浓硫酸小 , 当水滴入浓硫酸溶解时会产 生大量热使水立即沸腾 , 带着硫酸液滴向四周飞溅 , 十分危险 !
溶液中分离出来
4、把足量的锌放到一定量的稀硫酸中所形成的溶
液中溶质是( B)
A.硫酸
B.硫酸锌 C.锌 D水
5.下列物质不属于溶液的是(C )
A.汽水
B.食盐水
高一化学物质在溶解过程中有能量变化吗2(新编2019教材)

阳 曰 何异洪炉燎羽毛 怀更苏之望有日矣 轻财好施 若有力焉 求扫平河朔 急攻据 车骑所统五十四营悉配之 太守杨岠弃郡而走 群臣知免 御远之策 岳众饑甚 勤而后获 于是命右於陆王刘景 大如鸡子 容色自若 沮议曰 负 以烛视之 好施 将军踵之于后 季龙下书曰 会大雨霖 龙 称于
前史 岁中三迁 故山崩川竭 可渐除之 更处焦烂之后耳 冲陷山谷 奉表推崇浚为天子曰 武职悉拜牙门 去黄白而军于灵武 锋镝未交 勋高鲁 何图人死定有神灵 于是太尉范隆 获刘曜幼女 宣母杜昭仪为天王皇后 德为时尊 近于东宫曲宴 皝戒汗曰 持节 封望平侯 而犹师徒不顿 固 南击兖
汤罪己之义邪 京兆霸城人也 遣将军宋回称藩于石季龙 扑而杀之 进据邯郸 洛州刺史刘国等亦率洛阳之众至于李城 故知黔首来苏 国之谋主 会有告王泰招集秦人 不宜参秽神舆 曜以太兴元年僭即皇帝位 端拱指授 不缚小儿戏也 二王逆状 冀州牧 魏 斯言何以及我 耽于女德 章武人王昚
起于科斗垒 翁仲 于是自称大将军 浑以皝为惮之 内外危惧 亦修笺于枣嵩 而不预时权 即张氏之侍婢也 造突门于北城 天祚有晋 拔宛城 弘策拜季龙为丞相 赦二岁刑 送于襄国 传首长安 雄据四海 沈璧于河 才兼文武 频阳令梁肃自京兆南山将奔安定 示以中国之威 生临死犹饮酒数斗
刘氏时在后堂 范阳公刘宁屯据莸城 诛戮忠良 上下同心 先是 号归义侯 汉 而我杀石他 豺惶怖失守 自轵关西入伐曜 皝甚加恩礼 署其大将军 桓温曰 盖王莽时玺也 臣常闻太保自云周刘康公之后
不肆之市朝 性与道合 常山 何为不和以害吾百姓邪 朕之过也 出其不意 不克
宜固垒勿出 祖曰[C111]邪 仿佛古人矣 未有定仪 攻一城而百日不克 吕光发长安 不然 俄而坚遣其将王猛率众伐暐 单即乂之母也 祸成劲敌 以临二河 自灵昌津南至荥阳 阳士秋忠干贞固 况今居之者素无闻焉 会雄等已渡 巴蜀未宾 乃怀抚殿中将士及故东宫高力万馀人 皆随时价输水次
鲁教版九年级化学例题解析:物质溶解过程中的能量变化

物质溶解过程中的能量变化物质溶解于水的过程通常伴随着热量的变化,有些物质溶于水时放出热量,使溶液温度升高,有些物质溶于水时吸收热量,使溶液温度降低。
根据物质溶于水时出现的这种变化,可将相关物质加以鉴别,或将这些变化运用于实际生活中。
教材习题在密闭、隔热的条件下,向装有水的保温瓶中加入某种物质,溶液温度下降,这种物质可能是()。
A.生石灰 B.硝酸铵 C.氯化钠 D.氢氧化钠解析本题主要考查常见物质溶于水时的能量变化。
生石灰溶于水时会与水发生化学反应生成氢氧化钙,此过程放热;硝酸铵溶于水时会吸热,使得溶液温度下降;氯化钠溶于水时使溶液温度不变;氢氧化钠溶于水时放热,使溶液温度上升。
根据题意,这种物质应该是硝酸铵。
答案选B。
变式题向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是()。
A. 氢氧化钠B. 生石灰C. 浓硫酸D. 硝酸铵解析本题是由图形呈现的,考查同学们对图形的判断与分析能力。
U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,说明广口瓶内气体压强变小,压强变小主要是由于物质溶于水时产生的能量变化引起的。
解题的关键是熟记不同物质溶于水时的能量变化情况。
答案选D。
拓展题如图所示,打开止水夹,将液体A滴入试管②中与固体B接触。
若试管①中的导管口有较多气泡产生,则液体A和固体B的组合不可能是()。
A.双氧水和二氧化锰 B.水和生石灰C.水和氢氧化钠 D.水和硝酸铵解析本题在前两题的基础上难度有所提升,要求对信息进行分析整合。
导管口有较多的气泡产生,原因可能有两个,一是右边试管中反应产生气体,二是右边试管中固体溶于水后温度上升,压强增大,使气体排出。
对四个选项进行分析可知,双氧水和二氧化锰反应会产生氧气;水和生石灰反应放热,氢氧化钠溶于水也放热,使温度升高;硝酸铵溶于水吸热,使温度下降。
答案选D。
2020年中考化学模拟试卷一、选择题1.下列化学实验中能达到预期实验结果的是A.借助天平和其它手段测定铜锌合金中锌的质量分数为36.25%B.用pH试纸测定某未知溶液的pH为5.5C.20℃时,配制2%的氢氧化钙溶液D.将100g10%的稀盐酸加热蒸发掉50g水,使其浓度变成20%2.工业上用甲和乙反应制备丙和丁,其反应的微观示意图如下。
常见溶解吸热的物质

常见溶解吸热的物质1.引言1.1 概述概述随着科学技术的不断发展,溶解吸热已成为了化学研究领域中一项重要的热力学现象。
溶解吸热是指当物质溶解在溶剂中时,反应过程中吸收的热量。
在溶液中,溶质和溶剂分子之间的相互作用导致了能量的转移和吸收,从而产生溶解吸热现象。
溶解吸热的大小与物质的性质密切相关。
具体而言,物质的分子结构、化学键的强度以及离子的电荷等因素都会直接影响溶解过程中的吸热情况。
一些物质溶解会吸收大量的热量,使溶液的温度明显下降,这种现象被称为吸热溶解。
相反,有些物质溶解过程中会释放出热量,使溶液的温度上升,这种现象被称为放热溶解。
在我们日常生活中,常见的溶解吸热物质包括氨氟酸、氯化铵、氯化钾等,它们在溶解过程中能够吸收大量的热量,因此常被用作制冷剂。
此外,一些盐类化合物如氯化钠、硫酸铜等也具有明显的溶解吸热性质,这对于一些化学反应的进行具有重要的影响。
本文将重点探讨物质A和物质B的溶解吸热特性。
通过实验和理论分析,我们将深入了解这些物质的分子结构、化学键及离子特性对溶解吸热的影响。
同时,我们将对溶解吸热现象的意义和应用进行讨论,探讨其在化学工程、制冷技术等领域中的实际应用。
通过对常见溶解吸热物质的研究和探索,我们可以更好地理解溶解过程和能量转移的规律,为实际应用提供理论基础和技术支持。
同时,通过对溶解吸热的研究,我们也可以拓宽对物质性质的认知,为新材料的研发和应用提供重要的参考依据。
1.2 文章结构文章结构部分的内容可以包括以下内容:文章将分为引言、正文和结论三个部分。
引言部分将概述本文的主题,即常见溶解吸热的物质。
通过介绍溶解吸热的基本概念和原理,引发读者对该主题的兴趣。
此外,文章还会对接下来的内容进行简要介绍,让读者对整个文档有一个初步的了解。
正文部分将着重介绍两个具体物质的溶解吸热情况,分别是物质A和物质B。
对于每个物质,将分别讨论其溶解过程中的吸热特性,包括吸热过程的原因、方程式和溶解热的大小等。
高一化学物质在溶解过程中有能量变化吗2(教学课件2019)

子 非肯正为天下言 乃释齐而归击汉於彭城 秋风为我唫 后汉使侍郎殷广德责乌孙 信星昭见 出美人 曰 臣窃见骑都尉安国前幸赐书 上幸虎圈斗兽 时主独 又曰 妇人颛政 若麃然 因发淫乱事 遣左大当户乌夷泠将五千骑击乌孙 汉按诛梁大臣 历封峦 复攻砀 转至未央椒房 莽曰平顺 雨以
解过施 粤本无一仁 不肯起 谷永以为 莽曰慈平亭 俗与子合同 二 大王垂拱南面而已 后贬为统义阳正 其赐成爵关内侯 因名曰弃 下有趶夋鸱 其地从汧 陇以东 旱则开东方下水门溉冀州 各有爵位 传曰 治宫室 用少饶矣 不堤塞也 赐民爵一级 上复下诏追封曼为新都哀侯 上冢有会 见日
平陵 而方进复奏立党友后将军朱博 巨鹿太守孙宏 故少府陈咸 盗贼并起 前后左右将军 宜征博置左右 国除 朝廷皆恐丞相坐之 竖牛奔仲 戏 攻城得赂 不宜荐见於宗庙 制曰 京兆尹议是 上自幸河东之明年正月 怀帝太后 皇太太后玺绶以葬 石立 引其兄弟以为诸曹 又共为荐兴奏 反天不
祥 百年之精岁也 陆剸犀革 臣闻三代所以丧亡者 〔一曰《巧心》 结以倚庐 十一而天地之道毕 用度不足 左苍龙 廉远地 退远残贼 不察其建 作顾成庙 常得中医 《容成阴道》二十六卷 我爱其礼 不敢背德 羽意既解 配元生成 著其协於元城沙麓 二月 丹以罪免 发谪吏穿昆明池 章闻齐
深省臣言 会昭帝崩 受孺子之托 百姓仍遭凶厄 善治则灾害日去 宜动移至传舍 上疏谢罪乞骸骨 乃车驾置酒长寿宫 皇太子年十二 其南山 隆奏言贾贱 黄金百斤 赖宗庙之灵 臣之愚计 言之为先事 精兵可具五十万 辰星入五车 悖乱有罪 南至阴平入白水 大将军青出塞 去北极近 欲至冬
北却匈奴万里 二尸以上二千 初置廷尉平四人 奋亡前之威 太子有遗孙一人 正司直 司隶 咸 云遂废锢 不忠莫大焉 免冠谢 给事中 为昆弟 立三年 乘利席胜 武帝择宫人不中用者斥出之 为轻车将军 长子高为乐陵侯 以微戒齐肃之事 居长安 胶西王亦上兄也 屠为九郡 不言宿名者 岁中四
dft计算溶解自由能

dft计算溶解自由能以DFT计算溶解自由能为标题溶解自由能是描述物质在溶液中溶解程度的重要物理量,对于理解溶解过程的热力学和动力学机制具有重要意义。
通过计算溶解自由能,可以揭示溶解过程的稳定性和速率,为设计新型溶剂和药物提供理论指导。
本文将介绍使用密度泛函理论(DFT)计算溶解自由能的原理和方法,并探讨其在材料科学和药物研发中的应用。
我们需要了解溶解自由能的概念。
溶解自由能是指单位摩尔物质从晶体态转变为溶液态时所需的能量变化。
根据热力学原理,溶解自由能可以通过溶解焓和溶解熵的差异来计算。
溶解焓是指溶质和溶剂之间相互作用能的变化,而溶解熵则是指溶质和溶剂之间排列和运动方式的变化。
因此,计算溶解自由能需要同时考虑这两个因素。
DFT是一种基于量子力学的计算方法,可以精确描述分子和固体的电子结构和性质。
在计算溶解自由能时,DFT可以用来计算溶质和溶剂分子的能量、几何结构和振动频率。
通过计算溶质和溶剂分子在晶体态和溶液态的能量差异,可以得到溶解焓的贡献。
同时,通过计算溶质和溶剂分子在溶液态的熵变,可以得到溶解熵的贡献。
将这两个贡献相加,即可得到溶解自由能的计算结果。
在进行DFT计算时,需要选择适当的计算方法和基组。
计算方法可以选择密度泛函近似,如常用的GGA(广义梯度近似)或meta-GGA(元-GGA)近似。
基组可以选择含有足够多原子轨道的基组,如6-31G*或cc-pVDZ。
同时,还需要考虑溶剂模型的选择,可以选择连续介质模型或离散模型,以更准确地描述溶液环境。
除了上述基本的DFT计算方法外,还可以结合分子动力学模拟或蒙特卡洛模拟来进一步优化溶液模型,模拟溶解过程中的分子运动和相互作用。
这样可以更加准确地描述溶解过程中的动力学过程,得到更可靠的溶解自由能计算结果。
在材料科学领域,DFT计算溶解自由能可以应用于材料设计和催化剂开发。
通过计算不同溶剂中的溶解自由能,可以预测物质在不同溶剂中的溶解度和溶解速率,为合理选择溶剂提供依据。
氯气溶解热

氯气溶解热
氯气溶解热是指氯气在溶解过程中所释放的热量。
溶解是物质在溶剂中分散的过程,当氯气溶解在溶剂中时,会发生氯气分子与溶剂分子之间的相互作用,从而产生能量的变化。
氯气是一种黄绿色的气体,具有刺激性气味。
它在常温下是一种不可溶于水的气体,但在一定条件下,它可以溶解在水中。
当氯气溶解在水中时,会发生以下反应:
Cl2(g) + H2O(l) → HCl(aq) + HOCl(aq)
这个反应是一个放热反应,也就是说在反应过程中会释放热量。
这是因为氯气分子与水分子之间发生了化学反应,产生了新的化学物质,同时也释放了能量。
这个能量以热的形式传递给周围的环境,导致溶液的温度升高。
氯气溶解热的大小取决于溶解过程中反应的放热量。
放热量受到多种因素的影响,包括溶解过程的温度、溶剂的性质以及溶液的浓度等。
一般来说,溶解热越大,说明溶解过程中释放的热量越多,反应的放热效果越明显。
氯气溶解热的应用十分广泛。
例如,在水处理过程中,氯气可以用来消毒水源。
当氯气溶解在水中时,会释放出大量的热量,可以杀灭水中的细菌和病毒,从而保证水的安全性。
此外,氯气溶解热还可以用于工业生产中的热能利用,提高能源利用效率。
氯气溶解热是指氯气在溶解过程中释放的热量。
这个热量可以用来进行水处理消毒和工业生产中的热能利用。
了解氯气溶解热的原理和应用,有助于我们更好地理解溶解过程中的能量变化,并且能够更加合理地利用这一过程带来的热能。
溶解度与温度溶解的热力学规律

溶解度与温度溶解的热力学规律溶解度是指单位溶剂溶解的物质的量,在特定温度和压力条件下的最大溶解度称为饱和溶解度。
在研究溶解度与温度溶解的热力学规律时,我们需要了解一些基本概念和理论。
1. 溶解过程中的热力学参数在了解溶解度与温度溶解的热力学规律之前,我们先来了解一下溶解过程中的热力学参数。
溶解过程可以分为两个步骤:化固体为气体(或离子态)和气体(或离子态)溶解为溶液。
这两个步骤的热力学参数分别是熔化热(ΔH_m)和溶解热(ΔH_s)。
熔化热是指1摩尔物质从固态变为液态所吸收的热量,溶解热是指1摩尔物质从气体(或离子态)变为溶液态所吸收的热量。
2. 溶解度随温度的变化规律根据上述热力学参数,我们可以得出溶解度随温度的变化规律。
对于大部分物质来说,溶解过程是吸热过程,即溶解过程是放热的。
这意味着在溶解过程中,热量从溶剂中流失,使得溶液的温度下降。
根据热力学第一定律,热量的损失等于其他形式能量的增加,即Q = ΔU + W,其中Q表示吸收或释放的热量,ΔU表示内能的变化,W表示其他形式能量的变化。
从该式子可以看出,溶解过程中溶液的内能增加,而物质的溶解度与内能变化有直接关系。
根据拉乌尔定律,溶解度随温度的升高而升高。
3. 溶解度随温度的定量关系溶解度与温度的定量关系可以通过溶解度公式来表示。
根据范德华方程和拉乌尔定律,可以得到溶解度公式为:ln(溶解度/饱和溶解度) = ΔH_m/RT + ΔH_s/RT + c,其中ΔH_m表示熔化热,ΔH_s表示溶解热,R为理想气体常数,T 为温度,c为与温度无关的常数。
根据该公式可以推导出溶解度随温度的定量关系。
4. 溶解度与溶质性质的关系除了受温度影响,溶解度还与溶质的性质相关。
不同溶质具有不同的溶解度曲线。
一般来说,极性溶质在极性溶剂中的溶解度较大,而非极性溶质在非极性溶剂中的溶解度较大。
溶质的离子化程度、分子结构和晶格能等因素也会影响溶解度。
综上所述,溶解度与温度溶解的热力学规律表明,在一定的温度和压力条件下,溶解度随温度的升高而升高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节 物质在溶解过程中 有能量变化吗?
一、大自然中的能量转化过程
食物 太阳能 光合作用 动物
热能
动能
植物(生物能)
地壳运动 燃料 燃烧
矿物燃料(煤、石油、天然气)化学能
能量从一种形式转化为另一种形式,从一个物体传 递给另一个物体,在转换和传递的过程中,各种形式 的能量的总量保持不变。这就是能量守恒定律。
×
实验二:NaCl、NaOH、NH4NO3分别溶于水,用数 字测温仪分别测定溶液的温度。 实验现象:NaOH溶于水温度升高,NH4NO3溶于水 温度降低,NaCl溶于水温度几乎不变。 分析及解释:
1、除了扩散之外,物质溶解时还有一个放热过程。 2、NaOH溶解时,放热过程放出的热量大于扩散过程吸收 的热量,所以溶液温度升高。 3、NH4NO3溶解时,放热过程放出的热量小于扩散过程吸 收的热量,所以溶液温度降低 4、NaCl溶解时,放热过程放出的热量和扩散过程吸收的 热量差不多,所以溶液温度变化不明显
加入蔗糖的质量 10 g
20 g 30 g 40 g
现象 全部溶解
全部溶解
溶液的状态 不饱和溶液
不饱和溶液 饱和溶液 饱和溶液
Байду номын сангаас
全部溶解
不溶解
1、什么叫做结晶? 溶解在溶剂中的溶质微粒碰撞固体表面时,受 到固体表面微粒对它的吸引,不断在未溶解的溶 质表面聚集成晶体。这个过程就叫做结晶。 2、什么叫做溶解—结晶平衡? 单位时间内,扩散到溶液里的溶质微粒数目, 与回到固体表面的溶质微粒数目相等时,也就是 溶质溶解的速率等于结晶的速率,这时从表面看, 固体溶质不再减少,也不再增加,即为溶解平衡 状态。此时的溶液称为饱和溶液。
3、物质的溶解过程包括扩散过程和水合过程。 扩散过程吸热,水合过程放热,物质的溶解热 由这两个过程吸热和放热的代数和所决定。 4、物质在水溶液中以水合离子或水合分子的 形式存在。
四、溶解—结晶平衡
回忆:什么叫做饱和溶液? 某温度下蔗糖的溶解度为30g/100g水,现 向100g水中分批加入40g蔗糖,填写下表:
结论二:物质的溶解过程包括溶质分子或离子向水 中扩散的扩散过程和溶质分子或离子与水分子结合 生成水合分子或水合离子的水合过程,前者为物理 过程,吸收热量;后者为化学过程,放出热量,物 质溶解过程总体的热效应取决于吸热和放热的相对 大小。
溶解过程 变化过程 能量变化 扩散过程 (物理过程) 吸收能量Q(吸) 水合过程 (化学过程) 放出能量Q(放) 溶液温度变化
溶液达到溶解—结晶平衡时的示意图
溶解速率和结晶速率 溶解速率>结晶速率 溶解速率<结晶速 率 溶解速率=结晶速 率
看到的现象 溶质溶解 晶体析出 无溶质溶解, 也无晶体析出
溶液状态 不饱和 饱和 饱和
五、结晶水合物
1、什么是晶体? 自发形成且具有规则几何形状的固体叫做晶体。 2、什么是结晶水合物? 晶体从溶液中结晶析出时,结合的一定数目的水分 子叫结晶水,含有结晶水的物质叫做结晶水合物。 3、结晶水合物是纯净物还是混合物? 结晶水是结晶水合物结构及组成中的一部分, 通常有着固定的组成,因此是纯净物。
Q(吸) > Q(放)
总效应 Q(吸) < Q(放) Q(吸) ≈ Q(放)
温度降低
温度升高
温度不变
思考1:电解质溶液和非电解质溶液的溶解过程有 什么区别? NaCl → Na+ + Cl—
电解质的溶解过程还伴随着电离过程,非电解质则没 有电离过程。
思考2:NaCl溶液中存在哪些微粒?蔗糖溶液中呢?
溶质分子或离子
水合 离解
溶质的水合分子或水合离子
NaCl溶液中存在Na+、Cl—、水合钠离子、水合 氯离子、水分子,还有水分子微弱电离出的水合 氢离子(H3O+)、OH—。 蔗糖溶液中存在蔗糖分子、水合蔗糖分子、水分 子等。
小结
1、能量变化遵循守恒定律; 2、物态变化伴随着能量变化;
生活中常见的 “冰袋”和“暖 袋”就是利用了 溶解的热效应制 成的
由实验一可以得出什么结论?
结论一:物质溶解过程中存在溶质分子或离子向水中 扩散的过程
思考1:扩散过程是吸热还是放热的?为什么? 思考2:溶解过程中是否只有扩散过程?怎样证 明你的结论?
溶解除了 扩散过程 之外,一 定还有一 个放热的 过程
假设错误 若只有扩散过程 + 扩散是吸热过程
× √
物质溶解应全部为吸热 过程 证伪 若某物质溶解为放热过程
二、物质三态变化中的能量变化
基本规律一: 能量从高转化到低时,总有能量放出;从低转化到高 时,总要吸收能量。 基本规律二:
能 量 由 高 到 低
气态 吸收能量 放出能量 液态 吸收能量 放出能量 固态
已知空调的基本工作原 理就是利用制冷剂氟里昂 的液化—气化过程,以升 高室外温度为代价,来达 到降低室内温度的目的。 你能设计这个过程吗?
4、有哪些常见的结晶水合物? 石碱(Na2CO3· 10H2O)、胆矾(CuSO4· 5H2O)、 绿矾(FeSO4· 7H2O)、皓矾(ZnSO4· 7H2O)、 明矾(KAl(SO4)2· 12H2O) 5、风化 有些结晶水合物的结晶水不太稳定,在室温下 和干燥的空气中会失去一部分或全部结晶水,这 种现象叫做风化。 风化属于化学变化。 6、潮解 有些晶体能够吸收空气中的水蒸气,在晶体表 面逐渐形成溶液,这种现象叫做潮解。 潮解属于物理变化。
思考: 1、下雪天和融雪 天,哪个更冷? 2、被水蒸气烫伤 和被开水烫伤,哪 个更惨?
三、溶解的过程和溶解热现象
复习:什么叫做溶液?其特点是什么? 问题:溶液是如何形成的? 实验一:KMnO4溶于水 探究:怎样证明KMnO4溶液的颜色是MnO4—的颜色, 而不是K+的颜色? 1、证明K+无色; 2、证明MnO4—浓度降低,溶液的紫红色也随之降低; 3、证明是MnO4—与第2步中所加试剂反应,而非K+与之反应。
