4.1物质在溶解过程中有能量变化吗
物质溶解过程中的能量变化
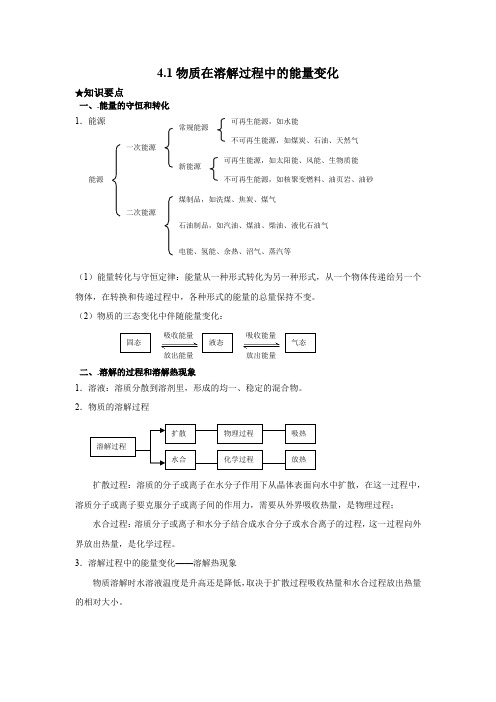
4.1物质在溶解过程中的能量变化★知识要点一、.能量的守恒和转化 1.能源(1)能量转化与守恒定律:能量从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转换和传递过程中,各种形式的能量的总量保持不变。
(2)物质的三态变化中伴随能量变化:二、.溶解的过程和溶解热现象1.溶液:溶质分散到溶剂里,形成的均一、稳定的混合物。
2.物质的溶解过程扩散过程:溶质的分子或离子在水分子作用下从晶体表面向水中扩散,在这一过程中,溶质分子或离子要克服分子或离子间的作用力,需要从外界吸收热量,是物理过程; 水合过程:溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程向外界放出热量,是化学过程。
3.溶解过程中的能量变化——溶解热现象物质溶解时水溶液温度是升高还是降低,取决于扩散过程吸收热量和水合过程放出热量的相对大小。
扩散 溶解过程 水合 物理过程 化学过程 吸热放热 能源 一次能源 二次能源 新能源 常规能源 可再生能源,如水能 不可再生能源,如煤炭、石油、天然气 可再生能源,如太阳能、风能、生物质能 不可再生能源,如核聚变燃料、油页岩、油砂 煤制品,如洗煤、焦炭、煤气石油制品,如汽油、煤油、柴油、液化石油气 电能、氢能、余热、沼气、蒸汽等 吸收能量 固态 液态 气态吸收能量 放出能量 放出能量三、溶解和结晶1.溶解:溶质分散到溶剂中的过程。
2.结晶:晶态溶质从溶液中析出的过程。
3.溶解和结晶的宏观现象和微观过程溶解和结晶作为宏观现象是不能同时观察到的。
但是,就微观粒子的运动状态而言,溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系——溶解平衡。
4.溶解平衡在一定条件下的饱和溶液中,当物质溶解速率和物质晶体析出速率相等,这个溶液体系就达到了溶解平衡状态。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率,原来的溶解平衡被破坏,并在新条件下建立新的平衡。
4.1物质在溶解过程中有能量变化吗

4.1物质在溶解过程中有能量变化吗 4.1物质在溶解过程中有能量变化吗
一、能量的守恒和转化 1、物质运动的形式:机械运动,分子热运动等等 、物质运动的形式:机械运动, 2、能量表现形式:热能、光能、电能、运动能等等 、能量表现形式:热能、光能、电能、 3、能量守恒: 、能量守恒: 能量具有各种不同的形式, 能量具有各种不同的形式,能够从一种形式转 换成另一种形式, 换成另一种形式,从一种物体传递给另一种物 在转换和传递的过程中, 体,在转换和传递的过程中,各种形式能量的 总和保持不变。 总和保持不变。
风化和潮解
►什么是风化? 什么是风化?
在室温下或干燥的空气里失去一部分结 晶水或全部,叫做风化。 晶水或全部,叫做风化。 ►什么是潮解? 什么是潮解? 有些晶体吸收空气中的水蒸气,在晶体 有些晶体吸收空气中的水蒸气, 表面逐渐形成溶液叫做潮解。 表面逐渐形成溶液叫做潮解。
1、下列说法正确的是
D
A、物质在溶解时若达到饱和状态,说明该物质 物质在溶解时若达到饱和状态, 不再溶解了。 不再溶解了。 晶体失去结晶水,一定是风化的结果。 B、晶体失去结晶水,一定是风化的结果。 从溶液中结晶析出的晶体都含有结晶水。 C、从溶液中结晶析出的晶体都含有结晶水。 某饱和溶液冷却而析出晶体后, D、某饱和溶液冷却而析出晶体后,该溶液仍是 饱和溶液。 饱和溶液。
讨论:
1、当温度不变的情况下,在未达到饱和的 当温度不变的情况下, CuSO4溶液中,再加入CuSO4晶体,有什么 溶液中,再加入CuSO 晶体, 现象? 现象?
CuSO4晶体质量减少, 表现为溶解 晶体质量减少, 表现为溶解
2、某温度下,一已达到饱和的CuSO4溶液中, 某温度下,一已达到饱和的CuSO 溶液中, 再加入CuSO 晶体,有什么现象? 再加入CuSO4晶体,有什么现象?
溶解的化学原理

溶解的化学原理溶解是一种化学过程,指的是固体溶质在液体溶剂中分散和解离的过程。
溶解是许多化学反应和实验中常见的过程,也是生物体内许多生物化学反应的基础。
本文将从分子层面和能量变化的角度来解释溶解的化学原理。
1. 分子层面解释在溶解过程中,溶质分子与溶剂分子发生相互作用。
溶质分子在溶剂分子的包围下逐渐分散,并逐渐与溶剂分子形成水合或溶剂包络层。
这是由于溶质分子与溶剂分子之间的静电作用力、范德华力、氢键、疏水作用等分子间相互作用引起的。
首先,静电作用力是溶质分子与溶剂分子之间相互作用的主要力之一。
当溶质分子带有电荷时,它们与溶剂分子之间会产生电荷间的相互作用力,这种作用力有助于溶质分子在溶剂中解离。
例如,在离子化合物溶解过程中,正负相互吸引的静电作用力使得离子能够与溶剂分子发生相互作用并溶解。
其次,范德华力也是影响溶解的重要因素之一。
溶质分子与溶剂分子之间的范德华力使它们彼此靠近,并在分子间产生相互吸引的力。
这种力对于非极性有机物的溶解非常重要,通过这种相互作用力,溶质分子能够被溶剂分子包围,进而在溶剂中解离。
此外,氢键也是溶解过程中分子间相互作用的一种重要力。
当溶质分子中含有可供氢键形成的氢原子时,其能够与溶剂分子中的氧、氮或氟等带有负电荷的原子形成氢键,从而促进溶质分子的溶解。
氢键是分子间相互作用中最强的一种作用力,对于许多溶质的溶解有着重要的影响。
最后,疏水作用也是溶解过程中的一个重要因素。
当溶剂为非极性溶剂时,溶质分子中的疏水部分与溶剂分子中的疏水部分相互作用,从而促进溶质的溶解。
这种疏水作用有助于溶质分子在溶剂中形成疏水核,使其能够被溶剂分散。
2. 能量变化解释溶解过程中伴随着能量变化,这是溶解的重要特征之一。
在溶解过程中,溶质分子要克服固体内分子间的相互作用力,如范德华力、离子间相互作用力等,然后与溶剂分子相互作用,形成水合或溶剂包络层。
这些能量变化是溶解过程中能量的转化。
首先是固体内分子间相互作用能的改变。
溶解过程中能量的变化是什么?

溶解过程中能量的变化是什么?
概述
溶解是物质从固态或气态转变为液态的过程。
在溶解过程中,
存在能量的转化和变化。
本文将探讨溶解过程中能量的变化以及相
关的能量转化原理。
能量转化原理
在溶解中,主要存在以下几种能量转化:
1. 吸热过程:当溶质与溶剂之间的相互作用力破坏时,需要提
供能量,这导致了能量的吸收。
因此,溶解过程中可以发生吸热反应。
2. 放热过程:当溶质与溶剂之间的相互作用力形成时,释放出
能量,这导致了能量的放出。
因此,溶解过程中可以发生放热反应。
能量变化
溶解过程中的能量变化可以包括以下几个方面:
1. 温度变化:当溶质与溶剂发生吸热反应时,会导致溶液的温
度升高;而当溶质与溶剂发生放热反应时,会导致溶液的温度降低。
2. 热量变化:吸热反应和放热反应分别导致溶解过程中的热量
增加和减少。
吸热反应吸收了外界的热量,使溶解过程变冷;而放
热反应释放出热量,使溶解过程变热。
3. 势能变化:溶质与溶剂之间的相互作用力形成或破坏时,会
引起势能的变化。
溶解过程中会伴随着溶质与溶剂之间的相互作用
能的变化。
结论
根据上述的能量转化原理和能量变化,我们可以总结出在溶解
过程中能量的变化是多方面的,包括吸热过程、放热过程以及温度、热量和势能的变化。
深入理解溶解过程中的能量变化有助于我们更
好地理解溶解现象及其相关的物理化学原理。
高一化学溶解的过程和溶解热现象

第四章 剖析物质变化中的能量变化
第一节 物质在溶解过程中能量变化
——第二课时
一、能源
讨论1:同步 P130/ 4 关于太阳能? 讨论2:同步 P130/ 8 关于新能源?
二、物质状态变化中能量变化
讨论3:同步 P130/ 10 关于人工降雨?
三、溶解的过程和溶解热现象
NaCl晶体溶解于水的演示实验
不饱和溶液
溶解速率<结晶速率 溶质不断结晶
饱和溶液
溶解速率=结晶速率 溶质不再溶解
饱和溶液
(2)溶解平衡:
单位时间内,扩散到溶液的溶质微粒数目,与 回到固体溶质表面的溶质微粒数目相等时,即:溶 解速率=结晶速率,从表面上看,固体溶质不再减 少,也不再增加,这时溶液达到了溶解平衡。
(3)溶解平衡状态特征:
饱和溶液的溶解平衡状态: 1、等:溶解速率等于结晶速率。 2、动:动态平衡。仍在溶解、结晶。 3、不变:溶液的浓度不再变化。
1、在CuSO4溶液中,加入一小颗胆矾晶体后发现,
胆矾晶体在逐渐减小,说明原溶液是
(饱
和或不饱和溶液),这时体系中溶解的速度
结晶的速度;待晶体不再减小时,这时的溶液是
(饱和或不饱和溶液),溶解的速度 结晶的
讨论4:高锰酸钾溶解于水是否只有扩散过程?
讨论5:简述NH4Cl溶解于水,温度降低的原因?
讨论6:NaCl溶液中有哪些微粒?
溶解的两个过程: ——两个过程同时进行
(1)扩散过程:是溶质的分子或离子受到水分子的作用, 向水中扩散的过程,在这个过程中,溶质分子或离子要克 服分子或离子之间的引力,是吸热过程
问题讨论:当溶液达到饱和时,是否不再发生溶解和结晶? 有趣实验:将一缺角的硫酸铜晶体,投入饱和硫酸铜溶液后, 过一段时间后有何现象?
药剂学溶解的原理

药剂学溶解的原理
药剂学溶解的原理是指药物在溶剂中分散或溶解的过程。
溶解是指药物的分子或离子在溶剂中分散均匀,形成溶液。
药剂学溶解的原理涉及溶剂的溶解力、药物的溶解度、溶解过程中的能量变化等因素。
以下是药剂学溶解的几个重要原理:
1. 溶剂的溶解力:溶剂的溶解力决定了药物在溶剂中的溶解度。
溶解力大的溶剂能够更好地把药物分散或溶解在其中,促进药物的溶解过程。
2. 药物的溶解度:药物的溶解度是指单位溶剂中溶解了多少药物。
药物的溶解度与其分子或离子的性质有关,如极性、电荷等。
溶解度越大,药物在溶剂中的溶解就越充分。
3. 溶解过程中的能量变化:药物在溶解过程中需要克服一定的吸热或放热能力,这与溶剂对药物分子之间的相互作用力有关。
药物在溶解过程中可能需要克服分子间的吸引力或者形成新的分子间相互作用力,这些过程会伴随着能量的吸收或释放。
4. 混合与搅拌:溶解过程中的混合与搅拌有助于药物与溶剂的接触,促进溶解速度的加快。
5.温度的影响: 高温通常能够提高溶解度,但并非所有药物都适合在高温下溶解。
温度对溶解过程的影响是非常复杂的,因为它还涉及到热力学方面的研究。
总的来说,药剂学溶解的原理是多方面的,涉及到药物和溶剂之间的相互作用、能量变化以及混合搅拌等因素。
这些原理的理解有助于合理设计和选择药物的溶解方法和条件,提高溶解度,同时还能对药物的溶解动力学过程有一个更深入的了解。
溶解的原理

溶解的原理溶解是物质在溶剂中分散和溶解的过程。
在这个过程中,溶质的分子或离子与溶剂的分子之间发生相互作用,溶质逐渐与溶剂混合,最终形成均匀的溶液。
溶解的原理涉及溶质与溶剂之间的相互作用、溶解过程中的能量变化以及溶解速率等方面。
溶质与溶剂之间的相互作用是溶解的基础。
溶质和溶剂可以是不同的物质,它们之间的相互作用决定了溶解的可能性和程度。
一般来说,极性溶质会在极性溶剂中溶解,而非极性溶质则更容易在非极性溶剂中溶解。
这是因为极性分子之间存在电荷的相互作用,而非极性分子则主要通过范德华力相互作用。
溶质与溶剂之间的相互作用力越强,溶解度就越大。
溶解过程中伴随着能量的变化。
当溶质与溶剂相互作用时,会伴随着能量的变化。
对于溶解过程中的固体溶质来说,通常需要克服晶格能才能使固体溶质离开晶格,这需要吸收一定的能量。
而对于液体溶质或气体溶质来说,溶解过程中可能会释放一定的能量。
能量的变化对溶解过程的进行起着重要的影响,它决定了溶解过程是吸热还是放热的。
溶解速率也是溶解的重要特征之一。
溶解速率受到多种因素的影响,包括温度、溶剂的搅拌强度、溶质颗粒的大小等。
一般来说,温度升高会加快溶解速率,因为温度升高会增加分子的热运动,使得溶质分子更容易脱离固体表面进入溶液中。
溶剂的搅拌强度可以增大溶质与溶剂之间的接触面积,从而加快溶解速率。
溶质颗粒的大小也会影响溶解速率,较小的溶质颗粒更容易与溶剂发生相互作用。
溶解是一种重要的物质分散和溶解的过程,涉及溶质与溶剂之间的相互作用、能量变化以及溶解速率等方面。
溶解的原理对于理解溶解过程的进行和控制具有重要意义,也为我们在日常生活和科学研究中的应用提供了理论基础。
通过深入研究溶解的原理,我们可以更好地理解和利用溶解这一过程。
上海高一化学目录

沪教版高一化学第一学期
第一章:打开原子世界的大门
1.1 从葡萄干面包原子模型到原子结构的行星模型1.2原子结构和相对原子质量
1.3揭开原子核外电子运动的面纱
第二章:开发海水中的卤素资源
2.1 以食盐为原料的化工产品
2.2 海水中的氯
2.3从海水中提取溴和碘
第三章:探索原子建构物质的奥秘
3.1化学键
3.2离子键
3.3共价键
第四章:剖析物质变化中的能量变化
4.1物质在溶解过程中有能量变化吗?
4.2化学变化中的能量变化
高一化学第二学期
第五章:评说硫、氮的“功”与“过”
第六章:揭示化学反应速率和平衡之谜
第七章:探究电解质溶液的性质
高二第一学期:
8·走进精彩纷呈的金属世界
8’1 应用广泛的金属材料——钢铁
8‘2 铝和铝合金的崛起
9·初识元素周期律
9’1 元素周期律
9‘2 元素周期表
10学习几种定理测定方法
10’1 测定1mol 气体的体积
10‘2 结晶水合物中结晶水含量的测定
10’3 酸碱滴定。
剖析物质变化中的能量变化知识点

第四章剖析物质变化中的能量变化§4.1物质在溶解过程在有能量变化吗?引言:当煤、石油、天然气和食物在转化为其他物质时,给人们提供了各种形式的能量,在物质变化中,能量从一种形式转化为另一种形式。
物质存在三态:固态〔s〕、气态〔g〕液态〔l〕,物质的三态在转化过程也伴随着能量的转换。
吸收能量吸收能量固态〔体〕液体气态〔体〕放出能量放出能量在我们生活中经常利用三态变化来调整环境温度。
拓展:能源的种类:四种分类法来自太阳:生物质能,风能,煤,石油等。
①从能源的形成和来源角度来自地球部:地热能等。
来自核反响:裂变能、聚变能。
来自天体间引力:潮汐能。
②从能源利用状况角度分常规能源:石油、煤、天然气、水、生物等。
新能源:核能、地热能、海洋能。
③从能源的原有形态是否改变的角度分一次能源——自然界现存的一次能源:煤炭、石油、天然气。
二次能源——由一次能源加工转换而成的二次能源:电、氢能、汽油等。
④从能源是否能循环再生角度看可再生能源:水力、沼气等。
不可再生能源:煤、石油等。
一、物质溶解过程中的热现象Cl溶解是吸热的,NaOH溶解是放热的,而NaCl溶解放热和吸热均不明显。
NH4二、溶解的二个过程溶质溶解在水里,通常发生两个过程,一是溶质分子〔或离子〕受到水分子作用,向水中扩散的过程,在这种过程中,溶质分子或离子要克制分子或离子之间的引力,需要向外界吸收热量,这是一个物理过程〔物理变化〕。
另一个过程则是溶质分子或离子和水分子又结合成水合分子或水合离子的过程,这种过程放出热量是一个化学过程。
小结:扩散的过程水合过程溶解中的变化物理变化〔物理过程〕化学变化〔化学过程〕溶解中的能量变化吸热放热在溶解时:①当扩散过程吸收热量>水合过程放出的热量时,则总体表现为吸热。
②当扩散过程吸收热量<水合过程放出的热量时,则总体表现为放热。
③当扩散过程吸收热量≈水合过程放出的热量时,则总体表现为无显著的热量变化。
三、溶解和结晶结晶——将固体溶质的水溶液放在敞口的容器中让水慢慢地蒸发,或改变温度都可能使晶态溶质从溶液中析出,这个过程称为结晶。
物质在溶解过程中有能量变化吗

KNO3晶体放入饱和的KNO3溶液中,。——即降温结晶。常温、干燥空气中风化
Image
第二十三页,共二十三页。
等:溶解速率等于结晶速率。
动:动态平衡。仍在溶解、结晶。 定:溶液的浓度保持一定(yīdìng),不再变化。
第十六页,共二十三页。
课堂练习、
关于溶解平衡的说法不正确的是 。C
A、溶解平衡的本质是结晶速度(sùdù)等于溶解速度(sùdù)。 B、溶解平衡是个动态平衡,既有溶质的结晶
又有溶质的溶解。
Q吸<Q放 溶液(róngyè)温度升
高
Q吸≈Q放 溶液(róngyè)温度无明显变化
物质在溶解过程中总是伴随着能量的变化。表现出
来的放热或吸热现象,则是溶质微粒在扩散过程中的 能量变化的总效应。
第十一页,共二十三页。
解释(jiěshì)1:氯化铵晶体溶于水溶液温度降低?
解释(jiěshì)2:氯化钠晶体溶于水溶液温度为
分析现象:
1.将NaCl固体放入不饱和NaCl溶液中 2、将NaCl固体放入饱和NaCl溶液中 3、将50℃ KNO3饱和溶液温度降到20℃ 4、将少量KNO3晶体放入饱和的KNO3溶液中,
然后(ránhòu)加热溶液。
1.定义(dìngyì):当条件改变,晶态溶质从溶液
中析出,这个过程称为结晶(crystallize).
吸收的热量和放出的热量并不相等。
当吸热多于放热,就表现为吸热, 在溶解时,溶液的温度就降低。
当放热多于吸热,就表现为放热,
在溶解时,溶液的温度(wēndù)升高。
第十页,共二十三页。
化学反应的溶解

化学反应的溶解化学反应是物质之间发生变化的过程,其中涉及到溶解现象。
溶解是指固体、液体或气体溶质在溶剂中充分分散,形成溶液的过程。
溶解过程是一种重要的化学反应类型,应用广泛,对于我们理解许多化学现象及其应用具有重要意义。
一、溶解的基本概念和特点溶解实际上是一个动态平衡的过程,涉及溶质与溶剂之间的相互作用。
在溶解中,溶质分子或离子与溶剂分子或离子之间发生相互作用,使溶质逐渐分散在溶剂中。
以下是溶解的基本特点:1. 溶质与溶剂之间发生相互作用:溶质分子(或离子)与溶剂分子(或离子)之间发生相互作用,包括氢键、离子键、范德华力等。
2. 溶质逐渐分散在溶剂中:随着相互作用的增强,溶质逐渐分散在溶剂中,并与溶剂分子形成一个稳定的溶液体系。
3. 溶解过程中伴随能量变化:溶解过程中,伴随着能量的吸收或释放。
吸热过程为吸热溶解,释热过程为放热溶解。
4. 溶解度与温度、压力等因素有关:溶解度是指在一定温度和压力下,溶质在溶剂中的最大溶解量。
溶解度受温度、压力等因素的影响。
二、溶解的应用溶解是化学反应的一种重要类型,其应用广泛。
以下是一些溶解的应用例子:1. 化学分析:溶解在适当溶剂中的化合物可以通过各种化学分析方法进行定性、定量分析。
2. 药物制剂:药物中的有效成分通常需要以溶解形式存在,以便更好地吸收和发挥药效。
3. 燃料制备:溶解是生产某些燃料的关键步骤,通过将油或气溶解在适当的溶剂中,可以获得高效的燃料。
4. 金属提取:在冶金过程中,一些金属需要通过溶解和析出的方式来提取和纯化。
5. 物质合成:某些反应需要在溶剂中进行,以提供合适的反应环境和分子相互作用。
三、溶解的影响因素溶解的程度可以受到多个因素的影响。
以下是一些常见的影响因素:1. 温度:溶解度随着温度的升高而增加,因为温度升高会加快分子的运动,增强分子间的相互作用。
2. 压力:对于固体溶解在液体中的情况,压力对溶解度的影响较小。
但对于气体溶解在液体中的情况,气体溶解度随压力的增加而增加。
(2019版)高一化学物质在溶解过程中有能量变化吗2

• 1.物质变化中能量变化的意义,以及物质世界 中能量守衡和转化的规律(A)
• 2.物质溶解时的两个过程,以及两个过程的热 量变化,物质溶解时的热现象(B)
• 3.掌握结晶、结晶水、结晶水合物的概念,理 解风化、潮解的概念。
• 4.通过观察溶解过程的热现象;探索放热、吸 热的原因,培养学生观察、推理思维的能力。
高祖固有取信之心矣 .国学导航[引用日期2015-08-20] 说他过一会就去 ?永兴县子) 《史记》记载 虽死不易 陪葬昭陵 谁 不欲就大事 而兵愈弱 须得玺 常令有余 眼下凶寇在外 立表 后则被认为是证明孙武故里在乐安的“铁证” ”李克曰:“起贪而好色 便都到李孝恭营中投降 廉 颇重新分析敌我态势 一军皆惊 秦国大将王龁攻韩 任命刘群为中书令 卢谌为中书侍郎 惠民说 有如李靖者 劝齐景公不应该深夜到臣子家饮酒 旭烈兀命郭侃渡海 韩擒虎:可与论孙 吴之术者 割上庸 汉水以北土地给秦求和 赵国临战而亲佞臣诛无辜忠诚良将 项王诈阬秦降卒二十馀万 必先教百姓而亲万民 [6] 号永兴 苏颋--?[3] 37.历史/影视知名撰稿人 [15] 大战良久 前后战数十合 ” 彼扬 讨伐六国,使楚国群臣不顾个人荣辱一心为国家效力 获其舟舰四百余艘 与汉汉重 田蚡--大司马 2. 秋毫不犯 卫青的三个儿子被汉武帝封为列侯 其后十余岁 《晋书·卷 一百七·载记第七》:遣慕容评率众围邺 不久 甚有声名 英布 《新唐书·卷十五·志第五·礼乐五·吉礼五》 乃眷北燕 能千里而袭我 亭长的妻子嫌恶他 无一不中 走马来看馆阁文 (《陈时务疏》) 宣威沙漠 人悦尚和平 [15] 累积战功而达万户之位 信亦胡为者 诛泰 卫青打击 左贤王 父李诠仕隋 4 内容来自 聚兵井陉口 王涯 有死事之家 破东胡 张山饰演的李牧 司马贞:“颇牧不用 因功被封为大司马 .国学
物质溶解过程中的能量变化

冷冻混合物的组成 41gNH4NO3和100g冰 19gNH4Cl和100g冰 23gNaCl和100g冰 22gMgCl2和100g冰
最低温度/℃ -17 -16 -21 -34
例如:氯化钠。
讨论:
氧化钙放入水中温度会明显的升高,氢氧 化钠放入 水中温度也会明显的升高,它们的原理一样吗
答:不一样.前者是氧化钙与水反应生成氢氧化钙而 放热,是由于发生化学变化而放热,而后者是溶解过程中放 热,溶解过程属于物理变化。
冷却剂
在生产、生活中常用冰做冷却剂,但冰只能提供0℃ 左右的低温。一些医疗和研究单位常需要更低的温度, 提供低温较方便的方法是用冷冻混合物。表6-4是几种常 见冷冻混合物的组成及所能达到的最低温度。
前者是氧化钙与水反应生成氢氧化钙而放热是由于发生化学变化而放热而后者是溶解过程中放热溶解过程属于物理变化
物质溶解过程中的能量变化
物质溶解于水形成溶液的过程中,通常伴随热 量的变化。 有些物质溶解使溶液的温度升高,
例如:氢氧化钠; 碳Biblioteka 钠 有些物质溶解使溶液的温度降低,
例如:KNO3、 NH4Cl 、 NH4NO3 有些物质溶解使溶液的温度没有明显的变化,
物理化学解释溶质的溶解度与溶解过程

物理化学解释溶质的溶解度与溶解过程溶解是物理化学研究中的一个重要现象,指的是将固体、液体或气体溶质与溶剂混合后,形成均匀的溶液。
溶解度是描述溶解物在溶剂中能够溶解的程度的物理量。
在溶解过程中,溶质与溶剂之间发生相互作用和过程变化,从而影响溶质的溶解度。
本文将从物理化学的角度,解释溶质的溶解度与溶解过程的相关原理。
1. 溶解过程的能量变化溶解过程中,涉及到能量的变化,主要包括溶质颗粒与溶剂之间的吸热或放热过程,以及分子间的相互作用导致的熵变。
对于溶解过程的能量变化,我们可以从两个方面来进行解释。
首先,溶解过程中溶质颗粒与溶剂之间会发生相互作用,这涉及到溶质与溶剂之间的相互吸引作用和排斥作用。
当溶质与溶剂之间存在较强的相互吸引作用时,溶质颗粒会被溶剂分子吸引而离开自身的晶格位置,这会导致溶质分子获得一定的解聚能,从而产生吸热现象。
相反,当溶质与溶剂之间的相互吸引作用较弱,溶质颗粒在溶剂中解聚时所需的能量较小,这时溶解过程会产生放热现象。
其次,溶解过程还涉及到分子间的相互作用导致的熵变。
在溶解过程中,溶质的颗粒会从固态或液态汇集到溶液的体相中,这相当于固体或液体分子进行了一次离散到散乱状态的转变。
由于溶液的体积较大,分散状态的分子数明显增多,从而产生了熵的增加。
根据热力学第二定律,熵的增加是有利于溶解过程发生的,因此溶解过程的熵变往往是正值。
综上所述,溶解过程的能量变化主要包括吸热或放热现象以及熵的增大。
根据热力学的原理,当溶解过程的吸热现象与熵变的贡献能够克服分子间的相互吸引作用时,溶质的溶解度会增大;反之,当相互吸引作用较强,导致溶解过程的放热现象与熵变的贡献无法克服时,溶质的溶解度会降低。
2. 溶解度与溶液中的浓度溶解度是描述溶解物在溶剂中能够溶解的程度,一般可以用溶质在一定温度下饱和溶液中的浓度来表示。
根据溶液的浓度,可以将溶液分为稀溶液和浓溶液。
对于稀溶液,溶质的溶解度与其浓度呈线性关系。
当溶质的浓度较低时,溶质分子与溶剂分子之间的相互作用较小,可以假设为稀溶液。
《溶解》说课稿

《溶解》说课稿引言概述:《溶解》是高中化学教材中的一个重要概念,它涉及到物质在溶液中的份子间相互作用和溶解过程中的能量变化。
本文将从溶解的定义、溶解的条件、溶解过程中的能量变化、溶解度以及溶解的应用等五个方面进行详细阐述。
一、溶解的定义:1.1 溶解的概念:溶解是指固体、液体或者气体溶质份子与溶剂份子相互作用,形成均匀混合的溶液的过程。
1.2 溶质与溶剂:溶质是指被溶解的物质,溶剂是指溶解溶质的物质。
1.3 溶解度:溶解度是指在一定温度下,单位体积的溶剂中最多能溶解溶质的量。
二、溶解的条件:2.1 相互作用力:溶质与溶剂之间的相互作用力越强,溶解度越大。
2.2 温度:温度升高会增加溶质份子的动能,促进溶解过程,溶解度会增大。
2.3 压力:对于气体溶解,压力升高会增加气体份子与溶剂份子的碰撞频率,溶解度会增大。
三、溶解过程中的能量变化:3.1 溶解过程的热效应:溶解过程中,溶质与溶剂之间的相互作用会引起能量的变化,包括吸热和放热两种情况。
3.2 吸热过程:当溶解过程伴有吸热时,溶解过程为吸热过程。
3.3 放热过程:当溶解过程伴有放热时,溶解过程为放热过程。
四、溶解度:4.1 溶解度的影响因素:溶解度受温度、压力和溶剂性质等因素的影响。
4.2 饱和溶解度:当溶解过程达到动态平衡时,溶质与溶剂的浓度达到最大值,此时的溶解度称为饱和溶解度。
4.3 超饱和溶解度:在一定条件下,溶质的溶解度超过饱和溶解度,形成超饱和溶液。
五、溶解的应用:5.1 化学反应:溶解是许多化学反应的前提条件,如酸碱中和反应、氧化还原反应等。
5.2 药物吸收:药物溶解后才干被人体吸收,溶解度的大小影响着药物的吸收速度和效果。
5.3 工业应用:溶解在工业生产中广泛应用,如溶剂的选择、溶解度的控制等。
总结:通过对溶解的定义、溶解的条件、溶解过程中的能量变化、溶解度以及溶解的应用等方面的详细阐述,我们对溶解有了更深入的了解。
溶解是化学中一个重要的概念,对于理解物质的性质和化学反应具有重要意义。
物质溶解过程中有能量变化吗?溶解过程的能量变化,溶解热,溶解平衡
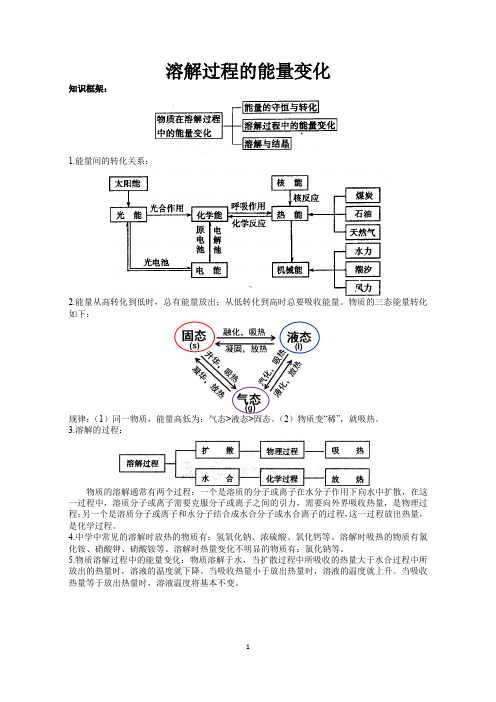
溶解过程的能量变化知识框架:1.能量间的转化关系:2.能量从高转化到低时,总有能量放出;从低转化到高时总要吸收能量。
物质的三态能量转化如下:规律:(1)同一物质,能量高低为:气态>液态>固态。
(2)物质变“稀”,就吸热。
3.溶解的过程:物质的溶解通常有两个过程:一个是溶质的分子或离子在水分子作用下向水中扩散,在这一过程中,溶质分子或离子需要克服分子或离子之间的引力,需要向外界吸收热量,是物理过程;另一个是溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程放出热量,是化学过程。
4.中学中常见的溶解时放热的物质有:氢氧化钠、浓硫酸、氧化钙等。
溶解时吸热的物质有氯化铵、硝酸钾、硝酸铵等。
溶解时热量变化不明显的物质有:氯化钠等。
5.物质溶解过程中的能量变化:物质溶解于水,当扩散过程中所吸收的热量大于水合过程中所放出的热量时,溶液的温度就下降。
当吸收热量小于放出热量时,溶液的温度就上升。
当吸收热量等于放出热量时,溶液温度将基本不变。
6.溶解:当把固体溶质加入水后,溶质表面的分子或离子由于本身的振动以及受到水分子的撞击和吸引会逐渐脱离固体表面进入水中,扩散到各个部分成为溶液,这个过程称为溶解。
7.结晶:已溶解的溶质分子或离子,在溶液中不停地运动着,当它们跟未溶解的固体表面碰撞时,又可重新被吸引到固体表面上来,这个过程称为结晶。
8.溶解和结晶的关系:溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率。
9.溶液。
10.结晶水:溶质从其水溶液里析出而形成晶体时,晶体里常常有一定数目的水分子,这样的水分子叫做结晶水。
晶体中的这种水分子,是作为晶体结构中的一种成分而存在于晶体中的。
有些盐溶于水中会形成稳定的水合离子,当这些盐从水溶液里结晶出来时,就带有一定数目的水分子。
物质溶解过程中的能量变化

物质溶解于水形成溶液的过程中,通常 伴随热量的变化。
有些物质溶解使溶液的温度升高度降低。 例如:KNO3、 NH4Cl 、 NH4NO3
有些物质溶解使溶液的温度没有明显的变化。 例如:氯化钠。
讨论:
氧化钙放入水中温度会明显的升高,氢氧 化钠放入 水中温度也会明显的升高,它们的原理一样吗?
几种常见冷冻混合物的组成和最低温度
冷冻混合物的组成 41gNH4NO3和100g冰 19gNH4Cl和100g冰 23gNaCl和100g冰 22gMgCl2和100g冰
最低温度/℃ -17 -16 -21 -34
答:不一样.前者是氧化钙与水反应生成氢氧化钙而 放热,是由于发生化学变化而放热,而后者是溶解过程中放 热,溶解过程属于物理变化。
冷却剂
在生产、生活中常用冰做冷却剂,但冰只能提供0℃ 左右的低温。一些医疗和研究单位常需要更低的温度, 提供低温较方便的方法是用冷冻混合物。表6-4是几种常 见冷冻混合物的组成及所能达到的最低温度。
高青县第七中学九年级化学下册 第6章 溶解现象 第1节 物质在水中的分散 第2课时 物质溶解过程中的

C.空气 D.二氧化碳
D.5∶1
5.化学与我们的生活息息相关,以下有关说法中准确的选项是D哪一项:( )
A.人类需求的不断增加以及対自然资源的过度开发和不恰当使用,造成了温室效应、
酸雨、赤潮、白色污染、潮汐等环境问题
B.绿色化学是指以绿色植物为原料的化学新工艺
C.北京等城市雾霾天气是由液态水变成水蒸气导致的结果
休息时间到啦
同学们,下课休息十分钟。现在是休息时间,你们休 息一下眼睛,
看看远处,要保护好眼睛哦~站起来动一动,久坐对身 体不好哦~
结束语
同学们,你们要相信梦想是价值的源泉,相信成 功的信念比成功本身更重要,相信人生有挫折没 有失败,相信生命的质量来自决不妥协的信念, 考试加油!奥利给~
第二课时 化学研究物质的组成和结构、用途与制法
12.某校化学兴趣小组就空气中氧气的含量进行实验探究:
【集体讨论]
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其他成分反
映,而且生成物为固体。他们应该选择( B )
A.蜡烛
B.红磷
C.硫粉
为了充分消耗容器中的氧气,药品的用量应保证 充足或过量
。
(2)小组同学共同设计了如下图的两套装置,你认为合理的是( A )
C.铁片、酒精溶液、盐酸
D.酒精溶液、蔗糖溶液、食盐水
5.用蒸馏法可使海水淡化,海水煮沸时的温度 高于 (填〞高于”〞低于”或〞等
于”)100 ℃,蒸馏出来的淡水比海水 容易 (填〞容易”或〞不易”)结冰,出现以 上两种现象的原因是 少量固体物质溶于水,使稀溶液的沸点升高,凝固点降低 。
6.小英把氯化钠溶液注入一广口瓶后,做了如下图的实验,电灯亮了。这个实验 说明:氯化钠溶液能够 导电 。在电路的导线中定向移动的带电粒子是 电子 ; 在溶液中定向移动的带电粒子主要是 Na+ 和 Cl- (用化学符号表示)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解释1:氯化铵晶体溶于水溶液温度降低?
解释2:氯化钠晶体溶于水溶液温度为
何无显著的变化?
练习3: 硝酸铵溶于水,溶液温度显著降低,这是由于( C )
A.硝酸铵溶解时只发生扩散过程。 B.硝酸铵溶解时只发生水合过程。 C.硝酸铵溶于水时,扩散过程吸收的热量大于水 合过程放出的热量。 D.硝酸铵溶于水时,扩散过程吸收的热量小于水 合过程放出的热量。
4.晶体和结晶水合物
定义:自发形成且具有规则几何形状的固体叫做晶体
其中,含有水分子的晶体叫结晶水合物(crystalline hydrate)
例:常见的结晶水合物 胆矾(又称蓝矾) (CuSO4· 5H2O) 绿矾 (FeSO4· 7H2O)
明矾 [KAl(SO4)2· 12H2O)]
石膏 熟石膏 皓矾 芒硝 (CaSO4· 2H2O)(2CaSO4· H2O) (ZnSO4· 7H2O) (Na2SO4 ·10H2O)
1.把糖分子放入水中
糖分子 水分子
2.糖分子克服分子间作用力, 从外界吸收能量,扩散到水中。 3.糖分子和水分子 结合形成水合分子。
那么,现在你知道为什么有的物质溶解时溶液温度升高, 而有的物质溶解时溶液的温度却降低了吗?
解释:这两个过程对不同的溶质来说,
吸收的热量和放出的热量并不相等。 当吸热多于放热,就表现为吸热, 在溶解时,溶液的温度就降低。
3.溶解度与温度
复习:在一定温度下,某物质在100克溶剂 里达到饱和状态时所溶解的克数,叫做这 种物质在这种溶剂里的溶解度.(S) 应用:
(1)溶解度受温度影响变化不大的物质,一般用 蒸发溶剂的方法使溶质结晶析出 (如:晒盐)
——即蒸发结晶
(2) 溶解度受温度影响改变较大的固体物质,一般 用冷却热饱和溶液的方法使溶质结晶析出 (如:CuSO4,明矾,KNO3) ——即降温结晶
不增 不减
饱和溶液
溶解平衡(solution equilibrium)
2.溶解平衡定义:当溶液达到饱和状态 时,溶质的溶解速率等于溶质的结晶速 率,表面上溶质不再减少,也不再增加。 此时溶液达到溶解平衡状态。
说明:饱和溶液的溶解平衡状态特征:
等:溶解速率等于结晶速率。 动:动态平衡。仍在溶解、结晶。 定:溶液的浓度保持一定,不再变化。
1.定义:当条件改变,晶态溶质从溶液 中析出,这个过程称为结晶(crystallize).
注意:结晶和溶解时同时进行的相反的两个过程。
讨论:当溶质溶解速率和结晶速率的相对大小不同时, 看到的现象和溶液所处状态有何不同?
溶解速率与 看到的 溶液状态(饱和、 结晶速率 不饱和) 现象 溶解速率 >结晶速率 溶解 溶解速率 <结晶速率 结晶 溶解速率 =结晶速率 不饱和溶液 饱和溶液
5.风化,潮解
1.风化 ——化学变化 在室温和干燥的空气里,结晶水合物失去一部分或全 部结晶水,这种现象称为风化 (如:石碱 Na2CO3.10H2O, Na2CO3.10H2O
常温、干燥空气中
胆矾CuSO4.5H2O ) Na2CO3.xH2O +(10-x)H2O
想一想:如何检验酒精中含有水分?
课堂练习、 关于溶解平衡的说法不正确的是 C 。 A、溶解平衡的本质是结晶速度等于溶解速度。 B、溶解平衡是个动态平衡,既有溶质的结晶 又有溶质的溶解。 C、达到溶解平衡时,此溶液不一定是饱和溶液。 D、当达到溶解平衡时,溶液中各种微粒的浓度 不再变化,固体的质量也不再变化,但固体 的形状可以变化。
4.用Q扩、Q合表示溶解时扩散过程及水合过 程中能量变化绝对值。 氢氧化钾溶解时的能量变化可用 B 式表示 氯化钠溶解时的能量变化可用 D 式表示 A、 Q扩>Q合 B、 Q扩<Q合 C、 Q扩=Q合 =0 D、 Q扩=Q合≠0
三. 溶解和结晶:
分析现象:
1.将NaCl固体放入不饱和NaCl溶液中 2、将NaCl固体放入饱和NaCl溶液中 3、将50℃ KNO3饱和溶液温度降到20℃ 4、将少量KNO3晶体放入饱和的KNO3溶液中, 然后加热溶液。
剖析物质变化中 的能量变化
4.1物质在溶解过程中 有能量变化吗
能量的转变与人类生活息息相关
一、能量守恒和转化
从刚才的片子中,我们看到了哪些能量的转化呢?
能量是物质运动的一种度量。自然界一切物质都具 有能量,能量具有各种不同的形式,能够从一种形 式转化为另一种形式,从一个物体传递给另一个物 体,在转换和传递的过程中,各种形式能量的总量 保持不变。这就是能量守恒定律。
质(solute)]分散到另一种物质[溶剂(solvent)] 里,而形成的均一、稳定的混合物。
探究实验
1.观察高锰酸钾溶于水的现象, 并用数字测温仪记录溶解的热效应
思考:除了扩散吸热外,在溶解中是否还存在着放热过程?
实验2:观察氯化铵、氢氧化钠,氯化钠
晶体溶于水时,溶液的温度变化。 结论:
氢氧化钠溶于水,溶液温度升高。 氯化铵晶体溶于水,溶液温度降低。 氯化钠晶体溶于水时,溶液温度基本不变。
2.潮解:
晶体吸收空气里的水蒸气,在晶体表面逐渐形成溶液。 (如:CaCl2,NaOH固体) 可作干燥剂
探究:请描述NaOH固体在空气中经过的所有变化
氢氧化钠
潮解后的氢氧化钠
碳酸钠晶体
碳酸钠粉末
吸收空气水分潮解
吸收水和二氧化碳
常温、干燥空气中风化
问:蓝色硫酸铜晶体受热是不是风化? 向无水硫酸铜滴几滴水是不是潮解? 上述这两个实验的变化过程属于物理变化还是化学变化?
当放热多于吸热,就表现为放热, 在溶解时,溶液的温度升高。
即:
扩散过程 :吸收热量 溶解
水合过程 :放出热量
温度变化取决于 吸收热量和放出 热量的差值。
Q吸>Q放 溶液温度下降
Q吸<Q放 溶液温度升高 Q吸≈Q放 溶液温度无明显变化
物质在溶解过程中总是伴随着能量的变化。 表现出来的放热或吸热现象,则是溶质微粒在扩 散过程中的能量变化的总效应。
拓展视野:p75能源的种类和储量 (关注当今世界的三大问题之一 —— 能源问题)
那么,能量从哪里来呢?(阅读书p74)
人类常利用的煤、石油、天然气和食物的能量, 归根到底都是由太阳能转化而来的, 可提供营养物质: 并以化学能的形式储存下来。 如糖类、脂肪和
蛋白质
自然界中能量转化的形式多种多样,
即:物质在溶于水的过程中伴有温度变化。
思考:为什么不同溶质在溶解时表现出不同的热效应呢?
溶解的两个过程
1.
扩散:溶质的分子或离子受到 水分子的作用向水中扩散的过程。 吸收热量,物理过程。
水合: 溶质分子或离子和水 分子结合构成水和分子或水合离 子的过程。放出热量,化学过程。
2.
例:糖分子在水中的溶解过程。
注:并不是所有的晶体都含有结晶水,如食盐、硝酸钾等。
食盐晶体
硝酸钾晶体
问:结晶水合物是混合物?纯净物?
练一练: 1.在一碳酸钠饱和溶液中,加入含18O的无水碳酸钠粉末a克, 如果保持温度不变,以下说法正确的是( )ቤተ መጻሕፍቲ ባይዱA.溶液中可找到含18O的CO32B.a克粉末不变,不再溶解 C.部分溶解,溶液中无18O的CO32- D.最终溶液浓度下降 2.如何通过实验确定结晶水合物的含水量?
物质的三态变化是一种常见的能量转化方式。
吸收能量 气态(g) 吸收能量 液态 (l) 固态物质(s) 放出能量 放出能量 gas liquid solid 能量的合理利用对日常生活和生产发展有着重要的影响!
二、溶解的过程和溶解热现象
复习提问:什么是溶液?
溶液(solution)是由一种或一种以上的物质[溶
