初中九年级化学(上)化学方程式.doc
化学九年级上册全部化学方程式

化学九年级上册全部化学方程式1. 镁在空气中燃烧:2Mg + O2 =点燃= 2MgO2. 铁在氧气中燃烧:3Fe + 2O2=点燃= Fe3O43. 铜在空气中受热:2Cu + O2 =加热= 2CuO4. 铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O35. 氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 =点燃= 2P2O57. 硫粉在空气中燃烧:S + O2 =点燃= SO28. 碳在氧气中充分燃烧:C + O2 =点燃= CO29. 碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO10. 一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 =点燃=CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O13.玻义耳研究空气的成分实验2HgO =加热= Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 =加热= K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 (MnO2催化剂)=2H2O+ O2 ↑(实验室制氧气原理2)16.水在直流电的作用下分解(研究水的组成实验):2H2O =通电= 2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO319.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO =加热= Cu + H2O22. 镁还原氧化铜:Mg + CuO =加热= Cu + MgO23. 碳在氧气中充分燃烧:C + O2 =点燃= CO224.木炭还原氧化铜:C+ 2CuO =高温=2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 =高温= 4Fe + 3CO2↑26.煤炉的底层:C + O2 =点燃= CO227.煤炉的中层:CO2 + C =高温= 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 =点燃= 2CO229.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3=高温= CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O34.一氧化碳还原氧化铜:CO+ CuO =加热= Cu + CO235.一氧化碳的可燃性:2CO + O2 =点燃= 2CO236.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑37.甲烷在空气中燃烧:CH4 + 2O2 =点燃= CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O40.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO41.铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O442. 铜在空气中受热:2Cu + O2 =加热=2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O344. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg 55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓+ NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl。
九年级化学上册化学方程式

九年级化学上册必备化学方程式一化合反应1、木炭在氧气中燃烧:C+O 点燃CO 2 2、硫在氧气中燃烧:S+O 点燃SO 23、镁在空气中燃烧:2Mg+O 2点燃2MgO 4、铁在氧气中燃烧:3Fe+2O 2点燃Fe 3O 45、磷在氧气中燃烧:4P+5O 2点燃2P 2O 56、铜在空气中加热:2Cu+O 2加热2CuO7、氢气在氧气中燃烧:2H 2+O 2点燃2H 2O8、一氧化碳在空气中燃烧:2CO+O 2点燃2CO 29、碳不充分燃烧:2C+O 2不充分点燃2CO 10、二氧化碳通过灼热的碳层:CO 2+C 高温2CO 11、二氧化碳与水反应:CO 2+H 2O=H 2CO 3 12、生石灰和水化合:CaO+H 2O=CaOH 2 二分解反应:13、氯酸钾与二氧化锰共热实验室制O 2:2KClO 3MnO 2KCl+3O 2↑ 14、电解水:2H 2O=== 2H 2↑+ O 2↑15、加热高锰酸钾:2KMnO 4加热K 2MnO 4 + MnO 2 + O 2↑ 16、分解过氧化氢溶液2H 2O 2MnO2H 2O+ O 2 ↑17、碳酸不稳定分解:H 2CO 3=H 2O+CO 2↑ 18、高温煅烧石灰石:CaCO 3高温CaO+CO 2↑ 三置换反应19、锌和稀硫酸反应实验室制H 2:Zn+H 2SO 4=ZnSO 4+H 2↑ 20、锌和盐酸反应:Zn+2HCl=ZnCl 2+H 2↑ 21、氢气还原氧化铜:H 2+CuO 加热Cu+H 2O 22、木炭还原氧化铜:C+2CuO 高温2Cu+CO 2↑ 23、碳还原氧化铁:3C+2Fe 2O 3高温4Fe+3CO 2↑ 24、铁和硫酸铜溶液:Fe+CuSO 4=Cu+FeSO 4 四其他25、大理石和稀盐酸实验室制CO 2:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑26、碳酸钠和盐酸灭火器原理:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ 27、二氧化碳使澄清石灰水变浑浊:CO 2+CaOH 2=CaCO 3↓+H 2O 28、一氧化碳还原氧化铜:CO+CuO加热Cu+CO 229、乙醇酒精在空气中燃烧:C 2H 5OH+3O 2点燃2CO 2+3H 2O30、一氧化碳还原氧化铁炼铁:3CO+Fe 2O 3高温2Fe+3CO 2 31、甲烷在空气中燃烧:CH 4+2O 2点燃CO 2+2H 2O。
初三化学方程式汇总上册

初三化学方程式汇总上册
一、金属与氧气反应
1. 镁在空气中燃烧:2Mg + O2点燃2MgO
2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4
3. 铜在空气中受热:2Cu + O2加热2CuO
4. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3
二、非金属与氧气反应
1. 氢气在氧气中燃烧:2H2 + O2点燃2H2O
2. 硫在氧气中燃烧:S + O2点燃SO2
3. 红磷在氧气中燃烧:4P + 5O2点燃2P2O5
4. 碳在氧气中充分燃烧:C + O2点燃CO2
三、酸与金属反应
1. 镁与稀盐酸反应:Mg + 2HCl = MgCl2 + H2↑
2. 铝与稀硫酸反应:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
3. 铜与稀盐酸不反应。
四、碱与金属反应
1. 镁与氢氧化钠溶液反应:2NaOH + Mg + H2O = Mg(OH)2↓+ 2NaCl
2. 铝与氢氧化钠溶液反应:6NaOH + 2Al + 6H2O = 2Al(OH)3↓+ 6NaCl
3. 铜与氢氧化钠溶液不反应。
五、盐与金属反应
1. 铁与硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu
2. 镁与氯化铜溶液反应:Mg + CuCl2 = MgCl2 + Cu
3. 铜与硝酸汞溶液反应:Cu + Hg(NO3)2 = Cu(NO3)2 + Hg。
九年级上化学必考的化学方程式(加星号是重点之中)

7. 硫粉在空气中燃烧:
S + O2 点燃 SO2
9. 碳在氧气中不充分燃烧:
2C + O2 点燃 2CO
★12.加热高锰酸钾:
2KMnO4 △ K2MnO4 + MnO2 + O2↑
★13.氯酸钾和二氧化锰共热制取氧气
2KClO3MnO22KCl+3O2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
28.碳酸不稳定而分解:
H2CO3 = H2O + CO2↑
29.二氧化碳可溶于水:
H2O + CO2=H2CO3
★30.高温煅烧石灰石(工业制CO2):
CaCO3 高温 CaO + CO2↑
★31.石灰水与二氧化碳反应
Ca(OH)2 + CO2 = CaCO3 ↓+ H2O
C+ 2CuO 高温 2Cu + CO2↑23. 焦炭还原氧化铁:
3C+ 2Fe2O3 高温 4Fe + 3CO2↑
24.煤炉的底层:
C + O2 点燃 CO2
25.煤炉的中层:
CO2 + C 高温 2CO
26.煤炉的上部蓝色火焰的产生:
2CO + O2 点燃 2CO2
★27.大理石与稀盐酸反应:
★14.过氧化氢二氧化锰催化剂条件下分解反应
2H2O2 MnO2 2H2O+ O2 ↑
★15.电解水(探究水的组成实验):
2H2O 通电 2H2↑+ O2 ↑
17.二氧化碳可溶于水:
H2O + CO2=H2CO3
九年级上册化学化学方程式汇总

CO2+CaOH2=CaCO3↓+ H2O
19
镁在二氧化碳中燃烧
2Mg+CO2点燃2MgO +C
20
碳和二氧化碳反应
C+CO2高温2CO
21
实验室制二氧化碳
CaCO3+ 2HCl==CaCl2+ CO2↑+ H2O
22
工业制取二氧化碳
CaCO3高温CaO + CO2↑
23
一氧化碳在空气中燃烧
HCl + NaOH == NaCl + H2O 2HCl + CaOH2== CaCl2+ 2H2O
H2SO4+ 2NaOH == Na2SO4+ 2H2O H2SO4+ BaCl2== BaSO4↓+ 2HCl
2HCl + Na2CO3== 2NaCl + CO2↑+ H2O
2HCl + CaCO3== CO2↑+ CaCl2+ H2O实验室制备CO2
2HCl +Zn == ZnCl2+ H2↑ H2SO4+ Fe == FeSO4+ H2↑
2HCl + Fe == FeCl2+ H2↑
Fe2O3+3H2SO4== Fe2SO43+ 3H2O Fe2O3+6HCl == 2FeCl3+ 3H2O
CuO + 2HCl == CuCl2+ 2H2O CuO +H2SO4== CuSO4+ H2O
CaOH2+ CO2== CaCO3↓+ H2O澄清石灰水变浑浊的原因
九年级上学期化学方程式汇总

九年级上学期化学方程式汇总1.碳与氧气反应产生二氧化碳:C + O2 = CO2.在空气中燃烧时,木炭发红,放热,生成使澄清石灰水变浑浊的气体;在氧气中燃烧时,发出白光,放热,生成使澄清石灰水变浑浊的气体。
2.硫与氧气反应产生二氧化硫:S + O2 = SO2.在空气中燃烧时,发出微弱淡蓝色火焰,放热,生成刺激性气味气体;在氧气中燃烧时,发出明亮蓝紫色火焰,放热,生成刺激性气味气体。
3.铁在氧气中燃烧产生三氧化二铁:3Fe + 2O2 = Fe3O4.火星四射,放热,生成黑色固体。
4.红磷在空气中燃烧产生五氧化二磷:4P + 5O2 = 2P2O5.生成大量白烟,放热。
5.镁在空气中燃烧产生氧化镁:2Mg + O2 = 2MgO。
发出耀眼白光,放热,生成白色固体。
6.铜在空气中受热生成氧化铜:2Cu + O2 = 2CuO。
红色固体变黑色。
7.甲烷在空气中燃烧产生二氧化碳和水:CH4 + 2O2 = CO2 + 2H2O。
点燃前要验纯。
8.酒精在空气中燃烧产生二氧化碳和水:C2H5OH + 3O2= 2CO2 + 3H2O。
9.过氧化氢和二氧化锰混合产生氧气:2H2O2 = 2H2O +O2.10.加热高锰酸钾产生氧气:2KMnO4 = MnO2 + K2MnO4 + O2.点燃。
11.加热氯酸钾和二氧化锰产生氧气:2KClO3 = 2KCl +3O2.12.碳在氧气中充分燃烧产生二氧化碳:C + O2 = CO2.13.碳在氧气中不充分燃烧产生一氧化碳:2C + O2 = 2CO。
14.一氧化碳在空气中燃烧产生二氧化碳:2CO + O2 =2CO2.点燃前要验纯。
15.氢气在空气中燃烧产生水:2H2 + O2 = 2H2O。
点燃前要验纯。
16.木炭还原氧化铜:C + 2CuO = 2Cu + CO2.黑色粉末变红色,生成使澄清石灰水变浑浊的气体。
17.焦炭还原氧化铁:3C + 2Fe2O3 = 4Fe + 3CO2.18.一氧化碳还原氧化铜:CO + CuO = Cu + CO2.19.一氧化碳还原氧化铁:3CO + Fe2O3 = 2Fe + 3CO2.20.当一氧化碳和四氧化三铁反应时,会产生三铁和四个一氧化碳的化学方程式为4CO + Fe3O4 = 3Fe + 4CO2.21.当氢气和氧化铜反应时,会产生铜和水的化学方程式为H2 + CuO = Cu + H2O。
九年级化学上册化学方程式

九年级化学上册必备化学方程式(一)化合反应1、木炭在氧气中燃烧: C+O 2点燃CO 22、硫在氧气中燃烧: S+O 2点燃SO 2点燃4、铁在氧气中燃烧:点燃3、镁在空气中燃烧: 2Mg+O 2 2MgO 3Fe+2O 2 Fe 3O 45、磷在氧气中燃烧: 4P+5O 点燃6、铜在空气中加热: 加热 2CuO2P O5 2Cu+O2 2 2点燃点燃7、氢气在氧气中燃烧: 2H 2+O 2 2H 2O8、一氧化碳在空气中燃烧: 2CO+O 2 2CO 2 9、碳不充分燃烧: 2C+O 2(不充分) 点燃 2CO 10、二氧化碳通过灼热的碳层: CO 2+C 高温 2CO 11、二氧化碳与水反应: CO +H O=H CO3 12、生石灰和水化合: CaO+H O=Ca(OH)22 2 2 2(二)分解反应:13、氯酸钾与二氧化锰共热(实验室制O 2):2KClO 3MnO 2KCl+3O 2↑14、电解水: 2H 2 O=== 2H 2↑+ O 2↑15、加热高锰酸钾: 2KMnO 加热+ MnO + O4K MnO4 222↑、分解过氧化氢溶液2 2 MnO 2H 2O+ O 2 ↑16 2H O17、碳酸不稳定分解: H 2CO 3=H 2O+CO 2↑ 18、高温煅烧石灰石: CaCO 3高温CaO+CO 2↑(三)置换反应19、锌和稀硫酸反应(实验室制 H 2): Zn+H 2SO 4=ZnSO 4+H 2↑20、锌和盐酸反应: Zn+2HCl=ZnCl 2+H 2↑21、氢气还原氧化铜: H 2+CuO 加热 Cu+H 2O22、木炭还原氧化铜: C+2CuO高温2Cu+CO 2↑23、碳还原氧化铁: 3C+2Fe 2O 3高温4Fe+3CO 2↑24、铁和硫酸铜溶液: Fe+CuSO 4=Cu+FeSO 4(四)其他25、大理石和稀盐酸(实验室制 CO 2): CaCO 3+2HCl=CaCl 2 +H 2O+CO 2↑26、碳酸钠和盐酸(灭火器原理) : Na 2 CO 3+2HCl=2NaCl+H 2O+CO 2↑27、二氧化碳使澄清石灰水变浑浊: CO 2+Ca(OH)2=CaCO 3↓+H 2O加热28、一氧化碳还原氧化铜: CO+CuO Cu+CO 229、乙醇(酒精)在空气中燃烧: C 2H 5OH+3O 2 点燃 2CO 2+3H 2O30、一氧化碳还原氧化铁(炼铁) : 3CO+Fe 2 O 3 高温2Fe+3CO 231、甲烷在空气中燃烧: CH 4+2O 2 点燃CO 2+2H 2O。
九年级上册常见化学方程式

九年级上册常见化学方程式1、镁在空气中燃烧:2Mg + O2点燃2MgO2、红磷在空气中燃烧:4P + 5O2点燃2P2O53、硫粉在空气中燃烧:S + O2点燃SO24、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O45、碳充分燃烧:C + O2点燃CO26、碳不充分燃烧:2C + O2点燃2CO7、一氧化碳燃烧:2CO + O2点燃 2CO2 8、氢气燃烧:2H2 + O2点燃2H2O9、生石灰(氧化钙)和水反应:CaO+H2O=Ca(OH)2(熟石灰)10、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO311、二氧化碳通过灼热碳层: C + CO2高温2CO12、实验室用双氧水制氧气:2H2O2MnO22H2O+ O2↑13、加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑14、加热氯酸钾:2KClO3 MnO22KCl+ 3O2↑15、水在直流电的作用下分解:2H2O通电2H2↑+ O2↑16、碳酸不稳定而分解:H2CO3 == H2O + CO2↑17、高温煅烧石灰石(二氧化碳工业制法):CaCO3煅烧CaO + CO2↑18、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(置换反应)19、木炭还原氧化铜:C+ 2CuO高温2Cu + CO2↑20、木炭还原氧化铁3C+2Fe2O3高温4Fe+3CO2↑21、一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO222、一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO223、一氧化碳还原氧化铜:CO+ CuO△ Cu + CO224、氢气还原氧化铜:H2+CuO△CuO+H2O25、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4 == Cu(OH)2↓+Na2SO426、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑27、碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑28、甲烷燃烧:CH4 + 2O2点燃CO2 + 2H2O29、酒精(乙醇)燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O30、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 = CaCO3↓+ H2O31、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 == Na2CO3 + H2O32、锌与稀硫酸反应Zn+H2SO4==ZnSO4+H2↑(置换反应)。
九年级上册化学方程式大全

九年级上册化学方程式大全方程是指含有未知数的等式。
是表示两个数学式(如两个数、函数、量、运算)之间相等关系的一种等式,使等式成立的未知数的值称为“解”或“根”。
求方程的解的过程称为“解方程”。
九年级上册化学方程式大全:【盐酸方程式】NaOH(也可为KOH)+HCl==NaCl+H2O现象:不明显HCl+AgNO3==AgCl↓+HNO3现象:有白色沉淀生成,这个反应用于检验氯离子CaCO3+2HCl==CaCl2+H2O+CO2↑现象:百色固体溶解,生成能使纯净石灰水变浑浊的气体Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体NaHCO3+HCl==NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体Fe2O3+6HCl==2FeCl3+3H2O现象:红色固体逐渐溶解,形成*的溶液Fe(OH)3+3HCl==FeCl3+3H2O现象:红棕色絮状沉淀溶解,形成了*的溶液Cu(OH)2+2HCl==CuCl2+2H2O现象:蓝色沉淀溶解,形成黄绿色的溶液CuO+2HCl==CuCl2+H2O现象:黑色固体溶解,生成黄绿色的溶液Zn+2HCl==ZnCl2+H2↑现象:同上Mg+2HCl==MgCl2+H2↑现象:同上Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成【硫酸方程式】2NaOH(或KOH)+H2SO4==Na2SO4+2H2O现象:不明显Fe2O3+3H2SO4==Fe2(SO4)3+3H2O现象:红色固体溶解,生成*溶液CuO+H2SO4==CuSO4+H2O现象:黑色固体溶解,生成蓝色溶液Cu(OH)2+H2SO4==CuSO4+2H2O现象:蓝色沉淀溶解,生成蓝色溶液H2SO4+BaCl2==BaSO4↓+2HCl现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子CaCO3+H2SO4==CaSO4+H2O+CO2↑Na2CO3+H2SO4==Na2SO4+H2O+CO2↑2NaHCO3+H2SO4==Na2SO4+2H2O+2CO2↑现象:这三个反应现象同与盐酸反应现象一致【*方程式】Fe2O3+6HNO3==2Fe(NO3)3+3H2O现象:红色固体溶解,生成*溶液CuO+2HNO3==Cu(NO3)2+H2O现象:黑色固体溶解,生成蓝色溶液Cu(OH)2+2HNO3==Cu(NO3)2+2H2O现象:蓝色沉淀溶解,生成蓝色溶液NaOH(或KOH)+HNO3==NaNO3+H2O现象:不明显Mg(OH)2+2HNO3==Mg(NO3)2+2H2O现象:白色沉淀溶解CaCO3+2HNO3==Ca(NO3)2+H2O+CO2↑Na2CO3+2HNO3==2NaNO3+H2O+CO2↑NaHCO3+HNO3==NaNO3+H2O+CO2↑现象:以上三个反应现象同与盐酸反应现象一致【置换反应】(1)盐(溶液)+金属单质-------另一种金属+另一种盐铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu(2)盐+酸--------另一种酸+另一种盐碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑(3)盐+碱--------另一种碱+另一种盐氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH (4)盐+盐-----两种新盐氯化钠溶液和*银溶液:NaCl+AgNO3==AgCl↓+NaNO3硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgClFe2(SO4)3+2Ag===2FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag不反应2FeCl3+H2S===2FeCl2+2HCl↑+S↓2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl2TlCl3+2Ag===2AgCl+TlCl(*、铅、铋的高价化合物都有强氧化性) 2,还原性:2FeCl2+Cl2===2FeCl3SnCl2+Cl2===SnCl4(SnCl2有强还原性)3Na2S+8HNO3(稀)===6NaNO3+2NO↑+3S↓+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2↓+NH4ClAlCl3+3NH3.H2O===Al(OH)3↓+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3↓+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO2↑3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓+3CO2↑+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+3CO2↑+6NaCl 3NaHCO3+AlCl3===Al(OH)3↓+3CO2↑3NaHCO3+FeCl3===Fe(OH)3↓+3CO2↑3Na2S+Al2(SO4)3+6H2O===2Al(OH)3↓+3H2S↑3NaAlO2+AlCl3+6H2O===4Al(OH)3↓+3NaCl5,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2↑+H2ONH4HCO3===NH3+H2O+CO2↑2KNO3===2KNO2+O2↑Cu(NO3)2===CuO+3NO2+O2↑2KMnO4===K2MnO4+MnO2+O2↑(用于实验室准备氧气)2KClO3===2KCl+3O2↑2NaHCO3===Na2CO3+H2O+CO2↑Ca(HCO3)2===CaCO3+H2O+CO2↑CaCO3===CaO+CO2↑MgCO3===MgO+CO2↑H2SO3===H2O+SO2↑ThI4==高温==Th+2I2↑(部分金属的碘化物高温下不稳定,分解反应用于提纯金属) 2NH4ClO4==Δ==N2↑+2O2↑+Cl2↑+4H2O↑(高氯酸铵用作火箭助推物,分解产生的大量气体能推动火箭升空)2ClO2==加热或震荡==Cl2+2O2(二氧化氯不稳定,会爆炸性分解)2BaO2==△==2BaO+O2↑(过氧化钡能在700℃分解)。
化学九年级上册所有方程式

化学九年级上册所有方程式九上化学方程式如下:1、磷的燃烧化学方程式 4P + 5O2 ═(点燃) 2P2O5 (化合反应)。
2、硫的燃烧化学方程式 S + O2 ═(点燃) SO2 (化合反应)。
3、碳完全燃烧化学方程式 C + O2 ═(点燃) CO2 (化合反应)。
4、碳不完全燃烧化学方程式 2C + O2 ═(点燃) 2CO (化合反应)。
5、铁的燃烧化学方程式 3Fe + 2O2 ═(点燃) Fe3O4 (化合反应)。
6、镁的燃烧化学方程式 2Mg + O2 ═(点燃) 2MgO (化合反应)。
7、铝的燃烧化学方程式 4Al + 3O2 ═(点燃) 2Al2O3 (化合反应)。
8、过氧化氢溶液中加入二氧化锰化学方程式 2H2O2 ═(MnO2)2H2O+ O2↑(分解反应)。
9、加热高锰酸钾制氧气化学方程式2KMnO4 ═(加热) K2MnO4 + MnO2 + O2↑(分解反应)。
10、把氯酸钾与二氧化锰混合加热制取氧气化学方程式 2KClO3═(MnO2)2KCl+3O2 (分解反应)。
11、水中通入直流电化学方程式 2H2O ═(通电)2H2↑+ O2↑(分解反应)。
12、氢气与氯气在点燃的条件下生成氯化氢化学方程式 2H2 + Cl2 ═(点燃)2HCl (化合反应)。
13、氢气燃烧生成水化学方程式 2H2 + O2 ═(点燃) 2H2O (化合反应)。
14、镁与硫酸反应生成硫酸镁和氢气化学方程式 Mg + H2SO4 ═ MgSO4 + H2↑(置换反应)。
15、铝与硫酸反应生成硫酸铝和氢气化学方程式 2Al + 3H2SO4 ═ Al2(SO4)3 + 3H2↑(置换反应)。
16、锌与硫酸反应生成硫酸锌和氢气化学方程式 Zn + H2SO4 ═ ZnSO4 + H2↑(置换反应)。
17、铁与硫酸反应生成硫酸亚铁和氢气化学方程式 Fe + H2SO4 ═ FeSO4 + H2↑(置换反应)。
九年级化学上册化学方程式汇总

东莞市光明中学 整理:陈亦伦九年级化学上册化学方程式汇总一、化合反应(四大基本反应类型之一): 1、红磷在空气中燃烧:4P + 5O 2 == 2P 2O 52、镁在空气中燃烧:2Mg + O 2 == 2MgO3、铁在氧气中燃烧:3Fe + 2O 2 == Fe 3O 44、硫在空气中燃烧:S+O 2 == SO 25、碳在空气中充分燃烧:C+O 2 == CO 26、碳在空气中不充分燃烧:2C + O 2 == 2CO7、氢气在空气中燃烧:2H 2 + O 2 == 2H 2O8、一氧化碳在空气中燃烧:2CO + O 2 == 2CO 29、木炭和二氧化碳反应: C + CO 2 == 2CO10、铜与氧气反应:2Cu+O 2 === 2CuO11、二氧化碳与水反应:CO 2 + H 2O == H 2CO 3 12、氧化钙与水反应:CaO+H 2O == Ca(OH)2二、分解反应(四大基本反应类型之一):13、水在通电的条件下分解:2H 2O == 2H 2↑+ O 2↑14、过氧化氢在二氧化锰的催化下分解:2H 2O 2 === 2H 2O + O 2↑ 15、加热氯酸钾和二氧化锰的混合物:2KClO 3 === 2KCl + 3O 2↑16、加热高锰酸钾:2KMnO 4 === K 2MnO 4 + MnO 2 + O 2↑17、碳酸不稳定分解:H 2CO 3 == H 2O + CO 2↑18、高温煅烧石灰石:CaCO 3 === CaO + CO 2↑三、还原反应(非基本反应类型;有木炭和铁的条件为高温) 19、木炭还原氧化铜:C + 2CuO == 2Cu + CO 2↑ 20、木炭还原氧化铁:3C + 2Fe 2O 3 == 4Fe + 3CO 2↑21、一氧化碳还原氧化铜:CO + CuO === Cu + CO 2 22、一氧化碳还原氧化铁:3CO + Fe 2O 3 == 2Fe + 3CO 223、一氧化碳还原四氧化三铁:4CO + Fe 3O 4 == 3Fe + 4CO 2 24、氢气还原氧化铜:H 2 + CuO === Cu + H 2O25、氢气还原氧化铁:3H 2 + Fe 2O 3 === 2Fe + 3H 2O四、其他反应26、大理石和稀盐酸反应制取二氧化碳:CaCO 3 + 2HCl == CaCl 2 + H 2O + CO 2↑ 27、二氧化碳使澄清石灰水变浑浊:CO 2 + Ca(OH)2 == CaCO 3↓ + H 2O 28、甲烷在空气中燃烧:CH 4 + 2O 2 == CO 2 + 2H 2O29、酒精在空气中燃烧:C 2H 5OH + 3O 2 == 2CO 2 + 3H 2O30、锌和稀硫酸反应制取氢气:Zn + H 2SO 4 == ZnSO 4 + H 2↑点燃点燃 点燃点燃MnO 2高温 点燃 点燃 点燃点燃通电△MnO 2△ 高温高温高温 高温高温△△点燃点燃 高温△。
最新中考九年级化学上册必背化学方程式

中考九年级化学上册必背化学方程式一、燃烧反应(描述现象时都要加上放出大量热)1.碳充分燃烧:C+O 2 __________燃 烧 CO 2(空气中:红热)(氧气中:发出白光,放出热量,产生使石灰水变浑浊的无色气体)2.碳不充分燃烧:2C+O 2 __________燃 烧 2CO3.硫燃烧:S+O 2 __________燃 烧 SO 2(空气中:淡蓝色火焰,放出热量,产生具有刺激气味的气体)(氧气中:蓝紫色火焰,放出热量,产生具有刺激气味的气体)4.磷燃烧:4P+5O 2 __________燃 烧 P 2O 5(产生大量白烟,P 2O 5污染空气)5.铁燃烧:3Fe+2O 2 __________燃 烧 Fe 3O 4(氧气中:剧烈燃烧,火星四射,放出大量热,生成黑色固体)(瓶底留少量水或细沙,防止溅落的高温熔化物炸裂瓶底。
)6.镁燃烧:2Mg+O 2 __________燃 烧 2MgO(发出耀眼的白光,生成白色固体)7.氢气燃烧:2H 2+O 2 __________燃 烧 2H 2O(产生淡蓝色火焰,干冷烧杯壁有小水株)8.一氧化碳燃烧:2CO+O 2 __________燃 烧 2CO 2(产生蓝色火焰,产生使石灰水变浑浊的无色气体)9.甲烷燃烧:CH 4+2O 2 __________燃 烧 CO 2+2H 2O(产生明亮的蓝色火焰)10.乙醇燃烧:C 2H 5OH+3O 2 __________燃 烧 2CO 2+3H 2O二、常见气体制备方程(一)制取氧气1.过氧化氢与二氧化锰混合制氧气:2H 2O 2 __________MnO 2 2H 2O + O 2↑2.加热氯酸钾和二氧化锰制备氧气:2KClO 3 __________MnO 2∆2KCl+O 2 3.加热高锰酸钾:2KMnO 4 __________∆ K 2MnO 4 + MnO 2 + O 2↑(棉花:防止高锰酸钾粉末堵塞导管)(先撤导管后灭酒精灯:防止水倒流回试管底部而炸裂试管)4.加热氧化汞:2HgO __________∆ 2Hg+O 2↑5.电解水:2H 2O __________通电 H 2↑+O 2↑(电极:正氧负氢;体积比:氢二氧一)(加入硫酸或氢氧化钠的目的:增强水的导电性)(二)制取二氧化碳1.石灰石跟稀盐酸反应制二氧化碳:CaCO 3 + 2HCl __________ CaCl 2 + H 2O+ CO 2↑(药品的选择性)2.碳酸根不稳定:H 2CO 3 __________ H 2O+CO 2↑3.高温煅烧石灰石: CaCO 3 __________高温 CaO+CO 2↑(工业上制备二氧化碳)(三)制取氢气1.锌跟稀硫酸反应:Zn + H 2SO 4 __________ ZnSO 4 + H 2↑(实验室制氢气)2.锌跟稀盐酸:Zn + 2HCl __________ ZnCl 2 + H 2↑3.镁跟稀盐酸反应:Mg + 2HCl __________ MgCl 2 + H 2↑三、其他方程式1.二氧化碳使澄清石灰水变浑浊: Ca(OH)2 + CO 2 __________ CaCO 3↓+ H 2O(CO 2的检验)CO 2与NaOH 反应:2NaOH+CO 2__________ Na 2CO 3+H 2O(CO 2吸收)2.二氧化碳溶于水:CO 2+H 2O __________ H 2CO 3(CO 2通入紫色石蕊试液,试液由紫色变为红色)3.木炭粉跟氧化铜高温共热:C+2CuO __________高温 2Cu+CO 2↑(黑色粉末逐渐变红,生成能使澄清石灰水变浑浊的气体)4.木炭粉还原氧化铁:3C+2Fe 2O 3 __________高温 4Fe+3CO 2↑5.一氧化碳还原氧化铜: CO+CuO __________∆ Cu+CO 2(要有尾气处理装置)H 2还原氧化铜:H 2+CuO __________∆ Cu+H 2O(反应前先通一段时间气体:排尽装置中的空气/氧气;反应结束后继续通一段时间气体,直至试卷冷却至常温下:防止生成的Cu 重新被氧化成氧化铜)6.一氧化碳还原氧化铁:3CO+Fe 2O 3 __________高温 2Fe+3CO 27.光合作用:6CO 2+6H 2O __________叶绿素光照C 6H 12O 6+6O 2二、中考化学推断题2.如图,物质王国中的A ~F 及X 七种物质玩“独木桥”游戏,其中A ~F 分别是盐酸、氢气、氧化铜、氢氧化钙、碳酸钠、二氧化碳六种物质中的一种。
九年级上册化学方程式汇总

初中化学上册化学方程式汇总 姓名(1)加热高锰酸钾制氧气:2KMnO 4 === K 2MnO 4 + MnO 2 + O 2↑(2)氯酸钾在二氧化锰催化下加热制氧气:2KClO 3 === 2KCl + 3O 2↑ (3)过氧化氢在二氧化锰催化下制氧气:2H 2O 2 ==== 2H 2O + O 2↑(4)电解水: 2H 2O === 2H 2↑ + O 2↑(5)氢气燃烧: 2H 2 + O 2 === 2H 2O(6)实验室制二氧化碳:CaCO 3 + 2HCl == CaCl 2 + H 2O + CO 2↑(7)工业上制二氧化碳(高温煅烧大理石):CaCO 3 === CaO + CO 2↑(8)氧化钙与水反应(生石灰变熟石灰): CaO + H 2O === Ca(O H)2(9)二氧化碳与石灰水反应(检验CO 2):CO 2 + Ca(OH)2 == CaCO 3↓ + H 2O(10)二氧化碳与水反应:CO 2 + H 2O === H 2CO 3(11)碳酸不稳定,易分解: H 2CO 3 === H 2O + CO 2↑(12)红磷燃烧:4P + 5O 2 === 2P 2O 5(13)铁在氧气中燃烧:3Fe + 2O 2 === Fe 3O 4(14)镁条燃烧:2Mg + O 2 === 2MgO(15)硫燃烧:S + O 2 === SO 2(16)碳充分燃烧:C + O 2 === CO 2(17)碳不充分燃烧:2C + O 2 === 2CO(18)木炭还原二氧化碳:C + CO 2 === 2CO(19)木炭还原氧化铜:C + 2CuO === 2Cu + CO 2↑(20)一氧化碳燃烧:2CO + O 2 === 2CO 2(21)一氧化碳还原氧化铜:CO + CuO === Cu + CO 2(22)甲烷(CH 4)燃烧:CH 4 + 2O 2 === CO 2 + 2H 2O(23)酒精(C 2H 5OH )燃烧:C 2H 5OH + 3O 2 === 2CO 2 +3H 2O (24)实验室用锌与稀硫酸(H 2SO 4)反应制取氢气:Zn + H 2SO 4== ZnSO 4 + H 2↑ MnO 2 △ 高温 通电 点燃 点燃 △高温 MnO 2高温 点燃 点燃 △ 点燃 点燃 点燃 点燃 点燃 点燃。
九年级化学方程式上(带图)

九年级上册化学方程式第二单元我们周围的空气1、木炭在O2中燃烧C+O2 点燃CO22、硫在O2中燃烧S+O2 点燃SO23、磷在O2中燃烧4P+5O2 点燃2P2O54、铁丝在O2中燃烧3Fe+2O2 点燃Fe3O45、镁在O2中燃烧2Mg+O2 点燃2MgO6、铝在O2中燃烧4Al+3O2 点燃2Al2O37.、实验室用氯酸钾制氧气2KClO3MnO2△2KCl + 3O2↑8.、实验室用高锰酸钾制氧气2KMnO4△K2MnO4 + MnO2 + O2↑9.、实验室用过氧化氢制氧气2H2O22H2O + O2↑第三单元自然界中的水1、电解水2H2O 通电2H2↑+ O2↑2、加热氧化汞2HgO △2Hg + O2↑3.、实验室制氢气Zn + H2SO4== ZnSO4 + H2↑4、氢气在空气中燃烧2H2 + O2 点燃2H2O第五单元化学方程式1、氢气还原氧化铜H2 + CuO △Cu + H2O2、氢气和氧化铁的反应3H2 + Fe2O3△2Fe+ 3H2O3、铁和硫酸铜的反应(湿法炼铜)Fe + CuSO4 == FeSO4 + Cu4、硫酸铜和氢氧化钠的反应CuSO4 +2NaOH == C u(O H)2↓+ Na2SO45、铜绿(碱式碳酸铜)受热分解Cu2(OH)2CO3△2CuO+H2O+ CO2↑第六单元碳和碳的氧化物1、木炭在氧气中燃烧 C + O2 点燃CO2(O2充足);2C + O2 点燃2CO(O2不足)2、木炭还原氧化铜 C + 2CuO 高温2Cu + CO2↑3、碳还原氧化铁2Fe2O3 +3C 高温4Fe +3CO2↑4、炭还原二氧化碳 C + CO2 高温2CO5、二氧化碳和水反应CO2 + H2O ===== H2CO36、碳酸不稳定分解H2CO3 ===== CO2↑+ H2O7、二氧化碳和澄清的石灰水反应CO2 + Ca(OH)2 ===CaCO3↓+H2O8、高温煅烧石灰石CaCO3 高温CaO + CO2↑9、实验室制取二氧化碳CaCO3 +2HCl === CaCl2 + CO2↑+ H2O10、一氧化碳在氧气中燃烧2CO + O2 点燃2CO211、一氧化碳还原氧化铜CO + CuO △Cu + CO2第七单元燃料及其利用1、甲烷在空气中燃烧CH4 + 2O2 点燃CO2 + 2H2O2、酒精在空气中燃烧C2H5OH + 3O2 点燃2CO2 + 3H2OMnO2附:一、化学方程式补充:1、镁和盐酸反应Mg + 2HCl === MgCl2 + H2↑2、一氧化碳还原氧化铁(高温炼铁)3CO + Fe2O3高温2Fe + 3CO23、锌和稀硫酸反应Zn + H2SO4 === ZnSO4 + H2↑4、实验室吸收多余SO2和CO2 CO2 + 2NaOH ===Na2CO3 +H2OSO2 + 2NaOH ===Na2SO3(亚硫酸钠)+ H2O 5、燃烧的条件探究Na2CO3+2HCl==2NaCl+CO2↑+H2O 或NaHCO3+HCl ==NaCl +CO2↑+ H2O(快速产生的大量CO2使烧杯内蜡烛熄灭)二、物质的俗名:单质:Hg→水银氧化物:CO2(固体)→干冰CaO→生石灰CO→煤气酸:HCl →盐酸H2SO4→硫酸H2CO3→碳酸盐酸硫酸碳酸碱:NaOH → 苛性钠、火碱、烧碱Ca(OH)2→熟石灰、消石灰盐:NaCl → 食盐CuSO4·5H2O → 胆矾、蓝矾Na2CO3→纯碱、苏打NaHCO3→小苏打CaCO3→石灰石、大理石Cu2(OH)2CO3 碱式碳酸铜→ 铜绿有机物:甲烷CH4→沼气、坑气、瓦斯、天然气、可燃冰乙醇C2H5OH →酒精乙酸CH3COOH →醋酸溶液:Ca(OH)2的水溶液→石灰水、石灰乳、石灰浆混合物:H2和CO的混合物→水煤气CH4为主的混合物→天然气、沼气三、物质的颜色:△CuSO4溶液(蓝色)NaOH溶液、NaHCO3溶液、Na2CO3溶液(无色)石蕊试剂(紫色)盐酸溶液、硫酸溶液、碳酸溶液(无色)△Cu(红色固体)MnO2、C、CuO(黑色固体)蓝色沉淀:Cu(OH)2 KMnO4 (紫黑色固体)KClO3(白色固体)Cu2(OH)2CO3[铜绿](绿色固体)四、常见元素、原子团的化合价:元素:例:+1-2 +2 -1+3 -2 +2 -2 -3 -1K2 O Ca(OH)2 Al2(SO4)3Cu SO4 NH4 Cl五、简单计算示例:1、环氧乙烷(C2H4O)中碳、氢、氧元素质量比为:(12×2)∶(1×4)∶(16×1)=6∶1∶42、FeO、Fe2O3、Fe3O4三化合物中,与等质量铁元素相结合的氧元素的质量比为:6FeO 3Fe2O3 2Fe3O4氧原子数为 6 9 8氧元素质量比为(16×6)∶(16×9)∶(16×8)=6∶9∶83、FeO、Fe2O3、Fe 3O4 、Fe2(SO4)3中铁元素的质量分数最高的是:FeO Fe2O3Fe3O4Fe2(SO4)3↓↓↓↓FeO FeO23FeO34Fe(SO4)23观察转化后各项,另一元素(或部分)的相对原子(或部分)质量越小,则铁元素的质量分数越高,选A。
九年级上册化学方程式

1、实验室氧气:2KMnO4==△==2K2MnO4+MnO2+O2↑(实验室制氧气)2KClO3=△=2KCl+3O2↑(用MnO2作催化剂) (实验室制氧气)2H2O2=MnO2 =2H2O+O2↑ (实验室制氧气)加热分解氧化汞:Hg2O2=2Hg+O2↑(氧气的制法)电解水:2H2O=2H2+O2↑(氧气的制法)2、实验室制CO2:实验室制取二氧化碳:CaCO3+2HCl=====CaCl2+ H2O+ CO2↑(常用)碳酸钠与稀盐酸反应:Na2CO3+2HCl=====2NaCl+H2O+ CO2↑碳酸钠与稀硫酸反应:Na2CO3+H2SO4=====Na2SO4+H2O+ CO2↑高温锻烧石灰石:CaCO3=CaO+CO2Cu2(OH)2CO3=====2CuO+H2O+ CO2↑CaCO3+H2SO4=====CaSO4↓+H2O+CO2↑(一)化合反应:1、木炭在氧气中燃烧:C+O2=点燃=CO22、硫在氧气中燃烧:S+O2=点燃=SO23、镁在空气中燃烧:2Mg+O2=点燃=2MgO4、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O45、磷在氧气中燃烧:4P+5O2=点燃=2P2O56、铜在空气中加热:2Cu+O2=△=2CuO7、铝在氧气中燃烧:4Al+3O2=点燃=2Al2O38、氢气在氯气中燃烧:H2+Cl2=点燃=2HCl9、氢气在氧气中燃烧:2H2+O2=点燃=2H2O10、一氧化碳在空气中燃烧:2CO+O2=点燃=2CO211、碳不充分燃烧:2C+O2(不充分)=点燃=2CO12、二氧化碳通过灼热的碳层:CO2+C=高温=2CO13、二氧化碳与水反应:CO2+H2O=H2CO314'、氧化钠溶于水:Na2O+H2O=2NaOH14''、生石灰和水化合:CaO+H2O=Ca(OH)214'''、三氧化硫溶于水:SO3+H2O=H2SO4(二) 置换反应:23、锌和稀硫酸反应(实验室制H2):Zn+H2SO4=ZnSO4+H2↑24、锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑25、铁和盐酸:Fe+2H Cl=FeCl2+H2↑26、铁和稀硫酸:Fe+H2SO4=FeSO4+H2↑27、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO428、氢气还原氧化铁:3H2+Fe2O3=△=2Fe+2H2O29、铝和稀硫酸:2Al+3H2SO4=Al2(SO4)3+3H2↑30、钠和水反应:2Na+2H2O=2NaOH+H2↑(三)还原反应:31、氢气还原氧化铜:H2+CuO=△=Cu+H2O32、木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑33、碳还原氧化铁:3C+2Fe2O3=高温=4Fe+3CO2↑34、一氧化碳还原氧化铜:Cuo+CO=△= Cu+ CO235、一氧化碳还原氧化铁(炼铁):3CO+Fe2O3=高温=2Fe+3CO236、镁还原氧化铜:Mg+CuO=△=Cu+MgO(四)其他:37、二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O38、二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+H2O39、氢氧化钠和硫酸铜反应:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓40、碳酸钠和盐酸:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑41、二氧化碳溶于水生成碳酸:CO2+H2O=H2CO342、甲烷在空气中燃烧:CH4+2O2=点燃=CO2+2H2O43、乙醇在空气中燃烧:C2H5OH+3O2=点燃=2CO2+3H2O44、甲醇在空气中燃烧:2CH3OH+3O2=点燃=2CO2+4H2O45、盐酸和氢氧化钠:HCl+NaOH=NaCl+H2O五、氢气的性质:可燃性24.氢气在空气中燃烧:氢气的还原性:氢气还原氧化铜:H2+CuO=Cu+H2O氢气还原氧化铁:3H2+Fe2O3=2Fe+3H2O.氢气还原四氧化三铁:4H2+Fe3O4=3Fe+4H2O氢气还原金属氧化物:H2+AO=A+H2O六、氢气的制法锌粒与稀硫酸反应:Zn+H2SO4=ZnSO4+H2锌粒与稀盐酸反应:Zn+2HCl=ZnCl2+H2镁条与稀盐酸反应:Mg+2HCl=MgCl2+H2镁条与稀硫酸反应:Mg+H2SO4=MgSO4+H2七、碳的性质可燃性:木炭在空气中充分燃烧:C+O2=CO2木炭在空气中不充分燃烧:2C+O2=2CO还原性:木炭还原二氧化碳:CO2+C=2CO木炭还原氧化铜:C+2CuO=2Cu+CO2 ↑木炭还原氧化铁:3C+2Fe2O3=4Fe+3CO2木炭还原四氧化三铁:2C+Fe3O4=3Fe+2CO2↑木炭还原金属氧化物:C+2AO=2A+CO2↑八、一氧化碳的性质可燃性:一氧化碳在氧气中燃烧:2CO+O2=CO2还原性:一氧化碳还原氧化铜:CO+CuO=Cu+CO2一氧化碳还原氧化铁:3CO+Fe2O3=2Fe+3CO2一氧化碳还原四氧化三铁:4CO+Fe3O4=3Fe+4CO一氧化碳还原金属氧化物:CO+AO=A+CO2九、其它反应铁丝放入硫酸铜溶液中:Fe+CuSO4=Cu+FeSO4把紫色石蕊试液遇二氧化碳变红的溶液放置一段时间或加热又变成紫色的原因H2CO3=H2O+CO2↑。
9年级上册科学化学方程式

九年级上册科学化学方程式:
1.镁在空气中燃烧:2Mg + O2点燃= 2MgO
2.铁在氧气中燃烧:3Fe + 2O2点燃= Fe3O4
3.铜在空气中受热:2Cu + O2加热= 2CuO
4.铝在空气中燃烧:4Al + 3O2点燃= 2Al2O3
5.氢气中空气中燃烧:2H2 + O2点燃= 2H2O
6.红磷在空气中燃烧:4P + 5O2点燃= 2P2O5
7.硫粉在空气中燃烧:S + O2点燃= SO2
8.碳在氧气中充分燃烧:C + O2点燃= CO2
9.碳在氧气中不充分燃烧:2C + O2点燃= 2CO
10.一氧化碳在氧气中燃烧:2CO + O2点燃= 2CO2
11.二氧化碳通过炽热的碳层:CO2 + C高温= 2CO
12.一氧化碳在空气中燃烧:2CO + O2点燃= 2CO2
13.二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O= H2CO3
14.氨气和氯化氢反应生成氯化铵:NH3 + HCl= NH4Cl
15.氯化铵受热分解:NH4Cl加热= NH3 + HCl
16.生石灰溶于水:CaO + H2O= Ca(OH)2
17.无水硫酸铜作干燥剂:CuSO4 + 5H2O= CuSO4·5H2O
18.钠和水反应:2Na + 2H2O = 2NaOH + H2↑
19.硫酸铜溶液和氢氧化钠溶液反应:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4。
九年级化学上册常见化学方程式汇总
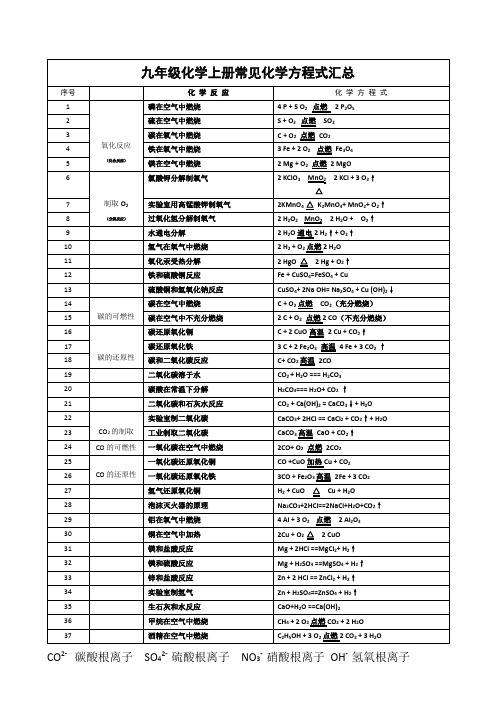
CO2- 碳酸根离子SO42- 硫酸根离子NO3- 硝酸根离子OH- 氢氧根离子NH4+ 铵根离子化学广义上的燃烧:发光发热的化学变化。
酸碱盐:酸是由氢离子和酸根离子组成。
碱是由氢氧根离子和金属离子组成。
盐是由酸根离子和金属离子组成。
活泼金属:能与HCl溶解的金属。
活泼金属金属氧化物盐与HCl反应:活泼金属与HCl反应生成盐和氢气。
金属氧化物与HCl反应生成盐和水。
盐与HCl反应生成另一种盐和另一种酸。
置换反应与复分解反应:单质+化合物反应生成单质+化合物——置换反应。
(A+BC-------B+AC)两种化合物阳离子(阴离子)互相交换生成新的两种化合物——复分解反应。
(AB+CD-------AD+CB)在置换反应中一定有元素化合价的变化。
金属在置换反应中得到的溶液为浅绿色。
阳离子(阴离子)相同不能发生复分解反应。
浓硫酸没有挥发性,有很好的吸水性,用作液体干燥剂。
一般稀释浓硫酸注酸于水,放热。
活泼金属金属氧化物盐与稀硫酸反应:活泼金属与稀硫酸反应生成盐和氢气。
金属氧化物与稀硫酸反应生成盐和水。
盐与稀硫酸反应生成另一种盐和另一种酸。
AgCl,BaSO4白色沉淀通常不溶于水,不容于酸。
BaSO4在医学中有应用。
鉴定H+:1.加活泼金属 2.加金属氧化物 3.加紫色石蕊试液鉴定Cl-:通常加AgNO3出现沉淀鉴定SO42+:通常加BaCl2出现沉淀稀硫酸化为稀盐酸:H2SO4+BaCl2===BaSO4白色沉淀+2HCl碳酸H2CO3亚硫酸H2SO3磷酸H3PO4盐酸HCl硝酸钠NaNO3硝酸银AgNO3硝酸钙Ca(NO3)2硝酸镁Mg(NO3)2硝酸钡Ba(NO3)2硝酸锌Zn(NO3)2硝酸铝Al(NO3)3硝酸铜Cu(NO3)2硝酸铁Fe(NO3)3硝酸亚铁Fe(NO3)2硝酸钾KNO3硫酸钠Na2SO4硫酸银Ag2SO4硫酸钙CaSO4硫酸镁MgSO4硫酸钡BaSO4硫酸锌ZnSO4硫酸铝Al2(SO4)3硫酸铜CuSO4硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硫酸铵(NH3)2SO4。
化学方程式九年级上

化学方程式V1.0一、酸和活泼金属反应生成盐和氢气Zn+2HCl ZnCl2+H2 ↑锌加稀盐酸生成氯化锌加氢气Zn+H2SO4ZnSO4+H2↑锌加稀硫酸生成硫酸锌(皓矾、锌矾)加氢气Mg+2HCl2+H2 ↑镁加稀盐酸生成氯化镁加氢气Mg+H2SO44+H2↑镁加稀硫酸生成硫酸镁加氢气Fe+2HCl2+H2↑铁加稀盐酸生成氯化铁加氢气铁加稀盐酸生成氯化铁加氢气Fe+H2SO44+H2↑铁加稀硫酸生成硫酸亚铁(绿矾)加氢气2Al+6HCl+3H2↑铝加稀盐酸生成氯化铝加氢气2Al+3H2SO4Al2(SO4)3+3H2↑铝加稀硫酸生成硫酸铝加氢气二、酸和碱能中和反应NaOH+HCl====NaCl+H2O 氢氧化钠加稀盐酸生成氯化钠(盐)加水2NaOH+H2SO42SO4+H2O 氢氧化钠加稀硫酸生成硫酸钠(无水芒硝、元明粉)NaOH+HNO3NaNO3+H2O 氢氧化钠加硝酸生成硝酸钠加水Ca(OH)2+2HCl CaCl2+2H2O 氢氧化钙(熟石灰)加稀盐酸生成氯化钙加水Ca(OH)2+H2SO44+2H2O 氢氧化钙(熟石灰)加稀硫酸生成硫酸钙加水Ca(OH)2+2HNO33)2+2H2O 氢氧化钙(熟石灰)加硝酸生成硝酸钙加水Ba(OH)2+2HCl2+2H2O 氢氧化钡加稀盐酸生成氯化钡加水Ba(OH)2+H2SO44↓+2H2O 氢氧化钡加稀硫酸生成硫酸钡加水Al(OH)3+3HCl AlCl3+3H2O 氢氧化铝加稀盐酸生成氯化铝加水KOH+HCl KCl+H2O 氢氧化钾加稀盐酸生成氯化钾加水2KOH+H2SO4K2SO4+2H2O 氢氧化钾加稀硫酸生成硫酸钾加水KOH+HNO33+H2O 氢氧化钾加硝酸生成硝酸钾加水三、酸与某些金属氧化物反应生成盐和水Fe2O3+6HCl2FeCl3+3H2O 三氧化二铁(氧化铁)加稀盐酸生成三氯化铁(氯化铁)加水CuO+H2SO4CuSO4+H2O 氧化铜加稀硫酸生成硫酸铜加水MgO+H2SO44+H2O 氧化镁加稀硫酸生成硫酸镁(泻盐)加水四、酸与某些盐反应生成另一种酸和另一种盐CaCO3+2HCl CaCl2+CO2↑+H2O 碳酸钙(石灰石)加稀盐酸生成氯化钙加二氧化碳加水CaCO3+H2SO4CaSO4+CO2↑+H2O 碳酸钙(石灰石)加稀硫酸生成硫酸钙加二氧化碳加水Na2CO3+2HCl2NaCl+CO2↑+H2O碳酸钠加稀盐酸生成氯化钠加二氧化碳加水Na2CO3+H2SO4Na2SO4+CO2↑+H2O 碳酸钠加稀硫酸生成硫酸钠加二氧化碳加水Na2CO3+2HNO32NaNO3+CO2↑+H2O 碳酸钠加硝酸生成硝酸钠加二氧化碳加水AgNO3+HCl↓+HNO3 硝酸银加稀盐酸生成氯化银加硝酸2AgNO3+H2SO4Ag2SO4↓+2HNO3 硝酸银加稀硫酸生成硫酸银加硝酸Ag2CO3+2HNO32AgNO3+CO2↑+H2O 碳酸银加硝酸生成硝酸银加二氧化碳加水AgNO3+NaCl↓+NaNO3硝酸银加氯化钠生成氯化银加硝酸钠Ba(NO3)2+H2SO44↓+2HNO3硝酸钡加稀硫酸生成硫酸钡加硝酸BaCl2+H2SO44↓+2HCl 氯化钡加稀硫酸生成硫酸钡加稀盐酸五、碱与某些非金属氧化物反应生成盐和水2NaOH+CO2NaCO3+H2O 氢氧化钠加二氧化碳生成碳酸钠加水2NaOH+SO22SO3+H2O 氢氧化钠加二氧化硫生成亚硫酸钠加水Ca(OH)2+CO2CaCO3↓+H2O 氢氧化钠加二氧化碳生成碳酸钙加水Ca(OH)2+SO 23+H 2O 氢氧化钙加二氧化硫 生成亚硫酸钙加水 2NaOH+SO 32SO 4+H 2O 氢氧化钠加三氧化硫 生成 硫酸钠加水 2KOH +CO 2K 2CO 3+H 2O 氢氧化钾加二氧化碳 生成 碳酸钾加水 2KOH +SO 22SO 3+H 2O 氢氧化钾加二氧化硫 生成 亚硫酸钾加水 Ba(OH)2+CO 2BaCO 3↓+H 2O 氢氧化钡加二氧化碳 生成 碳酸钡加水 Ba(OH)2+SO 23+H 2O 氢氧化钡加二氧化硫 生成 亚硫酸钡加水NaOH+CuSO 2NaOH +3NaOH+FeCl C a (O H )2 Ca(OH)2 CaCO 3+ CaCO 3 生成 CaO +H 2O Ca(OH)2 氧化钙加水 生成 氢氧化钙(消石灰、熟石灰) Ca(OH)2+CO 2CaCO 3↓+H 2O 氢氧化钠加二氧化碳 生成 碳酸钙加水 CaCO 3+CO 2+H 2O Ca (HCO 3)2 碳酸钙加二氧化碳加水 生成 碳酸氢钙 Ca (HCO 3)2 CaCO 3↓+CO 2↑+H 2O 碳酸氢钙 加热 生成 碳酸钙加二氧化碳加水八、部分氧化反应3Fe+2O 23O 4 铁加氧气 点燃 生成 四氧化三铁4P+5O 22O 5 磷加氧气 点燃 生成 五氧化二磷点燃点燃高温△2Cu+O 22CuO 铜加氧气 加热 生成 氧化铜 CH 4+2O 22O+CO 2 甲烷加氧气 点燃 生成 水加二氧化碳 C 3H 8+5O 22O+3CO 2 丙烷加氧气 点燃 生成 水加二氧化碳2C 4H 10+13O 2 10H 2O+8CO 2 异丁烷加氧气 点燃 生成 水加二氧化碳 C 4H 8+6O 2 4H 2O+4CO 2 1-丁烯加氧气 点燃 生成 水加二氧化碳 C 3H 6+O 22+3H 2O 环丙烷(三亚甲基)加氧气 点燃 生成 二氧化碳加水2Mg +O 22MgO 镁加氧气 点燃 生成 氧化镁 C +O 2 2 碳加氧气 点燃 生成 二氧化碳 2C 2H 2+5O 2 4CO 2+2H 2O 乙炔加氧气 点燃 生成 二氧化碳加水 九、其他CO 2+H 2O H 2CO 3 二氧化碳加水 生成 碳酸 H 2CO 3CO 2↑+H 2O 碳酸 加热 生成 二氧化碳和水 2H 2O 22H 2O +O 2↑ 双氧水(过氧化氢)加催化剂二氧化锰 生成 水和氧气2H 2O 2+O 2 水 通电 生成 氢气和氧气2Mg+CO 22MgO+C 镁加二氧化碳 生成 氧化镁和碳 H 2O+Cl 2HCl+HClO 水加氯气 生成 盐酸加次氯酸 3NO 2+H 2O 2HNO 3+NO 二氧化氮加水 生成 硝酸加一氧化氮 2NaHCO 3Na 2CO 3+H 2O+CO 2↑碳酸氢钠(小苏打) 加热 生成 碳酸钠加水加二氧化碳 NH 4HCO 33↑+CO 2↑+H 2O 碳酸氢铵 加热 生成 氨气和二氧化碳和水 Ca(HCO 3)2CaCO 3↓+CO 2↑+H 2O 碳酸氢钙 加热 生成 碳酸钙加二氧化碳加水 Ba(NO 3)2+K 2SO 44↓+2KNO 3 硝酸钡加硫酸钾 生成 硫酸钡加硝酸钾 Ba(NO 3)2+Na 2SO 44↓+2NaNO 3 硝酸钡加硫酸钠 生成 硫酸钡加硝酸钠 BaCO 3+2HNO 3B a (N O 3)2+CO 2↑+H 2O 碳酸钡加硝酸 生成 硝酸钡加二氧化碳加水 点燃△点燃点燃点燃MnO 2△点燃点燃 点燃点燃△△△ 通电点燃2Al 2O34Al +3O 2↑三氧化二氯 通电 生成 铝加氧气2H 2S +O 2+2H 2O 硫化氢+加氧气 点燃 生成4NH 3+6NO 2+6H 2O 氨气加一氧化氮 生成 氮气加水2AgBr +Br 2 溴化银 光照 生成 银加溴2Ag +Br 22AgBr 银加溴 生成 溴化银PbS +4H 2O 24+4H2O 硫化铅加过氧化氢(双氧水) 生成 硫酸铅加水C 2H 6O +3O 22+3H 2O 乙醇加氧气 点燃 生成 二氧化碳加水2KClOCH 32Mg +6CO 2H 2O +V1.0 点燃 光照点燃 通电。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学(上)相关的化学方程式一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 Fe3O43. 铜在空气中受热:2Cu + O2 2CuO4. 铝在空气中燃烧:4Al + 3O2 2Al2O35. 氢气中空气中燃烧:2H2 + O2 2H2O6. 红磷在空气中燃烧:4P + 5O2 2P2O57. 硫粉在空气中燃烧: S + O2 SO28. 碳在氧气中充分燃烧:C + O2 CO29. 碳在氧气中不充分燃烧:2C + O2 2CO过关签字:时间。
(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O (3)氧气的来源:13.氯酸钾受热分解 2KClO3 2KCl + 3O2↑14.加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 2H2O+ O2↑过关签字:时间。
二、自然界中的水:16.电解水:2H2O 2H2↑+ O2↑17.生石灰溶于水:CaO + H2O = Ca(OH)218.二氧化碳可溶于水: H2O + CO2=H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O22MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu 21.氢气还原氧化铜:H2 + CuO △ Cu + H2O22. 镁还原氧化铜:Mg + CuO Cu + MgO过关签字:时间。
四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2CO224.木炭还原氧化铜:C+ 2CuO 2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 CO227.煤炉的中层:CO2 + C 2CO28.煤炉的上部蓝色火焰的产生:2CO + O22CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑30.碳酸不稳定而分H2CO3 = H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2=H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 CaO + CO2↑33.石灰水与二氧化碳反应:Ca(OH)2+ CO2= CaCO3 ↓+ H2O (4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO Cu + CO235.一氧化碳的可燃性:2CO + O22CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O2 2H2O过关签字:时间。
资料赠送以下资料北京重点初中排名北京初中排名榜单,北京重点初中排名是那些?下面是晨露为大家整理的北京初中排名榜单。
希望能给广大北京市即将升学校的学生以及学生家长选择就读学校可以带来帮助。
1 北京中国人民大学附属中学2 北京第四中学3 北京师范大学附属实验中学4 北京师范大学第二附属中学5 北京清华大学附属中学6 北京大学附属中学7 北京第八中学8 北京第一零一中学9 北京第十一中学10 北京市首都师范大学附属中学11 北京第一六一中学12 北京第八十一中学13 北京第五中学14 北京育英中学15 北京第八十中学16 北京第十三中17 北京首都医科大学附属中学初中部18 北京第十五中学19 北京汇文中学20 北京苹果园中学21 北京市石景山区实验中学22 北京第三十五中学23 北京市昌平区第二中学24 北京第二十二中学25 北京师范大学第一附属中学26 北京樱花园中学27 北京上万中学28 北京蓝靛厂中学29 北京第二十中学30 北京玉渊潭中学31 北京裕中中学32 北京师范大学燕化附属中学33 北京师范大学第三附属中学34 北京延庆县第一中学35 北京高丽营第二中学36 北京满井中学37 北京博克图中学38 北京市昌平区第三中学39 北京国子监中学40 北京第二中学分校41 北京牛栏山第一中学42 北京第一一九中学43 北京市密云县新城子中学44 北京郎府中学45 北京东直门中学46 北京良乡第四中学47 北京香山中学48 北京第一零五中学49 北京劲松第一中学50 北京市密云水库中学51 北京丰华中学52 北京北小营中学53 北京奎德素中学54 北京师范大学大兴附属中学55 北京市定福庄中学56 北京回民学校57 北京私立正则中学58 北京铁路第三中学59 北京延庆县太平庄中学60 北京日坛中学分校61 北京市密云县第六中学62 北京市大兴区第八中学63 北京第六十三中学64 北京第五十四中学65 北京市密云县穆家峪中学66 北京第七十八中学67 北京喇叭沟门满族中学68 北京庞各庄中学69 北京温泉第二中学70 北京市通州区宋庄中学71 北京燕化前进中学72 北京长安中学73 北京永乐店中学74 北京万寿寺中学75 北京民族团结中学76 北京李桥中学77 北京延庆县第二中学78 北京丰台区第二中学79 北京市密云县古北口中学80 北京北关中学81 北京市顺义区第三中学82 北京王平中学83 北京云岗中学84 北京南法信中学85 北京仇家店中学86 北京延庆县中学87 北京老官地乡中学88 北京郭家务中学89 北京白家庄中学90 北京第十八中学91 北京市二龙路中学92 北京第六十一中学93 北京第三十九中学94 北京市通州区第六中学95 北京俸伯中学96 北京桦林学校97 北京市海淀北部新区实验中学98 北京市怀柔区九渡河中学99 北京市通州区第三中学《背影》教学设计【教学目标】知识与能力:学习本文选取动人情景,生动描写人物,以情感人的方法。
过程与方法:感受作者朴实的语言风格。
情感态度与价值观:通过体味文章所表现的父子之间的深情,培养学生懂得感受爱,也懂得回报爱的优良品德。
【教学重点、难点】1、作者对“父亲买橘子”的背影方法。
2、儿子对父亲的关心的不解、顿悟、感念的过程。
【预习设计】1、学生需认真朗读全文,弄懂重点词语的音、形、义;2、整体感知文章主要内容,注意事件发生的背景;3、你是如何看待文中的父亲和儿子的?【教学过程】一、导入新课运用多媒体播放歌曲《父亲》,并欣赏一首小诗。
“父爱是拐杖,让我们在人生中少摔跟头。
父爱是良言,让我们作出正确的判断。
父爱是阳光,让我们健康的成长。
父爱是音乐,让我们快快乐乐的生活。
父爱是蜡烛,默默的为我们奉献着自己。
”今天,就让我们一起来学习《背影》,看看这篇文章感人至深的地方究竟在哪里?二、检查预习(小组之内检查)1、正音练习:给加粗的词注音。
变卖典质(diǎn zhì) 颓唐(tuí) 狼藉(jí)交卸(xiè) 奔丧(bèn sāng) 簌簌(sù)晶莹(yíng) 迂腐(yū) 琐屑(suǒxiè)栅栏(zhà) 差使(chāi) 照看行李(kān)妥帖(tuǒ) 蹒跚(pán shān) 踌躇(chóu chú)2、根据解释填词语。
乱七八糟的样子。
狼藉失业在家。
赋闲凄惨暗淡,不景气。
惨淡因为腿脚不灵便,走路缓慢摇摆的样子。
蹒跚言行守旧,不合时宜。
迂腐细小而繁多的事。
琐屑不幸的事接二连三的发生。
祸不单行把自己的财产、衣服出卖和典当出去。
变卖典质精神不振作。
颓唐三、朗读课文,交流探讨1、刚才我已经说过,《背影》是一篇脍炙人口的名篇,几十年来为人们所传诵,这说明大家在读这篇文章的时候肯定给大家留下极其深刻的印象,或者产生了某方面的疑惑,那么同学们在读这篇文章的时候,有没有特别深刻的印象或疑惑。
请同学们自由朗读全文,把自己印象最深刻的地方画下来,然后用“我觉得。
”的句式来谈谈你是如何看待这篇文章的。
在学生回答的过程中,教师应注意引导学生完成以下几项任务。
(1)引导学生体会本文语言的朴实特点,通过读的形式来让学生体会文章的语言虽然平实,但是却很感人。
(2)引导体会文章为什么以“背影”为题?文中写了几次“背影”?那一次写的最详细?作者是如何来详细刻画“父亲为儿子买橘子的背影”的?(播放电视散文《背影》片段)边引导,边朗读,边体会,重点解决:A、“背影”是这篇文章的线索。
第一次是在文章的开头“我最不能忘记的是父亲的背影”。
第二次是父亲为我买橘子时的背影。
第三次是父亲混入来来往往的人群里的背影。
第四次是我收到父亲的来信,在晶莹的泪光中又看到了父亲的背影。
父亲为我买橘子时的背影写得最详细。
B、在描写父亲为儿子买橘子的背影时,引导学生从动作描写入手,细致入微的刻画。
如:“蹒跚”、“探”、“爬”、“攀”、“缩”、“微倾”等词语中体会父爱。
C、从父亲的衣着上来体会、父子衣服的对比(他给儿子做了紫毛大衣)及营造的氛围和心情(悲凉、沉重),帮助学生分析特定背景(祖母去世、父亲赋闲、变卖典质、还了亏空、借钱办丧等等)。
教师总结:作者刻画的这个背影,是自己终生难忘的父亲的背影,他通过写父亲的体态动作、穿着打扮,使我们仿佛看到了一位在奔波劳累中,依然为儿子尽心尽力的伟大的父亲,这也是这篇文章感人至深的地方,打动了千千万万的读者,让我们感受到了博大深沉的父爱。
(3)在送行中,父亲除了为儿子买橘子外,还用什么来表达对儿子的关爱?儿子理解父亲的深情吗?为什么?八年以后,作者在写这篇文章的时候怀的是怎样感情?教师总结:浦口送别的时候朱自清才20岁,因为年轻,所以他当时也会对父亲的琐碎的表达爱的方式表示不满,可是当他在八年后,随着自己心智的成熟,对父爱的感受也发生了很大的变化,对当时的自以为是也感到非常的后悔,自责。
他把自己这种真实的感受,真实的情感勇敢的展现在了众人面前,我想,这就是这篇文章最感人至深的地方。
(4)面对父亲,作者当时是怎样对待自己的父亲的?教师总结:觉得父亲迂腐、令人讨厌。
四、引深拓展1、同学们,看到20岁的朱自清,你是否想到了自己。
你是否也有一些对父母、老师、长辈的关心的不耐烦,是否在有的时候觉得他们的某些言语和举动太过多余,是否有过觉得自己要比他们聪明得多想法?那现在呢?你又怎样看待这些事情呢?学生讲述感人的故事。
