Realtime PCR检测原理和问题处理
RealtimePCR原理及其定量方法

定量PCR技术: 通过对PCR扩增反应中每一 个循环产物荧光信号的实 时检测从而实现对起始模 板定量及定性的分析
2、荧光定量PCR常用的三个概念
扩增曲线、阈值、CT值
plateau phase Liner phase
Exponential phase
Normalised reporter Fluorescence (Rn)
另一种思路
由于PCR反应体系中荧光物质的荧光强度与PCR产物的量成 正比,所以可以用荧光强度来代替PCR产物的量,同时考虑 荧光本底值,则:
Rn= RB+ X0(1+ Ex) Rs
总荧光信号强度=本底信号+分子数量×单位信号强度
Rn:第n个循环时的总信号 RB:本底 RS:单位信号强度 X0:起始DNA数目 Ex:PCR扩增效率
线性关系、扩增效率确认
相关系数(R2):大于0.98 标准曲线斜率: -3 到 -3.5 PCR扩增效率(Ex): 0.9到1.2
扩增效率
106 105 104 103 102 10
荧光强度---循环数曲线
初始模板量对数---C(T)循环数标准曲线
扩增效率理论值为1,即每增加一个循环PCR产物加倍。
实时荧光定量PCR原理和定量方法 一、荧光定量PCR的原理
在PCR反应体系中加入荧 光基团,利用荧光信号累积 实现了实时监测整个PCR进程, 对起始模板进行定量分析的 方法。
三个关键词: 实时,定量,荧光
1、定量与常规PCR的差别
常规PCR技术: 对 PCR 扩 增 反 应 的 终产物进行定量及 定性分析
非理想的PCR反应:
Xn=X0 ×(1+Ex)n
n:扩增循环数 X0:起始模板数量 Xn:第n次循环后扩增产物数量 Ex:PCR扩增效率
Real-timePCR实验原理与技术

实时荧光定量PCR技术原理
01
在实时荧光定量PCR反应中, DNA模板被扩增时,与荧光探 针结合,产生荧光信号。
02
随着DNA的扩增,荧光信号逐 渐增强,通过对荧光信号的实 时监测和分析,可以计算出 DNA的起始浓度。
03
通过标准曲线或内参基因的校 准,可以将起始浓度转化为目 标基因的表达量或基因拷贝数 。
实时监测荧光信号
实时监测荧光信号,确保PCR产物在指数扩增阶段被检测到。
标准化实验流程
建立标准化实验流程,确保实验结果的可靠性和可重复性。
未来展望
新技术应用
01
随着新技术的不断发展,如数字PCR、微流控PCR等,Real-
time PCR技术将得到进一步优化。
高通量检测
02
通过多重PCR和高通量检测平台,实现大规模样本的快速检测。
03
Real-time PCR 实验数 据分析
数据收集与整理
数据收集
在实时PCR实验中,数据收集通常涉 及记录每个循环的荧光信号强度。这 些数据通常以图表形式表示,其中横 轴表示循环数,纵轴表示荧光信号强 度。
数据整理
收集到的原始数据需要经过整理,包 括去噪、去除异常值和标准化等步骤, 以确保数据分析的准确性。
自动化与智能化
03
实现Real-time PCR的自动化和智能化,提高实验效率,减少人
为误差。
THANKS FOR WATCHING
感谢您的观看
real-timepcr实验原 理与技术
contents
目录
• Real-time PCR 实验原理 • Real-time PCR 实验技术 • Real-time PCR 实验数据分析 • Real-time PCR 实验应用 • Real-time PCR 实验注意事项与优化建
Realtime PCR检测原理和问题处理(技术材料)

技术研究
2
★实时荧光定量PCR检测技术
(Real-time PCR) 定量PCR的数学原理
定量PCR的化学原理
定量PCR的光学原理
技术研究
3
什么是PCR?
技术研究
4
PCR的反应过程
技术研究
5
RT-PCR原理图
技术研究
6
荧光定量PCR的数学原理
1、Baseline (基线) 2、Threshold (阈值)
推荐措施:提高引物设计质量,避免形成引物二聚体 补救措施:优化引物浓度和退火温度,专设高温度的收集信号步骤
技术研究
53
实例7:重复性不佳
正常的原始数据
技术研究
54
实例7:重复性不佳
不正常的原始数据
原因:盖子未盖紧,溶液蒸发。
技术研究
55
疾病监测中常用的反应Mix
ABI公司 AgPath-IDOne Step RT-PCR Kit(货号 AM1005)
8
阈值
阈值= 基线(背景)信号的标准偏差的10倍,即 PCR扩增信 号进入相对稳定对数增长的最下限,通常设定在S型扩增曲 线的增长拐点处附近。
技术研究
9Ct值Biblioteka 扩增反应中,当荧光信号增长到大于阈值时所对应的循 环数,即PCR增长信号与 Threshold发生交汇的循环数,也是 FQ-PCR判断阴阳性和进行定量分析的依据。
16
定量PCR的数学原理 定量PCR的化学原理 定量PCR的光学原理
技术研究
17
常用的荧光标记方法
1、DNA双链特异性染料 SYBR Green 、SYTO 9、LC Green、Evagreen
2、序列特异性探针
real-time rt-pcr的原理

real-time rt-pcr的原理
实时反转录聚合酶链式反应(real-time RT-PCR)的原理基于实时荧光定量PCR技术,结合了逆转录(RT)和聚合酶链式反应(PCR)两个技术。
首先,通过逆转录将RNA转录成cDNA。
这个过程由逆转录酶和引物完成,
引物与目标RNA序列的特异性序列互补。
当引物与目标RNA序列结合时,逆转录酶开始参与反应,通过循环变化的温度条件,使RNA序列转录成互补的DNA(cDNA)。
然后,这个cDNA作为模板进行PCR扩增。
PCR反应体系中含有荧光探针和
引物,引物与cDNA的特异性序列互补。
当引物与cDNA序列结合时,通过循环变化的温度条件,使DNA片段扩增。
在PCR扩增过程中,荧光信号发生器被激活,荧光信号开始释放。
荧光信号的释放与DNA片段的扩增相关联,通过检测荧光信号的强度,可以实时监测DNA片段的扩增情况。
通过比较荧光信号的强度与标准曲线,可以确定初始样品中目标RNA的量。
总之,实时反转录聚合酶链式反应是一种高灵敏度、高特异性的RNA检测技术,广泛应用于基因表达分析、病毒检测和基因突变研究等领域。
Realtime_PCR的原理和应用

4
Real time PCR的原理
在扩增产物达到阈值线时: XCt=X0(1+Ex)Ct=M (1) XCt:荧光扩增信号达到阈值强度时扩增产物的量. 在阈值线设定以后,它是一个常数,我们设为M 方程式(1)两边同时取对数得: log M=log X0(1+Ex)Ct(2) 整理方程式(2)得: log X0= -log(1+Ex) *Ct+ log M (3) 最后结论: Log X0与Ct呈线性关系,根据样品扩增的Ct值就可计算出样品中所含的 模板量
影响效率的因素为:引物、镁离子以及探针的浓度
11
Real time PCR数据处理方法
绝对定量的标准样品:
已知拷贝数的质粒DNA,做系列稀释。
标准样品的种类: •含有和待测样品相同扩增片段的克隆质粒 •含有和待测样品相同扩增片段的cDNA •PCR的产物 •含有已知数目的与待测样品相同的扩增片段的细胞
8
Real Time PCR的方法
分子信标的优点 对目标序列有很高的特异性 用于SNP检测的最灵敏的试剂之一 荧光背景低
分子信标的缺点 设计困难 无终点分析功能 只能用于一个特定的目标 价格较高
9
Real time PCR数据处理方法
绝对定量检测起始模板数的精确拷贝数, ������ 标准曲线法
SYBR-Green 的优点 使用方便 ---不必设计复杂的引物 没有序列特异性 ---可以用于不同的模板 便宜 灵敏 SYBR-Green 的缺点
特异性差,会与非特异性产物结合
7
Real Time PCR的方法
Taqman 的优点 对目标序列有很高的特异性 ---特别适合于SNP检测 与Molecular Beacons 相比设计相 对简单 Taqman 的缺点 价格较高 只适合于一个特定的目标 不能进行融解曲线分析
Real Time PCR 检测方法原理

Real Time PCR 检测方法原理■嵌合荧光染料检测法(SYBR Green I)SYBR® Green I是荧光定量PCR最常用的DNA结合染料,能与双链DNA非特异性结合,结合后发出荧光,可以通过检测反应体系中的SYBR® Green I 荧光强度,达到检测PCR产物扩增量的目的。
通过PCR反应生成双链DNA,SYBR® Green I与双链DNA结合发出荧光,通过检测荧光不但可以检测反应体系中的DNA扩增量,同时还能测定扩增产物的DNA融解温度。
具体原理见下图。
嵌合荧光染料法原理图■双标记荧光探针法双标记荧光探针法是使用5’端带有荧光物质(如:FAM等),3’端带有淬灭物质(如:TAMRA等)的双标记荧光探针进行荧光检测的方法。
当探针完整时,5’端的荧光物质受到3’端的淬灭物质的制约,不能发出荧光。
而当双标记荧光探针被分解后,5’端的荧光物质便会游离出来,发出荧光。
当PCR反应液中加入荧光探针后,在PCR反应的退火过程中,荧光探针便会和模板杂交。
进一步在PCR反应的延伸过程中,Taq DNA聚合酶的5’→3’Exonuclease活性可以分解与模板杂交的荧光探针,游离荧光物质发出荧光。
通过检测反应体系中的荧光强度,可以达到检测PCR产物扩增量的目的。
具体原理见下图。
双标记荧光探针法原理图■ CycleavePCR法原理CycleavePCR法是由RNA和DNA构成的杂合Cycling 探针与RNase H组合使用的高灵敏度检测方法,能够高效率地检出目的基因。
Cycling 探针内部夹有RNA部分,一端标记荧光物质,另一端标记淬灭物质,当探针处于完整状态时,由于荧光淬灭作用抑制荧光物质发出荧光,但当探针与扩增产物中的互补序列杂交后,RNase H在RNA部分将探针切断,淬灭抑制作用解除,荧光物质发出荧光,通过测定荧光强度,能够实时监测扩增产物量。
如果探针的RNA部分与模板不匹配,RNase H就不能在RNA部分将探针切断,所以该检出方法是一种即使一碱基不同也能识别的高特异性检出方法,特别适合于SNP解析。
实时定量pcr的原理及应用

实时定量PCR的原理及应用一、什么是实时定量PCR?实时定量聚合酶链反应(Real-time quantitative Polymerase Chain Reaction),简称实时定量PCR,是一种高度敏感且快速的核酸检测技术。
它不仅可以定性地检测目标核酸序列的存在与否,还可以精确测量目标序列的数量。
二、实时定量PCR的原理实时定量PCR利用DNA聚合酶的酶活性,在双链DNA模板上合成新的DNA 链。
该技术的原理是:首先,通过一个DNA引物与目标DNA序列特异性结合,并将DNA聚合酶带有荧光标记的探针与其结合。
然后,在每一轮的PCR循环中,DNA聚合酶将合成新的DNA链,并释放一个荧光信号。
这个荧光信号可以实时地被特定的检测设备及时检测到。
根据荧光信号的量,可以判断目标DNA序列的数量。
实时定量PCR主要包含以下步骤:1.DNA模板的制备:包括从生物样本中提取DNA,如细胞、组织或血液等;2.引物的设计:设计两个与目标DNA序列特异性结合的引物,确保引物的长度和温度适宜;3.反应体系的准备:准备PCR反应体系,包括引物、荧光标记的探针以及DNA聚合酶等;4.PCR循环条件的设定:确定PCR循环的温度和时间条件以实现合成新的DNA链;5.实时检测和数据分析:通过特定的实时定量PCR设备实时检测荧光信号,并根据标准曲线计算目标DNA序列的数量。
三、实时定量PCR的应用实时定量PCR在生物医学研究和临床诊断中具有广泛的应用。
以下是实时定量PCR常见的应用领域:1. 生物学研究实时定量PCR可以用于研究基因表达的变化,从而揭示生物体内基因调控的机制。
它可以定量测量不同组织或细胞中特定基因的表达水平,帮助科研人员了解基因在不同生理状态下的功能和调控网络。
2. 分子诊断实时定量PCR在疾病的分子诊断中扮演着重要角色。
通过对人体样本中特定基因的定量检测,可以帮助医生确定某些疾病的存在,并评估疾病的严重程度。
实时荧光定量pcr检测原理

实时荧光定量pcr检测原理实时荧光定量PCR(Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法。
这种方法通过内参或者外参法对待测样品中的特定DNA序列进行定量分析。
Real-timePCR是在PCR扩增过程中,通过荧光信号,对PCR进程进行实时检测。
由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。
实时荧光定量PCR的基本原理是利用DNA聚合酶的5’-3’外切酶活性,在DNA合成过程中检测荧光信号的变化。
当DNA聚合酶与特定荧光染料标记的DNA引物结合时,荧光染料会被标记在引物的3’端。
在PCR反应过程中,每当DNA聚合酶添加一个核苷酸到引物3’端时,聚合酶的外切酶活性将荧光染料从引物上切割下来,释放出荧光。
通过实时检测荧光信号的变化,可以实时监测DNA的合成过程。
实时荧光定量PCR的定量原理是利用PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系。
在PCR扩增的指数时期,随着循环次数的增加,DNA产物的量呈指数增长。
在这个阶段,每个循环的DNA产物量与上一个循环的DNA产物量成比例。
因此,通过实时检测荧光信号的变化,可以确定PCR进程中的DNA产物量。
由于每个模板的起始拷贝数不同,因此不同模板的Ct值也不同。
通过比较不同模板的Ct值,可以确定模板的起始拷贝数。
实时荧光定量PCR具有许多优点,如高灵敏度、高特异性和高自动化程度。
它可以用于多种类型的样本检测,包括血液、组织、细胞培养液等。
此外,实时荧光定量PCR还可以用于基因表达分析、突变检测和病原体鉴定等应用。
实时荧光定量PCR是一种非常有用的技术,可以用于多种类型的样本检测和分析。
它的基本原理是利用DNA聚合酶的外切酶活性和荧光染料标记的引物来实时监测DNA的合成过程。
通过比较不同模板的Ct值,可以确定模板的起始拷贝数,从而实现定量分析。
Real-time_PCR_原理(非常经典的PCR文档)
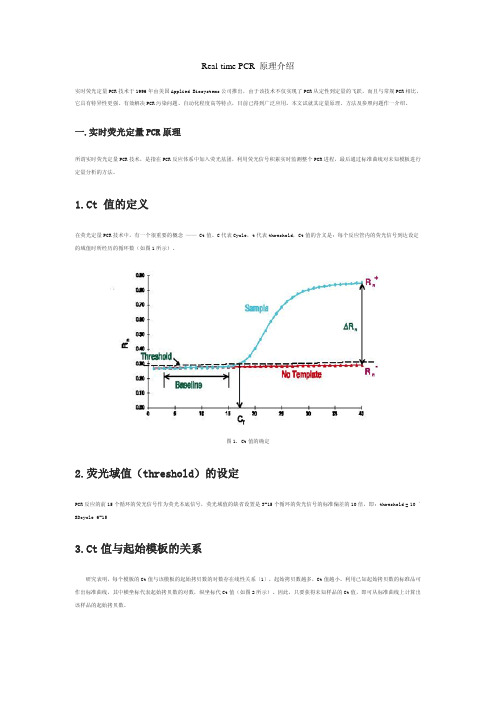
Real-time PCR 原理介绍实时荧光定量PCR技术于1996年由美国Applied Biosystems公司推出,由于该技术不仅实现了PCR从定性到定量的飞跃,而且与常规PCR相比,它具有特异性更强、有效解决PCR污染问题、自动化程度高等特点,目前已得到广泛应用。
本文试就其定量原理、方法及参照问题作一介绍。
一.实时荧光定量PCR原理所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
1.Ct 值的定义在荧光定量PCR技术中,有一个很重要的概念 —— Ct值。
C代表Cycle,t代表threshold,Ct值的含义是:每个反应管内的荧光信号到达设定的域值时所经历的循环数(如图1所示)。
图1. Ct值的确定2.荧光域值(threshold)的设定PCR反应的前15个循环的荧光信号作为荧光本底信号,荧光域值的缺省设置是3-15个循环的荧光信号的标准偏差的10倍,即:threshold = 10 ´ SDcycle 6-153.Ct值与起始模板的关系研究表明,每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系〔1〕,起始拷贝数越多,Ct值越小。
利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代Ct值(如图2所示)。
因此,只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数。
图2. 荧光定量标准曲线4.荧光化学荧光定量PCR所使用的荧光化学可分为两种:荧光探针和荧光染料〔2〕。
现将其原理简述如下:1)TaqMan荧光探针:PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
real-time pcr原理

real-time pcr原理
实时聚合酶链反应(real-time PCR)是一种广泛应用于分子生
物学研究中的技术,用于检测和定量DNA或RNA的存在。
与传统聚合酶链反应(PCR)相比,实时PCR能够提供更快、更准确的结果。
实时PCR基于聚合酶链反应原理,通过扩增目标DNA或
RNA序列来检测其存在。
实时PCR使用一对特异性引物,即
前向引物和反向引物,与目标序列的两侧结合。
在反应过程中,DNA聚合酶会复制模板DNA,并在每个引物的结合位点依次
合成新的DNA链。
然而,与传统PCR不同的是,实时PCR在反应混合物中加入
了一种叫做探针的荧光探测剂。
这种探针通常由一个引物和一个荧光信号发生器组成。
当探针与目标序列结合时,引物会选择性地与模板DNA结合,并将荧光信号发生器离开。
在PCR
反应进行的同时,荧光信号会产生,并且可以实时监测到
PCR反应的进程。
实时PCR设备一般配备了一个光学系统,可以记录PCR反应
过程中产生的荧光信号。
光学系统能够定量检测荧光信号的强度,并将其转化为DNA或RNA的相对数量。
这使得实时
PCR能够定量目标DNA或RNA序列在样本中的存在量。
总的来说,实时PCR结合了PCR的增幅特性和荧光技术的快
速检测特性,可以在PCR反应进行的同时实时监测和定量目
标DNA或RNA序列的存在量。
这使得实时PCR成为现代分子生物学研究中的重要工具。
Real-time PCR数据分析

由于Real-time qPCR 的众多优点,现在已是生命科学领域的一项常规技术。
越来越多的研究文章中涉及RT-PCR 的实验,也基本上被real-time qPCR 所代替。
由于real-time aPCR 输出的数据不同于常规的PCR 电泳检测,不少没有做过real-time qPCR 的研究者往往感到高深莫测,不知从何入手;甚至一些做过次实验的研究者也会对数据处理分析感到迷惑,不知所措。
本文就从real-time qPCR 的发展史说起,包括real-time qPCR 的原理,实验设计,实际操作,数据分析,常见问题解答五个方面,手把手教你从各个方面了解real-time qPCR,彻底的从菜鸟到高手!一、Real-time qPCR 发展史Real-time qPCR 就是在PCR 扩增过程中,通过荧光信号,对PCR 进程进行实时检测。
由于在PCR 扩增的指数时期,模板的Ct 值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。
由于常规的PCR 的缺点,real-time qPCR 由于其操作简便,灵敏度高,重复性好等优点发展非常迅速。
现在已经涉及到生命科学研究的各个领域,比如基因的差异表达分析,SNP 检测,等位基因的检测,药物开辟,临床诊断,转基因研究等。
在Real-time qPCR 技术的发展过程中,定量PCR 仪的发展起了至关重要的作用。
1995 年,美国PE 公司(已经并入Invitrogen 公司)成功研制了Taqman 技术,1996 年推出了首台荧光定量PCR 检测系统,通过检测每一个循环的荧光强度,通过Ct 值进行数据分析。
从而荧光定量PCR 获得广泛应用。
现在的定量PCR 仪有ABI7000、7300、7500,7700、7900HT、StepOnePlusTM、StepOneTM、PRISM@StepOneTM 系列;BIO-RAD 的CFX96、iCycler iQ5@、MyiQ@、MJ Research Chromo4TM Opticon 系列;Stratagene MxTM 系列;Roche LightCycler@ 系列;Eppendorf Masercycler@;Corbett Rotor-GeneTM;Cepheid SmartCycler@和BIOER 的LineGene 系列。
Real Time PCR技术原理及常见问题

普洛麦格(北京)生物技术有限公司 电话:800 810 8133,010 58256268
中文网址:
2 / 11
Promega (Beijing) Biotech Co., Ltd 英文网址:
2.B 染料法原理——特异性与双链 DNA 结合的荧光染料
中文网址:
Promega (Beijing) Biotech Co., Ltd 英文网址:
3 / 11
3. Real Time PCR 数据分析
Real Time PCR 实验完成后,通常可以得到以下三组数据:扩增曲线、标准曲线(只有采用标准品时才 有)、溶解曲线(只有染料法才有)。对 Real Time PCR 结果进行分析,主要是研究此三组数据。
Real Time PCR 技术原理及常见问题
Promega GoTaq® Amplification Family
目录
1. End-Point vs. Real Time PCR(终点法与实时荧光定量 PCR) ................................................................................ 1
3. Real Time PCR 数据分析 ......................................................................................................................................... 4 4. 相对定量 vs 绝对定量 ......................................................................................................................................... 5
Real-Time qPCR实验教程和结果问题分析

Real-Time qPCR实验流程一、①实验前准备,每天早上到实验室后,先把超净工作台的紫外灯打开15-20分钟。
②超净台前做实验,需佩戴干净的橡胶手套/一次性薄膜手套,RNA抽提需带口罩。
③取EP管/枪头时需用镊子,不可以用使用过的手套直接取用。
取完EP管/枪头后,袋子及时封好。
④橡胶手套须放入超净台照射紫外,实验操作过程中不得带出超净台,移液器在一天工作结束后调至最大量程,并用75%乙醇清洁移液器,枪头盒及超净台面。
⑤实验进行的过程中或观看实验时,没有带口罩不要在超净台前讲话。
二、总RNA抽提1)细胞培养皿中细胞样品用1*PBS洗两次后,用1ml枪将PBS吸干净,加入1ml Trizol (invitrogen)溶液,吹打混匀,并吸至1.5ml RNase free EP管中使细胞充分裂解,室温静置5min;组织样品用液氮充分研磨,加入1ml Trizol (Invitro gen)溶液,混匀,室温放置5min使其充分裂解;(管盖与管壁都需标记样品名称)2)加入200μl氯仿,剧烈振荡混匀30s,使水相和有机相充分接触,室温静置3-5min;(离心时离心管按顺序排放,离心完毕,离心管的顺序也按顺序排好,与第一步的顺序一致)3) 4℃下,14,000g离心15min,可见分为三层,RNA在上层水相,移至另一个新的RNase free EP管;(用20-200ul的枪吸取上清,吸上清时,枪头应沿着液面上层吸取上清,枪头不可碰到、吸到中间层)4)沉淀RNA:加入等体积异丙醇,轻柔地充分混匀(颠倒6-8次)(不应用振荡器混匀),室温静置10min;5)4℃下,14,000g离心10min,收集RNA沉淀(如离心后仍不见EP管底部有沉淀,应将EP管放置在-80度冰箱过夜,继续在4℃下,14,000g离心10min,收集RNA 沉淀),去上清;6)用75%乙醇洗涤两次(12,000g离心5min)(加入乙醇后只需轻轻颠倒EP管即可,不用振荡器震荡或枪头吸打沉淀),超净台风干;沉淀不能过干或过湿,过干则不易溶解,过湿则乙醇残留。
Real-time PCR 原理介绍
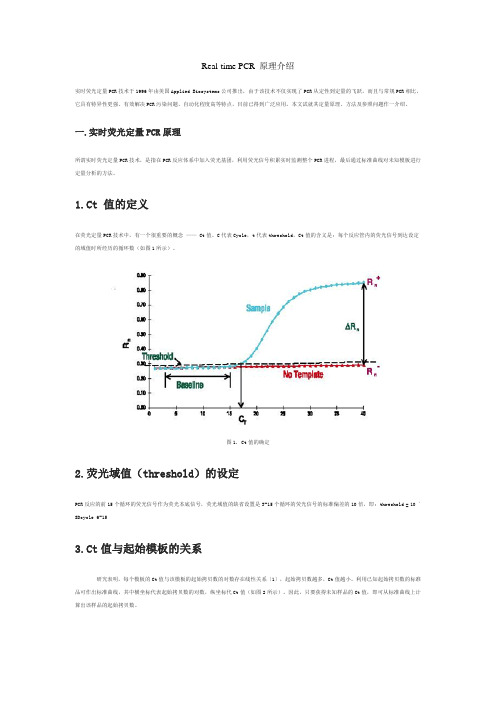
Real-time PCR 原理介绍实时荧光定量PCR技术于1996年由美国Applied Biosystems公司推出,由于该技术不仅实现了PCR从定性到定量的飞跃,而且与常规PCR相比,它具有特异性更强、有效解决PCR污染问题、自动化程度高等特点,目前已得到广泛应用。
本文试就其定量原理、方法及参照问题作一介绍。
一.实时荧光定量PCR原理所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
1.Ct 值的定义在荧光定量PCR技术中,有一个很重要的概念—— Ct值。
C代表Cycle,t代表threshold,Ct值的含义是:每个反应管内的荧光信号到达设定的域值时所经历的循环数(如图1所示)。
图1. Ct值的确定2.荧光域值(threshold)的设定PCR反应的前15个循环的荧光信号作为荧光本底信号,荧光域值的缺省设置是3-15个循环的荧光信号的标准偏差的10倍,即:threshold = 10 ´SDcycle 6-153.Ct值与起始模板的关系研究表明,每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系〔1〕,起始拷贝数越多,Ct值越小。
利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代Ct值(如图2所示)。
因此,只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数。
图2. 荧光定量标准曲线4.荧光化学荧光定量PCR所使用的荧光化学可分为两种:荧光探针和荧光染料〔2〕。
现将其原理简述如下:1)TaqMan荧光探针:PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
RealTimeRTPCR常见问题分析

Real-Time RT-PCR常见问题分析1.某一孔荧光信号特别强问题:同一批样品,其中某一个荧光信号特别强?原因:①试剂配制时反应液没完全溶化,导致探针量在一管中增多;②试剂配制时没有充分混匀致各管中各成分的量不同;③也可能是PCR仪热槽被荧光物质污染,这时就要清除热槽中的污染;2. 扩增曲线有一向上或向下的尖峰问题:扩增曲线有一向上或向下的尖峰?原因:①反应过程中电压不稳定;②可能在20循环左右仪器有停下或者仪器有开盖,使得光线突然增强;③如果尖峰向下,也可能是卤素灯老化所致,这时应更换;3. 部分样本扩增效率过低问题:部分样本扩增效率过低?原因:①提取液残留,一定程度抑制了PCR反应;②反应液未严格取量混匀或分装不均匀;③试剂失效;4.阴性对照或空白对照翘尾,可能原因:1、模板提取环境有污染。
2、模板提取操作有污染。
3、配液过程存在污染。
问题:阴性对照或空白对照翘尾?原因:①模板提取环境有污染;②模板提取操作有污染;③试剂配制过程存在污染;5. 直线型扩增曲线问题:直线型扩增曲线?原因:①探针部分降解(探针降解原因:a.探针反复冻融――稀释的探针可在4℃保存至少3个月,应避免反复冻融;b.探针在光线下暴露时间太长);②反应液中有PCR抑制物;6.没有扩增曲线问题:没有扩增曲线?原因:①PCR参数设置错误,在设计循环参数时将荧光信号读取时间设在反应的第一步,即stage 1阶段;②电脑设定了自动休眠;7.基线下滑问题:扩增曲线有一个下滑阶段?原因:基线选取范围不对,可试着将基线范围改大一些,这一问题常因试剂质量所致;8.扩增曲线断裂问题:扩增曲线断裂?原因:基线选取范围不对,基线终点大于Ct值,这通常是由于模板DNA浓度过高所致,因Ct值<15,而基线范围仍取3-15,其中包含部分扩增信号,导致标准差偏大,阈值过高,解决办法:减少基线终点至Ct值前4个循环,重新分析数据9.样品浓度跨度过大样品浓度过高,至阳性样品扩增曲线在后面循环中呈一向下的直线,原因及解决办法同“扩增曲线断裂”。
Real-time_PCR(从原理到实验方法及数据分析)

•
绝对定量:从荧光到拷贝数
The well contains 400 target copies
Y= mx+b
Ct values
0
Ct‘s
1
2
3
4
5
6
7
Log copy number
相对定量:参照因子 Calibrator
用以比较结果的基准
time t =0 t=12 t=24 t=48
total RNA total RNA
t=0 t=1h
2.0 1 0.1
t=6h t = 24 h
相对定量研究软件
• • • 同时分析多达10块反应板的基因表达数据 – 多至960个数据点的单击分析 – 数据直观 通过ΔΔCT (比较 Ct)法完全自动分析数据 无须将数据导出至电子数据表或多次数据导出
终点检测 终点检测
等位基因分型 等位基因分型 阴性阳性鉴定 阴性阳性鉴定
Workflow
mirVana™ miRNA Isolation Kit
TaqMan® MicroRNA RT kit TaqMan® MicroRNA Assays
TaqMan® Universal Master Mix,No UNG
Five Fully Integrated Systems for Real-Time PCR
•
•
正常与突变探针在同一管里反应的点突变检测
基因分型检测
FAM VIC Homozygote for FAM-specific allele
VIC FAM Homozygote for VIC-specific allele
FAM VIC
Heterozygote for both alleles
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
只有染料法才需要做熔解曲线,探针法没必要。
原始图谱
导数图谱
精品课件
SYBR Green I的优缺点
• 成本低 不需要制备序列特异的针对性探针,且试剂便宜
• 适合初步筛查 先用SYBR筛查,再对少数关键样品用探针法确认
• 配合熔解曲线分析 需鉴定PCR反应是否有杂带、引物二聚体
• 特异性问题 不能分辨主带与杂带,给出所有双链DNA的总信号
精品课件
[DNA]0
确定初始模板的浓度 初始DNA量越多, 荧光达 到某一值(域值)时所需 要的循环数越少 Log浓度与循环数呈线性 关系,根据样品扩增达到 域值的循环数就可计算出 样品中所含的模板量
精品课件
Real-time PCR动力学曲线和四个阶段
只有在荧光信号 指数扩增阶段, PCR 产物量的对数值与起始 模板量之间存在线性关 系,我们可以选择在这 个阶段进行定量分析。
阈值
阈值= 基线(背景)信号的标准偏差的10倍,即 PCR扩增信 号进入相对稳定对数增长的最下限,通常设定在S型扩增曲 线的增长拐点处附近。
精品课件
Ct值
扩增反应中,当荧光信号增长到大于阈值时所对应的 循环数,即PCR增长信号与 Threshold发生交汇的循环数,也 是FQ-PCR判断阴阳性和进行定量分析的依据。
精品课件
TaqMan探针的作用机理
精品课件
Taqman探针
优点
1. 灵敏、特异性高: 每扩增一个特异产物只释放一个分子的荧光染 料,实时检测特异扩增片断,非特异产物对检测信号没有影响,有 效提高检测的专一性
2. 有多种不同波长的荧光基团对可供选择,可以实现在同一管内检测 多重PCR,降低成本也提高效率和准确性
单链DNA,SYBR Green被释放,荧光信号逐渐减弱; • 当体系到达某一特定温度时,某些DNA双链会突然完全解离,
荧光强度也显著减弱; • 对融解曲线求一阶导数,峰值代表斜率改变最大值,该处所
对应的横坐标值(温度),即Tm
精品课件
融解曲线(Dissociation curve)
PCR双链产物荧光强度与温度的函数图,用于确认产物的特异性。
Baseline 基线
3、Threshold Cycle (CT
值)
Threshold Cycle (CT值)
4、[DNA]0 (初始模板)
精品课件
Thresபைடு நூலகம்old (阈值)
[DNA]0 (初始模板)
基线
反应荧光明显增加前的背景荧光值。默认为 3-15 cycles的信号值
线性图谱
精品课件
对数图谱
精品课件
★实时荧光定量PCR检测技术
(Real-time PCR) 定量PCR的数学原理
定量PCR的化学原理
定量PCR的光学原理
精品课件
什么是PCR?
精品课件
PCR的反应过程
精品课件
RT-PCR原理图
精品课件
荧光定量PCR的数学原理
1、Baseline (基线) 2、Threshold (阈值)
• 基本程序: -解链; -复性; -升温检测; -降温;
• 软件自动分析
精品课件
融解曲线(Dissociation curve)
PCR双链产物荧光强度与温度的函数图,用于确 认产物的特异性。
• Tm值:50%DNA变成单链时所需要的温度,此温度与双链DNA
的长度、GC含量有关,可部分代表产物序列的特异性; • PCR反应完成后,控制体系温度缓慢升高,双链DNA解链成为
精品课件
SYBR Green I 工作原理
1、每形成一个DNA双链,就有一定数量的染 料结合上去
2、染料一结合,就产生荧光信号 3、信号强度与DNA分子总数目成正比
精品课件
SYBR Green I工作原理图片演示
精品课件
熔解曲线(Dissociation curve)
目的:在PCR之后分析产物特异性
• 多重定量问题 每个PCR管只能检测一个目标基因
精品课件
Taqman原理
Taqman荧光定量技术是以Taqman荧光探针 为基础,Taqman荧光探针为一寡核苷酸,两端分别 标记一个荧光报告基团和一个荧光淬灭基团。探针 完整时,发射基团发射的荧光信号被淬灭基团吸收; PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶 切降解,使荧光发射基团和荧光淬灭基团分离,从 而荧光监测系统可接收到荧光信号,即每扩增一条 DNA链,就有一个荧光分子形成,实现了荧光信号的 累积与PCR产物形成完全同步,从而实现定量。
Real-time PCR检测技 术原理和问题处理
2014-06-25
精品课件
★实时荧光定量PCR检测技术
(Real-time PCR)
✓ 荧光定量PCR(Realtime fluores-cence quantitative PCR,RTFQ PCR)是1996年由 美国Applied Biosystems 公司推出的一种 新定量实验技术,它是通过荧光染料或荧 光标记的特异性的探针,对PCR产物进行标 记跟踪,实时在线监控反应过程,结合相 应的软件可以对产物进行分析,计算待测 样品模板的初始浓度。
PCR理论方程只 在指数期成立。
精品课件
PCR产物的量与扩增循环数间的 理论方程
Rn = RB + X0 (1+ e)n Rs
Rn :第N次PCR循环时的荧光信号强度 RB :背景信号强度 X0 (1+ e)n Rs :每个分子的荧光强度与分子数目的乘积
经过一系列移项、取对数等复杂数学公式变换:
得到:Ct = k lg X0 + b 线性方程, lg X0 越大,则CT值越小!
1、DNA双链特异性染料 SYBR Green 、SYTO 9、LC Green、Evagreen
2、序列特异性探针 TaqMan 、Molecular Beacons(分子信标)、
Dual Probes (FRET)、LNA(Locked Nucleic Acid) Double-Dye probes
精品课件
从荧光信号实现定量结果
一、检测荧光信号增长,获取样品CT值
精品课件
从荧光信号实现定量结果
二、绘制标准曲线
精品课件
从荧光信号实现定量结果
三、以待测样品的Ct值对[DNA]0作图,得到定量结果
精品课件
定量PCR的数学原理 定量PCR的化学原理 定量PCR的光学原理
精品课件
常用的荧光标记方法
