单官能团的切断
重要化合物的切断分析

CH3
Example 1:
3-甲基色酮的合成
CH3
O
CH3
CH3
O
OH O CH3
OH
O
CH3 + HCO2C2H5
Br (3) H3O ,加热
CH3CH2O-Na CO2C2H5 HCO C H 2 2 5 OH
CHO CO2C2H5
(1)CN(2)水解 COOH
COOH
逆合成分析:
Ph Ph OH CN + OH CHO OH OH C2H5O2C OH + CH2O OH
OHC
Synthesis:
CH2O CHO K2CO3 OHC HO2C (1)CN OH (2)OH-/H2O OH Ph Ph OH OH OH OH
CO2H
某些可能的负离子片段的相对稳定性可以用来指导进 行切断
O Ph BuO2C Ph CO2Bu
O O Ph BuO2C Ph CO2Bu Ph BuO2C CO2Bu + PhCCl
Ph
Br
+ BuO2C
CO2Bu
各种各样的甲基酮可以用甲酸酯和醇钠加以酰化,产物理 应为β-酮醛,但它们与α-羟亚基甲基酮成为互变异构体, 并几乎完全以后一种形式存在。
CH3COCH3 H
+
OH H3C C CH3 CH3
-H+
OH H3C C CH2
H3C C CH2 + H3C C OH OH
官能团的去除

CH3 OAc
2)磺原酸酯的的热消除——楚加耶夫反应
此反应与羧酸酯的热解相似,也为顺式消除,通常首先 制备黄原酸酯,然后将其直接或在惰性溶剂中加热。
优点:热解温度较低(100-200 oC),无异构化和重排产物生成; 缺点:多步合成黄原酸酯,热解时掺杂含硫杂质。
4.β-羟基酸可与多种试剂作用脱羧兼脱水生成烯烃。例如:
卡宾反应:又称碳宾、碳烯,通常由含有容易离去基团的分子 消去一个中性分子而形成。一般以R2C:表示,指碳原子上只有两个 价键含有基团,还剩两个未成键电子的高活性中间体。其寿命远 低于1秒,只能在低温下(77K以下)捕集,在晶格中加以分离和 观察
卤代烷的α-消除反应 多卤代烷在碱作用下,消除α-H,得卤代 烷基负离子,但不稳定,再消除一个卤离子,得卡宾。 例如:
β-氯代醚的消除 的产率。
β-氯代醚用强碱处理可生成炔醇,且具有良好
炔烃在用碱处理时,会发生碳碳三键的位置异构。
α-二酮的脱氧 在氮气存在下与亚磷酸三乙酯一起共热可脱 氧生成炔烃。 例如:
O C6H5 C O C C6H5 (C2H5O)3P/N2 C6H5 C C C6H5
二、羟基的去除
常用的脱水剂有酸(硫酸,磷酸,草酸等)、酸性氧化物
高等有机化学 ——官能团的除去
讲解内容
卤代烃脱卤化氢
醇脱水
季铵盐及其碱的热解
羧酸酯、黄原酸酯、氧化叔胺的热 解
引入碳碳双 键或三键
其他消除反应
一、卤代烃的消去反应
卤代烷的α-消去反应 烯) 同一原子上失去两个基团 ,生成卡宾(碳
有机化学逆合成分析

试设计以下化合物的合成路线 分析:
合成:
试设计以下化合物的合成路线 分析:
合成:
试设计以下化合物的合成路线 分析:
合成:
试设计以下化合物的合成路线 分析:
合成:
说明:
反应的应用
O
HO
CH2COOC2H5
+ BrCH2COOC2H5
(1) Zn/苯
(2) H2O
CO
H
Ph
+
O
Br
OC2H5
OC2H5
O
Ph
HO
OC2H5
O
Ph
(1) Zn/苯
(2) H2O
H+, △
α,β-不饱和羰基化合物的拆开
本节主要讨论问题: 合成α,β-不饱和醛或酮的反应 α,β—不饱和羰基化合物的拆开通式 逆合成分析举例
例3 试设计以下化合物的合成路线
合成:
例4试设计以下化合物的合成路线 分析:
合成:
例5试设计以下化合物的合成路线 分析:
合成: 例 6 试设计以下化合物的合成路线
分析:
合成:
α-羟基酮的拆开 方法一: 例1试设计以下化合物的合成路线 分析: 合成:
例2 试设计以下化合物的合成路线 分析: 合成:
丙二酸酯参与Knoevenagel的反应 芳香醛和丙二酸酯反应: 脂肪醛和丙二酸酯反应则生成混合产物:
C 制备各种肉桂酸酯 氰乙酸参与的Knoevenagel的反应
例1. 芳醛与氰乙酸酯 例2. 脂肪醛和氰乙酸酯生成混合产物
例3 酮与氰乙酸间发生的缩合反应 例4 其他活泼亚甲基的化合物参与的反应
第五节 1,5—二羰基化合物的拆开 一、迈克尔加成反应 通式:
2.1 切断法解析

室中均感不便,而
采用(2 )为中间 体的路线虽然长些
但却较为简单。这
条路线还算较短, 便用的是廉价起始
原料,而且每步给
出高产率。
设计一个合成的例行程序
1. 分析
认出目标分子中的官能团 用相当于已知和可靠的反应进行切断 进行切断以到达易于取得的起始原料
2. 合成
根据分析写出合成计划,加进试剂和条件 根据实验室中遇到的失败和成功,修改计划
第二章 切断法
• 本书旨在帮助你自行设计合成而不着重于讲述他人所设计 的合成。但书中包括许多他人工作的实例,因为在任何书 里借助例题学习知识始终是重要的。本章先展示一下以后 要发生的情景,以便让你不必过多关心合成的细节而要着 重关心合成之通法。
• 酮(1 )是个从廉价起始原料成吨地生产的重要工业化学 献,并被用于合成维生素A 和某些食用香精和香料。 高压、高温在实验
• 这些碎片(3 )和(4)都是合成子― 它们是想象中的碎片,可能被 牵涉到反应之中,也可能不被卷入,但它们都有助于使我们明白该用 哪些试剂。此处碰巧(4)是合成中的一个中间体,而不是(3 )。 分析完成后,必须以实际所用的试剂来代替合成子。一个负离子型合 成子的试剂往往是相应的烃;一个正离子型合成子的试剂往往是相应 的卤代物。
• 芳香腈(15)可
以极容易地按重 氮法加以切断。 由重氮盐的亲核 取代反应而制得 的芳族化合物
• 卤代物的亲核取代反应
• 只有当邻位和对位存在硝基或类似的吸电子基团时卤原子 才可能从芳环上被取代出来。幸运的是这种化合物易于通 过硝化反应制得:
• 如三氟拉灵B (17)之类的芽前除草剂可作为这条路线的优 秀代表。氨基可按此法引入,而两个硝基则可通过直接硝 化加以引进。起始原料( 18 )的合成将在第三章中加以 讨论。
逆向合成分析法之切断技巧

逆向合成分析法之切断技巧
作者:路杰
来源:《高中生学习·高二文综版》2015年第03期
有机化合物是由骨架、官能团和立体构型三部分组成。
有机化合物的性质主要是由分子中官能团决定的,但官能团是附着在骨架之上,所以在考虑有机合成时应优先考虑骨架的形成,官能团才会有归宿。
但同时,骨架的形成又离不开官能团的作用,碳碳键形成的位置常在官能团所在位置或受官能团影响的部位上,因而要形成碳碳键,必须先要引入成键反应所要求的官能团。
可见骨架形成和官能团的引入是设计合成路线最基本的两个要素,尤其以骨架的形成是设计合成路线的核心。
(参考资料)有机合成切断法简述

O Cl O Ph
R1NH2
O HNR1 O
O
反应
Ph
HNR2 O
H2
Ph
催化剂
O
O
HNR2 OH
HNR2 O
O
O
RCOCl
RNH2
F
AlCl3 F
RHN
准则六:尽量选择生成单一产物的反应作为一系列反应的起始反应。对 于芳香族化合物,如果邻对位取代基都要引入的话,先引入对位取代基 比较好。
第四章:单个基团C-X切断法
1、羰基衍生物:从羰基与杂原子处切断(注意羰基衍生物的反应活性)。 2、醚及硫醚的合成。
第五章:化学选择性
第二章:芳香族化合物的合成
1、切断和官能团转换。 2、亲电反应。 3、亲核反应。
第三章:次序先后问题(芳香族)
准则一:考虑每个官能团彼此的相互影响。 准则二:官能团的变化能显著改变反应活性。
CH3
CH3 Cl2
CCl3 SbF5
CF3
Cl
PCl5 Cl
Cl
准则三:有些取代基很难引入,所以最好直接选择带这些基团的原料。 比如沙丁胺醇的合成以水杨酸乙酰氯为原料。 准则四:一些双取代化合物是可以买到的,比如一些不容易通过亲电取 代得到的 双取代化合物(特别是邻位双取代)。 准则五:一些取代基可以通过亲核取代引入到苯环上。
HO OH
HO NHtBu
沙丁胺醇
第八章:胺的合成
1、酰胺还原。
O
N
N
NH + RCOCl
2、还原胺化:先与醛或酮形成亚胺盐,再用NaB(CN)H3或NaB(OAc)3H或 氢化催化还原。 3、腈的还原(缺点:毒性大)。 4、硝基化合物还原。 5、Riter反应:腈与叔碳正离子反应先成酰胺再还原或水解。 6、卤烷与NaN3反应成叠氮烷再还原(缺点:易爆炸)。
华理碳链增长与切断

逆向切断:
HO Ph
O O NMe2 HO Ph
O OEt Ph O COOEt
COOEt
合成:
Ph
O HBr COOEt
CN-
70%H2SO4
OHO
H3O△
EtOH O ZnBr HO Ph OEt
O O
HOCH2CH2NMe2 HO Ph
O
NMe2
㈢1,5氧化官能团
O
TM17
COOEt
O
含1,5二氧化和1,3二 氧化优先考虑1,5氧 化
OH
O
1 2
O
OH
安息香缩合反应或酯还原反应
O CHO NaCN 乙醇 OH
注意碳链的对 称性,偶数碳
OH COOEt Na/二甲苯 O
⑷邻位二酮
1 2
O O
由相应的碳链氧化得到
SeO2
O O O CCH2 Pb(AC)4 O C O C
无氢的酮
1,2二氧化官能团目标分子合成例题
炔钠是亲核试 剂
羧基由氰 基水解 TM3
OH COOH
TM1
C Me
OH C CH
COOH
氨基与羟基可转 化
3°醇 TM4
OH OH OH
TM2
NH2 COOH
㈡1,3氧化官能团
β羟基酮
OH
1 2
O
3
αβ不饱和醛、酮、酯
3 1
CHO
2
2 1
3
β二酮
O O
O
1 3 2 2 1
2
β酮酸酯, β二酸酯
1 2 3
3
COOEt
O
逆向切断:
有机物衍生关系及官能团的引入和消除

1、官能团的引入和转换: 、官能团的引入和转换:
(7)酯基的引入方法:①酯化反应的发生;②酯交换反 酯基的引入方法: 酯化反应的发生; 酯基的引入方法 应的发生。 应的发生。 (8)硝基的引入方法:硝化反应的发生。 硝基的引入方法: 硝基的引入方法 硝化反应的发生。 (9)氨基的引入方法:①-NO2的还原;②-CN的加氢 氨基的引入方法: 的还原; 氨基的引入方法 的加氢 还原; 蛋白质的水解。 还原;③肽、蛋白质的水解。 (10) 氰基的引入方法:①烯烃与HCN的加成;②炔烃 氰基的引入方法: 烯烃与 的加成; 的加成 的加成。 与HCN的加成。 的加成
有机合成题的常规解题方法
顺合成法: 顺合成法: 逆合成法: 逆合成法: 综合比较法: 综合比较法:
例题
以对二甲苯和乙醇为主要原料合成聚酯纤维
O HO C O C O CH2CH2O H n
例题
已知①溴单质通常与 起加成反应, 已知①溴单质通常与>C=C<起加成反应,但在高温下 起加成反应 溴易取代与>C=C<直接相连的碳原子上的氢原子②与 直接相连的碳原子上的氢原子② 溴易取代与 直接相连的碳原子上的氢原子 苯环直接相连的侧链碳原子上的氢原子在光照下也易被 溴取代
CH2 CH2 CH3 CH CH CH2 OH OH OH
例题
有机合成上通常通过下述两步反应在有机物分子碳 链上增加一个碳原子。 链上增加一个碳原子。
应用上述反应原理,试以乙炔,甲醇、HCN等物质 应用上述反应原理,试以乙炔,甲醇、 等物质 为主要原料, 为主要原料,通过六步反应合成
例题
已知: 已知:
CH 3 CH 2 CH 2 Br 消去→ CH 3 CH = CH 2 加成 → CH 3 C H CH 3 − HBr + HBr | Br
化学断键法口诀

化学断键法口诀
化学键(chemical bond)高中定义:使离子相结合或原子相结合的作用力通称为化学键。
能量越大,温度越高,温度越高,粒子的运动越激烈,也就是震动的越剧烈,对于一个化学键来讲,构成它的原子在动,电子也在动,当他们运动的太剧烈时,原子就被“甩开”了,化学键就断了。
下面是断键法口诀:
对于烷烃,取代反应,断C-H键。
对于烯烃,加成反应,断C=H键。
对于炔烃,加成反应,断C≡H键。
对于芳香烃,取代反应断C-H键加成反应断介于双键和单键的芳香烃独有的键。
对于卤代烃,取代断C-X键,烯烃的卤代烃会发生消去反应,断C-X和与卤原子所连碳的相邻碳的C-H键。
对于醇,与金属反应断O-H键,与HCl等反应断C-O键,氧化成醛则脱去两个氢原子。
对于酸,与金属反应,断O-H键,与醇发生酯化反应,酸脱羟基,醇脱氢。
对于对于醛,有银镜反应,和新制氢氧化铜反应。
对于氨基酸的脱水缩合反应,羟基断-OH键,氨基断N-H键。
逆合成分析法

HOOC
COOH con.
+
COOH HOOC
5、重排(rearrangement, 简写rearr)
重排:按重排反应的反方向把目 标分子拆开或重新组装, 以此来简化目标分子
O NH
rearr
N OH
2021/3/10
O O RCH2Br
OEt
讲解:XX
O
O
Ar R'
+ Ar
O
ArH
R' Cl
O R' R
O R'
+
R
R2CuLi
17
练习
O
O Ph
2021/3/10
讲解:XX
18
四、羧酸
O
O
主要切断: 羰基碳与α-碳之间 α-碳与β-碳之间
HO
O HO
+ R R HO
CO2 RMgBr O
O HO
R HO
11.2.1 单官能团化合物
一、醇
R' R''
主要切断: α-碳与β-碳之间
R' R''
β-碳与γ-碳之间
R
R
OH
RMgBr
R'、R'':H或烃基
R'
+
OH
R'
R''
C O
R OH
R':H或烃基
R
+
RMgBr
R'
OH R'
O
04单官能团的切断
OH
MgBr + O
O CH3MgI
有了两个好的切断标准:1)合理 。2)简单
M gBrO
OH
O
BrMg
C O 2E t 2B rM g
带有两个相同取代基的叔醇=酯+2Grignard
OH
CO2Et
CO2Et
MgBr
O
OH H
H
C H O
O NaBH4
H
O LiAlH4
OEt
C H O
N a B H 4
R 'C O C l (R 'C O )2O
O C
O C
OH
R O 2C R '
遇到上述结构,FGI到醇是一种好的思路
OAc
FGI
1. Mg, Ether
Br 2.HCO2Et
OH OH
2
Ac2O Py.
MgBr HCO2Et OAc
FGI
Br
OH
MgBr O
Homework
OH
验证重排产物结构
Me
选择最稳定的负离子处切断
OH C C CH Me
O C Me
OH C C CH Me
O C Me
O A lC l3 + CC l
M e
O
N a CC H
C M e
O H CCC H M e
通常情况是没有一个取代基能给出稳定负离子 How we do? We 怎么do?
OH C CH2CH3 CH3
C H 2 O H
C O 2 E t
C O 2 E t
L iA lH 4
C H 2 O H
NaBH4 只能还原醛,酮。不能还原酯 LiAlH4 能还原所有羰基化合物
第四章单官能团化

O
Ph a Ph
b
c OH
Ph
PhMgBr
a
O
b
最佳
试剂简化
OEt
反应更易
2PhMgBr
c MgBr Ph Ph
O
叔醇含有两个相同基团可同时切断
本次您浏览到是第十八页,共六十三页。
练习一
COOEt
a
CH2OH
b
CHO
C O O Et
CHO
本次您浏览到是第十九页,共六十三页。
P h O H M e CC _ _H
P h M e
C HC _ __液 N a 氮H CC H O
Ph Me
Ph Me
OH Et
OH Et
Ph Me
Ph Me
O -Et
EtMgBr 或Et -Li O
本次您浏览到是第十五页,共六十三页。
a
b
OH
O +MeMgI
a
b 最佳反应路线
MgBr
+
O
切断原则(2):最大步骤简化 切断原则(3):最适反应试剂
H
本次您浏览到是第八页,共六十三页。
例5:
Ph FGI
Ph
Ph
易生成副产物
OH
OH Ph
O + PhMgBr
切断原则:多分支点添加
本次您浏览到是第九页,共六十三页。
例6: Ph
分析:
Ph
P h C H O + P P h3
P h
P P h 3+ O H C
合成:
Ph
+
Br+ Ph3P
第一讲-官能团的保护与去保护..

2)当分子中存在对氢化敏感官能团时,采用化学方法进行脱 苄基。一般常用的方法是CCl3CH2COCl/CH3CN,也可以用Li/MH3、 Na/NH3、CAN等去除。 注:酰氨上的苄基一般较难用氢解脱除,可以用AlCl3进行脱除。
实例:
2: 羟基的保护与脱保护
※ 羟基广泛存在于许多生理和合成上有意义的化合物中; (如核苷,碳水化合物、甾族化合物、大环内酯类化合物等) ※ 羟基也是有机合成中一个很重要的官能团; (可转变为卤素、氨基、羰基、羧基等多种官能团) 在许多化合物官能团的转化(如氧化、酰基化、用卤代磷 或卤化氢的卤化、脱水的反应)过程中,我们常常需要将 羟基保护起来;在含有多官能团复杂分子的合成中,如何 选择性保护羟基和脱保护往往是许多新化合物开发时的关 键所在。 羟基保护主要将其转变为相应的醚或酯,以醚更为常见。 一般用于羟基的保护醚主要有硅醚、甲基醚、烯丙基醚、 苄基醚、烷氧甲基醚、烷巯基甲基醚、三甲基硅乙基甲基 醚等等。羟基的酯保护一般用的不多,但在糖及核糖化学 中较为多见。
稳定性:对酸、碱溶液稳定。
引入实例:
去保护方法: 1). 催化氢解
实验室常用简洁的方法是催化氢解(用H2或其它供氢体,一般常温常压氢 化即可); 当分子中存在对催化氢解敏感(有苄醚,氯溴碘等)或钝化催化 剂的基团(硫醚等)时,需要采用化学方法如酸解裂解或Na/NH3(液)还 原等。
2). 酸解裂解(HBr, TMSI)
苄氧羰基的用强酸或Lewis酸脱除时,会产生苄基的碳正离子, 若分子中有捕捉碳正离子的基团时,将得到相应的副产物.
实例:
3). Na/NH3(液)还原
1.1.2 叔丁氧羰基的引入与去除
除Cbz保护基外,叔丁氧羰基(Boc)也是目前多肽合成 中广为采用的胺基保护基,特别是在固相合成中,胺基 的保护多用Boc而不用Cbz。Boc具有以下的优点:
有机化合物的断裂规律PPT课件

有双键和Hγ ,又可以进一步发生麦氏重排。
26
b .烯烃的麦氏重排
R CH2 CH2 CH2 γβ α
H
R CH
┐
CH2 rH β
H2C
C
C H2
CH3
C CH2
CH3
R CH
CH2
中性分子
R4 CH
H
Z
CH C
R3 CH
R1
R2
R4 CH CH
R3
ZH
C
HC
R1
R2
24
a .酮、醛、酸、酯和酰胺等具有 C=O 基团又有 Cγ和Hγ 时,都可以发生麦氏重排,例如丁酸乙 酯。
H
H2C
O
rH β CH2
HO ┐
H2C
C
C H2
OCH2CH3
+
C
CH2
H2C OCH2CH3
m/z 88
25
11
① C-Y 型(游离基中心定域于饱和杂原子)
醇
R
α
CH2 OH
R + CH2 OH
硫醚 R
α
CH2 SR'
R + CH2 SR'
醚
R
α
CH2 OR'
R + CH2 OR'
R'
R'
胺
R
CH2 N
α
R + CH2 N
R"
R"
杂环
α
Y
R
+R
有机合成中有机物官能团的引入消除和转化方法

有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去1通过加成反应消除不饱和键;2通过消去反应、氧化反应或酯化反应消除羟基—OH;3通过加成反应或氧化反应消除醛基—CHO;4通过消去反应或水解反应消除卤素原子;3.官能团的转化1利用衍变关系引入官能团,如卤代烃错误!伯醇RCH2OH错误!醛错误!羧酸;2通过不同的反应途径增加官能团的个数,如3通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应1有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的;如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环;2成环反应生成的五元环或六元环比较稳定;2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示;1与HCN的加成反应2加聚或缩聚反应,如n CH23酯化反应,如CH3CH2OH+CH3COOH浓CH3COOCH2CH3+H2O;3.碳链的减短1脱羧反应:R—COONa+NaOH错误!R—H+Na2CO3;3水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解;4烃的裂化或裂解反应:C16H34错误!C8H18+C8H16;C8H18错误!C4H10+C4H8;合成路线的选择1.中学常见的有机合成路线2一元合成路线R—CH=CH2错误!卤代烃错误!一元醇错误!一元醛错误!一元羧酸―→酯3二元合成路线CH2=CH2错误!CH2X-CH2X错误!二元醇错误!二元醛错误!二元羧酸→错误!3芳香化合物合成路线:2.有机合成中常见官能团的保护1酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH变为—ONa或—OCH3将其保护起来,待氧化后再酸化将其转变为—OH;2碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键;3氨基—NH2的保护:如在对硝基甲苯错误!对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2;防止当KMnO4氧化—CH3时,—NH2具有还原性也被氧化;有机合成中有机物官能团的引入、消除和转化方法练习例1工业上用甲苯生产对羟基苯甲酸乙酯,其过程如下:据合成路线填写下列空白:1有机物A的结构简式:____________________________________________________,B的结构简式:_____________________________________________________________;2反应④属于__________反应,反应⑤属于____________反应;3③和⑥的目的是__________________________________________________________;4写出反应⑥的化学方程式:_________________________________________________;例2由环己烷可制备1,4-环己醇二醋酸酯;下面是有关的8步反应其中所有无机产物都已略去;1在上述8步反应中,属于取代反应的有________,属于加成反应的有________,反应④属于________反应;2写出下列化合物的结构简式;B:__________________,C:________________;3写出反应④、⑤、⑥的化学方程式;④____________________________________________________________ ____________,⑤____________________________________________________________ ____________,⑥____________________________________________________________ ____________;4写出在NaOH溶液中水解的化学方程式:______________________;例3乙醇在与浓硫酸混合共热的反应过程中,受反应条件的影响,可发生两类不同的反应类型:1,4-二氧六环是一种常见的溶剂;它可以通过下列合成路线制得:错误!错误!错误!错误!错误!错误!其中的A可能是A.乙烯B.乙醇C.乙二醇D.乙酸例4肉桂酸甲酯M,常用作调制具有草莓、葡萄、樱桃等香味的食用香精;M属于芳香化合物,苯环上只含一个直支链,能发生加聚反应和水解反应;测得M的摩尔质量为162 g·mol-1,只含碳、氢、氧三种元素,且原子个数之比为5∶5∶1;1肉桂酸甲酯的结构简式是;2G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示图中球与球之间连线表示单链或双键;G的结构简式为;3以芳香烃A为原料合成G的路线如下:①化合物E中的含氧官能团有________填名称;②E―→F的反应类型是__________,F―→G的化学方程式为_______________________;③写出符合下列条件的F的同分异构体的结构简式只写一种:____________________;ⅰ.分子内含苯环,且苯环上只有一个支链;ⅱ.在催化剂作用下,1 mol该物质与足量氢气充分反应,消耗5 mol H2;ⅲ.它不能发生水解反应;例5 食品添加剂必须严格按照食品安全国家标准GB2760-2011的规定使用;作为食品添加剂中的防腐剂G和W,可经下列反应路线得到部分反应条件略;1G的制备①A与苯酚在分子组成上相差一个CH2原子团,它们互称为__________;常温下A在水中的溶解度比苯酚的______填“大”或“小”;②经反应A→B和D→E保护的官能团是__________;③E→G的化学方程式为_____________________________________________________;2W的制备①J→L为加成反应,J的结构简式为__________________________________________;②M→Q的反应中,Q分子中形成了新的____________填“C—C键”或“C—H键”;③用Q的同分异构体Z制备,为避免R—OH+HO—R错误!R—O—R+H2O发生,则合理的制备途径为酯化、______、________填反应类型;④应用M→Q→T的原理,由T制备W的反应步骤为第1步_________________________________________________________________ ____;第2步:消去反应;第3步:_____________________________________________________________第1、3步用化学方程式表示例6 利用从冬青中提取出的有机物A合成抗结肠炎药物Y及其他化学品的合成路线如下:提示:根据上述信息回答:1D不与NaHCO3溶液反应,D中官能团的名称是________,B→C的反应类型是________;2写出A生成B和E的化学反应方程式:______________________________________;3A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下,I和J分别生成和,鉴别I和J的试剂为________;500 ℃4A 的另一种同分异构体K 用于合成高分子材料,K 可由 制得,写出K 在浓硫酸作用下生成的聚合物的结构简式:________________________________;例7 狄尔斯-阿德耳Diels-Alder 反应也称双烯合成反应;试回答下列问题:1Diels-Alder 反应属于______反应填有机反应类型;2某实验室以 和 合成 ,请用合成反应的流程图,表示出最合理的合成方案注明反应条件;提示:①RCH 2CH====CH 2+Cl 2――――→RCHClCH====CH 2+HCl②合成过程中无机试剂任选;③合成反应流程图可表示为A 错误!B 错误!C ―→……―→H例8 据中国制药报道,化合物C 是用于合成抗“非典”药品盐酸袪炎痛的中间体,其合成路线为已知:1写出下列物质的结构简式B :__________________,C :__________________反应②产物HCl 中的H元素来自于氨基;2A →D 的转化中涉及的反应类型有________填字母序号;A .加成B .取代C .聚合D .氧化E .还原3反应①②中属于取代反应的是______填数字序号;4请你设计由甲苯→…→D 的反应流程图有机物用结构简式表示,必须注明反应条件;提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:甲苯错误!……错误!D有机合成中有机物官能团的引入、消除和转化方法练习答案例12氧化酯化或取代3保护酚羟基,防止被氧化例21①⑥⑦③⑤⑧消去例3A例4例5 1①同系物小②—OH或酚羟基例6 1醛基取代反应例7 1加成2如图所示:例8。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O
O Br
O
O
Less selectivity
O
O
O
Br
OEt
O dilu.
OH- or H+
EtO
O
第三章 单官能团的切断
CO2H
Br
CO2H
CO2Et
CO2Et
LiAlH4
CH2OH
CH2Br
CH2Br CO2Et
EtONa
CO2Et dilu. H+ CO2Et
CO2H
CO2Et
第三章 单官能团的切断
AlCl3
O CCH2CH2CH3
Zn(Hg) H
+
CH2CH2CH2CH3
第三章 单官能团的切断
切断的选择
a CO2Et CH2 CH CO2Et
a
b CO2Et CH2 CH
CO2Et
b CH2
CO2Et CH CO2Et
CH2
CO2Et Br + CH2 CO2Et
Base CH2
CO2Et CH CO2Et
O N
O NH HO
BrMg
BrMg
FGI
HO
O BrMg
Br
1 Mg, Et2O 2.EtCHO
HO
1 PBr3 2 Mg, Et2O 3 CO2
O HO
第三章 单官能团的切断
2.7 Long Chain Alkane
Hydrogenation is one of many method
FGI
PPh3 O
AlCl3
O C Me
NaC
CH
OH C C CH Me
通常情况是没有一个取代基能给出稳定负离子 How we do? We 怎么do?
第三章 单官能团的切断
OH C CH2CH3 CH3
负离子等价物
O Li(MgX) C CH2CH3 CH3
OH C CH2CH3 CH3
OH C CH2CH3 CH3
带有两个相同取代基的叔醇=酯+2Grignard
第三章 单官能团的切断
OH
CO2Et
CO2Et
MgBr
O
第三章 单官能团的切断
O
OH H H
NaBH4 H O
LiAlH4 OEt
CHO
CHO
NaBH4
CH2OH
CO2Et
CO2Et
LiAlH4
CH2OH
NaBH4 只能还原醛,酮。不能还原酯
LiAlH4 能还原所有羰基化合物
第三章 单官能团的切断
2.2 Derivatives of alcohol 涉及H-还原时,实际是FGI
R X H
+
PX3 HX R OH (O) (O)
O C
- H2O
R'COCl (R'CO)2O
O C
OH
RO2CR'
遇到上述结构,FGI到醇是一种好的思路
第三章 单官能团的切断
OAc
Addition of H2O
O
FGI
HO
MgBr
FGI
HO
Useless
第三章 单官能团的切断
FGI
OH
FGI
OH
1. Mg,Et2O
Br 2. Me2CO
OH
H3PO3
Wittig Reaction O PPh3
Method A Method B
第三章 单官能团的切断
PPh3 OHC
CHO Ph3P
目的:使一种切断成为可能。
符号:
FGI
第三章 单官能团的切断
Example: CH2CH2CH2CH3 CH2CH2CH2CH3
CH3 CH CH2CH3
O CCH2CH2CH3
+ ClCH2CH2CH2CH3
Example:
FGI
CH2CH2CH2CH3
O CCH2CH2CH3
O Cl CCH2CH2CH3
第三章 单官能团的切断
1、基本概念 Basic Terms
目标分子,目标化合物,靶分子
Aim Aimed Target // Compound Molecule
切断 Disconnection 切断:将分子中的一个键断开。
符号:
条件:1)是一个成熟反应的逆过程。 2)原料易得。 切断点选择:官能团,如杂原子、羰基、羟基、 双键、苯环
第三章 单官能团的切断
O O O
O O O
O CHO
O CHO
O O O
O O O O
O X X O O
第三章 单官能团的切断
2、单官能团的切断
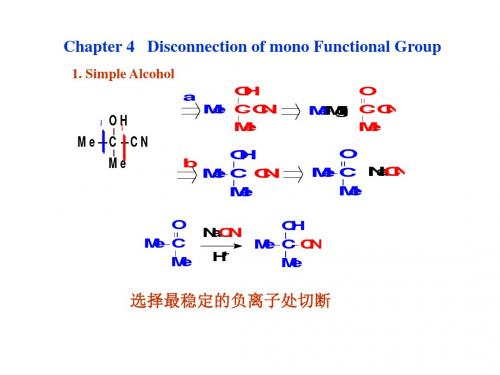
Disconnection of mono Functional Group 2.1 Simple Alcohol
a
a OH b
Me
OH C CN Me
O
O Br
Br
Br
Br
O
O OEt
O
O
HO
OEt
OH
O
O O OEt
NaNH2
MeI
O
O O OEt
H2 Pd/C BaSO4
O
O O OEt
HCl H2O
O
真麻烦!
第三章 单官能团的切断
2.6 Disconnection of Simple ketone and Acid
O
FGI
OH
MgBr O
FGI
OH
MgBr
2
HCO2Et
OH
1. Mg, Ether
OAc
Ac2O Py.
Br 2. HCO2Et
FGI
MgBr
OH
O
Br
第三章 单官能团的切断
work
OH 验证重排产物结构
Br
是合成萜类香料的重要中间体
O
O 合成美登木素(抗肿瘤)中间体
第三章 单官能团的切断
2.3 Disconnection of simple alkene
第三章 单官能团的切断
Example: Cl
Cl
Cl + Cl2 AlCl3 + HCl
合成子(synthon):切断时得到的概念性碎片 合成等价物:能起合成子作用的试剂。 FGI:Functional Group Interconversion 官能团互换 FGI:把一个官能团转换成另一种官能团。
O
OH
MgBr
交叉点
Homework
OMe OMe
CO2H
MeO MeO HN O
MeMgI
O C CN Me
Me C CN Me
b
OH Me C Me CN
O Me C Me
NaCN
O Me C Me
NaCN H
+
OH Me C CN Me
选择最稳定的负离子处切断
第三章 单官能团的切断
OH C C CH Me
OH C CH C Me
O C Me
O C Me
O + C Cl Me
O
a O O
b
O O Cl
O Cl
NO2
O
OMe O a b
OMe
NO2 Me
Me
第三章 单官能团的切断
2.5 Controlling
O OH
Protection !
O O OEt MgBr
O
O OEt MgBr
OH
O OEt
O
O O OEt
MgBr
O
O OH
H3O+
第三章 单官能团的切断
O
O
Br
method A method B
CHO
CHO
Br
PPh3
Base
PPh3
method A
切断:1)合理。2)简单。3)原料易得
第三章 单官能团的切断
2.4 Disconnection of Aromatic Ketone
将醇切断成羰基化合物和Grignard试剂----第一种主要切割 将烯键切断成羰基化合物和Wittig试剂----第二种主要切断 将芳香环上脂肪侧链切断---第三种主要切断
OH C CH2CH3 CH3
O C CH2CH3 CH3MgI , CH3Li
O C CH3 BrMgCH2CH3 LiCH2CH3
第三章 单官能团的切断
OH
MgBr +
O CH3MgI
O
有了两个好的切断标准:1)合理 。2)简单
第三章 单官能团的切断
MgBr O
OH
O BrMg
CO2Et
2 BrMg
