(完整版)金属晶体练习题
2020-2021学年高二化学人教版选修3第三章第三节 金属晶体 练习

第三节金属晶体一、选择题1.下列关于金属及金属键的说法正确的是()A.金属键具有方向性与饱和性B.金属键是金属离子与自由电子间的相互作用C.金属导电是因为在外加电场作用下产生自由电子D.常温下,金属单质都以金属晶体的形式存在2.下列对各组物质性质的比较中,正确的是()A.熔点:Li<Na<KB.导电性:Ag>Cu>Al>FeC.密度:Na>Mg>AlD.原子半径:Be>Mg>Ca3.石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是()A.10 B.18 C.24 D.144.下列金属晶体中,自由电子与金属阳离子间的作用力最弱的是()A.Na B.KC.Mg D.Al5.关于金属晶体的铜型最密堆积的结构的叙述中,正确的是()A.属于体心立方最密堆积B.属于六方最密堆积C.配位数为6D.每个晶胞含有4个原子6.有四种不同堆积方式的金属晶体的晶胞如下图所示,下列有关说法正确的是()A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积B.每个晶胞含有的原子数分别为①1,②2,③2,④4C.晶胞中原子的配位数分别为①6,②8,③8,④12D.空间利用率的大小关系为①<②<③<④7.下列关于金属键的叙述中,不正确的是()A.金属键是金属阳离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,其实质与离子键类似,也是一种电性作用B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性C.金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键无饱和性和方向性D.构成金属键的自由电子在整个金属内部的三维空间中做自由运动8.下列说法正确的是()A.钛和钾都采取图1的堆积方式B.图2为金属原子在二维空间里的非密置层放置方式,此方式在三维空间里堆积仅得简单立方堆积C.图3是干冰晶体的晶胞,在每个CO2周围距离最近且相等的CO2有8个D.图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC……堆积的结果9.金属钠晶体为体心立方晶胞,实验测得钠的密度为ρ(g·cm-3)。
人教版高中数学选修三第三章第三节《金属晶体》过关训练试题.docx

高中化学学习材料唐玲出品(人教版选修3)第三章第三节《金属晶体》过关训练试题(考试时间:40分钟满分:100分)一、单项选择题(每小题4分,共48分)1.下列叙述正确的是( D)A.金属受外力作用时常常发生变形而不易折断,这是由于金属原子之间有较强的作用B.通常情况下,金属里的自由电子会发生定向移动而形成电流C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分D.金属的导电性随温度的升高而减弱【解析】:金属受外力作用时常常发生变形而不易折断,这是因为金属晶体中各层会发生相对滑动,但不会改变原来的排列方式,故A项不正确;金属里的自由电子要在外电场作用下才能发生定向移动产生电流,故B项不正确;金属的导热性是由于自由电子碰撞金属原子将能量进行传递,故C项不正确。
2.下列关于金属晶体的叙述正确的是( B)A.用铂金做首饰不能用金属键理论解释B.固态和熔融时易导电,熔点在1 000 ℃左右的晶体可能是金属晶体C.Al、Na、Mg的熔点逐渐升高D.温度越高,金属的导电性越好【解析】:A项,用铂金做首饰利用了金属晶体的延展性,能用金属键理论解释。
B项,金属晶体在固态和熔融时能导电,其熔点差异很大,故题设条件下的晶体可能是金属晶体。
C项,一般来说,金属中单位体积内自由电子的数目越多,金属元素的原子半径越小,金属键越强,故金属键的强弱顺序为Al>Mg>Na,其熔点的高低顺序为Al>Mg>Na。
D项,金属的导电性随温度的升高而降低,温度越高,其导电性越差。
3.下列关于晶体的说法,一定正确的是( B)A.分子晶体中都存在共价键B.如上图,CaTiO3晶体中每个Ti4+和12个O2-相紧邻C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合D.金属晶体的熔点都比分子晶体的熔点高【解析】稀有气体为单原子分子,晶体中不存在共价键。
据图可知CaTiO3晶体中,Ti4+位于晶胞的顶角,O2-位于晶胞的面心,故Ti4+的O2-配位数为12。
人教版高中化学选修3练习:3.3金属晶体
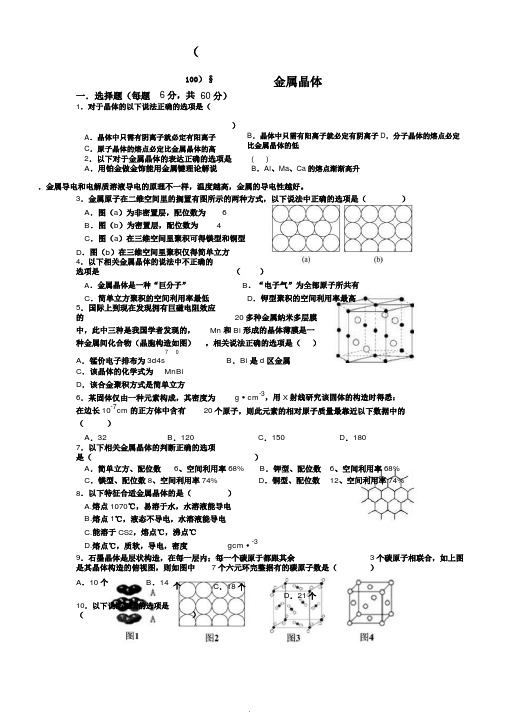
(100)§金属晶体一.选择题(每题6分,共60分)1.对于晶体的以下说法正确的选项是()A.晶体中只需有阴离子就必定有阳离子C.原子晶体的熔点必定比金属晶体的高B.晶体中只需有阳离子就必定有阴离子D.分子晶体的熔点必定比金属晶体的低2.以下对于金属晶体的表达正确的选项是()A.用铂金做金饰能用金属键理论解说B.Al、Ma、Ca的熔点渐渐高升.金属导电和电解质溶液导电的原理不一样,温度越高,金属的导电性越好。
3.金属原子在二维空间里的搁置有图所示的两种方式,以下说法中正确的选项是()A.图(a)为非密置层,配位数为6B.图(b)为密置层,配位数为4C.图(a)在三维空间里聚积可得镁型和铜型D.图(b)在三维空间里聚积仅得简单立方4.以下相关金属晶体的说法中不正确的选项是()A.金属晶体是一种“巨分子”B.“电子气”为全部原子所共有C.简单立方聚积的空间利用率最低D.钾型聚积的空间利用率最高5.国际上到现在发现拥有巨磁电阻效应的20多种金属纳米多层膜中,此中三种是我国学者发现的,Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞构造如图),相关说法正确的选项是()70B.Bi是d区金属A.锰价电子排布为3d4sC.该晶体的化学式为MnBiD.该合金聚积方式是简单立方g·cm-3,用X射线研究该固体的构造时得悉:6.某固体仅由一种元素构成,其密度为在边长10-7cm的正方体中含有20个原子,则此元素的相对原子质量最靠近以下数据中的()A.32B.120C.150D.1807.以下相关金属晶体的判断正确的选项是()A.简单立方、配位数6、空间利用率68%B.钾型、配位数6、空间利用率68%C.镁型、配位数8、空间利用率74%D.铜型、配位数12、空间利用率74%8.以下特征合适金属晶体的是()A.熔点1070℃,易溶于水,水溶液能导电B.熔点1℃,液态不导电,水溶液能导电C.能溶于CS2,熔点℃,沸点℃D.熔点℃,质软,导电,密度gcm·-39.石墨晶体是层状构造,在每一层内;每一个碳原于都跟其余3个碳原子相联合,如上图是其晶体构造的俯视图,则如图中7个六元环完整据有的碳原子数是()A.10个B.14个C.18个D.21个10.以下说法正确的选项是()A.和都采纳1的堆方式B.2金属原子在二空里的非密置搁置,此方式在三空里堆,得立方堆C.3是干冰晶体的晶胞,晶胞棱acm,在每个CO2周近来且等距离的CO2有8个D.4是一种金属晶体的晶胞,它是金属原子在三空以密置采纳ABCABC⋯堆的果二.非选择题(共40分)11.(40分)E、F、G三元素的原子序数挨次增大,它原子的最外子排布均4s1。
高二化学人教版选修3第三章第三节 金属晶体 强化练习

第三节金属晶体一、选择题1.金属钠是体心立方堆积,关于钠晶体,下列判断合理的是()A.其熔点比金属铝的熔点高B.一个钠的晶胞中,平均含有4个钠原子C.该晶体中的自由电子在外加电场作用下可发生定向移动D.该晶体中的钠离子在外加电场作用下可发生定向移动2.石墨烯是从石墨材料中剥离出来的由碳原子组成的只有一层原子厚度的二维晶体。
其结构如图:下列有关说法正确的是()A.石墨烯中碳原子的杂化方式为sp3杂化B.石墨烯中平均每个六元碳环含有3个碳原子C.从石墨中剥离石墨烯需要破坏化学键D.石墨烯具有导电性3.下列四种有关性质的叙述,可能属于金属晶体的是()A.由分子间作用力结合而成,熔点低B.固体或熔融后易导电,熔点在1000 ℃左右C.由共价键结合成网状结构,熔点高D.固体和熔融状态不导电,但溶于水后可能导电4.下列叙述中正确的是()A.有阳离子的晶体一定有阴离子B.有阳离子的晶体一定是化合物C.由单质组成的晶体如果固态时能导电也不一定是金属晶体D.金属晶体都具有较高的熔点和银白色的金属光泽5.下列金属晶体中,自由电子与金属阳离子间的作用力最弱的是()A.Na B.KC.Mg D.Al6.下列有关石墨晶体的说法正确的是()A.由于石墨晶体导电,所以它是金属晶体B.由于石墨的熔点很高,所以它是原子晶体C.石墨晶体中碳原子采取sp3杂化方式D.石墨晶体是一种混合晶体7.下列叙述不正确的是()A.金属键无方向性和饱和性,原子配位数较高B.晶体尽量采取紧密堆积方式,以使其变得比较稳定C.因为共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原理D.金属铜和镁均以ABAB……方式堆积8.下列说法正确的是()A.含有金属元素的晶体都是金属晶体B.金属晶体中只含有金属元素C.具有导电性的晶体一定是金属晶体D.可以导电的物质形成的晶体不一定是金属晶体9.依据电子气的金属键模型,下列对于金属导电性随温度变化的解释,正确的是()A.温度升高,自由电子的动能变大,导致金属导电性增强B.温度升高,金属阳离子的动能变大,阻碍电子的运动,导致金属导电性减弱C.温度升高,自由电子互相碰撞的次数增加,导致金属导电性减弱D.温度升高,阳离子的动能变大,自由电子与阳离子的吸引变小,导致金属的导电性增强10.下列晶体中,金属阳离子与自由电子间的作用最强的是()A.Na B.MgC.Al D.K11.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方堆积和体心立方堆积,如图a、b、c分别代表这三种晶胞的结构,其晶胞内金属原子个数比为()A.3∶2∶1 B.11∶8∶4C.9∶8∶4 D.21∶14∶912.下列对各组物质性质的比较中,正确的是()A.熔点:Li<Na<KB.导电性:Ag>Cu>Al>FeC.密度:Na>Mg>AlD.空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积13.铝硅合金(含硅13.5%)在凝固时收缩率很小,因而这种合金适合铸造。
高考第一轮复习——金属晶体 (习题+解析)

高考第一轮复习——金属晶体(习题+解析)年级高三学科化学版本苏教版内容标题金属晶体【模拟试题】(答题时间:40分钟)1、金属的下列性质中,不能用金属的电子气理论加以解释的是A、易导电B、易导热C、有延展性D、易锈蚀2、下列晶体中由原子直接构成的单质有A、白磷B、氦C、金刚石D、金属镁3、金属具有延展性的原因是A、金属原子半径都较大,价电子较少B、金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈作用C、金属中大量自由电子受外力作用时,运动速度加快D、自由电子受外力作用时能迅速传递能量4、下列叙述正确的是A、原子晶体中可能存在离子键B、分子晶体中不可能存在氢键C、在晶体中可能只存在阳离子不存在阴离子D、金属晶体导电是金属离子所致5、下列叙述正确的是C、金属原子的原子半径大D、金属键没有饱和性和方向性10、在核电荷数1~18的元素中,其单质属于金属晶体的有,金属中,密度最小的是,地壳中含量最多的是,熔点最低的是,既能与盐酸又能与碱反应的是,单质还原性最强的是。
11、某些金属晶体(Cu、Ag、Au)的原子按面心立方的形式紧密堆积,即在晶体结构中可以划出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个侧面上,试计算这类金属晶体中原子的空间利用率。
【试题答案】1、D2、BC3、B4、C5、D6、A7、C8、A9、D10、锂、铍、钠、镁、铝等;锂;铝;钠;铝;钠。
11、依题意画出侧面图,设正立方体边长为a ,则体积为a 3。
原子半径42a r =,每个正立方体包括金属原子8×1/8+6×1/2=4(个),球体体积共 4×,74.0)42(3433a a =⨯π 空间利用率为:%74%10074.033=⨯a a。
高二化学选修3第三章第三节金属晶体习题

高二化学选修3第三章第三节金属晶体习题(总8页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除课时跟踪检测(十一)金属晶体1.下列有关金属键的叙述中,错误的是( )A.金属键没有饱和性和方向性B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用C.金属键中的电子属于整块金属D.金属的性质和金属固体的形成都与金属键有关解析:选 B 金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起,故金属键无饱和性和方向性;金属阳离子和自由电子之间的强烈作用,既包括静电吸引作用,也存在静电排斥作用;金属键中的电子属于整块金属;金属的性质及固体的形成都与金属键的强弱有关。
2.金属能导电的原因是()A.金属晶体中的金属阳离子与自由电子间的作用较弱B.金属晶体中的自由电子在外加电场作用下可发生定向移动C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动D.金属晶体在外加电场作用下可失去电子解析:选B根据电子气理论,电子是属于整个晶体的,在外加电场作用下发生了定向移动从而导电,B项正确;有的金属中金属键较强,但依然导电,A项错误;金属导电是靠自由电子的定向移动,而不是金属阳离子发生定向移动,C项错误;金属导电是物理变化,而不是失去电子的化学变化,D项错误。
3.关于体心立方堆积型晶体(如图)的结构的叙述中正确的是()A.是密置层的一种堆积方式B.晶胞是六棱柱C.每个晶胞内含2个原子D.每个晶胞内含6个原子解析:选C体心立方堆积型晶体是非密置层的一种堆积方式,为立方体形晶胞,其+1=2。
中有8个顶点,一个体心,晶胞所含原子数为8×184.金属键的强弱与金属价电子数多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,半径越大,金属键越弱。
据此判断下列金属熔点逐渐升高的是() A.Li Na K B.Na Mg AlC.Li Be Mg D.Li Na Mg解析:选B金属熔点的高低与金属阳离子半径大小及金属价电子数有关,价电子数越多,阳离子半径越小,金属键越强。
金属晶体精编练习含答案

金属晶体一.选择题(每题2分共60分)1.金属键的实质是()A.自由电子与金属阳离子之间的相互作用B.金属原子与金属原子间的相互作用C.金属阳离子与阴离子的吸引力D.自由电子与金属原子之间的相互作用2.金属晶体堆积密度大,原子配位数高,能充分利用空间的原因是()A.金属原子的价电子数较少B.金属晶体中存在自由移动的电子C.金属原子的原子半径较大D.金属键不具有方向性和饱和性3.下列关于金属键的叙述中不正确的是()A.金属键是金属阳离子和“自由电子”这两种带异性电荷的微粒间强烈的相互作用B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性C.金属键是金属阳离子和“自由电子”间的相互作用,金属键无饱和性和方向性D.构成金属键的“自由电子”在整个金属内部的三维空间中做自由运动4.下列生活中的问题,不能用电子气理论知识解释的是()A.铁易生锈B.用金属铝制成导线C.用金箔做外包装D.用铁制品做炊具5.下图是金属晶体内部的电气理论示意图,仔细观察并用电气理论解释金属导电的原因是()A.金属能导电是因为含有金属阳离子B.金属能导电是因为含有的自由电子在外电场作用下做定向运动C.金属能导电是因为含有电子且无规则运动D.金属能导电是因为金属阳离子和自由电子的相互作用6.关于金属性质和原因的描述不正确的是A.金属晶体具有良好的延展性,是因为金属晶体中的原子层可以滑动而不破坏金属键B.金属具有良好的导电性,是因为金属晶体中共享了金属原子的价电子,形成了“电子气”,在外电场的作用下自由电子定向移动便形成了电流C.金属具有良好的导热性能,是因为自由电子通过与金属离子发生碰撞,传递了能量D.金属一般具有银白色光泽,是物理性质,与金属键没有关系7.下列关于金属键或金属的性质说法正确的是()①金属的导电性是由金属阳离子和自由电子的定向运动实现的②金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用③第三周期金属元素Na、Mg、Al的沸点依次升高④金属键没有方向性和饱和性,其中的电子在整个三维空间运动,属于整个金属A.①②B.②③C.③④D.①④8.下列有关金属元素特征的叙述正确的是()A.金属元素的原子只有还原性,离子只有氧化性B.金属元素在一般化合物中只显正价C.金属元素在不同的化合物中的化合价均不同D.金属元素的单质在常温下均为金属晶体9.金属原子在二维空间里的放置有下图所示的两种方式,下列说法不正确的是() A.图a为密置层B.图b为非密置层C.图a配位数为6 D.图b配位数为610.下列叙述正确的是A.任何晶体中,若含有阳离子,就一定含有阴离子B.金属晶体的形成是因为晶体中存在金属离子之间的相互作用C.价电子数越多的金属原子的金属性越强D.含有金属元素的离子不一定是阳离子11.金属原子在二维空间里的放置如图所示的两种方式,下列说法中正确的是。
44金属晶体(14页43题)

金属晶体A组1.不仅与金属的晶体结构有关,而且与金属原子本身的性质有关的是A 导电性B 电热性C 延展性D 密度2.下列何种物质的导电性是由自由电子的运动所决定的A 熔融的食盐B 饱和食盐水C 石墨D 铜3.金属晶体的特征是A 熔点都很高B 熔点都很低C 都很硬D 都有导电、导热、延展性4.含有阳离子而不含有阴离子的晶体是A 原子晶体B 分子晶体C 离子晶体D 金属晶体5.金属晶体的形成是通过A 金属原子与自由电子之间的相互作用B 金属离子之间的相互作用C 自由电子之间的相互作用D 金属离子与自由电子之间的较强的相互作用6.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。
有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。
则这种合金的化学式为A LaNi3B LaNi4C LaNi5D LaNi67.铁原子半径为1.26×10-8cm,质量为55.8μ(μ=1.67×10-24g),则铁原子的体积(用cm3表示)为,铁原子的密度为(用g/cm3表示)。
铁原子密度比一块铁试样的密度大的原因是。
8.晶体是质点(分子、离子、或原子)在空间有规则地排列的,具有整齐外形,以多面体出现的固体物质。
在空间里无限地周期性的重复能成为晶体的具有代表性的最小单元,称为晶胞。
一种Al-Fe合金的立体晶胞如图所示。
(1)确定该合金的化学式____________。
(2)若晶胞的边长=a nm,计算此合金的密度________________(不必化简)g/cm3。
(3)取一定质量的该合金粉末溶于足量的稀NaOH溶液中,待反应完全停止后得到气体6.72L。
过滤,将残渣用蒸馏水洗净后,取其质量的十分之一,投入100mL一定浓度的稀硝酸中,恰好完全反应,共收集到气体0.672L,求硝酸的物质的量浓度。
(以上气体体积均在标准状况下测定)B组9.锂金属晶体由体心立方晶胞组成。
(完整版)金属晶体练习题

金属晶体练习题1•金属键的实质是()A •自由电子与金属阳离子之间的相互作用B •金属原子与金属原子间的相互作用C •金属阳离子与阴离子的吸引力D •自由电子与金属原子之间的相互作用2. 金属的下列性质与金属晶体结构中的自由电子无关的是()A •良好的导电性B •良好的导热性C •良好的延展性D •密度大小3. 按下列四种有关性质的叙述,可能属于金属晶体的是()A •金属阳离子之间存在斥力B •金属原子半径都较大,价电子较少C •金属中大量自由电子受到外力作用时,运动速度加快D .金属受到外力作用时,各原子层容易发生相对滑动,但不会改变原来的排列方式,也不会破坏金属键4. 关于晶体的下列说法正确的是()A •在晶体中只要有阳离子就一定有阴离子B .金属镁、金刚石和固体氖都是由原子直接构成的单质晶体C .金属晶体的熔点可能比分子晶体的低,也可能比原子晶体的高D .铜晶体中,1个铜离子跟2个价电子间有较强的相互作用5. 金属晶体堆积密度大,原子配位数大,能充分利用空间的原因是()A .金属原子价电子数少B .金属晶体中有自由电子C .金属原子的原子半径大D .金属键没有饱和性和方向性6. 下列金属晶体中,金属阳离子和自由电子之间的作用最强的是A. NaB. MgC. AlD. K7. 铝硅合金(含硅13.5%)凝固时收缩率很小,因而这种合金适合于铸造。
现有下列三种晶体:①铝;②硅;③铝硅合金。
它们的熔点从低到高的顺序是()A .①②③B .②①③C .③②① D.③①②8. 关于体心立方堆积型晶体(如图)结构的叙述中正确的是()A .是密置层的一种堆积方式B.晶胞是六棱柱C.每个晶胞内含2个原子D.每个晶胞内含6个原子9. 石墨晶体是层状结构,在每一层内,每一个碳原子都跟其他子相结合。
据图分析,石墨晶体中碳原子数与共价键数之比为A . 2 : 3B . 2 : 1C . 1 : 3D . 3 : 210现有5种固态物质:四氯化硅、硼、石墨、锑、氖。
高中化学 1.2《金属晶体》单元测试 旧人教版选修.doc

第二节《金属晶体》一、选择题1. 金属钠晶体为体心立方晶格(如图),实验测得钠的密度为ρ(g·cm-3)。
已知钠的相对原子质量为a,阿伏加德罗常数为N A(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。
则钠原子的半径r(cm)为A. B.C. D.2. 金属的下列性质中,不能用金属晶体结构加以解释的是A.易导电 B.易导热 C.有延展性 D.易锈蚀3. 在金属晶体中,自由电子与金属离子的碰撞中有能量传递,可以用此来解释的金属的物理性质是A.延展性B.导电性 C.导热性 D.硬度4. 金属的下列性质中与金属晶体结构无关的是A.导电性 B.化学反应中易失去电子C.延展性 D.硬度5. 金属晶体的形成是因为晶体中主要存在A.金属离子之间的相互作用 B.金属原子之间的作用C.金属离子与自由电子间的相互作用 D.金属原子与自由电子间的相互作用6. 科学家最近又发现了一种新能源——“可燃冰”它的主要成分是甲烷与水分子的结晶水合物(CH4·nH2O)。
其形成:埋于海底地层深处的大量有机质在缺氧环境中,厌氧性细菌把有机质分解,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。
又知甲烷同CO2一样也是温室气体。
这种可燃冰的晶体类型是A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体7. 下列说法正确的是A.晶体是具有一定几何外观的,所以汞不属于金属晶体B.金属一般具有较高的硬度,而钠可以用小刀切,但钠属于金属晶体C.塑料具有一定延展性,所以属于金属晶体D.金属晶体一般具有较高的硬度,所以金刚石属于金属晶体8. 下列有关晶体的叙述正确的是A.金属晶体含有金属阳离子和自由电子B.原子晶体一定是单质C.分子晶体一定是化合物D.金属晶体的硬度>原子晶体的硬度>分子晶体的硬度9. 下列有关金属晶体的判断正确的是A.简单立方、配位数6、空间利用律68% B.钾型、配位数6、空间利用律68%C.镁型、配位数8、空间利用律74% D.铜型、配位数12、空间利用律74%10. 从严格意义上讲石墨属于A.分子晶体 B.原子晶体 C.混合晶体 D.金属晶体11. 金属晶体的基本堆积方式中空间利用律最高的是A.简单立方 B.钾型 C.镁型 D.铜型12. 下列金属晶体采取的堆积方式是铜型的是A.Ag B.Fe C.Zn D.Po13. 仔细观察右图这种堆积方式是A.钾型 B.简单立方 C.镁型 D.铜型14. 金属晶体的中金属原子的堆积基本模式有A.1 B.2 C.3 D.4二、填空题15. 美国《科学》杂志评选的2001年十大科技进展之一是当年科学家发现了一种在接近40K的温度下成为超导材料的硼镁化合物。
高二化学选修第三章第三节金属晶体习题

高二化学选修第三章第三节金属晶体习题Document number:PBGCG-0857-BTDO-0089-PTT1998课时跟踪检测(十一)金属晶体1.下列有关金属键的叙述中,错误的是()A.金属键没有饱和性和方向性B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用C.金属键中的电子属于整块金属D.金属的性质和金属固体的形成都与金属键有关解析:选B金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起,故金属键无饱和性和方向性;金属阳离子和自由电子之间的强烈作用,既包括静电吸引作用,也存在静电排斥作用;金属键中的电子属于整块金属;金属的性质及固体的形成都与金属键的强弱有关。
2.金属能导电的原因是()A.金属晶体中的金属阳离子与自由电子间的作用较弱B.金属晶体中的自由电子在外加电场作用下可发生定向移动C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动D.金属晶体在外加电场作用下可失去电子解析:选B根据电子气理论,电子是属于整个晶体的,在外加电场作用下发生了定向移动从而导电,B项正确;有的金属中金属键较强,但依然导电,A项错误;金属导电是靠自由电子的定向移动,而不是金属阳离子发生定向移动,C项错误;金属导电是物理变化,而不是失去电子的化学变化,D项错误。
3.关于体心立方堆积型晶体(如图)的结构的叙述中正确的是()A.是密置层的一种堆积方式B.晶胞是六棱柱C.每个晶胞内含2个原子D.每个晶胞内含6个原子解析:选C体心立方堆积型晶体是非密置层的一种堆积方式,为立方体形晶胞,其中有8个顶点,一个体心,晶胞所含原子数为8×1+1=2。
84.金属键的强弱与金属价电子数多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,半径越大,金属键越弱。
据此判断下列金属熔点逐渐升高的是() A.Li Na K B.Na Mg AlC.Li Be Mg D.Li Na Mg解析:选B金属熔点的高低与金属阳离子半径大小及金属价电子数有关,价电子数越多,阳离子半径越小,金属键越强。
第三章第三节金属晶体练习..doc

金属晶体练习[基础训练]1下列有关金属元素的特征叙述正确的是()A .金属元素的原子具有还原性,离子只有氧化性D •金属元素的化合价一定显正价C.金属元素在不同化合物中的化合价均不相同D •金属元素的单质在常温下均为金属晶体2•下列有关金属元素特征的叙述中正确的是()A. 金属元素的原子只有还原性,离子只有氧化性B. 金属元素在化合物中一定显正价C. 金属元素在不同化合物中的化合价均不同D. 金属单质在常温下都是金属晶体3. 金属的下列性质中,不能用金属的电子气理论加以解释的是()A易导电B .易导热C.有延展性D .易锈蚀4. 下列晶体中由原子直接构成的单质有()A. 白磷B .氦C.金刚石D .金属镁5. 金属具有延展性的原因是()A .金属原子半径都较大,价电子较少B. 金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈作用C. 金属中大量自由电子受外力作用时,运动速度加快D. 自由电子受外力作用时能迅速传递能量6. 下列说法不正确的是()A. 金属单质的熔点一定比非金属单质高B. 离子晶体中不一定含有金属元素C. 在含有阳离子的晶体中,一定含有阴离子D. 含有金属元素的离子不一定是阳离子7. 金属晶体的形成是因为晶体中存在()A. 金属离子间的相互作用 B .金属原子间产生相互作用C.金属离子与自由电子间的相互作用 D .金属原子与自由电子间的相互作用& 关于金属元素的特征,下列叙述正确的是①金属元素的原子只有还原性,离子只有氧化性②金属元素在化合物中一般显正价③金属性越强的元素相应的离子氧化性越弱④金属元素只有金属性,没有非金属性⑤价电子越多的金属原子的金属性越强A .①②③B.②③ C .①⑤ D .全部9. 金属的下列性质中,与自由电子无关的是()A. 密度大小B.容易导电 C •延展性好 D •易导热10. 下列有关金属的叙述正确的是()A .金属元素的原子具有还原性,其离子只有氧化性B •金属元素的化合价一般表现为正价C.熔化状态能导电的物质一定是金属的化合物D •金属元素的单质在常温下均为金属晶体11. 下列叙述正确的是()A .原子晶体中可能存在离子键B .分子晶体中不可能存在氢键C.在晶体中可能只存在阳离子不存在阴离子 D .金属晶体导电是金属离子所致12. 金属能导电的原因是()A. 金属晶体中金属阳离子与自由电子间的相互作用较弱B. 金属晶体中的自由电子在外加电场作用下可发生定向移动C. 金属晶体中的金属阳离子在外加电场作用下可发生定向移动D. 金属晶体在外加电场作用下可失去电子13. 下列叙述正确的是()A. 任何晶体中,若含有阳离子也一定含有阴离子B. 原子晶体中只含有共价键C. 离子晶体中只含有离子键,不含有共价键D. 分子晶体中只存在分子间作用力,不含有其他化学键14. 在核电荷数1~18的元素中,其单质属于金属晶体的有 _________________ ,属于分子晶体的有 ____________ ,属于原子晶体的有 _______________________ .15. 简要填空:(1)___________________________ 金属导电是的结果.(2)___________________________ 金属导热是的结果.(3)金属抽成丝或压成薄板是金属受到外力作用,紧密堆积的原子(离子)层发生了________________ ,而金属离子和自由电子之间的 ________________________ 没有改变. 16.碱金属单质的熔点顺序为 Li > Na > K > Rb > Cs ,试用金属晶体结构的知识加以解释.仃..在金属晶体中存在的粒子是 _______________ 和 _____________ .通过 _________________形成 的单质晶体叫做金属晶体.18.. (1)请描述金属晶体中自由电子的存在状态.答: __________________________________________________________________ . (2)请说明金属晶体中自由电子所起的作用.答: _________________________________________________________________________ . 19.金属导电靠 _____________ ,电解质溶液导电靠 _____________ ;金属导电能力随温度升高而 _________ , 溶液导电能力随温度升高而 _______________ . 20•有一种金属结构单元是一个面心立方体”(注:八个顶点和六个面分别有一个金属原子)该单元平均是由 __________ 个金属原子组成的。
(完整版)4章金属的结构和结晶习题

4章习题l、以下不是晶体的物质有______。
A.钢铁 B.普通玻璃 C.石墨 D.锡青铜答:B2、绝大多数的金属是以下列哪些的晶格形式存在______。
I、体心立方晶格 II、面心立方晶格Ⅲ、正交晶格Ⅳ、密排六方晶格A.I+II+Ⅲ B.II+m+Ⅳ C.I+II+Ⅳ D.I+Ⅲ+Ⅳ答:C3、关于晶体以下说法错误的是______。
A.绝人多数固体物质都是晶体 B.面心立方晶格的金属一般塑性较好C.单晶体各个方向上的物理、化学和力学性能基本一样D.纯铁具有同素异构转变的性质答:C4、关于晶体,以下说法正确的是______。
A绝大多数固体物质都是非晶体B.面心立方晶格的纯铁较体心立方晶格的纯铁强度高C.多晶体各个方向上的物理、化学和力学性能基本一样D.纯铁在室温时具有面心立方晶格类型答:C5、实际金属晶体多为_____晶体,其理化和力学性能在不同方向上表现出______。
A.。
单/各向同性 B.单/各向异性 C.多/各向异性 D.多/各向同性答:D6、实际金属晶体多为多晶体,包含有许多______.还存在大量的______. 答:DA.晶粒/晶体结构B.晶粒/晶体缺陷C.晶块/晶体结构D.晶块/晶体缺陷7、实际金属晶体存在大量的晶体缺陷,按其形态分.主要有______、______、和______。
A.点缺陷/刃型位错/线缺陷 B.点缺陷/线缺陷/面缺陷C.线缺陷/面缺陷/亚晶界 D.面缺陷/亚晶界/晶体缺陷答:B8、金属的结晶过程包含了______和______。
A.晶核不断形成/晶核长大 B.晶粒/晶界C.晶界/亚晶界D.晶核/晶核长大答:A9、同一金属结晶后,晶粒较细的其______. A.强度较高而塑性较差 B.强度较低而塑性较差 C.强度较低而塑性较好 D.强度较高而塑性较好答:D10、金属结晶后,其晶粒的粗细与结晶时______有关。
A.形核率和形核速度 B.形核速度和形核面积C.过冷度 D.品粒度和品核长人速度答:C11、为得到较细的金属晶粒,可采用______、______和附加振动等措施.A.适当减小过冷度,变质处理B.适当增加过冷度/变质处理C.适当增加过冷度/处理变质D.适当减小过冷度/处理变质答:B12、为得到较细的金属晶粒,生产上可采用增加过冷度等措施,对较大的铸件,其过冷度______。
高中化学第3章晶体结构与性质第3节金属晶体作业含解析新人教版选修3

第3节金属晶体A 级·基础巩固练一、选择题1.金属原子在二维空间里的放置有如图所示的两种方式,下列说法中正确的是( C )A.图a为非密置层,配位数为6B.图b为密置层,配位数为4C.图a在三堆空间里堆积可得六方最密堆积和面心立方最密堆积D.图b在三维空间里堆积仅得简单立方堆积解析:金属原子在二维空间里有两种排列方式,一种是密置层排列,一种是非密置层排列。
密置层排列的空间利用率高,原子的配位数为6,非密置层的配位数较密置层小,为4。
由此可知,上图中a为密置层,b为非密置层。
密置层在三维空间堆积可得到六方最密堆积和面心立方最密堆积两种堆积模型,非密置层在三维空间堆积可得简单立方堆积和体心立方堆积两种堆积模型。
所以,只有C选项正确。
2.下列关于金属晶体的叙述中,正确的是( C )A.温度越高,金属的导电性越强B.常温下,金属单质都以金属晶体形式存在C.金属晶体堆积密度大,能充分利用空间的原因是金属键没有饱和性和方向性D.金属阳离子与自由电子之间的强烈作用,在外力作用下会发生断裂,故金属无延展性解析:温度高,金属离子的热运动加快,对自由电子的移动造成阻碍,导电性减弱,A项错;常温下,Hg为液态,不属于晶体形态,B项错;金属键无方向性和饱和性,在外力作用下,一般不会断裂,即金属具有延展性,D项错;正是因为金属键无方向性和饱和性,所以金属晶体中的金属原子一般采用最密堆积,尽量充分利用空间,C项正确。
3.下列晶体中,金属阳离子与自由电子间的作用最强的是( C )A.Na B.MgC.Al D.K解析:Na、Mg、Al均位于第三周期,原子半径逐渐减小,价电子数目逐渐增多,所以金属键逐渐增强,即铝的金属键最强,钠的金属键最弱,而K和Na位于同一主族,且K的半径比Na的大,钾的金属键比钠的弱。
4.下列四种叙述,可能为金属晶体性质的是( B )A .由分子间作用力结合而成,熔点低B .固体或熔融后易导电,熔点在1 000 ℃左右C .由共价键结合成网状结构,熔点高D .固体不导电,但溶于水或熔融后能导电解析:由分子间作用力结合而成,熔点低是分子晶体的性质,A 错;固体能导电是金属晶体的特性,B 对、D 错,由共价键结合成网状结构,熔点高为原子晶体的性质,C 错。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属晶体练习题
1.金属键的实质是()
A.自由电子与金属阳离子之间的相互作用B.金属原子与金属原子间的相互作用C.金属阳离子与阴离子的吸引力D.自由电子与金属原子之间的相互作用2.金属的下列性质与金属晶体结构中的自由电子无关的是()
A.良好的导电性B.良好的导热性C.良好的延展性D.密度大小
3.按下列四种有关性质的叙述,可能属于金属晶体的是()
A.金属阳离子之间存在斥力B.金属原子半径都较大,价电子较少C.金属中大量自由电子受到外力作用时,运动速度加快
D.金属受到外力作用时,各原子层容易发生相对滑动,但不会改变原来的排列方式,也不会破坏金属键
4.关于晶体的下列说法正确的是()
A.在晶体中只要有阳离子就一定有阴离子
B.金属镁、金刚石和固体氖都是由原子直接构成的单质晶体
C.金属晶体的熔点可能比分子晶体的低,也可能比原子晶体的高
D.铜晶体中,1个铜离子跟2个价电子间有较强的相互作用
5.金属晶体堆积密度大,原子配位数大,能充分利用空间的原因是()
A.金属原子价电子数少B.金属晶体中有自由电子
C.金属原子的原子半径大D.金属键没有饱和性和方向性
6.下列金属晶体中,金属阳离子和自由电子之间的作用最强的是()
A.Na B.Mg C.Al D.K
7.铝硅合金(含硅13.5%)凝固时收缩率很小,因而这种合金适合于
铸造。
现有下列三种晶体:①铝;②硅;③铝硅合金。
它们的熔
点从低到高的顺序是()
A.①②③B.②①③C.③②①D.③①②
8.关于体心立方堆积型晶体(如图)结构的叙述中正确的是()
A.是密置层的一种堆积方式B.晶胞是六棱柱
C.每个晶胞内含2个原子D.每个晶胞内含6个原子
9.石墨晶体是层状结构,在每一层内,每一个碳原子都跟其他3个碳原
子相结合。
据图分析,石墨晶体中碳原子数与共价键数之比为()
A.2∶3 B.2∶1 C.1∶3 D.3∶2
10.现有5种固态物质:四氯化硅、硼、石墨、锑、氖。
将符合信息的物质名称和所
属晶体类型填在表格中。
11.(2012·武汉高二质检)在常温常压下,下列物质中属于金属晶体的是() A.铂B.汞C.水晶D.金刚石
12.金属的下列性质中,不.能用金属的电子气理论加以解释的是()
A.易导电B.易导热C.易腐蚀D.有延展性
13.按下列四种有关性质的叙述,可能属于金属晶体的是()
A.由分子间作用力结合而成,熔点低
B.固体或熔融后易导电,熔点在1000 ℃左右
C.由共价键结合成网状结构,熔点高
D.固体和熔融状态不导电,但溶于水后可能导电
13.金属晶体的形成是因为晶体中存在()①金属原子②金属阳离子③自由电子④阴离子
A.只有①B.只有③C.②③D.②④
14.下列不.属于金属晶体的共性的是()
A.易导电B.易导热C.有延展性D.高熔点
15.下列有关金属的叙述正确的是()
A.金属受外力作用时常常发生变形而不易折断,是由于金属离子之间有较强的作用
B.通常情况下,金属里的自由电子会发生定向移动,而形成电流
C.金属是借助金属离子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而降低
16.关于铜晶体的堆积方式说法正确的是()
A.按ABABAB…方式堆积,配位数为12 B.按ABABAB…方式堆积,配位数为8
C.简单立方堆积,配位数为6 D.按ABCABC……方式堆积,配位数为12
17.下列叙述中正确的是()
A.有阳离子的晶体一定有阴离子B.有阳离子的晶体一定是化合物
C.由单质组成的晶体如果固态时能导电也不一定是金属晶体
D.金属晶体都具有较高的熔点和银白色的金属光泽
18.在金属晶体中,金属原子的价电子数越多,原子半径越小,则自由电子与金属阳离子间的作用力越大,金属的熔、沸点越高。
由此判断下列各组金属熔、沸点高低顺序,其中正确的是()
A.Mg>Al>Ca B.Al>Na>Li C.Al>Mg>Ca D.Mg>Ba>Al 19.关于下图不.正确的说法是()
A.此种最密堆积为面心立方最密堆积B.该种堆积方式称为铜型
C.该种堆积方式可用符号……ABCABC……表示
D.该种堆积方式称为镁型
20.金属晶体中金属原子主要有三种常见
的堆积方式:体心立方堆积、面心立方堆
积和六方堆积,其结构单元分别如图中
甲、乙、丙所示,则甲、乙、丙三种结构
单元中,金属原子个数比为_______。
21.晶胞即晶体中最小的重复单元。
已知金晶体的晶胞是面心立
方体,即在立方体的8个顶点各有一个金原子,各个面的中心有
一个金原子,每个金原子被相邻的晶胞所共用(如图)。
金原子的半
径为d cm,用N A表示阿伏加德罗常数,M表示金的摩尔质量。
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定________
_______________________________________________。
(3)一个晶胞的体积为______。
金晶体的密度为____。
22.在1~18号元素中,部分连号元素单质的熔点情况
如图所示,试回答:
(1)c点代表的单质是__________,其熔点高的主要原因
是_________________________________。
(2)d所属的晶体类型是_____,粒子间的作用力为
_______________________。
(3)上述元素形成的氢化物中能形成氢键的是____________。
(4)图中的a所代表的元素符号是________,它的氢氧化物与h点元素氢氧化物溶液
反应的离子方程式是____________________________________
22.(1)金属导电是靠________,该粒子在外加电场作用下发生定向移动形成电流,金属导电能力随温度升高而________;电解质溶液导电是靠________,电解质溶液导电能力随温度升高而________。
(2)金属晶体中金属原子的价电子数越________,原子半径越________,金属阳离子与自由电子之间的静电作用就越强,金属键就越________,因此,金属晶体的熔、沸点就越________,硬度就越________。
如Na、Mg、Al的熔点由高到低的顺序为____________________,硬度由大到小的顺序为________________。
23.(1)如图所示为二维平面晶体示意图,所表示的化学式为AX3的是________。
(2)已知铝为面心立方晶体,其结构如上图甲所示,面心立方的结构特征如上图乙所示。
若铝原子的半径为1.27×10-10 m,试求铝金属晶体中的晶
胞长度,即上图丙中AB的长度为________m。
24.下图为一个金属铜的晶胞,请完成以下各题。
(1)该晶胞“实际”拥有的铜原子数是________个。
(2)该晶胞称为________。
(填序号)
A.六方晶胞B.体心立方晶胞C.面心立方晶胞
(3)此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρg/cm3,则阿伏加德罗常数为________(用a、ρ表示)。
25.现有四种金属晶体:Na、Zn、
Po、Au,下图所示为金属原子的四
种基本堆积模型。
请回答以下问
题:
(1)堆积方式的空间利用率最低的基本堆积模型是______(填编号),符合该堆积模型的金属晶体是________(填化学符号)。
(2)金属原子在二维平面里放置得到密置层和非密置层,其中非密置层的配位数是________,由非密置层互相错位堆积而成的基本堆积模型是________(填编号),符合该堆积模型的金属晶体是________(填化学符号)。
(3)按ABCABCABC……方式堆积的基本堆积模型是________(填编号),符合该堆积模型的金属晶体是________(填化学符号)。
