《试卷3份集锦》浙江省绍兴市2020高考化学经典试题
★试卷3套汇总★绍兴市2020年高考化学学业水平测试试题

2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.下列生活用品的主要成分不属于有机高分子物质的是()A.植物油B.丝织品C.聚乙烯D.人造毛2.某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合液,经测定ClO-和ClO3-个数比为1:2,则Cl2与KOH溶液反应时,被还原的氯与被氧化的氯的物质的量之比为()A.21:5 B.4:1 C.3:l D.11:33.下列物质的工业生产过程中,其主要反应不涉及氧化还原反应的是()A.纯碱B.氨气C.烧碱D.盐酸4.“ 17世纪中国工艺百科全书” 《天工开物》为明代宋应星所著。
下列说法错误的是A.“ 凡铁分生熟,出炉未炒则生,既炒则熟” 中的“ 炒” 为氧化除碳过程B.“ 凡铜出炉只有赤铜,以倭铅(锌的古称)参和,转色为黄铜” 中的“ 黄铜” 为锌铜金C.“ 凡石灰经火焚,火力到后,烧酥石性,置于风中久自吹化成粉” 中的“ 粉” 为CaOD.“ 凡松烟造墨,入水久浸,以浮沉分清悫” ,是指炭因颗粒大小及表面积的不同而浮沉5.已知1mol氢气和氧气完全燃烧生成水蒸气放出241.8千焦热量,下列热化学方程式正确的是A.2H2(g)+O2(g)→2H2O(g)+241.8kJB.H2(g)+1/2O2(g)→H2O(s)+241.8 kJC.H2(g)+1/2O2(g)→H2O(g)-241.8 kJD.H2O(g)→H2(g)+1/2O2(g)-241.8 kJ6.反应Fe2O3+3CO2Fe+3CO2,作氧化剂的是()A.Fe2O3B.CO C.Fe D.CO27.有关化学键和晶体的叙述中正确的是()A.分子晶体中,分子间作用力越大分子越稳定B.分子晶体都是由共价分子构成的C.离子晶体中可能含有共价键D.原子晶体中只存在非极性键8.下列实验中根据现象得出的结论正确的是()选项实验现象结论A向NaAlO2溶液中持续通入气体Y 先出现白色沉淀,最终沉淀又溶解Y可能是CO2气体B 向某溶液中加入Cu和浓H2SO4试管口有红棕色气体产生原溶液可能含有NO3-C 向溴水中通入SO2气体溶液褪色SO2具有漂白性D向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水先出现蓝色沉淀K sp[Cu(OH)2]>K sp[Mg(OH)2]A.A B.B C.C D.D9.下列有关垃圾分类说法错误的是A.废弃的聚乙烯塑料属于白色垃圾,不能使溴水退色B.可回收的易拉罐中含金属铝,可通过电解氧化铝制取C.废旧电池中含有镍、镉等重金属离子,不能填埋处理D.含丝、毛的废旧衣物燃烧处理时只生成CO2和H2O10.香豆素-4由C、H、O三种元素组成,分子球棍模型如下图所示。
2020年浙江卷【化学真题】普通高等学校招生全国统一考试卷(解析版)汇编版

D. 钢铁在潮湿空气中生锈主要是发生了电化学腐蚀 【答案】B 【解析】 【详解】A.Cl-很容易被吸附在铝表面的氧化膜上 ,将氧化膜中的氧离子取代出来 ,从而破坏氧化膜 ,A 选项正确; B.碳酸氢钠受热分解可产生碳酸钠、水和二氧化碳 ,则稳定性:NaHCO3<Na2CO3 ,B 选项错误; C.KMnO4 具有强氧化性 ,可使病毒表面的蛋白质外壳变形 ,其稀溶液可用于消毒 ,C 选项正确; D.钢铁在潮湿的空气中 ,铁和碳、水膜形成原电池 ,发生电化学腐蚀 ,腐蚀速率更快 ,D 选项正确; 答案选 B。 9.下列说法不正确的是( ) A. 高压钠灯可用于道路照明
1.水溶液呈酸性的是( )
A. NaCl
B. NaHSO4
C. HCOONa
D. NaHCO3
【答案】B
【解析】 【详解】A.NaCl 是强酸强碱盐 ,其不能水解 ,故其水溶液呈中性 ,A 不符合题意;
2
B.NaHSO4 是强酸的酸式盐 ,其属于强电解质 ,其在水溶液中的电离方程式为 NaHSO4=Na++H++SO 4 , 故其水溶液呈酸性 ,B 符合题意; C.HCOONa 属于强碱弱酸盐 ,其在水溶液中可以完全电离 ,其电离产生的 HCOO-可以发生水解 ,其水 解的离子方程式为 HCOO-+H2O⇌HCOOH+OH- ,故其水溶液呈碱性 ,C 不符合题意; D.NaHCO3是强碱弱酸盐 ,既能发生电离又能发生水解 ,但其水解程度大于电离程度 ,故其水溶液呈碱 性 ,D 不符合题意。 综上所述 ,本题答案为 B。
B. 甲酸甲酯的结构简式: C2H4O2
2020年浙江省绍兴市重点中学高考化学综合题大全100题
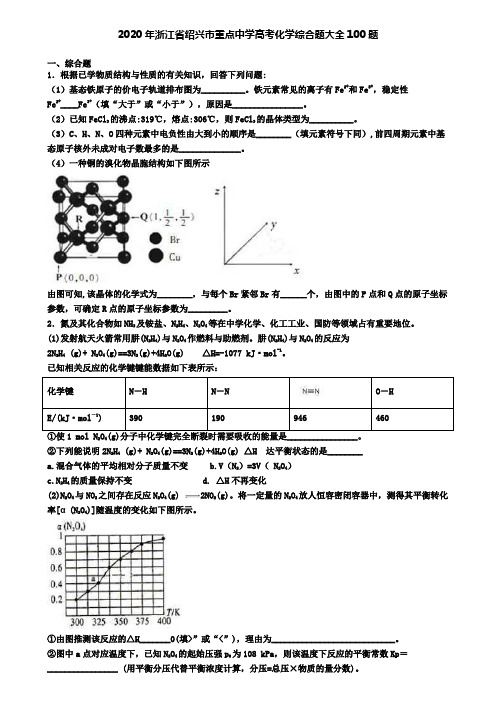
2020年浙江省绍兴市重点中学高考化学综合题大全100题一、综合题1.根据已学物质结构与性质的有关知识,回答下列问题:(1)基态铁原子的价电子轨道排布图为__________。
铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+____Fe3+(填“大于”或“小于”),原因是________________。
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为__________。
(3)C、H、N、O四种元素中电负性由大到小的顺序是________(填元素符号下同),前四周期元素中基态原子核外未成对电子数最多的是______________。
(4)一种铜的溴化物晶胞结构如下图所示由图可知,该晶体的化学式为________,与每个Br紧邻Br有______个,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为_________。
2.氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。
肼(N2H4)与N2O4的反应为2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H=-1077 kJ·mol-1。
已知相关反应的化学键键能数据如下表所示:24②下列能说明2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H 达平衡状态的是________a.混合气体的平均相对分子质量不变b.V(N2)=3V( N2O4)c.N2H4的质量保持不变d. △H不再变化(2)N2O4与NO2之间存在反应N2O4(g) 2NO2(g)。
将一定量的N2O4放人恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如下图所示。
①由图推测该反应的△H_______0(填>”或“<”),理由为____________________________。
化学2020浙江高考真题

化学2020浙江高考真题2020年浙江省高考化学试卷一、选择题1. 下列元素中电子亲和能力最大的是()A. LiB. NaC. KD. Cs2. 已知pH=3的气溶液X与pH=10的气液Y摇匀后得到气溶液Z,若气溶液Z的pH=7,则()A. X和Y为弱酸弱碱,或X和Y为酸碱,不限定强弱B. X和Y均为酸C. X和Y均为强酸D. X和Y均为弱酸3. 关于具有同样化学成分但不同结构的酒精混合物和记忆方法,下列说法正确的是()A. 沸点和融点是相同的B. 饱和蒸汽压是相同的C. 密度是相同的D. 光学旋转性质是相同的4. 化合物Na2CO3溶于水后,溶液pH计数为10,原因在于其中的离子组成及()A. 离子的电荷数量B. 化合物的电负度C. 溶解度积的大小D. 收缩比的大小5. 以下关于SnCl2和SnCl4的说法正确的是()A. 两者都为卤化锡B. 两者的还原性依次增大C. 两者的氧化数之和均为+6D. 两者的金属离子均为Sn2+二、填空题6. H2SO4能与分别为__和NH4OH发生酸碱反应。
7. 当CaSO4溶解度积大于CaCO3时,在CaSO4饱和溶液中加入(NH4)2CO3沉淀____。
8. 在正常温度下,雪花石并非粘塞状的石英,而是平稠的石英,此为石英__。
9. Na2S+Bf3反应生成S2F2和NaBF4是何因素引起的?10. 对于该题目,染色体或无机化合物级联传递的物理条件包括哪些?11. 斯成年植牙对骨膜的生长方式有何影响?三、解答题【解答题】12. 请用方程式表示以下反应:B2O3+HF→H3O++[BF4]-13. 释电池电解液的质子还电子的作用机理是经过激发态的形式存在的。
(1)请说明对称电子和反映态的差异。
(2)请问当前谜团的变异联系受体相连中,消失或损伤的人,并嘱咐救援机构将存废处理发布。
四、分析题【分析题】14. 从以下数据中推出性质的相对分言(,并理解其中过程为何):NaCl、(校川大则即,故并巨)LiCl、(PbCl2)、(NH4)2SO4、Na2SO415. 如何理解“氨气和硫酸混合是高危剂。
[合集3份试卷]2020浙江省绍兴市高考化学经典试题
![[合集3份试卷]2020浙江省绍兴市高考化学经典试题](https://img.taocdn.com/s3/m/069a64b3eff9aef8951e0667.png)
2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.将少量SO2通入Ca(ClO)2溶液中,下列离子方程式能正确表示该反应的是()A.SO2+H2O+Ca2++2ClO﹣→CaSO4↓+HClO+H++Cl﹣B.SO2+H2O+Ca2++2ClO﹣→CaSO3↓+2H++2ClO﹣C.SO2+H2O+Ca2++2ClO-→CaSO3↓+2HClOD.SO2+H2O+Ca2++2ClO-→CaSO4↓+2H++Cl-2.用NaOH标准溶液滴定盐酸,以下操作导致测定结果偏高的是A.滴定管用待装液润洗B.锥形瓶用待测液润洗C.滴定结束滴定管末端有气泡D.滴定时锥形瓶中有液体溅出3.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )A.苹果汁中的Fe2+变成Fe3+B.苹果汁中含有Cu2+C.苹果汁中含有OH-D.苹果汁中含有Na+Ti的说法中,错误的是()4.钛(Ti)常被称为未来钢铁。
下列关于4822A.质子数为22 B.质量数为70 C.中子数为26 D.核外电子数为22 5.下列实验操作对应的现象与结论均正确的是( )A.A B.B C.C D.D6.工业用强氧化剂PbO2来制备KClO4的工业流程如下:根据流程推测,下列判断不正确的是( )A.“酸化”的试剂是稀硝酸或浓盐酸B.“滤渣”主要成分是PbO2粉末,可循环使用C.NaClO3与PbO2反应的离子方程式为-+2+-PbO+ClO+2H=Pb+ClO+H O2342D.在KNO3、KClO4、NaClO4、NaNO3中,常温下溶解度小的是KClO47.下列物质的应用中,利用了该物质氧化性的是A.小苏打——作食品疏松剂B.漂粉精——作游泳池消毒剂C.甘油——作护肤保湿剂D.明矾——作净水剂8.短周期元素A、B、C、D的原子序数依次增大。
X、Y、Z、W分别是由这四种元素中的两种组成的常见化合物,Y为淡黄色固体,W为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示(部分生成物已省略)。
【精选4份合集】浙江省绍兴市2020-2021学年新高考化学经典试题

2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.室温下,下列各组离子在指定溶液中能大量共存的是A.()()-12+OH10Hcc-=的溶液:NH4+、Cu2+、NO3-、SO42-B.0.1 mol·L−1的氨水:Cu2+、Na+、SO42-、NO3-C.1 mol·L−1的NaClO溶液:Fe2+、Al3+、NO3-、I−D.0.1 mol·L−1的NaHCO3溶液:K+、Na+、NO3-、OH−2.邻甲基苯甲酸主要用于农药、医药及有机化工原料的合成,其结构简式为,下列关于该物质的说法正确的是()。
A.该物质能与溴水生成白色沉淀B.该物质含苯环的同分异构体中能水解且含有甲基的共5种C.1mol该物质最多能与4molH2生加成反应D.该物质中所有原子共平面3.下列反应中,相关示意图像错误的是:A.将二氧化硫通入到一定量氯水中B.将氨水滴入到一定量氯化铝溶液中C.将铜粉加入到一定量浓硝酸中D.将铁粉加入到一定量氯化铁溶液中4.下列有关表述正确的是()A.HClO是弱酸,所以NaClO是弱电解质B.Na2O、Na2O2组成元素相同,所以与CO2反应产物也相同C.室温下,AgCl在水中的溶解度小于在食盐水中的溶解度D.SiO2是酸性氧化物,能与NaOH溶液反应5.已知1mol氢气和氧气完全燃烧生成水蒸气放出241.8千焦热量,下列热化学方程式正确的是A.2H2(g)+O2(g)→2H2O(g)+241.8kJB.H2(g)+1/2O2(g)→H2O(s)+241.8 kJC.H2(g)+1/2O2(g)→H2O(g)-241.8 kJD.H2O(g)→H2(g)+1/2O2(g)-241.8 kJ6.下列关于糖类的说法正确的是A.所有糖类物质都有甜味,但不一定都溶于水B.葡萄糖和果糖性质不同,但分子式相同C.蔗糖和葡萄糖都是单糖D.摄入人体的纤维素在酶的作用下能水解为葡萄糖7.下列实验操作、实验现象和实验结论均正确的是A.A B.B C.C D.D8.2007年诺贝尔化学奖授予德国化学家格哈德·埃特尔,以表彰其在固体表面化学研究领域作出的开拓性贡献。
绍兴市达标名校2020年高考三月质量检测化学试题含解析
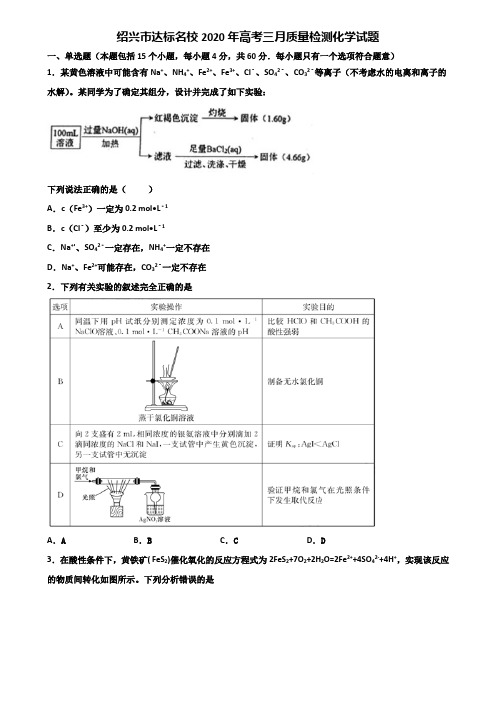
绍兴市达标名校2020年高考三月质量检测化学试题一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.某黄色溶液中可能含有Na+、NH4+、Fe2+、Fe3+、Cl﹣、SO42﹣、CO32﹣等离子(不考虑水的电离和离子的水解)。
某同学为了确定其组分,设计并完成了如下实验:下列说法正确的是()A.c(Fe3+)一定为0.2 mol•L﹣1B.c(Cl﹣)至少为0.2 mol•L﹣1C.Na+'、SO42﹣一定存在,NH4+一定不存在D.Na+、Fe2+可能存在,CO32﹣一定不存在2.下列有关实验的叙述完全正确的是A.A B.B C.C D.D3.在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。
下列分析错误的是A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2OB.反应Ⅱ的氧化剂是Fe3+C.反应Ш是氧化还原反应D.黄铁矿催化氧化中NO作催化剂4.大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。
某研究小组在实验室测得不同温度下(T1,T2)海水中CO32-浓度与模拟空气中CO2浓度的关系曲线。
已知:海水中存在以下平衡:CO2(aq)+CO32-(aq)+H2O(aq)2HCO3-(aq),下列说法不正确的是A.T1>T2B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO32-浓度降低C.当大气中CO2浓度确定时,海水温度越高,CO32- 浓度越低D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解5.将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是()A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液6.下表是四种盐在不同温度下的溶解度(g/100g水):(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)NaNO3KNO3NaCl KCl10℃80.5 21.2 35.7 31.0100℃175 246 39.1 56.6用物质的量之比为1:1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示以下说法错误的是()A.①和②的实验过程中,都需要控制温度B.①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤C.②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤D.用95%的酒精洗涤所得的硝酸钾晶体比较好7.下列实验不能达到目的的是()选项目的实验A 制取较高浓度的次氯酸溶液将Cl2通入小苏打溶液中B 除去溴苯中的少量溴加入苛性钠溶液洗涤、分液C 加快氢气的生成速率将与稀硫酸反应的粗锌改为纯锌D 制备少量氨气向新制生石灰中滴加浓氨水A.A B.B C.C D.D8.已知2FeSO4高温Fe2O3+SO2↑+SO3↑,某同学设计利用如图装置分别检验产物中的气体。
2020年高考浙江化学试题及答案(WORD版)
2020年普通高等学校招生全国统一考试(浙江卷)化 学可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 Zn 65 Ag 108 I 127 Ba 137一、选择题(本大题共25小题,每小题2分,共50分。
每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分) 1.水溶液呈酸性的是( ) A .NaClB .4NaHSOC .HCOONaD .3NaHCO2.固液分离操作中,需要用到的仪器是( )A .B .C .D .3.下列物质在熔融状态下不导电...的是( ) A .NaOHB .2CaClC .HClD .24K SO4.下列物质对应的组成不正确...的是( ) A .干冰:2COB .熟石灰:42CaSO 2H O ⋅C .胆矾:42CuSO 5H O ⋅D .小苏打:3NaHCO5.下列表示不.正确..的是( ) A .乙烯的结构式:B .甲酸甲酯的结构简式:242C H OC .2-甲基丁烷的键线式:D .甲基的电子式:6.下列说法不正确...的是( ) A .天然气是不可再生能源B .用水煤气可合成液态碳氢化合物和含氧有机物C .煤的液化属于物理变化D .火棉是含氮量高的硝化纤维 7.下列说法正确的是( )A .35Cl 和37Cl 是两种不同的元素B .单晶硅和石英互为同素异形体C .HCOOH 和2HOCH CHO 互为同系物D .H 与Na 在元素周期表中处于同一主族8.下列说法不正确...的是( ) A .Cl -会破坏铝表面的氧化膜 B .3NaHCO 的热稳定性比23Na CO 强C .4KMnO 具有氧化性,其稀溶液可用于消毒D .钢铁在潮湿空气中生锈主要是发生了电化学腐蚀 9.下列说法不正确...的是( ) A .高压钠灯可用于道路照明 B .2SiO 可用来制造光导纤维C .工业上可采用高温冶炼黄铜矿的方法获得粗铜D .3BaCO 不溶于水,可用作医疗上检查肠胃的钡餐 10.反应Δ2222MnO 4HCl()MnCl Cl 2H O ++↑+浓中,氧化产物与还原产物的物质的量之比是( ) A .1∶2B .1∶1C .2∶1D .4∶111.下列有关实验说法不正确...的是( ) A .萃取2Br 时,向盛有溴水的分液漏斗中加入4CCl ,振荡、静置分层后,打开旋塞,先将水层放出 B .做焰色反应前,铂丝用稀盐酸清洗并灼烧至火焰呈无色C .乙醇、苯等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞D .可用3AgNO 溶液和稀3HNO 区分NaCl 、2NaNO 和3NaNO 12.下列说法正确的是( )A .2Na O 在空气中加热可得固体22Na OB .Mg 加入到过量3FeCl 溶液中可得FeC .2FeS 在沸腾炉中与2O 反应主要生成3SOD .22H O 溶液中加入少量2MnO 粉末生成2H 和2O 13.能正确表示下列反应的离子方程式是( )A .()()4422NH Fe SO 溶液与少量2Ba(OH)溶液反应:2244SO BaBaSO -++=↓B .电解2MgCl 水溶液:2222Cl 2H O2OH Cl H --++↑+↑通电C .乙酸乙酯与NaOH 溶液共热:Δ323332CH COOCH CH OH CH COO CH CH OH --−−→++ D .4CuSO 溶液中滴加稀氨水:22Cu 2OH Cu(OH)+-+=↓14.下列说法不正确...的是( ) A .相同条件下等质量的甲烷、汽油、氢气完全燃烧,放出的热量依次增加 B .油脂在碱性条件下水解生成的高级脂肪酸盐是肥皂的主要成分 C .根据纤维在火焰上燃烧产生的气味,可以鉴别蚕丝与棉花 D .淀粉、纤维素、蛋白质都属于高分子化合物15.有关的说法正确的是( )A .可以与氢气发生加成反应B .不会使溴水褪色C .只含二种官能团D .1mol 该物质与足量NaOH 溶液反应,最多可消耗1mol NaOH16.X 、Y 、Z 、M 、Q 五种短周期元素,原子序数依次增大。
浙江省绍兴市2020新高考高一化学下学期期末经典试题

高一(下)学期期末化学模拟试卷一、单选题(本题包括20个小题,每小题3分,共60分.每小题只有一个选项符合题意)1.短周期主族元素X、Y、Z、W的原子序数依次增大,X是元素周期表中原子半径最小的元素,Y是地壳含量最多的元素,Z与X原子的最外层电子数相同,Y与W同主族。
下列说法正确的是A.X与Y只能形成一种化合物B.原子半径:r(Y) < r(W) < r(Z)C.W的气态氢化物的热稳定性比Y的强D.Z的最高价氧化物对应的水化物是强酸2.据科学家预测,月球的土壤中吸附着数百万吨的,而在地球上氦元素则主要以的形式存在。
下列说法正确的是A.原子核内含有4个质子B.与互为同位素C.与在元素周期表中占有不同的位置D.的最外层电子数为2,故易失去最外层电子3.从本质上讲,工业上冶炼金属的反应一定都属于A.氧化还原反应B.置换反应C.分解反应D.复分解反应4.下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。
下列说法错误..的是A.原子半径:W<XB.Y在自然界中只以化合态形式存在C.气态氢化物热稳定性:Z<WD.W和Z的氧化物对应的水化物酸性:Z<W5.反应2SO 2+O22SO3在密闭容器中进行。
下列关于该反应的说法错误的是A.升高温度能加快反应速率B.使用恰当的催化剂能加快反应速率C.增大O2的浓度能加快反应速率D.SO2与O2能100%转化为SO36.下列过程包含化学变化的是A.干冰升华B.粮食酿醋C.滴水成冰D.沙里淘金7.最早提出苯分子结构简写为的德国化学家是A.拉瓦锡B.凯库勒C.门捷列夫D.汤姆逊8.过氧化氢是一种“绿色氧化剂”,保存过氧化氢的试剂瓶上最适合贴上的一个标签是A.B.C.D.9.在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s) + 2B(g)C(g) + D(g) 已达平衡状态的是A.混合气体的压强B.混合气体的密度C.B的物质的量浓度D.气体的平均相对分子质量10.下列有机化学方程式及其反应类型均正确的是A.A B.B C.C D.D11.将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生反应:2A(g)+B(g)2C (g),若经3s后测得C的浓度为0.6mol/L,现有下列几种说法:①用物质A表示的反应的平均速率为0.6 mol/(L·s)②用物质B表示的反应的平均速率为0.1mol/(L·s)③3s时物质A的转化率为70%④3s 时物质B 的浓度为0.7 mol/L 。
〖精选3套试卷〗2020学年浙江省绍兴市高考化学经典试题

2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.下列有关电解质溶液的说法正确的是A.0.1mol/L氨水中滴入等浓度等体积的醋酸,溶液导电性增强B.适当升高温度,CH3COOH溶液pH增大C.稀释0.1 mol/L NaOH溶液,水的电离程度减小D.CH3COONa溶液中加入少量CH3COOH,-3-3c(CH COO)c(CH COOH)c(OH)减小2.磷及其化合物在工农业生产中具有重要用途。
回答下列问题:(1)下图所示为提纯白磷样品(含惰性杂质)的工艺流程。
过程I中,被还原的元素是________(填元素符号),过程III的化学方程式为__________。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:①复合材料中V的化合价为________,C的作用是____________。
②V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为____________;“洗涤”时用乙醇而不用水的目的是________________。
③锂离子电池是一种二次电池,又称“摇椅”电池。
若用和Li x C6和Li3V2(PO4)3/C做电极,放电时的电池总反应为Li x C6+Li3-x V2(PO4)3= Li3V2(PO4)3+C6,则电池充电时阳极的电极反应式为___________。
3.利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。
下列判断正A.该反应的ΔH=+91kJ·mol-1B.加入催化剂,该反应的ΔH变小C.反应物的总能量大于生成物的总能量D.如果该反应生成液态CH3OH,则ΔH增大4.研究表明,雾霾中的无机颗粒主要是硫酸铵和硝酸铵,大气中的氨是雾霾的促进剂。
(3份试卷汇总)2019-2020学年浙江省绍兴市高考化学经典试题

2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.某无色气体可能含有CO、CO2和H2O(g)、H2中的一种或几种,依次进行如下处理(假定每步处理都反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,黑色固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色晶体;④通过澄清石灰水时,溶液变得浑浊。
由此可以确定原无色气体中() A.一定含有CO2、H2O(g),至少含有H2、CO中的一种B.一定含有H2O(g)、CO,至少含有CO2、H2中的一种C.一定含有CO、CO2,至少含有H2O(g)、H2中的一种D.一定含有CO、H2,至少含有H2O(g)、CO2中的一种2.下列有关化学和传统文化关系的说法中不正确...的是A.东汉魏伯阳在《周易参同契》中对汞的描述:“太阳流珠,常欲去人…得火则飞,不见埃尘,将欲制之,黄芽为根……”,这里的“黄芽”是指硫B.三国时期曹植在《七步诗》中写到“煮豆持作羹,漉菽以为汁。
萁在釜中燃,豆在釜中泣。
……”,文中“漉”涉及的操作原理类似于化学实验中的过滤C.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“强烧之,紫青烟起……云是真硝石也”,该方法用了焰色反应D.《本草图经》在绿矾项载:“盖此矾色绿,味酸,烧之则赤……”,因为绿矾能电离出H+,所以“味酸”3.下列有关垃圾分类说法错误的是A.废弃的聚乙烯塑料属于白色垃圾,不能使溴水退色B.可回收的易拉罐中含金属铝,可通过电解氧化铝制取C.废旧电池中含有镍、镉等重金属离子,不能填埋处理D.含丝、毛的废旧衣物燃烧处理时只生成CO2和H2O4.含有0.01molFeCl3的氯化铁饱和溶液因久置变得浑浊,将所得分散系从如图所示装置的A 区流向B区,其中C区是不断更换中的蒸馏水。
已知N A为阿伏加德罗常数的值。
下列说法不正确的是A.实验室制备Fe(OH)3胶体的反应为:FeCl3+3H2O ΔFe(OH)3(胶体)+3HClB.滤纸上残留的红褐色物质为Fe(OH)3固体颗粒C.在B区的深红褐色分散系为Fe(OH)3胶体D.进入C区的H+的数目为0.03N A5.下列离子方程式正确的是A.钾和冷水反应:K+H2O=K++OH—+H2↑B.氢氧化铁溶于氢碘酸:2Fe3++2I—=2Fe2++I2C.碳酸氢铵稀溶液中加入足量烧碱溶液:HCO3—+ NH4++2OH—=CO32—+ NH3·H2O+H2OD.硫代硫酸钠溶液与稀硫酸混合:3S2O32—+2H+=4S↓+2SO42—+H2O6.相同温度下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。
浙江省绍兴市亭山中学2020年高三化学测试题含解析

浙江省绍兴市亭山中学2020年高三化学测试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 设N A为阿伏加德罗常数的值,下列说法正确的是A.1mol NO2与足量H2O反应,转移电子数为2N AB.1L0.5mol/L Na2CO3溶液中的阴离子数目小于0.5N AC.标准状况下,22.4L任意比的氢气与氧气的混合气体中含有的分子总数为N AD.10g H218O中所含的中子数为4N A参考答案:C2. 下列反应的离子方程式正确的是A.氯气与水反应:B.在稀氨水中通入过量C.用氯化铁溶液腐蚀电路板:D.少量SO2通入Ca(CIO)2溶液中:参考答案:B3. 某强酸与强碱溶液等体积混合后,所得溶液的pH为7。
原酸溶液和原碱溶液的物质的量浓度的关系是()A.大于 B.小于 C.等于 D.不能确定参考答案:答案:D4. 下列化学用语表达正确的是A. N2的电子式:B. 的结构示意图:C. 次氯酸的结构式:D. NaHCO3的电离方程式:参考答案:C略5. 相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:2SO2(g)+O2(g)2SO3(g)ΔH = -197 kJ/mol。
实验测得起始、平衡时的有关数据如下表。
下列正确的是A.Q132B.达到平衡时,乙容器中SO2的体积分数最大C.平衡时,甲、乙、丙3个容器中甲的平衡常数最小D.若在上述条件下,反应生成1molSO3(s),则反应放热为98.5kJ 参考答案:A略6. 短周期元素W、X、Y、Z的原子序数依次增大,W 与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电了数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。
下列说法正确的是A. Y的最高价氧化物对成水化物的酸性比W的强B. W的气态氢化物比X的稳定C. 离子半径的大小顺序:r(w)>r(X)>r(Y)>(Z)D. XY2与ZY2中的化学键类型相同参考答案:C试题分析:短周期元素W、X、Y、Z 的原子序数依次增大,W的单质是空气中体积分数最大的气体,则W为N元素;Z最外层电子数等于最内层电子数,原子序数大于N元素,只能处于第三周期,故Z为Mg元素;X、Y、Z的简单离子的电子层结构相同,结构原子序数可知,X只能处于第二周期,且最外层电子数大于5,W(氮元素)与Y最外层电子数之和为X的最外层电子数的2倍,则Y 原子最外层电子数只能为奇数,结合原子序数可知,Y不可能处于ⅠA族,只能处于ⅦA族,故Y为F元素,X最外层电子数为=6,则X为O元素。
2020年浙江省绍兴市孙端中学高三化学测试题含解析

2020年浙江省绍兴市孙端中学高三化学测试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 设N A代表阿伏加德罗常数.下列说法正确的是()A.2.9 g 2CaSO4·H2O中含有的结晶水分子数为0.02N AB.30 g乙酸和葡萄糖的混和物中含碳原子数为N AC.在铁与硫的反应中,1 mol铁失去的电子数为3N AD.62 g Na2O溶于水后所得溶液中含有的O2-数为N A参考答案:B略2. 下列各组离子中,在所给条件下能够大量共存的是A.无色溶液中;Na+、MnO4-、SO42-、K+B.pH=14的溶液中:Fe3+、Mg2+、Cl-、SO42-C.加入(NH4)2Fe(SO4)26H2O晶体的溶液中:Na+、H+、Cl-、NO3-D.c(H+)=1×10-10 mol/L溶液中:K+、SO32-、Na+、S2-参考答案:D略3. 研究发现,空气中少量的NO2能作为催化剂参与硫酸型酸雨的形成,NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是A.硫化氢通入浓H2SO4中B.稀H2SO4和乙酸乙酯共热C.浓H2SO4和C2H5OH共热到170℃D.潮湿的氯气通过盛有浓H2SO4的洗气瓶参考答案:B略4. 研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为C16H28N2O4?H3PO4,分子结构如图.下列有关奥司他韦的说法中正确的是()A.含极性键,易溶于水,其水溶液有丁达尔效应B.分子中含有酯基、氨基、苯环等官能团C.1mol 该物质最多能与3molNaOH反应D.可以发生加成、取代、氧化反应、还原反应参考答案:D考点:有机物的结构和性质分析:有机物含有酯基、肽键、氨基等官能团,结合酯、氨基酸的性质解答该题.解答:解:A.含有酯基,为酯类化合物,难溶于水,故A错误;B.苯环不是官能团,故B错误;C.1mol该物质含有1mol肽键、1mol酯基还有1mol的磷酸分子,所以最多能与5molNaOH反应,故C 错误;D.分子中含有酯基、氨基、碳碳双键等官能团,可以发生加成、取代、氧化反应,与氢气的加成反应也为还原反应,故D正确.故选D.点评:本题考查有机物的结构和性质,题目难度不大,本题注意把握有机物官能团的种类和性质,根据官能团的性质判断有机物的性质,为解答该类题目的关键,注意相关概念的把握.5.(08广东理科基础卷)电池是人类生产和生活中重要的能量来源。
浙江省绍兴市2019-2020学年高考化学经典试题
2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.N A代表阿伏加德罗常数的值。
下列说法正确的是()A.常温常压下,124gP4中所含P—P键数目为4N AB.100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1N AC.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2N AD.密闭容器中,2molSO2和1molO2催化反应后分子总数为2N A2.纳米级TiO2具有独特的光催化性与紫外线屏蔽等功能、具有广阔的工业应用前景。
实验室用钛铁精矿(FeTiO3)提炼TiO2的流程如下。
下列说法错误的是()A.酸浸的化学方程式是:FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2OB.X稀释所得分散系含纳米级H2TiO3,可用于观察丁达尔效应C.②用水蒸气是为了促进水解,所得稀硫酸可循环使用D.①③反应中至少有一个是氧化还原反应3.下列有关电化学原理及应用的相关说法正确的是A.电池是能量高效转化装置,燃料电池放电时化学能全部转化为电能B.电热水器用牺牲阳极的阴极保护法阻止不锈钢内胆腐蚀,阳极选用铜棒C.工业上用电解法精炼铜过程中,阳极质量减少和阴极质量增加相同D.电解氧化法在铝制品表面形成氧化膜减缓腐蚀,铝件作为阳极4.等质量的铁屑和锌粒与足量的同浓度的稀硫酸反应,下列图象可能正确的是()A.B. C.D.5.工业生产水煤气的反应为:C(s) + H2O(g) → CO(g) + H2 (g) -131.4kJ ,下列表述正确的是()A.反应物能量总和大于生成物能量总和B .CO(g) + H2 (g) → C(s) + H2O(l) +131.4kJC .水煤气反应中生成 1 体积 CO(g) 吸收 131.4kJ 热量D .水煤气反应中生成 1mol H 2 (g) 吸收131.4kJ 热量6.N A 表示阿伏加德罗常数的值。
浙江省绍兴市高考理综-化学三模试卷

浙江省绍兴市高考理综-化学三模试卷姓名:________ 班级:________ 成绩:________一、单选题 (共7题;共14分)1. (2分) (2020高一下·余姚期中) 1997年,英国的“克隆羊”备受世界关注。
“克隆羊”的关键技术之一是找到了一些特殊的酶,这些酶激活普通体细胞使之像生殖细胞一样发育成个体,有关酶的说法中错误的是()A . 酶是具有催化作用的蛋白质B . 由题可知酶具有选择性和专一性C . 高温或重金属盐能降低酶的活性D . 酶只有在强酸、强碱条件下才能发挥作用2. (2分) (2016高二上·温州期中) 向含有a mol Na2CO3的溶液中通入b molHCl,下列说法不正确的是()A . 当b>2a时,发生的离子反应为:CO32﹣+2H+=H2O+CO2↑B . 当b<a时,发生的离子反应为:CO32﹣+H+=HCO3﹣C . 当4a=3b时,发生的离子反应为:3CO32﹣+4H+=2HCO3﹣+CO2↑+H2OD . 当a<b<2a时,反应生成的HCO3﹣与CO2的物质的量之比为(b﹣a):(2b﹣a)3. (2分) (2018高三上·临沂期中) 短周期元素X、Y、Z、W在周期表中的相对位置如图,X的氢化物能与其最高价氧化物对应的水化物反应生成盐。
下列判断正确的是()A . 最简单气态氢化物的稳定性:X<YB . 单核阴离子的还原性:W>ZC . 含Z元素的盐溶液可能显酸性、碱性或中性D . Y、Z、W的含氧酸的酸性依次增强4. (2分)(2020·天津模拟) 盆栽使用诱抗素可保证鲜花盛开,它的分子结构如图,下列关于该分子说法正确的是()A . 诱抗素不能发生缩聚反应B . 诱抗素能与发生加成反应C . 诱抗素中羟基不能被氧化为醛基D . 诱抗素属于芳香族化合物5. (2分) (2016高三上·襄阳期中) 化学与生活密切相关.下列有关说法不正确的是()A . 燃料的脱硫脱氮、NO的催化转化都是减少酸雨产生的措施B . 利用稀硝酸清除铜镜表面的铜锈是因为稀硝酸具有强氧化性C . BaSO4难溶于水和强酸,在医学上常用作钡餐D . 食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质6. (2分)化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是()A . 中和反应中,反应物的总能量比生成物的总能量低B . 图I所示的装置能将化学能转变为电能C . 化学反应中能量变化的主要原因是化学键的断裂与生成D . 图Ⅱ所示的反应为吸热反应7. (2分) (2016高二下·南阳期末) 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.下列反应中,水作氧化剂的是()A.SO3+H2O→H2SO4B.2K+2H2O→2KOH+H2↑C.2F2+2H2O → 4HF+O2D.2Na2O2+2H2O→ 4NaOH+O2↑2.下列有关物质性质与用途具有对应关系的是()A.Na2SiO3易溶于水,可用作木材防火剂B.NaHCO3能与碱反应,可用作食品疏松剂C.Fe粉具有还原性,可用作食品袋中的抗氧化剂D.石墨具有还原性,可用作干电池的正极材料3.在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)2C(g) ΔH=QkJ/mol。
相关条件和数据见下表:实验编号实验Ⅰ实验Ⅱ实验Ⅲ反应温度/℃700 700 750达平衡时间/min 40 5 30平衡时n(C)/mol 1.5 1.5 1化学平衡常数K1K2K3下列说法正确的是()A.K1=K2<K3B.升高温度能加快反应速率的原因是降低了反应的活化能C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动4.查阅资料可知,苯可被臭氧氧化,发生化学反应为:。
则邻甲基乙苯通过上述反应得到的有机产物最多有( )A.5种B.4种C.3种D.2种5.有机物M、N之间可发生如图转化.下列说法不正确的是A .M 能与溴水发生加成反应B .M 分子中所有碳原子共平面C .N 能使酸性高锰酸钾溶液褪色D .M 、N 均能发生水解反应和酯化反应6.在指定条件下,下列各组离子一定能大量共存的是A .滴加甲基橙试剂显红色的溶液中:23Na Fe Cl NO ++--、、、 B .滴入KSCN 显血红色的溶液中:32434NH Al NO SO ++--、、、C .-+c(OH )c(H )=1012的溶液中:43NH K Cl HCO ++--、、、 D .由水电离的c(H +)=1.0×l0-13 mol/L 溶液中:3243K Al SO CH COO ++--、、、7.甲、乙、丙、丁四种易溶于水的物质,分别由NH 4+、Ba 2+、Mg 2+、H +、OH ﹣、Cl ﹣、HCO 3-、SO 42-中的不同阳离子和阴离子各一种组成,已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成; ②0.1 mol·L -1乙溶液中c (H +)>0.1 mol·L -1;③向丙溶液中滴入AgNO 3溶液有不溶于稀HNO 3的白色沉淀生成。
下列结论不正确的是( ) A .甲溶液含有Ba 2+ B .乙溶液含有SO 42- C .丙溶液含有Cl ﹣D .丁溶液含有Mg 2+8.下列物质的工业生产过程中,其主要反应不涉及氧化还原反应的是( ) A .纯碱B .氨气C .烧碱D .盐酸9.2019年是门捷列夫提出元素周期表150周年。
根据元素周期律和元素周期表,下列推断不合理的是 A .位于第五周期第VIA 族的元素为金属元素 B .第32号元素的单质可作为半导体材料 C .第55号元素的单质与水反应非常剧烈D .第七周期ⅦA 族元素的原子序数为11710.室温下,将0.05molCH 3COONa 固体溶于水配成100mL 溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )加入的物质结论A 0.05molCH 3COONa 固体 减小B 0.05molNaHSO 4固体 c (CH 3COO ﹣)+c (CH 3COOH )=c (Na +)﹣c (SO 42﹣) C0.05molNH 4Cl 固体水电离程度增大D 50mLH2O 由水电离出的c(H+)·c(OH﹣)减小A.A B.B C.C D.D11.下列化学用语或图示表达正确的是IA.乙烯的比例模型:B.质子数为53,中子数为78的碘原子:7853C.氯离子的结构示意图:D.CO2的电子式:12.以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是A.四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应B.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品C.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作13.用下列装置进行实验能达到相应实验目的的是A.装置配制100 mL某浓度NaNO3溶液B.分离溴苯和水混合物C.验证质量守恒定律D.可以实现防止铁钉生锈14.某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol/ L NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。
下列说法不正确的是( ) A.NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度C.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)D.加入CaCl2促进了HCO3-的水解15.一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)2NO (g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。
叙述正确的是()A.温度T℃时,该反应的平衡常数K=201214(c-c)cB.温度T℃时,混合气体的密度不变即达到平衡状态C.曲线b对应的条件改变可能是加入了催化剂D.若曲线b改变的条件是温度,则该正反应放热二、实验题(本题包括1个小题,共10分)16.碘酸钙[Ca(IO3)2]是重要的食品添加剂。
实验室制取Ca(IO3)2·H2O的实验流程:已知:碘酸是易溶于水的强酸,不溶于有机溶剂。
(1)转化步骤是为了制得碘酸,该过程在图1所示的装置中进行,当观察到反应液中紫红色接近褪去时,停止通入氯气。
①转化时发生反应的离子方程式为_____________________________________。
②转化过程中CCl4的作用是_______________________________________。
③为增大转化过程的反应速率,可采取的措施是_______________________。
______________________________,直至用淀粉溶液检验不出碘单质的存在。
(3)已知:①Ca(IO 3)2·6H 2O 是一种难溶于水的白色固体,在碱性条件下不稳定。
②Ca(IO 3)2·6H 2O 加热升温过程中固体的质量变化如图2所示。
设计以除碘后的水层为原料,制取Ca(IO 3)2·H 2O 的实验方案:向水层中__________。
[实验中必须使用的试剂:Ca(OH)2粉末、AgNO 3溶液]。
三、推断题(本题包括1个小题,共10分)17.美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:已知:()Zn Hg /HCl32322CH COCH R CH CH CH R −−−−→ 回答下列问题:(1)A→B 的反应类型是______________,B 中官能团的名称为______________。
(2)D→E 第一步的离子方程式为_________。
(3)E→F 的条件为______________,请写出一种该过程生成的副产物的结构简式_________。
(已知在此条件下,酚羟基不能与醇发生反应)。
(4)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。
写出G 的结构简式,并用星号(*)标出G 中的手性碳______________。
(5)芳香族化合物I 是B 的同分异构体,I 能与银氨溶液作用产生银镜,且在苯环上连有两个取代基,则I 同分异构体的数目为_________种。
(6)(J)是一种药物中间体,参照上述合成路线,请设计以甲苯和苯酚为原料制备J 的合成路线____________________(无机试剂任选)。
四、综合题(本题包括2个小题,共20分)18.氨氮(水中以NH3和NH4+形式存在的氮)含量是环境水体污染的一项重要指标,其氧化过程会造成水体中溶解氧浓度降低,导致水质下降,影响水生动植物的生长。
(1)水中NH3和NH4+两者的浓度比取决于水体的pH和水温。
当pH偏高时,___比例较高,原因是___(请用离子方程式表示)。
(2)空气吹脱法是目前消除NH3对水体污染的重要方法。
在一定条件下,向水体中加入适量NaOH充分反应后,再向水中通入空气,可增大NH3的脱除率,用平衡移动原理解释其原因:___。
(3)在微生物作用下,蛋白质在水中分解产生的NH3能够被O2氧化生成亚硝酸(HNO2)。
___NH3+__O2→__HNO2+__________①请将上述化学方程式补充完整,并配平。
②反应中氧化剂与还原剂的物质的量之比为___。
③若反应中有0.6mol电子发生转移,生成亚硝酸的质量为___。
(4)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示。
DO 的测定原理如下:①2Mn2++O2+4OH-→2MnO(OH)2↓②MnO(OH)2+2I-+4H+→Mn2++I2+3H2O③2S2O32-+I2→S4O62-+2I-某小组同学取100.00mL水样经反应①和②后,取出20.00mL溶液,以淀粉作指示剂,用amol/LNa2S2O3溶液进行滴定,终点现象为___;滴定消耗Na2S2O3溶液bmL,水样的DO=____mg/L。
19.(6分)钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
