寿县一中选修4第三章测试卷审核版
人教A版数学必修4第三章测试题(二).doc

高中数学学习材料唐玲出品云南省昭通市实验中学必修4第三章测试题(二)一、选择题:本大题共12小题,每小题5分,共60分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.054cos 24sin 36cos 24cos -的值为( )A .0B .21 C .23 D .21-2.若21cos -=α,23sin -=β,),2(ππα∈,)2,23(ππβ∈,则)sin(βα+的值等于( )A .23B .23-C .1-D .03.)63cos()33cos()27cos()33sin(0--++-x x x x 等于( )A .21 B .23-C .21-D .23 4.ααcos 23sin 21+等于( ) A .)3sin(πα+B .)3sin(πα-C .)6sin(πα+D .)6sin(πα-5.若2tan =α,3)tan(=-αβ,则)2tan(αβ-的值等于( ) A .51-B .1-C .75 D .71 6.函数x x x f cos sin )(=的最小值是( ) A .1- B .21-C .21D .17.函数1)4(cos 22--=πx y 是( )A .最小正周期为π的奇函数B .最小正周期为π的偶函数C .最小正周期为2π的奇函数 D .最小正周期为2π的偶函数 8.()()()()oooo24tan 123tan 122tan 121tan 1++++ 的值是( )A.16B.8C.4D.29.已知α是第四象限角,且257cos =α,则2tan α的值为 ( ) A .34 B .43 C .34- D . 43-10.若θθcos sin 3=,则θθ2sin 2cos +的值等于( )A .57B .57- C .53 D .53-11.若)20(62)4cos()4cos(πθπθθπ<<=-+,则θ2sin 等于( ) A .32B .37 C .67 D .7271 12.函数x x x f cos 3sin )(-=()0<≤-x π的单调递增区间是( )A .]65,[ππ-- B . ]6,65[ππ--C .]0,3[π- D .]0,6[π-二、填空题:本大题共4小题,每小题5分,共20分。
人教版高中化学选修四单元测试题全套带答案解析1.doc

最新人教版高中化学选修四单元测试题全套带答案解析1第一章测评B(高考体验卷)(吋间:45分钟满分:100分)一、选择题(每小题5分,共60分)1.(XXXX海南化学)标准状态下,气态分子断开1 mol化学键的熔变称为键焰。
己知11一1【、11-0和0=0键的键焙分别为436 kj・mol \ 463 kJ ・nio「和495 kJ • mol ^下列热化学方程式正确的是( )A.出0 (g) =H2 (g) +O2 (g) A 洋—485 kJ ・ mo f1B.H.2O (g):=H>(g) +02 (g) A 川+485 kJ ・ mol-1C.2氏(g) +02 (g);=211,0 (g) A /A+485 kJ ・D.2Ib (g) +O2 (g) =2IL0 (g) △ /A-485 kJ ・ mol-1解析:化学反应的焙变等于反应物总键焰与生成物总键焙的差,市此可确定D项正确。
答案:D2.(XXXX 重庆理综)已知:C (s) +比0 (g):= 0 (g) +出(g) △洋白kJ ・ mol'12C (s) +O2 (g) =2C0 (g) A /A-220 kJ ・ mol-'II—H、0=0和0TI键的键能分别为436、496和462 kJ・mo「,则日为( )A.-332B.-118 0. +350 D.+130解析:C(s)+H20(g)=CO(g)+H2(g) △辰kJ- moK'd)2C (s) +O2 (g) =2C0 (g) A /A-220 kJ ・ mol-1 (2)(1)X2- (2)得2H20 (g) =O2 (g) +2出(g)A 洋+ (2卅220) kJ・moL由键能数值计算得2H2O(g) =02(g)+2H2(g)中A 洋4X462 kJ • mo I-1-(496 kJ • mo「+2X436 kJ ・ mol_1) =+480 kJ ・ mol-1,即:2^+220=480,解得沪+130。
化学选修四第三章测试题.docx

华师大来凤附中 · 来凤县第一中学八月考化学试题一、单项选择题 ( 本题包括 18 小题,每小题 3 分,共 54 分。
每小题只有一个选项符合题目要求。
) 1、水是一种极弱的电解质,在室温下平均每 n 个水分子中只有 1 个水分子发生电离,则n 值是A. 1 ×10 -14B . ×10 8C. 1 ×10 7D.2、用 pH 试纸检验溶液的 pH 时,正确的操作是A. 把试纸一端浸入溶液,观察颜色变化B. 把试纸丢入溶液,观察颜色变化C. 把试纸一端在溶液中浸一下,取出后观察颜色变化,并与标准比色卡对照。
D. 用洁净玻璃棒蘸取待测溶液,点在pH 试纸中部,颜色变化后,马上与标准比色卡比照,读出pH 值3、在一支 25 mL 的酸式滴定管中盛入 mol/L HCl 溶液,其液面恰好在 5 mL 的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以 mol/L NaOH 溶液进行中和,则所需 NaOH 溶液的体积为A. 大于 20 mLB. 小于 20 mLC.等于 20 mLD.等于 5 mL4、 NH 4Cl 溶液的 pH 和稀 HCl 的 pH 值均为 5,其中由水电离出的c (H +) 分别为 a mol/L 和 b mol/L ,则 a 与b 的关系正确的是 A. a =b B.a < bC.a >b D.不能确定5、证明氨水是弱碱的事实是A. 氨水与硫酸发生中和反应B.氨水能使紫色石蕊液变蓝C. mol/L 的 NHCl 溶液的 pH 值为D.铵盐与熟石灰反应逸出氨气46 、 已 知 某 温 度 下 , K a (HCN)= ×10 -10 mol/L 、 K a (HF)= ×10-4 mol/L 、 K a (CH 3COOH)= ×10 -5 mol/L 、a (HNO)= ×10 -6mol/L 。
【精品习题】高中人教A版数学必修4:第三章 章末检测 Word版含解析

第三章章末检测班级____ 姓名____ 考号____ 分数____ 本试卷满分150分,考试时间120分钟.一、选择题:本大题共12题,每题5分,共60分.在下列各题的四个选项中,只有一个选项是符合题目要求的.1.sin68°sin67°-sin23°cos68°的值为( )A .-22 B.22C.32D .1 答案:B 解析:原式=sin68°cos23°-cos68°sin23°=sin(68°-23°)=sin45°=22. 2.已知sin α=23,则cos(π-2α)等于( )A .-53 B .-19C.19D.53 答案:B解析:cos(π-2α)=-cos2α=-(1-2sin 2α)=2sin 2α-1=2×49-1=-19.3.已知M =⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪⎪sin x =12,N =⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪⎪cos2x =12,则( ) A .M =N B .M ⊆NC .N ⊆MD .M ∩N =∅ 答案:B解析:由cos2x =1-2sin 2x =12,得sin x =±12,故选B.4.已知sin θ2=-45,cos θ2=35,则角θ终边所在象限是( )A .第一象限B .第二象限C .第三象限D .第四象限 答案:C解析:∵sin θ=2sin θ2cos θ2=-2425<0,cos θ=cos 2θ2-sin 2θ2=-725<0,∴θ终边在第三象限.5.函数f (x )=lg (sin 2x -cos 2x )的定义域是( ) A.⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪⎪2k π-3π4<x <2k π+π4,k ∈ZB.⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪⎪2k π+π4<x <2k π+5π4,k ∈ZC.⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪⎪ k π-π4<x <k π+π4,k ∈ZD.⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫x ⎪⎪⎪k π+π4<x <k π+3π4,k ∈Z答案:D解析:∵f (x )=lg (sin 2x -cos 2x )=lg (-cos2x ),∴-cos2x >0,∴cos2x <0,∴2k π+π2<2x <2k π+3π2,k ∈Z ,∴k π+π4<x <k π+3π4,k ∈Z .6.若函数f (x )=sin ax +cos ax (a >0)的最小正周期为1,则它的图象的一个对称中心为( )A.⎝ ⎛⎭⎪⎫-π8,0 B .(0,0) C.⎝ ⎛⎭⎪⎫-18,0 D.⎝ ⎛⎭⎪⎫18,0 答案:C解析:由条件得f (x )=2sin ⎝⎛⎭⎪⎫ax +π4,又函数的最小正周期为1,故2πa =1,∴a =2π,故f (x )=2sin ⎝⎛⎭⎪⎫2πx +π4.将x =-18代入得函数值为0. 7.tan20°+tan40°+3(tan20°+tan40°)等于( )A.33 B .1 C. 3 D. 6 答案:C解析:tan60°=tan20°+tan40°1-tan20°·tan40°,∴3-3tan20°tan40°=tan20°+tan40°, ∴tan20°+tan40°+3tan20°tan40°= 3.8.关于x 的方程sin x +3cos x -a =0有实数解,则实数a 的范围是( ) A .[-2,2] B .(-2,2) C .(-2,0) D .(0,2) 答案:A解析:sin x +3cos x -a =0,∴a =sin x +3cos x=2⎝ ⎛⎭⎪⎫12sin x +32cos x =2sin ⎝ ⎛⎭⎪⎫x +π3,-1≤sin ⎝ ⎛⎭⎪⎫x +π3≤1,∴-2≤a ≤2.9.若α,β为锐角,sin α=2 55,sin(α+β)=35,则cos β等于( )A.2 55B.2 525C.2 55或2 525 D .-2 525 答案:B解析:cos β=cos[(α+β)-α]=cos(α+β)cos α+sin(α+β)sin α,∵α为锐角cos α= 1-2025=55,∴sin(α+β)=35<sin α,∴α+β>π2.∴cos(α+β)=-1-925=-45, ∴cos β=-45×55+2 55×35=2 525.10.函数y =sin x 2+3cos x2的图象的一条对称轴方程为( )A .x =113πB .x =53πC .x =-53πD .x =-π3答案:C解析:y =sin x 2+3cos x 2=2sin ⎝ ⎛⎭⎪⎫x 2+π3, 又f ⎝ ⎛⎭⎪⎫-53π=2sin ⎝ ⎛⎭⎪⎫-56π+π3=2sin ⎝ ⎛⎭⎪⎫-π2=-2, ∴x =-53π为函数的一条对称轴.11.已知θ为第三象限角,若sin 4θ+cos 4θ=59,则sin2θ等于( )A.2 23 B .-2 23 C.23 D .-23 答案:A 解析:由sin 4θ+cos 4θ=(sin 2θ+cos 2θ)2-2sin 2θcos 2θ=59,知sin 2θcos 2θ=29,又θ为第三象限角,∴sin θ·cos θ=23,sin2θ=2 23.12.设动直线x =a 与函数f (x )=2sin 2⎝ ⎛⎭⎪⎫π4+x 和g (x )=3cos2x 的图象分别交于M ,N两点,则|MN |的最大值为( )A. 2B. 3 C .2 D .3 答案:D解析:f (x )=1-cos ⎝ ⎛⎭⎪⎫π2+2x =1+sin2x . |MN |=|f (a )-g (a )|=|1+sin2a -3cos2a |=|2sin ⎝⎛⎭⎪⎫2a -π3+1|≤3. 二、填空题:本大题共4小题,每小题5分,共20分.把答案填在题中横线上.13.cos π5cos 25π的值是________.答案:14解析:原式=12sin π5·2sin π5cos π5·cos 2π5=14sin π5·2sin 2π5cos 25π=14sinπ5sin 45π=14.14.已知sin α=12+cos α,且α∈⎝ ⎛⎭⎪⎫0,π2,则cos2αsin ⎝⎛⎭⎪⎫α-π4的值为________. 答案:-142解析:∵sin 2α+cos 2α=1,sin α=12+cos α,∴⎝ ⎛⎭⎪⎫12+cos α2+cos 2α=1,∴2cos 2α+cos α-34=0,∴cos α=-1±74,∵α∈⎝⎛⎭⎪⎫0,π2,∴cos α>0,∴cos α=7-14,∴sin α=12+cos α=7+14, ∴cos2αsin ⎝ ⎛⎭⎪⎫α-π4=cos 2α-sin 2α22sin α-cos α=-2(sin α+cos α)=-2⎝ ⎛⎭⎪⎫7+14+7-14=-142.15.已知cos α=13,cos(α+β)=-13,且α,β∈⎝⎛⎭⎪⎫0,π2,则cos(α-β)的值为________.答案:2327解析:∵cos α=13,α∈⎝⎛⎭⎪⎫0,π2,∴sin α=2 23,∴sin2α=4 29,cos2α=-79.又cos(α+β)=-13,α+β∈(0,π),∴sin(α+β)=2 23.∴cos(α-β)=cos[2α-(α+β)]=cos2αcos(α+β)+sin2αsin(α+β) =⎝ ⎛⎭⎪⎫-79×⎝ ⎛⎭⎪⎫-13+4 29×2 23=2327. 16.函数f (x )=3cos(3x -θ)-sin(3x -θ)是奇函数,则tan θ等于________.答案:- 3解析:∵f (x )是奇函数,∴f (0)=0,∴3cos(-θ)-sin(-θ)=0,∴3cos θ+sin θ=0,∴tan θ=- 3.三、解答题:本大题共6小题,共70分.解答应写出文字说明、证明过程或演算步骤.17.(10分)已知sin α+cos αsin α-cos α=3,tan(α-β)=2,求tan(β-2α)的值.解:∵sin α+cos αsin α-cos α=tan α+1tan α-1=3,∴tan α=2,∵tan(α-β)=2,∴tan(β-α)=-2,∴tan(β-2α)=tan[(β-α)-α]=tan β-αtan α1+tan β-αtan α=-2-2122=43.18.(12分)已知向量a =(cos α,sin α),b =(cos β,sin β),|a -b |=2 55,求cos(α-β)的值.解:∵a =(cos α,sin α),b =(cos β,sin β), ∴a -b =(cos α-cos β,sin α-sin β),∴|a -b |=cos α-cos β2sin α-sin β2=2-2cos α-β=2 55,∴cos(α-β)=35.19.(12分)已知函数f (x )=-2 3sin 2x +sin2x + 3.(1)求函数f (x )的最小正周期和最小值;(2)在给出的直角坐标系中,画出函数y =f (x )在区间[0,π]上的图象.解:(1)f (x )=3(1-2sin 2x )+sin2x=sin2x +3cos2x =2sin ⎝ ⎛⎭⎪⎫2x +π3, 所以f (x )的最小正周期T =2π2=π,最小值为-2.(2)列表:20.(12分)已知向量a =(sin θ,-2)与b =(1,cos θ)互相垂直,其中θ∈⎝⎛⎭⎪⎫0,π2.(1)求sin θ和cos θ的值;(2)若sin(θ-φ)=1010,0<φ<π2,求cos φ的值.解:(1)∵a ⊥b ,∴sin θ×1+(-2)×cos θ=0⇒sin θ=2cos θ.∵sin 2θ+cos 2θ=1,∴4cos 2θ+cos 2θ=1⇒cos 2θ=15.∵θ∈⎝ ⎛⎭⎪⎫0,π2,∴cos θ=55,sin θ=2 55.(2)解法一:由sin(θ-φ)=1010得, sin θcos φ-cos θsin φ=1010⇒sin φ=2cos φ-22, ∴sin 2φ+cos 2φ=5cos 2φ-2 2cos φ+12=1⇒5cos 2φ-2 2cos φ-12=0.解得cos φ=22或cos φ=-210, ∵0<φ<π2,∴cos φ=22.解法二:∵0<θ,φ<π2,∴-π2<θ-φ<π2.所以cos(θ-φ)=1-sin2θ-φ=31010. 故cos φ=cos[(θ-(θ-φ)]=cos θcos(θ-φ)+sin θsin(θ-φ)=55×3 1010+2 55×1010=22. 21.(12分)已知函数f (x )=2sin x +2cos(x -π). (1)求函数f (x )的最小正周期和值域;(2)若函数f (x )的图象过点⎝ ⎛⎭⎪⎫α,65,π4<α<3π4,求f ⎝ ⎛⎭⎪⎫π4+α的值. 解:(1)由题意得,f (x )=2sin x +2cos(x -π)=2sin x -2cos x =2sin ⎝⎛⎭⎪⎫x -π4,因为-1≤sin ⎝⎛⎭⎪⎫x -π4≤1,所以函数f (x )的值域为[-2,2],函数f (x )的周期为2π.(2)因为函数f (x )过点⎝⎛⎭⎪⎫α,65, 所以f (α)=65⇒2sin ⎝⎛⎭⎪⎫α-π4=65⇒ sin ⎝⎛⎭⎪⎫α-π4=35,因为π4<α<3π4, 所以0<α-π4<π2⇒cos ⎝ ⎛⎭⎪⎫α-π4>0⇒cos ⎝⎛⎭⎪⎫α-π4=1-sin 2⎝⎛⎭⎪⎫α-π4=45,所以f ⎝ ⎛⎭⎪⎫π4+α=2sin α=2sin ⎣⎢⎡⎦⎥⎤⎝⎛⎭⎪⎫α-π4+π4 =2sin ⎝ ⎛⎭⎪⎫α-π4cos π4+2cos ⎝ ⎛⎭⎪⎫α-π4sin π4⇒f ⎝ ⎛⎭⎪⎫π4+α=725.22.(12分)在△ABC 中,f (B )=4cos B ·sin 2⎝ ⎛⎭⎪⎫π4+B 2+3cos2B -2cos B .(1)若f (B )=2,求角B ;(2)若f (B )-m >2恒成立,求实数m 的取值范围.解:(1)f (B )=4cos B ·1-cos ⎝ ⎛⎭⎪⎫π2+B 2+3cos2B -2cos B =2cos B (1+sin B )+3cos2B-2cos B=sin2B +3cos2B =2sin ⎝ ⎛⎭⎪⎫2B +π3. ∵f (B )=2,∴2sin ⎝⎛⎭⎪⎫2B +π3=2. ∵B 是△ABC 的内角,∴2B +π3=π2,则B =π12.(2)若f (B )-m >2恒成立,即2sin ⎝⎛⎭⎪⎫2B +π3>2+m 恒成立. ∵0<B <π,∴π3<2B +π3<73π,∴2sin ⎝⎛⎭⎪⎫2B +π3∈[-2,2], ∴2+m <-2,即m <-4.。
选修4第三章测试题

高中化学选修4第三章测试题一、选择题:〔此题包括16小题,共48分〕2 3溶液中,假设使c3 2- ) 更接近0.1mol/L ,可采取的措施是〔〕1.0.1mol/LKCO (COA .参加少量盐酸B .加KOH 固体C .加水D .加热2.要使K2溶液中+ ] /2- ] 的比值变小,可参加的物质是 〔〕S [K [SA .适量盐酸B .适量NaOH 溶液C .适量KOH 溶液D .适量KHS 溶液 3.同温下,在Ca(OH)2〔K sp ×10-6〕、Mg(OH)2〔K sp ×10-11〕、AgCl〔K sp ×10-10〕三种物质中,以下说法正确的选项是 〔 〕A .Mg(OH)2的溶解度最小B .Ca(OH)2的溶解度最小C 2的溶解度比Ca(OH)2的溶解度小D .Ksp 越大的溶解度也越大4.能影响水的电离平衡,最终使水电离的离子在溶液中表现为-+)c(OH)<c(H的操作是〔 〕A .向水中投入一小块金属钠B .将水加热煮沸C .向水中通入二氧化碳气体D .向水中加醋酸钠晶体5.温度T 时水的离子积常数为K w ,该温度下,将浓度为amol ·L -1的一元酸HA 与bmol ·L -1的一元碱BOH 等体积混合。
可判定该溶液呈中性的依据是〔 〕A .a =bB.混合溶液的pH =7C .混合溶液中,c 〔H +〕=mol·L-1+ +- - D .混合溶液中,c 〔H〕+c 〔B 〕=c 〔OH 〕+c 〔A 〕6.将足量的BaCO3粉末分别参加以下溶液中,充分溶解至溶液饱和。
各溶液中Ba 2+的浓度最小的为〔〕A .10mL0.2mol/LNa2CO 溶液B.40mL 水3C .50mL0.01mol/L 氯化钡溶液D .100mL0.01mol/L盐酸7.在室温下,等体积的酸和碱的溶液混合后,pH 一定小于7的是〔〕A.pH=3的HNO3跟pH=11的KOH B.pH=3的盐酸跟pH=11的氨水C.pH=3硫酸跟pH=11的NaOH D.pH=3的醋酸跟pH=11的Ba(OH)2 8.以下各组离子能大量共存且溶液颜色为无色的是〔〕+-+-2-B+3+2---A.Na、MnO、K、NO、SO.Na、Al、CO、OH、NO43333 +2--+--D2+++2+-C.Na、S、OH、K、Cl、NO.Fe、H、Na、Ca、NO339.常温下,体积相同、pH也相同的HCl、HNO3、CH3COOH溶液分别与足量的NaHCO3溶液反响,产生CO2的体积〔〕A.同样多B.HCl最多C.HCl、HNO3一样多D.CH3COOH最少10.常温下·L-1某一元酸(HA)溶液中(H+)=10-3,相同物质的量浓度的某一元碱(BOH)溶液中c(OH-)=10-1,以下表达正确的选项是〔〕A.HA的pH=3;BOH的pH=13B.pH=a的HA溶液,稀释10倍,其pH=a+1 C.等体积的HA和BOH恰好完全反响,溶液的pH=7D.相同体积相同pH的HA和盐酸分别与足量Zn反响,生成氢气的物质的量相同Na2S溶液中各种离子的物质的量浓度关系不正确的选项是()A、c(Na+)>c(S2-)>c(OH-)>c(HS-)B、c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)C、c(Na+)=2c(HS-)+2c(S2-)+2c(H2S)D、c(OH-)=c(H+)+c(HS-)-112.在mol·L的NaHCO3溶液中,以下关系式正确的选项是( )A、c(Na+)>c(HCO3-)>c(H+)>c(OH-)B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)C、c(Na+)=c(HCO3-)>c(OH-)>c(H+)D、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)13.常温下,以下有关溶液的表达正确的选项是〔〕-+ A.将pH=1的醋酸和pH=13的NaOH溶液混合后,假设c(CH3COO)=c(Na),那么溶液显中性B.在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-)C.pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为-8-11×10 mol·L+2--D.在饱和Na2CO3溶液中:2c(Na)=c(CO3)+c(HCO3)+c(H2CO3)14.以下表达正确的选项是〔〕A.将/L的HI 溶液加水稀释l0倍,溶液中所有离子的浓度随之减小B.在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7-1-1-〕之比为1︰2 C.0.1mol·L与0.2mol·L氨水溶液中C〔OHD.25℃时,某溶液中由水电离出的c(H+)=10-a mol/L,假设a>7时,该溶液pH 一定为14-a15某酸的酸式盐NaHY的水溶液的pH=8,那么以下说法中正确的选项是〔)A、在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同B、NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+)-的水解离子方程式为:--+C、HY HY+H2O Y+H3OD、相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者16.以下关于溶液中离子的说法不正确的是〔〕...-1的Na2CO3溶液中粒子浓度关系:A.mol·Lc(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)B.常温下氢氧化钠溶液中滴入醋酸使溶液的pH=7,那么混合溶液中醋酸已过量-1-132C.mol·L的HCl和mol·L的NH·HO等体积混合后溶液中的离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-)-1的NaHS溶液中离子浓度关系:D.mol·Lc(S2--+)+c(OH)=c(H)+c(HS)2二、非选择题:〔共52分〕17.常温下在Na2CO3溶液中逐滴参加HCl 溶液40mL,溶液中含碳元素的各种微粒〔CO2因逸出未画出〕物质的量分数〔纵轴〕随溶液...................pH变化的局部情况如以下图所示。
化学选修4三单元检测试卷.doc

第1页 共18页 ◎ 第2页 共18页绝密★启用前 选修4三单元13 **测试试卷 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上 第I 卷(选择题) 请修改第I 卷的文字说明 一、单项选择 1. 下列技术手段或仪器在化学研究中的应用的说法中不正确的是( ) A .用电子天平可直接称出某个分子或原子的质量 B .用pH 计测定溶液的pH 值 C .用移液管量取25.00 mL 溶液 D .用量热计测定某些化学反应中的热效应 2. 水溶液中下列电离方程式书写正确的是() A .Ca(OH)2ƒCa 2++2OH - B .NaHCO 3===Na ++H ++CO 32— C .H 2CO 3ƒ2H ++CO 32— D .Na 2SO 4===2Na ++SO 42— 3. 下列说法正确的是() A .HCO 3—在水溶液中只电离,不水解 B .硝酸钠溶液水解之后呈中性 C .可溶性的铝盐都能发生水解反应 D .可溶性的钾盐都不发生水解反应4. 常温下,某溶液中由水电离出来的c (H +)=1.0×10-13mol ·L -1,该溶液可能是( ) ①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液 A .①④ B .①② C .②③ D .③④5. 下列各项的说法正确的是( ) A .Na 2SiO 3溶液加热、蒸干、灼烧后所得固体的成分是SiO 2 B .配制FeCl 3溶液时,将FeCl 3固体溶解在硫酸中,然后再用水稀释到所需的浓度 C .AgI 沉淀可以转化为AgCl 沉淀 D .为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH 计测定一次锥形瓶中溶液的pH6. 要求设计实验证明:某种盐的水解是吸热的。
有四位同学作了如下回答,其中不正确的是( ) A .甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 B .乙同学:用加热的方法可除去KNO 3溶液中混有的Fe 3+,说明含有Fe 3+的盐的水解是吸热的 C .丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好 D .丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠的水解是吸热的7. 用水稀释0.1mol· L -1的醋酸溶液,下列说法正确的是( ) A .醋酸的电离程度逐渐增大,溶液的PH 值减小 B .K w 逐渐减小 C .水的电离程度增大第3页 共18页 ◎ 第4页 共18页 …………○…………外…………○…………装…………○…………订…………○…………线…………○………… ※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※ …………○…………内…………○…………装…………○…………订…………○…………线…………○………… D .变大 8. 用已知浓度的盐酸测定未知浓度的NaOH 溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)( ) A .酸式滴定管未用标准盐酸润洗B .滴定过程中不慎有液体溅出C .滴定前仰视读数,滴定后读数正确D .碱式滴定管未用待测液润洗9. 在下列各微粒中,能使水的电离平衡向电离的方向移动,且使溶液的pH<7的是( )A. B .HCO 3- C .HSO 4- D.10. 用标准盐酸滴定未知浓度的氢氧化钠溶液,下列操作导致结果偏低的是()①锥形瓶用蒸馏水洗浄后,再用待测液润洗2~3次②滴定前滴定管尖嘴有气泡,滴定后气泡消失③滴定前仰视读数,滴定后平视读数④摇动锥形瓶时,有少量液体溅出⑤滴定时,锥形瓶里加入少量蒸馏水稀释溶液A .只有③B .④⑤C .①②③D .③④11. 在等体积的以下溶液中加入等量的氢氧化钙粉末,最有可能溶解不完全的是( )A .饱和食盐水B .0.1 mol/L 的盐酸C .0.1 mol/L 的CaCl 2溶液D .0.1 mol/L 的氢氧化钠溶液12. 下列说法正确的是A .强电解质溶液的导电能力一定比弱电解质溶液的导电能力强B .因为CH 3COOH 是弱电解质,HCl 是强电解质,所以中和等体积等物质第5页 共18页 ◎ 第6页 共18页 …………○…………外…………○…………装…………○…………订…………○…………线…………○………… 学校:___________姓名:___________班级:___________考号:___________ …………○…………内…………○…………装…………○…………订…………○…………线…………○………… 的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH 比盐酸消耗的NaOH 用量少 C .足量Zn 分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H 2的量相同,放出H 2的速率不等 D .物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO 43-的物质的量浓度相同 13. 对于相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的倍和倍,若稀释后两溶液的仍相同,则和的关系是( ) A .= B .< C .> D .不能确定 14. 下列叙述正确的是( ) A .95 ℃纯水的pH <7,说明加热可导致水呈酸性 B .pH = 3的醋酸溶液,稀释10倍后pH = 4 C .0.2 mol·L -1的盐酸,与等体积水混合后pH = 1 D .25℃与60℃时,水的pH 相等 15. 实验室中,通常以草酸钠(Na 2C 2O 4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为: C 2O 42—+MnO 4—+H +——Mn 2++CO 2↑+H 2O (未配平) 下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是 ( ) A .滴定过程中,高锰酸钾被氧化,草酸钠被还原 B .温度需超过100°C ,草酸钠与高锰酸钾才会反应 C .该反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2 D .为便于滴定终点的判断,滴定时必须往体系中加入指示剂 16. 下列叙述正确的是( ) A .室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体 B .氢氧化铁胶体是纯净物 C .强电解质在水中溶解度一定大于弱电解质 D .相同温度下,把水面上的空气换成相同压力的纯氧,100 g 水中溶入氧气的质量增加 17. 在下列给定条件的溶液中,一定能大量共存的离子组是() A .无色溶液:Ca 2+、H +、Cl -、HSO 3— B .能使pH 试纸呈红色的溶液:Na +、NH 4+、I -、NO 3— C .FeCl 2溶液:K +、Na +、SO 42—、AlO 2—D. ()Kw c H =0.1mol/L 的溶液:Na +、K +、SiO 32—、NO 3— 18. 设N A 是阿伏加德罗常数的数值,下列说法中正确的是( ) A .1mol Al 3+离子含有的核外电子数为3N A B .1mol Cl 2与足量的铁反应,转移的电子数为3N A C .10L pH =1的硫酸溶液中含有的H +离子数为2N A D .10L pH =13的NaOH 溶液中含有的OH -离子数为N A 19. 下列实验操作或对实验事实的叙述正确的是( ) ① 用稀盐酸洗涤盛放过石灰水的试剂瓶 ② 配制浓硫酸和浓硝酸的混合酸时,将浓硝酸沿器壁慢慢加入到浓硫酸中,并不断搅拌; ③ 用pH 试纸测得氯水的pH 为2; ④ 用稀硝酸清洗做过银镜反应实验的试管; ⑤ 浓硝酸保存在棕色细口瓶中; ⑥某溶液加入NaOH 并加热能产生使湿润红色石蕊试纸变蓝的气体,则原溶液中含NH 4+ A .①④⑤⑥ B.③④⑤ C.①②⑥ D.②③⑤⑥ 20. 将标准状况下2.24LCO 2缓慢通入100mL1.5mol·L -1NaOH 溶液中(溶液体积变化忽略不计),充分反应后,下列关系正确的是( ) A . c (2-3CO )>c (-3HCO ) B . c (-3HCO )+c (2-3CO )=1 mol·L -1第7页 共18页 ◎ 第8页 共18页 …………○…………外…………○…………装…………○…………订…………○…………线…………○…………※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※ …………○…………内…………○…………装…………○…………订…………○…………线…………○………… C .c (+H )>c (-OH ) D .c (+Na )+c (+H )=c (-3HCO )+2c (2-3CO )+c (-OH ) 21. 已知Ag 2SO 4的K W 为2.0×10-3,将适量Ag 2SO 4固体溶于100 mL 水中至刚好饱和,该过程中Ag +和SO 32—浓度随时间变化关系如右图〔饱和Ag 2SO 4溶液中c (Ag +)=0.034 mol ·L -1〕。
(完整word版)高中化学选修4第三章测试题.doc

高中化学选修 4 第三章测试题一、选择题:16 小题,共 48 分)(本题包括1.水是一种极弱的电解质,在室温下,平均每n 个水分子中只有 1 个水分子发生了电离,则n 的值是()A .1× 10-14 B . 55.6× 107 C. 107 D. 55.62.下列溶液一定是碱性的是() A . pH= 8 的某电解质的溶液B. c(OH -)>1× 10-7mol/L C.溶液中含有OH - D .溶液中 c(OH -)> c(H +)3.已知某温度下,四种一元弱酸的电离平衡常数为:K a(HCN) = 6.2× 10-10 mol/L 、 K a (HF) = 6.8× 10-4 mol/L 、 K a(CH 3COOH) = 1.8× 10-5 mol/L 、 K a (HNO 2)=6.4× 10-6 mol/L 。
物质的量浓度都为0.1 mol/L 的下列溶液中, pH 最小的是()A .HCN B .CH 3COOH C.HF D.HNO 2 4. 0.1 mol/L K 2 CO3溶液中,若使c(CO32- )更接近0.1 mol/L ,可采取的措施是()A .加入少量盐酸B .加 KOH 固体C.加水D.加热5.在已达到电离平衡的0.1 mol/L 的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的 pH 降低,应采取的措施是() A .加少量盐酸 B .加热C.加少量醋酸钠晶体D.加少量水6.将足量的 BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。
各溶液中Ba2+的浓度最小的为() A .10 mL 0 .2 mol/LNa 2CO3 溶液 B . 40 mL 水C. 50 mL 0.01 mol/L 氯化钡溶液D.100 mL 0 .01 mol/L 盐酸7.下列有关滴定操作的顺序正确的是()① 检查滴定管是否漏水;②用蒸馏水洗涤玻璃仪器;③用标准溶液润洗盛装标准溶液的滴定管,用待测液润洗盛待测液的滴定管;④ 装标准溶液和待测液并调整液面(记录初读数);⑤ 取一定体积的待测液于锥形瓶中;⑥滴定操作A .①③②④⑤⑥B .①②③④⑤⑥C.②③①④⑤⑥ D .④⑤①②③⑥8.要使 K 2S 溶液中 [K +] / [S2- ]的比值变小,可加入的物质是()A .适量盐酸B .适量 NaOH 溶液 C.适量 KOH 溶液 D .适量 KHS 溶液9.在 Ca(OH) 2 sp=5.5×10 -6)、Mg(OH)2 sp=1.2×10-11)、AgCl ( Ksp-10)三种物质中,下列说( K ( K =1 .56×10 法正确的是() A . Mg(OH) 2的溶解度最小 B .Ca(OH) 2的溶解度最小C. AgCl 的溶解度最小D.同下 Ksp 越大的溶解度也越大10.在室温下,等体积的酸和碱的溶液混合后,pH 一定少于7 的是()A .pH=3 的 HNO 3跟 pH=11 的 KOH B. pH=3 的盐酸跟 pH=11 的氨水C. pH=3 硫酸跟 pH=11 的 NaOH D. pH=3 的醋酸跟 pH=11 的 Ba(OH) 211. 已知某溶液中存在 OH -、 H +、NH 4+ 、 Cl - 四种离子。
人教版化学选修4-第三章章末综合检测及答案

章末综合检测(90分钟,100分)一、选择题(本题包括18个小题,每小题3分,共54分)1.(2018·河南高二期末)水是最宝贵的资源之一。
下列表述正确的是( )A.4 ℃时,纯水的pH=7B.温度升高,纯水中的c(H+)增大,c(OH-)减小C.水的电离程度很小,纯水中主要存在形态是水分子D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小答案:C点拨:25℃时纯水的pH=7,A错;升温,水的电离程度增加,c(OH-)和c(H+)均增大,B错;水是弱电解质,电离的程度很小,纯水中主要存在形态是水分子,C对;水的离子积与温度有关,加入酸或碱均能抑制水的电离,但水的离子积不变,D错。
2.(2018·江苏高二检测)下列物质的水溶液中只存在一种分子的是( )A.NaF B.NaHSC.HNO3D.HClO答案:C3.下列溶液一定呈中性的是( )A.pH=7的溶液B.c(H+)=c(OH-)=10-6mol/L的溶液C.使酚酞试液呈无色的溶液D.由强酸与强碱等物质的量反应得到的溶液点拨:25 ℃时pH=7的溶液才是中性,A错;酚酞的变色范围为8.2~10.0,酚酞是无色的溶液pH<8.2,不一定显中性,C错。
H2SO4与NaOH、HCl与Ba(OH)2等物质的量反应后所得溶液均不显中性。
答案:B4.(2018·浙江高二检测)下列溶液一定呈碱性的是( )A.pH=8的某电解质溶液B.c(OH-)>1×10-7mol/LC.溶液中含有OH-D.溶液中c(OH-)>c(H+)解析:溶液的酸碱性取决于c(OH-)和c(H+)的相对大小,D正确;A、B未指明温度,错误;任何水溶液中均存在OH-,C项错误。
答案:D5.氨水中所含有的分子和离子有( )①NH+4②H2O ③NH3④NH3·H2O ⑤H+⑥OH-A.①②③ B.②③④⑤C.②③④⑤⑥ D.①②③④⑤⑥答案:D点拨:NH3溶于水大部分与H2O反应生成NH3·H2O。
高二化学人教版选修4练习:第3章第1节弱电解质的电离Word版含解析
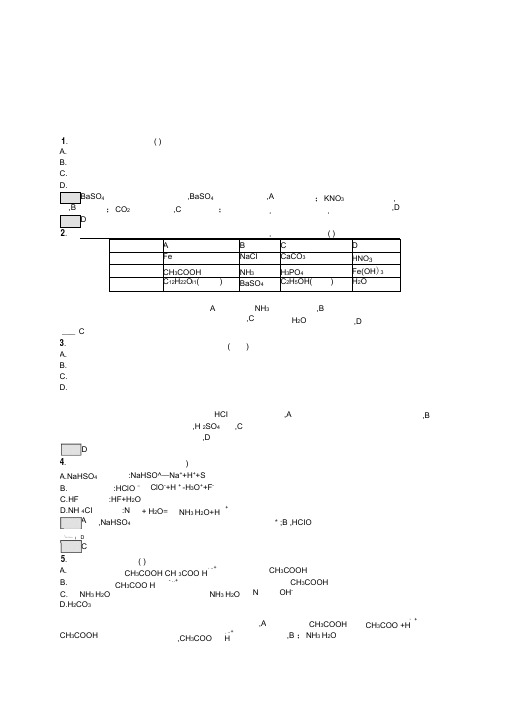
1. ( )A.B.C. D.BaSO 4 ,BaSO 4 ,A ;KNO 3 ,,B ;CO 2 ,C ; 5 5,D D2. 5 ( )A B C DFe NaCI CaCO 3 HNO 3CH 3COOH NH 3 H 3PO 4 Fe(OH )3C 12H 22O l1( ) BaSO 4 C 2H 5OH( ) H 2OD.H 2CO 3___ C 3. A. B.C.D.A NH 3 ,B,C H 2O ( ),DA.NaHSO 4B.C. H FD. N H 4CI A :HClO = :HF+H 2O:N ,NaHSO 4 5. A. B. C. NH 3 H 2O HCI ,H 2SO 4 ,D,C,A,B):NaHSO^—Na ++H ++SClO -+H + -H 3O ++F -+ H 2O = +NH 3 H 2O+H * ;B ,HCIO( )- ..+CH 3COOH CH 3COO H - ..+CH 3COO H NH 3 H 2O CH 3COOHCH 3COOHN OH -,A CH 3COOH ・ +CH 3COO +HCH 3COOH - ..+ ,CH 3COO H ,B ;NH 3 H 2O D4. '~~- ;DC中各粒子的浓度不变,而不是相等NH3H2O的电离程度很小,绝大多数以NH3H2O的形式存在,C错误;H答案| D6•某温度下,等体积、相同c(H)的盐酸和醋酸溶液分别加水稀释,溶液中的c(H)随溶液体积变化的A. n表示的是盐酸的变化曲线B. b点溶液的导电性比c点溶液的导电性强C. 取等体积的a点、b点对应的溶液,消耗的NaOH的量相同D. b点酸的总浓度大于a点酸的总浓度解析|CH3COOH属于弱电解质,在稀释时会电离出H+,故稀释时c(H+)的变化要比盐酸中c(H+)的变化慢一些,即I是盐酸的变化曲线,n是醋酸的变化曲线,A项错误;溶液的导电性与溶液中离子的浓度有关,离子浓度b>c,故导电能力也是b>c,B项正确;a点、b点表示溶液稀释相同倍数,溶质的量没有发生变化,都等于稀释前的物质的量,稀释前两溶液中c(H+)相同,但CH3COOH为弱酸,则c(CH3COOH)> c(HCl),故稀释前n(CH3COOH)> n(HCl),即CH3COOH 消耗NaOH 多,C 项错误;a 点酸的总浓度大于b点酸的答案|B7•下列关于电离常数的说法正确的是A. 电离常数随着弱电解质浓度的增大而增大B. CH 3COOH的电离常数表达式为K a= ------------------- 7C. 恒温下,在CH3COOH溶液中加入少量CH3COONa固体,电离常数减小D. 电离常数只受温度影响,与浓度无关解析|电离常数只受温度影响,与弱电解质的浓度无关,故A项错误,D项正确;B项,CH3COOH的电离常数表达式为K a= --------------------- ,故B项错误;C项,CH3COOH溶液中加入少量CH3COONa固体,温度不变,电离常数不变,故C项错误。
淮阳中学高二选修4第三章一

淮阳中学高二选修4第三章一、二节质量检测题高二化学备课组时量90分钟,分值100分。
一、选择题(每题可能有1-2个选择项正确)1.下列溶液肯定是酸性的是( )A 含H+的溶液B 加酚酞显无色的溶液C pH<7的溶液D [OH-]<[H+]的溶液2.将pH试纸用蒸馏水湿润后,去测定某溶液的pH,该溶液的pH将会A.偏高B.偏低C.不变D.上述三种情况均有可能3.pH相同的氨水、氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X倍、Y倍、Z倍,稀释后三种溶液的pH同,则X、Y、Z的关系是A.X=Y=ZB.X>Y=ZC.X<Y=ZD.X=Y<Z4.pH=2的溶液,其H+浓度为0.01mol/L,下列四种情况的溶液:①25℃的溶液、②100℃的溶液、③强酸溶液、④弱酸溶液,与上述符合的有A.①③B.①②③④C.③④D.①③④5.有甲、乙两种溶液,甲溶液的pH是乙溶液的两倍,则甲溶液中[H +]与乙溶液中[H+]的关系A.2:1B.100:1C.1:100D.无法确定6.有两瓶pH值都等于2的酸溶液,一瓶是强酸,另一瓶是弱酸,可用来鉴别它们的一组试剂是A.石蕊试液和水B.pH试纸和水C.酚酞试液和水D.酚酞试液和苛性钠溶液7.下列叙述正确的是( )A pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5B 溶液中[H+]越大,pH值也越大,溶液的酸性就越强C 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质D 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数8、在测溶液的性质时,下列试纸中预先不能用蒸馏水润湿的是( )A、石蕊试纸B、醋酸铅试纸C、KI淀粉试纸D、PH试纸9、关于下列水溶液的说法正确的是( )A、HCl溶液中无OH-B、氢氧化钠溶液中无H+C、NaCl溶液中既无OH-也无H+D、常温下,任何物质的水溶液中都有H+和OH-,且K W=10-1410、下列判断正确的是( )A、PH<7时溶液显酸性B、PH=7时溶液显中性C、c(OH-)>10-7 mol·L-1时溶液显碱性D、c(OH-)> c(H+)时溶液显碱性11、等体积混和0.06 mol·L-1Ba(OH)2溶液和0.10 mol·L-1盐酸后,溶液的pH值等于()A、2.0B、12.3C、12.0D、1.712、0.01 mol·L-1H A溶液的pH=2,将溶液稀释100倍后,溶液的pH值可能为()A、1B、4C、5D、813.在室温下,某溶液中由水电离出的H+浓度为1.0×10-13mol·L -1,则此溶液中一定不可能大量存在的离子组是( )A.Fe3+、NO3-、Cl-、Na+B.Ca2+、HCO3-、Cl-、K +C.NH4+、Fe2+、SO42-、NO3-D.Cl-、SO42-、K +、Na+14.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg则下列叙述正确的是( )A.中性溶液的AG=0B.酸性溶液AG<0C.常温下0.1 mol·L-1氢氧化钠溶液的AG=12D.常温下0.1 mol·L-1盐酸溶液的AG=1215.在25℃时,分别用pH=9、pH=10的两种氨水中和同浓度、同体积的盐酸,消耗氨水的体积分别为V1和V2,则V1和V2的关系是( )A.V1=10V2B.V1>10V2C.V1<10V2D.V2>10V116.在25 ℃时向V mL pH=a的盐酸中,滴加pH=b的NaOH(aq)10V mL 时,溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是A.13B.14C.15D.不能确定17.室温下,把1mL0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于()A. 1×10-4 mol/LB. 1×10-8 mol/LC. 1×10-11 mol/LD. 1×10-10 mol/L18.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c (SO42-):c (H+)约为()A、1:1B、1:2C、1:10D、10:119.弱酸HY溶液的pH=3.0,将其与等体积水混合后的pH范围是()A.3.0~3.3B.3.3~3.5C.3.5~4.0D.3.7~4.320.将体积均为10 mL、pH均为3的盐酸和醋酸,加入水稀释至a mL 和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积()A.a=b=100 mLB.a=b=1000 mLC.a<bD.a>b21.99mL0.1mol/L的盐酸和101mL0.05mol/L氢氧化钡溶液混合后,溶液的c(H+)为()(不考虑混合时的体积变化)。
2019——2020学年 选修4人教版 第三章 章末检测卷(100分)

2019——2020学年选修4人教版第三章章末检测试卷(100分)一、选择题(本题包括16小题,每小题3分,共48分;每小题只有一个选项符合题意)1.下列有关盐类水解的叙述正确的是()A.溶液呈中性的盐一定是强酸、强碱反应生成的盐B.含有弱酸根离子的盐的水溶液一定呈碱性C.盐溶液的酸碱性主要取决于形成盐的酸和碱的相对强弱D.强酸强碱盐的水溶液一定呈中性答案 C2下列说法不正确的是()A.pH<7的溶液不一定呈酸性B.在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等C.在相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-)=c(CH3COO-)D.氨水和盐酸反应后的溶液,若c(Cl-)=c(NH+4),则溶液呈中性答案 B3.某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中c(H+)=1×10-3mol·L-1。
下列对该溶液的叙述不正确的是()A.该温度高于25℃B.由水电离出来的H+的浓度为1×10-11mol·L-1C.加入NaHSO4晶体抑制水的电离D.取该溶液加水稀释100倍,溶液中的c(OH-)增大答案 BCOOH CH3COO-+H+,要使溶液中4.已知0.1mol·L-1的醋酸溶液中存在电离平衡:CHc(H+)值增大,可以采取的措施是()c(CH3COOH)①加少量烧碱固体②升高温度③加少量冰醋酸④加水⑤加少量醋酸钠固体A.①②B.②③⑤C.③④⑤D.②④答案 D5.常温下,某溶液中由水电离出来的c(H+)=1.0×10-11mol·L-1,该溶液可能是()①二氧化硫的水溶液②氯化钠水溶液③硝酸钠水溶液④氢氧化钠水溶液A.①④B.①②C.②③D.③④答案 A6在相同温度下,0.01mol·L -1NaOH 溶液和0.01mol·L-1的盐酸相比,下列说法正确的是( )A .两溶液中由水电离的c (H +)都是1.0×10-12mol·L -1B .NaOH 溶液和盐酸中由水电离出c (OH -)分别为1.0×10-2mol·L -1、1.0×10-12mol·L -1C .两溶液中由水电离出的c (H +)相等 D .两者都促进了水的电离 答案 C7.体积相同的盐酸和醋酸两种溶液,n (Cl -)=n (CH 3COO -)=0.01mol ,下列叙述错误的是( ) A .与NaOH 完全中和时,醋酸所消耗的NaOH 多 B .分别与足量CaCO 3反应时,放出的CO 2一样多 C .两种溶液的pH 相等D .分别用水稀释相同倍数时,n (Cl -)<n (CH 3COO -) 答案 B8等物质的量浓度的下列物质的溶液,其pH 由小到大的顺序排列正确的是( ) ①CH 3COONa ②NaOH ③NaNO 3 ④HCl ⑤Al 2(SO 4)3 A .①②③④⑤ B .⑤④③②① C .④⑤③①② D .④⑤②①③答案 C9.下列有关电解质溶液的说法正确的是( )A .向0.1mol·L -1CH 3COOH 溶液中加入少量水,溶液中c (H +)c (CH 3COOH )减小B .将CH 3COONa 溶液从20℃升温至30℃,溶液中c (CH 3COO -)c (CH 3COOH )·c (OH -)增大C .向盐酸中加入氨水至中性,溶液中c (NH +4)c (Cl -)>1D .向AgCl 、AgBr 的饱和溶液中加入少量AgNO 3,溶液中c (Cl -)c (Br -)不变答案 D10相同温度、相同浓度下的六种溶液,其pH 由小到大的顺序如图所示,图中①②③代表的物质可能分别为( )A .NH 4Cl (NH 4)2SO 4 CH 3COONaB .(NH 4)2SO 4 NH 4Cl CH 3COONaC .(NH 4)2SO 4 NH 4Cl NaOHD .CH 3COOH NH 4Cl (NH 4)2SO 4 答案 B11.下列物质所配成的0.1mol·L-1溶液中,离子浓度由大到小顺序排列正确的是()A.NH4Cl:c(Cl-)>c(H+)>c(NH+4)>c(OH-)B.Na2CO3:c(Na+)>c(CO2-3)>c(HCO-3)>c(OH-)>c(H+)C.NaHCO3:c(Na+)>c(CO2-3)>c(HCO-3)>c(OH-)>c(H+)D.(NH4)2SO4:c(NH+4)>c(SO2-4)>c(H+)>c(OH-)答案 D12.有4种混合溶液,分别由等体积0.1mol·L-1的2种溶液混合而成:①CH3COONa与HCl,②CH3COONa 与NaOH,③CH3COONa与NaCl,④CH3COONa与NaHCO3。
新课标人教版高中化学选修四第三章检测题及答案.docx

水傢液中的為孑平衡1.下列说法中正确的是()A.二氧化硫溶于水能导电,故二氧化硫属于电解质B.硫酸顿难溶于水,故硫酸顿属于弱电解质C.硫酸是强电解质,故纯硫酸能导电D.氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同2.在下列实验方法屮,不能证明醋酸是弱酸的是()A.25 °C时,醋酸钠溶液呈碱性B.25 °C时,0.1 mol L-1的醋酸的pH约为3C.25 °C时,等体积的盐酸和醋酸,前者比后者的导电能力强D.25 °C时,将pH = 3的盐酸和醋酸稀释成pH=4的溶液,醋酸所需加入的水多3.将①『②CT @A13+④K*⑤尹©OH- ©NO;⑧NH;分别加入出0中, 基本上不影响水的电离平衡的是()A.①③⑤⑦⑧B.②④⑦C.①⑥D.②④⑥⑧4.pH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸镭水稀释到原来的X、Y、Z 倍, 稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是()A.X=Y=ZB. X>Y=ZC. X<Y=ZD. X=Y<Z5.已知下面三个数据:©7.2X10-4②4.6X10^ ③4.9X10^°,分别是三种酸的电离平衡常数,若己知这些酸可发生如下反应:NaCN + HNO2=HCN + NaNCh; NaCN + HF=HCN + NaF;NaNO2+HF=HNO2 + NaFo由此可判断下列叙述中,正确的是()A.HF的电离平衡常数是①B.HNO2的电离平衡常数是①C.HCN的电离平衡常数是②D・HNO2的电离平衡常数是③6.下列各种情况下一定能大量共存的离子组为()A.pH = 7 的溶液中:Fe3+> C「、Na十、NO;B.由水电离出的c(H+)=lX10~13mol/L 的溶液中:NaS COf> CF> K+C.pH=l 的溶液中:NH;、Cl~> Cu2+> sofD・无色溶液中:Al*、HCO$、厂、K+7.若pH = 3的酸溶液和pH= 11的碱溶液等体积混合溶液呈酸性,下列叙述正确的()A.生成一种强酸弱碱盐B.弱酸溶液和强碱溶液反应C.强酸溶液与弱碱溶液反应D.一元强酸溶液与一元强碱溶液反应8.等物质的量下列各状态的电解质,自由离子数由大到小的排列顺序是()①熔融的NaHSO4②NaHSO4溶液③NaHCO3溶液④H2CO3溶液A.①②③④B.④②③①C.②③①④D.②①③④9.将O.lmol L^的下列物质的水溶液,从常温加热到90 °C,溶液的pH不变的是()A.氯化钠B.硫酸C.氢氧化钾D.硫酸钱10.常温下,下列各组数据中比值为2:1的是()A.K2SO3溶液屮c(K±)与c(SO「)之比B.0.2mol L_1的CHjCOOH 溶液与O.lmol L-1的盐酸屮c(H+)Z比C.pH = 7的氨水与(NH4)2SO4的混合溶液中,c(NH;)与c(SO「)之比D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液屮溶质的物质的量浓度Z比11.下列浓度关系正确的是()A.氯水中:C(C12)=2 [c(C10 )+c(Cr)+c(HC10')]B.氯水中:c(Cr)>c(H+)>c(0H~)>c(C10_)C.等体积等浓度的氢氧化钠溶液与醋酸混合:c(Na+) = c(CH3COO_)D.NazCOs 溶液中:c(Na+)>c(COr)>c(OH~)>c(HCO;)>c(H+)12.欲使O.lmol L-1的NaHCO3溶液中c(H) c(COf)> c(HCOQ都减少,其方法是( )A.通入二氧化碳气体B.加入氢氧化钠固体C.通入氯化氢气体D.加入饱和石灰水溶液13.有关①lOOmLO.lmol/LNaHCCh ②1 OOmL0.1mol/LNa2CO3两种溶液的叙述不正确的是()A.溶液中水电离出的『个数:@>®B.溶液中阴离子的物质的虽浓度Z和:®>®C・①溶液中:c(COr)>c(H2CO3)D.②溶液中:c(HCOr)>c(H2CO3)14.若室温下0.1mol L_1NaX溶液中pH = 9,则该溶液中发生水解反应的X一占全部X_ 的()A. 0.01%B. 0.09%D.无法确定C. 1.0%15.用1.0mol L_,NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是()/mlA.lmobL_L60mLB.0.5mol L h80mLC.0.5mol L_1,40mLD. 1 mol-L 吨OmL16.一定温度下的难溶电解质A〃,B”在水溶液中达到沉淀溶解平衡时,其中Ksp=d”(A")H(B〃L),称为难溶电解质的溶度积。
人教版选修4第3期创新卷一

⑤CO2(g) + 2H2O(g) CH4(g) + 2O2(g)
ΔH=+890 kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的有
(填序号)。
(2)H2的燃烧热ΔH=
。
a
22
(3)已知:C(s)+H2O(g) H2(g) +CO (g)
ΔH=a kJ·mol-1,则a=
。
17.(10分)已知某反应A(g)+B(g)
。
a
26
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶 液进行上述实验,测得的中和热ΔH将 (填“偏大”、“偏小”或“无影响”)。
19.(10分)将煤转化为水煤气的主要化学反应为C(s)+H 2O(g) CO(g)+H2(g)。已知C(s)、CO(g)和H2(g)完全 燃烧的热化学方程式为:
ΔH=-201
9.氢气在氯气中燃烧时产生苍白色火焰,在反应过程 中,破坏1 mol H2 中化学键消耗的能量为Q1 kJ,破坏1 mol Cl2 中化学键消耗的能量为Q2 kJ,形成1 mol HCl中 化学键释放的能量为Q3 kJ,Q1、Q2、Q3均为正值,下列
a
11
关系式中正确的是
A.Q1+Q2 > Q3 B.Q1+Q2 > 2Q3
C(s)+O2(g)
CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+
1 2
O2(g)
H2O(g)
a
27
ΔH=-242.0 kJ·mol-1
2CO(g)+O2(g) 2CO2(g)
ΔH=-566.0 kJ·mol-1 请回答: (1)根据以上数据,写出表示CO燃烧热的热化学方程 式:
选修4 人教版 第三章 (前三节检测题目)

杨镇一中高二化学5月第二周周检测(选修4 人教版第三章前节检测题目)(100分)一:选择题(单选,每小题3分,共54分)1、下列叙述正确的是( )A.硫酸钡难溶于水,故硫酸钡为弱电解质B.硝酸钾溶液能导电,故硝酸钾溶液为电解质C.二氧化碳溶于水能部分电离,故二氧化碳为弱电解质D.石墨虽能导电,但既不是电解质,也不是非电解质2、常温下,关于pH = 2的盐酸,下列说法不.正确..的是( )A.溶液中c(H+) = 1.0ⅹ10-2 mol·L-1 B.此溶液中由水电离出的c(OH-) = 1.0ⅹ10-12 mol·L-1 C.加水稀释100倍后,溶液的pH = 4 D.加入等体积pH = 12的氨水,溶液呈中性3、下列各式中属于正确的水解反应离子方程式的是( )A.NH+4+H2O NH3·H2O+H+B.S2-+2H2O H2S+2OH-C.CH3COOH+H2O CH3COO-+H3O+D.CH3COOH+OH-===CH3COO-+H2O4、关于0.1mol·L-1CH3COOH溶液,下列说法中正确的是()①加水稀释时,溶液中所有离子浓度都减小。
②加入少量0.1 mol·L-1HCl溶液,溶液中c(H+) 减小。
③加入少量CH3COONa固体,因为醋酸钠水解显碱性,所以平衡向正反应方向移动。
④加入少量CH3COONa固体,因为醋酸钠会电离出很多的醋酸根离子,所以平衡向逆反应方向移动。
⑤若加入少量的冰醋酸,则氢离子浓度减小⑥若加入少量的冰醋酸,醋酸溶液的电离程度减小。
A、④⑥B、①②C、①②③④⑥D、都正确5、在室温下等体积的酸和碱的溶液,混合后pH一定大于7的是()A.pH = 3的硝酸跟pH = 11的氢氧化钾溶液 B.pH = 3的硝酸跟pH = 11的氨水C.pH = 3的硫酸跟pH = 11的氢氧化钠溶液 D.pH = 3的硫酸跟pH = 11的氢氧化钡溶液6、甲酸的下列性质中,可以证明它是弱电解质的是()A.甲酸以任意比与水互溶B.0.1 mol·L-1甲酸溶液的c(H+)=10-3 mol·L-1C.10 mL 1 mol·L-1甲酸恰好与10 mL 1 mol·L-1 NaOH溶液完全反应D.甲酸溶液的导电性比一元强酸溶液的弱7、向某氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是()8、25℃时,水的电离达到平衡:H2O H++OH-ΔH>0,下列叙述正确的是()A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低B.向水中加入少量固体硫酸氢钠,c(H+)增大,K W不变C.向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低D.将水加热,K W增大,pH不变9、.室温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b关系为()A.a>bB.a=10-4bC.b=10-4aD.a=b10、某学生用碱式滴定管量取0.1mol·L-1的NaOH溶液,开始时仰视液面读数为1.00mL,取出部分溶液后,俯视液面,读数为11.00mL,该同学在操作中实际取出的液体体积为()A.大于10.00mLB.小于10.00mLC.等于10.00mLD.等于11.00mL11、下列有关叙述正确的是()A、pH均为11的氢氧化钠溶液与醋酸钠溶液中,水电离的c(OH-)相同B、0.1mol/L的硫酸与0.1mol/L的盐酸溶液中,水电离出的c(H+)之比为2:1C、常温时,若0.1mol/L NaHSO3溶液pH<7,则加水稀释时,c(OH-)减小D、0.1mol/L的醋酸溶液中加少量冰醋酸,醋酸的电离平衡正移,水的电离平衡逆移12、25℃时,在浓度均为1mol·L-1的(N H4)2S O4、(NH4)2CO3、(N H4)2F e(S O4)2的溶液中,测得其中c(NH4+)分别为a、b、c(mol·L-1),则下列判断正确的是()A. a>b>cB. c>a>bC. b>a>cD. a >c>b13、下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是()①pH=0的盐酸②0.1mol·L-1的盐酸③0.01mol·L-1的NaOH溶液④pH=11的NaOH溶液A.1∶10∶100∶1000B.0∶1∶12∶11C.14∶13∶12∶11D.14∶13∶2∶314、在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是()A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) B.c(CH3COO-)>c(Na+)>c(OH-)>c(H+) C.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)15、在一定条件下,Na2CO3溶液中存在如下平衡:CO2-3+H2O HCO-3+OH-,下列说法正确的是()A.稀释溶液,平衡正向移动,c(HCO-3)·c(OH-)c(CO2-3)增大B.通入CO2,平衡逆向移动,溶液pH减小C.加入NaOH固体,平衡逆向移动,pH减小D.升高温度,c(HCO-3)c(CO2-3)增大16、某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。
2019——2020学年选修4人教版 第三章检测卷(100分)

2019——2020学年选修4人教版第三章检测试卷(100分)一、选择题(本题包括16小题,每小题3分,共48分;每小题只有一个选项符合题意) 1.室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH+4)都增大的是()A.加入少量H2O B.加入少量NaOH固体C.通入少量HCl气体D.升高温度答案 C2.常温下,下列四种溶液中,水的电离程度最大的是()A.pH=5的NH4Cl溶液B.pH=5的NaHSO4溶液C.pH=8的CH3COONa溶液D.pH=8的NaOH溶液答案 A3室温下,下列有关两种溶液的说法不正确的是()A.①②两溶液中c(OH-)相等B.①②两溶液中水的电离程度相同C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①<②D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②答案 C4.6.下列化学原理的应用,主要用沉淀溶解平衡原理解释的是()①热纯碱溶液洗涤油污的能力强②误将钡盐[BaCl2、Ba(NO3)2]当作食盐混用后,常用0.5%的Na2SO4溶液解毒③溶洞、珊瑚的形成④碳酸钡不能作“钡餐”而硫酸钡则能⑤泡沫灭火器灭火的原理A.②③④B.①②③C.③④⑤D.①②③④⑤答案 A5.pH=3的两种一元酸HX和HY溶液,分别取50 mL加入足量的镁粉,充分反应后,收集到H2的体积分别为V(HX)和V(HY),若V(HX)>V(HY),则下列说法正确的是() A.HX可能是强酸B.HY一定是强酸C.HX的酸性强于HY的酸性D.反应开始时二者生成H2的速率相等答案 D6、硼酸(H3BO3)溶液中存在反应:H3BO3(aq)+H2O(l)[B(OH)4]-(aq)+H+(aq)。
已知硼酸、碳酸、醋酸的电离常数如表所示。
2019_2020年湖北 选修4人教版 第三章 综合测评(100分)

2019_2020学年选修4人教版第三章综合测评(100分)一、选择题(本题包括15小题,每小题3分,共45分;每小题只有一个选项符合题意)1. 下列说法正确的是()A.在水溶液中能离解为自由移动的离子的化合物是电解质B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物C.CO2的水溶液导电能力很弱,所以CO2是弱电解质D.在强电解质的水溶液中只有离子没有分子答案 A2. 下列过程或现象与盐类水解无关的是()A.纯碱溶液去油污B.铁在潮湿的环境下生锈C.加热氯化铁溶液颜色变深D.浓硫化钠溶液有臭味答案 B3. 下列说法正确的是()A.根据溶液中有CH3COOH、CH3COO-和H+即可证明CH3COOH达到电离平衡状态B.根据溶液中CH3COO-和H+的物质的量浓度相等可证明CH3COOH达到电离平衡状态C.当NH3·H2O达到电离平衡时,溶液中NH3·H2O、NH+4和OH-的浓度相等D.H2CO3是分步电离的,电离程度依次减弱答案 D4. 在25 ℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,它们的电离常数分别为4.6×10-4、1.8×10-4、6.2×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是()A.HNO2B.HCOOHC.HCN D.H2CO3答案 C5. 已知相同条件下,HClO的电离常数小于H2CO3的第一级电离常数。
为了提高氯水中HClO的浓度,可加入()A.HCl B.CaCO3(s)C.H2O D.NaOH(s)答案 B6. 已知在100 ℃时水的离子积K w=1×10-12,下列溶液的温度均为100 ℃。
其中说法正确的是()A.0.005 mol·L-1的H2SO4溶液,pH=2B.0.001 mol·L-1的NaOH溶液,pH=11C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性D.pH=3的H2SO4溶液与pH=9的NaOH溶液完全中和需要NaOH溶液的体积是硫酸溶液的2倍答案 A7. 室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是()A.0.1 mol·L-1的盐酸和0.1 mol·L-1的氢氧化钠溶液B.0.1 mol·L-1的盐酸和0.05 mol·L-1的氢氧化钡溶液C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液D.pH=4的盐酸和pH=10的氨水答案 D8. 酸碱恰好完全中和时()A.酸与碱的物质的量一定相等B.溶液呈现中性C.酸与碱的物质的量浓度相等D.酸所能提供的H+与碱所能提供的OH-的物质的量相等解析根据酸碱中和反应的实质可知酸碱恰好完全中和时,酸所能提供的H+与碱所能提供的OH-的物质的量相等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学选修4 第三章章末测试卷命题:梁亮审题:邹爱民时间:90分钟分值:100分一、选择题(本题包括16个小题,每小题3分,共48分)1.水是最宝贵的资源之一。
下列表述正确的是()A.4 ℃时,纯水的pH=7B.温度升高,纯水中的c(H+)增大,c(OH-)减小C.水的电离程度很小,纯水中主要存在形态是水分子D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小2.下列物质的水溶液中只存在一种分子的是()A.NaF B.NaHS C.HNO3D.HClO3.常温下,向20 mL 0.2 mol·L-1 H2SO3溶液中滴加0.2 mol·L-1 NaOH溶液。
有关微粒的物质的量变化如图所示。
(其中Ⅰ表示H2SO3,Ⅱ代表HSO-3、Ⅲ代表SO2-3)。
根据图示判断正确的()A.当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-7B.当V(NaOH)=20 mL时:c(Na+)>c(HSO-3)>c(H+)>c(SO2-3)>c(OH-)C.当V(NaOH)=40 mL时2c(Na+)=c(SO2-3)D.当V(NaOH)=40 mL后,继续滴加NaOH溶液,溶液的温度会继续升高4.下列溶液一定呈中性的是()A.pH=7的溶液B.c(H+)=c(OH-)=10-6mol/L的溶液C.使酚酞试液呈无色的溶液D.由强酸与强碱等物质的量反应得到的溶液5.常温下下列各组离子在指定溶液中能大量共存的是()A.pH=1的溶液中:Fe2+、NO-3、SO2-4、Na+B.由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO-3、K+C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO2-4、SCN-6.下列有关溶液中粒子浓度的关系式中,正确的是()A.pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三种溶液中的c(Na+):③>②>①B.0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)C.下图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+)D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) 7.对于常温下pH=3的乙酸溶液,下列说法正确的是()A.c(H+)=c(CH3COO-)+c(OH-)B.加水稀释到原体积的10倍后溶液pH变为4C.加入少量乙酸钠固体,溶液pH降低D.与等体积pH=11的NaOH溶液混合后所得溶液中:c(Na+)=c(CH3COO-)8.现有室温下的四种溶液,有关叙述不正确的是()A.相同体积的③、④溶液分别与NaOH完全反应,消耗NaOH的物质的量:③>④B.分别加水稀释10倍,四种溶液的pH:①>②>④>③C.①、④两溶液等体积混合,所得溶液中:c(Cl-)>c(NH+4)>c(OH-)>c(H+)D.V a L④溶液与V b L②溶液混合[近似认为混合溶液体积=(V a+V b)L],若混合后溶液的pH=4,则V a∶V b=11∶99.常温下,下列各组比值为1∶2的是()A.0.1 mol/L与0.2 mol/L 醋酸溶液,c(H+)之比B.0.1 mol/L Na2CO3溶液,c(CO2-3)与c(Na+)之比C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比D.pH=3的硫酸与醋酸溶液,c(SO2-4)与c(CH3COO-)之比10.下列说法正确的是()A.已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH33COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大。
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO-3)11.下列有关实验操作的说法错误的是()A.中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘12.下列说法错误的是()A.常温下,0.1 mol·L-1的CH3COOH溶液中,由水电离的c(H+)大于10-13 mol·L-1B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1∶10C.常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 D.某温度时水的离子积常数K w=10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=2∶913.关于常温下pH=12的NaOH溶液,下列说法正确的是()A.c(OH-)>c(Na+)+c(H+)B.由水电离出的c(OH-)=1.0×10-12 mol·L-1C.与等体积pH=2的醋酸混合后所得溶液显碱性D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+)=c(NH+4)14.常温下,将1 mL pH=2的一元酸HA溶液加水稀释至100 mL,其pH与溶液体积(V)的关系如左下图所示,下列说法正确的是()A.加热HA溶液时,溶液酸性增强B.1 mol·L-1 HA溶液与1 mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(A-),则2<a<4 C.某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=1014-d mol·L-1D.HA溶液与NaOH溶液恰好完全反应时,一定有c(Na+)>c(A-)>c(OH-)>c(H+)15.向20 mL 0.5 mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如右上图所示。
下列关于混合溶液的相关说法错误的是()A.醋酸的电离常数:b点>a点B.由水电离出的c(OH-):b点>c点C.从a点到b点,混合溶液中可能存在:c(CH3COO-)=c(Na+)D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)16.某温度下HF的电离常数K a=3.3×10-4,CaF2的溶度积常数K sp=1.46×10-10。
在该温度下取浓度为0.31 mol·L-1的HF溶液与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。
下列说法正确的是()A.该温度下,0.31 mol·L-1的HF溶液的pH值约为2B.升高温度或增大浓度,HF的电离平衡常数都将增大C.两溶液混合不会产生沉淀D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小二、非选择题(本题包括5小题,共52分)17.(4分)(1)已知K sp(BaSO4)≈1×10-10,K sp(BaCO3)≈5×10-9,则向BaSO4悬浊液中逐渐加入Na2CO3固体至c(CO2-3)=________mol·L-1时,BaSO4开始向BaCO3沉淀转化。
(2)若25℃时某一元酸HA的电离平衡常数K a=1×10-8,相同物质的量浓度的HA和NaA两溶液等体积混合后,溶液显________性(填“酸”、“碱”或“中”)。
18.(10分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:(1)其中溶质在溶液中不以分子形式存在的是(填序号,下同)____________。
(2)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____________。
(3)④、⑤、⑥、⑦四种溶液中NH+4浓度由大到小的顺序是(填序号)________。
(4)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是___________________。
(5)在用已知浓度的①与未知浓度的⑦做酸碱滴定实验时应选用________作指示剂。
19.(14分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H22++2K++Mg2++4SO2-4+2H2O为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原_________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后过滤,再加入________溶液调pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见下图。
由图可得,随着温度升高,①________________②________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO233(s)+SO2-4已知298 K时,K sp(CaCO3)=2.80×10-9,K sp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K=________________ (计算结果保留三位有效数字)。
20.(12分)工业上把Cl2通入NaOH溶液中制得漂白液(主要成分NaClO)。
一化学小组模拟实验得到ClO-、ClO-3等离子其物质的量(mol)与反应时间t(min)的关系曲线:(1)工业制取漂白液的化学反应方程式为___________________________________________。
(2)图中a点混合物所含的三种溶质是NaCl和________(填溶质的化学式),离子浓度从大至小的排列顺序是________________。
