3.4难溶电解质的沉淀溶解平衡
化学:3.4《难溶电解质的溶解平衡》课件(山东临沂)(人教版选修4)

以人为本,追求卓越 以人为本 追求卓越
与弱电解质的电离平衡常数做对比,Ksp的意义 的意义 与弱电解质的电离平衡常数做对比 以人为本,追求卓越 以人为本 追求卓越 和影响因素 Ka或Kb
影响因素 物质本身性质和温度 意义
Ksp
物质本身性质和温度等
以人为本,追求卓越 以人为本 追求卓越
3.生成难溶电解质的离子反应的限度: 3.生成难溶电解质的离子反应的限度: 生成难溶电解质的离子反应的限度 难溶电解质的溶解度小于0.01g,离子反应生成 溶解度小于0.01g, 难溶电解质的溶解度小于0.01g,离子反应生成 难溶电解质,通常离子浓度小于 离子浓度小于1 mol/L时 难溶电解质,通常离子浓度小于1×10-5mol/L时, 认为反应完全 但溶液中还有相应的离子。 反应完全, 认为反应完全,但溶液中还有相应的离子。 4.影响因素 内因、外因(浓度、温度等) 影响因素: 4.影响因素:内因、外因(浓度、温度等) 5.溶度积常数 简称溶度积 溶度积常数(简称溶度积 科学视野](p65): 溶度积常数 简称溶度积)—[科学视野 科学视野 溶度积(Ksp):难溶电解质的溶解平衡中,离子浓 难溶电解质的溶解平衡中, ⑴.溶度积 溶度积 难溶电解质的溶解平衡中 度幂的乘积。 度幂的乘积。
以人为本,追求卓越 以人为本 追求卓越 2. 根据对溶解度及反应限度、化学平衡原理的认识, 化学平衡原理的认识, 说明生成沉淀的离子反应是否能真正进行到底。 说明生成沉淀的离子反应是否能真正进行到底。 Ag+和 Cl-的反应真能进行到底吗?为什么? 的反应真能进行到底吗?为什么? a.生成沉淀的离子反应之所以能够发生 生成沉淀的离子反应之所以能够发生, a.生成沉淀的离子反应之所以能够发生,在于生成 物的溶解度小。 物的溶解度小。 b.难溶电解质的溶解度尽管很小 但不会等于0( 难溶电解质的溶解度尽管很小, 0(生 b.难溶电解质的溶解度尽管很小,但不会等于0(生 AgCl沉淀后的溶液中三种有关反应的粒子在 成AgCl沉淀后的溶液中三种有关反应的粒子在 反应体系中共存). 反应体系中共存). c.习惯上 将溶解度小于0.01 习惯上, 0.01克的电解质称为难溶 c.习惯上,将溶解度小于0.01克的电解质称为难溶 电解质。 电解质。 d.化学上通常认为残留在溶液中的离子浓度 化学上通常认为残留在溶液中的离子浓度小于 d.化学上通常认为残留在溶液中的离子浓度小于 mol/L时 沉淀反应达到完全。 10-5mol/L时,沉淀反应达到完全。 ).AgCl溶解平衡的建立 溶解平衡的建立: (一).AgCl溶解平衡的建立::
3.4第四节 难溶电解质的溶解平衡

5.在有Cl-和Br-共同存在的溶液中,只要滴入AgNO3溶液,就 一定先有AgBr沉淀生成。( ×) 分析:是否先生成AgBr沉淀,要看溶液中c(Cl-)、c(Br-)的大 小,因为形成沉淀必须满足的条件是c(Ag+)·c(X-)>Ksp(AgX), 如果c(Cl-)较大而c(Br-)较小,当c(Ag+)·c(Cl-)> Ksp(AgCl),而c(Ag+)·c(Br-)<Ksp(AgBr)时,先生成 AgCl沉淀。
(3)方法。 方法实例发生反应的离子方程式调节 pH法除去NH4Cl溶液中的沉淀3+ Fe +3NH3·H2O==== 剂法除去污水中的重金属离子H2S+Cu2+CuS↓+ Fe(OH) 2H+ ↓+3NH
3
4
+
2.沉淀的溶解
(1)含义。 减少溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移 动,从而使沉淀溶解。 (2)方法。
第四节 难溶电解质的溶解平衡
点击进入相应模块
1.了解难溶电解质的沉淀溶解平衡。
2.了解溶度积的意义。
3.知道沉淀的生成、沉淀溶解、沉淀转化的本质是沉淀溶解 平衡的移动。
一、难溶电解质的溶解平衡 在难溶电解质的饱和溶液中是否也存在像化学平衡一样的动态 平衡? 1.物质的溶解性 20 ℃时电解质在水中的溶解度与溶解性存在如下关系: 难溶 易溶
4.特征 溶解平衡也具有化学平衡的特点。 可逆 过程。 (1)逆:_____ 动态 平衡,溶解的速率和沉淀的速率并不为0。 (2)动:_____ = 沉淀)。 (3)等:v(溶解)__v( 离子浓度 保持不变。 (4)定:达到平衡,溶液中_________ (5)变:当外界条件发生改变,溶解平衡将发生移动,并建立新
的沉淀溶解平衡状态。
2023学年人教版高二上学期化学考点解读与综合训练3-4 难溶电解质的溶解平衡【分层解读】(解析版)

3.4 难溶电解质的溶解平衡分层解读考点一 沉淀溶解平衡1.把NaCl 晶体溶于水充分搅拌后,溶液中仍有晶体存在,下列说法正确的是 A .溶解过程停止 B .此时溶解速率等于结晶速率 C .此时溶质不再溶解 D .溶解过程停止【答案】B【解析】把NaCl 晶体溶于水,存在钠离子氯离子离开晶体表面进入溶液的溶解过程、同时存在溶液中的钠离子和氯离子回到晶体表面的结晶过程,当溶解速率和结晶速率相等时,就处于平衡,这是动态平衡:溶解和结晶仍在进行、但是溶解已达到了最大程度,形成了饱和溶液,则B 满足; 答案选B 。
2.已知常温下-10sp K (AgCl)=1.810⨯,-17sp K (AgI)=8.510⨯,下列有关说法正确的是 A .常温下,AgCl 在纯水中的sp K 比在3AgNO 溶液中的sp K 大B .向AgI 与AgCl 的悬浊液中加入几滴浓NaCl 溶液,--c(Cl )c(I )不变C .在AgCl 的饱和溶液中通入HCl ,有AgCl 析出,且溶液中+-c(Ag )=c(Cl )D .向NaCl 、NaI 的混合溶液中滴入几滴3AgNO 溶液,出现黄色沉淀,此现象可验证sp sp K (AgI)<K (AgCl) 【答案】B【解析】A .sp K 只随温度的改变而改变,所以二者sp K 相等,A 项错误; B .AgI 与AgCl 的悬浊液在滴入几滴浓NaCl 溶液后,仍是二者的饱和浴液()()()()()()()()spspc c c K K c I c I c Cl Cl Ag AgCl AgI Ag --+--+⋅==⋅,温度不变,sp K(AgCl)、sp K (AgI)不变,故(Cl )(I )c c --不变,B 项正确; C .在AgCl 的饱和溶液中通入HCl ,()c Cl -增大,AgCl(s)Ag ()()aq Cl aq +-+的沉淀溶解平衡向左移动,有AgCl 析出,溶液中()c Cl-增大,+c(Ag)减小,+c(Ag )、-c(Cl )不再相等,C 项错误;D .向NaCl 、NaI 的混合溶液中滴入几滴3AgNO 溶液,出现黄色沉淀,证明发生了反应:Ag I AgI +-+↓,但由于不知道溶液中-Cl 、-I 的浓度大小,不能确定AgI 和AgCl 溶度积大小关系,故D 项错误。
3.4.2沉淀反应的应用(用)

使 之转化为疏松、易溶于酸的CaCO3。
化学法除锅炉水垢的流程图
水垢Ca成S分O4
CaCO3 Mg(OH)2
SO42- + Ca2+ 用饱和Na2C+O3 溶液浸泡数C天O32-
疏松的水垢
CaCO3 Mg(OH)2
CaSO4
写出除去水垢过程中发生的C所aC有O离3 子方程式
CaSO4 (s) +CO32- === CaCO3 (s) +SO42CaCO3 (s) +2H+ === Ca2++ CO2↑+H2O Mg(OH)2 (s) +2H+ === Mg2++2H2O
运用四段式(列平衡—讲条件—论移动—说结果) (3)这样真的能除尽Ag+吗?
由于沉淀溶解平衡的存在,生成沉淀的离子反应不可 能进行到底。我们所说的“沉淀完全,并不是使溶液中的 某种离子浓度真正等于零,实际上这是做不到的。化学上 常认为残留在溶液中的离子浓度小于10-5mol/L时, 沉淀 达到完全
(4)影响因素: ①内因:电解质本身的性质
饱用 氯盐 化酸 铵或 液 除去水垢
应用2:一些自然现象的解释
当我们外出旅游,沉醉于秀美的湖光山色 时,一定会惊叹大自然的鬼斧神工。石灰 石岩层在经历了数万年的岁月侵蚀之后, 会形成各种奇形异状的溶洞。你知道它是 如何形成的吗?
CaCO3
Ca2+ + CO32+
H2O+CO2
2HCO3-
课
时
小 结
CaSO4 (s) +CO32- === CaCO3 (s) +SO42-
(2)C请aC写O出3+发2H生+ =反==应Ca的2++离C子O2↑方+H程2O式。
人教版高中化学选修四3-4难溶电解质的溶解平衡(含答案详解)

高中化学学习材料金戈铁骑整理制作课时作业(十六)(对应学生用书第125页)1.下列对沉淀溶解平衡的描述正确的是()A.反应开始时,溶液中各离子浓度相等B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变D.沉淀溶解达到平衡时,如果再加入难溶性该沉淀物将促进溶解【解析】A项中,反应开始时,各离子的浓度没有必然的关系。
B项正确;C项达到沉淀溶解平衡时溶液中溶质的离子浓度保持不变,但不一定相等;D项中,达到沉淀溶解平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,所以平衡不移动。
【答案】 B2.向AgCl饱和溶液中加水,下列叙述正确的是()A.AgCl的溶解度增大B.AgCl的溶解度、K sp均不变C.AgCl的K sp增大D.AgCl的溶解度、K sp均增大【解析】物质的溶解度和溶度积都是温度的函数,与溶液的浓度无关。
所以向AgCl 饱和溶液中加水,AgCl的溶解度和K sp都不变,故B项对。
【答案】 B3.要使工业废水中的重金属离子Pb 2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb 2+与这些离子形成的化合物的溶解度如下:化合物 PbSO 4 PbCO 3 PbS 溶解度/g1.03×10-41.81×10-71.84×10-14由上述数据可知,选用的沉淀剂最好是( ) A .硫化物 B .硫酸盐 C .碳酸盐 D .以上沉淀剂均可【解析】 产生的沉淀的溶解度越小,沉淀反应进行的越完全。
在某种沉淀中加入适当的沉淀剂,可使原来的沉淀溶解而转化为另一种溶解度更小的沉淀。
【答案】 A4.为除去MgCl 2酸性溶液中的Fe 3+,可在加热搅拌的条件下加入的一种试剂是( )A .NH 3·H 2OB .NaOHC .Na 2CO 3D .MgCO 3 【解析】 Fe 3++3H 2OFe(OH)3+3H +,调整pH ,可使Fe 3+转化为Fe(OH)3沉淀后除去。
3-4 难溶电解质的沉淀溶解平衡

3-4第四单元难溶电解质的沉淀溶解平衡知能定位1.了解难溶物在水中的溶解情况,认识沉淀溶解平衡的建立过程。
2.理解溶度积的概念,能用溶度积规则判断沉淀的产生、溶解。
3.了解沉淀溶解平衡在生产、生活中的应用(沉淀的生成和分步沉淀,沉淀的溶解和转化)。
情景切入你知道美丽的溶洞是怎样形成的吗?自主研习一、沉淀溶解平衡原理1.沉淀溶解平衡(1)概念在一定温度下,当溶解速率和沉淀速率相等时所达到的溶解平衡。
(2)溶解平衡的建立以AgCl溶解平衡为例,表达式:AgCl溶解沉淀Ag++Cl-。
(3)溶解平衡的特征动——动态平衡,溶解速率和沉淀速率不等于零|等——溶解速率和沉淀速率相等。
|定——平衡状态时,溶液中的离子浓度保持不变|变——当改变外界条件时,溶解平衡发生移动。
(4)表示方法Fe(OH) 3的沉淀溶解平衡可表示为2.溶度积(1)含义沉淀溶解平衡的平衡常数称为溶度积常数或溶度积,符号为K SP。
(2)表示方法:对M m An mM n++nA m-来说,K SP =c m (M n+)·c n (A m-) (3)影响因素K SP 与难溶电解质的性质和温度有关,与浓度无关,与沉淀量无关。
(4)意义溶度积(K SP )反映了物质在水中的溶解能力。
对同类型的难溶电解质(如AgCl 、AgBr 、AgI )而言,K SP 数值越大的难溶电解质在水中的溶解能力越强。
二、沉淀溶解平衡原理的应用 1.沉淀的转化 (1)实验探究(2)实验结论:在一定条件下溶解能力相对较强的物质易转化为溶解能力相对较弱的物质。
2.沉淀的生成(1)调节pH 法:除去CuSO 4溶液中少量Fe 3+Cu(OH) 2或Cu 2(OH)2CO 3,调节pH 至3~4,使Fe 3+转化为Fe(OH) 3沉淀除去。
(2)加沉淀剂法误食可溶性钡盐,可用Na 2SO 4解毒,反应式为Ba 2++SO 2-4==BaSO 4↓;除去食盐溶液中的MgCl 2,可加入少量NaOH ,反应式为 Mg +2OH ==Mg(OH) 2↓。
3.4沉淀溶解平衡

1.8 10 [OH ] ( 2 ) ( 0.1 [Mg ]
-
K sp
1 2
11 1 2
) 1.3 10 5 mol L1
pH =9.1
pH值在3.2 ~ 9.1之间可使Fe3+定 量沉淀而使Mg2+不沉淀。
[Ca2+]×[CO32-] = 10-4 mol /L Q = [Ca2+]×[CO32-] = 10-8 >Ksp,CaCO3 因此有CaCO3沉淀生成。
3、25℃时AgCl和Mg(OH)2的Ksp分别为1.8×10-10和5.6×10-12 通过计算比较二者在水中的溶解量。 设AgCl在水中能溶解x mol/L,Mg(OH)2在水中溶解y mol/L: AgCl(s) Ag+(aq) + Cl- (aq) X X X Ksp= [Ag+][OH-] = X2 = 1.8×10-10 X=1.34 ×10-5 mol/L Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq) y y 2y Ksp= [Mg2+][OH-]2 = y(2y)2 = 4y3 =5.6×10-12 y = 1.12×10-4 mol/L 所以:AgCl在水中的溶解度较大。
正反应: 溶解 过程
逆反应: 沉淀 过程 2、影响平衡的因素:
①升温: 大多数正 向移动(大多数溶解为吸热) ②加水: 向移动 正
③加AgCl固体: 不
④加NaCl固体: 逆 ⑤加NaI固体: 正
向移动(加固体反应物,平衡不移) 向移动(加Cl— )
向移动 (结合Ag+ )
根据课本92页内容回答下列问题: 1、医院中进行钡餐透视时,用BaSO4做内服造影剂,为什么不用 BaCO3做内服造影剂?
难溶电解质的沉淀溶解平衡

难溶电解质的沉淀溶解平衡1. 引言你有没有想过,在我们的生活中,许多看似普通的事情背后,其实隐藏着一套复杂的化学原理?今天,我们就来聊聊一个听起来有点高大上的话题——难溶电解质的沉淀溶解平衡。
别担心,不用怕,这个词听起来像是在讲课,其实它背后可是有趣得很!就像一场关于水和盐的小戏剧,咱们来细细品味一下。
2. 难溶电解质的世界2.1 什么是难溶电解质?首先,咱们得知道,什么叫难溶电解质。
简单来说,难溶电解质就是在水中不容易溶解的盐,比如碳酸钙、硫酸钡这些。
它们就像个性十足的小家伙,宁愿呆在自己的小世界里,也不想和水混在一起。
你能想象吗?这些盐在水里就像石头一样,静静待着,不肯动弹。
2.2 沉淀与溶解的斗争然而,事情并没有那么简单。
虽然这些电解质在水中难以溶解,但它们仍然和水发生着一场“潜伏已久”的较量。
就像老江湖一样,沉淀(也就是不溶解的部分)和溶解(水中能形成的部分)之间总是有那么一丝丝微妙的平衡。
换句话说,水中的这些难溶电解质,虽不愿意溶解,却又总是会跟水“你来我往”。
这就像是在谈恋爱,一边拉扯,一边又互相吸引,真是纠缠不清!3. 沉淀溶解平衡的秘密3.1 平衡的奥秘那么,这种沉淀和溶解的平衡到底是怎么回事呢?这就涉及到一个叫做“化学平衡”的概念。
听起来有点复杂,其实就是在某种条件下,沉淀和溶解的速率相等时,整个系统就达到了平衡。
就像两个人打架,打着打着,突然决定休战,互不相扰。
每一秒都有一些盐溶解到水中,同时又有一些从水中沉淀出来。
这种微妙的平衡,才让难溶电解质在水中生存得如此“自在”。
3.2 影响因素但是,平衡可不是一成不变的哦!就像天气一样,今天阳光明媚,明天可能就下雨。
我们可以通过改变温度、压力,甚至是盐的浓度,来影响这个平衡。
比如说,温度一升高,盐的溶解度可能就会增加,沉淀的部分就会减少。
想象一下,天气热了,人们都想去海滩玩,盐也一样,想要“溶”进水里,享受那份清凉。
4. 生活中的应用4.1 实际例子那么,难溶电解质的沉淀溶解平衡在我们的生活中有什么用呢?其实,它们可谓无处不在哦!比如在水处理过程中,为了去除水中的杂质,往往需要利用这些难溶电解质进行沉淀反应。
难溶电解质的沉淀溶解平衡
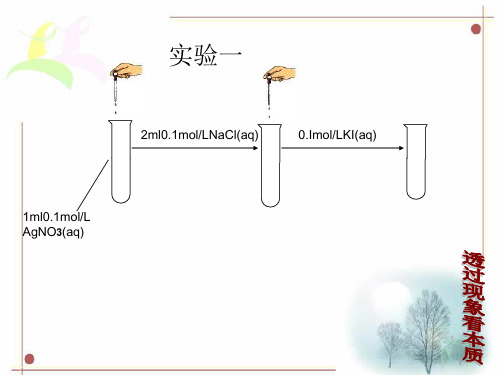
2ml0.1mol/LNaCl(aq)
0.Imol/LKI(aq)
1ml0.1mol/L AgNO3(aq)
一、 难溶电解质的溶解平衡
1、概念: 在一定条件下,当难溶电解质 v(溶解)= v (沉淀)时, 此时溶液中存在的溶解和沉淀间的动态平衡,称为沉 淀溶解平衡. 溶解平衡时的溶液是饱和溶液。
滴加0.5mol/L
Na2SO4(aq)
2C5a℃CO溶3解:1.度5 :×10-3g CaSO4:2.1 ×10-1g
注意:观察对比生成沉淀时Na2CO3(aq) 和Na2SO4(aq)的用量及实验现象。
水垢的主要成分:CaCO3、CaSO4、Mg(OH)2 如何除去水垢?
沉淀的溶解
实验三
CaCO3(S)
• 1、为什么医学上做胃部造影所服用的“钡餐”是 BaSO4而不是BaCO3?
• 2、为什么钙片的成分是CaCO3而不是CaSO4?
• 3、菠菜和豆腐为什么不宜同食?
• 4、如何预防肾结石[CaC2O4和Ca3(PO4)2]呢?
硬水的成分:是指含有较多Ca 、Mg 的水
——硬水的危害
1、全棉衣服或毛巾板结僵硬,多次洗涤后 颜色黯淡 。
2、洗澡后皮肤干燥、粗糙、发痒 。 3、热水器、增湿器、洗衣机等设备管路阻
塞、流量减小、寿命缩短 。
二、沉淀平衡的应用
沉淀的生成
实验二
滴加0.5mol/L
Na2CO3(aq)
CaCl2(aq) 0.5mol/L各1ml
①绝对不溶的电解质是没有的。
②同是难溶电解质,溶解度差别也很大。
b、外因:遵循平衡移动原理
①浓度: 加水,平衡向溶解的方向移动。 加入相同离子,平衡向沉淀方向移动。
人教版化学选修四——3.4难溶电解质的溶解平衡

二、沉淀反应的应用 1.沉淀的生成 (1)调节 pH 法 加入氨水调节 pH 至 7~8,可除去氯化铵中的杂质氯
Fe3++3NH3· 2O===Fe(OH)3↓+3NH+ H 化铁。反应离子方程式: 。 4
(2)加沉淀剂法 以 Na2S、H2S 等作沉淀剂,使 Cu2+、Hg2+等生成极难 溶的硫化物 CuS、HgS 等沉淀。反应离子方程式如下:
答案:BD
2. 已知: ℃时, sp[Mg(OH)2]=5.61×10-12, sp[MgF2] 25 K K =7.42×10-11。下列说法正确的是( )
A.25 ℃时,饱和 Mg(OH)2 溶液与饱和 MgF2 溶液相 比,前者的 c(Mg2+)大 B. ℃时, Mg(OH)2 的悬浊液中加入少量的 NH4Cl 25 在 固体,c(Mg2+)增大
, 。
知识点一 难溶物质的溶解平衡 【典例 1】 下列对沉淀溶解平衡的描述正确的是( A.反应开始时,溶液中各离子浓度相等 B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且 保持不变 D. 沉淀溶解达到平衡时, 如果再加入难溶性的该沉淀物将 促进溶解 )
第四节 难溶电解质的溶解平衡
授课人:李永丰 2013.11.15
一、溶解平衡及溶度积 1.溶解平衡 概念: 在一定温度下, 当沉淀 溶解 和 生成 的速率相等 时,固体质量、离子浓度不变的状态。
2.溶度积 概念:以 AmBn(s) mAn+ (aq)+nBm - (aq)为例,Ksp [c(An+)]m· [c(Bm-)]n。在一定温度下,K 是一个常数,称 =
CaCO3+2HCl===CaCl2+CO2↑+H2O
; 。
②自然界中矿物的转化 原 生 铜 的 硫 化 物 氧化、淋滤 ――→
难溶电解质的溶解平衡

难溶电解质的溶解平衡1.沉淀溶解平衡(1)概念在一定温度下,当难溶电解质溶于水形成饱和溶液时,沉淀溶解速率和沉淀生成速率相等的状态。
(2)溶解平衡的建立固体溶质溶解沉淀溶液中的溶质⎩⎪⎨⎪⎧v溶解大于v沉淀,固体溶解v溶解等于v沉淀,溶解平衡v溶解小于v沉淀,析出晶体(3)特点(4)表示AgCl在水溶液中的电离方程式为AgCl===Ag++Cl-。
AgCl的溶解平衡方程式为AgCl(s)Ag+(aq)+Cl-(aq)。
2.沉淀溶解平衡的影响因素(1)内因难溶电解质本身的性质。
溶度积(K sp)反映难溶电解质在水中的溶解能力。
对同类型的电解质而言,K sp数值越大,电解质在水中溶解度越大;K sp数值越小,难溶电解质的溶解度也越小。
(2)外因①浓度(K sp不变)a.加水稀释,平衡向溶解的方向移动;b.向平衡体系中加入难溶物相应的离子,平衡逆向移动;c.向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向溶解的方向移动。
②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解的方向移动,K sp 增大。
(3)实例 以AgCl (s )Ag +(aq )+Cl -(aq ) ΔH >0为例20 ℃时电解质在水中的溶解度与溶解性存在如下关系: (1)沉淀的生成 ①调节pH 法如除去CuCl 2溶液中的杂质FeCl 3,可以向溶液中加入CuO ,调节溶液的pH ,使Fe 3+形成Fe(OH)3沉淀而除去。
离子方程式为Fe 3++3H 2OFe(OH)3+3H +,CuO +2H+===Cu 2++H 2O 。
②沉淀剂法如用H 2S 沉淀Hg 2+的离子方程式为Hg 2++H 2S===HgS ↓+2H +。
(2)沉淀的溶解①酸溶解法:如CaCO 3溶于盐酸,离子方程式为CaCO 3+2H +===Ca 2++CO 2↑+H 2O 。
②盐溶解法:如Mg(OH)2溶于NH 4Cl 溶液,离子方程式为Mg(OH)2+2NH +4===Mg 2++2NH 3·H 2O 。
关于难溶电解质的沉淀溶解平衡

关于难溶电解质的沉淀溶解平衡●沉淀溶解平衡与电离平衡的区别:比如氢氧化铁:Fe(OH)3(s)Fe3++3OH-是沉淀溶解平衡;而Fe(OH)3(aq)Fe3++3OH-是电离平衡。
注意括号中的s、aq。
通常,(aq)可以省略不写,而(s)却不能省略不写。
当然,难溶强电解质只有沉淀溶解平衡,没有电离平衡。
●*难溶电解质的溶度积:一定温度下,难溶电解质的饱和溶液中,(难溶电解质的饱和溶液是极易获得的,只要有沉淀,就一定是饱和溶液!!)阳离子的浓度以其化学计量数(在溶解平衡的方程式中)为指数的幂与阴离子的浓度以其化学计量数(在溶解平衡的方程式中)为指数的幂的乘积为一常数,叫做溶度积常数,(不叫离子积常数!)简称为溶度积。
【参见课本p65.】记作Ksp 。
Ksp的几点用法:【以下计算是为了加深对于一些结论的理解,因为计算一般地都很麻烦,估计高考不会出现。
】1、与摩尔溶解度(用难溶电解质的饱和溶液中的溶质的物质的量浓度来表示的溶解度)互相换算。
(当然也可以与每100g水中,最多能够溶解的溶质质量g表示的溶解度继续换算。
)例1:已知常温下,硫酸钡的溶解度为0.000242g/100g水,求硫酸钡的溶度积。
解:先换算为摩尔溶解度。
硫酸钡这类难溶电解质的饱和溶液极稀,密度基本上仍然是1g/mL。
所以100g水形成的溶液认为是0.100L。
0.000242g硫酸钡的物质的量是0.000242g/233g·mol-1=1.039×10-6mol.所以摩尔溶解度为1.039×10-6mol/0.100L=1.039×10-5mol/L.那么,硫酸钡饱和溶液中C(Ba2+)= C(SO42-)=1.039×10-5mol/LKsp (BaSO4)=1.039×10-5×1.039×10-5=1.08×10-10【对于不同类型的难溶电解质,不能直接根据Ksp 的大小,来推断溶解度的大小。
3.4.1肾结石的预防——难溶电解质的沉淀溶解平衡+课件高二上学期化学人教版(2019)选择性必修1

化学式 Ba(OH)2 BaSO4 Ca(OH)2 CaSO4 Mg(OH)2 Fe(OH)3
溶解度/g 3.89
2.4×10-4 0.165 0.21 9×10-4 3×10-9
任务一:建立沉淀溶解平衡模型
1.宏观认识沉淀溶解平衡 实验探究:难溶物的溶解性探究
实验试剂:0.1mol/LAgNO3溶液、 0.1 mol/L NaCl溶液、0.1 mol/L MgCl2溶液、 0.1mol/L NaOH溶液、酚酞溶液、0.2mol/LNa2S溶液(Ag2S:黑色沉淀)
第三章 水溶液中的离子反应与平衡
肾结石为泌尿系常见病,多 发病,人群发病率1/20。病因是尿 液中成石物质浓度升高或溶解度 降低,析出晶体并局部生长聚积 形成结石。
肾结石的主要成分:CaC2O4
Ca2++C2O42- = CaC2O4↓
为什么多喝水能有效缓解肾结石?
还记得什么是溶解度吗?
一定温度下,某固体物质在100克溶剂中达到饱和状态时所 溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
BaSO4(s) ⇌ Ba2+(aq) + SO42- (aq) CaCO3(s) ⇌ Ca2+(aq) + CO32- (aq) Ag2S(s) ⇌ 2Ag2+(aq) +S2-(aq)
任务二:产生结石该怎么办?
沉淀溶解平衡的影响因素
【讨论】对于平衡CaC2O4(s) ⇌Ca2+ (aq)+ C2O42- (aq),改变下列条件,对其有何影响?
AgCl 难溶
Ca(OH)2 KClO3
微溶
可溶
NaCl 易溶
0.01
1
高考化学热点:难溶电解质的沉淀溶解平衡

难溶电解质的沉淀溶解平衡【热点思维】【热点释疑】1、怎样判断沉淀能否生成或溶解?通过比较溶度积与非平衡状态下溶液中有关离子浓度幂的乘积——离子积Q c的相对大小,可以判断难溶电解质在给定条件下沉淀生成或溶解的情况:Q c>K sp,溶液有沉淀析出;Q c=K sp,溶液饱和,沉淀的生成与溶解处于平衡状态;Q c<K sp,溶液未饱和,无沉淀析出。
2、如何理解溶度积(K sp)与溶解能力的关系?溶度积(K sp)反映了电解质在水中的溶解能力,对于阴阳离子个数比相同的电解质,K sp的数值越大,难溶电解质在水中的溶解能力越强;但对于阴阳离子个数比不同的电解质,不能通过直接比较K sp数值的大小来判断难溶电解质的溶解能力。
3、沉淀溶解平衡有哪些常考的知识点?沉淀生成的两大应用①分离离子:对于同一类型的难溶电解质,如向含有等浓度的Cl-、Br-、I-的混合溶液中滴加AgNO3溶液,AgCl、AgBr、AgI中溶度积小的物质先析出,溶度积大的物质后析出。
②控制溶液的pH来分离物质,如除去CuCl2中的FeCl3就可向溶液中加入CuO 或Cu(OH)2等物质,将Fe3+转化为Fe(OH)3而除去。
【热点考题】【典例】实验:①0.1 mol·L-1 AgNO3溶液和0.01 mol·L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加饱和KI溶液,沉淀变为黄色。
下列分析正确的是()A.通过实验①②证明浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶【答案】C【对点高考】【2014年高考上海卷第11题】向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中()A.c(Ca2+)、c(OH-)均增大B.c(Ca2+)、c(OH-)均保持不变C.c(Ca2+)、c(OH-)均减小D.c(OH-)增大、c(H+)减小【答案】B【解析】试题分析:碳化钙溶于水与水反应生成氢氧化钙和乙炔,反应的化学方程式为CaC2+2H2O→Ca(OH)2+HC≡CH↑。
3.4 沉淀溶解平衡(沉淀溶解平衡的应用(1)沉淀生成、溶解)高二化学(人教版2019选择性必修1)

Mg2+(aq) + 2OH-(aq) + H+
H2O
解释:对于Mg(OH)2的沉淀溶解平衡,H+与OH-反应,使c(OH-)减 小,使Q<Ksp,平衡向沉淀溶解的方向移动,只要盐酸足够,沉淀完全溶 解。
教学过程
沉淀溶解方法总结:
① 酸溶法:如CaCO3溶于盐酸,Al(OH)3、Cu(OH)2溶于强酸等。 ② 盐溶法:如Mg(OH)2溶于NH4Cl溶液
二、沉淀的溶解
查阅资料可知:锅炉内水垢 主要成分有Mg(OH)2、CaCO3、 CaSO4 等。
请运用沉淀溶解平衡的原理解释去除水垢的原因
教学过程
对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离 子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
Mg(OH)2(s) CaCO3(s)
课堂练习
典例1. 已知常温下CaCO3的Ksp=3.4×10-9,CaSO4的Ksp=4.9×10-5,将CaCO3与
CaSO4的饱和溶液等体积混合,再加入足量浓CaCl2溶液,下列说法正确的是( ) A.只产生CaCO3沉淀 B.产生等量的CaCO3和CaSO4沉淀 C.产生的CaSO4沉淀更多 D.产生的CaCO3沉淀更多
【答案】C 【解析】AgCl和Ag2CrO4的阴、阳离子配比类型不同,不能直接利用Ksp来比较二者溶解能力的 大小,所以只有C项正确;其余三项叙述均错误。若用溶度积比较溶解度大小,必须是同类型的 难溶电解质,否则不能直接比较。
课后小任务
思考:龋齿俗称蛀牙,是口腔的常见病之一。那么,龋齿是怎样发生的呢?
人教版选择性必修1
第四节 沉淀溶解平衡
第2课时 沉淀溶解平衡的应用1(沉淀生成、溶解)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2HCO3CaCO3 +H2O+CO2 Ca2++2HCO3-
课堂练习
1.一定条件下,强电解质溶解成离子的速 率等于离子重新结合成沉淀的速率,溶液中各 离子的浓度保持不变的状态:沉淀溶解平衡。 2.习惯上将溶解度小于0.01g的电解质称为 难溶电解质 。
课堂小结
(1).AgCl沉淀特点: ①Ag+和Cl-之间存在着强烈的相互作用; ②AgCl在水中的溶解度确实很小; ③在一定条件下,AgCl在水中的溶解可以 处于平衡状态。 (2).AgCl在溶液中的两个过程: ①在水分子的作用下,少量Ag+和Cl-脱离 AgCl的表面溶入水中。
第四单元 难溶电解质的沉淀溶解平衡
思考:碳酸钙沉淀物是否可以溶解呢? Ag+和Cl-反应生成难溶物AgCl,Ag+和 Cl-的反应真能进行到底吗?
教学目标
知识目标
1.了解难溶电解质在水中的溶解情况。 2.理解难溶电解质在水中的沉淀溶解平衡特点, 正确理解和掌握溶度积KSP的概念及其与物质 溶解性的关系。 3.能够分析沉淀的溶解、生成和沉淀的转化。 4.掌握利用KSP的表达式计算溶液中相关离子 的浓度。 5.了解沉淀溶解平衡在生产、生活中的应用。
①.在水分子的作用 下,少量Ag+和Cl脱离AgCl的表面溶 入水中。
②.溶液中的Ag+和Cl-受AgCl的 表面正、负离子的吸引,回到 AgCl的表面析出——沉淀。
在一定温度下,当沉淀溶解和生成的 速率相等时,得到AgCl的饱和溶液,即建 立下列动态平衡:
溶解
AgCl(s)
沉淀
Cl (aq)+Ag(aq)
溶度积常数(见p419附表6)
化学式 AgCl AgBr AgI Ag2CrO4 BaCO3 BaSO4 CaCO3 CaF2 CaSO4 CuS Ksp 1.56×10-10 7.7×11×10-9 1.08×10-10 8.7×10-9 3.95×10-11 1.96×10-4 8.5×10-45 化学式 Cu2S CuCl Fe(OH)2 Fe(OH)3 HgS Li2CO3 MgCO3 Mg(OH)2 PbSO4 ZnS Ksp 2×10-47 1.02×10-6 1.64×10-14 1.1×10-36 4×10-53 1.7×10-3 2.6×10-5 1.2×10-11 1.06×10-8 1.2×10-23
-
+
通常,我们习惯认为AgCl是“难溶”性物 质,AgNO3溶液与NaCl溶液的反应是“不可逆 反应”,现在看来,这些都不是绝对的 。
不同电解质在水中的溶解度差别很大,例如 AgCl和AgNO3,但难溶电解质与易溶电解质之间 并无严格的界限,习惯上将溶解度小于0.01g的电 解质称为难溶电解质。
难溶 0.01 微溶 可溶 易溶 10 S /g
美丽的溶洞
自然界一些溶解度下的矿物转化为溶解度更 小的矿物的现象。
钟乳石(stalactite),
又称钟乳石,是指碳酸盐岩 地区洞穴内在漫长地质历史 中和特定地质条件下形成的 石钟乳、石笋、石柱等不同 形态碳酸钙沉淀物的总称, 它的形成往往需要上万年或 几十万年时间。由于形成时 间漫长,钟乳石对远古地质 考察有着重要的研究价值。
理由:难溶是相对的,难溶电解质PbI2中加 入蒸馏水,水中存在Pb2+和I-,上层澄清的 溶液是PbI2的饱和溶液。
4、当沉淀的质量不再发生变化时,溶解停 止了吗? 理由:没有。沉淀继续溶解,溶液中的离 子也继续结合生成沉淀,建立一个动态的 沉淀溶解平衡。
沉淀的溶解
CaCO3
Ca2+ + CO32+ H2O+CO2
1
溶解度与溶解性的关系:20℃ 难溶电解质的溶解度尽管很小,但不会等于 0, 如Ag2S。因此,难溶电解质在水中都存在类似于上 述AgCl沉淀在水中的溶解平衡。
1、沉淀溶解平衡: 在一定温度下,对于难溶性电解质来说, 当沉淀溶解的速率和沉淀生成的速率相等 时,形成饱和溶液,达到平衡状态,人们 把这种平衡称为沉淀溶解平衡。
思考:
难溶电解质的沉淀溶解平衡与难电离物质的电离平 衡有什么区别和联系? 难溶电解质可以是强电解质或弱电解质,如BaSO4、 Al(OH)3 ;而难电离物质只能是弱电解质。 从变化过程看,沉淀溶解平衡是指已溶解的溶质与 未溶解的物质之间形成的沉淀与溶解的平衡状态; 而电离平衡是指已经溶解在溶液中的弱电解质分子 与离子之间的转化达到平衡状态。
3、浓度积常数KSP与浓度商Qc的关系: 若Qc <KSP ,溶液为未饱和溶液,体系中 无沉淀生成; 若Qc =KSP ,溶液为饱和溶液,体系处 于平衡状态; 若Qc >KSP ,溶液为过饱和溶液,体系 中有沉淀生成。 如: AmBn mAn++nBm浓度商Qc =Cm(An+)* Cn(Bm-)
②溶液中的Ag+和Cl-受AgCl的表面正、负离 子的吸引,回到AgCl的表面析出——沉淀。
一、沉淀溶解平衡原理:
1、沉淀溶解平衡 2、平衡常数Ksp
3、浓度积常数KSP与浓度 商Qc的关系: 若Qc <KSP , 无沉淀生成; 若Qc =KSP ,平衡状态; 若Qc >KSP ,有沉淀生成。
练习:将等体积的4×10-3mol· L-1的AgNO3和 4×10-3mol· L-1的K2CrO4溶液混合是否能析出 Ag2CrO4沉淀?Ksp(Ag2CrO4)=1.0×10-12 解:混合后因Ag2CrO4 2Ag++CrO42c(Ag+)=2×10-3mol· L-1, c(CrO42-)=2×10-3mol· L-1 Qc=c2(Ag+)×c(CrO42-) =(2×10-3)2×2×10-3=8×10-9 Qc>Ksp ∴有沉淀析出。 答:能析出Ag2CrO4沉淀。
能力目标
1.运用平衡移动原理分析、解决沉淀的生成,沉 淀的转化和溶解问题。 2.了解难溶电解质的沉淀溶解平衡及沉淀溶解平 衡的应用。
情感态度与价值观
1.领会“本质决定现象,现象是本质的具体体 现”的科学思想。 2.体会“实验方法、逻辑推理、科学抽象法” 在自然科学研究中的应用。
教学重难点
重点
难溶电解质的沉淀溶解平衡。
难点
难溶电解质的溶解、生成,溶度积 KSP
一、沉淀溶解平衡原理
谈谈你对酸、碱和盐的溶解度表中“溶”与 “难溶”的理解。
一般可用溶解度的大小来衡量物质在水中 溶解能力的大小。 物质 难溶物 微溶物 可溶物 易溶物 溶解度(g/100g水) < 0.01 0.01~1 1~10 > 10
根据对溶解度及反应限度、化学平衡原理的 认识,说明生成沉淀的离子反应是否能真正 进行到底。 化学式 溶解度/g AgCl 1.5×10-4 Ba(OH)2 AgNO3 3.89 222 BaSO4 2.4×10-4
几种电解质的溶解度(20℃)
生成沉淀的离子反应所以能够发生,在于生 成的溶解度小。
尽管AgCl溶解度很小,但并不是绝对不溶, 生成的AgCl沉淀会有少量溶解。 生成AgCl沉淀后的溶液中三种有关反应的粒 子在反应体系中共存:
Ag+ + Cl-
AgCl
AgCl在溶液中的两个过程:
ClAg+ Ag+ ClAg+ Ag+ ClClClAg+
简答:1、在装有少量难溶PbI2黄色固体的试 管中加入少量蒸馏水,充分振荡后静置,观察 现象。 现象:过一段时间后,试管底部仍有少量黄 色沉淀,上层是澄清的溶液。 2、待上层溶液澄清后,向其中滴入几滴0.1 mol/L的KI溶液,观察现象。
现象:澄清的溶液中出现黄色沉淀。
3、你能解释1和2中出现的实验现象吗?
2、平衡常数 用来描述难溶电解质在水中的沉淀溶解平衡, 其平衡常数称为溶度积常数或简称溶度积,用 KSP来表示。 如反应 : AmBn mAn++nBmKSP=Cm(An+)* Cn(Bm-) KSP 的大小反应难溶电解质在水中的溶解能力, 只与难溶电解质的性质和温度有关,与沉淀的 量无关。在一定温度下, KSP为常数。
