碘离子标准电极电势
标准电极电势(精)

-2.925
-2.924
-2.923
-2.90
-2.87
-2.714
-2.375
-2.07
-1.66
-1.182
-0.763
-0.74
-0.69
-0.49
-0.48
-0.44
-0.277 -0.246 -0.152 -0.136 -0.126 -0.036 -0.02 0.000 +0.071 +0.08 +0.141 +0.154 +0.159 +0.17 +0.2223 +0.2676 +0.337 +0.36 +0.37
O2 + 4H+ + 4e ?2H2O
Cr2O72- + 14H+ + 6e ?2Cr3+ + 7H2O Cl2 + 2e ?2Cl-
BrO3- + 6H+ + 6e ?Br- + 3H2O
ClO3- + 6H+ + 6e ?Cl- + 3H2O
PbO2 + 4H+ + 2e ?Pb2+ + 2H2O
-1.405
-1.26
-1.216
-1.21
-1.04
-0.909
-0.8277
-0.67
-0.66
-0.66
-0.56
-0.447
-0.224
-0.09 -0.076 -0.05 +0.01 +0.09 +0.1 +0.26 +0.33 +0.373 +0.401 +0.49 +0.54 +0.56 +0.564 +0.588 +0.61 +0.62 +0.76 +0.88
最全的标准电极电势(无表格版)

——标准电极电势表—-1 在酸性溶液中(298K)电对方程式E/VLi(I)-(0) Li++e-=Li -3。
0401 Cs(I)-(0)Cs++e-=Cs -3。
026 Rb(I)-(0) Rb++e-=Rb -2。
98 K(I)-(0)K++e-=K -2。
931 Ba(II)-(0)Ba2++2e-=Ba -2。
912 Sr(II)-(0)Sr2++2e-=Sr -2。
89 Ca(II)-(0) Ca2++2e-=Ca -2。
868 Na(I)-(0)Na++e-=Na -2。
71 La(III)-(0) La3++3e-=La -2.379 Mg(II)-(0)Mg2++2e-=Mg -2。
372 Ce(III)-(0) Ce3++3e-=Ce -2。
336 H(0)-(-I) H2(g)+2e-=2H--2.23Al(III)-(0) AlF63-+3e-=Al+6F--2.069 Th(IV)-(0)Th4++4e-=Th -1.899 Be(II)-(0)Be2++2e-=Be -1。
847 U(III)-(0)U3++3e-=U -1.798 Hf(IV)-(0)HfO2++2H++4e-=Hf+H2O -1。
724 Al(III)-(0)Al3++3e-=Al -1。
662 Ti(II)-(0) Ti2++2e-=Ti -1.630Zr(IV)-(0)ZrO2+4H++4e-=Zr+2H2O -1.553 Si(IV)-(0)[SiF6]2-+4e-=Si+6F--1。
24 Mn(II)-(0)Mn2++2e-=Mn -1.185 Cr(II)-(0)Cr2++2e-=Cr -0。
913 Ti(III)-(II)Ti3++e-=Ti2+-0。
9B(III)-(0) H3BO3+3H++3e-=B+3H2O -0。
8698 *Ti(IV)-(0)TiO2+4H++4e-=Ti+2H2O -0。
(完整版)标准电极电势表(非常全)

标准电极电势Standard Electrode Potentials下表中所列的标准电极电势(25.0℃,101.325kPa)是相对于标准氢电极电势的值。
标准氢电极电势被规定为零伏特(0.0V)。
序号(No.)电极过程(Electrode process)EÅ/V 1Ag++e═Ag0.79962Ag2++e═Ag+ 1.983AgBr+e═Ag+Br-0.07134AgBrO3+e═Ag+BrO3-0.5465AgCl+e═Ag+Cl-0.2226AgCN+e═Ag+CN--0.0177Ag2CO3+2e═2Ag+CO32-0.478Ag2C2O4+2e═2Ag+C2O42-0.4659Ag2CrO4+2e═2Ag+CrO42-0.44710AgF+e═Ag+F-0.77911Ag4[Fe(CN)6]+4e═4Ag+[Fe(CN)6]4-0.14812AgI+e═Ag+I--0.152 13AgIO3+e═Ag+IO3-0.35414Ag2MoO4+2e═2Ag+MoO42-0.45715[Ag(NH3)2]++e═Ag+2NH30.37316AgNO2+e═Ag+NO2-0.56417Ag2O+H2O+2e═2Ag+2OH-0.342182AgO+H2O+2e═Ag2O+2OH-0.60719Ag2S+2e═2Ag+S2--0.691 20Ag2S+2H++2e═2Ag+H2S-0.0366 21AgSCN+e═Ag+SCN-0.0895 22Ag2SeO4+2e═2Ag+SeO42-0.36323Ag2SO4+2e═2Ag+SO42-0.65424Ag2WO4+2e═2Ag+WO42-0.46625Al3+3e═Al-1.662 26AlF63-+3e═Al+6F--2.069 27Al(OH)3+3e═Al+3OH--2.3128AlO2-+2H2O+3e═Al+4OH--2.3529Am3++3e═Am-2.048 30Am4++e═Am3+ 2.631AmO22++4H++3e═Am3++2H2O 1.7532As+3H++3e═AsH3-0.608 33As+3H2O+3e═AsH3+3OH--1.3734As2O3+6H++6e═2As+3H2O0.23435HAsO2+3H++3e═As+2H2O0.24836AsO2-+2H2O+3e═As+4OH--0.6837H3AsO4+2H++2e═HAsO2+2H2O0.5638AsO43-+2H2O+2e═AsO2-+4OH--0.7139AsS2-+3e═As+2S2--0.7540AsS43-+2e═ AsS2-+2S2--0.641Au++e═Au 1.69242Au3++3e═Au 1.49843Au3++2e═Au+ 1.401 44AuBr2-+e═Au+2Br-0.959 45AuBr4-+3e═Au+4Br-0.854 46AuCl2-+e═Au+2Cl- 1.15 47AuCl4-+3e═Au+4Cl- 1.002 48AuI+e═Au+I-0.5 49Au(SCN)4-+3e═Au+4SCN-0.66 50Au(OH)3+3H++3e═Au+3H2O 1.45 51BF4-+3e═B+4F--1.04 52H2BO3-+H2O+3e═B+4OH--1.79 53B(OH)3+7H++8e═BH4-+3H2O-0.0481 54Ba2++2e═Ba-2.912 55Ba(OH)2+2e═Ba+2OH--2.99 56Be2++2e═Be-1.847 57Be2O32-+3H2O+4e═2Be+6OH--2.63 58Bi++e═Bi0.5 59Bi3++3e═Bi0.308 60BiCl4-+3e═Bi+4Cl-0.16 61BiOCl+2H++3e═Bi+Cl-+H2O0.16 62Bi2O3+3H2O+6e═2Bi+6OH--0.46 63Bi2O4+4H++2e═2BiO++2H2O 1.593 64Bi2O4+H2O+2e═ Bi2O3+2OH-0.56 65Br2(水溶液,aq)+2e═2Br- 1.087 66Br2(液体)+2e═2Br- 1.066 67BrO-+H2O+2e═Br-+2OH0.761 68BrO3-+6H++6e═Br-+3H2O 1.423 69BrO3-+3H2O+6e═Br-+6OH-0.61 702BrO3-+12H++10e═Br2+6H2O 1.482 71HBrO+H++2e═Br-+H2O 1.331 722HBrO+2H++2e═Br2(水溶液,aq)+2H2O 1.574 73CH3OH+2H++2e═CH4+H2O0.59 74HCHO+2H++2e═CH3OH0.19 75CH3COOH+2H++2e═CH3CHO+H2O-0.12 76(CN)2+2H++2e═2HCN0.373 77(CNS)2+2e═2CNS-0.77 78CO2+2H++2e═CO+H2O-0.12 79CO2+2H++2e═HCOOH-0.199 80Ca2++2e═Ca-2.868 81Ca(OH)2+2e═Ca+2OH--3.02 82Cd2++2e═Cd-0.403 83Cd2++2e═Cd(Hg)-0.352 84Cd(CN)42-+2e═Cd+4CN--1.09 85CdO+H2O+2e═Cd+2OH--0.783 86CdS+2e═Cd+S2--1.17 87CdSO4+2e═Cd+SO42--0.246 88Ce3++3e═Ce-2.336 89Ce3++3e═Ce(Hg)-1.437 90CeO2+4H++e═Ce3++2H2O 1.4 91Cl2(气体)+2e═2Cl- 1.35892ClO-+H2O+2e═Cl-+2OH-0.89 93HClO+H++2e═Cl-+H2O 1.482 942HClO+2H++2e═Cl2+2H2O 1.611 95ClO2-+2H2O+4e═Cl-+4OH-0.76 962ClO3-+12H++10e═Cl2+6H2O 1.47 97ClO3-+6H++6e═Cl-+3H2O 1.451 98ClO3-+3H2O+6e═Cl-+6OH-0.62 99ClO4-+8H++8e═Cl-+4H2O 1.38 1002ClO4-+16H++14e═Cl2+8H2O 1.39 101Cm3++3e═Cm-2.04 102Co2++2e═Co-0.28 103[Co(NH3)6]3++e═[Co(NH3)6]2+0.108 104[Co(NH3)6]2++2e═Co+6NH3-0.43 105Co(OH)2+2e═Co+2OH--0.73 106Co(OH)3+e═Co(OH)2+OH-0.17 107Cr2++2e═Cr-0.913 108Cr3++e═Cr2+-0.407 109Cr3++3e═Cr-0.744 110[Cr(CN)6]3-+e═[Cr(CN)6]4--1.28 111Cr(OH)3+3e═Cr+3OH--1.48 112Cr2O72-+14H++6e═2Cr3++7H2O 1.232 113CrO2-+2H2O+3e═Cr+4OH--1.2 114HCrO4-+7H++3e═Cr3++4H2O 1.35 115CrO42-+4H2O+3e═Cr(OH)3+5OH--0.13 116Cs++e═Cs-2.92 117Cu++e═Cu0.521 118Cu2++2e═Cu0.342 119Cu2++2e═Cu(Hg)0.345 120Cu2++Br-+e═CuBr0.66 121Cu2++Cl-+e═CuCl0.57 122Cu2++I-+e═CuI0.86 123Cu2++2CN-+e═[Cu(CN)2]- 1.103 124CuBr2-+e═Cu+2Br-0.05 125CuCl2-+e═Cu+2Cl-0.19 126CuI2-+e═Cu+2I-0 127Cu2O+H2O+2e═2Cu+2OH--0.36 128Cu(OH)2+2e═Cu+2OH--0.222 1292Cu(OH)2+2e═Cu2O+2OH-+H2O-0.08 130CuS+2e═Cu+S2--0.7 131CuSCN+e═Cu+SCN--0.27 132Dy2++2e═Dy-2.2 133Dy3++3e═Dy-2.295 134Er2++2e═Er-2 135Er3++3e═Er-2.331 136Es2++2e═Es-2.23 137Es3++3e═Es-1.91 138Eu2++2e═Eu-2.812 139Eu3++3e═Eu-1.991 140F2+2H++2e═2HF 3.053190IO3-+2H2O+4e═IO-+4OH-0.15 191IO3-+3H2O+6e═I-+6OH-0.26 1922IO3-+6H2O+10e═I2+12OH-0.21 193H5IO6+H++2e═IO3-+3H2O 1.601 194In++e═In-0.14 195In3++3e═In-0.338 196In(OH)3+3e═In+3OH--0.99 197Ir3++3e═Ir 1.156 198IrBr62-+e═ IrBr63-0.99 199IrCl62-+e═IrCl63-0.867 200K++e═K-2.931 201La3++3e═La-2.379 202La(OH)3+3e═La+3OH--2.9 203Li++e═Li-3.04 204Lr3++3e═Lr-1.96 205Lu3++3e═Lu-2.28 206Md2++2e═Md-2.4 207Md3++3e═Md-1.65 208Mg2++2e═Mg-2.372 209Mg(OH)2+2e═Mg+2OH--2.69 210Mn2++2e═Mn-1.185 211Mn3++3e═Mn 1.542 212MnO2+4H++2e═Mn2++2H2O 1.224 213MnO4-+4H++3e═MnO2+2H2O 1.679 214MnO4-+8H++5e═Mn2++4H2O 1.507 215MnO4-+2H2O+3e═MnO2+4OH-0.595 216Mn(OH)2+2e═Mn+2OH--1.56 217Mo3++3e═Mo-0.2 218MoO42-+4H2O+6e═Mo+8OH--1.05 219N2+2H2O+6H++6e═2NH4OH0.092 2202NH3OH++H++2e═N2H5++2H2O 1.42 2212NO+H2O+2e═N2O+2OH-0.76 2222HNO2+4H++4e═N2O+3H2O 1.297 223NO3-+3H++2e═HNO2+H2O0.934 224NO3-+H2O+2e═NO2-+2OH-0.01 2252NO3-+2H2O+2e═N2O4+4OH--0.85 226Na++e═Na-2.713 227Nb3++3e═Nb-1.099 228NbO2+4H++4e═Nb+2H2O-0.69 229Nb2O5+10H++10e═2Nb+5H2O-0.644 230Nd2++2e═Nd-2.1 231Nd3++3e═Nd-2.323 232Ni2++2e═Ni-0.257 233NiCO3+2e═Ni+CO32--0.45 234Ni(OH)2+2e═Ni+2OH--0.72 235NiO2+4H++2e═Ni2++2H2O 1.678 236No2++2e═No-2.5 237No3++3e═No-1.2 238Np3++3e═Np-1.856239NpO2+H2O+H++e═Np(OH)3-0.962 240O2+4H++4e═2H2O 1.229 241O2+2H2O+4e═4OH-0.401 242O3+H2O+2e═O2+2OH- 1.24 243Os2++2e═Os0.85 244OsCl63-+e═Os2++6Cl-0.4 245OsO2+2H2O+4e═Os+4OH--0.15 246OsO4+8H++8e═Os+4H2O0.838 247OsO4+4H++4e═OsO2+2H2O 1.02 248P+3H2O+3e═PH3(g)+3OH--0.87 249H2PO2-+e═P+2OH--1.82 250H3PO3+2H++2e═H3PO2+H2O-0.499 251H3PO3+3H++3e═P+3H2O-0.454 252H3PO4+2H++2e═H3PO3+H2O--0.276 253PO43-+2H2O+2e═HPO32-+3OH--1.05 254Pa3++3e═Pa-1.34 255Pa4++4e═Pa-1.49 256Pb2++2e═Pb-0.126 257Pb2++2e═Pb(Hg)-0.121 258PbBr2+2e═Pb+2Br--0.284 259PbCl2+2e═Pb+2Cl--0.268 260PbCO3+2e═Pb+CO32--0.506 261PbF2+2e═Pb+2F--0.344 262PbI2+2e═Pb+2I--0.365 263PbO+H2O+2e═Pb+2OH--0.58 264PbO+4H++2e═Pb+H2O0.25 265PbO2+4H++2e═Pb2+2H2O 1.455 266HPbO2-+H2O+2e═Pb+3OH--0.537 267PbO2+SO42-+4H++2e═PbSO4+2H2O 1.691 268PbSO4+2e═Pb+SO42--0.359 269Pd2++2e═Pd0.915 270PdBr42-+2e═Pd+4Br-0.6 271PdO2+H2O+2e═PdO+2OH-0.73 272Pd(OH)2+2e═Pd+2OH-0.07 273Pm2++2e═Pm-2.2 274Pm3++3e═Pm-2.3 275Po4++4e═Po0.76 276Pr2++2e═Pr-2 277Pr3++3e═Pr-2.353 278Pt2++2e═Pt 1.18 279[PtCl6]2-+2e═[PtCl4]2-+2Cl-0.68 280Pt(OH)2+2e═Pt+2OH-0.14 281PtO2+4H++4e═Pt+2H2O1 282PtS+2e═Pt+S2--0.83 283Pu3++3e═Pu-2.031 284Pu5++e═Pu4+ 1.099 285Ra2++2e═Ra-2.8 286Rb++e═Rb-2.98 287Re3++3e═Re0.3337Th4++4e═Th-1.899 338Ti2++2e═Ti-1.63 339Ti3++3e═Ti-1.37 340TiO2+4H++2e═Ti2++2H2O-0.502 341TiO2++2H++e═Ti3++H2O0.1 342Tl++e═Tl-0.336 343Tl3++3e═Tl0.741 344Tl3++Cl-+2e═TlCl 1.36 345TlBr+e═Tl+Br--0.658 346TlCl+e═Tl+Cl--0.557 347TlI+e═Tl+I--0.752 348Tl2O3+3H2O+4e═2Tl++6OH-0.02 349TlOH+e═Tl+OH--0.34 350Tl2SO4+2e═2Tl+SO42--0.436 351Tm2++2e═Tm-2.4 352Tm3++3e═Tm-2.319 353U3++3e═U-1.798 354UO2+4H++4e═U+2H2O-1.4 355UO2++4H++e═U4++2H2O0.612 356UO22++4H++6e═U+2H2O-1.444 357V2++2e═V-1.175 358VO2++2H++e═V3++H2O0.337 359VO2++2H++e═VO2++H2O0.991 360VO2++4H++2e═V3++2H2O0.668 361V2O5+10H++10e═2V+5H2O-0.242 362W3++3e═W0.1 363WO3+6H++6e═W+3H2O-0.09 364W2O5+2H++2e═2WO2+H2O-0.031 365Y3++3e═Y-2.372 366Yb2++2e═Yb-2.76 367Yb3++3e═Yb-2.19 368Zn2++2e═Zn-0.7618 369Zn2++2e═Zn(Hg)-0.7628 370Zn(OH)2+2e═Zn+2OH--1.249 371ZnS+2e═Zn+S2--1.4 372ZnSO4+2e═Zn(Hg)+SO42--0.799。
最全最实用的电极电势表

最全最实用的电极电势表新年快到了想写一篇化学方面的文章作为总结吧,但是要查很多资料,事情也多,拖到现在。
其实这个电极电势,标准电极电势表,我读化学的时候就比较感兴趣,因为可以用它来判断元素和化合物在标准状况下氧化性,还原性的强弱,当时有些地方是不懂的,比如g,s都是什么意思,那个氟的标准电极电势是怎么来的,老师没有多讲,只是让我们记住常用的氧化剂,还原剂的电极电势数值就行了。
电极电势表,许多化学书,包括网上,有很多的,当然数据来源不同,数值有差别也是正常的,不能说谁对谁错。
我自己动手做个电极电势表,我的口的是实用,元素周期表118个元素,化合物更是成千上万,我们不可能一个一个去记住,知道常见的即可;有些数据化学家那里也是没有的。
另外既然标题有这个“最” 字,就要满足学生,以及化学爱好者的愿望,比如LI前最强的氧化剂是什么,最强的还原剂是什么,最实用的氧化剂是什么,等等;对于有异议的给予说明。
我列出的电极电势表将去除不常用的氧化剂和还原剂;对于零度以下不能存在的不在列出,比如二氟化二氧,虽然它在零下100度就有极强的氧化能力,如:在零下100度将钎迅速氧化到+6价,而氟,三氟化氯常温,甚至加热也不能将杯氧化到+6价氟只能将环氧化到+4价,+6价需要700摄氏度,用强紫外线照射才能发生反应;将氤氧化到+6价,氟需要加压加热。
但它在零下93度就会显著分解,零下57度迅速分解完。
大家只要知道它即使在极低温下氧化性也比氟强即可关于自由基,只列出疑基自由基OH-,其他象OF, XeF, KrF自山基,这些都属于很少见,瞬间存在的东西,这儿个自山基的氧化性以KrF最强,XeF最弱,我看到有些化学书籍上说XeF自山基的电极电势数值为3. 4,这个数值应该是佔汁值,XeF在普通条件下是不存在的,只是在加热或者强光照射合成二氟化氤,四氟化氤,六氟化氛的时候瞬间存在。
疑基自山基这个是常见的自111基,水溶液里就有。
如果把XeF列上,那么氮离子也可以列上。
标准电极电势表

V(OH) +4H++5e-=V+4H2O
Ti2++2e-=Ti
W2O5+2H++2e-=2WO2+H2O
Ti3++e-=Ti2+
WO2+4H++4e-=W+2H2O
TiO2++2H++e-=Ti3++H2O
WO3+6H++6e-=W+3H2O
TiO2+4H++2e-=Ti2++2H2O
HClO+H++2e-=Cl-+H2O
Ag2C2O4+2e-=2Ag+C2
7
ClO2+H++e-=HClO2
AgCl+e-=Ag+Cl-
HClO2+2H++2e-=HClO+H2O
Ag2CO3+2e-=2Ag+CO
HClO2+3H++3e-=1/2Cl2+2H2O
Ag2CrO4+2e-=2Ag+Cr
La(OH)3+3e-=La+3OH-
Br +3H2O+6e-=Br-+6OH-
Mg(OH)2+2e-=Mg+2OH-
Ca(OH)2+2e-=Ca+2OH-
MnO4-+2H2O+3e-=MnO2+4OH-
Ca(OH)2+2e-=Ca(Hg)+2OH-
Mn +2H2O+2e-=MnO2+4OH-
ClO-+H2O+2e-=Cl-+2OH-
Co(OH)3+e-=Co(OH)2+OH-
Ni(OH)2+2e-=Ni+2OH-
Cr +2H2O+3e-=Cr+4OH-
NiO2+2H2O+2e-=Ni(OH)2+2OH-
Cr +4H2O+3e-=Cr(OH)3+5OH-
O2+H2O+2e-=HO2-+OH-
Cr(OH)3+3e-=Cr+3OH-
SO +4H++2e-=H2SO3+H2O
高中化学电极电势计算方法与原理

高中化学电极电势计算方法与原理化学电势是化学反应发生时产生的电能与电荷之间的关系。
在化学反应中,电子的转移会引起电势的变化,而电极电势则是用来描述这种变化的物理量。
在高中化学学习中,电极电势的计算是一个重要的考点。
本文将介绍电极电势的计算方法与原理,并通过具体的例子来说明。
一、电极电势的计算方法电极电势的计算方法主要有两种:标准电极电势法和Nernst方程法。
1. 标准电极电势法标准电极电势是指在标准状态下,电极与溶液中的氢离子浓度为1mol/L时的电极电势。
标准电极电势可以通过测量电池的电动势来确定。
在标准电极电势法中,电极电势的计算公式为:E°cell = E°cathode - E°anode其中,E°cell为电池的标准电动势,E°cathode为还原电极的标准电极电势,E°anode为氧化电极的标准电极电势。
举例说明:计算以下电池的标准电动势。
Cu(s) | Cu2+(aq, 0.1M) || Ag+(aq, 0.01M) | Ag(s)根据标准电极电势表,Cu2+/Cu的标准电极电势为0.34V,Ag+/Ag的标准电极电势为0.80V。
代入计算公式:E°cell = 0.80V - 0.34V = 0.46V因此,该电池的标准电动势为0.46V。
2. Nernst方程法Nernst方程是用来计算非标准电极电势的方法。
根据Nernst方程,非标准电极电势的计算公式为:Ecell = E°cell - (RT/nF) * ln(Q)其中,Ecell为非标准电极电势,E°cell为标准电极电势,R为理想气体常数,T为温度(单位为开尔文),n为电子转移数,F为法拉第常数,Q为反应物浓度的乘积与生成物浓度的乘积的比值。
举例说明:计算以下电池在25°C下的电动势。
Zn(s) | Zn2+(aq, 0.1M) || Cu2+(aq, 0.01M) | Cu(s)根据标准电极电势表,Zn2+/Zn的标准电极电势为-0.76V,Cu2+/Cu的标准电极电势为0.34V。
标准电极定律

标准电极定律标准电极定律是电化学研究中的重要理论基础,它描述了电化学反应速率与电极上的电势之间的关系。
在电化学中,电极是电化学反应发生的地方,而电势则是描述电极上化学反应进行方向的物理量。
标准电极定律的提出,为我们理解和预测电化学反应提供了重要的依据。
首先,我们来了解一下标准电极电势的概念。
标准电极电势是指在标准状态下,一个电极上的电势与标准氢电极之间的电势差。
标准氢电极被定义为具有零电势的电极,它被用作电势的基准。
在标准状态下,标准氢电极的电势被定义为0V。
其他电极与标准氢电极之间的电势差可以通过实验测量得到,这就是它们的标准电极电势。
根据标准电极定律,电化学反应的速率与电极上的电势之间存在着一定的关系。
具体来说,当两个电极之间的电势差越大,电化学反应进行的速率就越快。
这是因为电势差实际上是描述了化学反应进行方向的物理量,它可以促进或者抑制电化学反应的进行。
因此,我们可以通过测量电极的电势来了解电化学反应进行的速率。
在实际的电化学研究中,标准电极定律可以被应用于许多方面。
例如,我们可以利用标准电极定律来研究电化学反应的动力学特性,从而优化电化学反应的条件和参数。
此外,标准电极定律还可以被用于设计和制备新型的电化学材料,以满足不同领域的需求。
总之,标准电极定律是电化学研究中不可或缺的理论基础,它为我们理解和预测电化学反应提供了重要的依据。
通过对电极电势与反应速率之间关系的深入研究,我们可以更好地控制和应用电化学反应,推动电化学领域的发展。
希望本文的介绍能够帮助大家更好地理解标准电极定律的重要性和应用价值。
碘离子选择性电极的性能及应用

碘离子选择性电极的性能及应用实验目的 理解离子选择性电极的主要性质和测量原理。
学会应用碘离子选择性电极测定未知碘离子溶液中的碘离子含量。
理解Gran 氏作图法基本原理,学会利用半反对数坐标纸作图计算位置碘离子溶液中碘离子的浓度。
实验原理 离子选择电极是一种以电势响应为基础的电化学敏感元件。
将电极插入到含有待测离子的溶液中时,在膜—液界面上产生一特定的电势响应值。
电势响应值与离子活度间的关系可用能斯脱方程来描述。
若以本实验所采用的碘离子电极为例,用甘汞电极做参比电极,则所组成的电池其电动势可表达如下:--=I a FRT E E ln 0。
已知γ是活度系数,故--=Cl I c a γ。
在实验工作中,通常采用固定离子强度(如本实验的溶液中均含有0.1mol/L 的KNO 3)的测试方法,此时γ可视作保持定值,上式可改写成--'=I c F RT E E ln 0。
在实际工作中,分别测定不同浓度c I -的碘离子溶液的电动势E i ,作出E i ~-lg c I -图,在一定浓度范围内,可得一直线,这一段直线为电极的响应范围。
应用离子选择电极可以测定溶液中特定离子的浓度。
本实验使用Gran 氏图解法用碘离子选择电极测定未知碘离子溶液的浓度。
由于---'=-'=I I c K E c F RT E E ln ln 00所以将上式可改写为:,=,令常数E K E c K E K E I ⎪⎭⎫ ⎝⎛'⎪⎭⎫ ⎝⎛'=⎪⎭⎫ ⎝⎛----01011lg lg lg 所以有:)。
式(1lg 1-=⎪⎭⎫ ⎝⎛-I kc K E 如果在一定体积的浓度为c x 的待测溶液中控制溶液活度系数和溶液体积不变的情况下,分别加入已知量的少量待测离子,并测定溶液的电动势E ,则E 与浓度的关系为)式(加入加入2)()(lg 1--+=+=⎪⎭⎫ ⎝⎛-I i x I x i V m m k c c k K E 。
最全的标准电极电势(无表格版)

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载最全的标准电极电势(无表格版)地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容-- 标准 --标准电极电势表-- 1 在酸性溶液中 (298K)电对方程式E/VLi(I)-(0) Li++e-=Li -3.0401Cs(I)-(0) Cs++e-=Cs -3.026Rb(I)-(0) Rb++e-=Rb -2.98K(I)-(0) K++e-=K -2.931Ba(II)-(0) Ba2++2e-=Ba -2.912Sr(II)-(0) Sr2++2e-=Sr -2.89Ca(II)-(0) Ca2++2e-=Ca -2.868Na(I)-(0) Na++e-=Na -2.71La(III)-(0) La3++3e-=La -2.379Mg(II)-(0) Mg2++2e-=Mg -2.372Ce(III)-(0) Ce3++3e-=Ce -2.336H(0)-(-I) H2(g)+2e-=2H--2.23Al(III)-(0) AlF63-+3e-=Al+6F--2.069Th(IV)-(0) Th4++4e-=Th -1.899Be(II)-(0) Be2++2e-=Be -1.847U(III)-(0) U3++3e-=U -1.798Hf(IV)-(0) HfO2++2H++4e-=Hf+H2O -1.724Al(III)-(0) Al3++3e-=Al -1.662Ti(II)-(0) Ti2++2e-=Ti -1.630Zr(IV)-(0) ZrO2+4H++4e-=Zr+2H2O -1.553Si(IV)-(0) [SiF6]2-+4e-=Si+6F--1.24Cr(II)-(0) Cr2++2e-=Cr -0.913Ti(III)-(II) Ti3++e-=Ti2+-0.9B(III)-(0) H3BO3+3H++3e-=B+3H2O -0.8698*Ti(IV)-(0) TiO2+4H++4e-=Ti+2H2O -0.86Te(0)-(-II) Te+2H++2e-=H2Te -0.793Zn(II)-(0) Zn2++2e-=Zn -0.7618Ta(V)-(0) Ta2O5+10H++10e-=2Ta+5H2O -0.750 Cr(III)-(0) Cr3++3e-=Cr -0.744Nb(V)-(0) Nb2O5+l0H++10e-=2Nb+5H2O -0.644 As(0)-(-III) As+3H++3e-=AsH3 -0.608U(IV)-(III) U4++e-=U3+-0.607Ga(III)-(0) Ga3++3e-=Ga -0.549P(I)-(0) H3PO2+H++e-=P+2H2O -0.508P(III)-(I) H3PO3+2H++2e-=H3PO2+H2O -0.499*C(IV)-(III) 2CO2+2H++2e-=H2C2O4 -0.49Fe(II)-(0) Fe2++2e-=Fe -0.447Cr(III)-(II) Cr3++e-=Cr2+-0.407Cd(II)-(0) Cd2++2e-=Cd -0.4030Se(0)-(-II) Se+2H++2e-=H2Se(aq) -0.399Pb(II)-(0) PbI2+2e-=Pb+2I--0.365Eu(III)-(II) Eu3++e-=Eu2+-0.36Pb(II)-(0) PbSO4+2e-=Pb+SO42--0.3588In(III)-(0) In3++3e-=In -0.3382Tl(I)-(0) Tl++e-=Tl -0.336P(V)-(III) H3PO4+2H++2e-=H3PO3+H2O -0.276Pb(II)-(0) PbCl2+2e-=Pb+2Cl--0.2675Ni (II)-(0) Ni2++2e-=Ni -0.257V(III)-(II) V3++e-=V2+-0.255Ge(IV)-(0) H2GeO3+4H++4e-=Ge+3H2O -0.182Ag(I)-(0) AgI+e-=Ag+I--0.15224Sn(II)-(0) Sn2++2e-=Sn -0.1375Pb(II)-(0) Pb2++2e-=Pb -0.1262*C(IV)-(II) CO2(g)+2H++2e-=CO+H2O -0.12P(0)-(-III) P(white)+3H++3e-=PH3(g) -0.063Hg(I)-(0) Hg2I2+2e-=2Hg+2I--0.0405Fe(III)-(0) Fe3++3e-=Fe -0.037H(I)-(0) 2H++2e-=H2 0.0000Ag(I)-(0) AgBr+e-=Ag+Br-0.07133S(II.V)-(II) S4O62-+2e-=2S2O32- 0.08*Ti(IV)-(III) TiO2++2H++e-=Ti3++H2O 0.1S(0)-(-II) S+2H++2e-=H2S(aq) 0.142Sn(IV)-(II) Sn4++2e-=Sn2+0.151Sb(III)-(0) Sb2O3+6H++6e-=2Sb+3H2O 0.152Cu(II)-(I) Cu2++e-=Cu+0.153Bi(III)-(0) BiOCl+2H++3e-=Bi+Cl-+H2O 0.1583 S(VI)-(IV) SO42-+4H++2e-=H2SO3+H2O 0.172 Sb(III)-(0) SbO++2H++3e-=Sb+H2O 0.212Ag(I)-(0) AgCl+e-=Ag+Cl-0.22233Hg(I)-(0) Hg2Cl2+2e-=2Hg+2Cl-(饱和KCl) 0.26808 Bi(III)-(0) BiO++2H++3e-=Bi+H2O 0.320U(VI)-(IV) UO22++4H++2e-=U4++2H2O 0.327 C(IV)-(III) 2HCNO+2H++2e-=(CN)2+2H2O 0.330 V(IV)-(III) VO2++2H++e-=V3++H2O 0.337Cu(II)-(0) Cu2++2e-=Cu 0.3419Re(VII)-(0) ReO4-+8H++7e-=Re+4H2O 0.368Ag(I)-(0) Ag2CrO4+2e-=2Ag+CrO42-0.4470S(IV)-(0) H2SO3+4H++4e-=S+3H2O 0.449Cu(I)-(0) Cu++e-=Cu 0.521I(0)-(-I) I2+2e-=2I-0.5355I(0)-(-I) I3-+2e-=3I-0.536As(V)-(III) H3AsO4+2H++2e-=HAsO2+2H2O 0.560 Sb(V)-(III) Sb2O5+6H++4e-=2SbO++3H2O 0.581 Te(IV)-(0) TeO2+4H++4e-=Te+2H2O 0.593U(V)-(IV) UO2++4H++e-=U4++2H2O 0.612**Hg(II)-(I) 2HgCl2+2e-=Hg2Cl2+2Cl-0.63Pt(IV)-(II) [PtCl6]2-+2e-=[PtCl4]2-+2Cl- 0.68O(0)-(-I) O2+2H++2e-=H2O2 0.695Pt(II)-(0) [PtCl4]2-+2e-=Pt+4Cl-0.755*Se(IV)-(0) H2SeO3+4H++4e-=Se+3H2O 0.74Fe(III)-(II) Fe3++e-=Fe2+ 0.771Hg(I)-(0) Hg22++2e-=2Hg 0.7973Ag(I)-(0) Ag++e-=Ag 0.7996N(V)-(IV) 2NO3-+4H++2e-=N2O4+2H2O 0.803 Hg(II)-(0) Hg2++2e-=Hg 0.851Si(IV)-(0) (quartz)SiO2+4H++4e-=Si+2H2O 0.857 Cu(II)-(I) Cu2++I-+e-=CuI 0.86N(III)-(I) 2HNO2+4H++4e-=H2N2O2+2H2O 0.86 Hg(II)-(I) 2Hg2++2e-=Hg22+0.920N(V)-(III) NO3-+3H++2e-=HNO2+H2O 0.934Pd(II)-(0) Pd2++2e-=Pd 0.951N(V)-(II) NO3-+4H++3e-=NO+2H2O 0.957N(III)-(II) HNO2+H++e-=NO+H2O 0.983I(I)-(-I) HIO+H++2e-=I-+H2O 0.987V(V)-(IV) VO2++2H++e-=VO2++H2O 0.991V(V)-(IV) V(OH)4++2H++e-=VO2++3H2O 1.00 Au(III)-(0) [AuCl4]-+3e-=Au+4Cl- 1.002Te(VI)-(IV) H6TeO6+2H++2e-=TeO2+4H2O 1.02 N(IV)-(II) N2O4+4H++4e-=2NO+2H2O 1.035N(IV)-(III) N2O4+2H++2e-=2HNO2 1.065I(V)-(-I) IO3-+6H++6e-=I-+3H2O 1.085Br(0)-(-I) Br2(aq)+2e-=2Br- 1.0873Se(VI)-(IV) SeO42-+4H++2e-=H2SeO3+H2O 1.151 Cl(V)-(IV) ClO3-+2H++e-=ClO2+H2O 1.152Pt(II)-(0) Pt2++2e-=Pt 1.18Cl(VII)-(V) ClO4-+2H++2e-=ClO3-+H2O 1.189 I(V)-(0) 2IO3-+12H++10e-=I2+6H2O 1.195Cl(V)-(III) ClO3-+3H++2e-=HClO2+H2O 1.214Mn(IV)-(II) MnO2+4H++2e-=Mn2++2H2O 1.224O(0)-(-II) O2+4H++4e-=2H2O 1.229Tl(III)-(I) T13++2e-=Tl+ 1.252Cl(IV)-(III) ClO2+H++e-=HClO2 1.277N(III)-(I) 2HNO2+4H++4e-=N2O+3H2O 1.297**Cr(VI)-(III) Cr2O72-+14H++6e-=2Cr3++7H2O 1.33 Br(I)-(-I) HBrO+H++2e-=Br-+H2O 1.331Cr(VI)-(III) HCrO4-+7H++3e-=Cr3++4H2O 1.350Cl(0)-(-I) Cl2(g)+2e-=2Cl- 1.35827Cl(VII)-(-I) ClO4-+8H++8e-=Cl-+4H2O 1.389 Cl(VII)-(0) ClO4-+8H++7e-=1/2Cl2+4H2O 1.39Au(III)-(I) Au3++2e-=Au+ 1.401Br(V)-(-I) BrO3-+6H++6e-=Br-+3H2O 1.423I(I)-(0) 2HIO+2H++2e-=I2+2H2O 1.439Cl(V)-(-I) ClO3-+6H++6e-=Cl-+3H2O 1.451Pb(IV)-(II) PbO2+4H++2e-=Pb2++2H2O 1.455Cl(V)-(0) ClO3-+6H++5e-=1/2Cl2+3H2O 1.47Cl(I)-(-I) HClO+H++2e-=Cl-+H2O 1.482Br(V)-(0) BrO3-+6H++5e-=l/2Br2+3H2O 1.482Au(III)-(0) Au3++3e-=Au 1.498Mn(VII)-(II) MnO4-+8H++5e-=Mn2++4H2O 1.507Mn(III)-(II) Mn3++e-=Mn2+ 1.5415Cl(III)-(-I) HClO2+3H++4e-=Cl-+2H2O 1.570Br(I)-(0) HBrO+H++e-=l/2Br2(aq)+H2O 1.574N(II)-(I) 2NO+2H++2e-=N2O+H2O 1.591I(VII)-(V) H5IO6+H++2e-=IO3-+3H2O 1.601Cl(I)-(0) HClO+H++e-=1/2Cl2+H2O 1.611Cl(III)-(I) HClO2+2H++2e-=HClO+H2O 1.645Ni(IV)-(II) NiO2+4H++2e-=Ni2++2H2O 1.678Mn(VII)-(IV) MnO4-+4H++3e-=MnO2+2H2O 1.679Pb(IV)-(II) PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.6913 Au(I)-(0) Au++e-=Au 1.692Ce(IV)-(III) Ce4++e-=Ce3+ 1.72N(I)-(0) N2O+2H++2e-=N2+H2O 1.766O(-I)-(-II) H2O2+2H++2e-=2H2O 1.776Co(III)-(II) Co3++e-=Co2+(2mol·L-1 H2SO4) 1.83Ag(II)-(I) Ag2++e-=Ag+ 1.980S(VII)-(VI) S2O82-+2e-=2SO42- 2.010O(0)-(-II) O3+2H++2e-=O2+H2O 2.076O(II)-(-II) F2O+2H++4e-=H2O+2F- 2.153Fe(VI)-(III) FeO42-+8H++3e-=Fe3++4H2O 2.20O(0)-(-II) O(g)+2H++2e-=H2O 2.421F(0)-(-I) F2+2e-=2F- 2.866F2+2H++2e-=2HF 3.0532 在碱性溶液中 (298K)电对方程式E/VCa(II)-(0) Ca(OH)2+2e-=Ca+2OH--3.02Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH--2.99La(III)-(0) La(OH)3+3e-=La+3OH--2.90Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88 Mg(II)-(0) Mg(OH)2+2e-=Mg+2OH--2.690Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63Hf(IV)-(0) HfO(OH)2+H2O+4e-=Hf+4OH--2.50Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr+4OH--2.36Al(III)-(0) H2AlO3-+H2O+3e-=Al+OH--2.33P(I)-(0) H2PO2-+e-=P+2OH--1.82B(III)-(0) H2BO3-+H2O+3e-=B+4OH--1.79P(III)-(0) HPO32-+2H2O+3e-=P+5OH--1.71Si(IV)-(0) SiO32-+3H2O+4e-=Si+6OH--1.697P(III)-(I) HPO32-+2H2O+2e-=H2PO2-+3OH--1.65Mn(II)-(0) Mn(OH)2+2e-=Mn+2OH--1.56Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH--1.48*Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn+4CN--1.26Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH--1.249Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219Zn(II)-(0) ZnO22-+2H2O+2e-=Zn+4OH--1.215Cr(III)-(0) CrO2-+2H2O+3e-=Cr+4OH--1.2Te(0)-(-I) Te+2e-=Te2--1.143P(V)-(III) PO43-+2H2O+2e-=HPO32-+3OH--1.05*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn+4NH3 -1.04*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0Sn(IV)-(II) [Sn(OH)6]2-+2e-=HSnO2-+H2O+3OH- -0.93 S(VI)-(IV) SO42-+H2O+2e-=SO32-+2OH--0.93Se(0)-(-II) Se+2e-=Se2--0.924Sn(II)-(0) HSnO2-+H2O+2e-=Sn+3OH--0.909P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87N(V)-(IV) 2NO3-+2H2O+2e-=N2O4+4OH--0.85H(I)-(0) 2H2O+2e-=H2+2OH--0.8277Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809Co(II)-(0) Co(OH)2+2e-=Co+2OH--0.73Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691As(III)-(0) AsO2-+2H2O+3e-=As+4OH--0.68Sb(III)-(0) SbO2-+2H2O+3e-=Sb+4OH--0.66*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59 *Sb(V)-(III) SbO3-+H2O+2e-=SbO2-+2OH--0.59Re(VII)-(0) ReO4-+4H2O+7e-=Re+8OH--0.584*S(IV)-(II) 2SO32-+3H2O+4e-=S2O32-+6OH--0.58Te(IV)-(0) TeO32-+3H2O+4e-=Te+6OH--0.57Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56S(0)-(-II) S+2e-=S2--0.47627Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi+6OH--0.46N(III)-(II) NO2-+H2O+e-=NO+2OH--0.46*Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3 -0.422Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34*Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2CN--0.31Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH--0.222Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13 *Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3 -0.12O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076Ag(I)-(0) AgCN+e-=Ag+CN--0.017N(V)-(III) NO3-+H2O+2e-=NO2-+2OH-0.01 Se(VI)-(IV) SeO42-+H2O+2e-=SeO32-+2OH-0.05 Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH-0.07S(II,V)-(II) S4O62-+2e-=2S2O32- 0.08Hg(II)-(0) HgO+H2O+2e-=Hg+2OH-0.0977Co(III)-(II) [Co(NH3)6]3++e-=[Co(NH3)6]2+0.108 Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH-0.14Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17Pb(IV)-(II) PbO2+H2O+2e-=PbO+2OH-0.247I(V)-(-I) IO3-+3H2O+6e-=I-+6OH- 0.26Cl(V)-(III) ClO3-+H2O+2e-=ClO2-+2OH-0.33 Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH-0.342Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(CN)6]4-0.358 Cl(VII)-(V) ClO4-+H2O+2e-=ClO3-+2OH-0.36 *Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH3 0.373O(0)-(-II) O2+2H2O+4e-=4OH-0.401I(I)-(-I) IO-+H2O+2e-=I-+2OH-0.485*Ni(IV)-(II) NiO2+2H2O+2e-=Ni(OH)2+2OH-0.490 Mn(VII)-(VI) MnO4-+e-=MnO42-0.558Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60Ag(II)-(I) 2AgO+H2O+2e-=Ag2O+2OH-0.607Br(V)-(-I) BrO3-+3H2O+6e-=Br-+6OH-0.61Cl(V)-(-I) ClO3-+3H2O+6e-=Cl-+6OH-0.62Cl(III)-(I) ClO2-+H2O+2e-=ClO-+2OH-0.66I(VII)-(V) H3IO62-+2e-=IO3-+3OH-0.7Cl(III)-(-I) ClO2-+2H2O+4e-=Cl-+4OH-0.76Br(I)-(-I) BrO-+H2O+2e-=Br-+2OH- 0.761Cl(I)-(-I) ClO-+H2O+2e-=Cl-+2OH- 0.841*Cl(IV)-(III) ClO2(g)+e-=ClO2-0.95O(0)-(-II) O3+H2O+2e-=O2+2OH- 1.24摘自David R.Lide, Handbook of Chemistry and Physics, 8-25-8-30, 78th. edition, 1997-1998* 摘自J.A. Dean Ed,Lange’s Handbook of Chemistry, 13th. edition, 1985** 摘自其他参考书.。
常用金属的电极电位

常⽤⾦属的电极电位标准电极电位是以标准氢原⼦作为参⽐电极,即氢的标准电极电位值定为0,与氢标准电极⽐较,电位较⾼的为正,电位较低者为负。
如氢的标准电极电位H2←→H+ 为⼀般标准电极电位以298K(即25摄⽒度)常见⾦属的标准电极电位:⽯墨的标准电极电位为 + V⼀价⾦Au+ +e = Au原⼦价标准电极电位为 + 1.692 V三价⾦Au3+ + 3e=Au原⼦价标准电极电位为 + 1.498 V钯Pd2+2e=Pd的标准电极电位为 + 0.830 V三价铑 Rh3+ + 3e=Rh 的标准电极电位为 + 0.800 V银 Ag+ +e=Ag的标准电极电位为 + 0.799 V钌Rh3+ + 3e = Rh的标准电极电位为 + 0.790 V汞 Hg2/2+ + 2e 的标准电极电位为+ 0. 789 V铜 Cu2+ + 2e 的标准电极电位为 + V氯化银的标准电极电位为 + 0. 222 V氢2H+ + 2e = H2的标准电极电位为V铁Fe3++3e=Fe的标准电极电位为- V铅 Pb2+ + 2e=Pb 的标准电极电位为- V锡 Sn2+ + 2e=Sn 的标准电极电位为- V钼 Mo3+ + 3e=Mo 的标准电极电位为- V镍 Ni2+ + 2e=Ni 的标准电极电位为- V钴 Co2+ + 2e=Co 的标准电极电位为- V铟 In3+ + 3e=In 的标准电极电位为- V镉 Cd2+ + 2e 的标准电极电位为- V铁 Fe2+ + 2e=Fe的标准电极电位为- V镍硼Ni-B镀层的⾃腐蚀电位为,⽐Ni-B-PTFE的⾃腐蚀电位要⾼,⽽Ni-B-PTFE复合镀层的⾃腐蚀电位为左右铬 Cr3+ + 3e = Cr 的标准电极电位为-0. 74 V 锌Zn2+ + 2e 的标准电极电位为-0. 763 V钨 W 的标准电极电位为- 1. 05 V 锰 Mn2+ + 2e 的标准电极电位为- V钛 Ti2+ + 2e 的标准电极电位为- V铝 Al3+ + 3e 的标准电极电位为- V镁 Mg2+ + 2e 的标准电极电位为- V钕 Nd 是⼀种活性极强的⾦属,标准平衡电位为- V1氢 H 3锂Li 4铍Be 5硼 B 6碳 C8 氧 O 9 氟 F 11纳Na 12镁Mg 13铝Al 14硅Si 15 磷 P 16硫 S 17 氯Cl 19钾K 22钛Ti 24铬Cr 25锰Mn 27钴Co 33砷As 42钼Mo44钌Ru 46钯Pd 51 锑Sb 52 碲Te 60 钕Nd 73 钽Ta 74钨 W 76锇Os 77铱Ir 78铂Pt 80汞Hg 82铅Pb。
标准电极电势表 (2)
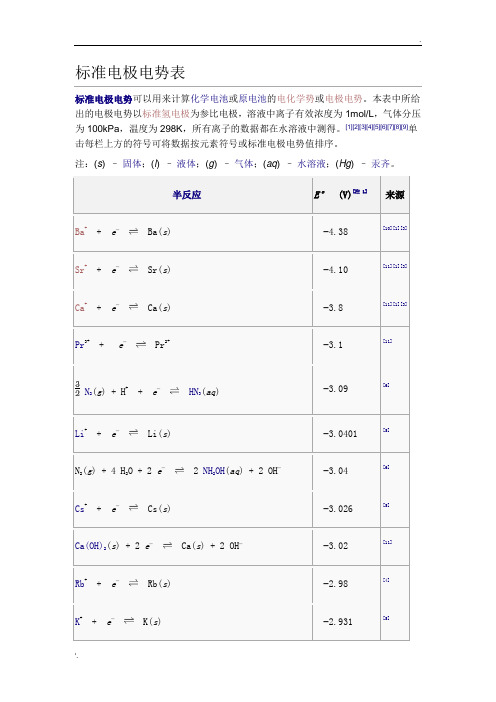
标准电极电势表标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。
本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为1mol/L,气体分压为100kPa,温度为298K,所有离子的数据都在水溶液中测得。
[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。
注:(s) –固体;(l) –液体;(g) –气体;(aq) –水溶液;(Hg) –汞齐。
半反应E°(V)[注 1]来源Ba++ e−Ba(s) −4.38 [10][1][3]Sr++ e−Sr(s) −4.10 [11][1][3] Ca++ e−Ca(s) −3.8 [11][1][3]Pr3++ e−Pr2+−3.1 [11] N2(g) + H++ e−HN3(aq) −3.09 [6]Li++ e−Li(s) −3.0401 [5]N2(g) + 4 H2O + 2 e−2 NH2OH(aq) + 2 OH−−3.04 [6]Cs++ e−Cs(s) −3.026 [5]Ca(OH)2(s) + 2 e−Ca(s) + 2 OH−−3.02 [11]Rb++ e−Rb(s) −2.98 [4]K++ e−K(s) −2.931 [5]半反应E°(V)[注 1]来源Mg++ e−Mg(s) −2.93 [10] Ba2++ 2 e−Ba(s) −2.912 [5]La(OH)3(s) + 3 e−La(s) + 3OH−−2.90 [5]Fr++ e−Fr(s) −2.9 [11] Sr2++ 2 e−Sr(s) −2.899 [5]Sr(OH)2(s) + 2 e−Sr(s) + 2 OH−−2.88 [11] Ca2++ 2 e−Ca(s) −2.868 [5] Eu2++ 2 e−Eu(s) −2.812 [5] Ra2++ 2 e−Ra(s) −2.8 [5] Yb2++ 2 e−Yb(s) −2.76 [11][1] Na++ e−Na(s) −2.71 [5][9] Sm2++ 2 e−Sm(s) −2.68 [11][1] No2++ 2 e−No(s) −2.50 [11] HfO(OH)2(s) + H2O + 4 e−Hf(s) + 4 OH−−2.50 [11]半反应E°(V)[注 1]来源Th(OH)4(s) + 4 e−Th(s) + 4 OH−−2.48 [11] Md2++ 2 e−Md(s) −2.40 [11] La3++ 3 e−La(s) −2.379 [5]Y3++ 3 e−Y(s) −2.372 [5] Mg2++ 2 e−Mg(s) −2.372 [5] ZrO(OH)2(s) + H2O + 4 e−Zr(s) + 4OH−−2.36 [5]Pr3++ 3 e−Pr(s) −2.353 [11] Ce3++ 3 e−Ce(s) −2.336 [11] Er3++ 3 e−Er(s) −2.331 [11] Ho3++ 3 e−Ho(s) −2.33 [11]Al(OH)4−+ 3 e−Al(s) + 4 OH−−2.33Al(OH)3(s) + 3 e−Al(s) + 3OH−−2.31Tb3++ 3 e−Tb(s) −2.28半反应E°(V)[注 1]来源H2(g) + 2 e−2 H−−2.25Ac3++ 3 e−Ac(s) −2.20Be++ e−Be(s) −2.12 [10] Cf2++ 2 e−Cf(s) −2.12 [11] Am3++ 3 e−Am(s) −2.048 [11] Cf3++ 3 e−Cf(s) −1.94 [11] Am2++ 2 e−Am(s) −1.9 [11] Be2++ 2 e−Be(s) −1.85Rf4++ 4 e−Rf(s) −1.67 [12]U3++ 3 e−U(s) −1.66 [7]Al3++ 3 e−Al(s) −1.66 [9]Ti2++ 2 e−Ti(s) −1.63 [9]Bk2++ 2 e−Bk(s) −1.6 [11]半反应E°(V)[注 1]来源ZrO2(s) + 4 H++ 4 e−Zr(s) + 2 H2O −1.553 [5]Hf4++ 4 e−Hf(s) −1.55 [11]Zr4++ 4 e−Zr(s) −1.45 [5]Ti3++ 3 e−Ti(s) −1.37 [13] TiO(s) + 2 H++ 2 e−Ti(s) + H2O −1.31Ti2O3(s) + 2 H++ 2 e−2 TiO(s) + H2O −1.23Zn(OH)42−+ 2 e−Zn(s) + 4 OH−−1.199 [14] Mn2++ 2 e−Mn(s) −1.185 [14] Fe(CN)64−+ 6 H++ 2 e−Fe(s) + 4HCN(aq) −1.16 [15]V2++ 2 e−V(s) −1.175 [2]Te(s) + 2 e−Te2−−1.143 [2] Nb3++ 3 e−Nb(s) −1.099Sn(s) + 4 H++ 4 e−SnH4(g) −1.07半反应E°(V)[注 1]来源In(OH)3(s) + 3 e−In(s) + 3 OH−−0.99 [11] SiO2(s) + 4 H++ 4 e−Si(s) + 2 H2O −0.91B(OH)3(aq) + 3 H++ 3 e−B(s) + 3 H2O −0.89Fe(OH)2(s) + 2 e−Fe(s) + 2 OH−−0.89 [15] Fe2O3(s) + 3 H2O + 2 e−2Fe(OH)2(s) + 2 OH−−0.86 [15] TiO2++ 2 H++ 4 e−Ti(s) + H2O −0.862 H2O+ 2 e−H2(g) + 2 OH−−0.8277 [5]Bi(s) + 3 H++ 3 e−BiH3−0.8 [14] Zn2++ 2 e−Zn(Hg) −0.7628 [5]Zn2++ 2 e−Zn(s) −0.7618 [5]Ta2O5(s) + 10 H++ 10 e−2 Ta(s) + 5 H2O −0.75Cr3++ 3 e−Cr(s) −0.74[Au(CN)2]−+ e−Au(s) + 2 CN−−0.60半反应E°(V)[注 1]来源Ta3++ 3 e−Ta(s) −0.6PbO(s) + H2O + 2 e−Pb(s) + 2 OH−−0.582 TiO2(s) + 2 H++ 2 e−Ti2O3(s) + H2O −0.56Ga3++ 3 e−Ga(s) −0.53U4++ e−U3+−0.52 [7]H3PO2(aq) + H++ e−P(白磷[16]) + 2 H2O −0.508 [5]H3PO3(aq) + 2 H++ 2 e−H3PO2(aq) + H2O −0.499 [5]H3PO3(aq) + 3 H++ 3 e−P(红磷)[16]+ 3H2O −0.454 [5]Fe2++ 2 e−Fe(s) −0.44 [9]2 CO2(g) + 2 H++ 2 e−HOOCCOOH(aq) −0.43Cr3++ e−Cr2+−0.42Cd2++ 2 e−Cd(s) −0.40 [9] SeO32−+ 4e−+ 3H2O ⇌Se + 6OH−−0.37 [17]半反应E°(V)[注 1]来源GeO2(s) + 2 H++ 2 e−GeO(s) + H2O −0.37Cu2O(s) + H2O + 2 e−2 Cu(s) + 2 OH−−0.360 [5] PbSO4(s) + 2 e−Pb(s) + SO42−−0.3588 [5] PbSO4(s) + 2 e−Pb(Hg) + SO42−−0.3505 [5] Eu3++ e−Eu2+−0.35 [7]In3++ 3 e−In(s) −0.34 [2]Tl++ e−Tl(s) −0.34 [2] Ge(s) + 4 H++ 4 e−GeH4(g) −0.29Co2++ 2 e−Co(s) −0.28 [5]H3PO4(aq) + 2 H++ 2 e−H3PO3(aq) + H2O −0.276 [5]V3++ e−V2+−0.26 [9]Ni2++ 2 e−Ni(s) −0.25As(s) + 3 H++ 3 e−AsH3(g) −0.23 [2]半反应E°(V)[注 1]来源AgI(s) + e−Ag(s) + I−−0.15224 [14] MoO2(s) + 4 H++ 4 e−Mo(s) + 2 H2O −0.15Si(s) + 4 H++ 4 e−SiH4(g) −0.14Sn2++ 2 e−Sn(s) −0.13O2(g) + H++ e−HO2•(aq) −0.13Pb2++ 2 e−Pb(s) −0.13 [9] WO2(s) + 4 H++ 4 e−W(s) + 2 H2O −0.12P(红磷) + 3 H++ 3 e−PH3(g) −0.111 [5] CO2(g) + 2 H++ 2 e−HCOOH(aq) −0.11Se(s) + 2 H++ 2 e−H2Se(g) −0.11CO2(g) + 2 H++ 2 e−CO(g) + H2O −0.11SnO(s) + 2 H++ 2 e−Sn(s) + H2O −0.10半反应E°(V)[注 1]来源SnO2(s) + 2 H++ 2 e−SnO(s) + H2O −0.09WO3(aq) + 6 H++ 6 e−W(s) + 3 H2O −0.09 [2]P(白磷) + 3 H++ 3 e−PH3(g) −0.063 [5]Fe3++ 3 e−Fe(s) −0.04 [15] HCOOH(aq) + 2 H++ 2 e−HCHO(aq) + H2O −0.032 H++ 2 e−H2(g)0.00 ≡0 AgBr(s) + e−Ag(s) + Br−+0.07133 [14]S4O62−+ 2 e−2 S2O32−+0.08Fe3O4(s) + 8 H++ 8 e−3 Fe(s) + 4 H2O +0.085 [8]N2(g) + 2 H2O + 6H++ 6 e−2 NH4OH(aq) +0.092HgO(s) + H2O + 2 e−Hg(l) + 2 OH−+0.0977Cu(NH3)42++ e−Cu(NH3)2++ 2 NH3+0.10 [2]Ru(NH3)63++ e−Ru(NH3)62++0.10 [7]半反应E°(V)[注 1]来源N2H4(aq) + 4 H2O + 2 e−2 NH4++ 4 OH−+0.11 [6]H2MoO4(aq) + 6 H++ 6 e−Mo(s) + 4 H2O +0.11Ge4++ 4 e−Ge(s) +0.12C(s) + 4 H++ 4 e−CH4(g) +0.13 [2] HCHO(aq) + 2 H++ 2 e−CH3OH(aq) +0.13S(s) + 2 H++ 2 e−H2S(g) +0.14Sn4++ 2 e−Sn2++0.15Cu2++ e−Cu++0.159 [2] HSO4−+ 3 H++ 2 e−SO2(aq) + 2 H2O +0.16UO22++ e−UO2++0.163 [7] SO42−+ 4 H++ 2 e−SO2(aq) + 2 H2O +0.17TiO2++ 2 H++ e−Ti3++ H2O +0.19半反应E°(V)[注 1]来源Bi3++ 2e−Bi++0.2SbO++ 2 H++ 3 e−Sb(s) + H2O +0.20AgCl(s) + e−Ag(s) + Cl−+0.22233 [14]H3AsO3(aq) + 3 H++ 3 e−As(s) + 3 H2O +0.24GeO(s) + 2 H++ 2 e−Ge(s) + H2O +0.26UO2++ 4 H++ e−U4++ 2 H2O +0.273 [7]At2+ e−2 At-+0.3 [11] Re3++ 3 e−Re(s) +0.300Bi3++ 3 e−Bi(s) +0.32VO2++ 2 H++ e−V3++ H2O +0.34Cu2++ 2 e−Cu(s) +0.340 [2] [Fe(CN)6]3−+ e−[Fe(CN)6]4−+0.36半反应E°(V)[注 1]来源Tc2++ 2 e−Tc(s) +0.40 [11]O2(g) + 2 H2O + 4 e−4 OH−(aq) +0.40 [9]H2MoO4+ 6 H++ 3 e−Mo3++ 2 H2O +0.43Ru2++ 2 e−Ru(s) +0.455 [11]Bi++ e−Bi(s) +0.50CH3OH(aq) + 2 H++ 2 e−CH4(g) + H2O +0.50SO2(aq) + 4 H++ 4 e−S(s) + 2 H2O +0.50Cu++ e−Cu(s) +0.520 [2] CO(g) + 2 H++ 2 e−C(s) + H2O +0.52I3−+ 2 e−3 I−+0.53 [9]I2(s) + 2 e−2 I−+0.54 [9] [AuI4]−+ 3 e−Au(s) + 4 I−+0.56半反应E°(V)[注 1]来源H3AsO4(aq) + 2 H++ 2 e−H3AsO3(aq) + H2O +0.56[AuI2]−+ e−Au(s) + 2 I−+0.58MnO4−+ 2 H2O + 3 e−MnO2(s) + 4 OH−+0.59Rh++ e−Rh(s) +0.600 [11]S2O32 −+ 6 H++ 4 e−2 S(s) + 3 H2O +0.60Fc++ e−Fc(s) +0.641 [18]+0.643 [11]+ e−Ag + −H2MoO4(aq) + 2 H++ 2 e−MoO2(s) + 2 H2O +0.65+0.6992 [14] + 2 H++ 2 e−O2(g) + 2 H++ 2 e−H2O2(aq) +0.70Tl3++ 3 e−Tl(s) +0.72半反应E°(V)[注 1]来源PtCl62−+ 2 e−PtCl42−+ 2 Cl−+0.726 [7]H2SeO3(aq) + 4 H++ 4 e−Se(s) + 3 H2O +0.74Rh3++ 3 e−Rh(s) +0.758 [11] PtCl42−+ 2 e−Pt(s) + 4 Cl−+0.758 [7]Fe3++ e−Fe2++0.77Ag++ e−Ag(s) +0.7996 [5] Hg22++ 2 e−2 Hg(l) +0.80NO3−(aq) + 2 H++ e−NO2(g) + H2O +0.80FeO42−+ 5 H2O + 6 e−Fe2O3(s) + 10 OH−+0.81 [15]H2(g) + 2 OH−2 H2O + 2 e−+0.828 [19] [AuBr4]−+ 3 e−Au(s) + 4 Br−+0.85Hg2++ 2 e−Hg(l) +0.85半反应E°(V)[注 1]来源MnO4−+ H++ e−HMnO4−+0.902 Hg2++ 2 e−Hg22++0.91 [2] Pd2++ 2 e−Pd(s) +0.915 [7] [AuCl4]−+ 3 e−Au(s) + 4 Cl−+0.93MnO2(s) + 4 H++ e−Mn3++ 2 H2O +0.95[AuBr2]−+ e−Au(s) + 2 Br−+0.96[HXeO6]3−+ 2 H2O + 2 e−+ [HXeO4]−+ 4 OH−+0.99 [20] HNO2+ H++ e-= NO(g)+ H2O +0.996H6TeO6(aq) + 2 H++ 2 e−TeO2(s) + 4 H2O +1.02 [21] Br2(l) + 2 e−2 Br−+1.07Br2(aq) + 2 e−2 Br−+1.09 [9] NO2(g) + H++ e-= HNO2+1.093半反应E°(V)[注 1]来源IO3−+ 5 H++ 4 e−HIO(aq) + 2 H2O +1.13[AuCl2]−+ e−Au(s) + 2 Cl−+1.15HSeO4−+ 3 H++ 2 e−H2SeO3(aq) + H2O +1.15Ir3++ 3 e−Ir(s) +1.156 [11] Ag2O(s) + 2 H++ 2 e−2 Ag(s) + H2O +1.17ClO3−+ 2 H++ e−ClO2(g) + H2O +1.18[HXeO6]3−+ 5 H2O + 8 e−Xe(g) + 11 OH−+1.18 [20]Pt2++ 2 e−Pt(s) +1.188 [7] ClO2(g) + H++ e−HClO2(aq) +1.192 IO3−+ 12 H++ 10 e−I2(s) + 6 H2O +1.20ClO4−+ 2 H++ 2 e−ClO3−+ H2O +1.20O2(g) + 4 H++ 4 e−2 H2O+1.229 [9]半反应E°(V)[注 1]来源MnO2(s) + 4 H++ 2 e−Mn2++ 2H2O +1.23[HXeO4]−+ 3 H2O + 6 e−Xe(g) + 7 OH−+1.24 [20]Tl3++ 2 e−Tl++1.25Cr2O72 −+ 14 H++ 6 e−2 Cr3++ 7 H2O +1.33Cl2(g) + 2 e−2 Cl−+1.36 [9] CoO2(s) + 4 H++ e−Co3++ 2 H2O +1.422 NH3OH++ H++ 2 e−N2H5++ 2 H2O +1.42 [6]2 HIO(aq) + 2 H++ 2 e−I2(s) + 2 H2O +1.44Ce4++ e−Ce3++1.44BrO3−+ 5 H++ 4 e−HBrO(aq) + 2 H2O +1.45β-PbO2(s) + 4 H++ 2 e−Pb2++ 2 H2O +1.460 [2]α-PbO2(s) + 4 H++ 2 e−Pb2++ 2 H2O +1.468 [2]半反应E°(V)[注 1]来源2 BrO3−+ 12 H++ 10 e−Br2(l) + 6 H2O +1.482ClO3−+ 12 H++ 10 e−Cl2(g) + 6 H2O +1.49HO2+ H++ e−H2O2+1.495 [11] MnO4−+ 8 H++ 5 e−Mn2++ 4 H2O +1.51HO2•+ H++ e−H2O2(aq) +1.51Au3++ 3 e−Au(s) +1.52NiO2(s) + 4 H++ 2 e−Ni2++ 2 OH−+1.592 HClO(aq) + 2 H++ 2 e−Cl2(g) + 2 H2O +1.63Ag2O3(s) + 6 H++ 4 e−2 Ag++ 3 H2O +1.67HClO2(aq) + 2 H++ 2 e−HClO(aq) + H2O +1.67Pb4++ 2 e−Pb2++1.69 [2] MnO4−+ 4 H++ 3 e−MnO2(s) + 2 H2O +1.70半反应E°(V)[注 1]来源AgO(s) + 2 H++ e−Ag++ H2O +1.77 H2O2(aq) + 2 H++ 2 e−2 H2O +1.776Co3++ e−Co2++1.82Au++ e−Au(s) +1.83 [2] BrO4−+ 2 H++ 2 e−BrO3−+ H2O +1.85Ag2++ e−Ag++1.98 [2]S2O82−+ 2 e−2 SO42−+2.07O3(g) + 2 H++ 2 e−O2(g) + H2O +2.075 [7] HMnO4−+ 3 H++ 2 e−MnO2(s) + 2 H2O +2.09XeO3(aq) + 6 H++ 6 e−Xe(g) + 3 H2O +2.12 [20]H4XeO6(aq) + 8 H++ 8 e−Xe(g) + 6 H2O +2.18 [20] FeO42−+ 3 e−+ 8 H+Fe3++ 4 H2O +2.20 [22] XeF2(aq) + 2 H++ 2 e−Xe(g) + 2HF(aq) +2.32 [20].'. 半反应E°(V)[注 1]来源H4XeO6(aq) + 2 H++ 2 e−XeO3(aq) + H2O +2.42 [20] F2(g) + 2 e−2 F−+2.87 [2][9] F2(g) + 2 H++ 2 e−2 HF(aq) +3.05 [2] Tb4++ e− Tb3++3.05 [11]。
简述标准电极定律

简述标准电极定律一、引言电解池中,不论是直流电解,还是交流电解都遵循着相同的电极反应规律——标准电极电势。
这里,我们将以水溶液中离子的电极反应来简述标准电极电势。
二、标准电极电势:(一)、电流密度1、在理想情况下,每个离子的迁移数只与其本身浓度和离子电荷有关,而与电流无关,所以称此值为:零。
2、在现实情况中,正负离子的迁移数会受到外加电压的影响,也就是说,标准电极电势只取决于本体溶液的组成、离子浓度和离子的电荷性质。
3、在理想情况下,当电流方向改变时,则电流强度会发生改变,而离子的迁移数仍保持不变。
4、标准电极电势可根据电流密度的定义求得: R=N[I-It]/I。
二、电流密度:(一)、电流密度的意义(二)、影响电流密度的因素三、标准电极电势: 1、标准电极电势:由于电解质溶液中的离子各具有相应的化学势,且电位越高的离子,其化学势越大。
而各种溶液的化学势不同,故标准电极电势是个与离子浓度无关的常数。
一般标准电极电势仅适用于弱电解质溶液。
2、电解质溶液的导电能力与它的电导率及离子的浓度成正比。
在一定范围内,随着电导率的增加,标准电极电势逐渐减小。
3、根据标准电极电势可以计算出溶液中各离子的浓度,如氢氧化钠溶液中的氢离子浓度等。
四、能斯特公式:五、电极电势的应用:(一)、电解实例:(二)、两极板的问题六、总结电流密度:不论电流大小,只要存在离子迁移,电流密度均不变,但实际应用中并非完全如此。
电流密度的测量除了依赖电流表和电流源外,还需要电流密度计。
电流密度计可以测量单位时间通过某电流表的电流,也可以在电路中测量某一点的电流。
3、对照实验:用碳棒作为阴、阳两极,并在阴极和阳极之间施加一个恒定的电压,用电流表测量阴极、阳极间的电流。
然后在碳棒上滴一些碘溶液,再用数字万用表测量电流表读数。
4、得出结论:标准电极电势与参加反应的离子浓度无关,仅与离子的本性有关。
- 1 -。
标准电极电势表

标准电极电势表标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。
本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为1mol/L ,气体分压为100kPa ,温度为298K ,所有离子的数据都在水溶液中测得。
[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。
注:(s ) – 固体;(l ) – 液体;(g ) – 气体;(aq ) – 水溶液;(Hg ) – 汞齐。
半反应 E° (V)[注 1] 来源Ba + + e − Ba(s ) −4.38 [10][1][3]Sr + + e − Sr(s ) −4.10 [11][1][3]Ca + + e − Ca(s ) −3.8 [11][1][3]Pr 3+ + e − Pr 2+ −3.1 [11] N2(g ) + H + + e − HN 3(aq ) −3.09 [6] Li + + e − Li(s ) −3.0401 [5]N2(g ) + 4 H 2O + 2 e − 2 NH 2OH (aq ) + 2 OH − −3.04 [6] Cs + + e − Cs(s ) −3.026 [5]Ca(OH)2(s ) + 2 e − Ca(s ) + 2 OH − −3.02 [11] Rb + + e − Rb(s ) −2.98 [4]K + + e − K(s ) −2.931 [5]半反应E°(V)[注 1]来源Mg++ e−Mg(s) −2.93 [10]Ba2++ 2 e−Ba(s) −2.912 [5]−La(s) + 3OH−−2.90 [5]La(OH)Fr++ e−Fr(s) −2.9 [11]Sr2++ 2 e−Sr(s) −2.899 [5]−Sr(s) + 2 OH−−2.88 [11]Sr(OH)Ca2++ 2 e−Ca(s) −2.868 [5]Eu2++ 2 e−Eu(s) −2.812 [5]Ra2++ 2 e−Ra(s) −2.8 [5]Yb2++ 2 e−Yb(s) −2.76 [11][1]Na++ e−Na(s) −2.71 [5][9]Sm2++ 2 e−Sm(s) −2.68 [11][1]No2++ 2 e−No(s) −2.50 [11]−Hf(s) + 4 OH−−2.50 [11]HfO(OH)半反应E°(V)[注 1]来源−Th(s) + 4 OH−−2.48 [11]Th(OH)Md2++ 2 e−Md(s) −2.40 [11]La3++ 3 e−La(s) −2.379 [5]Y3++ 3 e−Y(s) −2.372 [5]Mg2++ 2 e−Mg(s) −2.372 [5]−Zr(s) + 4OH−−2.36 [5]ZrO(OH)Pr3++ 3 e−Pr(s) −2.353 [11]Ce3++ 3 e−Ce(s) −2.336 [11]Er3++ 3 e−Er(s) −2.331 [11]Ho3++ 3 e−Ho(s) −2.33 [11]−+ 3 e−Al(s) + 4 OH−−2.33Al(OH)−Al(s) + 3OH−−2.31Al(OH)Tb3++ 3 e−Tb(s) −2.28。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碘离子标准电极电势
碘离子标准电极电势是指在标准状况下,碘离子在溶液中的电极电势。
碘离子标准电极电势的测定对于研究电化学反应和溶液中离子的活度系数具有重要意义。
本文将介绍碘离子标准电极电势的定义、测定方法以及在实际应用中的意义。
碘离子标准电极电势的定义。
碘离子标准电极电势通常用E°(I2/I-)表示,其中I2表示碘分子,I-表示碘离子。
在标准状况下,碘离子还原成碘分子的标准电极电势为0.54V。
这个数值是通过实验测定得到的,可以用来计算其他物质的标准电极电势。
碘离子标准电极电势的测定方法。
测定碘离子标准电极电势的方法通常是利用玻璃电极和参比电极进行测量。
首先,将含有碘离子的溶液与参比电极接触,然后用玻璃电极来测量溶液的电势。
通过测量不同浓度的碘离子溶液的电势,可以得到碘离子标准电极电势的数值。
碘离子标准电极电势在实际应用中的意义。
碘离子标准电极电势在化学分析和电化学反应研究中具有重要意义。
首先,可以利用碘离子标准电极电势来计算其他物质的标准电极电势,从而推断化学反应的进行方向和速率。
其次,碘离子标准电极电势还可以用来计算溶液中碘离子的活度系数,进而得到溶液中其他离子的活度系数。
这对于溶液的化学平衡和离子交换过程的研究具有重要意义。
总结。
碘离子标准电极电势是电化学研究中的重要参数,它的测定和应用对于理解化学反应和溶液中离子行为具有重要意义。
通过测定碘离子标准电极电势,可以推断其他物质的标准电极电势,计算溶液中离子的活度系数,从而为化学分析和反应研究提供重要依据。
希望本文能够对读者理解碘离子标准电极电势有所帮助。
