探讨求解Vanderwaals方程程序设计
基于Java程序的化工热力学气体状态方程的计算及应用

程序:
import java.util.Arrays; import ermodel.HSSFWorkbook; import ermodel.HSSFSheet; import ermodel.HSSFRow; import ermodel.HSSFCell; import java.io.FileInputStream; import java.util.Scanner; public class eos {
System.out.println("The volume of liquid is:"+String.format("%.4f", z[1]*1000)+" L/mol");
System.out.println("The volume of gas is:"+String.format("%.4f", z[0]*1000)+" L/mol");
} void preos(double tc, double pc, double w,double t,double p) {
double a,b,r=8.3146,m; double[] e=new double[4],z=new double[2]; eos root=new eos(); m=0.37464+1.54226*w-0.26992* Math.pow(w,2.0); a=0.45724* Math.pow(r,2.0)* Math.pow(tc,2.0)/pc* Math.pow((1+m*(1Math.pow(t/tc,0.5))),2.0); b=0.0778*r*tc/pc; e[0]=1.0;e[1]=(b-r*t/p);e[2]=a/p-2*b*r*t/p-3* Math.pow(b,2);e[3]=b*(b*r*t/p+ Math.pow(b,2)-a/p); z=root.equa(e,z);
vlw爆轰产物状态方程的发展及应用

文章标题:探索VLW爆轰产物状态方程的发展与应用目录1. 简介2. VLW爆轰产物状态方程的基本原理3. VLW爆轰产物状态方程的发展历程4. VLW爆轰产物状态方程在能源领域的应用5. VLW爆轰产物状态方程在环境保护领域的应用6. 个人观点与总结1. 简介VLW爆轰产物状态方程(Vander Waals-Loewdin-Weisskopf爆轰产物状态方程)是一种用于描述高温、高压下爆轰产物状态的方程。
它的发展不仅对爆炸理论和实践有着重要意义,同时在能源利用和环境保护领域也有着广泛的应用。
本文将从基本原理、发展历程以及应用领域等方面来详细探讨VLW爆轰产物状态方程的全貌。
2. VLW爆轰产物状态方程的基本原理VLW爆轰产物状态方程基于Van der Waals方程,但在计算爆轰产物状态时考虑了Loewdin和Weisskopf的贡献。
它主要包括两个方面的内容:一是对爆炸产物的状态进行描述,包括了温度、压力、密度等参数;二是对爆轰反应的动力学过程进行描述,包括了爆炸产物的生成、演化和消亡等过程。
通过VLW爆轰产物状态方程,可以更准确地预测和控制爆炸反应的产物状态,从而为爆炸理论和实践提供了重要的理论支持。
3. VLW爆轰产物状态方程的发展历程VLW爆轰产物状态方程的发展经历了多个阶段,从最初的基于Van der Waals方程的简单模型,到后来加入Loewdin和Weisskopf的修正项,再到如今应用于复杂多组分爆炸产物系统的综合模型。
这一发展历程既是理论上对爆炸产物状态理解的不断深化,也是实际应用需求的不断推动。
未来,随着爆炸理论和模拟计算的不断发展,VLW爆轰产物状态方程有望在更多领域展现其价值。
4. VLW爆轰产物状态方程在能源领域的应用在能源领域,爆炸反应是一种重要的能量释放方式,而VLW爆轰产物状态方程的应用可以帮助更好地理解和控制爆炸反应的产物状态,为高效能源利用提供重要支持。
在推进剂燃烧过程中,VLW爆轰产物状态方程可以帮助优化燃烧产物的组成和性质,提高推进剂的推进效率;在爆炸引发的煤矿瓦斯治理中,VLW爆轰产物状态方程可以帮助准确预测瓦斯爆炸的产物组成和行为,从而指导瓦斯治理和利用。
高二物理竞赛真实气体的范德瓦耳斯方程课件

z
dQ
dTdSdt dz
z0
o
T2 (<T1)
dQ
dS
T1
A
T=T(z)
x
B
气体热传导现象的微观本质是分子热运动能
量的定向迁移,而这种迁移是通过气体分子无规
热运动来实现的. 可以证明:b等于1mol气体固有体积的4倍。
(3)总是伴随着涨落.
三、扩散现象 §4-6 真实气体的范德瓦耳斯方程
在一定条件下,某偶然事件出现的可能性的大小称为该事件发生的概率。 大量偶然事件从整体上反映出来的一种规律性……统计规律。
a 是一个与气体种类、气体温度有关的常数 二、热传导现象与能量的输运
可以证明:b等于1mol气体固有体积的4倍。
大量偶然事件从整体上反映出来的一种规律性……统计规律。
三、范德瓦耳斯方程 设气体各气层间无相对运动 , 且各处气体分子数密度均相同, 但气体内由于存在温度差而产生热量从温度高的区域向温度低的区域传
设N为实验总次数,NA为事件A出现的次数,则
事件A出现的概率 统计规律的特点:
pA
lim
N
NA N
(1)只对大量偶然的事件才有意义.
(2)它是不同于个体规律的整体规律(量变到质变).
(3)总是伴随着涨落.
3.统计平均值
测量物理量M: M1、M2、Mn出现次数分别为N1、 N2、Nn
M的算术平均值为
M2 a
MM
(pM m 2 oVl2)V (M mo b)lM moRl T
对于压强不是很高(低于500大气压),温 度不是太低的实际气体,范德瓦尔斯方程是很 好量。
§4-8 输运过程 气体的非平衡状态:系统各部分物理性质不均匀 如:气体内各部分的温度或压强不相等
第六讲 非线性方程求根

设方程f(x)=0有近似根xk(f `(xk)0),将f(x)在xk 展开: (在x和xk之间)
f ( ) 2 f ( x) f ( xk ) f ( xk )( x xk ) ( x xk ) 2!
可设
f ( x) f ( xk ) f ( xk )( x xk )
x
f (x ) x f ( x )
例:采用切线法求方程在区间[0.5,2]上的一个根。
x x 20
3
>> r=NewtonRoot('sqrt(x)-x^3+2',0.5,2)
r= 1.4759
弦截法(割线法) 在Newton迭代格式中,用差商近似导数,
f ( xk ) f ( xk 1 ) f ( xk ) xk xk 1
function r=FindRoots(f,a,b,eps) f_1=subs(sym(f),findsym(sym(f)),a); %两端点的函数值 f_2=subs(sym(f),findsym(sym(f)),b); mf=subs(sym(f),findsym(sym(f)),(a+b)/2); %中点函数值 if(f_1*mf>0) t=(a+b)/2; r=FindRoots(f,t,b,eps); %右递归 else if(f_1*mf==0) r=(a+b)/2; else if(abs(b-a)<=eps) r=(b+3*a)/4; else s=(a+b)/2; r=FindRoots(f,a,s,eps); %左递归 end end end 注:SUBS:Symbolic substitution. Also used to evaluate expressions numerically. SYM ; Construct symbolic numbers, variables and objects. FINDSYM:Finds the symbolic variables in a symbolic expression or matrix.
范德瓦尔斯方程与真实气体状态试验

范德瓦耳斯(Van der Walls)方程与真实气体状态实验在近代工程技术和科学研究中,经常需要处理高压或低温条件下的气体问题,例如在现代化的大型蒸汽涡轮机中,为了提高效率,都采用高压下的高温蒸汽作为工作物质;又如化学工程中的气体合成,以及许多尖端材料和产品的加工制造,也都需要在高压的条件下进行。
所以学习真实气体的物态方程及其压力、体积、温度关系的测绘方法十分必要并有意义。
实验原理:一般气体,在密度不太高,压力不太大(与大气压比较)和温度不太低(与室温比较)的实验范围内,遵守玻意耳定律、盖•吕萨克定律和查理定律。
我们把在任何情况下都遵守上述三条实验定律的气体称为理想气体。
对于质量为m,摩尔质量为M 的理想气体的物态方程为RT M m PV = (1)但真实气体只是在温度不太低,压力不太高的条件下,才能遵守理想气体的状态方程。
理想气体的等温线是等轴双曲线,而真实气体的等温线,并非都是等轴双曲线。
研究真实气体的等温线,就可了解真实气体偏离理想气体定律的情况,从而对真实气体的性质得到进一步的认识。
因此,理想气体状态方程应用到真实气体,必须考虑到真实气体的特征,予以必要的修正。
上世纪以来,许多物理学家先后提出了各种不同的修正意见,建立了各种不同形式的气体状态方程,其中形式较为简单,物理意义比较清楚的就是范德瓦耳斯方程。
范德瓦耳斯方程为RT b V V a P ννν=−+))((22 (2)式中是考虑到气体分子本身体积的修正量,对于给定的气体,是一个恒量,可由实验来测定,一般约等于1摩尔气体分子本身体积的四倍。
另一常数是由气体分子间的引力引起,决定于气体的性质,可由实验来测定。
对于一定量气体,其摩尔数b b a M m =ν。
图1:CO 2实验等温线 图2: 范德瓦耳斯三次方程图范德瓦耳斯方程等温线与真实气体的实验等温线作比较(见图1),二者都有一条临界等温线。
在临界等温线以上,二者比较接近;在温度很高时,二者之间没有区别,在临界等温线以下,却有显著的区别。
vanderwaals方程

vanderwaals方程van der Waals方程是荷兰物理学家Johannes Diderik van der Waals于1873年所提出的一种修正的气体状态方程。
传统的理想气体状态方程是基于理想气体模型推导得出的,其中假设气体分子是无大小、无相互作用及无体积的点粒子。
然而在高压、低温条件下,气体分子之间存在相互吸引力和有体积的效应,这些效应对气体的真实行为产生了显著影响,因此需要引入修正项。
van der Waals方程是对理想气体状态方程的修正,考虑了气体分子之间的相互作用和体积效应。
(P + a(n/V)^2)(V - nb) = nRT其中P为气体的压强,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的温度,a和b分别为van der Waals方程的修正参数,代表了吸引力和体积效应的影响。
修正项a用于考虑气体分子之间的吸引力效应。
吸引力使得气体分子更接近,导致气体分子的平均动能减小。
所以修正项a在方程中呈现为负号。
修正参数a的数值大小与分子间力的强度成正比,表示了分子间吸引力的强弱程度。
修正项b用于考虑气体分子的体积效应。
实际气体分子具有一定的体积,导致气体的真实体积比理想气体的体积要大。
所以修正项b在方程中也呈现为负号。
修正参数b的数值大小与分子的体积成正比,表示了分子间体积的大小。
van der Waals方程适用于理论和实验上对气体行为的描述。
通过修正的van der Waals方程,可以更准确地计算气体的压强、体积和摩尔数之间的关系。
特别是在高压、低温情况下,van der Waals方程的修正项对气体行为的描述更加精确。
除了van der Waals方程外,研究者们还提出了一些其他的修正方程,如Redlich-Kwong方程、Peng-Robinson方程等。
这些方程都是基于类似的思路,引入修正项来更好地描述气体的真实行为。
这些修正方程在工程领域和实际应用中有着广泛的应用,能够提供更准确的气体性质计算和预测。
范德堡方程

范德堡方程
【原创实用版】
目录
1.范德堡方程的定义和背景
2.范德堡方程的应用领域
3.范德堡方程的解法和实例
4.范德堡方程的局限性和未来发展
正文
范德堡方程,又称范德堡微分方程,是一种描述流体力学中涡旋运动的偏微分方程。
该方程最早由 19 世纪荷兰物理学家范德堡(L.van der Burgh)提出,用以研究液体中的涡旋运动,从而解释流体力学中的一些现象。
范德堡方程在流体力学、气象学、海洋学等领域有着广泛的应用。
范德堡方程的应用领域主要集中在涡旋运动和湍流现象的研究。
在气象学中,范德堡方程可以用来研究气旋和反气旋的运动,从而预测天气变化。
在海洋学中,范德堡方程可以用来研究海洋涡旋的运动,如海流和潮汐等。
此外,范德堡方程还在流体力学、空气动力学、生物流体力学等领域有着广泛的应用。
范德堡方程的解法通常采用数值方法,如有限差分法、有限元法等。
通过数值计算,可以求解出方程的解,从而得到涡旋运动的详细描述。
在实际应用中,范德堡方程的解可以帮助工程师和科学家更好地理解流体力学现象,从而优化设计和提高效率。
然而,范德堡方程也有其局限性。
由于它是一个偏微分方程,解法相对复杂,对计算机技术和数学方法的要求较高。
此外,范德堡方程只能描述一定范围内的流体力学现象,对于更复杂的现象,如多相流、非牛顿流等,范德堡方程可能无法准确描述。
因此,未来在范德堡方程的研究上,还需要进一步拓展其适用范围,提高解的精度和效率。
总之,范德堡方程作为一种描述流体力学中涡旋运动的偏微分方程,在多个领域有着广泛的应用。
探讨求解Van der waals方程程序设计
1 前 言
( P+na v ) V—n =n T 2/ 2 ( b) R
计 算 机 和 化学 的密 切 结 合 是 当 代 自然 科 学 的 一 个 重 要 发 展 方 向 。在 化学 当 中 有 大 量 的方 程 其 数 学 处 理 过 程 十 分 麻烦 , 与 运 算 的 数 据 量 往 往 非 常 大 , 计 算 参 而 机拥 有计 算 速 度 快 , 算 结 果 准 确 , 观 等 多 种 优 点 , 运 直 计 算 机 已 发 展 了 6 余 年 , 这 6 余 年 中 , 生 了 大 量 o 在 o 产 的程 序 设 计 语 言 , 中 c语 言 功 能 丰 富 , 达 能 力 强 , 其 表
一
使 用 灵 活 广 泛 , 用 面 广 。例 如 : 真 实 气 体 状 况 方 程 应 求
涉 及 到 一 个 复 杂 的 一元 三 次 方 程 , 工 计 算 的 话 , 费 手 耗 大 量 时 间 , 且 容 易 发 生 错 误 , 们 可 以用 c语 言 编 写 并 我 出计 算 机 程序 , 户 只 需 要 输 入 要 测 试 的 数 据 , 可 以 用 就 通 过 程 序 产 生 结 果 。这 样 不 仅 答 案 准 确 而 且 运 算 速 度 明显 加 快 , 何 将 计 算 机 应 用 到 化 学 领 域 中 成 为 现 在 如
4 4 4.
些气体的临界参数①
P/ a eP
1. 9 0 27X 16 0. 2 0 2 9X 1 6 4. 3X 1 6 6 0
1 2 0 1. 8 X 1 6 2 1 0 2. 1X 1 6
1 6. 2 2 1 9. 7 2 1 4. 5 8 3 4. 2 6 1 0. 5 7
① 引 自 G. B r w.h s a c e i r . 1 8 . ( M. a o p yi hm s y 5 9 8 4 经量 r c l t . 3
热力学状态方程

Tr
T TC
m 0.480 1.574 0.1762
是偏心因子,是物性常数
(3)S-R-K方程
迭代法:将S-R-K方程变形为便于计算机计算的迭代 形式:
其中, A a(T ) p R2T 2
B bp RT
(3)S-R-K方程
应用条件:
SRK方程可用于汽液两相PVT性质的计算,在工 业上获得了广泛的应用;
(4) Peng-Robinson方程
其中,
a( T ) ( T ) ac
ac
0.45724
R2Tc2 pc
b 0.07780 RTc pc
(T
)
[1
m(1
T 0.5 r
)]2
m 0.37464 1.54226 0.269922
(4)Peng-Robinson方程
p RT a( T ) v b v( v b )
R-K方程中,a=f(物性) S-R-K方程中,a(T)=f(物性、T )
(3)S-R-K方程
其中,
a( T
)
ac( Tr
)
0.42747
R2Tc2 pc
( Tr
)
( Tr
)
[1
m( 1
T 0.5 r
ቤተ መጻሕፍቲ ባይዱ
)]2
b 0.8664 RTc pc
2 p V 2
T
TC
V VC
0
a 0.42748R2Tc2.5 pc
b 0.08664RTc pc
ab 称为状态方程的参数,只与物性有关,与P、V、T
2.3 立方型状态方程

立方型状态方程的求解方法
(1)利用立方型状态方程的基本形式求解。 已知V、T,求解P 解题思路: ① 查表找出物质的Tc,Pc,ω 等参数,计算出 a,b,α (T)等参数。 ② 计算过程中,统一单位。 ③ 列出相应的状态方程,带入相应的参数。 ④ 根据状态方程所涉及到的未知参数,采用相应的 公式求解出。 ⑤ 带入数据求解。 举例:例2-2。(陈忠秀教材P9例2-1)
举例:例2-4(陈新志教材P18例2-2)。
定义参数h:
b B h V Z
PR方程可以表示成另外一种形式:
1 A h Z 2 1 h B 1 2h h
PV Z RT
2.3.5 立方型状态方程的根及其求解方法
给定T和V,由立方型状 态方程可直接求得P 。但大 多数情况是由T和P求 V 。 当T > Tc 时,立方型状态 方程有一个实根,它是气体 容积。 当T<Tc时,高压下立方 型状态方程有一个实根,它 是液体容积。低压存在三个 不同实根,最大的V值是蒸 气容积,最小的V值是液体 容积,中间的根无物理意义。
231vanderwaalsvdw方程第一个同时计算汽液两相表达临界点的方程其它立方型方程的基础形式简单ab是常数准确度低实际应用少计算常数采用了临界等温线在临界点的条件prtvbav???2关于vdw常数和临界压缩因子zc临界等温线在c点的斜率和曲率等于零??0222?????????????cccctvabvrtvp??0624322??????????????cccctvabvrtvp解方程组得方程常数389cccvbvrta??ccccccccccccvrtvvrtvvrtvabvrtp8389322???????可得到375
(3) 利用立方型状态方程的三次展开式求解 已知T、P,求解V。 ◆在临界点,方程有三重实根,所求实根即为Vc; ◆当T<Tc,压力为相应温度下的饱和蒸气压时,方 程有三个实根,最大根是气相摩尔体积VV (ZV ), 最小根是液相摩尔体积VL (ZL ),中间根无物理 意义。 ◆其他情况下,方程有一实根和两个虚根,其实根 为 液 相 摩 尔 体 积 VL ( ZL ) 或 气 相 摩 尔 体 积 VV (ZV)。
范德华 范德华方程

范德华(J.D.vanderwaals1837—1923)荷兰物理学家。
青年时代家境贫寒,无力入学读书。
在工作之余,刻若钻研,自学成才,1874年他的论文“论液态和气态的连续性”引起了学术界的关注。
并获得了莱顿大学的博士学位。
经过研究,他认识到如果假定气体分子不占有体积,而且分子之间不存在引力,则可从气体分子运动论得出理想气体的状态方程,但是,这两项假定不符合事实。
1881年,他给这个方程引入两个参量,分别表示分子的大小和引力,得出一个更准确的方程即范德华方程。
他还研究了毛细作用,对附着力进行了计算。
他在研究物质三态(气、液、固)相互转化的条件时,推导出临界点的计算公式,计算结果与实验结果相符。
1877—1910年任阿姆斯特丹大学教授。
1910年因研究气态和液态方程获诺贝尔物理学奖。
原子间和分子间的吸引力被命名为范德华力。
1873年他最先假设了这种力,以研究关于真实气体的理论范德华方程范德华方程是范德瓦耳斯方程的另一种翻译,简称范氏方程,是荷兰物理学家范德瓦耳斯(van der Waals,又译“范德华”、“凡德瓦耳”)于1873年提出的一种实际气体状态方程。
范氏方程是对理想气体状态方程的一种改进,特点在于将被理想气体模型所忽略的的气体分子自身大小和分子之间的相互作用力考虑进来,以便更好地描述气体的宏观物理性质。
范德华方程式具体形式为更常用的形式为(N=摩尔数)式中p为气体的压强a'为度量分子间重力的唯象参数b'为单个分子本身包含的体积v为每个分子平均占有的空间大小(即气体的体积除以总分子数量); k为波兹曼常数T绝对温度在第二个方程式里V为总体积a为度量分子间重力的参数b为1摩尔分子本身包含的体积之和b= NAb', R为普适气体常数NA为阿伏加德罗常数. 下表列出了部分气体的a,b的值范德华方程常用的形式(N=摩尔数)在一般形式的范氏方程中,常数a和b 因气体/流体种类而异,但我们可以通过改变方程的形式,得到一种适用于所有气体/流体的普适形式。
立方型状态方程如vanderWaals

PV B Z 1 RT V
特点: (1)实用性,维里方程的两截式适用于小于临界温度、压力约为 1.5MPa的蒸气,而且准确度很高。当压力大于5MPa时,两截式 的准确度下降,需要用三项式; (2)维里系数,对于一定的纯物质来说,维里系数都只是温度的 函数;第二维里系数的取值与Z-P图上的等温线在P→0时的斜率 有关。维里方程的两截式可以表示为
临界点数学特征:
p 0 V T Tc 2 p 0 2 V T Tc
* t点和c点都是物质的特性常数,对不同的物质,它们是 不同的。
纯流体的状态方程
状态方程是描述流体的P-V-T关系的数学解析式,主要 有以下三类: 立方型状态方程 如van der Waals、RK、SRK、 PR等;
27 R Tc a 64 pc
2
2
RTc b 8 pc
状态方程的Zc值
对任何气体,Van der Waals方程给出一个固定的Zc值,即 Zc=
0.375,但大多数流体的 Zc=0.23~0.29范围内变化 ;
根据气体的临界参数,即可求出Van der Waals方程常数
a,b,从而可进行p-V-T关系的计算;
1 V
RT
例2-1 1mol异丁烷在273.15K下的体积为 1.4 104 cm3 ,用 维里方程计算其压力。 解:查附录得:Tc = 408.1K,Pc = 0.3648MPa,ω= 0.176,故Tr = 0.6693
B 0 0.1445 0.33/ Tr 0.1385/ Tr2 0.000607 / Tr3 0.7132 B1 0.0637 0.33/ Tr2 0.423/ Tr3 0.08/ Tr8 0.8136 BPc B 0 B1 0.8564 , B 796.9cm3 / mol RTc
用VisualFoxpro语言编程求解范德华方程的根

张桂军 钟 宏(中南大学化学化工学院 ,长沙 410000)摘 要 :范德华方程求解真实气体的体积 ,传统的求解方程的根的方法是试差 法 ,花费大量的时间 ,且精度达不到要求 ,改用 Visual Fo x p r o 语言进行程序设计以后 , 难题迎刃而解 。
关键词 : V isual Fo x p r o 语言 ;牛顿迭代法 ;范德华方程 中图分类号 : TQ02111文献标识码 :A文章编号 :1003 - 6490 (2008) 02 - 0055 - 02时的摩尔体积 。
查手册得 O 2 的范德华常数为 :a = 01138 P a ·m 6 ·m ol - 2 ,b = 3181 ×10 - 5 m 3 ·m ol - 1将已知数据代入上式得 :0 引 言范德华方程是最早的描述气体压力 、温度 、体积 三参数相互关系的状态方程 ,通过该方程求解真实气 体在确定温度 、压力下的体积 ,既是物理化学的重要 教学内容 ,同时 ,也是一个教学难点 。
范德华方程为 :15156 ×106 ×V 3- 56m- ( 3181 ×10×15156 ×10 )V 2 m + 01138 V - 01138 ×3181 ×10 - 5= 0 m 由试差法解得 :- 4 3- 1V m = 2110 ×10m ·m ola p + ( V -b ) = R T V 2 m m用试差法计算工作量较大 ,如果范德华常数 a 和b 的值不能直接查手册得到时 ,还需用用气体的临界 常数计算 ,经验公式如下 :式中 : P —压力 , P aV m —摩尔体积 ,m 3 ·m ol - 1 T —温度 , K a 、b —范德华常数R —理想气体常数 ,81314J ·m ol - 1 ·K - 1 。
变人工黏性的一维van der Waals流体模型稳态解的分析与相关计算

变人工黏性的一维van der Waals流体模型稳态解的分析与相关计算史洪雪; 黄晋阳【期刊名称】《《北京化工大学学报(自然科学版)》》【年(卷),期】2019(046)006【总页数】6页(P95-100)【关键词】van der Waals流体; 相变; 人工黏性; 周期边界条件【作者】史洪雪; 黄晋阳【作者单位】北京化工大学数理学院北京100029【正文语种】中文【中图分类】O29引言气液流体相变是自然界和化学化工领域常见的现象。
van der Waals 流体方程组是描述一类气液流体相变的模型,其分析与计算在流体动力学中占有重要的地位。
在数值模拟时,如果按照原始模型计算,由于气液流体在相变区的不稳定性,模型的解会出现剧烈的振荡。
为解决这一问题,通常在连续性方程中加入人工黏性项以抑制振荡。
近年来,对于带人工黏性的非理想流体,其初边值问题解的性态分析有不少研究。
文献[1 -3]讨论了类van der Waals 流体周期边界下解的存在性、有界性和渐近稳定性;文献[4 -8]讨论了van der Waals 流体多种情况下解的渐近稳定性。
以上文献中的黏性系数一般取为常数,但是在分析和计算时,人工黏性应主要在不稳定的椭圆区(相变区)起作用,而当人工黏性系数为常数时,在整个求解区域内都用到了同样程度的人工黏性,这就意味着在稳定的非椭圆区中加入了多余的黏性,从而增大了非椭圆区内的误差。
针对这一问题,本文将人工黏性系数取为依赖于质量密度(或比容)的函数,使密度在非椭圆区时的人工黏性较小,在不稳定的椭圆区时的人工黏性增大,以减缓震荡,从而在一定程度上减少误差,提高数值模拟的准确性。
本文针对Lagrange 坐标下具有变人工黏性系数的一维van der Waals 等温模型的周期初边值问题,通过构造泛函进行相关估计,给出了其解只有平凡解和存在非平凡解且容易判别的充分条件,并对理论结果进行了相关数值验算,同时也对初边值问题进行了计算。
第二章2.2立方型方程

其中,
A a (T ) p R T
2
2
B bp RT
(3)S-R-K方程
应用条件:
SRK方程可用于汽液两相PVT性质的计算,在工
业上获得了广泛的应用;
尤其适用于烃类体系,其精度很高。
(4)Peng-Robinson方程
P-R方程是对Van der Waals和R-K方程的进一步 修正,一般形式为:
输出Z,V值
结束
(2)R-K方程的根及其求解方法
迭代法示意图:
h
h0
2
(1)
Z0
Z
(2)R-K方程适用条件
R-K方程为VDW方程的改进,虽然也是两参数方 程,其精度却高很多。
R-K方程适用于气体pVT性质的计算;
对非极性、弱极性物质误差在2%左右,对 于强极性物质误差在10-20%。
(5)应用(直接计算)
当T=20℃时,分别代入R-K方程、S-R-K方程、P-R方程计算。 P-
R方程给出的结果更可靠些。
当T=-20℃时, S-R-K方程计算的结果为P=3.125MPa。 而从文献查得此温度下的乙烯的饱和蒸汽压是2.528MPa, 显然乙烯会发生液化。是否全部液化,要看目前的摩尔体 积是否小于此温度下的饱和液体摩尔体积。从文献查得,
p
RT v b
a( T ) v( v b ) b( v b )
R-K方程中,a=f(物性) P-R方程中,a(T)=f(物性、T )
(4) Peng-Robinson方程
其中,
a( T ) ( T ) ac
a c 0 . 45724 R Tc pc
2 2
van der Waals状态方程及其对科学的贡献

2van der Waals 状态方程及其对科学的贡献19世纪初,在Boyle(玻义耳)、Gay -Lussac(盖-吕萨克)和Avogadro(阿伏伽德罗)等学者的努力下,一个能够描述低密度气体pVT 行为的经验方程pV m =RT (2-1)已被确立,式中R 是一个普适的常数,称为摩尔气体常数,V m 为气体的摩尔体积。
但是,要说发展成一个理论,应当归功于德国物理学家R J E Clausius(克劳修斯),他在1857年首先用气体分子运动论导得了这个方程。
在推导中,他为低密度气体设想了如下微观模型:①气体是大量分子的集合体。
②分子在容器中作无规则运动,它们的运动遵守牛顿运动定律。
③分子本身的大小可以忽略不计。
④除了碰撞外,分子间没有相互作用。
⑤分子间和分子与器壁间的碰撞是弹性碰撞。
显而易见,这是一个十分粗放的理想模型。
完全符合这种模型的气体称为理想气体。
故式(2-1)称为理想气体状态方程。
理想气体状态方程的一个显著特征是:它的等温线总是一些双曲线。
无论温度多么低,压力多么高,都不可能使其液化,故理想气体是一种永久气体。
显然,这与人们的经验很不相符。
经验表明,任何物质都能够气液相变,在一定的温度下都有确定的饱和蒸气压,温度愈高,饱和蒸气压愈大。
然而,这种平衡关系是否会随温度的升高而无限地保持下去呢?这个看似简单的问题,却让不少著名物理学家困惑了近50年,直到1869年才得出了明确的结论。
这归功于英国物理学家T Andrews(安德鲁斯),他用了将近十年的时间,对气体的压缩性做了一系列实验,特别是二氧化碳。
他发现随着温度的升高,平衡的气液两相密度差逐渐缩小,到了31℃时,两者差别消失,蒸发焓变为零,即气液平衡到此终止。
Andrews 称此为“临界点”,意即以此为界,当温度超过31℃时,无论压力多高,都不可能使气体液化。
当Andrews 将这些实验结果在英国皇家学会作了题为“论物质液态和气态的连续性”报告后,立即引起了世界各国学者的关注。
简述van deemter方程对气相色谱法条件选择的指导作用

简述van deemter方程对气相色谱法条件选择的指导作用全文共四篇示例,供读者参考第一篇示例:Van Deemter方程是描述气相色谱分离效率的经典方程,它对气相色谱法条件选择具有重要的指导作用。
本文将简要介绍Van Deemter方程的原理和意义,以及它在气相色谱法条件优化中的应用。
Van Deemter方程由荷兰科学家Van Deemter于1956年提出,是描述气相色谱柱传质及分离效率与载气线速率之间的关系的经典方程,其基本形式为:H = A + B/u + CuH为总峰高(分离效率),A为固定相的分散程度,B/u为扩散带宽,Cu为流体动力学带宽。
这个方程的含义非常重要,可以帮助分析柱末端带宽及其对色谱分离的影响,进而指导色谱条件的优化。
Van Deemter方程揭示了扩散带宽、固定相的分散程度和流体动力学带宽对柱效率的影响。
通过实验测定这些参数,可以定量评估分离过程中各种因素的影响程度,从而有针对性地优化柱条件。
Van Deemter方程与柱温、载气流速等操作参数之间的关系帮助人们在实验中快速获得最佳条件,提高分离效率和分析速度。
通过调节温度和流速等条件,可以有效地降低带宽,提高分离效率。
Van Deemter方程还可以帮助优化柱长度,达到更好的分离效果。
通过调节柱长度和内径,使得不同化合物在柱中的保留时间有所不同,从而实现更好的分离效果。
Van Deemter方程对气相色谱法条件选择的指导作用不容忽视。
它为色谱条件的选择和优化提供了理论依据和量化分析的方法,使得色谱分析更加准确、高效。
在实际应用中,科研人员可以根据Van Deemter方程的原理和公式,合理选择条件,优化实验设计,提高分析效率和准确度。
第二篇示例:Van Deemter方程是描述气相色谱法条件选择的重要数学模型。
它揭示了色谱柱效率与流速、固定相特性和柱尺寸之间的相互关系,可帮助色谱分析人员优化色谱实验条件,提高分离效率。
§1.7.3 范德瓦斯方程

修正。
对气体压强来说一般不会有排斥力(四)气体中的内压强
•理想气体中只有动理压强, •真实气体中除了有动理压强外还 应有由于分子间作用力产生的压 强。 总的压强是这两者之和. 气体中分子是基本不接触相互分离. 分子间作用力主要反映为吸引力, 所以吸引力产 生压强与动理 压强方向相反。
• 理想气体不考虑分子的固有体积,所以理想气体方程 中容器的体积V 就是每个分子可以自由活动的空间。
•
•
如果把分子看作有一定大小的刚性球,则每个分子 能有效活动的空间不再是V 。
若1mol气体占有Vm体积,分子能自由活动空间的体
积为Vm -b。则有
•
Vm-b = RT/p
•
p = RT/(Vm-b)
• 因为△pi为分子吸引力压强修正量称为气体内压强,故
p i {单位时间内碰在单位面 积上平均分子数 } 2k
(1 / 6 ) n v 2 k
△k与分子数密度n 成正比(为什么?),设比例系数
为K, 则
△k = K n
1 6
故
N
A
pi
n v 2 Kn (
)
2
v 2(
分子力的合力方向
合力 为零
过界面层过程中,都受 到一指向气体内侧的力。
指向气体内侧的力使分子碰撞器壁产生的动量改变要比 不考虑分子引力时要小。器壁实际受到压强要比气体内 部的压强小。 设分子吸引力所减少的压强量值为pi , p i
称为气体内压强修正量。简称气体内压强。
假定仪器所测出的真实气体压强为p, 又假定真实气体内部压强为p内 则
。
(注意气体内压强 pi 和气体内部压强 p内是不同的)
p内 > p (为什么?) p + pi = p内
计算范德瓦尔斯气体体积的简单方法

大学物理COLLEGE PHYSICS1999年 第18卷 第7期 Vol.18 No.7 1999计算范德瓦尔斯气体体积的简单方法吴剑峰 黄金聪 吴瑞贤 摘 要 范德瓦尔斯方程是体积V的三次方程.本文提供一种用计算机迭代求解体积的方法,此法能快速、精确地迭代计算,且能根据不同要求进行快速迭代.用计算机迭代计算的方法也可对其他物理问题的函数进行近似计算. 关键词 范德瓦尔斯气体;迭代法 分类号 O 414.1A SIMPLE METHOD OF CALCULATING THE VOLUME OF VANDER WAALS’ GASWu JianfengDepartment of Computer, University of Electronic Science and Technology, Chengdu, 610054,China; 2)Huang JincongFirst Middle School of Xianyou, Xianyou, Fujian, 351200, China;Wu RuixianDepartment of Physcis, Sichuan University, Chengdu, 610064, China; Abstract The equation of van der Waals is a cubic equation about volume. It is introduced a method for calculatation of volume through iteration by a computer. This method is fast and accurate, and can fit defferent claims. This method can be used for other physical questions as well. Key words van der Waals' gas; iteration method1 引言 理想气体状态方程只是在压强不高、温度不低时实际气体的一级近似方程.当压强较高时就不能用理想气体状态方程来处理.范德瓦尔斯方程是考虑了分子力的影响得出的,是实际气体的二级近似方程.在不是高压时可用范德瓦尔斯方程来处理实际气体.1 mol气体的范德瓦尔斯方程[1]为 (1)任意质量M的范德瓦尔斯方程为 (2)式中a、b为该气体的范德瓦尔斯修正系数,μ为气体摩尔质量.对于一定质量的气体,若已知压强p、体积V、温度T中的任意两个参量,就可通过式(1)或式(2)计算出另一个参量.然而对于已知压强p和温度T,要计算范德瓦尔斯气体体积V时,因为式(2)为V的三次方程,则不易求解.由于各种实际气体的范德瓦尔斯修正数a、b都较小,故可采用迭代近似法求解.但多次迭代计算麻烦,耗时较多,且易出错,因而在大学教材习题中大都避开计算范德瓦尔斯气体体积的问题.本文将提出一种用计算机迭代快速、准确求解范德瓦尔斯气体体积的方法,并举例说明.2 用迭代法计算体积 将范德瓦尔斯方程式(2)改写为 (3)用迭代法计算体积时,由于修正项范德瓦尔斯常数a、b较小,作零级近似时,忽略了a、b修正项,视为理想气体,零级近似的体积为V0=(MRT)/(μp)将零级近似代入式(3),得到一级近似再将一级近似代入式(3),得到二级近似这样逐次迭代下去,直到某一级近似与下一级近似的值近似相等,则该级近似值就是此体积的解[2].由于近似精度的要求不同,则迭代次数不同.有时迭代的次数很多,计算很复杂,且易出错,特别是要求计算精度较高时更是如此.3 用计算机快速、准确地计算体积 用计算机数学软件迭代计算式(3).根据精度要求决定迭代次数,也可自动迭代计算,还可列出一系列迭代后的近似值.下面举例来说明. 例1 将100 atm*、27 ℃时0.320 kg的氧气视为范德瓦尔斯气体,试计算氧气的体积. 用计算机自动迭代计算得到V=0.00226268m3=2.262 68×10-3m3 也可以列出一系列迭代后的近似值 {0.00246101, 0.00232794, 0.00228551, 0.00227083, 0.00226561, 0.00226374, 0.00226306, 0.00226282, 0.00226273, 0.0022672, 0.00226269, 0.00226269, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268, 0.00226268,}从表中可以看出,按照规定的精度,计算机已自动迭代计算了34次.4 小结 这种用计算机数学软件进行迭代计算的方法,能够根据不同的要求对函数进行n次迭代,可以根据精度要求提出的迭代中止条件对函数进行迭代,也可以对函数自动迭代并可列出一系列迭代后近似值.用计算机能快速、方便、精确地进行迭代计算,除了能迭代计算范德瓦尔斯气体的体积外,还可以对其他物理问题的函数进行迭代近似求解.这是应用计算机处理物理问题的一种很好的方法.作者单位:吴剑峰(电子科技大学计算机系,成都 610054); 黄金聪(福建仙游县第一中学,仙游 351200); 吴瑞贤(四川大学物理系,成都 610064)参考文献 1 吴瑞贤,杜定旭,杨友梅.热学教程.成都:四川大学出版社,1986.286 2 徐行.热学.北京:高等教育出版社,1990.296 * atm为标准大气压,它与帕的关系为1 atm=101 325 Pa.按国家标准,atm属“不赞成使用”的单位——编者注收稿日期:1998-05-20计算范德瓦尔斯气体体积的简单方法作者:吴剑峰, 黄金聪, 吴瑞贤, Wu Jianfeng, Huang Jincong, Wu Ruixian作者单位:吴剑峰,Wu Jianfeng(电子科技大学计算机系,成都,610054), 黄金聪,Huang Jincong(福建仙游县第一中学,仙游,351200), 吴瑞贤,Wu Ruixian(四川大学物理系,成都,610064)刊名:大学物理英文刊名:COLLEGE PHYSICS年,卷(期):1999,18(7)引用次数:2次1.吴瑞贤.杜定旭.杨友梅热学教程 19862.徐行热学 19901.吴剑峰.吴瑞贤微机在热学教学及教学研究中的应用[期刊论文]-大学物理 2003(3)2.任保文.李存志经验性状态方程[期刊论文]-大学物理 2001(5)本文链接:/Periodical_dxwl199907007.aspx下载时间:2010年6月17日。
化工热力学标准答案(第三版).

Tc=425.2K Pc=3.800MPa
( 1)理想气体方程
V=RT/P=8.314 ×510/2.5 1×06=1.696 ×10-3m3/mol 误差: 1.696 1.4807 100% 14.54%
1.4807
(2)Pitzer 普遍化关系式
对比参数: Tr T Tc 510 425.2 1.199 Pr P Pc 2.5 3.8 0.6579 —普维法
2-8.试用 R-K 方程和 SRK 方程计算 273K、101.3MPa下氮的压缩因子。
已知实验值为 2.0685
解:适用 EOS 的普遍化形式
查 附 录 二 得 NH 3 的 临 界 参 数 : Tc=126.2K ω =00.4
2
2
T
1 k 1 Tr0.5
1 0.7433 1 1.1060.5
0.9247
aT
ac T
0.45724 R2Tc2 T Pc
8.3142 405.62
6
2
0.45724
11.28 106
0.9247 0.4262Pa m mol
b
0.07780 RTc Pc
0.07780
8.314 405.6 11.28 10 6
vanderwaals方程2rtapvbv???由zfxy的性质1yxzzxyxyz????????????????????????????得1tpvpvtvtp????????????????????????????又??232tpartvvvb???????????vprtvb??????????所以??2321partvvbvtrvb???????????????????????????3232prvvbvtrtvavb????????????故????22312prvvbvvtrtvavb??????????????????222312tvvbvkvprtvavb??????????????32
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
探讨求解Van der waals方程程序设计
刘小理李芳
(南昌理工学院生物环境工程系计算机系,江西南昌330013)
摘要:求解van der waals方程涉及到求一元三次方程的解,手工计算比较复杂,该文提出了用计算机程序求解实际气体摩尔体积van der waals方程的程序设计方法。
关键词:实际气体摩尔体积程序设计
1前言
计算机和化学的密切结合是当代自然科学的一个重要发展方向。
在化学当中有大量的方程其数学处理过程十分麻烦,参与运算的数据量往往非常大,而计算机拥有计算速度快,运算结果准确,直观等多种优点,计算机已发展了60余年,在这60余年中,产生了大量的程序设计语言,其中C语言功能丰富,表达能力强,使用灵活广泛,应用面广。
例如:求真实气体状况方程涉及到一个复杂的一元三次方程,手工计算的话,耗费大量时间,并且容易发生错误,我们可以用C语言编写出计算机程序,用户只需要输入要测试的数据,就可以通过程序产生结果。
这样不仅答案准确而且运算速度明显加快,如何将计算机应用到化学领域中成为现在研究的热点。
2程序设计探讨
2.1van der waals方程求解实际气体摩尔体积推导
根据van der waals方程:
(P+n2a/v2)(V-nb)=nRT
对于1mol实际气体,状态方程变形为:
(P+a/v2)(Vm-b)=RT
上述方程整理为:PVm3-(P.b+R.T)Vm2+aVm-ab=0
方程中a,b常数可以从相应的资料查出;R=8.314 (J/mol#k),代入一组P,T值即可求出对应的Vm值;但是,要解如此复杂的一元三次方程,并且要保证Vm有一定的精确度,并非易事。
为此,我们设计了计算机程序,可以快速准确计算Vm值。
2.2有关方程的讨论
2.2.1方程中,P为实际气体的压力,单位为Pa;T为绝对温度,单位为K;Vm为实际气体摩尔体积,单位为m3/mol;R为气体常数,单位为8.314(J/mol#k);a为van der waals常数,单位为Pa.m6/mol2;b为van der waals常数,单位为m3/mol.
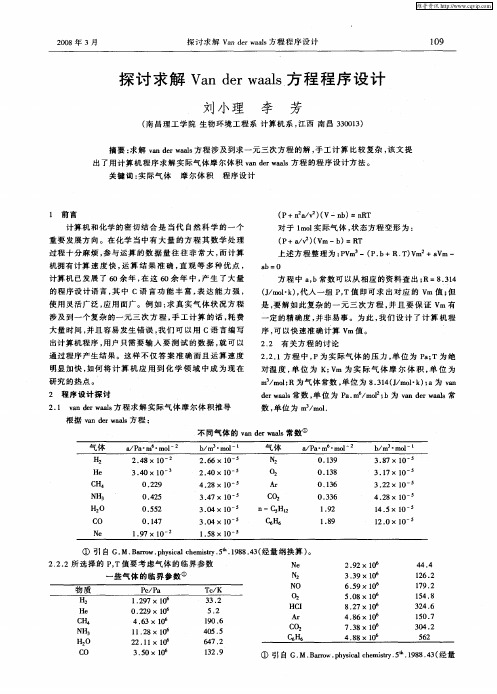
不同气体的van der waals常数¹
气体a/Pa#m6#mol-2b/m3#mol-1气体a/Pa#m6#mol-2b/m3#mol-1 H2 2.48@10-2 2.66@10-5N20.139 3.87@10-5 He 3.40@10-3 2.40@10-5O20.138 3.17@10-5 C H40.229 4.28@10-5Ar0.136 3.22@10-5 NH30.425 3.47@10-5CO20.336 4.28@10-5 H2O0.552 3.04@10-5n-C5H12 1.9214.5@10-5 CO0.147 3.04@10-5C6H6 1.8912.0@10-5 Ne 1.97@10-2 1.58@10-5
¹引自G.M.Barrow.physical chemistry.5th.1988.43(经量纲换算)。
2.2.2所选择的P,T值要考虑气体的临界参数
一些气体的临界参数¹
物质Pc/Pa Tc/K
H2 1.297@10633.2
He0.229@106 5.2
C H4 4.63@106190.6
NH311.28@106405.5
H2O22.11@106647.2
C O 3.50@106132.9
Ne 2.92@10644.4
N2 3.39@106126.2
NO 6.59@106179.2
O2 5.08@106154.8
HCI8.27@106324.6
Ar 4.86@106150.7
CO27.38@106304.2
C6H6 4.88@106562
¹引自G.M.Barrow.physical chemis try.5th.1988.43(经量
109
2008年3月探讨求解Van der waals方程程序设计
纲换算)。
(3)一元三次方程可能出现下述几种解的情况
a.一个负实数,二个复数;
b.三个负实数
c.一个正实数,二个复数
d.一个正实数,二个负实数
e.二个正实数。
一个负实数
f.三个正实数
对于a.b二种情况应该自动去掉,对于c,d二种情况应去掉复数和负实数解,对于e,f二种情况,可把实际气体看成理想气体,应用理想气体状态公式P#Vm= RT,计算出Vm值,在正实数中取最接近者为最后结果。
2.2.3Vm的最后结果应精确到小数点后第四位。
2.3算法分析
PVm3-(P.b+R.T)Vm2+aVm-ab=0
此方程为一个一元三次方程,有多种方式可以解该一元三次方程,如:二分法,牛顿迭代法,卡丹公式等等,但以往的解题比较复杂,缺乏直观性,我们这里采用/盛金公式[4]0,并将计算机程序设计应用到该方程的求解过程中,使计算结果更准确和迅速。
在上述公式当中a,b,R均为已知,可以由论文前的表格查出,在程序设计过程当中,只要用户输入一组P,T的值即可由程序求出Vm
将公式PVm3-(P.b+R.T)Vm2+aVm-ab=0转换成ax3+bx2+cx+d=0的形式
即令X=Vm a1=P b1=-(Pb+RT)c=a d=-ab
使用盛金公式[4]当中的重根判别式
A=b12-3a1.c
B=b1.c-9a1.d
C=c2-3b1.d
总判别式:
$=B2-4AC。
当$=B2-4AC>0时
X1=(-b-(Y11/3+Y21/3))/(3a);
X2,3=(-2b+Y11/3+Y21/3?31/2(Y11/3-Y21/ 3)i)/(6a);
其中Y1,2=Ab+3a(-B?(B2-4AC)1/2)/2,i2= -1。
2.4
流程图2.5若干算例)))计算值与试验值对比
以CO2气体为例
(1)P=1.013@105Pa,T=320K
实验值Vm=0.0262,计算机精确求解Vm=0.0261
(2)P=1.013@105Pa,T=320K
实验值Vm=0.00252,计算机精确求解Vm=0.0026
(3)P=40.52@105Pa,T=320K
实验值Vm=0.00054,计算机精确求解Vm=0.0005
3结果与讨论
求解实际气体的摩尔体积,历经几十年,提出了近百种状态方程,其中最经典的为van der weals方程。
但方程数学处理十分麻烦,随着科学技术的日益发展,以及计算机技术的普及,如何将计算机技术应用于化学领域,从而开创一个完全崭新的研究方面,已成为目前计算机与化学交叉学科的研究重点。
本文作了一点探讨,本文提出的程序设计方法,思路明确程序简单,实用效果较好,用户在使用时,只要输入P,T值,就可立即得到Vm的值。
参考文献
[1]何玉萼,袁永明,薛英.物理化学(上册)[M].北京化
学工业出版社,2006.7:173-174
[2]天津大学物理化学教研室编.物理化学(上册)[M],
北京人民教育出版社,1979.1:21-26
[3]谭浩强.C程序设计(第二版)[M].清华大学出版
社,1999.12:106-120
[4]范盛金.一元三次方程的新求根公式与新判别法
[J].海南师范学院学报(自然科学版).1989,2(2): 91-98
110江西化工2008年第1期。
