2010版《中国药典》纯化水标准及检测项目
2010版药品GMP指南水系统

水系统1、概述水在制药工业中是应用最广泛的工艺原料,用做药品的成份、溶剂、稀释剂等。
制药用水作为制药原料,各国药典定义了不同质量标准和使用用途的工艺用水,并要求定期检测。
水极易滋生微生物并助其生长,微生物指标是其最重要的质量指标,在水系统设计,安装,验证,运行和维护中需采取各种措施抑制其生长。
水是良好的溶剂、尤其是与自然界失去平衡的纯化水和注射用水,具有极强的溶解能力和极少的杂质,广泛用于制药设备和系统的清洗。
鉴于水在制药工业中的既作为原料又作为清洗剂,各国药典对制药用水的质量标准,用途都有明确的定义和要求;各个国家和组织的GMP将制药用水的生产和储存分配系统视为制药生产的关键系统,对其设计,安装,验证,运行和维护等提出明确要求。
在指南第二章将具体介绍我国和其他国家药典和GMP对制药用水的要求。
我国幅员辽阔,各地水质不同,季节的变化也会导致水质的巨大变化,我国制药企业使用的最初原料水未必常年符合饮用水的标准要求,需将其依次处理成饮用水,纯化水,注射用水等制药用水,适合不同的工艺需求。
在指南第三章中将介绍制药用水处理的各种技术,工艺和设备。
制药生产中其它原料、辅料、包装材料是按批检验和释放的,而作为原料的制药用水(饮用水,纯化水或注射用水)通常是通过管道连续流出的,随时取用的,其微生物属性等质量指标通常无法连续地实时检测到。
通常是先使用到产品中,若干天后才能知道其微生物指标是否合格,为保证制药用水系统生产出的水在任何时候是好的,即水系统生产质量的稳定性和一致性是各国药品监管部门和制药企业共同关注的重大问题。
各国GMP对水系统的设计和验证有严格要求,第四章将介绍水系统的设计和验证。
在水系统的设计、验证和运行过程中,制药企业、药监部门都遇到各种各样的疑问、问题和争议,我们参照国际组织尤其是ISPE(国际制药工程协会)的指南和工程实践,在第五章对常见问题进行了讨论。
第六章介绍一些关于水的化学和微生物知识以及水系统的钝化技术。
2010版药品GMP指南水系统

水系统1、概述水在制药工业中是应用最广泛的工艺原料,用做药品的成份、溶剂、稀释剂等。
制药用水作为制药原料,各国药典定义了不同质量标准和使用用途的工艺用水,并要求定期检测。
水极易滋生微生物并助其生长,微生物指标是其最重要的质量指标,在水系统设计,安装,验证,运行和维护中需采取各种措施抑制其生长。
水是良好的溶剂、尤其是与自然界失去平衡的纯化水和注射用水,具有极强的溶解能力和极少的杂质,广泛用于制药设备和系统的清洗。
鉴于水在制药工业中的既作为原料又作为清洗剂,各国药典对制药用水的质量标准,用途都有明确的定义和要求;各个国家和组织的GMP将制药用水的生产和储存分配系统视为制药生产的关键系统,对其设计,安装,验证,运行和维护等提出明确要求。
在指南第二章将具体介绍我国和其他国家药典和GMP对制药用水的要求。
我国幅员辽阔,各地水质不同,季节的变化也会导致水质的巨大变化,我国制药企业使用的最初原料水未必常年符合饮用水的标准要求,需将其依次处理成饮用水,纯化水,注射用水等制药用水,适合不同的工艺需求。
在指南第三章中将介绍制药用水处理的各种技术,工艺和设备。
制药生产中其它原料、辅料、包装材料是按批检验和释放的,而作为原料的制药用水(饮用水,纯化水或注射用水)通常是通过管道连续流出的,随时取用的,其微生物属性等质量指标通常无法连续地实时检测到。
通常是先使用到产品中,若干天后才能知道其微生物指标是否合格,为保证制药用水系统生产出的水在任何时候是好的,即水系统生产质量的稳定性和一致性是各国药品监管部门和制药企业共同关注的重大问题。
各国GMP对水系统的设计和验证有严格要求,第四章将介绍水系统的设计和验证。
在水系统的设计、验证和运行过程中,制药企业、药监部门都遇到各种各样的疑问、问题和争议,我们参照国际组织尤其是ISPE(国际制药工程协会)的指南和工程实践,在第五章对常见问题进行了讨论。
第六章介绍一些关于水的化学和微生物知识以及水系统的钝化技术。
符合2010版GMP要求的纯化水URS

纯化水检测标准

纯化水检测标准纯化水是一种经过多种处理工艺去除各种杂质和离子的水,它在许多行业中都有着广泛的应用,如制药、电子、化工等。
因此,对纯化水的质量进行检测是非常重要的。
本文将介绍纯化水检测的标准,以便相关行业人员了解如何进行准确的检测。
首先,纯化水的检测需要遵循一定的标准方法。
常见的检测项目包括电导率、溶解氧、总有机碳、微生物菌落总数等。
针对不同行业对纯化水质量的要求,各国标准化组织都发布了相应的标准,如美国环保局(EPA)、欧洲药典(EP)、中国药典(CP)等。
在进行纯化水检测时,需要根据具体的行业标准选择相应的检测项目和方法。
其次,纯化水的检测设备也需要符合相应的标准。
常见的检测设备包括电导率仪、溶解氧仪、总有机碳仪等。
这些设备需要定期进行校准和维护,以确保检测结果的准确性和可靠性。
同时,操作人员也需要接受相应的培训,掌握正确的操作方法和注意事项。
另外,纯化水的检测结果需要进行准确的记录和分析。
检测结果应当及时记录在检测报告中,并进行相应的数据分析。
如果检测结果不符合标准要求,需要及时采取措施进行调整和改进,以确保纯化水的质量符合要求。
最后,纯化水的检测工作需要建立健全的质量管理体系。
这包括建立完善的纯化水检测标准和方法、规范的检测设备管理、严格的操作规程和培训、定期的质量审核等。
只有通过建立健全的质量管理体系,才能保证纯化水的质量稳定可靠。
总之,纯化水的检测是非常重要的,它关系到许多行业的生产和产品质量。
因此,相关行业人员需要严格遵循标准方法进行检测,并建立健全的质量管理体系,以确保纯化水的质量符合要求。
希望本文能对相关行业人员有所帮助,谢谢阅读!。
中国药典纯化水检验标准

中国药典纯化水检验标准一、酸碱度按照中国药典规定,纯化水的酸碱度应该符合以下要求:pH值在5.0-7.0之间,以保证其符合药典规定的范围。
测试酸碱度的样品应该在使用之前进行取样,并且使用酸碱度试纸进行检测。
二、硝酸盐硝酸盐是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的硝酸盐含量不得超过0.00005%。
测试硝酸盐的样品应该在使用之前进行取样,并且使用硝酸盐试纸进行检测。
三、亚硝酸盐亚硝酸盐也是纯化水中常见的污染物之一,其含量过高会对人体健康产生影响。
因此,中国药典规定纯化水中的亚硝酸盐含量不得超过0.00001%。
测试亚硝酸盐的样品应该在使用之前进行取样,并且使用亚硝酸盐试纸进行检测。
四、氨氨是一种有毒物质,其含量过高会对人体健康产生影响。
因此,中国药典规定纯化水中的氨含量不得超过0.00005%。
测试氨的样品应该在使用之前进行取样,并且使用氨试纸进行检测。
五、氯化物氯化物是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的氯化物含量不得超过0.001%。
测试氯化物的样品应该在使用之前进行取样,并且使用氯化物试纸进行检测。
六、硫酸盐硫酸盐是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的硫酸盐含量不得超过0.001%。
测试硫酸盐的样品应该在使用之前进行取样,并且使用硫酸盐试纸进行检测。
七、钙钙是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的钙含量不得超过0.002%。
测试钙的样品应该在使用之前进行取样,并且使用钙试纸进行检测。
八、镁镁是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的镁含量不得超过0.002%。
测试镁的样品应该在使用之前进行取样,并且使用镁试纸进行检测。
纯化水验证检测指标

4.整个水质监测分为三个“验证”周期,每个周期7天4.1.1.纯化水箱取样频率:每天取样一次检测项目:理化指标、微生物指标、电导率检测方法: 按企业《纯化水检验规程》(根据中国药典2010年版二部纯化水标准及微生物检测标准制定)执行。
标准:《纯化水质量标准》(根据现行中国药典2010年版二部纯化水标准及微生物检测标准制定)。
4.1.2.总送水取样频率:每天取样一次检测项目:理化指标、微生物指标、电导率检测方法: 按企业《纯化水检验规程》(根据中国药典2010年版二部纯化水标准及微生物检测标准制定)执行。
标准:《纯化水质量标准》(根据现行中国药典2010年版二部纯化水标准及微生物检测标准制定)。
4.1.3.总回水口(附件13性能确认水质检测报告)取样频率:每天取样一次检测项目:理化指标、微生物指标、电导率检测方法: 按企业《纯化水检验规程》(根据中国药典2010年版二部纯化水标准及微生物检测标准制定)执行。
标准:《纯化水质量标准》(根据现行中国药典2010年版二部纯化水标准及微生物检测标准制定)。
4.1.4.各使用点取样频率:每个“验证”周期轮流取样一次,共3次检测项目:理化指标、微生物指标、电导率检测方法: 按企业《纯化水检验规程》(根据中国药典2010年版二部纯化水标准及微生物检测标准制定)执行。
标准:《纯化水质量标准》(根据现行中国药典2010年版二部纯化水标准及微生物检测标准制定)。
4.2. 异常情况处理程序4.2.1.在纯化水制备系统性能确认过程中,应严格按照系统标准操作程序、维护保养程序、取样程序、检验规程进行操作;按质量标准进行判定,当个别取样点纯化水质量不符合标准的结果时,应按下列程序处理; 4.2.2.在不合格点重新取样,重新检测不合格项目或全项;必要时,在不合格点的前后分段取样,进行对照检测,以确定不合格原因;4.2.3.若附属系统运行方面的原因,需报验证小组,调整运行参数或对系统进行处理。
2010版《中国药典》纯化水标准及检测项目
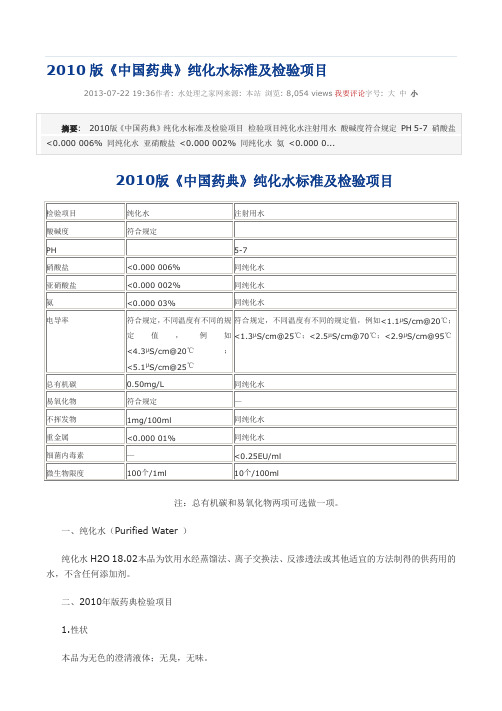
2010版《中国药典》纯化水标准及检验项目2013-07-22 19:36作者: 水处理之家网来源: 本站浏览: 8,054 views我要评论字号: 大中小注:总有机碳和易氧化物两项可选做一项。
一、纯化水(Purified Water )纯化水H2O 18.02本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何添加剂。
二、2010年版药典检验项目1.性状本品为无色的澄清液体;无臭,无味。
取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
3.硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
4.亚硝酸盐取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2))0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(.0000 02%)。
5.氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 03%)。
纯化水电导率标准及测定方法

5
二、纯化水电导率测定方法
2. 注射用水 (1)可使用在线或离线电导率仪完成。在表2 温度 和电导率限度表中,找到不大于测定温度的最接近温 度值,表中对应的电导率值即为限度值。如测定的电 导率值不大于表中对应的限度值,则判为符合规定; 如测定的电导率值大于表中对应的限度值,则继续按 (2)进行下一步测定。 (2)取足够量的水样(不少于100ml)至适当容器 中,搅拌,调节温度至25℃,剧烈搅拌,每隔5 分钟 测定电导率,当电导率值的变化小于0.1μ S/cm时, 记录电导率值。如测定的电导率不大于2.1μ S/cm, 则判为符合规定;如测定的电导率大于2.1 μ S/cm, 继续按(3)进行下一步测定。
2
二、纯化水电导率测定方法
本法是用于检查制药用水的电导率进而控制水中电解质总量的一种测定方法。 电导率是表征物体导电能力的物理量,其值为物体电阻率的倒数。单位是S/cm (Siemens)或μ S/cm。 纯水中的水分子也会发生某种程度的电离而产生氢离子与氢氧根离子,所以纯 水的导电能力尽管很弱,但也具有可测定的电导率。水的电导率与水的纯度密切 相关,水的纯度越高,电导率越小,反之亦然。当空气中的二氧化碳等气体溶于 水并与水相互作用后,便可形成相应的离子,从而使水的电导率增高。 当然,水中含有其他杂质离子时,也会使电导率增高。另外,水的电导率还与 水的pH值与温度有关。
3
二、纯化水电导率测定方法
1.仪器和操作参数 测定水的电导率必须使用精密的并经校正的电导率仪,电导率仪的电导池包括 两个平行电极,这两个电极通常由玻璃管保护,也可以使用其它形式的电导池。 根据仪器设计功能和使用程度应对电导率仪定期进行校正,电导池常数可使用电 导标准溶液直接校正,或间接进行仪器比对,电导池常数必须在仪器规定数值的 ±2%范围内。进行仪器校正时,电导率仪的每个量程都需要进行单独校正。仪器 最小分辨率应达到0.1 μ s/cm,仪器精度应达到±0.1 μ s/cm。 温度对样品的电导率测定值有较大影响,电导率仪可根据测定样品的温度自动 补偿测定值并显示补偿后读数。水的电导率采用温度修正的计算方法所得数值误 差较大,因此本法采用非温度补偿模式,温度测量的精确度应在±2℃以内。
制药用纯化水的定义与用途

四、制药工艺用水的质量标准
在《中国药典》2010 版中,规定纯化水检查项目包括酸碱度; 硝酸盐;亚硝酸盐;氨; 电导率;总有机碳;易氧化物;不挥发物;重金属;微生物限 度,其中总有机碳和易氧化物 两项可选做一项。与2005 版相比,增加了电导率和总有机碳 的要求,取消了氯化物、硫酸 盐与钙盐的检验项目。
净得瑞宗旨
专业专 注
创造卓 越
客户至 上
谢谢!
制药用纯化水的定义与用途
一、制药用水的定义、用途
制药用水通常指制药工艺过程中用到的各种质量标准的水。
对制药用水的定义和用途,通常以药典为准。
各国药典对制药用水通常有不同的定义、不同的用途规定。
二、中国制药用水的定义、水质要求和应用范围
【法规要求】 在《药品生产质量管理规范》2010 修订版通则和附录中有如下要求: 《药品生产质量管理规范》2010 修订版: 第九十六条 制药用水应适合其用途,并符合《中华人民共和国药典》 的质量标准及相关要 求。制药用水至少应采用饮用水。 第一百条 应对制药用水及原水的水质进行定期监测,并有相应的记录。 附录1 第五十条 无菌原料药的精制、无菌药品的配制、直接接触药品 的包装材料和器具 等最终清洗、 A/B 级区内消毒剂和清洁剂的配制用水应符合注射用水 的质量标准。 附录2:原料药 第十一条 非无菌原料药精制工艺用水应至少符合纯化 水的质量标准。 附录5:中药制剂 第三十三条 中药材洗涤、浸润、提取用工艺用水的 质量标准不得低于 饮用水标准,无菌制剂的提取用工艺用水应采用纯化水。
在《中国药典》2010 版中,规定注射用水检查pH 值;氨; 硝酸盐与亚硝酸盐、电导率、总有机碳、不挥发物与重金 属;细菌内毒素;微生物限度。与2005 版相比,增加了电 导率和总有机碳的要求。 在《中国药典》2010 版中,规定灭菌注射用水检查pH 值; 氯化物、硫酸盐与钙盐;二氧化碳;易氧化物;硝酸盐与 亚硝酸盐、氨、电导率、不挥发物与重金属;细菌内毒素。
2010版药典纯化水

2010版药典纯化水
2010年版的药典中,纯化水通常指的是经过特定纯化工艺处理
的水,用于制药、实验室和其他相关领域的需要。
根据药典的规定,纯化水必须符合一定的纯度标准,包括微生物限度、溶解物质含量、电导率等方面的要求。
在药典中,通常会详细描述纯化水的生产工艺、质量标准、储存要求等内容,以确保其符合药品生产和实验室
使用的需要。
纯化水在制药和实验室领域具有重要的应用价值,因
此药典对其质量要求非常严格,以确保药品和实验结果的准确性和
可靠性。
版药典纯化水设备制作要求及标准

2010版药典纯化水设备制作要求及标准1purpose目的本URS文件规定了纯化水系统的用户需求,总括了用户对该设备的功能、性能、制造及标准等方面的要求。
本URS文件是构建起项目和系统的文件体系的基础,同时也是验收的主要依据。
2scope范围本URS文件的范围自原水进水阀开始至纯水灭菌后输出的整个纯水制备系统。
包括设备配电控制柜、电仪系统、原水进水自动阀、纯化水泵、臭氧灭菌器等。
3responsibility职责质量部质量工程师负责编写和发行本URS文件。
设备部厂务工程师负责按本URS文件确认和验收纯化水系统。
4referencedocuments参考文件《中华人民共和国药典》2010年版《中华人民共和国药品质量管理规范(2010年版)》《钢制件焊接常压容器》JB/T4735-95GB/T19249-2003反渗透水处理设备GB/T《机械产品电气安全要求通用要求》5Procedure程序使用要求URSNo: 需求编号Requirements需求Require/Expect必须/期望URS001 纯化储罐水量:吨必须URS002 制水机产水量:吨/小时必须URS003 纯化水指标:符合中国药典(2010版)纯化水指标必须URS004 生产出水点:5个(生产洁净区3个,实验室2个)必须技术要求工艺技术总要求URSNo: 需求编号Requirements需求Require/Expect必须/期望URS005 纯化水质符合《中华人民共和国药典》2010年版要求电导率小于2μS/cm(25℃,在线控制),TOC控制在L内(离线控制),不挥发物小于1mg/100ml,微生物限度100个/1ml,pH5-7,硝酸盐<006%,亚硝酸盐<002%,氨<03%,重金属<01%必须URS006 纯化水制备系统的设计基于如下原水数据:按城市饮用水供水水质进行设计必须URS007 系统设计应最大限度地减少微生物生长的可能,应最大限度地减少系统死点必须URS008 任何与纯化水接触的材料必须满足GMP的要求,所用钢材必须是304L以上不锈钢必须/304卫生级管件URS009 整个系统必须具备可靠的消毒功能必须URS010 为了控制纯化水产品的质量,必须控制总送水、原水储罐和总回水。
制药用水中TOC的检测——岛津应对2010药典

可吹除有机碳(Purgeable Organic Carbon):指样品在室温下酸化和气流吹扫 去除 IC 的过程中,可以被除去的 TOC 部分。
不可吹除有机碳(Non-Purgeable Organic Carbon):指样品在室温下酸化和气 流吹扫去除 IC 以后,仍然留下的 TOC 部分
样品中各种形态的化合氮在含铂金催化剂的TOC燃烧管中,720℃下被转化 成NO,NO又被总氮测定单元所产生的臭氧(O3)激发成NO2*(激发态的NO2)。 NO2*返回到基态时,将发射 590-2500 nm的光,由化学发光检测器 (硅光二极 管检测器)测定。为了安全,NOx和臭氧分别用NOx 吸收器(碱石灰)和臭氧 处理单元(含有二氧化锰)除去。
制药用水中总有机碳的测定
一、TOC 测定原理
水是制药工业和药物调剂中使用最多的物料,制药用水的质量对于药品质量 来说至关重要。制药用水中的有机物质一般来自水源、供水系统(包括净化、贮 存和输送系统)以及水系统中菌膜的生长。检查制药用水中有机碳总量,可以间 接控制水中的有机物含量。
美国药典(USP)与欧洲药典(EP)分别于1996年与1998年规定,医用注射 用水(WFI,Water for Injection)与纯化水(PW,Purified Water)必须检测TOC 值(Total Organic Carbon,总有机碳),以反映制药用水中有机物质的总量。2010 中国药典也规定纯化水和注射用水必须检测TOC。
燃烧法是含碳物质在高温和催化剂的条件下被完全氧化为二氧化碳的过程; 湿法是通过紫外光照射、过硫酸盐催化剂或加热(或三者结合)将样品中的含碳 物质氧化为二氧化碳。湿法灵敏度高,但氧化能力不强,不能完全氧化高浓度或 颗粒状的 TOC 样品。燃烧法的氧化能力强,使用高灵敏度催化剂,检出限可以 达到 4μg/L,完全满足药典对 TOC 分析仪的要求。 (1) TC 的测定
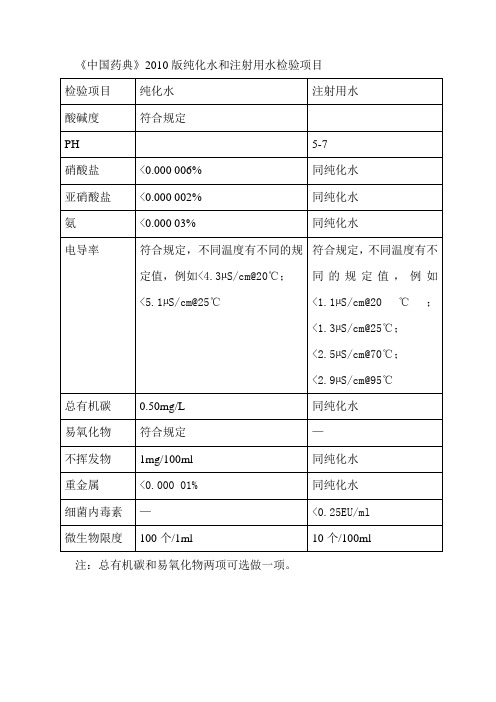
《中国药典》2010版纯化水和注射用水检验项目
检验项目
纯化水
注射用水
酸碱度
符合规定
PH
5-7
硝酸盐
<0.000 006%
同纯化水
亚硝酸盐
<0.000 002%
同纯化水
氨
<0.000 03%
同纯化水
电导率
符合规定,不同温度有不同的规定值,例如<4.3µS/cm@20℃;
<5.1µS/cm@25℃
符合规定,不同温度有不同的规定值,例如<1.1µS/cm@20℃;<1.3µS/cm@25℃;
电导率(µS/cm)
温度(℃)
电导率(µS/cm)
0
0.6
55
2.1
5
0.8
60
2.2
10
0.9
65
2.4
15
1.0
70
2.5
20
1.1
75
2.7
25
1.3
80
2.7
30
1.4
85
2.7
35
1.5
90
2.7
40
1.7
95
2.9
45
1.8
100
3.1
50
1.9
温度(℃)
电导率(µS/cm)
温度(℃)
电导率(µS/cm)
0
2.4
60
8.1
10
3.6
70
9.1
20
4.3
75
9.7
25
5.1
80
9.7
30
5.4
90
9.7
40
制药用水检测项目及注意事项

制药用水检测项目及注意事项第一部分、制药用水所检项目有哪些?制药用水根据不同的使用范围分为饮用水、纯化水、注射用水和灭菌注射用水。
这里我们只针对纯化水(PW)和注射用水(WFI)进行分析讨论。
根据中国药典规定,PW需检验项目为:性状、酸碱度、氨、硝酸盐、亚硝酸盐、电导率、总有机碳(TOC)、不挥发物、重金属、微生物限度。
WFI所需检验项目与PW相比,将酸碱度更换为pH值,增加了细菌内毒素控制,其余检验项目与PW基本相同,但是微生物的控制标准要严于PW的标准。
第二部分、微生物限度检测方法的确认根据非无菌产品微生物限度检测方法的要求,应进行培养基适用性检查和计数方法适用性试验。
纯化水培养基适用性检查方面,相应进行R2A琼脂培养基的适用性检查,菌株为铜绿假单胞菌和枯草芽孢杆菌。
以及无菌培养试验。
方法:取不大于100cfu菌液,于购买的R2A琼脂培养基,快速涂布,每一菌株平行2个平板。
同样操作涂布与中检院购买的对照培养基,培养5天。
无菌培养试验:取2平皿,作为阴性对照培养。
标准:被测培养基上的菌落平均数与对照培养基上的菌落平均数比值应在0.5-2之间,菌落形态、大小一致。
无菌培养,培养基上无微生物生长。
纯化水计数方法适用性方面,水作为无抑菌作用的溶剂,进行微生物回收试验意义不大,因此,应不进行计数方法适用性试验。
R2A培养基,营养欠丰富,有利于损伤微生物的回收,培养时间不低于5天。
第三部分、准备工作注意哪些?(1)仪器设备及耗材:检测前要根据所要检测的项目,检查所用仪器/设备(如天平、pH计、电导率仪、培养箱等)是否经过了校准,是否在校准效期内,有些仪器还需要使用前校准或日校,比如天平,pH计。
微生物限度检验所用的生物安全柜(或超净工作台)、微生物过滤系统和培养箱应保证在确认效期内。
用到的关键耗材,如微孔滤膜及滤杯等物料应保证其无菌性,可购买一次性无菌过滤器,也可在经验证的灭菌程序下灭菌,并在经验证的有效期内使用,但微孔滤膜不建议用户自行湿热灭菌,因为湿热灭菌可能会引起滤膜孔径的改变,除非有充分的证据证明灭菌后的滤膜仍满足使用需求。
中国药典2010

《中国药典》(2010年版)规定:“纯化水为采用蒸馏法、离子交换法、反渗透法,EDI法或其他适宜的方法制得供药用的水。
”而不再仅局限于“蒸馏”这一种工艺。
药典这一改变是我国制药用水生产发展史上的一大进步,与世界先进国家的药典实现了接轨。
药典将注射用水规定为“纯化水经蒸馏所得的水”。
而USP已连续在7个版本中明确规定反渗透(reverse osmosis,RO)法可以作为制取注射用水的法定方法,显示了人们对采用膜技术生产制药用水的信心。
膜分离法生产制药用水是制药用水技术发展的必然趋势。
目前,国内、外多数制药企业采用离子交换及反渗透、离子交换联合等方法制得纯化水,再经蒸馏的方法制取注射用水。
上述制药用水生产工艺中,离子交换技术作为深度除盐手段仍被普遍采用。
但离子交换树脂再生时会产生大量废酸、废碱,严重污染环境,发展受到制约。
反渗透膜对水中的细菌、热原、病毒及有机物的去除率达到100%。
二级反渗透虽可以免除使用离子交换树脂,但对原水的含盐量要求极高,因为目前反渗透装置的系统脱盐率为98%左右,如果原水含盐量高,则产水电导率就会超过控制指标。
医药用纯水对水质要求相对来说更加严格,更加高。
常要求超纯水的电阻值应高于15兆以上。
为保证医药用超纯水的用水安全,超纯水的处理设备整个系统也都由全不锈钢材质组合而成,而且在用水点之前都必须装备杀菌装置。
我们公司从整个医药行业用超纯水的特点出发,针对不同用户对高纯水的不同要求,采用反渗透,EDI等最新工艺,比较有针对性地设计出成套高纯水处理工艺,以满足药厂、医院的纯化水制取、大输液制取的用水要求。
[编辑本段]分类制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB 5749 -2006《生活饮用水卫生标准》。
按2010中国药典规定,饮用水不能直接用作制剂的制备或试验用水。
《中国药典》2010年版附录部分内容

通用检测方法和指导原则主要增修订内容
1、一部共16项,其中新增6项:
电泳测定法
渗透压摩尔浓度测定法
等离子体发射光谱法 大孔树脂有机残留物测定法 聚合酶链式反应法 中药特征图谱指导原则
通用检测方法和指导原则主要增修订内容
2、二部共45项,新增12项:
核磁共振波谱法 离子色谱法 电导率测定法 锥入度检查法 2-乙基己酸测定法 光学显微镜法 拉曼光谱法指导原则 溶出度测定指导原则 药物多晶型研究指导原则 蛋白质含量测定法 合成多肽中醋酸测定法 氨基酸测定指导原则
通用检测方法和指导原则主要增修订内容
离子色谱法
1、有机、无机阴阳离子和低分子量亲水性 有机分子的分离测定 2、氨基酸不经衍生化直接测定 3、某些抗生素的有关物质检查 4、金属的形态与价态分析
通用检测方法和指导原则主要增修订内容
拉曼光谱法指导原则 1、与红外光谱一样,同为分子的振动光谱 ∞ Ψ IR 与偶极矩变化相关│Mnm│= ∫ n ΡΨm dτ
紫外-可见分光光度法 1、波长校正 增加了高氯酸钬溶液的校正(以10% 高氯酸为溶剂,配制含4%氧化钬的溶液) λmax nm:241.13,278.10,287.18,333.44, 345.47,361.31,416.28,451.30, 485.29,536.64,640.52nm。 2、波长允差 紫外区 ±1nm 500nm ±2nm 700nm ±4.8nm
通用检测方法和指导原则主要增修订内容
酸败度检查法 羰基值的原计算公式有误 A 羰基值= 854 ×W V ×1000 V 1、854的各种醛的2,4-二硝基苯腙的ε ,而不是mε 2、V1 供试品稀释总体积 V2 测定用供试品稀释液体积 S 25ml
纯化水验证检测指标

4.整个水质监测分为三个“验证”周期,每个周期7天4.1.1.纯化水箱取样频率:每天取样一次检测项目:理化指标、微生物指标、电导率检测方法: 按企业《纯化水检验规程》(根据中国药典2010年版二部纯化水标准及微生物检测标准制定)执行。
标准:《纯化水质量标准》(根据现行中国药典2010年版二部纯化水标准及微生物检测标准制定)。
4.1.2.总送水取样频率:每天取样一次检测项目:理化指标、微生物指标、电导率检测方法: 按企业《纯化水检验规程》(根据中国药典2010年版二部纯化水标准及微生物检测标准制定)执行。
标准:《纯化水质量标准》(根据现行中国药典2010年版二部纯化水标准及微生物检测标准制定)。
4.1.3.总回水口(附件13性能确认水质检测报告)取样频率:每天取样一次检测项目:理化指标、微生物指标、电导率检测方法: 按企业《纯化水检验规程》(根据中国药典2010年版二部纯化水标准及微生物检测标准制定)执行。
标准:《纯化水质量标准》(根据现行中国药典2010年版二部纯化水标准及微生物检测标准制定)。
4.1.4.各使用点取样频率:每个“验证”周期轮流取样一次,共3次检测项目:理化指标、微生物指标、电导率检测方法: 按企业《纯化水检验规程》(根据中国药典2010年版二部纯化水标准及微生物检测标准制定)执行。
标准:《纯化水质量标准》(根据现行中国药典2010年版二部纯化水标准及微生物检测标准制定)。
4.2. 异常情况处理程序4.2.1.在纯化水制备系统性能确认过程中,应严格按照系统标准操作程序、维护保养程序、取样程序、检验规程进行操作;按质量标准进行判定,当个别取样点纯化水质量不符合标准的结果时,应按下列程序处理; 4.2.2.在不合格点重新取样,重新检测不合格项目或全项;必要时,在不合格点的前后分段取样,进行对照检测,以确定不合格原因;4.2.3.若附属系统运行方面的原因,需报验证小组,调整运行参数或对系统进行处理。
2010版《中国药典》纯化水标准及检测项目
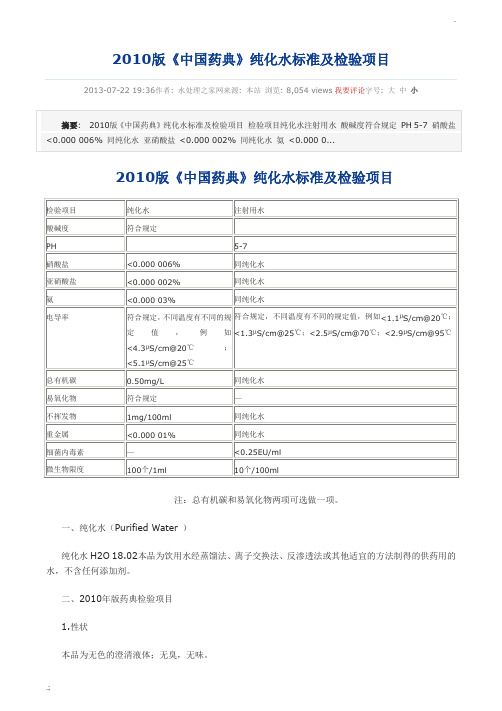
2010版《中国药典》纯化水标准及检验项目2013-07-22 19:36作者: 水处理之家网来源: 本站浏览: 8,054 views我要评论字号: 大中小注:总有机碳和易氧化物两项可选做一项。
一、纯化水(Purified Water )纯化水H2O 18.02本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何添加剂。
二、2010年版药典检验项目1.性状本品为无色的澄清液体;无臭,无味。
取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
3.硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
4.亚硝酸盐取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2))0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(.0000 02%)。
5.氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 03%)。
中国药典纯化水总有机碳标准

中国药典纯化水总有机碳标准标题:中国药典纯化水总有机碳标准
一、引言
中国药典(中国医学科学院、中国药科大学主编)是我国医药领域最具权威性和参考价值的药物、药品标准文献,其中纯化水总有机碳标准是对药品纯化水质量的重要指标之一。
二、纯化水的重要性
1. 纯化水在药品制造中的应用
2. 纯化水对药品质量的影响
三、纯化水总有机碳标准的制定
1. 标准制定的目的和意义
2. 相关标准制定的背景
3. 标准制定的过程和参与方
4. 标准的主要内容和要求
四、纯化水总有机碳的检测方法
1. 传统的化学检测方案
2. 先进的仪器检测方法
3. 检测方法的选择和应用范围
五、纯化水总有机碳的控制和提高
1. 控制纯化水总有机碳的来源
a) 原水源和前处理工艺的选择
b) 各个处理步骤的控制方法
2. 提高纯化水总有机碳的清除率
a) 合理设置纯化器设备
b) 优化纯化过程参数
c) 寻找更有效的清除方法
3. 纯化水总有机碳监测和评估
a) 定期监测和检验
b) 对检测结果的分析和问题分析
六、纯化水总有机碳标准的应用与展望
1. 标准在药品生产中的应用情况
2. 标准的不足和改进方向
3. 对未来纯化水总有机碳标准的展望
七、结论
纯化水总有机碳标准在药品制造中起到重要的指导作用,对确
保药品质量和生产安全有着不可忽视的意义。
在未来的发展中,
应进一步完善标准和检测方法,提高纯化水总有机碳的控制水平,为我国医药行业的发展做出更大的贡献。
备注:以上仅为参考,具体内容可以根据实际需要进行修改和
扩充。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2010版《中国药典》纯化水标准及检验项目
2013-07-22 19:36作者: 水处理之家网来源: 本站浏览: 8,054 views我要评论字号: 大中小
注:总有机碳和易氧化物两项可选做一项。
一、纯化水(Purified Water )
纯化水H2O 18.02本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何添加剂。
二、2010年版药典检验项目
1.性状
本品为无色的澄清液体;无臭,无味。
取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
3.硝酸盐
取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
4.亚硝酸盐
取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2))0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(.0000 02%)。
5.氨
取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 03%)。
6.电导率
电导率≤2μS/cm (电阻率≥0.5 MΩ.CM)
7.总有机碳
不得过0.50mg/L(附录VIII R)。
8.易氧化物
取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
9.不挥发物
取本品100ml,置105℃恒重的蒸发皿中,在水浴上蒸干,并在105℃干燥至恒重,遗留残渣不得过1mg。
取本品100ml,加水19ml,蒸发至20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,加硫代乙酰胺试液2ml,摇匀,放置2分钟,与标准铅溶液1.0ml加水19ml用同一方法处理后的颜色比较,不得更深(0.000 01%)。
11.微生物限度
取本品,采用薄膜过滤法处理后,依法检查(附录XIJ),细菌、霉菌和酵母菌总数每1ml不得超过100个。
