蛋白质化学-肽结构
蛋白质的化学结构

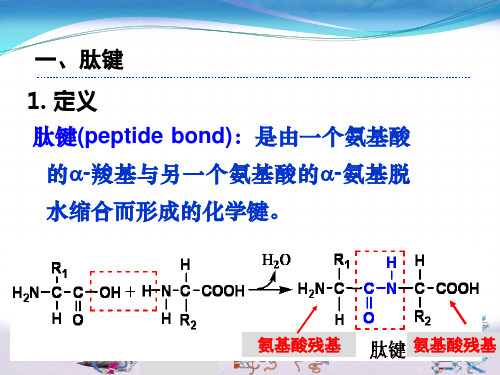
第二章蛋白质第三节蛋白质的化学结构一、肽键及多肽链(一)基本概念肽键:蛋白质分子中不同氨基酸是以相同的化学键连接的,即前一个氨基酸分子的α-羧基与下一个氨基酸分子的α-氨基缩合,失去一个水分子形成肽(peptide),该C-N化学键称为肽键(peptide bond)。
多肽:由两个氨基酸分子缩合而成的肽称为二肽;含三个氨基酸的肽,称为三肽,以此类推;含20个以上的称多肽(polypeptide)。
肽与蛋白质之间无明显界限,50个以上氨基酸构成的肽一般称蛋白质。
氨基酸残基:蛋白质中的氨基酸不再是完整的氨基酸分子,称为氨基酸残基。
H2N CH C OCH COHOH2N CH CRON CH CR OHOH多肽链:通过肽键连接而成的链状结构称为多肽链(polypeptide chain),其骨架由-N-Cα-C-重复构成。
书写格式:把含有α-NH2的氨基酸残基写在多肽链的左边,称为N-末端(氨基端),把含有α-COOH的氨基酸残基写在多肽的右边,称为C-末端(羧基端)。
除肽键外,蛋白质中还含有其他类型的共价键,例如,蛋白质分子中的两个半胱氨酸可通过其巯基形成二硫键(-S-S-,又称二硫桥),这是蛋白质分子中一种常见的共价键,可存在于多肽链内部或两条肽链之间。
(二)肽类存在的生理意义肽类作为小分子蛋白质,在体内有一些相当重要的功能,并有一定的应用价值。
如:1.神经肽的类似物内啡肽(endorphins),可作为天然的止痛药物;2.动物体内的谷胱甘肽具有重要生理功能,它是由谷氨酸、半胱氨酸和甘氨酸构成,其中谷氨酸以γ-羧基而不是α-羧基与半胱氨酸形成肽键。
二、蛋白质的一级结构(一)蛋白质一级结构的概念蛋白质的一级结构(primary structure)是指多肽链上各种氨基酸残基的排列顺序。
一级结构的基本结构键是肽键。
一级结构是蛋白质的结构基础,也是各种蛋白质的区别所在,不同蛋白质具有不同的一级结构。
(二)一级结构的测定三、蛋白质的高级结构构象:蛋白质在体内发挥各种功能不是以简单的线性肽链形式,而是折叠成特定的、具有生物活性的立体结构,即构象(conformation)。
最新蛋白质的一级结构

Primary structure)又称为共价结构或化学结构。
它是指蛋白质中的氨基酸按照特定的排列顺序通过肽键连接起来的多肽链结构。
脱水形成共价键。
肽键:一个氨基酸的α-COOH 和相邻的另一个氨基酸的α-NH21)构成肽链的氨基酸已残缺不全,称为氨基酸残基;端开始,由N指向C,即多肽链有方向性,N端为头,C端为尾。
2)肽链中的氨基酸的排列顺序,一般-NH2肽的颜色反应:多肽可与多种化合物作用,产生不同的颜色反应。
这些显色反应,可用于多肽的定性或定量鉴定。
如黄色反应,是由硝酸与氨基酸的苯基(酪氨酸和苯丙氨酸)反应生成二硝基苯衍生物而显黄色。
多肽的双缩脲反应是多肽特有的颜色反应;双缩脲是两分子的尿素经加热失去一分子NH3而得到的产物。
双缩脲能够与碱性硫酸铜作用,产生兰色的铜-双缩脲络合物,称为双缩脲反应。
含有两个以上肽键的多肽,具有与双缩脲相似的结构特点,也能发生双缩脲反应,生成紫红色或蓝紫色络合物。
这是多肽定量测定的重要反应.(二)天然活性肽1.谷胱甘肽(GSH):三肽(Glu-Cys-Gly),谷氨酸-半胱氨酸-甘氨酸广泛存在于生物细胞中,含有自由的-SH,具有很强的还原性,可作为体内重要的还原剂,保护某些蛋白质或酶分子中的巯基免遭氧化,使其处于活性状态。
2.促甲状腺素释放激素:三肽(焦谷氨酰组氨酰脯氨酸),可促进甲状腺素的释放。
3.短杆菌素S:环十肽,含有D-苯丙氨酸、鸟氨酸,对革兰氏阴性细菌有破坏作用,主要作用于细胞膜。
4.青霉素:含有D—半胱氨酸和D—缬氨酸的二肽衍生物。
主要破坏细菌的细胞壁粘肽的合成引起溶菌。
蛋白质的结构蛋白质是由一条或多条多肽(polypeptide)链以特殊方式结合而成的生物大分子。
蛋白质与多肽并无严格的界线,通常是将分子量在6000道尔顿以上的多肽称为蛋白质。
蛋白质分子量变化范围很大, 从大约6000到1000000道尔顿甚至更大。
一、蛋白质的一级结构p1681. 定义—— 1969年,国际纯化学与应用化学委员会(IUPAC)规定:蛋白质的一级结构指蛋白质多肽连中AA的排列顺序,包括二硫键的位置。
肽的结构和功能
氨基酸残基
氨基酸残基
二、肽单元 (peptide unit)
1. 定义
参与组成肽键的6个原子位于同一平面, 又叫酰胺平面或肽键平面。它是蛋白质构 象的基本结构单位。
Cys Tyr Phe S Gln Asn Cys Pro Arg Gly NH2 牛加压素 S
催产素: 促平滑肌收缩、催产、排乳、促进遗忘 加压素: 升高血压、抗利尿、促进记忆
3)促肾上腺皮质激素(ACTH)
☻腺垂体分泌,作用于肾上腺皮质 ☻刺激肾上腺皮质的生长和肾上腺皮质激 素的合成和分泌 ☻可用于关节炎、皮肤和眼睛炎症的治疗
(一) -螺旋(最常见的结构)
-螺旋结构要点:
①多肽链主链围绕中心轴形成右手螺旋,侧链伸向螺 旋外侧。 ②每圈螺旋含3.6个氨基酸,螺距为0.54nm。 ③每个肽键的亚氨氢和第四个肽键的羰基氧形成的氢 键保持螺旋稳定。氢键与螺旋长轴基本平行。 ④α-螺旋有左手螺旋和右手螺旋两种,天然蛋白质的 α-螺旋绝大多数都是右手螺旋,仅在嗜热菌蛋白酶的 晶体结构中发现左手螺旋。右手螺旋较稳定。
结构:
GSH的转化:
H 2O 2 2GSH
GSH过氧 化物酶
NADP+
GSH还原酶
2H2O
GSSG
NADPH+H+
GSH是细胞内十分重要的还原剂
谷胱甘肽的功能
☻-SH为活性基团,参与氧化还原过程, 清除内源性过氧化物和自由基,维护蛋白 质活性中心的巯基处于还原状态;
☻为酸性肽;
☻红细胞中的巯基缓冲剂。
4)脑啡肽(5肽)
生物化学-03 蛋白质3 结构

第三章 蛋白质
2.4.2 蛋白质的空间结构 (1)维持蛋白质空间结构的化学键 (2)蛋白质的二级结构 (3)球状蛋白质与三级结构 (4)蛋白质的四级结构
熟悉维持蛋白质空间结构的各种化学键,理解 蛋白质的二级、三级和四级结构的概念
能判断维持蛋白质空间结构的主要作用力 应用蛋白质的结构知识解决实际问题
βαβ
βββ
αα
ββ
E、结构域
结构域:在较多的球状蛋白质分子中,多肽链往 往形成几个紧密的球状构象,彼此分开,以松 散的肽链相连,此球状构象就是结构域。
结构域存在的原因:
1、局域分别折叠比整条肽链折叠在动力学上更为合理 2、结构域之间由肽链连接,有利于结构的调整
图示:假设具有2个结构域的蛋白质的线性折叠途径
例如:铁氧还蛋白
稳定蛋白质构象的力
盐键
氢键
二
疏
硫
水
键
作
用
酯键
范德华力
(2)蛋白质的二级结构
A、酰胺平面与α-碳原子的二面角
①肽键中C-N键有部分双键性质——不能自由旋转 ②相关的6个原子处于同一平面(肽平面、酰胺平面) ③键长及键角(约120º)一定 ④大多数情况以两个Cα反式结构存在
O C ¨N
在β-折叠片层中,多肽链间依靠相邻肽链间形 成的 __键来维持结构的稳定性。
练习
β-转角结构是由第一个氨基酸残基的 C=O 与 第___个氨基酸残基的 N-H 之间形成氢键而 构成的。
具有四级结构的蛋白质分子中,每一条肽链称 为一个_____。
维持蛋白质构象的作用力有____,___ _,____,____和____。
蛋白质四级结构的特征
(1)寡聚蛋白质的由两个到几十个亚基组成。一 般为偶数。
蛋白质多肽的化学结构与功能

蛋白质多肽的化学结构与功能蛋白质多肽是由多个氨基酸残基经肽键连接而成的链状分子。
它是生命体中最基本的有机大分子之一,广泛存在于植物、动物和微生物中。
蛋白质多肽的化学结构直接影响它的生物功能,因此了解其结构与功能的关系对于研究生命科学、开发生物药物等具有重要意义。
蛋白质多肽的化学结构蛋白质多肽的化学结构主要由氨基酸的基本结构组成。
每个氨基酸由一个氨基基团(NH2)、一个羧基基团(COOH)和一个侧链(R)组成。
在蛋白质多肽中,一个氨基酸残基的羧基和下一个氨基酸残基的氨基通过肽键(-CO-NH-)连接起来,形成一个肽链。
不同的肽链通过氢键、离子键、范德华力等相互作用在空间上折叠成特定的三维结构,从而实现生物功能。
蛋白质多肽的功能蛋白质多肽的生物功能非常多样化。
它可以作为酶催化化学反应、参与信号传导、构成细胞骨架,还可以作为免疫系统中的抗体、携带氧气、调节基因表达等。
这些功能与蛋白质多肽的结构密切相关。
一些具有活性位点的蛋白质多肽如酶和激素,通常具有特定的空间构象,其活性位点也会确切地定位在分子中。
活性位点的情况下,蛋白质多肽的结构和功能是非常紧密的关联的,例如酶的底物与反应物结合到酶的活性位点处,通过键的断裂和新生,促进反应进程的发生。
但是,对于一些大分子复合物,蛋白质多肽的结构很可能不是一个单一的构象,而是包含两个或多个结构异构体的动态平衡态。
这种平衡态的情况下,蛋白质多肽的结构和功能之间的关系就更加复杂,例如蛋白质的折叠状态与疾病的发生之间的关系就是一例。
在某些情况下,蛋白质多肽的折叠状态会出现错误或失去稳定性,导致蛋白质聚集并且残留不断地积累,最终可能会导致一些细胞、组织和器官的发病。
未来展望随着生物科技的飞速发展,蛋白质多肽的研究已成为生命科学和医药领域的一个重要研究方向。
现代分子模拟计算和实验方法的结合,也为蛋白质多肽结构和生物功能的深入研究提供了先进的手段。
未来,我们可以预期蛋白质多肽在生命科学和医药领域的广泛应用将进一步拓展,这将极大地推动生命科学和医药领域的研究和发展。
蛋白质的结构

习题:
等电点计算: 有一个蛋白质拥有30个侧链羧基(pKa 4.3),10个咪唑基团(pKa 7.0),15 个 ε-氨基(pKa 10.0)。
求该蛋白质的等电点。
2 蛋白质的一级结构
• 蛋白质的一级结构 (Primary structure)包 括组成蛋白质的多肽链 数目。很多场合多肽和蛋
白质可以等同使用。
测定蛋白质的一级结构的要求
• 1 样品必需纯(>97%以上); • 2 知道蛋白质的分子量; • 3 知道蛋白质由几个亚基组成; • 4 测定蛋白质的氨基酸组成;并根据分
子量计算每种氨基酸的个数。 • 5 测定水解液中的氨量,计算酰胺的含
量。
蛋白质和多肽氨基酸顺序的测定
(1)、肽链的拆开和分离 (2)、测定蛋白质分子中多肽链的数目 (3)、二硫键的断裂 (4)、测定每条多肽链的氨基酸组成,并计算
H 2NCHCO O H+H 2NCHCO O H
R 1
HR 2
H 2NCHCNCHCO O H
O
二肽
由两个氨基酸组成的肽称为二肽,由多个氨基酸 组成的肽则称为多肽。组成多肽的氨基酸单元称为 氨基酸残基。
肽键将氨基酸与氨基酸头尾相连
肽链中的肽平面
肽键平面
O CN
肽键
OC N+
O
C
CN
C
H
• 肽键的特点是氮原子上的孤对电子与羰基具有 明显的共轭作用。
蛋白质的结构层次
1952年丹麦人Linderstrom-Lang最早提出蛋白质 的结构可以分成四个层次:
primary structure 一级结构: 氨基酸序列
secondary structure 二级结构: α螺旋,β折叠
03-蛋白质-肽
(5)结晶牛胰岛素的成功,完全证明了蛋白质肽链结构学说的
正确性。
肽键的形成
两个氨基酸分子头尾连接起来 NH2
1
COOH
Carbodiimide
NH2
脱水
2
COOH
四、天然存在的活性肽
1、 谷胱甘肽(GSH)
三肽(Glu-Cys-Gly),广泛存在于生物细胞中,含
有自由的巯基,具有很强的还原性,可作为体内重要的还 原剂,保护某些蛋白质或酶分子中的巯基免遭氧化,使
其处于活性状态。
HOOC
CH NH2
H2 C
H2 C
CO
HN
CH CH2 SH
CO
HN
CH2
COOH
g-肽键
Glu
Cys
Gly
g b
2.促甲状腺素释放激素:三肽(焦谷氨酰组氨酰脯
氨酸),可促进甲状腺素的释放。 3.短杆菌素S:环十肽,含有D-苯丙氨酸、鸟氨酸,
对革兰氏阴性细菌有破坏作用,主要作用于细胞膜。
4.青霉素:含有D—半胱氨酸和D—缬氨酸的二肽衍生 物 。主要破坏细菌的细胞壁粘肽的合成引起溶菌。
生物化学
第三章 蛋白质
Proteins
第三节 肽 (peptides)
一、肽的定义与肽键 二、肽的书写 三、自然界中存在的小肽
四、肽的理化性质
一、蛋白质中氨基酸之间的连接键 是主要的是肽键
蛋白质肽链结构学说的证据:肽键是一个酰胺键。 (1)蛋白质水解前后的结果分析。
(2)人工合成的多肽和天然蛋白质,都可被蛋白水解酶水解,
高中生物竞赛课件-第三章 肽和蛋白质
肽基脯氨酰顺反异构酶
3.肽和蛋白质 3.1 肽
二.寡肽和多肽 1.肽的写法
书写一条肽的序列总是从N-端到C-端,即左边为N-端,右边为C-端,有时为了强调, 可在N-端和C-端分别添加H或OH。
3.肽和蛋白质 3.1 肽
三.肽的理化性质 4.天然活性肽 (1) 谷胱甘肽
➢ 谷胱甘肽由L-Glu、L-Cys、Gly组成,(在谷胱甘肽分子的Glu是羧基参加肽键的形成。)
➢ 谷胱甘肽中含有游离的巯基(-SH),具有还原性,所以也称为还原型谷胱甘肽(GSH), GSH可以脱氢氧化成为氧化型谷胱甘肽(GSSG)
3.肽和蛋白质 3.1 肽
三.肽的理化性质 1.旋光性
一种寡肽只要不是全部由Gly组成,它就具有旋光性
2.两性解离
肽的酸碱主要取决于R基。肽链中α-COOH与α-NH2间的距离比氨基酸中的α-COOH和αNH2间的距离大,因此它们间的静电引力较弱,可离子化程度较氨基酸低。
不同肽的大小也可以其离子化程度高低来鉴别,大肽链的离子化程度比小链肽的离子化 程度低,即大肽完全质子化所需的pH比小肽高。
原因:肽中N-末端的α-NH3+的pK值比游离的氨基酸的小一些,而C-末端的α-COOH的 pK值比游离氨基酸的大一些
侧链R基的pK值,与游离氨基酸相比较,两者差别不大。
肽也有等电点,其中小肽的pI计算方法与氨基酸相似,但复杂的寡肽只能与多肽和蛋白 质一样不能计算,只能测定。
3.肽和蛋白质 3.1 肽
3.肽和蛋白质 3.1 肽
三.肽的理化性质
4.天然活性肽 (1) 谷胱甘肽
蛋白质的化学结构

蛋白质的化学结构
1、蛋白质的一级结构:即蛋白质分子中氨基酸的排列顺序.
主要化学键:肽键,有些蛋白质还包含二硫键.
2、蛋白质的高级结构:包括二级、三级、四级结构.
1)蛋白质的二级结构:指蛋白质分子中某一段肽链的局部空间结构,也就是该段肽链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象.二级结构以一级结构为基础,多为短距离效应.可分为:
α-螺旋:多肽链主链围绕中心轴呈有规律地螺旋式上升,顺时钟走向,即右手螺旋,每隔3.6个氨基酸残基上升一圈,螺距为0.540nm.α-螺旋的每个肽键的N-H和第四个肽键的羧基氧形成氢键,氢键的方向与螺旋长轴基本平形.
β-折叠:多肽链充分伸展,各肽键平面折叠成锯齿状结构,侧链R基团交错位于锯齿状结构上下方;它们之间靠链间肽键羧基上的氧和亚氨基上的氢形成氢键维系构象稳定.
β-转角:常发生于肽链进行180度回折时的转角上,常有4个氨基酸残基组成,第二个残基常为脯氨酸.
无规卷曲:无确定规律性的那段肽链.
主要化学键:氢键.
2)蛋白质的三级结构:指整条肽链中全部氨基酸残基的相对空间位置,显示为长距离效应.
主要化学键:疏水键(最主要)、盐键、二硫键、氢键、范德华力.
3)蛋白质的四级结构:对蛋白质分子的二、三级结构而言,只涉及一条多肽链卷曲而成的蛋白质.在体内有许多蛋白质分子含有二条或多条肽链,每一条多肽链都
有其完整的三级结构,称为蛋白质的亚基,亚基与亚基之间呈特定的三维空间排布,并以非共价键相连接.这种蛋白质分子中各个亚基的空间排布及亚基接触部位的布局和相互作用,为四级结构.由一条肽链形成的蛋白质没有四级结构.
主要化学键:疏水键、氢键、离子键。
生物化学第一章 蛋白质——结构与功能的关系
Arg
缩,有催产及排乳功能,并促进遗
Gly NH2
忘; 加压素:使血管平滑肌收缩,增加
牛加压素
血压,减少排尿,故又叫抗利尿素; 并增强记忆
(3)、神经肽
➢·脑啡肽
+H3N-Tyr-Gly-Gly-Phe-Met-COO-
➢·Leo脑啡肽
+H3N-Tyr-Gly-Gly-Phe-Leu-COO-
➢·有镇痛麻醉作用。
(2). 多肽类激素:
•种类较多,生理功能各异。主要见于 下丘脑及垂体分泌的激素。
Cys Tyr ILe Gln Asn Cys Pro Leu Gly
S S
NH2
牛催产素
Cys Tyr Phe Gln Asn Cys Pro Arg Gly
S S
NH2
牛加压素
催产素和加压素
Cys Tyr ILe S Gln S Asn Cys Pro Leu Gly NH2
第三节 肽
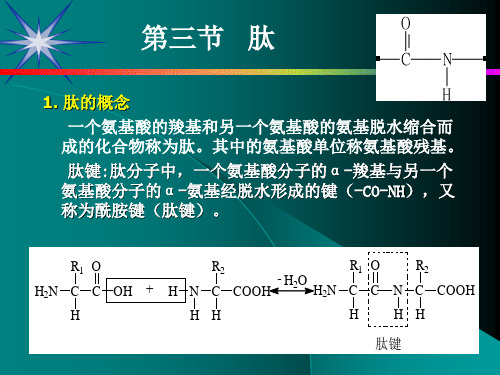
1. 肽的概念
一个氨基酸的羧基和另一个氨基酸的氨基脱水缩合而 成的化合物称为肽。其中的氨基酸单位称氨基酸残基。
肽键:肽分子中,一个氨基酸分子的α-羧基与另一个 氨基酸分子的α-氨基经脱水形成的键(-CO-NH),又 称为酰胺键(肽键)。
H2N
R1 O CC
OH
+
HN
R2 C
COOH
- H2O
4. 肽的物理和化学性质
• 短肽在晶体和水溶液中以偶极离子形式存在,酸碱性 质决定于末端的氨基和羧基以及可解离的侧链基团。
• 许多化学反应与氨基酸相似,与茚三酮发生呈色反应; 能发生双缩脲反应,形成紫红色或蓝紫色反应(氨基酸 不能) Pr特有的反应。
蛋白质-氨基酸、肽、蛋白分子结构

•肽键:
一个氨基酸的羧基与另 一个氨基酸的 a-氨基脱 去一分子水缩合后形成 的酰胺键,也称为肽键 (peptide bond.)
•肽的命名与方向 残基
N→C
丝氨酰甘氨酰酪氨酰丙氨酰亮氨酸
•天然多肽
新陈代谢的产物, 具有特殊的生物学 功能。
•天然多肽
谷
氨
酸
a
b g
g-肽键
•天然多肽
新陈代谢的产物,具有 特殊的生物学功能。
一、基本认识 ★
二、入手点?
★ 入手点:
1.蛋白质是大分子多聚物!
2.结构物质的基本特性? 3.生理环境因素的影响—水?! 4.各种作用力的相互平衡?
5.多肽链中可能存在的有组织的 局部排列?
蛋白质结构层次的推测
第四节 蛋白质的分子结构
一、基本认识
二、入手点
三、蛋白质空间构象 的形成与蛋白质的结 构层次
多肽链折叠的 空间限制
二面角
F=180° y=180°
a-C
a-C
a-C
R
空多 间肽 限链 制折
叠 的
180°=
角 =0°
氨基酸
a-碳原子
八、氨基酸的重要化学反应
◆茚三酮反应: -水合茚三酮试剂 ◆桑格(Sanger)反应: -DNFB (2,4-二硝基氟苯) ◆艾德曼(Edman)反应: –PITC (苯异硫氰酸)
Peptide
成 肽
反
酰胺键 肽键 应
第 一、蛋白质基本氨基酸
二 节
二、基本氨基酸的分类 三、蛋白质的稀有氨基酸
氨 四、非蛋白质氨基酸
五、氨基酸的酸碱性
基 六、氨基酸的立体化学
酸 ………
苯丙氨酸 酪氨酸 色氨酸
蛋白质-肽

一. 肽的定义
一个氨基酸的羧基与另一个氨基酸的氨基脱去一 分子水而形成酰胺键,这个键称为肽键(peptide bond),产生的化合物叫做肽(peptide)。
二个氨基酸形成的肽称作二肽,三个氨基酸形成的 肽称作三肽; …… 余类推。 寡肽(oligopeptide):aa < 10 个 多肽(polypeptide) :aa > 10 个
二.肽的结构
无分枝的长链
二.肽的结构
具有方向性。两个末端分别为N端(氨基端)和C端(羧 基端)。
由“N-C-C”单元的周期性连接,构成多肽链的主链; 氨基酸残基的R基团连接在主链的Ca上,形成多肽链 的侧链。
二.肽的结构
三. 肽的表示法
1、中文表示法:
从肽链的N端开始,对氨基酸残基逐一命名, 残基称氨酰
其等电点是在所有可解离的基团的净电荷为0 时的状态。
2、 三字母表示法: aa1 - aa2 - aa3 - aa4 - …… aa1 . aa2 . aa3 . aa4 . ……
3、 单链的一端含有一个游离的-氨基,另一端含 有一个游离的-羧基,加上部分氨基酸可解离的 R基团,因而与氨基酸一样具有两性解质的性质 。
肽和蛋白质的关系

肽和蛋白质的关系
肽和蛋白质是两种不同的生物分子,但它们之间却有着千丝万缕的关系。
肽是蛋白质的组成单位,而蛋白质的特征是由其所包含的肽的特性来决定的。
首先,肽是由氨基酸组成的最小的蛋白质片段,通常是2-100个氨基酸组成的链。
不同的氨基酸片段的组合,会产生不同的肽,它们的组合形成了肽链,而肽链又组成了蛋白质。
因此,可以将蛋白质看作是一种复杂的肽结构,其特性就取决于它所包含的肽。
其次,蛋白质的生物学功能主要取决于其形状。
这种形状的变化是由一种叫做“键合”的现象所决定的。
键合是指氨基酸中的多种分子结合在一起,形成新的氨基酸,从而改变蛋白质的结构。
因此,蛋白质的形状和功能取决于肽链中包含的不同氨基酸片段的组合及其键合现象。
最后,肽和蛋白质的关系也可以在一定程度上解释为氨基酸的层次结构。
肽是氨基酸的最小组成单位,由多个氨基酸组成,而蛋白质则是由许多肽组成的一种复杂的多肽结构,由多个氨基酸片段组合和相互键合形成。
总之,肽和蛋白质之间有着千丝万缕的关系,肽是蛋白质的组成单位,蛋白质的特征取决于其所包含的肽特性,而肽是氨基酸的最小组成单位,由多个氨基酸片段组合而成,而蛋白质则是一种复杂的多肽结构。
- 1 -。
简述蛋白质的结构类型及特点

蛋白质的分子结构可划分为四级,以描述其不同的方面:1、一级结构蛋白质的一级结构又称为初级结构或化学结构,是指蛋白质分子内氨基酸的排列顺序。
蛋白质分子中氨基酸主要通过肽键相互连接。
肽键是由一个氨基酸分子中的α-氨基与相邻另一个氨基酸分子中的α-羧基,通过缩水而成,这样连起来的氨基酸聚合物叫做肽。
多肽链上各个氨基酸由于在相互连接过程中丢失了α-氨基上的H和α-羧基上的OH,被称为氨基酸残基。
在多肽链的一端氨基酸含有一个未反应的游离氨基(-NH2),称为肽链的氨基末端氨基酸或N末端氨基酸,另一端的氨基酸含有一个尚未反应的游离羧基(-COOH),称为肽链的羧基末端氨基酸或C末端氨基酸。
一般表示多肽时,总是N末端:写在左边,C末端写在右边。
肽链中除肽键外还有二硫键,它是由肽链中相应部位上两个半胱氨酸脱氢连接而成,是肽链内和肽链间的主要桥键。
2、二级结构二级结构是指多肽链本身绕曲折叠成的有规律的结构或构象。
这种结构是以肽链内或肽链间的氢键来维持的。
常见的二级结构有α-螺旋、β-折叠、β-转角、自由绕曲等四种。
3、三级结构纤维状蛋白质一般只有二级结构,而球状,蛋白质在二级结构的基础上,经过超二级结构和结构域,进一步组装成三级结构。
维持三级结构的作用力主要是一些次级键,包括氢键、盐键、疏水键和范德华力等。
其中疏水键在维持蛋白质的三级结构上有突出作用。
4、四级结构四级结构是指蛋白质分子内具有三级结构的亚单位通过氢键、盐键、疏水键和范德华力等弱作用力聚合而成的特定构象。
所谓亚单位,又称亚基,是指那些在化学上相互独立但自身又具有特定构象的共同构成同一蛋白质的肽链。
如血红蛋白有四个不同的亚基,这4个亚基以一定形式结合在一起,形成特定的构象,即是四级结构。
扩展资料蛋白质结构与功能的关系①蛋白质的一级结构决定它的高级结构②以血红蛋白为例说明蛋白质结构与功能的关系:镰状红细胞性贫血患者血红蛋白中有一个氨基酸残基发生了改变。
可见一个氨基酸的变异(一级结构的改变),能引起空间结构改变,进而影响血红蛋白的正常功能。
蛋白质分子中的肽键

蛋白质分子中的肽键
肽键是蛋白质分子的基础结构组成部分,是一种化学连接,由氨基酸
共价键形成。
它有两种氨基酸构成:一种是胺基酸的胺基,而另一种则是
酰胺的胺基。
换言之,肽键是一个具有两个氨基键的化学链接,从氨基酸
的胺基到酰胺的胺基。
构成肽键的氨基酸之间具有明显的化学矛盾,胺基属于基团,而酰胺
属于酸离子,这样一种化学异构体具有很强的稳定性,并且具有良好的耐
热性和耐碱性,这对蛋白质的稳定性来讲很有益处。
肽键与肽聚糖和核酸双螺旋卷曲不同,它不会构成三维结构,这是由
于肽键具有极限的灵活性,因而构成可以合理理解的信号转导手段。
同时,肽键之间还存在着特殊的依赖关系,肽键可以拉伸、变形和旋转,所以可
以调节蛋白质活性,从而实现组织修复和代谢稳定等功能。
此外,蛋白质分子中的肽键可用于一种称为“小分子抑制”的定量研究,小分子可以与肽键形成直接的化学反应,这样就可以研究蛋白质的功
能性以及可能的修饰方式。
总之,蛋白质分子中的肽键对蛋白质的功能性有重要影响,它不仅提供在蛋白质之间复杂的信息传输过程中的稳定性,还可作为小分子抑制的研究的基础,具有重要的分子生物学意义。
生殖细胞 蛋白质 肽 氨基酸结构

生殖细胞蛋白质肽氨基酸结构
生殖细胞是一种特殊类型的细胞,它们负责生殖过程。
在生殖
细胞中,蛋白质是一种非常重要的分子,它们扮演着许多关键角色。
蛋白质由氨基酸构成,氨基酸是蛋白质的基本组成单元。
在蛋白质
合成过程中,肽是由氨基酸连接而成的链状分子。
肽链的结构对蛋
白质的功能起着至关重要的作用。
在生殖细胞中,蛋白质的功能多种多样,它们可以参与调节细
胞分裂和生长,维持细胞内稳态,以及在受精过程中发挥重要作用。
此外,一些特定的蛋白质在生殖细胞中起着激素的作用,调节生殖
系统的功能。
氨基酸的结构在蛋白质合成中起着关键作用。
氨基酸由氨基、
羧基和侧链组成,侧链的不同决定了不同氨基酸的特性。
在蛋白质
合成过程中,氨基酸通过肽键连接成肽链,进而形成特定结构的蛋
白质分子。
总的来说,生殖细胞中的蛋白质和氨基酸结构对于维持生殖系
统的正常功能至关重要。
它们参与调节生殖细胞的生长、分裂和受
精过程,确保生殖系统的正常运作。
同时,对蛋白质和氨基酸结构
的研究也有助于我们更深入地了解生殖细胞的生物学特性和生理功能。
蛋白质与肽的结构与功能分析

蛋白质与肽的结构与功能分析蛋白质和肽是组成生物体的重要成分之一,它们在细胞代谢、信号转导、免疫应答、基因表达调控等方面都发挥着重要的作用。
在本文中,我们将探讨蛋白质和肽的结构和功能,并介绍一些常见的分析方法。
1. 蛋白质和肽的基本结构蛋白质是一种由氨基酸组成的高分子化合物,其分子量较大,通常大于10 kDa。
而肽则是由少于100个氨基酸组成的短链分子,分子量通常小于10 kDa。
蛋白质和肽的结构形式包括原形、一级、二级、三级和四级结构。
原形结构是指氨基酸单体,它们通过肽键相连形成了线性的多肽链。
一级结构表示了多肽链的顺序和长度。
二级结构通常是指蛋白质和肽的α-螺旋和β-折叠等结构。
三级结构描述了多肽链折叠成三维空间结构的方式和状态。
最后,四级结构则是指多肽链之间的相互作用,包括了多肽链之间的交叉链接和共价结构。
2. 蛋白质和肽的功能蛋白质和肽具有多种生物学功能,包括酶活性、结构作用、免疫调节等方面。
例如,许多酶如淀粉酶、蛋白酶等都是蛋白质,它们能够加速生物体内化学反应的速率,从而维持生命活动。
此外,蛋白质和肽还能作为细胞膜的主要组成部分和细胞信号转导的重要调节因子。
除此之外,蛋白质和肽在免疫系统中也具有非常重要的作用。
例如,各种细胞和分子之间通过相互识别、配对和交流来诱导和调节免疫细胞的细胞因子、免疫调节因子等信号分子的产生和释放。
3. 蛋白质和肽的分析方法现代生物学研究涉及到蛋白质和肽的多个方面,因此需要多种不同的技术方法来进行分析。
下面是一些常见的方法:a) 氨基酸分析:氨基酸分析能够测定蛋白质和肽中的各个氨基酸的含量和组成。
这种方法适合于分析已知化合物中氨基酸的含量和比例。
b) 质谱分析:质谱法是一种通用的分析方法,能够精确测定蛋白质和肽的分子量、结构和组成等信息。
c) 红外光谱分析:红外光谱法能够测定蛋白质和肽分子中的化学键类型和波数,以明确分子的结构。
d) X-射线晶体学:该方法可确定蛋白质和肽的三维结构。
维持蛋白质各级结构的主要化学键

维持蛋白质各级结构的主要化学键蛋白质是生物体内非常重要的生物大分子,它们在维持生命活动中起着至关重要的作用。
蛋白质的功能与其结构密切相关,而蛋白质的结构则由一系列化学键的形成和断裂而决定。
本文将介绍维持蛋白质各级结构的主要化学键。
一、肽键肽键是蛋白质中最常见的化学键,也是蛋白质分子中主要的共价键。
它是由氨基酸分子中的羧基和氨基反应形成的,形成肽键后,氨基酸分子之间就形成了肽链。
肽键的形成是通过反应中的脱水缩合作用实现的,其反应方程式如下所示:氨基酸1 - COOH + H-NH2 - 氨基酸2 → 氨基酸1 - CO-NH - 氨基酸2 + H2O肽键的形成使得蛋白质分子中的氨基酸能够形成线性的多肽链,从而构成了蛋白质的主干结构。
二、二硫键二硫键是维持蛋白质三级结构的重要化学键。
它是由两个半胱氨酸分子中的硫原子之间的氧化反应形成的。
二硫键的形成可以通过氧化剂的作用来促进,如空气中的氧气或者还原剂的缺乏。
二硫键的形成能够使蛋白质分子的空间结构得以稳定,从而保证其正常的功能。
三、氢键氢键是蛋白质中非常重要的非共价键。
它是由分子中的氢原子与电负性较大的原子之间形成的相互作用力。
在蛋白质中,氢键主要发生在氨基酸侧链之间以及氨基酸侧链与蛋白质主链之间。
氢键的形成能够在蛋白质的空间结构中提供稳定性,从而使蛋白质能够正确地发挥其功能。
四、离子键离子键是由正负电荷之间的静电相互作用力形成的化学键。
在蛋白质中,离子键主要发生在氨基酸侧链之间以及氨基酸侧链与蛋白质主链之间。
离子键的形成能够在蛋白质的空间结构中提供稳定性,从而使蛋白质能够正确地发挥其功能。
五、疏水键疏水键是蛋白质中非常重要的非共价键。
它是由疏水性氨基酸侧链之间的疏水效应形成的。
在蛋白质中,疏水键的形成能够使疏水性氨基酸靠近一起,从而使蛋白质分子的空间结构更加紧密和稳定。
维持蛋白质各级结构的主要化学键包括肽键、二硫键、氢键、离子键和疏水键。
这些化学键的形成和断裂在蛋白质的结构中起着至关重要的作用,它们共同维持着蛋白质分子的稳定性和功能性。
小肽化学结构

小肽化学结构小肽(oligopeptide)是由2-20个氨基酸残基组成的链状生物分子。
它们是蛋白质的一种,但相对于多肽和蛋白质,小肽的分子量较低。
小肽的化学结构对于其生物活性和功能具有重要影响。
小肽的化学结构由氨基酸的序列确定。
氨基酸是构成蛋白质的基本单元,它们由一个氨基(NH2)基团、一个羧基(COOH)基团和一个侧链基团组成。
氨基酸的侧链基团可以是不同的化学结构,如疏水性的烷基、亲水性的羟基或带电的氨基酸残基。
小肽的氨基酸序列决定了其三维空间结构和功能。
小肽的化学结构可以分为线性和环状两种形式。
线性小肽是由氨基酸的序列直接连接而成的链状结构。
环状小肽则是通过氨基酸的侧链与链上其他氨基酸残基形成环状结构。
环状小肽通常比线性小肽更稳定,因为环的形成可以减少分子内部的自由度,从而降低分子的能量。
小肽的化学结构决定了其生物活性和功能。
小肽可以通过与其他生物分子发生相互作用来调节细胞功能和信号传导。
例如,一些小肽可以作为激素调节身体的生理过程,如生长激素和胰岛素。
另一些小肽可以作为抗菌肽,具有杀死细菌和真菌的能力。
还有一些小肽可以作为药物载体,将药物传递到特定的细胞或组织中。
小肽的化学结构还可以通过化学修饰来改变其性质和功能。
化学修饰可以在小肽的氨基酸残基上引入新的化学基团,如磷酸基团或糖基团,从而改变其水溶性、稳定性和生物活性。
化学修饰还可以改变小肽的构象,使其更容易与特定的受体结合或与其他分子相互作用。
小肽的化学结构对于其生物活性和功能具有重要影响。
了解小肽的化学结构有助于我们理解和利用这些分子在生物体内的作用。
通过对小肽的化学结构的研究,我们可以设计和合成具有特定功能的小肽,用于疾病治疗、药物传递和生物技术等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一,测定蛋白质的一级结构的要求
样品必需纯(>97%以上); 样品必需纯(>97%以上); 以上 知道蛋白质的分子量; 知道蛋白质的分子量; 知道蛋白质由几个亚基组成; 知道蛋白质由几个亚基组成; 测定蛋白质的氨基酸组成; 测定蛋白质的氨基酸组成;并根据分子量计算每种氨基酸的 个数. 个数. 测定水解液中的氨量,计算酰胺的含量. 测定水解液中的氨量,计算酰胺的含量.
(4)氨肽酶法
氨肽酶是一类肽链外切酶,它能从多肽链的N端逐个地 氨肽酶是一类肽链外切酶,它能从多肽链的N 切下氨基酸. 切下氨基酸. 最常用的氨肽酶是亮氨酸氨肽酶, 最常用的氨肽酶是亮氨酸氨肽酶,水解以亮氨酸残基 为N-末端的肽键速度最大. 末端的肽键速度最大.
C-末端测定的方法
肼解法;还原法;羧肽酶法 肼解法;还原法;
peptide) 五,天然存在的活性肽(active peptide) 天然存在的活性肽(
生物体内以游离态存在的分子量较小的多肽, 生物体内以游离态存在的分子量较小的多肽, 这类多肽通常都具有特殊的生理功能. 这类多肽通常都具有特殊的生理功能. 如催产素,加压素,谷胱甘肽,脑啡肽, 如催产素,加压素,谷胱甘肽,脑啡肽,激 素类多肽,抗菌肽,蛇毒多肽等. 素类多肽,抗菌肽,蛇毒多肽等.
二硫键的断裂
几条多肽链通过二硫键交联在一起.可在可用8mol/L尿素或 几条多肽链通过二硫键交联在一起.可在可用8mol/L尿素或 8mol/L mol/L盐酸胍存在下 用过量的β 巯基乙醇处理, 盐酸胍存在下, 6mol/L盐酸胍存在下,用过量的β-巯基乙醇处理,使二硫键还原 为巯基,然后用烷基化试剂( COOH)保护生成的巯基, 为巯基,然后用烷基化试剂(ICH2COOH)保护生成的巯基,以防 止它重新被氧化. 止它重新被氧化. 可以通过加入盐酸胍方法解离多肽链之间的非共价力; 可以通过加入盐酸胍方法解离多肽链之间的非共价力;应用过甲 酸氧化法拆分多肽链间的二硫键. 酸氧化法拆分多肽链间的二硫键.
二,蛋白质的化学组成 蛋白质由C, , , 四种元 蛋白质由 ,H,O,N四种元 素组成,多数含有S, 素组成,多数含有 ,有的含 有微量铁, 有微量铁,铜,锌,碘和磷等 元素. 元素. 各种蛋白质的含氮量都接近于 16%是测定蛋白质含量的基础. 16%是测定蛋白质含量的基础.
50% 碳 50%-55% 6.5-7.3% 氢 6.5-7.3% 19-24% 氧 19-24% 氮 硫 16% 0-3% 量
测定蛋白质分子中多肽链的数目
通过测定末端氨基酸残基的摩尔数与蛋白质分子量之 间的关系,即可确定多肽链的数目. 间的关系,即可确定多肽链的数目.
多肽链的拆分
由多条多肽链组成的蛋白质分子,必须先进行拆分. 由多条多肽链组成的蛋白质分子,必须先进行拆分.可用 8mol/L尿素或 mol/L盐酸胍处理 即可分开多肽链(亚基). 尿素或6 盐酸胍处理, 8mol/L尿素或6mol/L盐酸胍处理,即可分开多肽链(亚基).
§4-2 蛋白质的共价结构 peptide) -肽(peptide)
一,蛋白质的一级结构 1969年 1969年,国际纯化学与应用化学委员会 IUPAC)规定: (IUPAC)规定:蛋白质的一级结构指 蛋白质多肽连中AA的排列顺序, AA的排列顺序 蛋白质多肽连中AA的排列顺序,包括二 硫键的位置. 硫键的位置. 多肽链即为蛋白质一级结构的主体. 多肽链即为蛋白质一级结构的主体.NCCNCC-
蛋白质一级结构测定的基本策略
1,测定蛋白质中多肽链的数目; 测定蛋白质中多肽链的数目; 测定蛋白质中多肽链的数目 拆分蛋白质分子的多肽链,分离纯化各肽链; 2,拆分蛋白质分子的多肽链,分离纯化各肽链; 拆开多肽链内的二硫键; 3,拆开多肽链内的二硫键; 4,分析各肽链的氨基酸组成; 分析各肽链的氨基酸组成; 鉴定多肽链的氨基末端残基和羧基末端残基; 5,鉴定多肽链的氨基末端残基和羧基末端残基; 用两种不同的裂解方式裂解多肽链成较小的片段; 6,用两种不同的裂解方式裂解多肽链成较小的片段; 测定各片段的氨基酸顺序; 7,测定各片段的氨基酸顺序; 用片段重叠法重建完整多肽链的一级结构; 8,用片段重叠法重建完整多肽链的一级结构; 确定二硫键的形成方式. 9,确定二硫键的形成方式.
-CO-NH-中的四个原子和与 CO-NH它相邻的两个Ca Ca在一个平 它相邻的两个Ca在一个平 面上. 面上.
在肽链中,任何 在肽链中,任何α—碳原子的二面角发生 碳原子的二面角发生 变化, 变化,肽链主链骨架的构象必然发生相 应的变化.如果所有的α—碳原子的二面 应的变化.如果所有的 碳原子的二面 角都相等, 角都相等,则主链骨架的构象一般足螺 旋构象;如果二面角分别等于+—180', 旋构象;如果二面角分别等于 , 则呈现充分仲展的构象.螺旋构象Φ为 则呈现充分仲展的构象.螺旋构象 为57,Ψ为-47 , 为
4, 氨基酸组成的测定 酸水解是主要水解方法,同时辅以碱水解. 酸水解是主要水解方法,同时辅以碱水解. 酰胺基:总量可由水解液中的氮量算出; 色氨酸:可用碱水解蛋白质,能定量回收 色氨酸.
N-末端分析方法
注意环肽和基团的修饰
二硝基氟苯(DNFB) (1)二硝基氟苯(DNFB)法
Sanger法 2,4-二硝基氟苯在碱性条件下,能够与肽链N Sanger法.2,4-二硝基氟苯在碱性条件下,能够与肽链N-端的 游离氨基作用,生成二硝基苯衍生物(DNP). 游离氨基作用,生成二硝基苯衍生物(DNP). 在酸性条件下水解,得到黄色DNP 氨基酸. DNP在酸性条件下水解,得到黄色DNP-氨基酸.该产物能够用乙醚 抽提分离.不同的DNP 氨基酸可以用色谱法进行鉴定. DNP抽提分离.不同的DNP-氨基酸可以用色谱法进行鉴定.
谷胱甘肽 CO-NH-CH-CO-NH-CH2-C H α CHNH2 COOH
谷胱甘肽—存在与动, 谷胱甘肽 存在与动,植物及 存在与动 微生物中: 微生物中: 1.参与体内氧化还原反应 1.参与体内氧化还原反应 2.作为辅酶参与氧化还原反应 2.作为辅酶参与氧化还原反应 保护巯基酶或含Cys的蛋白质中SH Cys的蛋白质中SH的还 保护巯基酶或含Cys的蛋白质中SH的还 原性, 原性, 防止氧化物积累
肽键( bond) 二,肽键(peptide bond) -C-N-比大多数C-N键短,具有部 比大多数C 键短, 分双键性质,不能自由旋转. 分双键性质,不能自由旋转. 键上的H 原子是反式的. -C-N-键上的H和O原子是反式的. 组成肽键的原子处于同一平面 肽平面). (肽平面).
三,肽平面
六,蛋白质功能的多样性
作为有机体新陈代谢的催化剂( 作为有机体新陈代谢的催化剂(酶). 生物体的结构成分(胶元蛋白) 生物体的结构成分(胶元蛋白). 贮藏功能( 贮藏功能(作为生物体养料和胚胎或幼儿生长发育的 原料.) 原料.) 运输功能(血红蛋白). 运输功能(血红蛋白). 运动功能(肌动蛋白和肌球蛋白) 运动功能(肌动蛋白和肌球蛋白) 调节功能(激素) 调节功能(激素) 参与高等动物的免疫反应(抗体和免疫蛋白). 参与高等动物的免疫反应(抗体和免疫蛋白). 控制或调节遗传物质核酸的作用(组蛋白). 控制或调节遗传物质核酸的作用(组蛋白). 提供能量
§ 4-3
蛋白质一级结构的测定
蛋白质的一级结构(Primary structure)包括组成蛋白质的多 蛋白质的一级结构(Primary structure)包括组成蛋白质的多 肽链数目,多肽链的氨基酸顺序, 肽链数目,多肽链的氨基酸顺序,以及多肽链内或链间二硫键 的数目和位置. 的数目和位置. 其中最重要的是多肽链的氨基酸顺序, 其中最重要的是多肽链的氨基酸顺序,它是蛋白质生物功能的 基础 蛋白质氨基酸顺序的测定是蛋白质化学研究的基础.自从1953 蛋白质氨基酸顺序的测定是蛋白质化学研究的基础.自从1953 F.Sanger测定了胰岛素的一级结构以来 测定了胰岛素的一级结构以来, 年F.Sanger测定了胰岛素的一级结构以来,现在已经有上千种 不同蛋白质的一级结构被测定. 不同蛋白质的一级结构被测定.
其他 微
蛋白质的构象测定
x-射线衍射法:x-射线衍射法是测定蛋白质晶体结构 射线衍射法: 的极其重要而有效的方法. 的极其重要而有效的方法. X-射线衍射分析需要 单晶制品.结晶的蛋白质具有结构均一性, 单晶制品.结晶的蛋白质具有结构均一性,是高纯度 的. 核磁共振(NMR) (NMR): 核磁共振(NMR):根据外磁场存在下某些原子核吸收射 频能量发展起来的波谱分析技术. 二维核磁共振是测 频能量发展起来的波谱分析技术. 定溶液中蛋白质等生物大分子三维结构的唯一方法. 定溶液中蛋白质等生物大分子三维结构的唯一方法. 根据氨基酸序列预测,例如统计学方法: 根据氨基酸序列预测,例如统计学方法:统计出各残 基或二肽,三肽片段在有序结构中出现的频率, 基或二肽,三肽片段在有序结构中出现的频率,用以 计算预测其形成二级结构的可能性. 计算预测其形成二级结构的可能性.
第四章 蛋白质共价结构
蛋白质共价结构内容提要 § 4-1 蛋白质通论 蛋白质的共价结构§ 4-2 蛋白质的共价结构-肽 § 4-3 蛋白质一级结构的测定 §4-4 多肽与蛋白质的人工合成
§ 4-1
蛋白质通论
一,蛋白质概念
蛋白质是由20种a-氨基酸通过肽键组成的高分 蛋白质是由20种 20 子有机物. 子有机物.
苯异硫氰酸酯(PTC) (3)苯异硫氰酸酯(PTC)法
多肽或蛋白质的末端氨基能与PITC作用, 多肽或蛋白质的末端氨基能与PITC作用,生成苯氨基 PITC作用 硫甲酰多肽或蛋白质( PTC-多肽或蛋白质), ),它们在 硫甲酰多肽或蛋白质( PTC-多肽或蛋白质),它们在 酸性有机溶剂中加热时, 末端的PTC 氨基酸发生环化, PTC酸性有机溶剂中加热时,N末端的PTC-氨基酸发生环化, 生成苯乙内酰硫脲的衍生物并从肽链上脱离. 生成苯乙内酰硫脲的衍生物并从肽链上脱离. 脱去N末端氨基酸后剩下的肽链仍然是完整的. 脱去N末端氨基酸后剩下的肽链仍然是完整的. 重复反应可以用来测定氨基酸顺序. 重复反应可以用来测定氨基酸顺序.
