稽查指南(2)
药物临床试验 监查稽查·广东共识(2020年版)

药物临床试验监查稽查·广东共识(2020年版)广东省药学会2020年8月1日发布监查与稽查,作为临床试验过程中质量管理的重要手段,随着我国临床试验监管与时俱进,与ICH-GCP接轨,其实施的具体环节需明确共同遵循的要求及做法。
近年来,国内外针对临床试验规范的相关法规发生一定的变化,而新一版《药物临床试验质量管理规范》(GCP)也已于今年7月1日起施行,5年前的共识中的部分内容已不能完全满足现有临床试验监查和稽查相关工作的需要。
本次更新遵照近年来国家陆续出台及更新的政策法规文件,参照国外的相关法规,对监查稽查的实施过程及要求予以更新和明确。
药物临床试验过程的规范,数据及结果的科学、真实、可靠,受试者权益和安全的保护是临床试验相关活动管理的主要目的。
监查和稽查作为药物临床试验质量控制和质量保证体系的重要组成部分,应制定规范的流程和明确的质量标准以保证临床试验的规范实施。
药物临床试验过程中的监查与稽查活动,以及相关制度与标准操作规程的制定等均可以本共识作为参考。
本次修订得到专委会各位专家的指导以及各位同行在共识征求意见期间提供宝贵意见,在此谨向大家致以诚挚谢意!共识撰写小组2020年7月3日目录1 监查1.1 监查员资质1.2 监查计划1.3 现场监查访视类型1.4 其他访视类型1.5 监查过程中研究者的义务1.6 现场监查流程2 稽查2.1 稽查的组织和管理2.2 稽查类别2.3 稽查计划2.4 稽查内容2.5 稽查流程2.6 稽查报告撰写参考文献1 监查1.1 监查员资质(1)应有适当的临床医学、护理、药学等医药相关专业的大专及以上学历(2)经过专业化的培训,熟悉药品注册管理办法、中国GCP及ICH-GCP等法律法规,取得国家局或行业认可的GCP培训证书;(3)熟悉有关试验药物的临床前和临床方面的信息以及临床试验方案及其相关的文件,能够有效履行监查职责;(4)具备较强的责任心,工作态度积极、细心且有耐心,具有良好的沟通能力,无同行业举报并查证属实的不良记录,由申办者委派并为研究者和临床试验机构所接受。
GCP试题集(附答案)

第一部分必考题1.GCP中英文含义?主要内容?实施目的?起草依据?颁布、施行时间?(30)简要答案:GCP: Good clinical practice,即药物临床试验质量管理规范,是临床试验全过程的标准规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告等。
实施目的1.保证临床试验过程规范、结果可靠;2.保护受试者权益和安全。
起草依据:赫尔辛基宣言,注意强调保护受试者权益和试验质量。
颁布、施行时间:2003年6月4发布,2003年9月1日实施2.CRO、CRF、SOP、SAE中英文含义?(20)简要答案:CRO:contract research organization,合同协作组织CRF:Case report form/Case record form,病例报告表,病例记录表SOP:Standard operating procedure,标准操作规程SAE:Serious adverse event,严重不良事件3.严重不良事件?报告要求?(30)简要答案:严重不良事件可定义为致命的或威胁生命的、致残的、先天性不正常、能够导致门诊病人住院或延长住院时间的事件。
发生肿瘤、妊娠或超量用药及其他明显的治疗事故等也被视为严重的不良事件。
研究的申办者要将所有的严重不良事件十分仔细地记录在案,进行迅速而认真的处理,并在规定的时间内向申办者、伦理委员会和药品监督管理部门报告,我国规定申办者应在24h内向国家和省级药品监督管理部门报告所有不良事件,也应同时向批准试验的伦理委员会报告这些事件。
4.4.如何保障受试者的权益?(10)简要答案:根据GCP原则制定SOP,并严格遵照执行;加强伦理委员会的作用;签署知情同意书等……5.5.稽查和视察的区别?(10)简要答案:稽查由申办者委托其质量保证部门或第三者(独立的稽查机构)进行。
是指由不直接涉及试验的人员对临床试验相关行为和文件所进行的系统而独立的检查,以评价临床试验的运行及其数据的收集、记录、分析和报告是否遵循试验方案、申办者的SOP、GCP和相关法规要求,报告的数据是否与试验机构内的记录一致,即病例记录表内报告或记录的数据是否与病历和其他原始记录一致。
食品药品监管总局关于印发药品不良反应报告和监测检查指南(试行)的通知

食品药品监管总局关于印发药品不良反应报告和监测检查指南(试行)的通知文章属性•【制定机关】国家食品药品监督管理总局(已撤销),全国食品安全整顿工作办公室,司法部,全国普及法律常识办公室•【公布日期】2015.07.02•【文号】食药监药化监〔2015〕78号•【施行日期】2015.07.02•【效力等级】行业规定•【时效性】失效•【主题分类】卫生医药、计划生育综合规定正文食品药品监管总局关于印发药品不良反应报告和监测检查指南(试行)的通知食药监药化监〔2015〕78号各省、自治区、直辖市食品药品监督管理局:为推动药品生产企业实施药品不良反应报告和监测制度,指导各级食品药品监管部门对企业开展药品不良反应报告和监测工作的检查,根据《药品不良反应报告和监测管理办法》相关要求,总局组织制定了《药品不良反应报告和监测检查指南(试行)》,现印发给你们,请遵照执行。
食品药品监管总局2015年7月2日药品不良反应报告和监测检查指南(试行) 药品不良反应报告和监测是药品上市后监管的重要内容,是药品生产企业对其生产的药品进行全生命周期管理的主要内容和重要责任,是药品安全评价的重要依据。
为推进药品生产企业开展不良反应报告和监测工作,指导食品药品监督管理部门开展对企业药品不良反应报告和监测工作的检查,制定本检查指南。
本指南适用于食品药品监督管理部门开展对药品生产企业不良反应报告和监测工作的检查。
1.检查目的1.1通过对药品生产企业执行《药品不良反应报告和监测管理办法》情况进行检查,促进企业规范开展药品不良反应报告和监测工作,推进相关工作全面开展。
1.2确定药品生产企业具备符合法律法规所要求的机构、人员、制度、体系和设施。
1.3检查药品生产企业是否严格履行报告和监测责任,是否存在可能对公众健康造成威胁的因素和风险。
1.4必要时,检查结果可作为监管措施的依据。
2.检查类型2.1常规检查:指按计划开展的例行检查,通常为系统性检查,可选取一个或多个特定药品作为实例检查企业药品不良反应报告和监测体系运转情况。
银行业税务稽查指南

期权合约
期权是指期权的买方支付给卖方一笔权利金,获得一种权利,可于期权的存续期内或到期 日当天,以执行价格与期权卖方进行约定数量的特定标的物的交易。根据期权标的物的不 同,可分为外汇期权、期货期权、股指期权等。
4
Deloitte
银行业基本业务——中间业务
其他业务:
我国银行主要其他中间业务分类表
基金托管业务是指有托管资格的银行接受基金管理公司委托,安全保管所托管基金的全部资产 并办理清算划拨、会计核算、基金估值等托管业务。基金托管业务通常按照基金净值的一定比 例提取基金托管费。
银行保函
银行凭借自身的资金实力和业务条件,接受客户申请,向受益人开出的保 证。如果委托人违约,担保银行保证履行委托人的责任。包括投标保函、 承包保函、还款担保履约书、借款保函等。
4
Deloitte
银行业基本业务——中间业务
承诺类中间业务:
我国银行主要承诺类中间业务分类表
贷款承诺
银行向客户做出的在未来一定时期内按商定条件为该客户提供约定数额贷款的承诺。商业 银行收取一定的费用作为提供这种保证的补偿。贷款承诺在被正式提取前是中间业务,一 旦履行了就转化为真正的贷款业务。
在中央银行存款
在中央银行存款是银行存放在中央银行的资金,包括法定存款准备金和超额存款准备金。法 定存款准备金具有强制性,是中央银行调节信用规模的政策工具;超额准备金是指在存款准 备金账户中超过法定存款准备金的存款,可用于银行日常支付和债权债务清算。
存放同业存款
存放同业存款是银行存放在代理行和相关银行的存款,为了便于银行在同业之间开展各项结 算收付、贷款参加等代理业务。
包括农村商业银行、农村合作银行、农村信用社和新型农村金融机构。 包括信托投资公司、企业集团财务公司、金融租赁公司、货币经纪公司、汽车金融公司、消费金 融公司。 包括政策性银行及国家开发银行、外资银行、民营银行和邮政储蓄银行。
稽查科工作总结(精选5篇)

稽查科工作总结(精选5篇)稽查科工作总结篇120xx年上半年,我局稽查工作在市局和政府的正确领导下与各科室密切配合,认真贯彻落实《药品管理法》学法律法规,针对我县药品市场情况,深入开展了药品市场与各项整治工作,依法取缔无证经营,现将工作总结如下;一、统一思想认识,确保稽查工作顺利开展为巩固药械市场整治成果,局党组高度重视稽查工作,始终将稽查工作为全局的中心工作抓紧不放,坚持一切围绕稽查这个中心。
同时,强化稽查责任,明确工作任务和个人岗位责任制,在执法车辆上优先保证稽查用于形成了相对集中,相对分工,相互协作的稽查工作机制。
二、开展日常监督检查工作对全市零售药店GSP执行情况,医疗器械经营使用单位及制剂室检查,重点是药械质量,购进渠道及验收记录,同时,把日常检查各项专项检查结合,做到一次检查,全面兼顾,既提高了稽查效率,又降低了执法成率,通过检查发现,部分经营使用单位仍存在以下问题;1、过期药品未及时处理。
2、非法渠道购进药品。
3、未经医师处方销售处方药。
4、不按规定储存药品。
我局现针对上述行为依法进行了处理。
三、开展药品抽验工作我局在市药检所共抽检批次,完成了全年抽检任务,确保了人民群众用药安全。
四、开展专项治理整顿工作一是开展了非法药品冒充药品专项行动二是开展了“牙痛舒”专项检查工作三是开展了中药材及中药饮片专项检查四是开展了高风险医疗器械专项检查五是开展了无证经营专项检查行动。
我局稽查人员共出动人次,车辆车次,稽查单位家,收行政处罚的款万元。
五、下半年工作安排1、继续开展药械市场日常监督检查工作。
2、继续开展非法药品冒充药品检查工作。
3、开展医疗器械经营使用单位专项检查,第二阶段工作。
稽查科工作总结篇2法制稽查与审验科在20xx年第一季度,积极响应市委市政府的号召,以“转作风、提效率、优环境、保增长、促发展”为指南,根据科室职责分工,奋发进取,扎实工作,完成了各项工作,现总结如下:一、做好了春季卫生监督员集中培训。
药品不良反应整改报告

XXXX药业有限公司关于药品不良反应检查的整改报告XXXX食品药品稽查局:2018年11月15日由XXX、XXX、XXX组成的检查小组,依据《药品不良反应报告和监测管理办法》(卫生部令第81号)及《药品不良反应报告和监测检查指南(试行)》对我公司的药品不良反应报告和监测、组织机构、人员管理、工作程序、培训记录,相关监测工作开展情况进行现场检查,并对出现的问题进行了分析指导,检查中共提出一般缺陷项2项。
针对检查组提出的不合格项目,我公司领导高度重视,认真分析原因,确定整改责任人和整改期限,积极整改。
具体整改情况如下:一、企业对相关部门的不良反应培训监测培训未覆盖到销售代理商。
1、不合格项描述:我公司生产的中药制剂包括XXX颗粒、XXX颗粒、XXXXXXX糖浆、XXXXXX糖浆,由于市场因素,这5个制剂品种没有达到满负荷的生产,并且每年不是同时开展生产,因此目前生产量较少的现状下,对不良反应培训监测培训涉及了不良反应办公室、生产及销售部门。
2、原因分析:对《药品不良反应报告和监测管理办法》等文件理解不透彻、不全面,在日常培训工作中只是对不良反应办公室、生产和销售部门进行了培训,未覆盖到销售代理商。
3、风险分析,选择风险评估工具:风险评估方法:失败模式效果分析法风险评估等级:将可能存在的风险对其严重程度(S)、发生概率(P)、可检测性(D)按照3分制打分,打分依据见下表:采用RPN进行风险优先数量等级判定。
确定风险优先指数RPN=严重程度X发生概率X可检测性;风险等级共分三级,当RPN V4时为低风险;当4W RPN W9为中风险;当RPN〉9为高风险。
4、整改前风险评估:采用RPN进行风险优先数量等级判定,具体见下表:(1)评价结论:经过以上分析,RPN值为3,该缺陷项目属于低等级风险,需采取纠正与预防措施。
(4)纠正与预防改进措施和要求:在以后的产品销售过程中逐渐加强对销售代理商关于药品不良反应相关内容的培训。
ICH GCP的指南介绍

ICH GCP的指南介绍(王青宇中国药科大学国际医药商学院江苏南京 210009)1 背景全球制药最发达的三个地区——美国、日本和欧洲于1991年11月在比利时的布鲁塞尔召开了“人用药品注册技术要求的国际一体化会议”(International Conference on Harmonization of Technical Requirements for the Registration of Pharmaceuticals for Human Use,ICH process).之后,每两年召开一次会议,在三个地区轮流举行。
1996年5月ICH《药物临床试验质量管理规范》(Good Clinical Practice,GCP)的指南定稿。
1997年被加入到美国的联邦注册法,FDA希望所有在美国之外进行的用于支持新药申请(New drug application,NDA)的临床试验均应按照ICH GCP的要求进行。
日本于1997年4月实施了ICH GCP.欧洲药品注册机构(CPMP)要求自1997年1月1日。
所有在欧洲为药品注册目的进行的临床试验,都必须按照ICH GCP的指南进行。
该指南已替代了欧洲GCP的指导原则。
欧盟在1997年还颁布法令使ICH GCP成为法定要求,该法定被添加到欧盟各成员国的法律之中。
[1]因此,按照该指南得出的临床试验的数据在上述地区的任何一个国家都是应得到认可的,并且澳大利亚、加拿大及世界卫生组织等参与GCP制定(作为观察员身份)的地区及组织也认可。
[2]2 ICH GCP指南的内容[2]~[3]2.1 概念及术语该指南中GCP的概念是“对临床试验的设计、实施、结果的监查、审计、记录、分析、报告设立一种标准以确保临床试验的数据及报告的结果是可信的、准确的,并且受试者的权益、尊严、隐私得到保护。
”术语可以参见www.emea.eu.int/pdf/human/ich/013595en.pdf.2.2 ICH GCP的基本原则进行临床试验应当符合伦理准则并符合GCP及法规的要求.进行一项临床试验的前提是必须有可能的获益,并且临床试验的潜在的获益应该大于它的风险。
稽查表
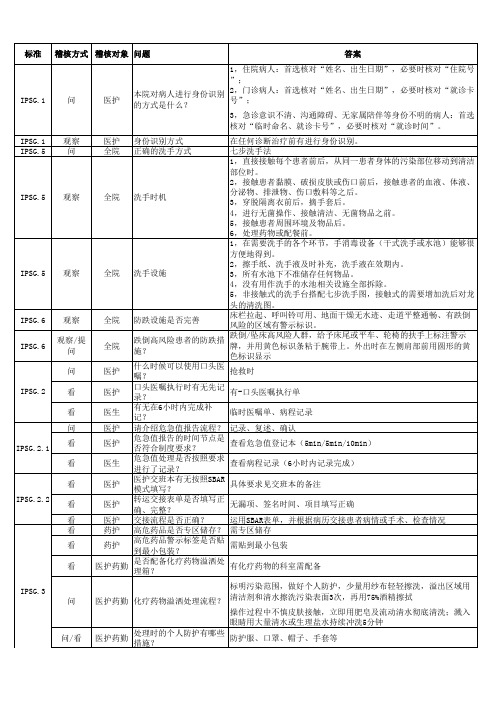
ACC.2.2. 1 ACC.1.1
问 问 问 问 问/看 问 问/看 问 看 问/看 看
PFR.1
PFR.1.3
问
3人以上伤员来院时,立即问清事发地点,大概受伤人数,伤情情 况,汇报应急办、护士长(节假日/夜间汇报总值班、值班护士长 病人因病情需要(包括病情复杂难以确诊者,无生命危险,需入院 什么情况下,病人可在急 医生 诊治而暂时无床又不能转出者)。可在急诊观察室短期观察。但必 诊观察室短期观察? 须有急诊医师或者专科医师在病历上写明“留观察室”字样医嘱。 医护 绿色通道救治原则? 抢救生命、稳定病情、缓解症状、平安转出 门诊/住院患者入院后如 医护 海报、一般知情同意书签署 何进行权利义务的告知? 发现患者因为身体因素存 工作人员需主动协助,并安排轮椅或平车;存在语言障碍的联系便 医护勤导 在就医障碍时,会怎么处 民服务中心处理 理? 轮椅和平车是怎么管理 门诊导医管理轮椅,并负责清洁消毒;急诊轮椅平车勤工管理,并 勤导 的?如何进行清洁消毒? 负责清洁消毒;一般用酸化水,有体液血液时用含氯消毒剂 患者就医时因语言因素存 医护导 便民服务中心提供院内员工外语清单 在就医障碍时如何处理? 患者入院后如何评估其价 医护 护理人员进行初始评估 值观和信仰? 当患者提出宗教精神支持 医护 提供宗教机构联系方式 的需求时如何处理? 医护在执行涉及隐私的操 医护 作/检查时,有没有关门 现场查看 或拉上床帘? 科室出现的一些带有患者 医护 科室统一收集,定期用碎纸机处理 信息的废纸如何处理? 床位一览表如何做到保护 护士 现场查看 患者隐私? 住院患者入院时有没有询 医护 问其隐私的期望?医护如 有,如住院期间不愿公开,医护人员会做好探视人员的限制 何处理患者的隐私期望?
医护 全院
IPSG.3 问 医护药勤 化疗药物溢洒处理流程?
海关总署令第230号——《中华人民共和国海关稽查条例》实施办法(2016)

海关总署令第230号——《中华人民共和国海关稽查条例》实施办法(2016)文章属性•【制定机关】中华人民共和国海关总署•【公布日期】2016.09.26•【文号】海关总署令第230号•【施行日期】2016.11.01•【效力等级】部门规章•【时效性】现行有效•【主题分类】海关综合规定正文海关总署令第230号《〈中华人民共和国海关稽查条例〉实施办法》已于2016年9月22日经海关总署署务会议审议通过,现予公布,自2016年11月1日起施行。
署长于广洲2016年9月26日《中华人民共和国海关稽查条例》实施办法第一章总则第一条为有效实施《中华人民共和国海关稽查条例》(以下简称《稽查条例》),根据《中华人民共和国海关法》以及相关法律、行政法规,制定本办法。
第二条《稽查条例》第三条所规定的与进出口货物直接有关的企业、单位包括:(一)从事对外贸易的企业、单位;(二)从事对外加工贸易的企业;(三)经营保税业务的企业;(四)使用或者经营减免税进口货物的企业、单位;(五)从事报关业务的企业;(六)进出口货物的实际收发货人;(七)其他与进出口货物直接有关的企业、单位。
第三条海关对与进出口货物直接有关的企业、单位(以下统称进出口企业、单位)的下列进出口活动实施稽查:(一)进出口申报;(二)进出口关税和其他税、费的缴纳;(三)进出口许可证件和有关单证的交验;(四)与进出口货物有关的资料记载、保管;(五)保税货物的进口、使用、储存、维修、加工、销售、运输、展示和复出口;(六)减免税进口货物的使用、管理;(七)其他进出口活动。
第四条海关根据稽查工作需要,可以通过实地查看、走访咨询、书面函询、网络调查和委托调查等方式向有关行业协会、政府部门和相关企业等开展贸易调查,收集下列信息:(一)政府部门监督管理信息;(二)特定行业、企业的主要状况、贸易惯例、生产经营、市场结构等信息;(三)特定商品的结构、成份、等级、功能、用途、工艺流程、工作原理等技术指标或者技术参数以及价格等信息;(四)其他与进出口活动有关的信息。
GCP试题+答案

;第一部分必考题1. GCP中英文含义?主要内容?实施目的?起草依据?颁布、施行时间?(30)简要答案:GCP: Good clinical practice,即药物临床试验质量管理规范,是临床试验全过程的标准规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告等。
实施目的1.保证临床试验过程规范、结果可靠;2.保护受试者权益和安全。
起草依据:赫尔辛基宣言,注意强调保护受试者权益和试验质量。
颁布、施行时间:2003年6月4发布,2003年9月1日实施2. CRO、CRF、SOP、SAE中英文含义?(20)简要答案:CRO:contract research organization,合同协作组织CRF:Case report form/Case record form,病例报告表,病例记录表SOP:Standard operating procedure,标准操作规程SAE:Serious adverse event,严重不良事件3. 严重不良事件?报告要求?(30)简要答案:严重不良事件可定义为致命的或威胁生命的、致残的、先天性不正常、能够导致门诊病人住院或延长住院时间的事件。
发生肿瘤、妊娠或超量用药及其他明显的治疗事故等也被视为严重的不良事件。
研究的申办者要将所有的严重不良事件十分仔细地记录在案,进行迅速而认真的处理,并在规定的时间内向申办者、伦理委员会和药品监督管理部门报告,我国规定申办者应在24h内向国家和省级药品监督管理部门报告所有不良事件,也应同时向批准试验的伦理委员会报告这些事件。
4.如何保障受试者的权益?(10)简要答案:根据GCP原则制定SOP,并严格遵照执行;加强伦理委员会的作用;签署知情同意书等……5.稽查和视察的区别?(10)简要答案:稽查由申办者委托其质量保证部门或第三者(独立的稽查机构)进行。
是指由不直接涉及试验的人员对临床试验相关行为和文件所进行的系统而独立的检查,以评价临床试验的运行及其数据的收集、记录、分析和报告是否遵循试验方案、申办者的SOP、GCP和相关法规要求,报告的数据是否与试验机构内的记录一致,即病例记录表内报告或记录的数据是否与病历和其他原始记录一致。
税务稽查案件处理指南

税务稽查案件处理指南随着社会经济的快速发展和税收管理的日益严格,税务稽查成为了一种必不可少的手段,以确保纳税人的合法权益以及国家税收的笔笔入账。
然而,在进行税务稽查案件处理时,需要遵循一定的程序和法定要求,以确保公正和合法性。
本文将为您呈现税务稽查案件处理的指南,旨在帮助相关从业人员正确处理税务稽查案件,并使纳税人和税务机关得到公正的待遇。
一、调查前的准备工作在开始任何一起税务稽查案件的处理之前,稽查人员需要进行充分的准备工作。
这包括但不限于以下几个方面:1. 深入了解案件背景及相关信息。
稽查人员需要详细了解涉及的企业或个人的税务情况,包括纳税记录、申报情况等。
2. 制定调查计划和调查步骤。
稽查人员需要预先制定调查计划,并根据实际情况确定调查的具体步骤和方法。
3. 收集证据材料。
稽查人员需要搜集和整理相关证据材料,以支持后续的调查和处理工作。
二、税务稽查案件的调查与核实在稽查人员完成准备工作后,将进入实际的调查与核实阶段。
在这个阶段,稽查人员需要按照以下要求开展工作:1. 依法开展调查核实工作。
稽查人员在调查过程中,必须依法行事,并确保严格遵守相关法律法规和部门规章。
2. 依据证据进行排查。
稽查人员需要根据已经收集到的证据材料,对相关纳税人进行排查和核实。
3. 确认案件事实并形成调查结论。
稽查人员需要根据调查结果和证据,确认案件事实,并形成详细的调查结论。
三、税务稽查案件的责任追究与处罚在完成税务稽查案件的调查与核实后,稽查人员将根据调查结论和相关法律法规,对违法或违规的纳税人进行责任追究和相应处罚。
在责任追究和处罚过程中,需要遵循以下原则:1. 法定程序和程序公正原则。
稽查人员需要确保在追究责任和处罚时,按照法定程序进行,并保证处罚的公正性。
2. 依法决定罚款和其他行政处分。
稽查人员根据调查结果和相关法律法规,进行合理的判断和决策,对违法或违规纳税人进行罚款和其他行政处分。
3. 依法保护纳税人的合法权益。
GCP指南中英文对照

compliant clinical study. It is almost impossible to achieve the ideal proclaimed in the existing guidelines and regulations. However, this does not mean we should not strive for the best standard possible. You must think beyond the 'minimum standard' if you really want to do a good job and ensure the best quality possible. Slavish adherence to guidelines and regulations will not work: you must be convinced of the basic logic, ethics and science behind GCP requirements. Going for the most expedient and cheapest route will not only result in a poorer standard but it may also cost lives.首先,我们应该清楚,在我们看来,没有完全依从GCP的临床研究,完美遵从目前指导原则和法规几乎是不可能的。
但是,这并不意味着我们就不应该尽可能达到最好的标准。
如果你确实想要做好工作并尽可能确保高质量,就必须考虑超过最低标准。
机械的遵从指导原则和法规是没有用的,但必须遵循GCP要求的基本的逻辑、伦理和科学原则。
一味的寻求最方便、最便宜的途径将不仅仅导致一个更低的标准,也可能增加成本。
How much non-compliance should we tolerate? In 1996, we published a book on GCP compliance based on the findings of our audit experience at 226 investigator study sites, involving studies conducted in 20 different countries, and audited by an independent external audit team between 1991 and 1995. GCP compliance was compared for various factors and the data patterns suggested some interesting trends. First, the overall level of GCP compliance was generally poor across all investigator study sites and far below the expectations of guidelines and regulations. (In many areas, the studies were possibly dangerous for study subjects, in our opinion.) Second, there were no important differences in studies with regard to the year in which the study was conducted. Basically, all the new regulatory efforts, particularly in Europe, did not show a positive effect onstandards. (However, a survey over a five- to six-year time period is possibly too limited to draw conclusions on this point.) Third, there were no important differences in studies which used a CRO (contract research organization) compared to those which did not. This appears to be because CROs simply follow the standards of the sponsor responsible for the conduct of the study rather than setting consistent and better standards themselves. Fourth, some slight differences between phases of studies were observed, with better compliance in early phase studies. However, this should not be surprising since a Phase I single-centre study with 20 subjects is much easier to control than a Phase III multicentre multinational study involving several hundred study subjects. Fifth, there were some slight differences between therapeutic areas, but this was probably linked to the standards of the sponsor or CRO managing the studies. Sixth, overall, there were no basic overall differences between levels of GCPcompliance in different countries. (However, a later analysis of selected items showed some individual differences between countries: for example, direct access to source documents was achieved 100% of the time at US sites, but not as frequently in other countries.)The only apparent important differences in levels of GCP compliance were between the different sponsors (mostly pharmaceutical companies) managing the studies. The main conclusions reached from analysis of this audit database were that overall standards of GCP compliance greatly needed improvement, and that standards were only as good as the sponsor managing the study regardless of where in the world the study was being conducted. In theory, good research could be conducted anywhere provided it was managed properly.我们可容许多大的非依从性呢?1996年我们出版了一本关于GCP依从性的书,此书根据我们在226个研究基地的稽查发现编写,涉及了1991年到1995年间20个不同国家并由独立的外部稽查小组稽查的研究。
银行业税务稽查指南课件

成本费用稽查
稽查内容
检查银行成本费用是否按照规定核算和扣除,是否存在多计、错计或以其他方式虚增成 本费用的情况。
稽查方法
核对银行账户记录、费用报销单据、成本计算表等资料,比对申报数据与实际核算数据 是否一致。
04
银行业税务稽查的风险和 挑战
数据安全和隐私保护
数据安全
确保稽查过程中收集、处理和存储的数 据的安全性,防止数据泄露和被非法访 问。
稽查方法
核对银行账户记录、手续费合同、收费清单等资料,比对申报数据与实际核算数据是否一致。
其他业务收入稽查
稽查内容
检查银行其他业务收入是否按照规定计提、核算和申报,是否存在少计、漏计或以其他方式转移其他 业务收入的情况。
稽查方法
核对银行账户记录、业务合同、收费清单等资料,比对申报数据与实际核算数据是否一致。
利息收入稽查
稽查内容
检查银行利息收入是否按照规定计提、核算和申报,是否存在少计、漏计或以 其他方式转移利息收入的情况。
稽查方法
核对银行账户记录、贷款合同、利息计算表等资料,比对申报数据与实际核算 数据是否一致。
手续费收入稽查
稽查内容
检查银行手续费收入是否按照规定计提、核算和申报,是否存在少计、漏计或以其他方式转移手续费收入的情况 。
银行业税务稽查指南课件
目 录
• 引言 • 银行业税务稽查概述 • 银行业税务稽查的重点领域 • 银行业税务稽查的风险和挑战 • 银行业税务稽查的优化建议 • 案例分析
01
引言
目的和背景
帮助银行业从业人员了解税务稽查的 基本概念、目的、程序和要求,提高 对税务法规的遵守意识。
促进银行业与税务部门之间的理解和 合作,加强信息交流和协作。
药物临床试验的稽查查察查察

稽查查察查察的法规和标准
法规
各国药品监管机构和国际组织制定了相关法规和指导原则,如《药物临床试验质量 管理规范》(GCP)等,规范了稽查查察查察的职责、权利和义务。
标准
稽查查察查察应遵循国际公认的标准,如世界卫生组织(WHO)的《国际伦理指南》 和国际制药工程协会(ISPE)的《药品研发最佳实践指南》等,以确保稽查查察查 察的规范性和可靠性。
案例分析
在某新药Ⅰ期临床试验中,稽查查察查察发现受试者招募存在不合规行为,部分受试者未 经过充分的知情同意,数据记录存在误差。针对这些问题,稽查查察查察团队提出了整改 意见并要求试验方进行整改。
案例二
稽查查察查察目的
评估Ⅱ期临床试验的科学性和可行性,确保试验数据的可靠性和完整性。
稽查查察查察内容
试验设计是否合理,样本量是否足够,随机化分组是否公正,数据分析和解释是否科学等。
药物临床试验的法规和伦理要求
法规
各国药品监管机构制定相关法规,规范药物临床试验的开展 和管理。
伦理要求
遵循伦理原则,保护受试者的权益和安全,确保研究的公正 性和科学性。
02 稽查查察查察的概述
稽查查察查察的定义和目的
定义
稽查查察查察是对药物临床试验的过 程、数据和结果进行系统性和独立性 的核查,以确保试验数据的真实性、 完整性和可靠性。
04 药物临床试验的稽查查察 查察结果处理
发现问题时的处理方式
01
02
03
立即停止试验
一旦发现严重问题或违反 伦理原则的情况,应立即 停止试验,确保受试者安 全。
记录并报告
详细记录发现的问题,并 及时向上级监管部门报告, 同时通知所有相关方。
整改与纠正
针对发现的问题进行整改 和纠正,确保试验的合规 性和准确性。
稽查员工作指南

建立完善的临床稽查员制度及标准操作规程新颁布的《药品注册管理办法》和《药品临床试验管理规范(GCP)》对临床研究的稽查进行了明确规定,临床检查的目的就是为了确保用受试者的权益,试验记录、报告数据的准确、完整无误,并保证临床试验严格遵循批准的文件和试验方案,符合国家有关临床研究的管理规范和有关法规。
稽查员(monitor)是由药品研究注册人任命的,主要负责与临床研究承担单位的联系工作,其任务是保证临床试验严格遵循以批准的实验方案,并及时报告和稽查试验的进行情况和审核数据,确保临床研究报告真实、客观。
在《GCP》中还明确规定,为确保稽查员工作的规范化,必须制定详细的标准操作规程(Standard Operating Procedure-SOP),以确保整个试验研究是在稽查员稽督下按临床方案进行。
稽查员的标准操作规程制定1.1稽查员的任命和确定担任稽查员的人员除具有医学、药学或相关学科学历,必须经过主管药政部门进行一定专业培训,并对工作具有严格认真负责的精神,必须熟悉掌握临床试验的有关法规和试验用药的全部研究工作及有关信息。
对于一个研究项目,稽查员的数量要根据临床研究的难度和临床承担单位的多少和分布区域来确定。
稽查员之间的工作要做到统一协调,分工明确。
临床稽查员的任命、变动和具体工作职责,药品研究注册单位要以书面文件的形式通知临床研究单位。
1.2临床试验研究的稽查临床试验研究稽查的标准操作规程应包括:试验前的稽查、试验过程的稽查、试验结束的稽查这三个阶段。
每个阶段的工作职责和工作内容是不相同的。
1.2.1临床前的稽查新药研究注册单位主要是根据所试验药品的应用范围和研究内容,选择国家认定的临床研究基地,并对所有参与的临床单位整体情况进行详细了解(单位简介、临床研究资格的认定材料、以往所承担完成的研究课题情况),并对承担所要研究的药品的有关实际研究能力进行确认,其中包括临床单位项目研究机构的组成和参与研究人员的专业情况、以及有关实验室检验条件、仪器设备状况、受试者来源保障情况进行考查。
国家药监局综合司关于印发药品网络交易第三方平台检查指南(试行)的通知

国家药监局综合司关于印发药品网络交易第三方平台检查指南(试行)的通知文章属性•【制定机关】国家药品监督管理局•【公布日期】2023.12.29•【文号】药监综药管函〔2023〕691号•【施行日期】2023.12.29•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药监局综合司关于印发药品网络交易第三方平台检查指南(试行)的通知药监综药管函〔2023〕691号各省、自治区、直辖市和新疆生产建设兵团药品监督管理局:为指导药品监督管理部门开展药品网络交易第三方平台(以下简称第三方平台)检查工作,督促企业履行法定义务,落实平台主体责任,根据《药品网络销售监督管理办法》,国家药监局组织制定了《药品网络交易第三方平台检查指南(试行)》(以下简称检查指南),现予印发,请遵照执行。
检查指南适用于指导药品监督管理部门对提供第三方平台服务的企业开展监督检查工作。
有关检查组织实施、检查机构和人员、检查程序、常规检查、有因检查、检查与稽查的衔接、跨区域检查协作、检查结果的处理等工作,按照《药品检查管理办法(试行)》等有关要求执行。
一、常规检查重点考虑因素(一)首次开展第三方平台业务的;(二)开展第三方平台业务无药品流通专业背景的;(三)第三方平台经营规模大、覆盖范围广、业务量较大的。
二、有因检查重点考虑因素(一)网络监测、群众信访、投诉举报、舆情信息、网络抽检等提示可能存在风险的;(二)未能及时识别、发现、制止、报告相关风险的;(三)未严格审核管理平台内药品信息、链接和药品销售活动的;(四)既往多次检查不符合要求的;(五)管理体系与关键岗位负责人发生重大调整的;(六)未及时整改监督检查发现缺陷项的;(七)药品监管部门认为需要开展检查的其他情况。
三、检查方式检查方式包括现场检查和非现场检查。
现场检查指检查人员到企业开展第三方平台业务的经营场所进行检查。
非现场检查指采用网络巡查、网络监测、视频电话等方式开展检查。
海关常规稽查实施工作指引

海关常规稽查实施工作指引海关常规稽查实施工作指引海关常规稽查实施工作指引前言为加强稽查制度建设,明确稽查实施内容,规范稽查人员行为。
根据《海关法》、《海关稽查条例》、《海关稽查操作规程》、《海关常规稽查作业标准》等有关法律、法规和规章,结合关区稽查工作实际情况,特制定本《指引》。
本《指引》旨在让海关稽查人员在常规稽查实施过程中得到一种简便明确、易于操作的工作指引。
海关稽查人员对企业实施常规稽查时应根据据本《指引》开展稽查。
常规稽查指引一、常规稽查的特点常规稽查,是指海关以监督和规范被稽查人进出口行为为主要目标,以例行检查和全面“体检”为基本特征,有计划地对被稽查人一定期限或业务范围内的进出口活动实施检查的一种稽查作业方式。
海关实施常规稽查,应当按照“属地管理”要求,以被稽查人注册地海关为主,相关海关予以协助配合,并提供必要的人力和业务支持。
海关实施常规稽查,应当依据监管任务要求、企业信用等级、风险高低、规模大小等的不同,实施差别化稽查作业。
二、常规稽查适用范围直属海关负责组织制订对高信用企业的常规稽查计划,每年度应当对关区不少于三分一的高信用企业实施常规稽查,确保每3年完成一次对所有高信用企业实施常规稽查的全覆盖。
直属海关应当在每季度前10个工作日内,通过海关综合业务管理平台(HZ2011)将本季度拟实施常规稽查的高信用企业名单报总署稽查司备案。
直属海关应当以下列高信用企业作为当年度常规稽查对象的选取重点:(一)超过2年未实施常规稽查的高信用企业;(二)风险管理部门提供的风险程度相对较高、但未纳入专项稽查的高信用企业;(三)存在行业性走私违法风险、但未纳入专项稽查的高信用企业;(四)其他需要实施常规稽查的高信用企业。
对高信用企业常规稽查的时间范围原则上为3年。
有下列情形之一的,除有明显风险指向的外,相关时段可以不纳入常规稽查时间范围;(一)企业管理类别上调为高信用企业之日前;(二)同一企业正在实施或已经办结的验证稽查作业,与常规稽查时间范围重叠的部分;(三)被稽查人自行委托会计师事务所等社会中介机构提供的、并经海关认可的审计报告所涉及的时间范围。
临床试验数据管理工作技术指南20160729

附件目录一、概述(一)国内临床试验数据管理现状(二)国际临床试验数据管理简介二、数据管理相关人员的责任、资质及培训(一)相关人员的责任 1.申办者 2.研究者3.监查员4.数据管理员5.合同研究组织(CRO)三、临床试验数据管理系统(一)临床试验数据管理系统的重要性(二)数据质量管理体系的建立和实施(三)临床试验数据管理系统的基本要求1.系统可靠性2.临床试验数据的可溯源性3.数据管理系统的权限管理四、试验数据的标准化(一)CDISC(二)医学术语标准1.MedDRA2.世界卫生组织药物词典3.WHOART术语集五、数据管理工作的主要内容(一)CRF的设计与填写1.CRF的设计2.CRF填写指南3.注释CRF4.CRF的填写(二)数据库的设计(三)数据接收与录入(四)数据核查(五)数据质疑的管理(六)数据更改的记录(七)医学编码(八)试验方案修改时的CRF变更(九)实验室及其他外部数据(十)数据盲态审核(十一)数据库锁定1.数据库锁定清单2.数据库锁定后发现数据错误(十二)数据备份与恢复(十三)数据保存(十四)数据保密及受试者的个人隐私保护1.数据保密2.受试者的个人隐私保护六、数据质量的保障及评估(一)质量保障1.质量控制(1)临床研究机构和质量控制(2)监查和质量控制(3)计算机系统的生命周期过程和质量控制(4)数据管理过程和质量控制2.质量保证(1)标准操作规程(SOP)(2)稽查(3)纠正和预防措施(CAPA)系统(二)质量评估七、安全性数据及严重不良事件报告(一)不良事件的获取、管理和报告(二)实验室数据(三)其他数据(四)严重不良事件数据八、名词解释九、参考文献临床试验数据管理工作技术指南一、概述临床试验数据质量是评价临床试验结果的基础。
为了确保临床试验结果的准确可靠、科学可信,国际社会和世界各国都纷纷出台了一系列的法规、规定和指导原则,用以规范临床试验数据管理的整个流程。
同时,现代新药临床试验的发展和科学技术的不断进步,特别是计算机、网络的发展又为临床试验及其数据管理的规范化提供了新的技术支持,也推动了各国政府和国际社会积极探索临床试验及数据管理新的规范化模式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、电力生产企业增值税部分(一)销项税额方面【常见涉税违法类型】:1、年度机组(或班组)生产电量与上网总电量不相符;2、年度上网总电量与结算总电量不相符;3、电力销售结算价与结算定价相同;4、电力收入总额与上网电量计价结算总收入不相一致;5、将已售电力未结算款项不记销售收入;6、采取“直供”方式销售电力发生的预收电价业务在电力产品发出后不记入产品销售收入;7、超基数发电而未确认收入;8、申报的应税收入(销项税额)与帐列应税收入(销项税额)不一致;9、销售收入不入账,未计提、申报销项税额;10、销售收入记往来账,未计提、申报销项税额;11、将应税收入计入其他业务收入而不计提销项税额;12、将应税收入计入营业外收入,不计提销项税额;13、销售收入直接记入所有者权益,未计提、申报销项税额;14、销售收入冲减生产、销售费用,未计提、申报销项税额;15、适用法定税率(征收率)不准确;16、结算方式与其纳税义务发生时间执行不正确,发出商品未按规定时间作销售和计提、申报销项税额;17、销售货物价格明显偏低且无正当理由,少计提、申报销项税额;18、与其关联企业之间的购销业务未按照独立企业之间的业务往来作价,价格明显偏低,少计提、申报销项税额;19、销售旧货及应税固定资产不申报缴纳增值税。
【检查提示】:1、检查生产部门年度机组(或班组)生产电量统计表与上网总电量统计表;2、检查年度上网总电量与结算总电量结算表;3、检查关联企业之间签订的电力购销合同;检查向关联企业收取的电费收入是否存在价格明显偏低;4、检查往来账户;5、检查销售收入、营业外收入、其他业务收入、所有者权益账户;6、检查管理费用、经营费用、生产成本账户;7、检查应交增值税明细账。
(二)、进项税额方面【常见涉税违法类型】:1、自产、委托加工或购进固定资产抵扣进项税额;2、购进货物入库凭据与取得的发票上的数量、金额不一致;3、购进货物或者应税劳务用于非应税项目、固定资产改良支出、集体福利或者个人消费未转出进项税额。
【检查提示】:1、检查存货账户借、贷方发生额及余额;检查购进货物发票。
(三)、有关税收优惠政策的检查(煤矸石发电)【常见涉税违法类型】:1、未取得省级有关部门颁发的《资源综合利用资格证书》的资质;未取得税务机关相关审批文件;2、使用煤矸石(石煤、油母页岩、煤泥)比例未达到不低于原料总量的60%。
【检查提示】:1、检查省级有关部门颁发的《资源综合利用资格证书》;2、计算使用煤矸石(石煤、油母页岩、煤泥)比例。
二、电力经营企业增值税部分(一)销项税额方面【常见涉税违法类型】:1、用户抄表总电量与经营收入电量不相符;2、将欠收电费收入转电损而不记收入的情况;3、小水电及网外电厂均摊加价部分不记入经营收入;4、随同电价收入收取的或一次性收取的用电权收入、集资收入,以及其他收费项目取得的收入不记入经营收入;5、高压线损率、低压线损率超标。
【检查提示】:1、将用户抄表总电量及实际收取的电费。
与财务部门的经营收入电量进行核对;2、检查往来账户;3、检查收入账户;4、审查线损率。
(二)进项税额方面【常见涉税违法类型】:1、自产、委托加工或购进固定资产抵扣进项税额;2、购进货物入库凭据与取得的发票上的数量、金额不一致;3、购进货物或者应税劳务用于非应税项目、固定资产改良支出、集体福利或者个人消费未转出进项税额。
【检查提示】:1、检查存货账户借、贷方发生额及余额;检查购进货物发票。
三、电力企业所得税部分(一)收益方面1、生产、经营收入【常见涉税违法类型】:1、年度机组(或班组)生产电量与上网总电量不相符;2、年度上网总电量与结算总电量不相符;3、电力销售结算价与结算定价相同;4、电力收入总额与上网电量计价结算总收入不相一致;5、将已售电力未结算款项不记销售收入;6、采取“直供”方式销售电力发生的预收电价业务在电力产品发出后不记入产品销售收入;7、超基数发电而未确认收入;8、申报的应税收入(销项税额)与帐列应税收入(销项税额)不一致;9、销售收入不入账,未计提、申报销项税额;10、销售收入记往来账,未计提、申报销项税额;11、将应税收入计入其他业务收入而不计提销项税额;12、将应税收入计入营业外收入,不计提销项税额;13、销售收入直接记入所有者权益,未计提、申报销项税额;14、销售收入冲减生产、销售费用,未计提、申报销项税额;15、适用法定税率(征收率)不准确;16、结算方式与其纳税义务发生时间执行不正确,发出商品未按规定时间作销售和计提、申报销项税额;17、销售货物价格明显偏低且无正当理由,少计提、申报销项税额;18、与其关联企业之间的购销业务未按照独立企业之间的业务往来作价,价格明显偏低,少计提、申报销项税额;19、销售旧货及应税固定资产不申报缴纳增值税;20、用户抄表总电量与经营收入电量不相符;21、将欠收电费收入转电损而不记收入的情况;22、小水电及网外电厂均摊加价部分不记入经营收入;23、随同电价收入收取的或一次性收取的用电权收入、集资收入,以及其他收费项目取得的收入不记入经营收入;24、高压线损率、低压线损率超标。
【检查提示】:1、检查生产部门年度机组(或班组)生产电量统计表与上网总电量统计表;2、检查年度上网总电量与结算总电量结算表;3、检查关联企业之间签订的电力购销合同;检查向关联企业收取的电费收入是否存在价格明显偏低;4、检查往来账户;5、检查销售收入、营业外收入、其他业务收入、所有者权益账户;6、检查管理费用、经营费用、生产成本账户;7、检查应交增值税明细账;8、将用户抄表总电量及实际收取的电费。
与财务部门的经营收入电量进行核对;9、检查往来账户;10、检查收入账户;4、审查线损率。
2、财产转让收入【常见涉税违法类型】:有偿转让固定资产、有价证券、股权以及其他资产取得的收入不记入其他业务收入或者投资收益。
【检查提示】:检查企业将有偿转让固定资产、有价证券、股权以及其他资产取得的收入是否已记入其他业务收入或者投资收益。
3、利息收入【常见涉税违法类型】:将由资本资源或者其他单位和个人欠款而形成的利息收入不记入收入总额。
【检查提示】:检查企业有无将由资本资源或者其他单位和个人欠款而形成的利息收入未记入收入总额。
4、租赁收入【常见涉税违法类型】:将对外出租的固定资产或者出租其他财产取得的租赁收入不记入收入总额。
【检查提示】:检查企业有无将对外出租的固定资产或者出租其他财产取得的租赁收入未记入收入总额的情况。
5、特许权使用费收入【常见涉税违法类型】:对外提供或者转让专利权、专利技术等取得的收入不并入收入总额。
【检查提示】:检查企业有无对外提供或者转让专利权、专利技术等取得的收入未并入收入总额的情况。
6、股息收入【常见涉税违法类型】:对外投资,股息和红利不并入收入总额。
【检查提示】:检查企业是否存在对外投资情况,投资收益的股息和红利是否并入收入总额。
7、其他收入【常见涉税违法类型】:将资产评估增值、罚款、滞纳金、企业参加财产、运输保险取得的的无赔款优待、无法支付的长期应付款项、收回以前年度已核销的坏帐损失,固定资产盘盈收入,教育费附加返还,以及在“资本公积金”中反映的债务重组收益、接受捐赠资产及根据税收规定应在当期确认的其他收入不列入收入总额。
【检查提示】:检查企业是否将资产评估增值、罚款、滞纳金、企业参加财产、运输保险取得的的无赔款优待、无法支付的长期应付款项、收回以前年度已核销的坏帐损失,固定资产盘盈收入,教育费附加返还,以及在“资本公积金”中反映的债务重组收益、接受捐赠资产及根据税收规定应在当期确认的其他收入是否列入收入总额。
8、其他情形【常见涉税违法类型】:为政府部门代收电力城市附加费,取得的反还收入不并入收入总额。
【检查提示】:检查企业为政府部门代收电力城市附加费,取得的反还收入是否并入收入总额。
(二)支出方面1、工资及三费项目【常见涉税违法类型】:1.工效挂钩企业没有行业主管部门核定的年度工资总额文件,计提的工资总额超过实发工资总额,不作纳税调整,在成本、费用中列支各项奖金、补贴等不计入工资总额进行纳税调整;2.计税工资企业将2006年7月1日以前超过原工资扣除标准部分的工资结转到2006年7月1日以后进行扣除,超过计税工资标准列支工资及“三项费用”不作纳税调整,将职工福利、职工教育以及工会支出不在“三项费用”中列支,直接记入成本费用科目,不作纳税调整。
【检查提示】:1、检查企业是否持有行业主管部门核定的年度工资总额文件,实行“工效挂钩”核算办法的企业计提的工资总额超过实发工资总额,是否作纳税调整,有无在成本、费用中列支各项奖金、补贴等未计入工资总额进行纳税调整。
2、计税工资企业有无将2006年7月1日以前超过原工资扣除标准部分的工资结转到2006年7月1日以后进行扣除的情况,超过计税工资标准列支工资及“三项费用”,是否作纳税调整,有无职工福利、职工教育以及工会支出未在“三项费用”中列支,直接记入成本费用科目,未作纳税调整。
2、业务招待费、广告费、宣传费【常见涉税违法类型】:1、超过规定标准列支业务招待费,不作纳税调整;2、汇缴成员企业实际发生的业务招待费超过汇缴企业按规定分摊的指标额度,汇缴成员企业再次单独计算扣除;3、在“农电管理费”中列支超标准的业务招待费;4、超过规定标准列支广告费不作纳税调整;5、超过规定标准列支业务宣传费不作纳税调整;6、业务招待费、差旅费、会议费等项目不能提供真实合法凭证不作纳税调整。
【检查提示】:1、超过规定标准列支业务招待费,是否作纳税调整;2、汇缴成员企业实际发生的业务招待费是否超过汇缴企业按规定分摊的指标额度,汇缴成员企业有无再次单独计算扣除的情况;3、有无在“农电管理费”中列支超标准的业务招待费的情况;4、超过规定标准列支广告费,是否作纳税调整;5、超过规定标准列支业务宣传费,是否作纳税调整;6、有无业务招待费、差旅费、会议费等项目不能提供真实合法凭证,未作纳税调整。
3、利息项目【常见涉税违法类型】:向非金融机构借款和向职工个人集资利息高于同类金融机构的同期贷款利率全额扣除。
【检查提示】:检查企业发生的向非金融机构借款和向职工个人集资利息高于同类金融机构的同期贷款利率是否全额扣除。
4、捐赠项目【常见涉税违法类型】:1、直接向受赠人提供公益性或者救济性捐赠在税前扣除;2、超过规定允许扣除的公益、救济性的捐赠,非公益、救济性的捐赠在税前扣除。
【检查提示】:1、检查有无直接向受赠人提供公益性或者救济性捐赠的情况。
2、检查有无超过国家规定允许扣除的公益、救济性的捐赠,以及非公益、救济性的捐赠在税前扣除。
5、坏账准备金项目【常见涉税违法类型】:1、计提“坏长准备金“的企业未经过税务机关批准;2、计提“坏账准备金”的年末应收账款基数不准确,将其他应收款项计入计提基数;3、计提比不正确。
