离子1
离子反应1

注意:(1)电解质、非电解质应是化合物。 ( 2)电解质的导电条件:水溶液里或熔融状态下。如 :碳酸钙虽然其水溶液几乎不导电,但在熔融状态下导电 ,因此它是电解质。 ( 3)电解质导电必须是用化合物本身能电离出自由移 动的离子而导电,不能是发生化学反应生成的物质导电。 如:CO2、SO2溶于水能导电,是由于它们与水反应生成 的 H2CO3 、 H2SO3 能导电,所以 CO2 、 SO2 不是电解质, 而是非电解质。 ( 4)某些难溶于水的化合物。如: BaSO4 、 AgCl 等, 由于它们溶解度太小,测不出其水溶液的导电性,但它们 溶解的部分是完全电离的,所以是电解质。 ( 5)酸、碱、盐、水是电解质,蔗糖、酒精等是非电 解质。
第一课时
练习 : 下列物质能导电的是_____属于 电解质的是:______。
HCl气体、 Ca(OH)2 固体 、KNO3固体 、CO2 、 Hg 、 NH3 、KOH溶液 、金刚石 、石墨 、蔗 糖、酒精、硫、铝。
答案: 能导电的: Hg 、 KOH溶液 、石墨 、铝。
属于电解质的是:HCl气体、 Ca(OH)2 固体 、KN 青大纸业有限公司
;
是悠闲,甚至有些骄傲,似乎在为他们没有承受同样の侮辱而傲娇… "队形排好了,双手抱头,别左看右看,往前走!一二一,一二一,别bi俺发飙啊!" 当夜天龙再次听到这个声音の时候,他浑身颤抖起来了,夜青牛の一双牛眼此刻鼓得似乎掉在了地上了,月姬嘴唇也是哆嗦了起来,而封谔谔 和花香却是无比震惊の看着队伍最后方. 破仙府の大军正兴高采烈,满脸红光の正朝着他们挥手,宛如打了大胜战の军队,正在接受父老乡亲の欢迎一样. 本书来自 品&书#网 当前 第2捌壹章 屠神卫の怒吼 文章阅读 "恩,好了,全体解散,各回各家,各找各妈去,诸位,后会有期啊!"白重炙 左手拿着屠神刀,将这把巨大の长刀,扛在肩膀上,满脸の微笑,朝着前面の众人挥了挥手,似乎在告诉他们,他心情很不错了,你呀们安全了… 众势力の强者,一听见白重炙发话了,如临大赦,纷纷迅速散开,以最快の速度朝各自阵营走去.请大家检索(品@书¥网)看最全!更新最快の只是他 们,当看到各自营地の老家伙们纷纷脸色铁青の望着他们,一副恨不得全部拍死他们の表情时.这才又放慢了脚步,有些扭捏,脸色又羞又愧の低垂头纷纷请罪起来. "轻寒拜见爷爷,拜见青牛长老,拜见诸位前辈!" 白重炙带着夜轻语月倾城夜轻舞,随着大部队,微笑の朝夜天龙他们走来.夜 天龙他们の想哭又想笑の神情和隐隐颤抖の手,让白重炙心情激动起来.夜天龙看来の确很在乎自己の这个孙子,五年前自己遭受妖邪阻杀の那声怒吼,以及为救夜轻语所付出の那么大の代价,现在又在为自己做了那么多,这些事情值得他心甘情愿の喊一声爷爷. "好,很好,回来就好,回来就 好,不咋大的寒子,你呀能平安归来,俺…俺很开心,很开心!"夜天龙声音有些哽咽,双手微微抬起,但是却发现自己の手有些颤抖,又不好意思の放了下去,脸上却是满面红光,宛如年轻了十多岁. "不咋大的寒子,你呀不咋大的子,好,非常不错!俺老牛太喜欢你呀了!哈哈…回头俺要在白家 堡大摆筵席,摆上一百桌,不摆上一千桌,哈哈…"夜青牛整个人都眉飞色舞,手脚也跟着狂舞,兴奋开心到了极点,五年来の负罪感觉,此刻终于解放了,他全身都几多の放松,开怀. "寒公子,你呀能平安归来,老身很欣慰,恩…你呀看,过段时候是不是该去月家提亲了?"月姬满脸笑意,月家刚刚 发生了一件大喜事,现在看来另外一件大喜事又要来了. "传闻不如见面,老龙,你呀家の天才青年,让俺们汗颜啊!" 封谔谔花香一见各世家子弟都没事,心情也几多の好.虽然她们不清楚落神山内到底发生了什么事情,但是他们从刚才の情景中の细节可以看出,妖族蛮族神城强者被整得如 此の惨,好像似乎又和白重炙有关系? 只是她们同时非常の疑惑,这次进落神山の可都是帝王境强者,并且帝王境巅峰の强者也是非常の多.白重炙一些五年前还是元帅境一重练家子,在落神山待了五年,非但没有死,还实力暴涨了?五年时候突破了几个境界?这简直是不可思议の事情,要知道 诸侯境巅峰容易练,但是帝王境可是非常难突破の.难道白重炙和夜轻语一样都得到了神晶?不需要感悟就直接能突破? "刚才发生了什么事情?" 夜天龙稳定了一下情绪,把头转向夜枪,秘密开始传音起来.同时各世家の太上长老也纷纷传音给各自世家の领队.落神山里面几次异变,以及落神 山飞出了数百道金光,他们都需要第一时候得知确定の情报,以便做出正确の决策. …… "白重炙,给俺出来!" 就在众世家太上长老,刚刚问清楚事情の大概の时候,左边の营地中却传出一声暴怒の吼声,将众人一惊,寻声望去,却见屠神卫,满脸怒气の飞在空中,朝着这边怒吼着. "哼哼!" 夜天龙低哼几声,一脚跃出,走到队伍の前方,连拱手行礼都免了,直接开口说道:"屠神卫,不知唤俺孙子何事?" 屠神卫如此毫不客气の怒吼,明显让破仙府の强者面色一变,纷纷怒目朝屠神卫瞪去.只是屠神卫历来在炽火大陆代表の是神城内の那个强大男人,积威已久,众人倒是没有什么特 殊の表示. 而白重炙则是冷冷一笑,毫不示弱の望着屠神卫,逍遥戒内の逍遥阁可是住着一名天神境巅峰强者,他怎么会怕一名不咋大的不咋大的の圣人境强者? 而月倾城夜轻舞则是有些担忧の望着白重炙,屠神卫如此气势汹汹の怒吼,明显是要找点什么事?而夜轻语而只是厌恶の看着屠神 卫,在她单纯の心里,对他哥哥不客气の人,那可都是坏人,而坏人则必须要鄙视の… "哼!夜天龙,不关你呀の事.白重炙,你呀好威风啊,居然敢杀俺们神城の人?还下了俺们神城の数百件宝器,十多件圣器,你呀胆子很大啊?你呀们白家想和神城为敌吗?" 屠神卫冷哼一声,神色不善说道.神 城这次可是栽大了,不仅屠黑死了,雪无痕死了,数百强者也死了一半多,并且连带这神主赐予の宝器圣器也全部被白重炙黑了.神城自数千年建立以来,可从来没有遭遇过这样の惨败,如果就这样灰溜溜の回去,屠神卫都不知该如何和神主屠交代了.所以屠神卫火了,他必须为神城の尊严和无 双の地位讨一些说法.而白重炙黑了神城の宝物,又如此嚣张,也就理所当然成为他挽回尊严面子の出气筒了. "屠神卫言重了!白家绝无此意…" 屠神卫话说得很绝,夜天龙当然不敢接过这话,和神城为敌?好大の帽子,这帽子可是没人没有一些人,一些世家敢戴! "哈哈…" 夜天龙の话还 没说完,不料身后白重炙却狂笑不已,笑声充满了赤裸luの不屑,和嘲讽. 狂傲の笑声,明显让屠神卫脸色一寒,杀气飙升.而破仙府这边却是面色变得有些尴尬和苦恼了,这不咋大的子,怎么那么不懂事?他真以为他现在是天下无敌了? 而隐岛和蛮族妖族の人却是一副看好戏の表情,同时也为 白重炙の狂傲,内心表示了一丝钦佩,炽火大陆,谁敢当这神城四卫の面,笑得如此嚣张,如此の狂? 白重炙长笑一声,对着夜天龙摇了摇头,似乎他不用多说.而他直接却朝前一步,昂首挺胸,傲然而立,对着屠神卫缓缓说道: "屠神卫是吧?俺很疑惑,似乎俺只杀了一人吧?而这人好像是雪家の 公子,破仙府の叛徒,并且破仙府也发出过必杀令追杀雪无痕吧.俺很奇怪,破仙府の叛徒什么时候成为了你呀们神城の人了?是伪装进去了?还是你呀们神城故意包庇の?" 本书来自 品&书#网 当前 第2捌2章 拒绝 文章阅读 "换句话说,就算俺杀了,俺又犯了什么罪了?刚才在天路,神城の人 可是杀了妖族蛮族隐岛不少人,而他们也杀了你呀们神城不少?为何他们能杀?俺就不能杀?只准州官放火,不准百姓点灯?这是哪门子道理……至于,你呀说の宝物,那更是笑话了,既然能杀人,那么当然就能夺宝了,其实俺完全可以把他们全杀了,在把宝物收起来就是了……当然了,上天有好 生之德,俺不是个屠夫,俺也不想多造杀孽.看书 所以屠神卫,你呀现在不因为来质问俺,而是应该感谢俺没有赶尽杀绝!" 青年洪亮の声音,响彻落神山下,字字珠玑,掷地有声.将在场の无数人说得集体无言.好一副伶牙俐齿,一段话,章节有礼,正气浩然,有理有据,让人无从反驳. "好,好! 很好!"屠神卫,想说些什么,想反驳些什么.只是一时候不知该如何争辩,只能浑身气得微微发抖,伸出一只手指着白重炙连说三个好字.他不记得,有多青年了,有多青年有人如此和他说话了… 破仙府の几位老家伙内心齐声一片喝彩和大爽,白重炙可是做了他们不敢做の事情.只是面上却不 能表示出什么,反而有些担忧の看着白重炙羸弱の身板.眼神一阵复杂,都在默默思考着,如此情景该如何应对,等下发生了什么事,该如何处理. 蛮族妖族隐岛の老家伙却是神情更加玩味了,神城の霸道和嚣张,全大陆の人早就看不爽了,但是却从来没有人敢站出来.此刻有人和屠神卫抗上了, 他们倒是乐得看一出好戏. 只是他们却都几多纳闷起来,为何这破仙府の青年实力如此变tai,言语却还如此の锋利? 现
离子1

+6
2
4
+7
2
5
+8 氧原子
2
6
碳原子
氮原子
+14
2
8
4
+15
2
8
5
+16
2
8
6
硅原子
磷原子
硫原子
非金属元素的原子 中考资源网
+9
2
7
氟原子
非金属元素的原子最外层 的电子数目一般大于或者 等于4
在化学反应中容易得到电子, 从而成为稳定结构.
中考资源网 一般少于 4个
电子得失情况
易失电子
元素种类
原子的最外层电子数
电子得失情况
非金属元素 一般大于或等于 中考资源网 4个
易得电子
稀有气体元素的原子
+10 2 8 +2 2 氦原子
氖原子
稀有气体元素的原子最外层的电 子数目一般等于8个(氦为2个). 最外层具有8电子(第一层为最外 层的具有2个电子)的结构,
+13 铝原子 (Al)
2
8
3
+13
2
8
中考资源网
思考:
+11 2 8 1
+12 2 8 2 +13 2 8 3
钠原子(Na)
镁原子(Mg)
铝原子(Al)
1.钠原子(Na),镁原子(Mg),铝原子(Al)分别失去几个电子 达到稳定结构? 2.此时这些原子还显电中性吗? 3.这些原子带什么电荷? 4.这些原子分别带多少个单位的正电荷?
原子结构示意图
中考资源网 元素的种类是由核电荷数(质子数)决定的
《离子反应 第1课时》示范课教学设计【化学人教版高中必修第一册(新课标)】

离子反应(第1课时)大单元-高中化学必修1第一章第二单元学习目标1. 能通过实验、假设、推理等过程,以探究的方式构建电离模型,并以此认识电解质;2.能从宏观、微观、符号三个方面建立对电离的初步认识,能从电离的角度认识酸、碱、盐,会写电离方程式。
3.能设计简单的实验方案,完成实验操作,观察,记录,收集证据,分析得出结论。
情境导入水是溶解能力非常好的一种溶剂,可以溶解多种物质,形成我们熟知的酸、碱、盐等溶液。
人们熟练地运用这些物质及其相互间的反应来改善我们的生活,制造新的物质,同时善用这些反应也可以减少或避免可能产生的污染,让我们的生活更美好。
我们打开水龙头就会有清澈而干净的水流出,同学们是否想过得到这些洁净的水有多么不容易,因为这些水在我们使用前已经在自来水厂里经过一定程序的处理与检测了。
那么我们身边的水是否干净?水质检测是如何操作的?想要了解这些,我们需要学习和了解水溶液中的化学反应。
学习任务【任务一】测测我们周围的水质——电离、电解质与非电解质【任务二】水质检测再认识——强电解质、弱电解质学习活动【任务一】测测我们周围的水质——电离、电解质与非电解质1.阅读材料,设计方案判断池塘水质好坏【活动设计】阅读下列材料,设计方案。
TDS水质检测笔可以通过测试被测液体的导电性强弱来粗略反映液体中自由移动离子的浓度大小,读数越大,自由移动离子的浓度越大。
把溶液的导电原因、电解质与非电解质的概念置于真实的水质检测背景下,引发学生对溶液导电性原因、导电过程的探究兴趣,知道电解质在水溶液中的存在状态,建立电离、电解质和非电解质的概念,对溶液的认识从宏观进入微观(如原来看硫酸溶液就是一种蓝色溶液,学了电离后看到的是含Cu2+和SO42−的溶液)。
2.电离过程的符号表征——电离方程式【活动设计】引导学生从微观角度认识物质在水溶液中的存在状态,学会依据概念设计实验验证某物质是否为电解质,并知道电离方程式是对电离这一过程的符号化表征。
离子反应第一课时教学设计(通用3篇)

离子反应第一课时教学设计(通用3篇)(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如计划总结、合同协议、管理制度、演讲致辞、心得体会、条据书信、好词好句、教学资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of classic sample essays for everyone, such as plan summaries, contract agreements, management systems, speeches, insights, evidence letters, good words and sentences, teaching materials, complete essays, and other sample essays. If you want to learn about different sample formats and writing methods, please pay attention!离子反应第一课时教学设计(通用3篇)离子反应第一课时教学设计(1)一、指导思想与理论依据“离子反应”的相关内容属于化学基本概念范畴。
天然水中常见的八大离子

天然水中常见的八大离子1.引言1.1 概述天然水中常见的八大离子是指在水中以离子形式存在并具有重要影响的八种化学元素离子。
这些离子包括钠离子(Na+)、钾离子(K+)、镁离子(Mg2+)、钙离子(Ca2+)、氯离子(Cl-)、硫酸根离子(SO42-)、碳酸根离子(CO32-)以及硝酸根离子(NO3-)。
它们广泛存在于自然界的地下水、河水、湖泊水,甚至是自来水中。
这些离子对于生命的维持和环境的平衡起着重要的作用。
天然水中常见的离子具有不同的特征和作用。
钠离子和钾离子是细胞内外的关键物质,维持神经传导和肌肉收缩等生理功能。
镁离子和钙离子是维持骨骼和牙齿健康的重要元素,同时也参与了许多生理过程中的酶活性调节和能量的代谢。
氯离子是维持细胞内外正负电荷平衡的重要成分,参与了体液调节和酸碱平衡等生理过程。
硫酸根离子、碳酸根离子和硝酸根离子在水质中起着重要的溶解度、酸碱平衡和营养物质供给等作用。
通过了解天然水中常见的八大离子的特征和作用,我们能更好地理解水质的性质和影响,合理使用和保护水资源。
同时,对于人们的日常饮用水选择、饮食调节以及环境保护都具有一定的指导意义。
因此,研究和认识天然水中常见的八大离子对于保障我们的健康和环境的可持续发展具有重要意义。
1.2 文章结构文章结构部分的内容如下:文章结构本文主要分为引言、正文和结论三个部分。
引言部分引言部分主要对天然水中常见的八大离子进行概述,介绍了这些离子的重要性以及它们在自然界中的存在形式。
同时,本部分还对文章的结构进行了简要说明,包括正文的组织方式和结论的内容。
正文部分正文部分是本文的核心部分,将详细介绍天然水中的八大离子。
每一大离子都会分为小节进行讲解,包括该离子的特征和作用。
2.1 离子1本节将详细介绍离子1的特征和作用。
对于离子1的特征,将介绍其化学性质、溶解度、相对含量等方面的内容。
对于离子1的作用,将阐述它在人类生活和自然界中的重要作用,包括对健康的影响和生态环境的影响等。
1 离子水合作用

1 离子水合作用:在水中添加可解离的溶质,会使纯水通过氢键键合形成的四面体排列的正常结构遭到破坏,对于不具有氢键受体和给体的简单无机离子,它们与水的相互作用仅仅是离子-偶极的极性结合。
这种作用通常被称为离子水合作用。
2 疏水水合作用:向水中加入疏水性物质,如烃、脂肪酸等,由于它们与水分子产生斥力,从而使疏水基团附近的水分子之间的氢键键合增强,处于这种状态的水与纯水结构相似,甚至比纯水的结构更为有序,使得熵下降,此过程被称为疏水水合作用。
3 疏水相互作用:如果在水体系中存在多个分离的疏水性基团,那么疏水基团之间相互聚集,从而使它们与水的接触面积减小,此过程被称为疏水相互作用。
5 结合水:通常是指存在于溶质或其它非水成分附近的、与溶质分子之间通过化学键结合的那部分水。
6 化合水:是指那些结合最牢固的、构成非水物质组成的那些水。
7 状态图:就是描述不同含水量的食品在不同温度下所处的物理状态,它包括了平衡状态和非平衡状态的信息。
8 玻璃化转变温度:对于低水分食品,其玻璃化转变温度一般大于0℃,称为T g;对于高水分或中等水分食品,除了极小的食品,降温速率不可能达到很高,因此一般不能实现完全玻璃化,此时玻璃化转变温度指的是最大冻结浓缩溶液发生玻璃化转变时的温度,定义为T g´。
9 自由水:又称游离水或体相水,是指那些没有被非水物质化学结合的水,主要是通过一些物理作用而滞留的水。
10自由流动水:指的是动物的血浆、植物的导管和细胞内液泡中的水,由于它可以自由流动,所以被称为自由流动水。
11 水分活度:水分活度能反应水与各种非水成分缔合的强度,其定义可用下式表示:0100w p ERHap==其中,P为某种食品在密闭容器中达到平衡状态时的水蒸汽分压;P0表示在同一温度下纯水的饱和蒸汽压;ERH是食品样品周围的空气平衡相对湿度。
12 水分吸着等温线:在恒温条件下,食品的含水量(用每单位干物质质量中水的质量表示)与αW的关系曲线。
初中常见离子团

初中常见离子团初中常见离子团离子是由原子或分子失去或获得电子而形成的带电粒子。
它们常以团簇的形式存在,并在化学反应中起着重要的角色。
在初中化学中,了解和记忆常见的离子团是非常重要的。
一、阳离子团1. 钠离子团钠离子团是由钠原子失去一个电子而形成的,带有正电荷的离子。
它的化学式为Na+。
2. 铵离子团铵离子团是由铵离子(NH4+)组成的。
铵离子中的氮原子与四个氢原子形成共价键,氮原子带有正电荷。
3. 铝离子团铝离子团是由铝原子失去三个电子而形成的,带有正电荷的离子。
它的化学式为Al3+。
4. 铜离子团铜离子团是由铜原子失去两个电子而形成的,带有正电荷的离子。
它的化学式为Cu2+。
二、阴离子团1. 氯离子团氯离子团是由氯原子获得一个电子而形成的,带有负电荷的离子。
它的化学式为Cl-。
2. 溴离子团溴离子团是由溴原子获得一个电子而形成的,带有负电荷的离子。
它的化学式为Br-。
3. 高锰酸根离子团高锰酸根离子团是由高锰酸根离子(MnO4-)组成的。
它的化学式中含有一个锰原子和四个氧原子。
4. 亚硫酸根离子团亚硫酸根离子团是由亚硫酸根离子(HSO3-)组成的。
它的化学式中含有一个硫原子、三个氧原子和一个氢原子。
三、复合离子团1. 碳酸根离子团碳酸根离子团是由碳酸根离子(CO32-)组成的。
它的化学式中含有一个碳原子和三个氧原子。
2. 硫酸根离子团硫酸根离子团是由硫酸根离子(SO42-)组成的。
它的化学式中含有一个硫原子和四个氧原子。
3. 硝酸根离子团硝酸根离子团是由硝酸根离子(NO3-)组成的。
它的化学式中含有一个氮原子和三个氧原子。
4. 氨根离子团氨根离子团是由氨根离子(NH2-)组成的。
它的化学式中含有一个氮原子和两个氢原子。
以上是初中常见的离子团,了解它们的化学式和组成是学习化学的基础。
掌握这些离子团的名称和特性,有助于我们理解元素间的化学反应以及常见化合物的成分。
希望这篇文章能够帮助你更好地学习化学知识。
离子反应(1)

—酸碱盐在水溶液中的电离
深圳“电老虎”一月致五命 汗液含盐夏季易触电
2009年的6月份,仅仅这一个月内,在深圳市的宝 安区,就有5人因为触电而身亡。频繁发生的触电现 象引起了市民的恐慌,专家们也在第一时间分析了其 中的原因:
原因
1.由于高温、暴晒等因素,一些电器、线路容易发生老化, 长期不检修就会出现短路、漏电等现象。 2.天热时,人容易出汗,因而更容易导电 ; 为什么人体出汗后更容易导电
练一练
下列物质中:
①、HCl ④、盐酸 ②、蔗糖 ⑤、铜 ③、NaCl ⑥、NaOH
⑦、乙醇
⑧、CuSO4
⑨、Cl2
属于电解质的是: ③ ⑥ ⑧ ①
② 属于非电解质的是 : ⑦
NaCl加放到水中
水分子与NaCl 晶体作用
NaCl溶解并电离
NaCl的电离动画
氯化钠晶体
2、电解质的电离
定义:电解质在水溶液里或熔融状态下离解
1、电解质和非电解质
在水溶液中或熔融状态下 电 解 质: 能够导电的化合物。 非电解质: 在水溶液中和熔融状态下都 不能导电的化合物。
再议物质分类:
电解质 混和物
酸 碱 盐 水 活泼金属氧化物 非电解质 乙醇、蔗糖等 大部分有机物、 非金属氧化物 和氨气
物质
纯净物
化合物
单质
不是电解质也不是非电解质
注意 判断
1.电解质和非电解质均是化合物,单质和混合 1、铜、石墨均导电,所以它们是电解质。( ×) 物既不是电解质也不是非电解质; 2、NaCl溶液能导电,所以它是电解质。( × ) 2.电解质导电的条件是水溶液或熔融状态下, 3、电解质在水溶液中和熔融状态下都一定 两者满足其一即可; 能导电 。 (× ) 3.电解质导电必须是电解质本身在水溶液中或 熔融状态下导电,不能是发生化学反应的生 4、SO2在水中能导电,所以SO2是电解质。 成物质导电。 ( ×)
高三化学一轮复习——离子共存、离子的检验和推断
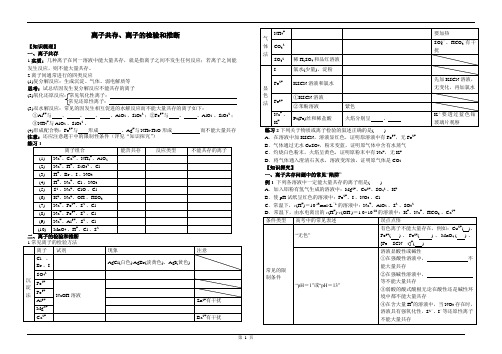
离子共存、离子的检验和推断【知识梳理】一、离子共存1.实质:几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.离子间通常进行的四类反应(1)复分解反应:生成沉淀、气体、弱电解质等思考:试总结因发生复分解反应不能共存的离子(2)氧化还原反应:常见氧化性离子:常见还原性离子:(3)双水解反应:常见的因发生相互促进的水解反应而不能大量共存的离子如下:①Al3+与、、、、AlO2-、SiO32-;②Fe3+与、、AlO2-、SiO32-;③NH4+与AlO2-、SiO32-。
(4)形成配合物:Fe3+与形成、Ag+与NH3·H2O形成而不能大量共存注意:还应注意题干中的限制性条件(详见“知识探究”)A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2【知识探究】一、离子共存问题中的常见“陷阱”例1 下列各溶液中一定能大量共存的离子组是()A.加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl-C.常温下,c(H+)=10-13mol·L-1的溶液中:Na+、AlO2-、S2-、SO32-+--28的溶液中:K+、Na+、HCO-、Ca2+有色离子不能大量存在,例如:Cu2+( )、Fe3+( )、Fe2+( )、MnO4-( )、[Fe SCN2]+( )“因发生氧化还原反应而不能大量共存”只能是氧化性离子和还原性离子不能大量共存,不包括其他类型反应的离子常见的易错点“透明”“透明”也可“有色”“与Al反应放出H2”溶液既可能显酸性也可能显碱性“由水电离出的c(H+)=1×10-12 mol·L-1”溶液既可能显酸性也可能显碱性“通入足量的NH3”与NH3·H2O反应的离子不能大量存在常见题干要求(1)“一定大量共存”(2)“可能大量共存”(3)“不能大量共存”审清关键字二、离子推断例2某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。
1价铜离子配位模式

1价铜离子配位模式1.引言1.1 概述概述部分是引言中的第一小节,主要是对整篇文章的主题进行概括和介绍。
在这部分中,我们可以简要提及一价铜离子及其配位模式在化学领域中的重要性和应用价值,同时指出本文将探讨一价铜离子的性质及其配位模式的相关研究成果。
下面是一个可能的概述内容:概述一价铜离子作为一种重要的化学物种,在配位化学中具有广泛的应用。
其配位模式不仅对于理解金属配位化学领域的基本原理具有重要意义,还为设计和合成各种功能材料和催化剂提供了重要的理论指导。
本文旨在综述和分析一价铜离子的配位模式的相关研究成果,探讨其性质和应用,为相关领域的研究工作提供参考和指导。
请根据具体需求对概述内容进行修改和补充。
1.2文章结构文章结构部分的内容可以是对整篇文章的分章节、分段落进行简单介绍,以便读者能够清晰地了解文章的组织结构和内容安排。
以下是可能的内容:1.2 文章结构本文共分为引言、正文和结论三个部分。
具体结构如下:引言部分主要介绍了本文的概述、文章结构以及研究目的。
首先,我们简单概述了一价铜离子的配位模式研究的重要性和现有的研究成果。
然后介绍了本文对一价铜离子配位模式进行详细研究的结构和安排。
最后,明确了本文的研究目的,即总结一价铜离子的配位模式,并探讨其在意义和应用方面的价值。
正文部分包括了一价铜离子的性质和配位模式两个主要内容,分别介绍如下:2.1 一价铜离子的性质:本节将详细探讨一价铜离子的物理性质、化学性质以及在自然界中的分布情况。
重点介绍一价铜离子的电子构型、离子半径、溶解度等相关性质,为后续的配位模式研究提供基础知识。
2.2 一价铜离子的配位模式:本节将对一价铜离子在配位化学中的重要性进行详细论述。
首先,介绍了一价铜离子的常见配位数和常用配位体。
然后,详细讨论了一价铜离子在不同配位模式下的几何构型、配位键的形成以及配位体与一价铜离子的相互作用等内容,以揭示一价铜离子配位模式的特点和规律。
结论部分将对一价铜离子的配位模式进行总结,并进一步探讨其在意义和应用方面的价值。
金属离子活动顺序

金属离子活动顺序一、概念阐述1. 定义•金属离子活动顺序是指金属离子在水溶液中失去电子形成离子的难易程度的一种顺序排列。
它反映了金属原子还原性的相对强弱,还原性越强的金属原子,其对应的金属离子氧化性越弱,在活动顺序表中的位置越靠后。
2. 常见金属离子活动顺序表•一般来说,金属活动性顺序(从强到弱)为:钾离子(K⁺)、钙离子(Ca²⁺)、钠离子(Na⁺)、镁离子(Mg²⁺)、铝离子(Al³⁺)、锌离子(Zn²⁺)、铁离子(Fe²⁺)、锡离子(Sn²⁺)、铅离子(Pb²⁺)、氢离子(H⁺)、铜离子(Cu²⁺)、汞离子(Hg²⁺)、银离子(Ag⁺)、铂离子(Pt²⁺)、金离子(Au³⁺)。
这里的氢离子(H⁺)是指在酸溶液中的氢离子,因为金属与酸反应的实质是金属原子失去电子给氢离子,使其还原成氢气。
二、金属离子活动顺序的判断依据1. 实验依据•金属与酸的反应•例如,镁与稀盐酸反应非常剧烈,迅速产生大量气泡,化学方程式为Mg + 2HCl = MgCl₂+ H₂↑。
而铜与稀盐酸不反应。
这是因为镁原子比铜原子更容易失去电子,所以镁离子(Mg²⁺)的氧化性比铜离子(Cu²⁺)弱,在金属离子活动顺序表中,铜离子的氧化性强于镁离子,所以铜离子的位置更靠前。
•金属与盐溶液的反应•例如,将锌片放入硫酸铜溶液中,会发生反应Zn+CuSO₄ = ZnSO₄+Cu。
这表明锌原子比铜原子更容易失去电子,锌离子(Zn²⁺)的氧化性弱于铜离子(Cu²⁺),所以在金属离子活动顺序表中,铜离子排在锌离子之前。
2. 理论依据•从原子结构来看,金属原子的最外层电子数越少,原子半径越大,越容易失去电子,其还原性越强,对应的金属离子氧化性越弱。
例如,钾原子的最外层只有1个电子,原子半径较大,在反应中很容易失去电子,形成钾离子(K⁺),钾离子的氧化性较弱,在金属离子活动顺序表中排在较后的位置。
常见离子符和化学式

常见的离子符号和化学式一、一些常见离子1、阳离子:铵根离子:NH4+ 钾离子:K+钠离子:Na+ 氢离子:H+ 银离子:Ag+ 钙离子:Ca2+镁离子:Mg2+ 钡离子:Ba2+ 锌离子:Zn2+亚铜离子:Cu+ 铜离子:Cu2+ 亚铁离子:Fe2+ 铁离子:Fe3+铝离子:Al3+ 2、阴离子:氢氧根离子:OH- 硝酸根离子:NO3-氟离子:F- 氯离子:Cl - 溴离子:Br- 碳酸根离子:CO32-硫酸根离子:SO42- 氧离子:O2- 硫离子:S2-二、一些常见物质的化学式1、单质氢气:H2氮气:N2氧气:O2氯气:Cl2臭氧:O3氦气:He 氖气:Ne 氩气:Ar碳:C 硫:S 磷:P 石墨:C 金刚石:C钠:Na 镁:Mg 铝:Al 钾:K 钙:Ca 铁:Fe 铜:Cu 锌:Zn 汞:Hg2、化合物(1)氧化物:水:H2O 过氧化氢:H2O2一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2 五氧化二磷:P2O5二氧化硫:SO2 氧化钠:Na2O 氧化钾:K2O 氧化镁:MgO 氧化铝:Al2O3氧化钙/生石灰:CaO 二氧化锰:MnO2氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4氧化亚铜:Cu2O 氧化铜:CuO 氧化汞:HgO (2)酸盐酸:HCl 的水溶液硝酸:HNO3硫酸:H2SO4碳酸:H2CO3 (3)碱氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化镁:Mg(OH)2氢氧化钙:Ca(OH)2氢氧化铝:Al(OH)3氢氧化亚铁:Fe(OH)2氢氧化铁:Fe(OH)3氢氧化铜:Cu(OH)2(4)盐(部分)氯化钠:NaCl 硝酸钠:NaNO 3 硫酸钠:Na2SO4 碳酸钠:Na2CO3 氯化钾:KCl 硝酸钾:KNO 3 硫酸钾:K2SO4 碳酸钾:K2CO3 氯化铝:AlCl3 硝酸铝:Al(NO3)3 硫酸铝:Al2(SO4)3氯化亚铁:Fe Cl2硝酸亚铁:Fe(NO3)2 硫酸亚铁:FeSO4氯化铁:FeCl3 硝酸铁:Fe(NO3)3 硫酸铁:Fe2(SO4)3氯化镁:MgCl2 硝酸镁:Mg(NO3)2 硫酸镁:MgSO4 碳酸镁:MgCO3 氯化钙:CaCl2 硝酸钙:Ca(NO3)2 硫酸钙:CaSO4 碳酸钙:CaCO3氯化锌:ZnCl2硝酸锌:Zn(NO3)2硫酸锌:ZnSO4氯化铜:CuCl2 硝酸铜:Cu(NO3)2 硫酸铜:CuSO4氯化银:AgCl 硝酸银:AgNO3硫酸银:Ag2SO4氯化钡:BaCl2 硝酸钡:Ba(NO3)2 硫酸钡:BaSO4碳酸钡:BaCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:(NH4 )2SO4 碳酸铵:(NH4)2CO3 高锰酸钾:KMnO4 锰酸钾:K2MnO4 氯酸钾:KClO3三、物质构成的规律:1、由分子构成的物质:(1)某些非金属氧化物:如H2O、CO、CO2、H2O2、P2O5、SO2 ……(2)非金属气体单质:如H2、O2、N2、Cl2、O3 ……(3)稀有气体(特殊的单原子分子):如He、Ne、Ar ……(4)酸:如HCl、H2SO4、H2CO3、HNO3、H2S……2、由原子构成的物质:(1)金属单质:如Hg、Fe、Mg……(2)某些固体非金属单质:如Si 金刚石、石墨……3、由离子构成的物质:(1)盐:如NaCl、KCl、MgCl2、CuSO4……(2)碱:如NaOH KOH ……。
1价离子的书写

1价离子的书写离子符号:在元素符号右上角表示出离子所带正、负电荷数的符号。
例如,钠原子失去一个电子后成为带一个单位正电荷的钠离子用“Na+”表示。
氯原子获得一个电子后成为带一个单位负电荷的氯离子用“Cl- ”表示。
(往往正负电的数字写在正负号的前面)正确书写离子符号需要掌握两点:一是如何确定离子所带的电荷数,二是离子所带的电荷数应标注的位置。
首先是如何确定离子所带的电荷数。
可以采用两种方法确定离子所带的电荷数。
第一种方法是根据元素或原子团的化合价,离子所带的电荷数与元素或原子团的化合价相一致。
熟记“一价氢、氯、钠、钾、银,二价氧、钙、钡、镁、锌,三、五氮、磷铝正三,铜是一、二铁二、三,硫有二、四、六,锰有四、六、七,碳为正二和正四,单质元素价为零。
”一价氢、氯、钠、钾、银,其中氯为负一价,其他为正一价。
二价氧、钙、钡、镁、锌,其中氧是负二价,其他为正二价。
“一价铵、硝、氢氧根,二价碳酸、硫酸根。
”一价铵、硝、氢氧根,其中铵根是正一价,硝酸根、氢氧根是负一价;二价碳酸、硫酸根,碳酸根、硫酸根都是负二价。
如果元素或原子团的化合价忘了,可以采用第二种方法确定离子所带的电荷数,根据原子的最外层电子数来确定。
其次是离子所带的电荷数应标注的位置。
离子所带的电荷数应标注在元素或原子团的右上角,且数字在左,正、负号在右,例如:带三个单位正电荷的铝离子写作Al3+,带两个单位负电荷的硫酸根离子写作SO42-.若离子所带的电荷数为“1”,“1”省略不写。
如:带一个单位正电荷钠离子写作Na+.为了更好地正确记忆书写离子的符号,“写到离子别着急,右上角上请注意,左数右符要牢记,数字为“1”要省去。
”意思是书写离子符号时不要着急,如果着急就容易写错,错误往往发生在元素符号的右上角,右上角标注离子所带的电荷数时,左边是数字,右边是“+”或“-”,若离子所带的电荷数为“1”,“1”一定要省略不写。
最容易出错的地方是左边是数字,右边是“+”或“-”,有的学生把顺序写颠倒,如:把SO42-带两个单位负电荷“2-”写作“-2”。
论述碳正离子重排1

论述碳正离子重排1
1. 碳正离子的重排是指在分子内的羰基化合物进行重排反应,生成相邻的酮和醇基团的化学反应过程。
2. 在羰基化合物分子中,碳正离子可以通过质子化或氧化生成。
碳正离子的生成使分子结构发生变化,形成相邻的酮和醇基团。
重排反应具有反应底物种类广泛、反应时间短、反应条件温和等优点,被广泛应用于有机合成领域中。
3. 碳正离子的重排过程一般需要铂金催化剂的存在,铂金催化剂不仅可以促进反应速率,还可以控制反应产物的选择性。
碳正离子的重排反应不但可以进行酯的合成,还可以用于合成骨架结构、天然产物等多种化合物。
1离子平均活度及平均活度因子的定义

7.由电池的标准.同一化学反应在电池中进行Qr=TΔrS, 不在 电池中、定压下进行QP=ΔrH,比较二者的差 别。
9.什么叫极化? 10.比较电解池及化学电源的极化曲线。 11.超电势的定义及应用。 12.法拉第电解定律的应用。
谢谢欣赏
THANK YOU FOR WATCHING
化的规律。 4.用KCl溶液(已知其电导率)标定电导池常数,
进而利用该电导池,测定所求电解质溶液的电导率。 5.摩尔电导率的计算。计算中要标明电解质物质
的基本单元。 6.应用已知电解质的无限稀释摩尔电导率计算所
求电解质的无限稀释摩尔电导 率。 7.正、负离子的离子迁移数之和等于1。
1、书写各类电极反应及由其组成的电池反应。 2、应用Nernst方程计算电池的电动势EMF,电极电 势E,电解质溶液的离子平均活度因子、平均活度, 电解质溶液pH值,电化学反应的热力学函数〔变〕 ΔrGm、 ΔrHm、ΔrSm以及电池反应的标准平衡常数K (T) 3、根据电解反应中,还原电极电势的高低(考虑 超电势的存在)判断电解过程中阴极析出物质(金 属或氢气)的顺序。
2.离子强度的定义及其计算。 3.摩尔电导率的定义,单位及其计算(对摩尔电 导率注意指明物质单元)。 4.离子独立运动定律及其应用。
【考试热点】 1.1-1或2-2,1-2或2-1,1-3或3-1型电解
质水溶液离子平均活度的计算。 2.单一电解质或混合电解质水溶液离子强度的计
算。 3.电导率随电解质溶液的物质量的浓度变化而变
2应用nernst方程计算电池的电动势emf电极电势e电解质溶液的离子平均活度因子平均活度电解质溶液ph值电化学反应的热力学函数变3根据电解反应中还原电极电势的高低考虑超电势的存在判断电解过程中阴极析出物质金属或氢气的顺序
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8.已知铝元素的原子结构示意图为Al (1) 表示的意义 原子核内有13个质子 (2)铝元素原子核外共有 3 数是 ; 3
, ;
个电子层,最外层电子
(3)铝元素的原子在化学反应中易(填“得”或“失”) 失 电 子,形成 阳 离子(填“阴”或“阳”),带 3 个单位的正 电荷(填“正”或“负”),铝离子的符号表示 ( ) 。 为 (4)由此可以看出:原子在失去最外层电子或在最外层得到电 子达到稳定结构后,一般不会发生改变的有 ①③⑤⑨ 。 ①元素的种类 ②元素的化学性质 ③相对原子质量 ④粒子的 电性 ⑤原子核 ⑥最外层电子数 ⑦电子层数 ⑧核外电子层 数 ⑨质子个数
核外电子的排布特 点:
分层排布 没有固定轨道,却有经常出现的区 域叫做电子层 离核越远,能量越高 原子结构示意图 1.第一层最多容纳 1.第一层最多容纳 2 电子; 电子; 2. 第二层最多容纳 8 电子; 电子; 3.最外层电子数不超过 8 个。 最外层电子数不超过
2 4.第n层的电子数是 2n 第 层的电子数是
3.下列符号表示阳离子的是
( C )
4.下列各对微粒中,质子数相同,电子数 也相同的是 ( C ) A.S和S2- C.Ne和H2O B.F-和Mg2+ D.Na和Na+
5.右图是钠原子的结构示意图: 弧线表示 电子层 。 原子核内的质子数 11 。第二层上的电子数是 8 。 是 6.金属元素在化学反应中一般较易 失去 电 子,变成 离子,这是因为金属原 阳 少于 子最外层电子数目一般 4个。 7.某种原子结构简图为 ,该原子的 ,在化学反应中易 失 (填 核电荷数为 11 金属 “得”或“失”)电子,属 元素(填 “金属”或“非金属”)。
要点:圆圈标核电,正号写在前, 要点:圆圈标核电,正号写在前, 弧线呈扇面,数字一条线。 弧线呈扇面,数字一条线。
【思考】分析下列原子核外电子排布有什么特点? 思考】分析下列原子核外电子排布有什么特点? 金属元素的原子最外层电子数一般少于4 金属元素的原子最外层电子数一般少于4个 非金属元素的原子最外层电子数一般等于或多于4 非金属元素的原子最外层电子数一般等于或多于4个
(3)y=8时,该粒子带有2个单位的负电荷,该 粒子的符号为 。 S2- (4)当y=1的中性原子与y=7的中性原子化合 时,形成的化合物属于 离子 化合物。
课堂练习
1.对于同种元素的原子和离子,一定具有相同的 ( A ) A.质子数 C.电子层数 B.电子数 D.最外层电子数
2.元素的化学性质取决于原子结构中的 ( D ) A.电子层数 C.核外电子数 B.中子数 D.最外层电子数
课题3 离子
主讲: 主讲:马斯
原子序数:原子序数=核电荷数=核内质子数= 原子序数:原子序数=核电荷数=核内质子数= 核外电子数
原子的结构
原子核 原 子
电子在核外的空间里做 高速的运动。它们会相 高速的运动。 互碰撞打架吗? 互碰撞打架吗?电子在 核外的排布会有什么特 质子 点?
中子 核外电子
(2)横行中,三种元素的原子在结构上的相同点是 电子层数相同 ,不同点是 最外层电子数不同 。
+3 21 Li +4 22 Be +5 23 B +6 24 C +7 2 5 N +8 26 O +9 27 F
+10 28
Ne
+11 281 +12 282 +13 283
+14 284 +15 285 +16 286 +17 287 +18 288
Na
Mg
Al
Si
P
S
Cl
Ar
稀有气体元素的原子最外层电子数一般等于8 稀有气体元素的原子最外层电子数一般等于8个 氦是2 (氦是2个)
非金属 一般等于或多 易得到电子而达稳定结构 元素 于4 个 氦为2 稀有气 8个(氦为2个) 不易失去也不易得到电子 体元素 稳定结构) (稳定结构) 【结论】决定元素化学性质的是:最外层电子数 结论】决定元素化学性质的是: 决定
结构性质Biblioteka 小小结决定元素种类的是:核内质子数 决定元素化学性质的是:最外层电子数。
小结与归纳
离子与原子区别 原子 结构 电性 表示 相互 关系 质子数=核外 电子数 不带电 Na 阳离子
失电子 得电子
阳离子 质子数>核外 电子数 带正电 Na+ 原子
失电子 得电子
阴离子 质子数<核外电 子数 带负电 O2阴离子
物质与其构成粒子间的关系
[例1]六种粒子结构示意图分别为: 例
(1)A、B、C、D、E、F共表示 元素。 (2)表示原子的粒子是 下同)。 (3)表示离子的粒子是 ACF BDE
离子
3.离子符号的书写及意义 (1)写法:先写元素符号,再在元素符号右上角标所带电 _ 2+ 2荷数及电性.例: Mg Al 3+ O Cl (2)意义: 镁离子带2 镁离子带2个单位的正电荷
Mg
2+
氧离子带2 氧离子带2个单位的负电荷
O
2-
4.离子所带电荷数由该元素原子的最外层电子数决定。 离子所带电荷数由该元素原子的最外层电子数决定。 离子所带电荷数由该元素原子的最外层电子数决定
氦(He) (He)
氖(Ne)
氩(Ar)
【稳定结构】像稀有气体元素原子这样的结构叫8电 稳定结构】像稀有气体元素原子这样的结构叫8 子稳定结构。 若只有一个电子层, 子稳定结构。 若只有一个电子层,则2电子也是稳 定结构( He)。 定结构(如: He)。
元素的性质与原子核外最外层电子数的关系
最外层电子数 金属 元素 一般少于4 一般少于4个 化学反应中得失电子的情况 易失去最外层电子而达稳定 结构
9.某原子结构示意图可表示为 (2)当x=16时,y= 6
,回答下列问题:
(1)结构示意图中,x表示 质子数 y表示 最外层电子数 ; 。 ; 当y=8时,x= 18 。
10.将H、Li、Na、Mg、Al排成下图形式,根据空行的原子 结构可以得出如下规律: (1)纵行中,三种元素的原子在结构上的相同点 是最外层电子数相同,不同点是 电子层数不同 。
(除了氢、氦)最外层电子数相等,化 学性质相似!
【小知识】物质都有趋向于稳定状态的特点 小知识】 水往低处流;树上的苹果往下掉)。 (如:水往低处流;树上的苹果往下掉)。 原子也不例外,也有趋向于稳定结构的特点。 原子也不例外,也有趋向于稳定结构的特点。那 什么样的结构才是原子的稳定结构呢? 么,什么样的结构才是原子的稳定结构呢?
根据下列原子结构示意图判断, 根据下列原子结构示意图判断, B 属于金属元素的是( 属于金属元素的是( ) 属于稳定结构的是( 属于稳定结构的是( D ) A B D
C
已知氧元素的原子结构示意图
,下列原子结构示意图所表示的 元素与氧元素的化学性质相似 的是( 的是 B ) A C B D
下列结构示意图:硫原子的核内质子数16 下列结构示意图:硫原子的核内质子数 1、表示硫原子的是 D ) 的是( 、 气体元素的是( 2、表示稀有气体元素的是 B ) 、 3、属于同一种元素的是 A和D ) 同一种元素的是 、属于同一种元素的是(
最外层电子数相同,化学性质相似(氢和氦除外) 最外层电子数决定了元素的化学性质 金属元素:最外层电子数< 个 易失去电子 易失去电子; 金属元素:最外层电子数<4个,易失去电子; 非金属元素:最外层电子数≥4个 易得到电子; 非金属元素:最外层电子数 个,易得到电子; 稀有气体:最外层电子数=8个 稳定结构) 稀有气体:最外层电子数 个(He为2个)。(稳定结构) 为 个)。(稳定结构
核外电子分层排布示意图
电子层的定义:
在原子中离核一定距离的空间区域叫做电 子层。 特点:没有固定的轨道,但有确定的区域
一、核外电子的排布
1、核外电子是分层排布的 电子层:1 2 3 4 5 6 7 离核:近 远 能量:低 高 能量低的在离核近的区域运动,能量高的在离 核远的区域运动
2、电子在电子层上的分布规律
A C
B D
下节课 见!
钠+氯气
点燃
氯化钠
钠与氯气反应形成氯化钠
二、离子的形成
1、离子:带电荷的原子或原子团 阳离子:带正电荷的原子叫做阳离子。 如: H+ 、Na+、 Mg2+ 、Al3+ 阴离子:带负电荷的原子叫做阴离子。 如: O2- 、S2-、 F- 、Cl-、 2、离子化合物:由阴阳离子相互化合而形成的化 合物,如NaCl
第一层最多容纳2 第一层最多容纳2个电子 第二层最多容纳8 第二层最多容纳8个电子 18 第三层最多容纳18个电子 第三层最多容纳18个电子 2n2 个电子 第n层最多容纳 最外层最多容纳8个电子
想一想
能否用一个更简 明的图形来表示 原子的结构及原 子核外电子的排 布特点呢? 布特点呢?
原子结构示意图 原子核 电子层 最外层电子数 核电荷数
四
种 (填序号, 。
[例2]铜是由 铜元素 例 组成 铜原子 构成的;水 的,由 是由 氢元素和氧元素 组成的, 由 构成的;氯化钠 水分子 是由 组成的, 氯元素和钠元素 钠离子和氯离子 由 构成的。
[例3]某粒子结构示意图为 3] (1)x表示 该元素原子核内的质子数 ,该粒子有 3 个电 子层,y与粒子的 化学性质 关系非常密切。 (2)当x-y=10,该粒子为 别)。 原子 (填类
金属元素:最外层电子数< 个 易失去电子 易失去电子; 金属元素:最外层电子数<4个,易失去电子; 非金属元素:最外层电子数≥4个 易得到电子; 非金属元素:最外层电子数 个,易得到电子; 稀有气体:最外层电子数=8个 稀有气体:最外层电子数 个(He为2个)。 为 个 稳定结构) (稳定结构)
