1--化学动力学基础
第九章-化学动力学基本原理第1期

§9.3 简单级数反应的动力学规律凡是反应速率只与反应物浓度有关,而且反应级数,无论是、、…或n都只是零或正整数的反应,统称为“简单级数反应”。
简单反应都是简单级数反应,但简单级数反应不一定就是简单反应,前已述及的HI气相合成反应就是一例。
具有相同级数的简单级数反应的速率遵循某些简单规律,本节将分析这类反应速率公式的微分形式、积分形式及其特征。
(1)一级反应反应速率与反应物浓度的一次方成正比的反应称为一级反应。
其速率公式可表示为(9.7)式中c为t时刻的反应物浓度。
将上式改写成的形式,积分可得(9.8)B为积分常数,其值可由t = 0时反应物起始浓度c0确定:B = ln c0。
故一级反应速率公式积分形式可表示为(9.9)或(9.10)或(9.11)使用这些公式可求算速率常数k1的数值,只要知道了k1和c0的值,即可求算任意t时刻反应物的浓度。
从(9.8)式可看出,以lnc对t作图应得一直线,其斜率即为k1。
如图9.2所示。
反应物浓度由c0消耗到c=c0/2所需的反应时间,称为反应的半衰期,以t1/2表示。
由(9.9)式可知,一级反应的t1/2表示式为(9.12)可以看出,一级反应的半衰期与反应物起始浓度c0无关。
许多分子的重排反应和热分解反应属一级反应。
还有些反应例如蔗糖水解实际上是二级反应,但由于水溶液中反应物之一H2O大大过量,其浓度在整个反应过程中可视为常数,故表观上表现为一级反应,这类反应称为“准一级反应”。
例题1 30℃时N2O5在CCl4中的分解反应为一级反应,由于N2O4和NO2均溶于CCl4中,只有O2能逸出,用量气管测定不同时刻逸出O2的体积有下列数据:t / s 0 2400 4800 7200 9600 12000 14400 16800 19200V(O2) / cm3 0 15.65 27.65 37.70 45.85 52.67 58.30 63.00 66.8584.85求算此反应的速率常数k1和半衰期t1/2。
化学反应动力学基础-§1化学反应速率汇编

● §1化学反应速率●§1.1化学反应速率表示法当一个化学反应开始后,反应物的数量(或浓度)不断减少,产物的数量(或浓度)不断增加。
化学反应的速率可以用单位体积单位时间反应进度 的变化来表示。
(在考虑计量系数后,也可以用单位体积单位时间反应物的物质的量减少或产物的物质的量增加来表示。
)如果化学反应以如下计量式来表示:(假设没有副反应)0=∑BB B ν 或 cC +dD —→eE +fFr =V 1dt d ξ=B V ν1dt dn B (=-Vc 1dt dn C =Ve 1dtdn E……) 注意:1、如果化学反应有副反应时,就会出现困难,所得到的数据结果是有差异的。
2、用物质的量来表示反应速率时,通常是否除于计量系数会使得的数据结果有成倍数的差异。
所以在查看化学动力学数据时,需要注意速率表示方式。
因为物质的量是广度性质,而物质的量浓度是强度性质,所以物质的量浓度更适于用来表示化学反应速率。
(B n =V B C )r =V 1dt d ξ=B V ν1dt dn B =B V ν1dt dVC B =B ν1dt dC B +B B V C νdtdV对于等容反应,dV =0r =B ν1dtdC B这个式子适用于大多数的溶液反应和固定容器的气体反应如果化学反应是在固体界面上进行的气—固相间或液—固相间反应,则化学反应速率可以用单位固体界面上(或单位固体体积、或单位固体质量)单位时间反应进度的变化来表示。
r =A 1dtd ξ=B A ν1dt dn B 或 r =V 1dtd ξ=B V ν1dt dn B 或 r =m 1dtd ξ=B m ν1dt dn B化学反应速率的大小会受到温度T 、压力p 、浓度B C 、介质、光、催化剂、……等各种强度性质的影响,由于反应速率表示式中就含有浓度因素,因此现在首先讨论物质浓度对反应速率的影响。
● §1.2物质浓度对化学反应速率的影响 ●§1.2.1化学反应速率方程式如果除了物质浓度以外其他影响化学反应速率的强度性质都保持不变,就可以将反应速率表示成物质浓度的函数关系:r =B ν1dtdC B=f (C B )从后一个等式中,变量只有物质浓度C B 和时间t ,微分方程积分后得到物质浓度C B 与时间t 的函数关系C B =F (t)这两个式子都称为化学反应的速率方程式或动力学方程式,有时细分为动力学微分方程式和动力学积分方程式。
第十一章化学动力学基础(一)练习题及答案

第十一章化学动力学基础(一)练习题一、选择题1. 某化学反应的方程式为2A →P,则在动力学研究表明该反应为:( )(A) 二级反应(B) 基元反应(C) 双分子反应(D) 以上都无法确定2. 对下面反应来说,当用-(d[N2]/dt)表示其反应速率时,与此速率相当的表示是:( )3H2(g)+ N2(g)= 2NH3(g)(A) 2(d[NH3]/dt)(B) 1/3(d[H2]/dt(C) -1/2(d[NH3]/dt)(D) 1/2(d[NH3]/dt)3. 某化学反应为2A + B →P,实验测定其速率常数为k = 0.25 (mol • dm-3)-1• s-1, 则该反应的级数为:( )(A) 零级反应(B) 一级反应(C) 二级反应(D) 三级反应4. 某一基元反应为mA →P,动力学方程为r = k[A]m,[A]的单位是mol • dm-3,时间的单位是s,则k的单位是:( )(A) mol(1 - m)• dm3(m - 1)• s-1(B) mol- m• dm3m• s-1(C) mol(m - 1)• dm3(1 - m)• s-1(D) mol m• dm-3m• s-15. 某气相反应在400 K时的k p = 10-3 kPa-1• s-1,若用k c表示应等于:( )(A) 3326 (mol • dm-3)-1• s-1(B) 3.326 (mol • dm-3)-1• s-1(C) 3.01 × 10-4(mol • dm-3)-1• s-1(D) 3.01 × 10-7(mol • dm-3)-1• s-16. 某反应,当反应物反应掉5/9所需时间是它反应掉1/3所需时间的2倍,则该反应时:( )(A) 3/2级反应(B) 二级反应(C) 一级反应(D) 零级反应7. 有两个都是一级反应的平行反应:下列说法错误的是:( ) (A) k总= k1 +k2(B) E总= E1 +E2(C) k1/k2 = [B]/[C] (D) t1/2 = ln2/(k1 + k2)8. 某一分解反应,当反应物浓度为0.2 mol•L-1,反应速率为0.3 mol•L-1•s-1。
化学动力学基础一111化学动力学的任务和目的ΔmΔm

量纲:压力·时间-1
(2)对多相催化反应
r=
1 dξ Q dt
Q 为催化剂的量,如 m, V, A
1 dξ ⎧ ⎪rm = m dt ⎪ 1 dξ ⎪ ⎨rV = V dt ⎪ 1 dξ ⎪ ⎪rA = A dt ⎩
催化剂的比活性 单位体积催化剂上的反应速率 单位面积催化剂上的反应速率
二、反应速率的测定 c~t 1、化学方法:骤冷、冲稀、加阻化剂或除去催化剂 2、物理方法:利用与物质浓度有关的物理量(如旋光度、电导、折射率、电动势、V、P、光谱等)进行连 续监测,获得一些原位反应的数据。即:物理量~ci 优点: (1)可进行原位分析(2)连续跟踪
2 4 8
二级反应(例题) 1. 某二级反应,反应物消耗 1/3 需时间 10min,若再消耗 1/3 还需时间为: ( (A)10min(B)20min(C)30min( 5 个与 NO 有关的三级反应,类型有:
A + B+C → P 2A + B → P 3A → P
当 x → a 时,t → ∞,反应不能进行到底。 2.k1 量纲:时间-1 3.半衰期: t 1 =
2
1 a ln k1 a − a
= 2
ln 2 k1
与初始浓度 a 无关
4.一级反应的特征 (1)以 ln(a-x)对 t 作图为一直线,斜率为-k1
(2)k1 量纲:时间-1
11-3
(3)对于一给定反应, t 1 是一个常数,与初始浓度 a 无关
2
H + HBr → H2 + Br
Br + Br + M → Br2 + M
k[H 2 ][Br2 ] 2 r3 = [HBr] 1 + k' [Br2 ]
化学动力学基础(一、二)习题

化学动力学基础(一、二)习题一、选择题:1、某反应的速率常数k=0.0462分-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为:(A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分(D) 1/(4.62×102×0.1)分答案:(B)2、某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则:(A ) t1﹥t2(B) t1=t2(C) t1﹤t2(D) 不能确定二者关系答案:(B)3、某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是:(A) 零级(B) 一级反应(C) 三级反应(D) 二级反应答案:(B )4、反应A→B(Ⅰ);A→D(Ⅱ), 已知反应Ⅰ的活化能E1大于反应Ⅱ的活化能E2, 以下措施中哪一种不能改变获得B和D的比例:(A)提高反应温度(B) 降低反应温度(C) 延长反应时间(D) 加入适当的催化剂答案:C5、由基元步骤构成的复杂反应:2A→2B+C A+C→2D,以C物质的浓度变化表示反应速率的速率方程(已知:-dC A/dt=K A1C A2-K A2C B2C c+K A3C A C C ) 则(A)dC c/dt=K A1C A2-K A2C B2C c+K A3C A C C(B)dC c/dt=1/2K A1C A2-1/2K A2C B2C c+1/2K A3C A C C(C)dC c/dt=2K A1C A2-2K A2C B2C c+2K A3C A C C(D)dC D/dt=-K A3C A C C答案:(B)6、反应Ⅰ, 反应物初始浓度C0’, 半衰期t1/2’, 速率常数K1,反应Ⅱ, 反应物初始浓度C0”, 半衰期t1/2”, 速率常数K2,K2/ K1=(3 t1/2’ C0’/2 t1/2” C0”2)则(A) Ⅰ为零级, Ⅱ为二级(B) Ⅰ为一级,Ⅱ为三级(C) Ⅰ为二级, Ⅱ为零级(D) Ⅰ为二级, Ⅱ为三级答案:(D)7、某反应, 以㏒(-dC/dt) 对㏒C作图得直线, 如果该反应为二级, 则直线的(A)截距=2 (B) 截距=0.3010(C) 斜率=2 (D) 截距/斜率=2答案:(C)8、微观可逆性原则不适用的反应是(A)H2+I2=2HI (B)Cl+Cl=Cl2(C)C12H22O11(蔗糖)+H2O=C6H12O6(葡萄糖)+ C6H12O6(果糖)(D)CH3COOC2H5+OH-=CH3COO-+C2H5OH答案:(A)9、理想气体双分子反应A+B→产物, 反应温度600K, 阈能95KJ.mol-1, 活化能97.5 KJ.mol-1, 其有效碰撞分数是(A)3.25×10-9 (B)5.36×10-9(C)0.606 (D)9.03×10-20答案:(B)10、一基元反应, 正反应的活化能是逆反应活化能的2倍, 反应时吸热120 KJ.mol-1, 正反应的活化能是(A) 120 KJ.mol-1 (B) 240 KJ.mol-1(C) 360 KJ.mol-1(D) 60 KJ.mol-1答案:(B)11、对自由基参加的反应A·+ BD→产物, 已知摩尔等压反应热为-90KJ.mol-1, B—D键能为210 KJ.mol-1, 则逆反应的活化能为:(A)105 KJ.mol-1 (B)153 KJ.mol-1(C)300 KJ.mol-1 (D)101.5 KJ.mol-1答案:(D)12、若两个相同类型的气相双分子反应的△H⊙值相等, 又在400k时,它们的活化熵之差△S1⊙-△S2⊙=10 J.mol-1,则两反应的速率常数之比为:(A) K1/K2=0.300 (B) K1/K2=0.997 (C) K1/K2=1.00 (D) K1/K2=3.33答案:(D)13、对反应A+B→C, 由下列数据C A0/mol.dm-3C B0/mol.dm-3 r0/ mol.dm-31.0 1.0 0.152.0 1.0 0.301.02.0 0.15则该反应的速率方程为:(A) r=K C B (B) r=K C A C B(C) r=K C A (D) r=K C A C B2答案:(C)14、理想气体反应A+B→(AB)→产物, E a与活化焓△H⊙的关系为:(A) E a=△H⊙+RT (B) E a=△H⊙+2RT(C) E a=△H⊙-RT (D) E a=△H⊙-2RT答案:(B)15、在对峙反应A+B→C+D中加入催化剂时, 那么(A) K1增大K-1增大K1/ K-1增大(B) K1增大K-1减小K1/ K-1增大(C) K1增大K-1增大K1/ K-1不变(D) K1增大K-1增大K1/ K-1减小答案:(C)16、已知25℃时, △f G m⊙(HCl,g)=-92.30 KJ.mol-1, 化学反应H2(g)+C l2(g)→2HCl(g)(25℃)在催化剂作用下, 可大大加快反应速率, 则反应的△r G m⊙(25℃)为:(A) -92.30 KJ.mol -1 (B) -184.6 KJ.mol -1(C) -228.4KJ.mol -1 (D) 不能确定答案:(B)17、作为载体, 以下那种说法是错误的(A) 提高催化剂的强度 (B) 可与催化剂生成稳定的化合物(C) 改善催化剂的热稳定性 (D) 改善催化剂的导热性答案:(B)18、 液相反应的简单机理如下:A+B →[AB]→生成物其中[AB]称为:(A) 中间产物 (B) 活化络合物 (C) 缔合体 (D) 遭遇对答案:(D)19、设某反应机理为:11(k k A B C -+快速平衡) 2k B+D E+F →(慢) 则其速率常数为:(A)K= K 2 (B) K= K 1 K 2/ K -1 (C) K= K 1 / K -1 (D) K= K 1 ﹒ K -1答案:(B)20、对光化反应,下列说法不正确的是:(A) 光化反应的各个基元步骤的速率都与光强度有关(B) 光化反应初级过程的量子效率必等于1(C) 光化反应的活化能来源于光能(D) 光化反应初级过程,1个光子活化1个原子或分子答案:(A )21、对于均相基元反应A=2B ,下列方程中不正确的是(A) -dC A /dt=KC A (B) dC B /dt=KC A (C) d §/Vdt=K A C A (D) 1/2(d §/Vdt=KC A 答案(B )22、关于催化剂的作用,下列说法中不正确的是(A) 催化剂能改变反应途径 (B) 催化剂能改变反应的速率(C) 催化剂能改变体系的始末态 (D) 催化剂能改变反应的活化能答案(C)23、若反应速率常数的量纲是:[浓度]·[时间]-1,则该反应是:(A)三级反应 (B)二级反应 (C) 一级反应 (D) 零级反应答案(D)24、对一级反应,反应物浓度C 与时间t 的关系是:(A) 以1/C 对t 作图为直线 (B) 以C 对t 作图为直线(C) 以㏑C 对t 作图为直线 (D) 以C 对1/t 作图为直线答案(C)25、对基元反应的以下说法中,不正确的是:(A) 只有基元反应才有反应分子数可言(B) 基元反应的活化能才有明确的物理意义(C) 基元反应是质量作用定律建立的基础(D) 从微观上考虑,基元反应一定是双分子反应答案(D)26、关于基元反应的过渡状态有下列说法(1) 过渡状态是反应途径上活化能的最高点(2) 过渡状态是势能面上能量最高的状态(3) 过渡状态是一个反应途径中反应物分子组能量最高的状态(4) 过渡状态就是活化络合物所处的状态其中正确的是:(A)(1) (2) (B)(3) (4) (C) (1) (3) (D)(2) (4)答案(C)27、验证某一反应机理是否正确,首先必需(A) 根据拟定机理导出的速率浓度关系与实验结果是否一致(B) 用仪器确认是否有自由基存在(C) 根据拟定的各基元反应活化能估算得到的总活化能与实验值相符(D) 确定中间产物的浓度答案(A)28、按碰撞理论,双分子反应的频率因子与(A) T成正比 (B) T 无关(C) T1/2成正比 (D) T3/2成正比答案(C)29、H2和O2反应可产生爆炸,其原因是:(A)H2和O2之比正好为2:1 (B) 直链反应速率快(C)反应热不能及时传递散走 (D) 支链反应速率快答案(D)30、若双分子反应A+B→C+D的速率方程为V=K[A]a[B]b,则一定有(A) a+b=2 (B) a+b﹤2 (C) a+b﹥2 (D) a+b﹤2或 a+b=2答案(D)二、问答题1、复杂反应的表观活化能一定等于组成复杂反应的各基元反应活化能代数和,这种说法对吗?为什么?2、微观可逆性原理只适用于基元反应,这种说法对吗?为什么?3、过渡状态理论的基本假设是什么?4、 H2和O2可产生爆炸,其原因是什么?5、碰撞数与温度、分子相对平动速度、与分子大小,与分子浓度的乘积成正比,这种说法对吗?为什么?6、从拟定的反应机理来确定速率与浓度的关系,可采用什么方法?7、对于双分子反应A+B→产物,阈能和Arrhenius活化能的关系为E c=E a+nRT,则n的值为多少?8、影响化学反应速率常数的因素有那些?9、哈柏法制氨过程的催化剂是什么?10、请写出一级反应,二级反应,三级反应的速率常数的量纲。
【生物化学】第六章 酶促反应动力学

本章纲要
一、化学动力学基础 二、底物浓度对酶反应速度的影响 三、抑制剂对酶反应速度的影响 四、激活剂对酶反应速度的影响 五、温度对酶反应速度的影响 六、pH对酶反应速度的影响
一、化学动力学基础
了解反应速率及其测定 反应分子数和反应级数
一、化学动力学基础
㈠ 反应速率及其测定
单位时间内反应物的减少量或生成物的增加量用瞬时速率表示, 单位: 浓度/时间,研究酶反应速度以酶促反应的初速度为准。
第六章 酶促反应动力学
Enzyme kinetics
概述
研究酶促反应的速率以及影响此速率的各 种因素的科学,是酶工程中的重要内容
研究酶结构和功能的关系以及酶的作用机 制,需要动力学提供实验数据
发挥酶促反应的高效率,寻找最为有利的 反应条件
酶在代谢中的作用和某些药物的作用机制 具有理论研究的意义和实践价值
C是反应物的浓度变化, K为速率常数,是时间的倒数 基元反应:反应物分子在碰撞中一步直接转化为生成物分子的反应。
一、化学动力学基础
2. 反应级数:实验测得的表示反应速率与反应浓度之间关系的概念。 对于基元反应
1.一级反应单分子反应符合V=KC的反应
蔗糖+水
葡萄糖+果糖 V=KC蔗糖C水
由于水的浓度变化影响可忽略(非限制性因素)则V=KC蔗糖
二、底物浓度对酶反应速度的影响
㈠ 中间络合物学说
L.米歇利斯和L.M.门腾(1913)基于酶被底 物饱和的现象,提出“中间产物”学说:
酶与底物反应时,通过特异识别作用,先 形成酶底物复合物,然后再形成产物和酶分 子,酶分子重新结合底物。
该学说已得到大量实验证实
012345678
80
60
傅献彩《物理化学》(第5版)(下册)章节题库-化学动力学基础(一)(圣才出品)

【解析】活化焓相等,则活化能也近似相等,活化熵相差 30 J gK −1 gmol −1 ,则根据
k = P exp( S )exp( − Ea )
R
RT
k2
( S2 − S1 )
= exp R R
30
= exp8.314
= 37
k1
8. 某化学反应,当温度每升高 1K 时,该反应的速率常数 k 增加 1%,则该反应的活化
k = Aexp( − Ea ) RT
1 / 74
圣才电子书 十万种考研考证电子书、题库视频学习平台
得
k2
( E1 − E2 )
= exp RT RT
80000
= exp8.314298
= 1014
k1
3.某二级反应,反应物消耗 1/3 需时间 10min,若再消耗 1/3 还需时间为( )。
应的半衰期为 t1/2=1/(kCA,0)=100s。
10.在简单硬球碰撞理论中,有效碰撞的定义是( )。 A.互撞分子的总动能超过 EC B.互撞分子的相对动能超过 EC C.互撞分子的内部动能超过 EC D.互撞分子的相对平动能在连心线上的分量超过 EC 【答案】D 【解析】能导致旧键破裂的碰撞成为有效碰撞。只有相对平动能在分子连心线上的分量 超过临界值的分子对,才能把平动能转化为分子内部的能量,使旧键破裂而发生原子间的重 新组合。
速率常数的温度系数较小。
12.某反应,无论反应物初始浓度为多少,在相同时间和温度时,反应物消耗的浓度为 定值,此反应是( )。
A.负级数反应 B.一级反应 C.零级反应 D.二级反应 【答案】C
【解析】零级反应速率方程式为:cA,0 − cA = kt ,一定温度下,k 为定值,时间也一定 时,等式右边是常数,所以, cA,0 − cA 即反应物消耗的浓度为定值
第十一章 化学动力学基础(一)

第十一章 化学动力学基础(一)一 选择题1.某反应进行完全所需时间是有限的,且等于C 。
/k ,则该反应是( )(1)一级反应 (2)二级反应 (3)零级反应 (4)三级反应2.基元反应A+B-C →A-B+C 的摩尔反应焓∆rHm <0,B-C 键的键能为εBC,A 为自由基,则反应活化能等于( )(1)0.30εBC (218)0.05εBC (3)0.05εBC +∆rHm (4)0.05εBC -∆rHm3.如果反应2A+B=2D 的速率可表示为 r=-1/2d [A ]/dt=- d [B ]/dt=1/2 d [D ]/dt 则其反应分子数为( )(1)单分子 (2)双分子 (3)三分子 (4)不能确定4.400K 时某气相反应的速率常数Kp=10-3(kpa)-1s -1 若速率常数用k c 表示,则k c 应为( )(1)3.326(mol dm -3)-1 s -1 (2)3.0∗10-4(mol dm -3)-1 s -1(3) 3326(mol dm -3)-1 s -1 (4) 3.0∗10-7(mol dm -3)-1 s -15.关于H 2和O 2 等混合气体存在爆炸高限和低限,下列哪种说法是正确的(1) 高界限主要是热来不及散出所引起的.(2) 高界限主要是由器壁销毁决定.(3) 高界限主要是由器相销毁所决定(4) 高界限与温度基本无关6.如果某反应的∆rHm=100kJ mol -1,那么活化能Ea ( )(1) Ea ≠100kJ mol -1, (2) Ea ≥100kJ mol -1,(3) Ea ≤100kJ mol -1, (4)都可以.7.一级反应,反应物反应掉1/n 所需时间是 ( )(1)-0.6932/k (2) (2.303/k)lg [n/(n-1)](3)(2.303k)lgn (4) (2.303/k)lg(1/n)8.对于基元反应 NO 2+NO 3→NO+O 2+NO 2 ,可作断论 ( )(1)一定是二级反应 (2)一定不是二级反应(3)一定是双分子反应 (4)一定不是双分子反应9.某反应.当反应物反应掉5/9所需时间是它反应掉1/3所需时间 的2倍,则该反应是( )(1)一级反应 (2)零级反应 (3)二级反应 (4)3/2级反应10.当一反应物的初始浓度为0.04 mol dm -3时,反应的半衰期为360S. 初始浓度为0.024 mol dm -3时,反应的半衰期为600S.此反应为 ( )(1) 零级反应 (2)1.5级反应 (3)二级反应 (4)一级反应 11.连串反应A B C,其中k 1=0.1min -1,k 2=0.2min -1.,假定反应开始时只有A,且浓度为1 mol dm -3,则B 浓度达最大的时间为 ( )K 2K (1)0.3 min (2)5.0 min (3)6.93 min (4) ∞12.某放射性同位素的半衰期为5天,则经过15天后所剩的同位素的量是原来的( )(1)1/3 (2)1/4 (3)1/8 (4)1/1613.气固相催化反应 2CO(g)+O 2(g) 2CO 2(g) 的速率方程为r=kP(o 2)/p(co).其反应级数应为 ( )Pt <700k (1) 一级反应 (2)二级反应 (3)对O 2一级,对CO 是负一级(4)级数不能确定.14.某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度 ( )(1)成正比(2)成反比(3)平方成反比(4)无关15.反应A→2B在温度T 时的速率方程为d[B]/dt=k B[A] ,则反应的半衰期为 ( )(1)ln2/ k B(2)2ln2/ k B (3) k B ln2 (4)2 k B ln216.两个活化能不相同的反应,如E2>E1,且都在相同的升温区间内升温,则( )(1)dlnk2/dT> dlnk1/dT (2) dlnk2/dT<dlnk1/Dt(3) dlnk2/dT=dlnk1/dT (4)dk2/dT>dk1Dt17.饱和分子间反应活化能一般都是 ( )(1)比较小 (2)167kJ mol-1以上(3)不需要活化能 (4)400 kJ mol-1以上K1K2K318.在反应A B C, A D 中,活化能E1>E2>E3,C是所需要的产物.从动力学的角度考虑,为了提高C的产量,选择反应温度时,应选择( )(1)较高反应温度(2)较低反应温度(3)适中反应温度(4)任意二填空题1.反应A+B→C的速率方程为: -dC A/dt=k A C A C B/C C,则该反应的总级数是级.若浓度为mol dm-3.时间以S为单位,则速率常数k A的单位是2.反应分子数只能是,一般不会大于3.水溶液中过氧化氢催化分解反应历程为:H2O2(aq)+I-(aq)→H2O(l)+IO-(aq) k1H2O(l)+IO-(aq) →H2O(l)+O2+I-k2当k2>>k1时,该反应的速率方程为4.有一反应mA nB是简单反应,其动力学方程-dC A/dt=kC A m ,C A单位为mol dm-3.时间以S为单位,则(1)k的单位为(2)以dC B/dt表达的反应速率方程和题中给的速率方程关系为5.在恒温下,加入催化剂能加快反应速率的原因是由于,而升高温度能增加反应速率的原因是由于6.分别用反应物和生成物表示反应A+3B=2C的反应速率.并写出它们间关系为.7.某反应的表观活化能为50kJ/mol.在300K下测其速率常数.若要求k的测定误差在1.5%以内,则恒温槽的控温精度为因为.8.N2和H2合成NH3.在4000C下,动力学实验测定结果表明没有催化剂时,其活化能为334.9 kJ/mol.用Fe催化时,活化能降至167.4 kJ/mol.假定催化和非催化反应的指前因子相等. ,则两种情况下反应速率常数之比为9.反应2N2O5→4NO2+O2在328K时O2(g)的生成速率为0.75*10-4mol·dm-3·s-1.(如其间任一中间物浓度极低,难以测得)则该反应的总包反应速率为mol·dm-3·s-1,N2O5的消耗速率为moldm-3s-1 NO2的生成速率为mol·dm-3·s-110.某反应物的转化率分别达到50%,75%,87.5%所需时间分别为t1/2,2t1/2,3t1/2.则反应对此物质的级数为.11.实验测得反应 2A+B→2C+D的速率方程为r=k[A][B],反应历程为A+B→C+F k1(慢)A+F→C+D k2(快)则k1与k的关系为.12.一般情况下,连续反应的决速步是 13.综合反应A B C,稳态近似处理的条件是 ,稳态浓度C B = .K -1K 1K 2 14.在恒温下,加入催化剂能加快反应.速率的原因是由于而升高温度能增加反应速率的原因是由于 15反应A+B AB AB+C D(决速步) 其表观活化能与基元活化能的关系 为 K 2 ,因为 . K -1K 1 16.气相基元反应2A B 在一恒容的容器中进行,P 0为A 的初始压力,P t 为时间t 时反应体系的总压.此反应的速率方程dP t /dt= .K 1 三.计算题1.(1)某溶液含有NaOH 和CH 3COOC 2H 5浓度均为0.01 moldm -3,设为二级反应,在298K.10min 内有39%CH 3COOC 2H 5分解,而在308K 时10min 分解55%.粗略估计288K 在10min 内能分解多少?(2)用对数公式计算293K 时若有50%的CH 3COOC 2H 5分解需时间若干? 2.硝基异丙烷在水溶液中与碱的反应是二级反应.其速率常数可用下式表示: lnk=-7284.4/T+27.383.时间以min,浓度以moldm -3表示(1) 计算反应的活化能.(2) 在283K 时, 硝基异丙烷与碱的浓度均为0.008 moldm -3,求反应的半衰期3.N 2O(g)的热分解反应2N 2O(g) 2N 2(g)+O 2(g).从实验测出不同温度时各个起始浓度与半衰期如下k 反应温度T/K 初始压力P 0/kpa 半衰期t 1/2 /s967 156.787 380967 39.197 15201030 7.066 14401030 47.996 212求(1)反应级数和不同温度下的速率常数(2)实验活化能(3)若1030K 时N 2O(g)的初始压力为54.00kpa.,当压力达到64.02kpa 时所需时间.。
10-化学动力学基础-1

第十章、化学动力学基础(一)(521题)一、选择题( 共71 题)1. 1 分(5202)反应2O3→3O2的速率方程为- d[O3]/d t = k[O3]2[O2]-1 ,或者d[O2]/d t = k'[O3]2[O2]-1,则速率常数k和k' 的关系是:( )(A) 2k = 3k' (B) k = k' (C) 3k = 2k' (D) -k/2 = k'/32. 2 分(5203)气相反应A + 2B ─→2C,A 和B 的初始压力分别为p A和p B,反应开始时并无C,若p为体系的总压力,当时间为t时,A 的分压为:( )(A) p A- p B(B) p - 2p A(C) p - p B(D) 2(p - p A) - p B3. 2 分(5204)对于反应2NO2= 2NO + O2,当选用不同的反应物和产物来表示反应速率时,其相互关系为:( )(A) -2d[NO2]/d t = 2d[NO]/d t = d[O2]/d t(B) - d[NO2]/2d t = d[NO]/2d t = d[O2]/d t = dξ/d t(C) - d[NO2]/d t = d[NO]/d t = d[O2]/d t(D) - d[NO2]/2d t = d[NO]/2d t = d[O2]/d t = 1/V dξ/d t4. 1 分(5222)有关基元反应的描述在下列诸说法中哪一个是不正确的:( )(A) 基元反应的级数一定是整数(B) 基元反应是“态-态”反应的统计平均结果(C) 基元反应进行时无中间产物,一步完成(D) 基元反应不一定符合质量作用定律5. 2 分(5223)400 K 时,某气相反应的速率常数k p= 10-3(kPa)-1·s-1,如速率常数用k C表示,则k C 应为:( )(A) 3.326 (mol·dm-3)-1·s-1(B) 3.0×10-4 (mol·dm-3)-1·s-1(C) 3326 (mol·dm-3)-1·s-1(D) 3.0×10-7 (mol·dm-3)-1·s-16. 2 分(5224)如果反应2A + B =2D 的速率可表示为:r = -12d c A/d t = - d c B/d t =12d c D/d t则其反应分子数为:( )(A) 单分子(B) 双分子(C) 三分子(D) 不能确定7. 1 分(5251)某反应,当反应物反应掉5/9 所需时间是它反应掉1/3 所需时间的2 倍,则该反应是:( )(A) 一级反应(B) 零级反应(C) 二级反应(D) 3/2 级反应8. 1 分(5252)某反应进行完全所需时间是有限的,且等于c0/k,则该反应是:( )(A) 一级反应(B) 二级反应(C) 零级反应(D) 三级反应9. 1 分(5253)反应2A →P 为二级反应,其半衰期:( )(A) 与[A]0无关(B) 与[A]0成正比(C) 与[A]0成反比(D) 与[A]成反比[A]0为反应物A 的起始浓度。
物理化学答案——第九章-化学动力学基础
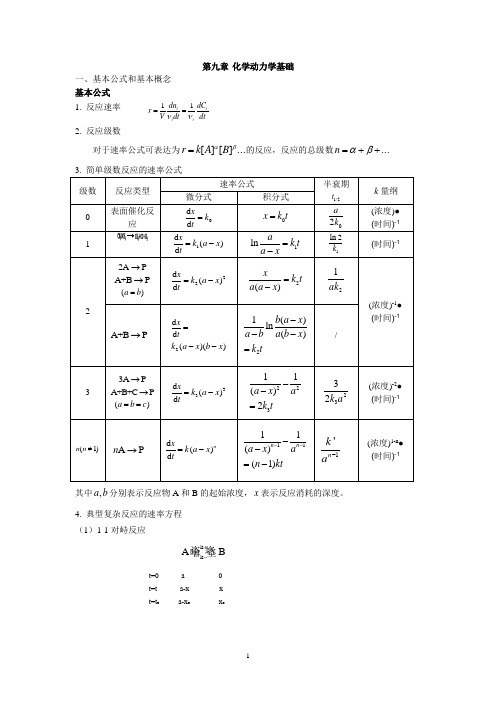
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
第十一章化学动力学基础(二) 本章内容:介绍碰撞理论,过渡状态理论

第十一章化学动力学基础(二)本章内容:介绍碰撞理论,过渡状态理论和单分子反应理论。
了解分子反应动力学的常用实验方法,快速反应所常用的测试方法,说明溶液中反应的特点和溶剂对反应的影响;了解光化学反应的特点及量子产率的计算;介绍催化反应的特点和常见的催化反应的类型。
第一节碰撞理论(simple collision theory)一、碰撞理论基本论点分子碰撞理论是在接受了阿仑尼乌斯活化态、活化能概念的基础上,利用分子运动论于1918 年由路易斯建立起来的。
其基本论点是:1.反应物分子要发生反应必须碰撞,反应物分子间的接触碰撞是发生反应的前提;2.不是任何反应物分子间的碰撞均能发生反应,只有那些能量较高的活化分子、并满足一定的空间配布几何条件的碰撞反应才能发生;3.活化分子的能量较普通能量高,它们碰撞时,松动并部分破坏了反应物分子中的旧键,并可能形成新键,从而发生反应,这样的碰撞称为有效碰撞或非弹性碰撞,活化分子愈多,发生化学反应的可能性就愈大;4.若从Z A,B表示单位时间、单位体积内A,B分子碰撞总数,以q代表有效碰撞在总碰撞数Z A,B中所占的百分数,则反应速率可表示为二、双分子的互碰频率设A、B两种分子都是完全弹性的、无压缩性的刚球,二者半径各为1/2d A, 1/2d B, 单位体积中A的分子数为nN A/V, A分子运动的平均速率为〈U A〉。
假定B分子是静止的,那么一个A 分子与静止B 分子的碰撞次数为,A、B 分子的碰撞直径为d AB = 1/2(d A +d B),碰撞截面为πd2AB,,在时间t内,A分子走过的路程为〈U A〉t,碰撞截面所掠过的体积为〈U A〉tπd2AB, 凡是质心落在这个体积内的静态B分子都可能与A碰撞。
所以移动着的A分子在单位时间内与静止B分子相碰的次数(即碰撞频率)为,由于B分子也在运动,因此要用相对速率u r来代替平均速率(u),A与B的相对速率有几种情况考虑平均情况,则那么,一个运动着的A 分子与运动着的B 分子互相碰撞频率为那么,单位时间、单位体积内所有运动着的A、B 分子碰撞的总次数为对于浓度为[A]的同种分子,则三、硬球碰撞摸型设A.和B为两个没有结构的硬球分子,质量分别为m A和m B,折合质量为μ,运动速度分别为u A、u B,总能量E为'四、微观反应与宏观反应之间的关系反应截面是微观反应动力学基本参数,而速率常数k和实验活化能E a 等是宏观反应动力学参数。
化学动力学基础(一、二)习题

化学动力学基础(一、二)习题一、选择题:1、某反应的速率常数k=0.0462分-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为:(A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分(D) 1/(4.62×102×0.1)分答案:(B)2、某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则:(A ) t1﹥t2(B) t1=t2(C) t1﹤t2(D) 不能确定二者关系答案:(B)3、某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是:(A) 零级(B) 一级反应(C) 三级反应(D) 二级反应答案:(B )4、反应A→B(Ⅰ);A→D(Ⅱ), 已知反应Ⅰ的活化能E1大于反应Ⅱ的活化能E2, 以下措施中哪一种不能改变获得B和D的比例:(A)提高反应温度(B) 降低反应温度(C) 延长反应时间(D) 加入适当的催化剂答案:C5、由基元步骤构成的复杂反应:2A→2B+C A+C→2D,以C物质的浓度变化表示反应速率的速率方程(已知:-dC A/dt=K A1C A2-K A2C B2C c+K A3C A C C ) 则(A)dC c/dt=K A1C A2-K A2C B2C c+K A3C A C C(B)dC c/dt=1/2K A1C A2-1/2K A2C B2C c+1/2K A3C A C C(C)dC c/dt=2K A1C A2-2K A2C B2C c+2K A3C A C C(D)dC D/dt=-K A3C A C C答案:(B)6、反应Ⅰ, 反应物初始浓度C0’, 半衰期t1/2’, 速率常数K1,反应Ⅱ, 反应物初始浓度C0”, 半衰期t1/2”, 速率常数K2,K2/ K1=(3 t1/2’ C0’/2 t1/2” C0”2)则(A) Ⅰ为零级, Ⅱ为二级(B) Ⅰ为一级,Ⅱ为三级(C) Ⅰ为二级, Ⅱ为零级(D) Ⅰ为二级, Ⅱ为三级答案:(D)7、某反应, 以㏒(-dC/dt) 对㏒C作图得直线, 如果该反应为二级, 则直线的(A)截距=2 (B) 截距=0.3010(C) 斜率=2 (D) 截距/斜率=2答案:(C)8、微观可逆性原则不适用的反应是(A)H2+I2=2HI (B)Cl+Cl=Cl2(C)C12H22O11(蔗糖)+H2O=C6H12O6(葡萄糖)+ C6H12O6(果糖)(D)CH3COOC2H5+OH-=CH3COO-+C2H5OH答案:(A)9、理想气体双分子反应A+B→产物, 反应温度600K, 阈能95KJ.mol-1, 活化能97.5 KJ.mol-1, 其有效碰撞分数是(A)3.25×10-9 (B)5.36×10-9(C)0.606 (D)9.03×10-20答案:(B)10、一基元反应, 正反应的活化能是逆反应活化能的2倍, 反应时吸热120 KJ.mol-1, 正反应的活化能是(A) 120 KJ.mol-1 (B) 240 KJ.mol-1(C) 360 KJ.mol-1(D) 60 KJ.mol-1答案:(B)11、对自由基参加的反应A·+ BD→产物, 已知摩尔等压反应热为-90KJ.mol-1, B—D键能为210 KJ.mol-1, 则逆反应的活化能为:(A)105 KJ.mol-1 (B)153 KJ.mol-1(C)300 KJ.mol-1 (D)101.5 KJ.mol-1答案:(D)12、若两个相同类型的气相双分子反应的△H⊙值相等, 又在400k时,它们的活化熵之差△S1⊙-△S2⊙=10 J.mol-1,则两反应的速率常数之比为:(A) K1/K2=0.300 (B) K1/K2=0.997 (C) K1/K2=1.00 (D) K1/K2=3.33答案:(D)13、对反应A+B→C, 由下列数据C A0/mol.dm-3C B0/mol.dm-3 r0/ mol.dm-31.0 1.0 0.152.0 1.0 0.301.02.0 0.15则该反应的速率方程为:(A) r=K C B (B) r=K C A C B(C) r=K C A (D) r=K C A C B2答案:(C)14、理想气体反应A+B→(AB)→产物, E a与活化焓△H⊙的关系为:(A) E a=△H⊙+RT (B) E a=△H⊙+2RT(C) E a=△H⊙-RT (D) E a=△H⊙-2RT答案:(B)15、在对峙反应A+B→C+D中加入催化剂时, 那么(A) K1增大K-1增大K1/ K-1增大(B) K1增大K-1减小K1/ K-1增大(C) K1增大K-1增大K1/ K-1不变(D) K1增大K-1增大K1/ K-1减小答案:(C)16、已知25℃时, △f G m⊙(HCl,g)=-92.30 KJ.mol-1, 化学反应H2(g)+C l2(g)→2HCl(g)(25℃)在催化剂作用下, 可大大加快反应速率, 则反应的△r G m⊙(25℃)为:(A) -92.30 KJ.mol -1 (B) -184.6 KJ.mol -1(C) -228.4KJ.mol -1 (D) 不能确定答案:(B)17、作为载体, 以下那种说法是错误的(A) 提高催化剂的强度 (B) 可与催化剂生成稳定的化合物(C) 改善催化剂的热稳定性 (D) 改善催化剂的导热性答案:(B)18、 液相反应的简单机理如下:A+B →[AB]→生成物其中[AB]称为:(A) 中间产物 (B) 活化络合物 (C) 缔合体 (D) 遭遇对答案:(D)19、设某反应机理为:11(k k A B C -+快速平衡) 2k B+D E+F →(慢) 则其速率常数为:(A)K= K 2 (B) K= K 1 K 2/ K -1 (C) K= K 1 / K -1 (D) K= K 1 ﹒ K -1答案:(B)20、对光化反应,下列说法不正确的是:(A) 光化反应的各个基元步骤的速率都与光强度有关(B) 光化反应初级过程的量子效率必等于1(C) 光化反应的活化能来源于光能(D) 光化反应初级过程,1个光子活化1个原子或分子答案:(A )21、对于均相基元反应A=2B ,下列方程中不正确的是(A) -dC A /dt=KC A (B) dC B /dt=KC A (C) d §/Vdt=K A C A (D) 1/2(d §/Vdt=KC A 答案(B )22、关于催化剂的作用,下列说法中不正确的是(A) 催化剂能改变反应途径 (B) 催化剂能改变反应的速率(C) 催化剂能改变体系的始末态 (D) 催化剂能改变反应的活化能答案(C)23、若反应速率常数的量纲是:[浓度]·[时间]-1,则该反应是:(A)三级反应 (B)二级反应 (C) 一级反应 (D) 零级反应答案(D)24、对一级反应,反应物浓度C 与时间t 的关系是:(A) 以1/C 对t 作图为直线 (B) 以C 对t 作图为直线(C) 以㏑C 对t 作图为直线 (D) 以C 对1/t 作图为直线答案(C)25、对基元反应的以下说法中,不正确的是:(A) 只有基元反应才有反应分子数可言(B) 基元反应的活化能才有明确的物理意义(C) 基元反应是质量作用定律建立的基础(D) 从微观上考虑,基元反应一定是双分子反应答案(D)26、关于基元反应的过渡状态有下列说法(1) 过渡状态是反应途径上活化能的最高点(2) 过渡状态是势能面上能量最高的状态(3) 过渡状态是一个反应途径中反应物分子组能量最高的状态(4) 过渡状态就是活化络合物所处的状态其中正确的是:(A)(1) (2) (B)(3) (4) (C) (1) (3) (D)(2) (4)答案(C)27、验证某一反应机理是否正确,首先必需(A) 根据拟定机理导出的速率浓度关系与实验结果是否一致(B) 用仪器确认是否有自由基存在(C) 根据拟定的各基元反应活化能估算得到的总活化能与实验值相符(D) 确定中间产物的浓度答案(A)28、按碰撞理论,双分子反应的频率因子与(A) T成正比 (B) T 无关(C) T1/2成正比 (D) T3/2成正比答案(C)29、H2和O2反应可产生爆炸,其原因是:(A)H2和O2之比正好为2:1 (B) 直链反应速率快(C)反应热不能及时传递散走 (D) 支链反应速率快答案(D)30、若双分子反应A+B→C+D的速率方程为V=K[A]a[B]b,则一定有(A) a+b=2 (B) a+b﹤2 (C) a+b﹥2 (D) a+b﹤2或 a+b=2答案(D)二、问答题1、复杂反应的表观活化能一定等于组成复杂反应的各基元反应活化能代数和,这种说法对吗?为什么?2、微观可逆性原理只适用于基元反应,这种说法对吗?为什么?3、过渡状态理论的基本假设是什么?4、 H2和O2可产生爆炸,其原因是什么?5、碰撞数与温度、分子相对平动速度、与分子大小,与分子浓度的乘积成正比,这种说法对吗?为什么?6、从拟定的反应机理来确定速率与浓度的关系,可采用什么方法?7、对于双分子反应A+B→产物,阈能和Arrhenius活化能的关系为E c=E a+nRT,则n的值为多少?8、影响化学反应速率常数的因素有那些?9、哈柏法制氨过程的催化剂是什么?10、请写出一级反应,二级反应,三级反应的速率常数的量纲。
第一章动力学基础
(2.1 - 13)
➢ 关键组分k的消耗速率:
rk
1 V
dnk dt
(2.1 - 14)
➢ 以反应程度表示的反应速率与以摩尔数表示的反应速率
之间的关系:
对于 aA bB pP sS
有 (rA ) (rB ) rP rS 1 d r
a
b
p s V dt
(2.1 - 15)
所以r rI (rk ) (2.1 -16)
2
3
33.3%
必须是反应物
2NH3
关键组分K
属பைடு நூலகம்
该组分在原料中的量按化学计
性
量方程计算能完全转化掉,即转
化率最大值为100%。
Chemical Reaction Engineering
关键组分 转化率xK
=
nK 0 nK 100% nK 0
(2.1 - 6)
反应程度 与 转化率 的关系
结合反应程度的定义: nK nK 0 K
(2.1 - 5)
(1)ξ=f(time); (2)ξ是一个累积量,其值恒为正; (3)ξ是以具有广度性质的量,其值与体系的量有关,若希 望其具有强度性质时,可用单位体积的反应程度来表示。
Chemical Reaction Engineering
3、 转化率
3H2
t0
2
t t
0
转化率 100%
N2 1
(rA
)
k
C C n1 n2 AB
反应动力学
包含反应级数的浓度项
反应速率常数(温度项)
Chemical Reaction Engineering
四、影响化学反应速率的温度效应
化学动力学基础1

14
§11.2 化学反应速率的表示方法
Ch11. 动力学基础1
---反应速率测定方法
物理法
利用一些物理性质与浓度成单值函数的关系,测定反
应体系物理量随时间的变化,然后折算成不同时刻反
应物的浓度值,通常可利用的物理量有P,V,α,G等。这
r def 1 d
V dt ----V:反应体系体积
因为:
d def dnB B
r 1 1 dnB 体积恒定 1 dcB 1 d[B]
B B 反应式中物质B的计量系数;r 的量纲: 浓度·时间-1
11
Ch11. 动力学基础1
Ch11 化学动力学基础1
作业:19、34
Ch11 化学动力学基础(一)
Elements of Chemical Kinetics
2
本章目录
§11.1 化学动力学的任务和目的 §11.2 化学反应速率表示法 §11.3 化学反应的速率方程 §11.4 具有简单级数的反应 §11.5 几种典型的复杂反应 §11.7 温度对反应速率的影响 §11.8 关于活化能 §11.9 链反应 §11.10 拟定反应历程的一般方法
---速率方程(rate equation)
动力学方程(Kinetics Equation):反应速率r 与各物质浓度
的函数关系式或各物质的浓度与时间t的函数关系式。
r f (ci )(微分式); ci f (t)(积分式)
反应速率方程只有通过实验才能确定。一般,知道一化学反应 计量方程并不能预言它的速率方程 。
化学热力学预测反应的可能性,
化学动力学基础(一)习题

化学动力学基础(一)一、简答题1.反应Pb(C 2H 5)4=Pb+4C 2H 5是否可能为基元反应为什么2.某反应物消耗掉50%和75%时所需要的时间分别为t 1/2和 t 1/4,若反应对该反应物分别是一级、二级和三级,则t 1/2: t 1/4的比值分别是多少3.请总结零级反应、一级反应和二级反应各有哪些特征平行反应、对峙反应和连续反应又有哪些特征4.从反应机理推导速率方程时通常有哪几种近似方法各有什么适用条件5.某一反应进行完全所需时间时有限的,且等于kc 0(C 0为反应物起始浓度),则该反应是几级反应6. 质量作用定律对于总反应式为什么不一定正确7. 根据质量作用定律写出下列基元反应速率表达式:(1)A+B→2P(2)2A+B→2P(3)A+2B→P+2s(4)2Cl 2+M→Cl 2+M8.典型复杂反应的动力学特征如何9.什么是链反应有哪几种 10.如何解释支链反应引起爆炸的高界限和低界限11.催化剂加速化学反应的原因是什么二、证明题1、某环氧烷受热分解,反应机理如下:稳定产物−→−⋅+⋅+⋅−→−⋅++⋅−→−⋅⋅+⋅−→−43213433k k k k CH R CH R CH RH CO CH R H R RH证明反应速率方程为()()RH kc dtCH dc =4 2、证明对理想气体系统的n 级简单反应,其速率常数()n c p RT k k -=1。
三、计算题1、反应2222SO Cl SO +Cl →为一级气相反应,320℃时512.210s k --=⨯。
问在320℃加热90min ,22SO Cl 的分解百分数为若干[答案:%]2、某二级反应A+B C →初速度为133105---⋅⋅⨯s dm mol ,两反应物的初浓度皆为32.0-⋅dm mol ,求k 。
[答案:11325.1---⋅⋅=s mol dm k ]3、781K 时22H +I 2HI →,反应的速率常数3-1-1HI 80.2dm mol s k =⋅⋅,求2H k 。
化学动力学基础一试卷

化学动力学基础一试卷班级姓名分数一、选择题( 共17题34分)1. 2 分(5203)5203气相反应A + 2B ─→2C,A 和B 的初始压力分别为p A和p B,反应开始时并无C,若p为体系的总压力,当时间为t时,A 的分压为:( )(A) p A- p B(B) p - 2p A(C) p - p B(D) 2(p - p A) - p B2. 2 分(5291)5291某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度:( )(A) 成正比(B) 成反比(C) 平方成反比(D) 无关零级反应3. 2 分(5559)5559连串反应A k1Bk2C 其中k1= 0.1 min-1,k2= 0.2 min-1,假定反应开始时只有A,且浓度为 1 mol·dm-3,则B 浓度达最大的时间为:( )(A) 0.3 min (B) 5.0 min(C) 6.93 min (D) ∞4. 2 分(5268)5268某反应物起始浓度相等的二级反应,k = 0.1 dm3·mol-1·s-1,c0= 0.1 mol·dm-3,当反应率降低9 倍所需时间为:( )(A) 200 s(B) 100 s(C) 30 s(D) 3.3 s5. 2 分(5560)5560某气相1-1 级平行反应M k1R;Mk2S,其指前因子A1= A2,活化能E1≠E2,但均与温度无关,现测得298 K 时,k1/ k2= 100,则754 K 时k1/k2为:( )(A) 2500 (B) 2.5(C) 6.2 (D) 缺活化能数据,无法解6. 2 分(5301)5301某放射性同位素的半衰期为5 d ,则经15 d后,所剩的同位素的量是原来的:( )(A) 1/3(B) 1/4(C) 1/8(D) 1/167. 2 分(5204)5204对于反应2NO2= 2NO + O2,当选用不同的反应物和产物来表示反应速率时,其相互关系为:( )(A) -2d[NO2]/d t = 2d[NO]/d t = d[O2]/d t(B) - d[NO2]/2d t = d[NO]/2d t = d[O2]/d t = dξ/d t(C) - d[NO2]/d t = d[NO]/d t = d[O2]/d t(D) - d[NO2]/2d t = d[NO]/2d t = d[O2]/d t = 1/V dξ/d t8. 2 分(5652)5652化学反应速率常数的Arrhenius 关系式能成立的范围是:( )(A) 对任何反应在任何温度范围内(B) 对某些反应在任何温度范围内(C) 对任何反应在一定温度范围内(D) 对某些反应在一定温度范围内9. 2 分(5286)5286[X]0[Y]0[Z] 增加0.0050 mol·dm-3所需的时间/ s0.10 mol·dm-30.10 mol·dm-3720.20 mol·dm-30.10 mol·dm-3180.20 mol·dm-30.05 mol·dm-336对于反应X + 2Y →3Z,[Z] 增加的初始速率为:( )(A) 对X 和Y 均为一级(B) 对X 一级,对Y 零级(C) 对X 二级,对Y 为一级(D) 对X 四级,对Y 为二级*. 2 分 (5553) 55531-1 级对峙反应 12A B kk 由纯 A 开始反应,当进行到 A 和 B 浓度相等的时间为: (正、逆向反应速率常数分别为 k 1 ,k 2) ( ) (A) t = ln12k k (B) t =11221ln kk k k -(C) t =1121212lnk k k k k +- (D) 112121lnk t k k k k =+-11. 2 分 (5428) 5428假如具有下列半衰期的等物质的量的放射性元素中, 哪一种对生态是瞬时 最危险的?(A) 4.5×109 a (B) 65 a (C) 1 min (D) 12 d12. 2 分 (5707) 5707 在反应 Ak 1Bk 2C ,Ak 3D 中,活化能E 1> E 2> E 3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择: ( ) (A) 较高反应温度 (B) 较低反应温度 (C) 适中反应温度 (D) 任意反应温度13. 2 分 (5260) 5260下表列出反应 A + B → C 的初始浓度和初速:初 始 浓 度 /mol ·dm -3 初 速 /mol ·dm -3·s -1 c A,0 c B,0 1.0 1.0 0.15 2.0 1.0 0.30 3.0 1.0 0.45 1.0 2.0 0.15 1.0 3.0 0.15此反应的速率方程为: ( ) (A) r = k c B (B) r = k c A c B(C) r = k c A(c B)2(D) r = k c A14. 2 分(5308)53082M →P 为二级反应,若M 的起始浓度为1 mol·dm-3,反应1 h后,M 的浓度减少1/2,则反应 2 h后,M 的浓度是:( )(A) 1/4 mol·dm-3(B) 1/3 mol·dm-3(C) 1/6 mol·dm-3(D) 缺少k值无法求15. 2 分(5257)5257当一反应物的初始浓度为0.04 mol·dm-3时,反应的半衰期为360 s,初始浓度为0.024 mol·dm-3时,半衰期为600 s,此反应为:( )(A) 0 级反应(B) 1.5 级反应(C) 2 级反应(D) 1 级反应16. 2 分(5288)5288某反应物反应掉7/8 所需的时间恰好是它反应掉1/2 所需时间的3 倍,则该反应的级数是:( )(A) 零级(B) 一级反应(C) 二级反应(D) 三级反应17. 2 分(5271)5271一级反应完成99.9% 所需时间是完成50% 所需时间的:( )(A) 2 倍(B) 5 倍(C) 10 倍(D) 20 倍二、填空题( 共8题16分)18. 2 分(5311)5311某反应物的转化率分别达到50%,75%,87.5% 所需时间分别为t12,2t12,3t12,则反应对此物质的级数为_______ 。
第十一章化学动力学基础1练习题

第十一章化学动力学基础1练习题第十一章化学动力学基础(1)练习题一、判断题:1.在同一反应中各物质的变化速率相同。
2.若化学反应由一系列基元反应组成,则该反应的速率是各基元反应速率的代数和。
3.单分子反应一定是基元反应。
4.双分子反应一定是基元反应。
5.零级反应的反应速率不随反应物浓度变化而变化。
6.若一个化学反应是一级反应,则该反应的速率与反应物浓度的一次方成正比。
7.一个化学反应进行完全所需的时间是半衰期的2倍。
8.一个化学反应的级数越大,其反应速率也越大。
9.若反应A + B Y + Z的速率方程为:r=kc A c B,则该反应是二级反应,且肯定不是双分子反应。
10. 下列说法是否正确:(1) H2+I2=2HI 是2 分子反应;(2) 单分子反应都是一级反应,双分子反应都是二级反应。
;(3) 反应级数是整数的为简单反应(4) 反应级数是分数的为复杂反应。
11.对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生成更多的产物。
12.若反应(1)的活化能为E 1,反应(2)的活化能为E 2,且E 1 > E 2,则在同一温度下k 1一 定小于k 2。
13.若某化学反应的Δr U m < 0,则该化学反应的活化能小于零。
14.对平衡反应A Y ,在一定温度下反应达平衡时,正逆反应速率常数相等。
15.平行反应C B A 21−→−−→−kk ┤,k 1/k 2的比值不随温度的变化而变化。
16.复杂反应的速率取决于其中最慢的一步。
17.反应物分子的能量高于产物分子的能量,则此反应就不需要活化能。
18.温度升高。
正、逆反应速度都会增大,因此平衡常数也不随温度而改变。
二、单选题:1.反应3O 2 2O 3,其速率方程 -d[O 2]/d t = k [O 3]2[O 2] 或 d[O 3]/d t = k '[O 3]2[O 2],那 么k 与k '的关系是:(A) 2k = 3k ' ; (B) k = k ' ; (C) 3k = 2k ' ; (D) ½k = ⅓k ' 。
第1章化学热力学与动力学基础

率的因素 研究各种化学反响机理,即研究由反响物到生
成物所经历的具体途径
有化学反响的系统的特点
热力系经历化学反响后不仅有热力参数变化, 而且其组成和成分亦会发生变化
确定平衡状态的独立参数在2个以上
Uf(T,P,n1,n2,,nk)
化学反响的热效应
热效应:在以下条件下系统吸收或释放的热量 体系是在等温、等压或等温、等容条件下进展
化学反响 除膨胀功以外不作任何其它形式的功 热效应的分类 生成焓 反响焓 燃烧焓
生成焓
生成焓
由稳定的单质在等温、等压条件下生成一摩尔 的化合物时的热效应,称为该化合物的生成焓。
以Dhf 表示,单位:kJ/mol。
化学反响的热效应
反响焓与反响能的比较
QpQv R Tn
以辛烷C8H18为例:
Q Q 0 假设温度为298K,那么: RT=8.314×2p98=2477.6vkJ/kmol=2.48 kJ/mol 工△程n=上3.5,反响焓与反响能近似相等 RT △n=8.68kJ/mol=76kJ/kg
辛烷的燃烧热: Q=-47837.7kJ/kg
g s g h
T p
T
Gibbs-
Helmholtz 方程
g gh
T p
T
化学平衡与平衡常数
化学平衡常数
质量作用定律
设化学反响的一般式为:
aiA i kaiA i
在温度不变的情况下,反响速率可表示为:
w k1 a 1 C 2 a 2 C 3 a 3 k C ia i
反响焓
任意温度、压力下反响焓的计算
d dHR T 0 TnpcppnRcpR
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1--化学动力学基础[教学要求]1.掌握化学反应速率的基本概念及表示方法。
2.掌握反应机理概念,掌握有效碰撞理论,了解过渡状态理论,掌握活化能、活化分子的概念及其意义。
3.掌握浓度、温度、催化剂对化学反应速率的影响及浓度、温度对化学反应速率影响的定量关系:质量作用定律,化学反应的温度因子,熟悉阿仑尼乌斯方程及其应用。
[教学重点]1.反应机理的概念,有效碰撞理论,过渡状态理论,活化能、活化分子的概念及其意义。
2.浓度、温度、催化剂对化学反应速率的影响及浓度、温度对化学反应速率影响的定量关系:质量作用定律,化学反应的温度因子,阿仑尼乌斯方程及其应用 [教学难点]1.有效碰撞理论,过渡状态理论,活化能、活化分子的概念。
2.阿仑尼乌斯方程。
[主要内容]1.化学反应速率的基本概念及表示方法:平均速率和瞬时速率,同一反应用不同物系表示速率时这些速率间的关系。
2.反应机理(反应历程)概念:基元反应和非基元反应、反应分子数(单分子反应、双分子反应、三分子反应)。
3.反应速率理论简介:有效碰撞理论的基本要点,有效碰撞的条件,有效碰撞、活化能、活化分子的概念,碰撞频率因子与化学反应临界能或阀能的关系公式,活化能、方位因子、碰撞频率因子与反应速率的关系,活化过渡状态理论的基本要点,活化络合物;实验活化能。
4.浓度对化学反应速率的影响:质量作用定律、反应级数、化学反应速率方程式;温度对化学反应速率的影响:阿仑尼乌斯方程式及其应用。
5.催化剂基本概念及其基本特征,催化作用,催化剂对化学反应速率的影响机制 。
[教学内容]§3.1 化学反应速率的概念 3.1.1 平均速率和瞬时速率 1. 平均速率某一有限时间间隔内浓度的变化量。
2. 瞬时速率时间间隔Δt 趋于无限小时的平均速率的极限。
12NO 2 (CCl 4) + O 2(g)例:N 2O 5(CCl 4)21252152252)O N ()O N ()O N (t t c c r ---=tc ∆∆-=)O N (52lim t r r∆→=先考虑一下平均速率的意义:,割线 AB 的斜率要求得在 t 1 — t 2 之间某一时刻 t 0 的反应速率, 可以在 t 0 两侧选时间间隔 t 0 - — t 0 + , 越小, 间隔越小, 则两点间的平均速率越接近 t 0 时的速率t0 .当 -> 0 时, 割线变成切线, 则:割线的极限是切线, 所以割线 AB 的极限是切线 k; 故 t 0 时刻曲线切线的斜率是 t 0 时的瞬时速率 v to . 从瞬时速率的定义, 可以归纳出瞬时速率的求法: (1) 做浓度— 时间曲线图;(2) 在指定时间的曲线位置上做切线;(3) 求出切线的斜率(用做图法, 量出线段长, 求出比值)3.1.2 定容反应速率d d r V tξ=定容条件下,定义:r ——定容条件下的反应速率(mol·L -1·s -1)溶液中的化学反应:A B Y Z d d d d d d d d c c c cr a t b t y t z t=-=-==对于定容的气相反应:BB d 1d p r tν=12NO 2 (CCl 4) + O 2(g)例:N 2O 5(CCl 4)2-125(N O ) mol L 300 sc t ∆(0.180-0.200)⋅=∆5-1-16.6710mol L s -=-⨯⋅⋅24-1-11.3310mol L (NO )s c t -⨯⋅⋅∆=∆5-1-213.3310mol L )s (O c t-∆⋅⋅=⨯∆§3.2 浓度对反应速率的影响——速率方程 3.2.1 化学反应速率方程40℃,CCl 4中N 2O 5分解反应的r :c ( N 2O 5)N 2O 5的分解速率与N 2O 5浓度的比值是恒定的,即反应速率υ与c(N 2O 5)成正比。
上式称为该反应的速率方程式,k 称 为“反应速率常数”,又称“比速常数”,意义是速率方程式中各种物质浓度均为1mol.dm-3时的反应速率;其量纲由速率方程确定;k 大小取决于反应物的本质,而与浓度无关,当其他条件相同时, k↑,则v↑ ;通常,T↑ ,则k↑ 。
速率方程式表示反应速率与浓度的关系。
对于一般的化学反应:α,β—反应级数:若α=1,A 为一级反应; β=2,B 为二级反应,则α+β=3,总反应级数为3。
α,β必须通过实验确定其值。
通常α≠a,β≠b 。
k —反应速率系数:零级反应 mol·L -1 ·s -1; 一级反应 s -1;二级反应 (mol·L -1)-1 ·s -1。
k 不随浓度而变,但受温度的影响,通常温度升高, k 增大。
3.2.2 由实验确定反应速率方程的简单方法—初始速率法例如:反应的有关实验数据如下:25(N O )r kc =A B Y Za b y z +→+A B r kc cαβ=()()()()1073K2222NO g 2H g N g 2H O g +−−−→+该反应的速率方程:对NO 而言是二级反应,对H 2而言是一级反应。
试问如何求出反应速率系数?3.2.3 浓度与时间的定量关系ln c-t 关系应为直线半衰期:当反应物A 的转化率为50%时所需的反应时间称为半衰期,用 1/2t 表示。
对于一级反应,其半衰期为:()22NO (H )r k c c =⎡⎤⎣⎦零级、一级、二级反应的速率方程总结:*仅适用于只有一种反应物的二级反应。
§3.3 温度对反应速率的影响—Arrhenius 方程 3.3.1 Arrhenius 方程Arrhenius 方程:k = k 0 exp (-Ea / RT)k 0—指前参量 A Br kc c αβ=a0ln{}ln{}E k k RT=-对数形式: E a—实验活化能,单位为kJ·mol -1显然ln{k }—{1/T }为直线关系,直线的斜率为:-Ea / RT ,直线的截距为ln{k 0} 。
由Arrhenius 方程可定义E a:2a a 2dln{}dln{}d d E k k E RT T T RT == 则3.3.2 Arrhenius 方程的应用 1.已知T 1—k 1, T 2—k 2,求E a110a 1ln ln /T T k k E RT ==-时, 220a 2ln ln /T T k k E RT ==-时,两式相减,整理得到:a 211211lnE k k R T T ⎛⎫=- ⎪⎝⎭通常活化能的数值在40 ~400 kJ·mol -1 之间,多数为60~250 kJ·mol -1。
2.由E a计算反应速率系数 例题: N 2O 5(g)→2NO 2 (g) +1/2O 2(g)已知:T 1=298.15K, k 1=0.469×10-4s-1T 2=318.15K, k 2=6.29×10-4s -1求:E a 及338.15K 时的k 3。
-1122a 211ln 102kJ mol TT k E RT T k ==⋅-解:3a 11311ln k E k R T T ⎛⎫=- ⎪⎝⎭3.3.3 对Arrhenius 方程的进一步分析1. 在k=k 0exp(-E a /RT),Ea 处于方程的指数项中,对k 有显著影响,在室温下, Ea 每增加4kJ×mol-1,k 值降低约80%.2. 温度升高,k 增大,一般反应温度每升高10℃,k 将增大2~4倍.3. 根据 , 对同一反应,升高一定温度,在高温区值增加较少, 因此对于原本反应温度不高的反应 , 可采用升温的方法提高反应速率。
4. 对不同反应,升高相同温度,Ea 大的反应 k 增大的倍数多,因此升高温度对反应慢的反应有明显的加速作用。
§3.4 反应速率理论和反应机理简介 3.4.1 碰撞理论Lewis 提出,以气体分子运动论为基础,主要用于气相双分子反应。
O 3(g) +NO(g) → NO 2(g) + O 2(g) )( )发生反应的两个基本前提:发生碰撞的分子应有足够高的能量; 碰撞的几何方位要适当;如用数学形式综合上面两个条件: 则 r = Z ×P ×fZ 表示分子碰撞频率,叫做频率因子,P 是与反应物分子碰撞时的取向有关,叫做取向因子,f 为具有发生反应的能量的分子数与总碰撞分子数之比,叫做能量因子。
能量因子符合玻尔兹曼分布率: f = e –E/RT因而有:r = Z P e -E/RTA 、B 的碰撞频率ZAB : (A (g) + B(g) → D(g)) ZAB = Z 0 (A) (B)Z 0为(A )、(B )为单位浓度时的碰撞频率,它与分子量及分子大小有关。
只有平均动能大于一个临界值Ec 的A,B 分子互相碰撞才是“有效碰撞”。
“有效碰撞”占总碰撞次数的分数 f ,符合Maxwell-Boltzmann 分布定律(正态分布),又称“能量因子”。
f = 有效碰撞次数 /总碰撞次数 = exp(- Ec/ RT)Ec 指发生有效碰撞的“分子对”所具有的最低动能(或称“阈能”), 且实验活化能 Ea = Ec + ½ RT ∵ Ec >> ½ RT ∴ Ea ≈ EcA 、B 分子沿着有利的方向碰撞才能发生“有效碰撞”。
活化分子: 能够发生有效碰撞的分子,活化能Ea 是活化分子的平均能量与反应物的平均能量之差. 速率常数与 Z 0、P 、e-Ec/RT有关,即与分子的大小、分子量、活化能、温度、碰撞方位等因素有关,从而从理论上论证了阿仑尼乌斯的公式,阐明了速率常数的物理意义。
该理论直观,但仅限于处理气体双分子反应,且把分子当作刚性球,忽略了的分子结构。
3.4.2 活化络合物理论(过渡态理论)由Eyring 和Pelzer 提出,运用了量子力学及统计力学方法。
认为从反应物到生成物之间形成了势能较高的活化络合物,活化络合物所处的状态叫过渡态。
要点:1. 反应物分子—活化配合物(过渡状态) —产物2. 位能(势能): 始态 < 过渡状态 > 终态3. T 一定, Ea↑ ,则活化分子总分子总数的比例 ↓,反应速率v↓ ;反之, Ea↓ ,反应速率v↑313 6.1210s k --=⨯a 221112ln E k T T k R TT -=⋅3(NO)(O )r kc c =E(Ⅰ)-反应物(始态)势能: E(Ⅱ)-生成物(终态)势能正反应的活化能Ea(正) =Eac - E(Ⅰ)逆反应的活化能Ea(逆) =Eac - E(Ⅱ)ΔrHm= E(Ⅱ) - E(Ⅰ)= [Eac - Ea(逆)] -[Eac - Ea(正)]ΔrHm= Ea(正) - Ea(逆)Ea(正) >Ea(逆),ΔrHm >0 ,为吸热反应Ea(正) <Ea(逆),ΔrHm <0 ,为放热反应例:基元反应可见:正反应活化能Ea = E(活化配合物分子)- E(反应物分子)一般化学反应Ea =60~250kJ•mol若Ea<40 kJ•mol v太大,无法测定。
