氨基酸
氨基酸

元羧酸, 例如谷氨酸 ( Glutamic acid)];中 性 [一元氨基一元羧酸, 例如丙氨酸 (Alanine)] 三种类型。大多数氨基酸都呈显不同程度的酸性或碱性,呈显中性的较少。所以既能与 酸结合成盐,也能与碱结合成盐。 3 由于有不对称的碳原子,呈旋光性。同时由于空间的排列位置不同,又有两种构型: D 型和 L 型,组成蛋白质的氨基酸,都属 L 型。 由于以前氨基酸来源于蛋白质水解(现 在大多为人工合成) ,而蛋白质水解所得的氨基酸均为α-氨基酸,所以在生化研究方面 氨基酸通常指α-氨基酸。至于β、γ、δ……ω等的氨基酸在生化研究中用途较小,大都用 于有机合成、石油化工、医疗等方面。氨基酸及其衍生物品种很多,大多性质稳定,要 避光、干燥贮存。
W Trp Tryptophan 色氨酸
疏 水 性
5.89
2.46
9.41
Y Tyr Tyrosine
亲 水 酪氨酸 性
5.64
2.20
9.21
10.4 6
D Asp
Aspartic acid
天冬氨 酸
2.85
1.99
9.90
3.90
H His Histidine
7.60
1.80
9.33
6.04
N Asn Asparagine
氨基酸
多肽是一种链状的氨基酸
苯丙氨酸是标准氨基酸的一种
氨基酸(Amino acid)是构成蛋白质的基本单位,赋予蛋白质特定的分子结构形态,使他的 分子具有生化活性。蛋白质是生物体内重要的活性分子,包括催化新陈代谢的酵素和酶。 不同的氨基酸化学聚合成肽,一个蛋白质的原始片段,是蛋白质生成的前体。
基本结构 氨基酸为分子结构中含有氨基( ―NH2 )和羧基( ―COOH )的有机化合物。通式是 H2NCHRCOOH。根据氨基连结在羧酸中碳原子的位置,可分为α 、 β 、 γ 、 δ…… 的氨基酸 ( C……C―C―C―C―COOH)。 蛋白质经水解后,即生成20多种α-氨基酸,如甘氨酸、丙氨酸、天冬氨酸、谷氨酸等。
20种常用氨基酸

精氨酸
Arg
HN=C(NH₂)-NH-(CH₂)₃-CH(NH₂)-COOH
碱性;二氨基一羧基酸;必需氨基酸
20
组氨酸
His
NH-CH=N-CH=C-CH₂-CH(NH₂)-COOH
碱性;杂环;必需氨基酸
8
色氨酸
Trp
*Ph-NH-CH=C-CH₂-CH(NH₂)-COOH
芳香基侧链;中性;必需氨基酸;杂环
9
丝氨酸
Ser
HO-CH₂-CH(NH₂)-COOH
极性、中性;含羟基
10
酪氨酸
Tyr
HO-p-Ph-CH₂-CH(NH₂)-COOH
芳香基侧链;极性、中性;条件必需氨基酸
11
半胱氨酸
Cys
HS-CH₂-CH(NH₂)-COOH
非极性、疏水性;中性;必需氨基酸
5
异亮氨酸
Ile
CH₃-CH₂-CH(CH₃)-CH(NH₂)-COOH
非极性、疏水性;中性;必需氨基酸
6
甲硫氨酸(蛋氨酸)
Met
CH₃-S-(CH₂)₂-CH(NH₂)-COOH
非极性、疏水性;中性;必需氨基酸
7
脯氨酸
Pro
*NH-(CH₂)₃-CH-COOH
非极性、疏水性;杂环;亚氨基酸
20种常用氨基酸
序号
氨基酸名称
缩写
化学结构特点
分类
1
甘氨酸
Gly
NH₂-CH₂-COOH
非极性、疏水性;中性
2
丙氨酸
Ala
CH₃-CH(NH₂)-COOH
非极性、疏水性;中性
3
缬氨酸
Val
(CH₃)₂CH-CH(NH₂)-COOH
人体八大氨基酸

人体八大氨基酸人体八大氨基酸是构成蛋白质的基本组成单位,对于人体的生长发育和健康至关重要。
本文将依次介绍人体八大氨基酸的作用及来源。
1. 谷氨酸(Glutamic Acid)谷氨酸是人体中含量较高的氨基酸之一,对于人体的神经系统和免疫系统发挥重要作用。
谷氨酸可通过食物摄入,如肉类、奶制品、豆类等。
2. 苏氨酸(Aspartic Acid)苏氨酸是人体内重要的养分之一,可促进肝脏的解毒功能,同时对心血管系统和神经系统也有一定的保护作用。
苏氨酸主要存在于动物肉类、鱼类、大豆等食物中。
3. 缬氨酸(Valine)缬氨酸是人体无法自身合成的必需氨基酸之一,对于肌肉的生长和修复起着重要作用。
缬氨酸主要存在于肉类、奶制品、大豆等食物中。
4. 亮氨酸(Leucine)亮氨酸是构成蛋白质的重要组成部分,对于促进肌肉生长和修复具有重要作用。
亮氨酸主要存在于肉类、鱼类、蛋类等食物中。
5. 异亮氨酸(Isoleucine)异亮氨酸是人体必需的氨基酸之一,对于肌肉生长和修复有重要作用。
异亮氨酸主要存在于肉类、奶制品、大豆等食物中。
6. 苯丙氨酸(Phenylalanine)苯丙氨酸是人体必需的氨基酸之一,对于神经系统和脑功能发挥重要作用。
苯丙氨酸主要存在于肉类、鱼类、豆类等食物中。
7. 赖氨酸(Lysine)赖氨酸是人体必须从食物中摄入的氨基酸之一,对于促进生长发育、增强免疫力具有重要作用。
赖氨酸主要存在于肉类、奶制品、豆类等食物中。
8. 苏胺酸(Asparagine)苏胺酸是一种非必需氨基酸,对于维持神经系统的稳定和功能发挥重要作用。
苏胺酸主要存在于豆类、坚果、大麦等食物中。
人体八大氨基酸在人体内发挥着重要的生理功能和作用,我们应通过合理的饮食来摄取这些氨基酸。
合理搭配膳食,摄取丰富的蛋白质来源,能够保证人体充足的氨基酸供应,维持人体健康。
20种常见氨基酸的分类和结构

20种常见氨基酸的分类和结构氨基酸是构成蛋白质的基本单位,根据其侧链的不同化学性质,可以将氨基酸分为不同的分类。
下面将介绍20种常见氨基酸的分类和结构。
1.非极性氨基酸:- 甘氨酸 (Gly):侧链仅有一个氢原子。
- 丙氨酸 (Ala):侧链为一个甲基基团。
- 缬氨酸 (Val):侧链为一个异丁基基团。
- 亮氨酸 (Leu):侧链为一个异戊基基团。
- 异亮氨酸 (Ile):侧链为一个异戊基基团和甲基基团。
2.非极性芳香氨基酸:- 苯丙氨酸 (Phe):侧链为苯甲基。
- 色氨酸 (Trp):侧链包含类似吲哚的环结构。
- 酪氨酸 (Tyr):侧链为苯酪基。
3.极性非电荷氨基酸:-非极性的侧链:- 蛋氨酸 (Met):侧链为甲硫基。
- 赖氨酸 (Lys):侧链为五碳鏈帶一原子氮的氨基。
-极性的侧链:- 缬氨酸 (Val):侧链为羟基。
- 嘧啶丙氨酸 (Asn):侧链包含一个酰胺基团。
- 谷氨酸 (Gln):侧链为二酰胺基团。
4.极性带正电氨基酸:- 精氨酸 (Arg):侧链带有三个氨基。
- 肌氨酸 (Lys):侧链带有一个氨基。
- 组氨酸 (His):侧链带有一个咪唑环。
5.极性带负电氨基酸:- 谷氨酸 (Glu):侧链呈羧基酸态。
- 天冬氨酸 (Asp):侧链呈羧基酸态。
- 异亮氨酸 (Ile):侧链包含羧乙基。
以上就是20种常见氨基酸的分类和结构。
每种氨基酸都具有不同的化学结构和性质,它们的组合形成了多样的蛋白质结构和功能。
这些氨基酸的分类对于理解蛋白质的结构和功能以及生物学过程的研究非常重要。
20种常见氨基酸

20种常见氨基酸的名称和结构式名称中文缩写英文缩写结构式非极性氨基酸甘氨酸(-氨基乙酸)Glycine 甘Gly GCH2COONH3丙氨酸(-氨基丙酸)Alanine 丙Ala ACH COONH3CH3亮氨酸(-甲基--氨基戊酸)* Leucine 亮Leu LCHCOONH3(CH3)2CHCH2异亮氨酸(-甲基--氨基戊酸)* Isoleucine 异亮Ile ICHCOONH3CH3CH2CHCH3缬氨酸(-甲基--氨基丁酸)* Valine 缬Val VCHCOONH3(CH3)2CH脯氨酸(-四氢吡咯甲酸)Proline 脯Pro P COONH H苯丙氨酸(-苯基--氨基丙酸)* Phenylalanine 苯丙Phe FCHCOONH3CH2蛋(甲硫)氨酸(-氨基--甲硫基戊酸) * Methionine 蛋Met MCHCOONH3CH3SCH2CH2色氨酸[-氨基--(3-吲哚基)丙酸]* Tryptophan 色Trp W NCH2CH COONH3不带电荷的极性氨基酸丝氨酸(-氨基--羟基丙酸) Serine 丝Ser SCHCOONH3HOCH2谷氨酰胺(-氨基戊酰胺酸)Glutamine 谷胺Gln Q CH2CH2CHCOONH3H2N CO苏氨酸(-氨基--羟基丁酸)* Threonine 苏Thr TCHCOONH3CH3CHOH半胱氨酸(-氨基--巯基丙酸) Cysteine 半胱Cys CCHCOONH3HSCH2天冬酰胺(-氨基丁酰胺酸)Asparagine 天胺Asn NCH2CHCOONH3H2N CO酪氨酸(-氨基--对羟苯基丙酸) Tyrosine 酪Tyr YCHCOONH3CH2HO酸性氨基酸(带负电荷)天冬氨酸(-氨基丁二酸)Aspartic acid 天Asp DNH3HOOCCH2CHCOO谷氨酸(-氨基戊二酸)Glutamic acid 谷Glu ECHCOONH3HOOCCH2CH2碱性氨基酸(带正电荷)赖氨酸(,-二氨基己酸)*Lysine 赖Lys KCHCOONH2CH2CH2CH2CH2NH3精氨酸(-氨基--胍基戊酸)精Arg R H2N C CHCOONH2NHCH2CH2CH2NH2Arginine组氨酸[-氨基--(4-咪唑基)丙酸] Histidine组His H NCH2CH COONH3N* 为必需氨基酸。
氨基酸

紫外吸收性质
氨基酸的一个重要光学性质是对光有吸收作用。20种Pr——AA在可见光区域均无光吸收,在远紫外区(<220nm)均有光吸收,在紫外区(近紫外区)(220nm—300nm)只有三种AA有光吸收能力,这三种氨基酸是苯丙氨酸、酪氨酸、色氨酸,因为它们的R基含有苯环共轭双键系统。苯丙AA最大光吸收在259nm、酪AA在278nm、色AA在279nm,蛋白质一般都含有这三种AA残基,所以其最大光吸收在大约280nm波长处,因此能利用分光光度法很方便的测定蛋白质的含量。分光光度法测定蛋白质含量的依据是朗伯—比尔定律。在280nm处蛋白质溶液吸光值与其浓度成正比。
酸碱性质
1、两性解离与等电点 氨基酸在水溶液或结晶内基本上均以兼性离子或偶极离子的形式存在。所谓两性离子是指在同一个氨基酸分子上带有能释放出质子的NH3正 缬氨酸离子和能接受质子的COO-负离子,因此氨基酸是两性电解质。 氨基酸的等电点:氨基酸的带电状况取决于所处环境的PH值,改变PH值可以使氨基酸带正电荷或负电荷,也可使它处于正负电荷数相等,即净电荷为零的两性离子状态。使氨基酸所带正负电荷数相等即净电荷为零时的溶液PH值称为该AA 2、解离常数 解离式中K1和K2′分别代表α-碳原子上-COOH和-NH3的表现解离常数。在生化上,解离常数是在特定条件下(一定溶液浓度和离子强度)测定的。等电点的计算可由其分子上解离基团的表观解离常数来确定。 氨基酸解离常数列表: 中文译名 支链 分子量 等电点) 羧基解离常数 氨基解离常数 R基解离常数 Gly 甘氨酸 亲水性 75.07 6.06 2.35 9.78 -H Ala 丙氨酸 疏水性 89.09 6.11 2.35 9.87 -CH3 Val 缬氨酸 疏水性 117.15 6.00 2.39 9.74 -CH-(CH3)2 Leu 亮氨酸 疏水性 131.17 6.01 2.33 9.74 -CH2-CH(CH3)2 Ile 异亮氨酸 疏水性 131.17 6.05 2.32 9.76 -CH(CH3)-CH2-CH3 Phe 苯丙氨酸 疏水性 165.19 5.49 2.20 9.31 -CH2-C6H5 Trp 色氨酸 疏水性 204.23 5.89 2.46 9.41 -C8NH6 Tyr 酪氨酸 疏水性 181.19 5.64 2.20 9.21 10.46 -CH2-C6H4-OH Asp 天冬氨酸 酸性 133.10 2.85 1.99 9.90 3.90 -CH2-COOH Asn 天冬酰胺 亲水性 132.12 5.41 2.14 8.72 -CH2-CONH2 Glu 谷氨酸 酸性 147.13 3.15 2.10 9.47 4.07 -(CH2)2-COOH Lys 赖氨酸 碱性 146.19 9. 60 2.16 9.06 10.54 -(CH2)4-NH2 Gln 谷氨酰胺 亲水性 146.15 5.65 2.17 9.13 -(CH2)2-CONH2 Met 甲硫氨酸 疏水性 149.21 5.74 2.13 9.28 -(CH2)-S-CH3 Ser 丝氨酸 亲水性 105.09 5.68 2.19 9.21 -CH2-OH Thr 苏氨酸 亲水性 119.12 5.60 2.09 9.10 -CH(CH3)-OH Cys 半胱氨酸 亲水性 121.16 5.05 1.92 10.70 8.37 -CH2-SH Pro 脯氨酸 疏水性 115.13 6.30 1.95 10.64 -C3H6 His 组氨酸 碱性 155.16 7.60 1.80 9.33 6.04 Arg 精氨酸 碱性 174.20 10.76 1.82 8.99 12.48 3、多氨基(碱性氨基酸)和多羧基(酸性氨基酸)氨基酸的解离 解离原则:先解离α-COOH,随后其他-COOH;然后解离α-NH3+,随后其他-NH3总之羧基解离度大于氨基,α-C上基团大于非α-C上同一基团的解离度。等电点的计算:首先写出解离方程,两性离子左右两端的表观解离常数的对数的算术平均值。一般PI值等于两个相近PK值之和的一半。如天冬氨酸 赖氨酸 4、氨基酸的酸碱滴定曲线 以甘氨酸为例:摩尔甘氨酸溶于水时,溶液PH为5.97,分别用标准NaOH和HCL滴定,以溶液PH值为纵坐标,加入HCL和NaOH的摩尔数为横坐标作图,得到滴定曲线。该曲线一个十分重要的特点就是在PH=2.34和PH=9.60处有两个拐点,分别为其PK和PK。 规律:pH<pK1′时,[R]>[R±]>[R]; pH>pK2′时,[R]>[R±]>[R+]; pH=pI时,净电荷为零,[R]=[R-]; pH<pI时,净电荷为“+”; pH>pI时,净电荷为“-”。
氨基酸

氨基酸amino acid定义1:同时含有一个或多个氨基和羧基的脂肪族有机酸。
根据氨基和羧基的位置,有α氨基酸和β氨基酸等类型。
参与蛋白质合成的常见的是20种L-α-氨基酸。
定义2:羧酸分子中α碳原子上的一个氢原子被氨基取代所生成的衍生物,是蛋白质的基本结构单位。
定义3:同时含有一个或多个氨基和羧基的脂肪族有机酸。
根据氨基和羧基的位置,有α氨基酸和β氨基酸等类型。
参与蛋白质合成的常见的是20种L-α-氨基酸。
百科名片简介氨基酸(Amino acid)是构成蛋白质(protein)的基本单位,赋予蛋白质特定的分子结构形态,使它的分子具有生化活性。
蛋白质是生物体内重要的活性分子,包括催化新陈代谢的酶。
两个或两个以上的氨基酸化学聚合成肽,一个蛋白质的原始片段,是蛋白质生成氨基酸是指含有氨基的羧酸。
生物体内的各种蛋白质是由20种基本氨基酸构成的。
除甘氨酸外均为L-α-氨基酸其中(脯氨酸是一种L-α-亚氨基酸),其结构通式如图(R基为可变基团):构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。
除甘氨酸外,其它蛋白质氨基酸的α-碳原子均为不对称碳原子(即与α-碳原子键合的四个取代基各不相同),因此氨基酸可以有立体异构体,即可以有不同的构型(D-型与L-型两种构型)。
分类20种蛋白质氨基酸在结构上的差别取决于侧链基团R的不同。
通常根据R基团的化学结构或性质将20种氨基酸进行分类根据侧链基团的极性1、非极性氨基酸(疏水氨基酸)8种丙氨酸(Ala)缬氨酸(Val)亮氨酸(Leu)异亮氨酸(Ile)脯氨酸(Pro)苯丙氨酸(Phe)色氨酸(Trp)蛋氨酸(Met)2、极性氨基酸(亲水氨基酸):1)极性不带电荷:7种甘氨酸(Gly)丝氨酸(Ser)苏氨酸(Thr)半胱氨酸(Cys)酪氨酸(Tyr)天冬酰胺(Asn)谷氨酰胺(Gln)2)极性带正电荷的氨基酸(碱性氨基酸) 3种赖氨酸(Lys)精氨酸(Arg)组氨酸(His)3)极性带负电荷的氨基酸(酸性氨基酸) 2种天冬氨酸(Asp)谷氨酸(Glu)根据氨基酸分子的化学结构1、脂肪族氨基酸:丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺2、芳香族氨基酸:苯丙氨酸、酪氨酸3、杂环族氨基酸:组氨酸、色氨酸4、杂环亚氨基酸:脯氨酸从营养学的角度1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这一般性质缬氨酸无色晶体,熔点极高,一般在200℃以上。
人体需要的21氨基酸

人体需要的21氨基酸人体蛋白质的构成基础是氨基酸,氨基酸共有20种常见的类型,这些被称为标准氨基酸,是构成蛋白质的基本单元。
这20种标准氨基酸是:1. 丙氨酸(Alanine, Ala, A)2. 精氨酸(Arginine, Arg, R)3. 天冬氨酸(Aspartic acid, Asp, D)4. 天冬酰胺(Asparagine, Asn, N)5. 半胱氨酸(Cysteine, Cys, C)6. 谷氨酸(Glutamic acid, Glu, E)7. 谷氨酰胺(Glutamine, Gln, Q)8. 甘氨酸(Glycine, Gly, G)9. 组氨酸(Histidine, His, H)10. 异亮氨酸(Isoleucine, Ile, I)11. 亮氨酸(Leucine, Leu, L)12. 赖氨酸(Lysine, Lys, K)13. 甲硫氨酸(Methionine, Met, M)14. 苯丙氨酸(Phenylalanine, Phe, F)15. 脯氨酸(Proline, Pro, P)16. 丝氨酸(Serine, Ser, S)17. 胸腺氨酸(Threonine, Thr, T)18. 色氨酸(Tryptophan, Trp, W)19. 酪氨酸(Tyrosine, Tyr, Y)20. 缬氨酸(Valine, Val, V)除此之外,还有一些氨基酸不是由遗传密码直接编码的,但它们也存在于蛋白质中,例如:21. 硒代半胱氨酸(Selenocysteine,被认为是第21种“标准”氨基酸)22. 吡咯赖氨酸(Pyrrolysine,有时被认为是第22种“标准”氨基酸)硒代半胱氨酸在蛋白质合成中的插入是通过特定的RNA 结构和专门的延伸因子进行的,这使得它成为蛋白质生物合成的罕见组分。
吡咯赖氨酸在某些古细菌和少数细菌中发现。
人体可以自己合成一部分氨基酸,这些被称为非必需氨基酸。
20种常见氨基酸

Q
甘氨酸
Gly
G
丙氨酸
Ala
A
缬氨酸
Val
V
亮氨酸
Leu
L
20种常见氨基酸
氨基酸名称
三字符号
单字符号
氨基酸名称
三字符号
单字符号
天冬氨酸
Asp
D
异亮氨酸
Ile
I
谷氨酸
Glu
E
脯氨酸
Pro
P
赖氨酸
Lys
K
二十种氨基酸的结构特点
支链氨基酸:缬氨酸、亮氨酸、异亮氨酸
含羟基的氨基酸:丝氨酸、苏氨酸(含硫甲基)
含苯环的氨基酸:苯丙氨酸、色氨酸、酪氨酸
含胍基的氨基酸:精氨酸
含咪唑基的氨基酸:组氨酸
亚氨基酸:脯氨酸
含酰胺的氨基酸:天冬酰胺、谷氨酰胺
含吲哚基的氨基酸:色氨酸
含ε-氨基的氨基酸:赖氨酸
精氨酸
Arg
R
组氨酸
His
H
酪氨酸
Tyr
Y
苯丙氨酸
Phe
F
丝氨酸
Ser
S
色氨酸
Trh
W
半胱氨酸
Cys
C
蛋氨酸
Met
M
苏氨酸
Thr
T
天冬酰胺
Asn
N
谷氨酰胺
20种氨基酸的特殊分类

20种氨基酸的特殊分类一、极性氨基酸:1. 赖氨酸(Lysine):是一种带有阳离子的氨基酸,具有强烈的极性,主要参与电荷相互作用。
2. 精氨酸(Arginine):带有阳离子的氨基酸,具有较强的极性,主要参与电荷相互作用。
3. 谷氨酸(Glutamic acid):带有阴离子的氨基酸,具有较强的极性,主要参与电荷相互作用。
4. 酪氨酸(Tyrosine):在苯丙氨酸的基础上,加入了一个羟基,具有一定的极性。
二、非极性氨基酸:5. 丙氨酸(Alanine):是一种非极性氨基酸,与其他氨基酸相互作用较少。
6. 缬氨酸(Valine):是一种非极性氨基酸,主要参与疏水作用。
7. 亮氨酸(Leucine):是一种非极性氨基酸,主要参与疏水作用。
8. 异亮氨酸(Isoleucine):是一种非极性氨基酸,主要参与疏水作用。
三、芳香族氨基酸:9. 苯丙氨酸(Phenylalanine):是一种含有苯环结构的氨基酸,具有芳香性。
10. 酪氨酸(Tyrosine):在苯丙氨酸的基础上,加入了一个羟基,具有芳香性。
11. 色氨酸(Tryptophan):是一种含有吲哚环结构的氨基酸,具有芳香性。
四、含硫氨基酸:12. 胱氨酸(Cysteine):是一种含有硫原子的氨基酸,具有较强的还原性。
13. 甲硫氨酸(Methionine):是一种含有硫原子的氨基酸,具有较强的亲脂性。
五、酸性氨基酸:14. 天冬氨酸(Aspartic acid):是一种带有阴离子的氨基酸,具有酸性。
15. 谷氨酸(Glutamic acid):带有阴离子的氨基酸,具有酸性。
六、碱性氨基酸:16. 赖氨酸(Lysine):是一种带有阳离子的氨基酸,具有碱性。
17. 精氨酸(Arginine):带有阳离子的氨基酸,具有碱性。
18. 组氨酸(Histidine):是一种带有阳离子的氨基酸,具有碱性。
七、含醇氨基酸:19. 苏氨酸(Threonine):是一种含有醇基的氨基酸,具有醇的特性。
20种常见氨基酸
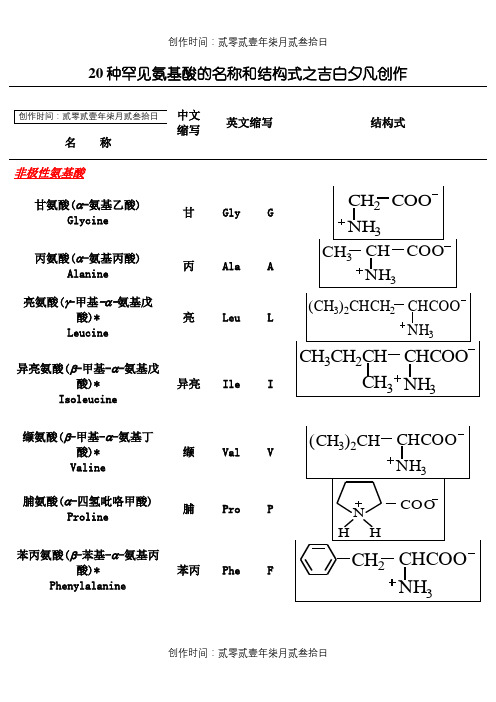
20种罕见氨基酸的名称和结构式之吉白夕凡创作
名称
结构式非极性氨基酸
甘氨酸(α-氨基乙酸)
Glycine 甘Gly G
丙氨酸(α-氨基丙酸)
Alanine
丙Ala A 亮氨酸(γ-甲基-α-氨基戊
酸)* Leucine 亮Leu L
异亮氨酸(β-甲基-α-氨基戊
酸)*
Isoleucine
异亮Ile I 缬氨酸(β-甲基-α-氨基丁
酸)* Valine 缬Val V
脯氨酸(α-四氢吡咯甲酸)
Proline
脯Pro P
苯丙氨酸(β-苯基-α-氨基丙
酸)*
Phenylalanine
苯丙Phe F
不带电荷的极性氨基酸
丝氨酸(α-氨基-β-羟基丙
酸) Serine 丝Ser S
谷氨酰胺(α-氨基戊酰胺酸)
Glutamine
谷胺Gln Q
苏氨酸(α-氨基-β-羟基丁
酸)*
Threonine
苏Thr T
半胱氨酸(α-氨基-β-巯基丙
酸)
Cysteine
半胱Cys C
天冬酰胺(α-氨基丁酰胺酸)
Asparagine
天胺Asn N
酪氨酸(α-氨基-β-对羟苯基
丙酸)
Tyrosine
酪Tyr Y 酸性氨基酸(带负电荷)
碱性氨基酸(带正电荷)
赖氨酸(α,ω
-二氨基己酸)*
Lysine
赖 Lys K
精氨酸(α-氨基-δ-胍基戊酸)
Arginine
精
Arg
R
* 为必须氨基酸。
氨基酸

定义:氨基酸(amino acid):是含有一个碱性氨基和一个酸性羧基的有机化合物,氨基一般连在α-碳上。
氨基酸的结构通式是生物功能大分子蛋白质的基本组成单位。
分类:必需氨基酸(essential amino acid):指人(或其它脊椎动物)(赖氨酸,苏氨酸等)自己不能合成,需要从食物中获得的氨基酸。
非必需氨基酸(nonessential amino acid):指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
检测:茚三酮反应(ninhydrin reaction):在加热条件下,氨基酸或肽与茚三酮反应生成紫色(与脯氨酸反应生成黄色)化合物的反应。
蛋白质:肽键(peptide bond):一个氨基酸的羧基与另一个的氨基的氨基缩合,除去一分子水形成的酰氨键。
肽(peptide):两个或两个以上氨基通过肽键共价连接形成的聚合物。
是氨基酸通过肽键相连的化合物,蛋白质不完全水解的产物也是肽。
肽按其组成的氨基酸数目为2个、3个和4个等不同而分别称为二肽、三肽和四肽等,一般含10个以下氨基酸组成的称寡肽(oligopeptide),由10个以上氨基酸组成的称多肽(polypeptide),它们都简称为肽。
肽链中的氨基酸已不是游离的氨基酸分子,因为其氨基和羧基在生成肽键中都被结合掉了,因此多肽和蛋白质分子中的氨基酸均称为氨基酸残基(amino acid residue)。
多肽有开链肽和环状肽。
在人体内主要是开链肽。
开链肽具有一个游离的氨基末端和一个游离的羧基末端,分别保留有游离的α-氨基和α-羧基,故又称为多肽链的N端(氨基端)和C端(羧基端),书写时一般将N端写在分子的左边,并用(H)表示,并以此开始对多肽分子中的氨基酸残基依次编号,而将肽链的C端写在分子的右边,并用(OH)来表示。
目前已有约20万种多肽和蛋白质分子中的肽段的氨基酸组成和排列顺序被测定了出来,其中不少是与医学关系密切的多肽,分别具有重要的生理功能或药理作用。
20种常见氨基酸分子式

20种常见氨基酸分子式氨基酸(Amino Acid),是构成生物体内蛋白质的基本单元。
在自然界中,已发现了20种常见的氨基酸。
每一种氨基酸都具有独特的分子式和特性,这些特性决定了它们在蛋白质合成和生化反应中的作用。
在本文中,将介绍这20种常见氨基酸的分子式及其特点。
1. 丙氨酸(Alanine)- Ala分子式:C3H7NO2特点:丙氨酸是一种非极性氨基酸,具有疏水性。
它在体内起到维持合成蛋白质的作用,并参与能量产生的过程。
2. 缬氨酸(Valine)- Val分子式:C5H11NO2特点:缬氨酸是支链氨基酸之一,具有疏水性。
它在体内起到调节细胞代谢稳态和肌肉生长的作用。
3. 亮氨酸(Leucine)- Leu分子式:C6H13NO2特点:亮氨酸也是一种支链氨基酸,具有疏水性。
它在体内参与细胞信号传导和蛋白质合成等重要过程。
4. 缬氨酸(Isoleucine)- Ile分子式:C6H13NO2特点:缬氨酸是一种支链氨基酸,具有疏水性。
它在体内参与蛋白质合成和糖原合成等生化反应。
5. 丝氨酸(Serine)- Ser分子式:C3H7NO3特点:丝氨酸是一种假性极性氨基酸,具有亲水性。
它在体内参与蛋白质磷酸化、转化和合成等关键过程。
6. 苏氨酸(Threonine)- Thr分子式:C4H9NO3特点:苏氨酸是一种假性极性氨基酸,具有亲水性。
它在体内参与蛋白质合成和免疫系统的调节。
7. 缬氨酸(Cysteine)- Cys分子式:C3H7NO2S特点:缬氨酸是一种含硫氨基酸,具有亲水性。
它在体内参与抗氧化过程和硫醇反应的调控。
8. 亮氨酸(Methionine)- Met分子式:C5H11NO2S特点:亮氨酸也是一种含硫氨基酸,具有亲水性。
它在体内参与蛋白质合成和甲硫氨酸新陈代谢。
9. 缬氨酸(Phenylalanine)- Phe分子式:C9H11NO2特点:缬氨酸是一种芳香氨基酸,具有亲水性。
它在体内参与神经递质的合成和蛋白质稳定性的调节。
氨基酸 百度百科

编辑词条氨基酸百科名片氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通称。
生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。
是含有一个碱性氨基和一个酸性羧基的有机化合物。
氨基连在α-碳上的为α-氨基酸。
天然氨基酸均为α-氨基酸。
目录[隐藏]氨基酸的结构通式氨基酸的分类氨基酸的检测氨基酸的功能氨基酸合成氨基酸所对应的密码子表氨基酸胶囊氨基酸的结构通式氨基酸的分类氨基酸的检测氨基酸的功能氨基酸合成氨基酸所对应的密码子表氨基酸胶囊amino acid (abbr.aa)[编辑本段]氨基酸的结构通式α-氨基酸的结构通式:(R是可变基团)构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。
[编辑本段]氨基酸的分类天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
共有10种其作用分别是:①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;②色氨酸(Tryptophan):促进胃液及胰液的产生;③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗;④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;⑦亮氨酸(Leucine ):作用平衡异亮氨酸;⑧缬氨酸(Valine):作用于黄体、乳腺及卵巢。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨基酸氨基酸定义氨基酸(amino acids):含有氨基和羧基的一类有机化合物的通称。
生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。
是含有一个碱性氨基和一个酸性羧基的有机化合物,氨基一般连在α-碳上。
氨基酸的结构通式:构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。
氨基酸分类天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
共有8种其作用分别是:①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;②色氨酸(Tryptophane):促进胃液及胰液的产生;③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗;④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;⑦亮氨酸(Leucine ):作用平衡异亮氨酸;⑧缬氨酸(Viline):作用于黄体、乳腺及卵巢。
其理化特性大致有:1)都是无色结晶。
熔点约在230°C以上,大多没有确切的熔点,熔融时分解并放出CO2;都能溶于强酸和强碱溶液中,除胱氨酸、酪氨酸、二碘甲状腺素外,均溶于水;除脯氨酸和羟脯氨酸外,均难溶于乙醇和乙醚。
2)有碱性[二元氨基一元羧酸,例如赖氨酸(lysine)];酸性[一元氨基二元羧酸,例如谷氨酸(Glutamic acid)];中性[一元氨基一元羧酸,例如丙氨酸(Alanine)]三种类型。
大多数氨基酸都呈显不同程度的酸性或碱性,呈显中性的较少。
所以既能与酸结合成盐,也能与碱结合成盐。
3)由于有不对称的碳原子,呈旋光性。
同时由于空间的排列位置不同,又有两种构型:D型和L型,组成蛋白质的氨基酸,都属L型。
由于以前氨基酸来源于蛋白质水解(现在大多为人工合成),而蛋白质水解所得的氨基酸均为α-氨基酸,所以在生化研究方面氨基酸通常指α-氨基酸。
至于β、γ、δ……ω等的氨基酸在生化研究中用途较小,大都用于有机合成、石油化工、医疗等方面。
氨基酸及其衍生物品种很多,大多性质稳定,要避光、干燥贮存。
2、非必需氨基酸(nonessential amino acid):指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。
例如甘氨酸、丙氨酸等氨基酸。
氨基酸单字母简写和性质列表:缩写全名中文译名支链分子量等电点解离常数(羧基)解离常数(胺基)pKr(R)G Gly Glycine 甘氨酸亲水性75.07 6.06 2.35 9.78A Ala Alanine 丙氨酸疏水性89.09 6.11 2.35 9.87V Val Valine 缬氨酸疏水性117.15 6.00 2.39 9.74L Leu Leucine 亮氨酸疏水性131.17 6.01 2.33 9.74I Ile Isoleucine 异亮氨酸疏水性131.17 6.05 2.32 9.76F Phe Phenylalanine 苯丙氨酸疏水性165.19 5.49 2.20 9.31W Trp Tryptophan 色氨酸疏水性204.23 5.89 2.46 9.41Y Tyr Tyrosine 酪氨酸亲水性181.19 5.64 2.20 9.21 10.46D Asp Aspartic acid 天冬氨酸酸性133.10 2.85 1.99 9.90 3.90H His Histidine 组氨酸碱性155.16 7.60 1.80 9.33 6.04N Asn Asparagine 天冬酰胺亲水性132.12 5.41 2.14 8.72E Glu Glutamic acid 谷氨酸酸性147.13 3.15 2.10 9.47 4.07K Lys Lysine 赖氨酸碱性146.19 9.60 2.16 9.06 10.54Q Gln Glutamine 谷氨酰胺亲水性146.15 5.65 2.17 9.13M Met Methionine 甲硫氨酸疏水性149.21 5.74 2.13 9.28R Arg Arginine 精氨酸碱性174.20 10.76 1.82 8.99 12.48S Ser Serine 丝氨酸亲水性105.09 5.68 2.19 9.21T Thr Threonine 苏氨酸亲水性119.12 5.60 2.09 9.10C Cys Cysteine 半胱氨酸亲水性121.16 5.05 1.92 10.70 8.37P Pro Proline 脯氨酸疏水性115.13 6.30 1.95 10.64氨基酸检测茚三酮反应(ninhydrin reaction):在加热条件下,氨基酸或肽与茚三酮反应生成紫色(与脯氨酸反应生成黄色)化合物的反应。
肽键(peptide bond):一个氨基酸的羧基与另一个氨基酸的氨基缩合,除去一分子水形成的酰胺键。
肽(peptide):两个或两个以上氨基通过肽键共价连接形成的聚合物。
是氨基酸通过肽键相连的化合物,蛋白质不完全水解的产物也是肽。
肽按其组成的氨基酸数目为2个、3个和4个等不同而分别称为二肽、三肽和四肽等,一般含10个以下氨基酸组成的称寡肽(oligopeptide),由10个以上氨基酸组成的称多肽(polypeptide),它们都简称为肽。
肽链中的氨基酸已不是游离的氨基酸分子,因为其氨基和羧基在生成肽键中都被结合掉了,因此多肽和蛋白质分子中的氨基酸均称为氨基酸残基(amino acid residue)。
多肽有开链肽和环状肽。
在人体内主要是开链肽。
开链肽具有一个游离的氨基末端和一个游离的羧基末端,分别保留有游离的α-氨基和α-羧基,故又称为多肽链的N端(氨基端)和C端(羧基端),书写时一般将N端写在分子的左边,并用(H)表示,并以此开始对多肽分子中的氨基酸残基依次编号,而将肽链的C端写在分子的右边,并用(OH)来表示。
目前已有约20万种多肽和蛋白质分子中的肽段的氨基酸组成和排列顺序被测定了出来,其中不少是与医学关系密切的多肽,分别具有重要的生理功能或药理作用。
多肽在体内具有广泛的分布与重要的生理功能。
其中谷胱甘肽在红细胞中含量丰富,具有保护细胞膜结构及使细胞内酶蛋白处于还原、活性状态的功能。
而在各种多肽中,谷胱甘肽的结构比较特殊,分子中谷氨酸是以其γ-羧基与半胱氨酸的α-氨基脱水缩合生成肽键的,且它在细胞中可进行可逆的氧化还原反应,因此有还原型与氧化型两种谷胱甘肽。
近年来一些具有强大生物活性的多肽分子不断地被发现与鉴定,它们大多具有重要的生理功能或药理作用,又如一些“脑肽”与机体的学习记忆、睡眠、食欲和行为都有密切关系,这增加了人们对多肽重要性的认识,多肽也已成为生物化学中引人瞩目的研究领域之一。
多肽和蛋白质的区别,一方面是多肽中氨基酸残基数较蛋白质少,一般少于50个,而蛋白质大多由100个以上氨基酸残基组成,但它们之间在数量上也没有严格的分界线,除分子量外,现在还认为多肽一般没有严密并相对稳定的空间结构,即其空间结构比较易变具有可塑性,而蛋白质分子则具有相对严密、比较稳定的空间结构,这也是蛋白质发挥生理功能的基础,因此一般将胰岛素划归为蛋白质。
但有些书上也还不严格地称胰岛素为多肽,因其分子量较小。
但多肽和蛋白质都是氨基酸的多聚缩合物,而多肽也是蛋白质不完全水解的产物。
氨基酸制备专利集1、氨基酸纳米硒及其制备方法2、含有活性药物、主链中具有氨基酸的聚酯及其制备方法3、复合氨基酸胶囊及其制备方法4、利用离交树脂由D-N-氨甲酰氨基酸水解制备D-氨基酸的方法5、一种D-氨基酸氧化酶的制备方法6、利用洋葱伯克霍氏德氏菌JS-02制备系列D-a-氨基酸的方法7、3-羟基-3-甲基丁酸(HMB)氨基酸盐制备方法8、环酮、其制备以及其在合成氨基酸中的应用9、一种氨基酸人体毛发营养食品或药品添加剂及其制备方法10、氨基酸叶面肥的制备方法11、氨基酸-麦饭石复合微量元素肥的制备方法12、酶制备富集对映体的β-氨基酸的方法13、酶制备富集对映体的β-氨基酸的方法14、芳香性氨基酸衍生物,其制备方法及其医药用途15、L-氨基酸酰-(8-喹啉基)胺及其衍生物和其制备方法16、稳定的氨基酸固体剂型和它们的制备方法17、新的氨基酸衍生物,其制备方法及含该化合物的药物组合物18、由氨基酸与羧酸酐反应水法制备酰氨基羧酸的方法19、氨基酸锌的制备方法及其应用20、氮-氨甲酰基氨基酸热水解制备光学活性氨基酸的方法目前认为,氨基酸以及各种氨基酸组成的二肽和三肽的吸收与单糖相似,是主动转运,且都是同Na+转运耦联的。
当肽进入肠粘膜上皮细胞后,立即被存在于细胞内的肽酶水解为氨基酸。
因此,吸收入静脉血中的几乎全部是氨基酸。
氨基酸作用氨基酸是构成生物体蛋白质并同生命活动有关的最基本的物质,是在生物体内构成蛋白质分子的基本单位,与生物的生命活动有着密切的关系。
它在抗体内具有特殊的生理功能,是生物体内不可缺少的营养成分之一。
一、构成人体的基本物质,是生命的物质基础1.构成人体的最基本物质之一构成人体的最基本的物质,有蛋白质、脂类、碳水化合物、无机盐、维生素、水和食物纤维等。
作为构成蛋白质分子的基本单位的氨基酸,无疑是构成人体内最基本物质之一。
构成人体的氨基酸有20多种,它们是:色氨酸、蛋氨酸、苏氨酸、缬氨酸、赖氨酸、组氨酸、亮氨酸、异亮氨酸、丙氨酸、苯丙氨酸、胱氨酸、半胱氨酸、精氨酸、甘氨酸、丝氨酸、酪氨酸、3.5.二碘酪氨酸、谷氨酸、天门冬氨酸、脯氨酸、羟脯氨酸、精氨酸、瓜氨酸、乌氨酸等。
这些氨基酸存在于自然界中,在植物体内都能合成,而人体不能全部合成。
其中8种是人体不能合成的,必需由食物中提供,叫做“必需氨基酸”。
这8种必需氨基酸是:色氨酸、苏氨酸、蛋氨酸、缬氨酸、赖氨酸、亮氨酸、异亮氨酸和苯丙氨酸。
其他则是“非必需氨基酸”。
组氨酸能在人体内合成,但其合成速度不能满足身体需要,有人也把它列为“必需氨基酸”。
胱氨酸、酪氨酸、精氨酸、丝氨酸和甘氨酸长期缺乏可能引起生理功能障碍,而列为“半必需氨基酸”,因为它们在体内虽能合成,但其合成原料是必需氨基酸,而且胱氨酸可取代80%~90%的蛋氨酸,酪氨酸可替代70%~75%的苯丙氨酸,起到必需氨基酸的作用,上述把氨基酸分为“必需氨基酸”、“半必需氨基酸”和“非必需氨基酸”3类,是按其营养功能来划分的;如按其在体内代谢途径可分为“成酮氨基酸”和“成糖氨基酸”;按其化学性质又可分为中性氨基酸、酸性氨基酸和碱性氨基酸,大多数氨基酸属于中性。
