《丁钠黑药》意见汇总处理表
不合格药品处理情况汇总分析表
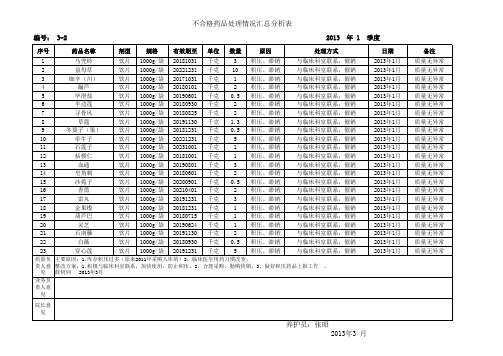
质量负 主要原因:1.库存积压过多(原来2011年采购入库的)2,临床医生用药习惯改变。 责人意 整改方案:1.积极与临床科室联系,加快使用,防止积压。2、合理采购,勤购快销。3、做好积压药品上报工作 。 见 薛钊剑 2013年3月 业务负 责人意 见 院长意 见
养护员:张昭 2013年3 月
与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销
不合格药品处理情况汇总分析表
编号: 3-2
序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 药品名称 马兜铃 益母草 细辛(川) 漏芦 毕澄茄 半边莲 寻骨风 草蔻 冬葵子(果) 牵牛子 石莲子 栝楼仁 血通 皂角刺 沙菀子 香薷 雷丸 金果榄 葫芦巴 灵芝 石南藤 白薇 穿心莲 剂型 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 规格 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 有效期至 20181031 20221231 20171031 20180101 20190601 20180930 20180825 20191130 20181231 20221231 20231001 20181001 20190801 20180601 20200901 20210401 20191231 20181231 20180715 20190624 20191130 20180930 20191231 单位 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 数量 3 10 1 2 0.5 2 2 1.3 0.5 5 1 1 3 2 0.5 2 3 1 1 1 2 0.5 5 原因 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销
(根据《药剂业及毒药条例》(第138章)第29条)

《藥劑業及毒藥條例》決議(根據《藥劑業及毒藥條例》(第138章)第29條)議決批准藥劑業及毒藥管理局於2001年6月18日訂立的—(a)《2001年藥劑業及毒藥(修訂)(第4號)規例》;及(b)《2001年毒藥表(修訂)(第3號)規例》。
《2001年藥劑業及毒藥(修訂)(第4號)規例》(由藥劑業及毒藥管理局根據《藥劑業及毒藥條例》(第138章)第29條訂立,並經立法會批准)1.特別限制根據第3及5條適用在毒藥表範圍內的物質《藥劑業及毒藥規例》(第138章,附屬法例)附表1的A部分現予修訂,加入— “左乙拉西坦;其鹽類西羅莫司;其鹽類利塞膦酸;其鹽類那格列奈;其鹽類;其酯類阿托西班;其鹽類洛匹那韋;其鹽類”。
2.第9條規定僅可按照註冊醫生、註冊牙醫或註冊獸醫開出的處方而以零售方式銷售的物質附表3的A部分現予修訂,加入— “左乙拉西坦;其鹽類西羅莫司;其鹽類利塞膦酸;其鹽類那格列奈;其鹽類;其酯類阿托西班;其鹽類洛匹那韋;其鹽類”。
(蘇天安醫生)藥劑業及毒藥管理局主席2001年6月18日註釋本規例修訂《藥劑業及毒藥規例》(第138章,附屬法例)附表1及3,在該等附表中分別加入6種物質。
1《2001年毒藥表(修訂)(第3號)規例》(由藥劑業及毒藥管理局根據《藥劑業及毒藥條例》(第138章)第29條訂立,並經立法會批准)1.毒藥表《毒藥表規例》(第138章,附屬法例)的附表現予修訂,在第I部的A部分中,加入— “左乙拉西坦;其鹽類西羅莫司;其鹽類利塞膦酸;其鹽類那格列奈;其鹽類;其酯類阿托西班;其鹽類洛匹那韋;其鹽類”。
(蘇天安醫生)藥劑業及毒藥管理局主席2001年6月18日註釋本規例修訂《毒藥表規例》(第138章,附屬法例)的附表,在毒藥表的第I部的A部分中加入6種物質。
药品安全“黑名单”管理规定模版

药品安全“黑名单”管理规定模版第一章总则第一条为规范药品安全管理工作,保障人民群众的生命健康权益,根据相关法律法规,制定本规定。
第二条本规定适用于药品生产、经营、使用、监督管理等活动中的“黑名单”管理工作。
第三条“黑名单”是指药品生产、经营、使用等环节中存在违法行为或者严重失信行为的单位或个人名单。
第四条“黑名单”管理应坚持公开、公平、公正、公信原则,实行依法追究、公开曝光、信用惩戒的工作机制。
第五条国家食品药品监督管理部门负责统一管理药品安全“黑名单”制度,相关部门按照各自职责参与管理工作。
第六条本规定的制定和修订工作由国家食品药品监督管理部门负责。
第二章“黑名单”管理工作程序第七条“黑名单”管理工作分为以下程序:(一)收集个人或单位的违法或失信信息;(二)审核违法或失信信息的真实性和证据;(三)通知被列入“黑名单”的单位或个人并要求其作出解释和申辩;(四)作出列入“黑名单”的决定,并告知相关单位或个人;(五)公开曝光“黑名单”信息;(六)对列入“黑名单”的单位或个人进行监管和惩戒。
第八条“黑名单”管理工作应当遵循以下原则:(一)依法依规进行,尽量减少对合法经营的影响;(二)实事求是,严格按照事实办事,公正处理;(三)公开透明,通过适当方式向社会公布“黑名单”信息;(四)分类管理,根据违法或失信行为的严重程度采取相应的管理措施。
第三章“黑名单”管理措施第九条对列入药品安全“黑名单”的单位或个人,将采取以下管理措施:(一)限制、暂停或撤销相关许可证、资质证书;(二)暂停或取消相关药品生产、经营、使用资格;(三)限制参与相关政府采购;(四)限制享受相关药品生产、经营扶持政策;(五)限制参与相关行业协会组织的活动;(六)向社会公开曝光相关单位或个人的违法或失信信息。
第十条对列入药品安全“黑名单”的单位或个人,应当按照相关要求进行整改,并取得相关监管部门的满意证明才能解除“黑名单”限制。
第十一条相关部门应当加强对列入药品安全“黑名单”的单位或个人的监督管理,及时发现并处理其可能存在的违规行为。
《选矿药剂产品分类、牌号、命名》

《选矿药剂产品分类、牌号、命名》标准(送审稿)编制说明1任务来源工业和信息化部2018年11月2日下发了《工业和信息化部办公厅关于印发2018年第四批行业标准制修订计划的通知》(工信厅科[2018]73号)文件,由矿冶科技集团有限公司(以下简称矿冶集团)承担《选矿药剂产品分类、牌号、命名》行业标准的修订工作,计划项目代号为2018-2068T-YS,计划完成年限为2020年。
2工作简况2.1立项目的和意义(1)产品的性质用途在矿物加工过程中,为了调节矿物的亲水和疏水性能,改变矿物表面物理化学性质而添加的各种药剂统称为选矿药剂。
在矿物选别作业中,不论是浮选、重选、电选、磁选、化学选矿和絮凝选矿等都离不开选矿药剂,是选矿行业中不可或缺的重要组成部分。
选矿药剂类品繁多,通常按照用途分类可以分为捕收剂、调整剂、起泡剂、辅助剂等。
(2)原标准使用情况及修订的必要性国外研究者十分重视新型选矿药剂的研制开发,目前已工业应用的药剂品种达数百种,且不断有新药剂出现。
在药剂研发、生产和使用中选矿工作者应该懂得和熟悉药剂的类型、性能等基本属性,但是面对如此繁杂的药剂种类,尤其是药剂的化学名称复杂多变,再加上一些药剂的商品名称由于历史原因及使用习惯,未按照系统命名法进行命名,更容易造成混淆。
对药剂名称及牌号表述不清晰给科研、生产和药剂使用带来极大不便。
现行《选矿药剂产品分类、牌号、命名》标准制定于2011年,对于选矿药剂的分类、牌号和命名均反映了当时的行业现状,对当时的行业发展起到了规范和促进作用。
但是近年来,随着计算机辅助分子设计技术的进步及协同作用理论的发展,新型药剂研发速度加快,使絮凝剂、乳化剂、增效剂的作用更加受到重视,在此期间更是涌现了很多药剂研发公司,不同药剂公司对药剂牌号和命名相当随意,药剂牌号和命名越来越显得杂乱无章。
这种现象使得选矿工作者无法有效识别药剂的类型、性能,已影响到选矿药剂行业乃至矿物加工行业的发展。
EU-GMP中文版

欧盟药品管理规则第 4 卷药品生产质量管理规范1998 版前言欧洲共同体制药工业在药品的开发,生产和控制过程中保持高标准的质量保证。
上市许可系统保证由有能力的权威机构对药品的安全,质量和有效性是否达到相应的规定进行评估。
生产许可系统保证在欧洲市场上获准销售的药品是由授权的生产商生产,其日常活动由权威机构定期检查。
无论是在欧共体之内销售,还是在欧共体之外销售,所有欧共体的药品生产企业都必须通过生产许可。
有两个药品生产和质量管理指导原则,药品生产和质量管理规范(GMP)和指南来源于两个指导原则, 一个是人用药物指导原则(指导原则91/356/EEC)一个是兽用药物指导原则(指导原则91/412/EEC),这两个指导原则1991年被欧共体采纳。
根据这些原则,制定了详细的药品生产和质量管理规范,用于对申请生产许可的企业进行评估和对药品生产企业进行检查的基础。
GMP的原则和详细的指南适用于需要按照第16条75/319/ EEC和修改的第24条81/851/EEC要求认证的所有的操作。
也与所有其它大规模药品生产过程,诸如医院负责的临床试验用药的制备有关。
所有的成员国和工业企业本身都同意GMP适用于人用药物的生产,也适用于兽用药物的生产。
在两个附录中对兽用药品和兽用免疫药品的GMP指南做了详细的调整。
指南用章来表述,每章用标题来概括章节的原则内容。
第一章质量管理列出了药品生产的质量保证的基本概念。
后续各章的原则列出了质量保证的目标和提供了足够的让生产商在执行这一原则时所必须考虑的基本要素。
这一指南除了在9个章节中表述了GMP的基本要素外, 还包括一系列附录提供了与之有关的活动的特定范围的细节。
有时几个附录同时使用,如关于无菌制剂,辐射性药物,生化药物的附录。
在附录后还列出了这一指南所使用的术语表.指南的第一版在1989 年出版, 包括一个无菌药品生产的附录。
第二版在1992 年1月出版; 欧共体指到原则包括给人用药品和兽用药品的GMP提供原则和指南的欧共体于1991 年6月13 日颁布的91/356指导原则和1991 年7月23 日颁布的91/412指导原则。
《25号钠黑药》意见汇总处理表
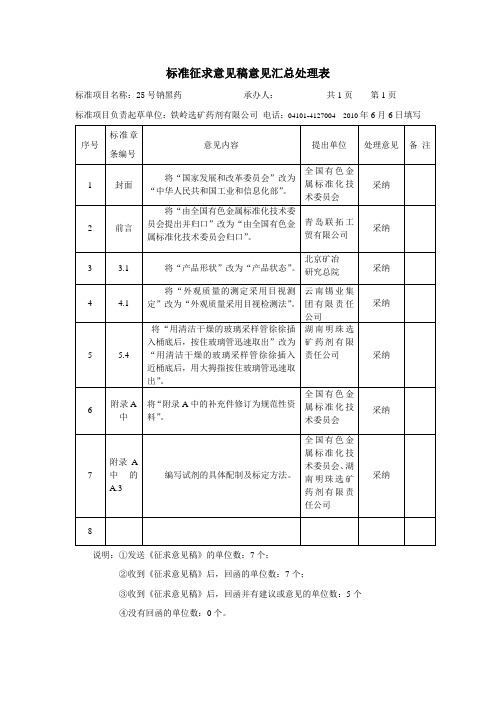
标准项目名称:25号钠黑药承办人:共1页第1页
标准项目负责起草单位:铁岭选矿药剂有限公司电话:04101-41270042010年6月6日填写
序号
标准章条编号
意见内容
提出单位
处理意见
备注
1
封面
将“国家发展和改革委员会”改为“中华人民共和国工业和信息化部”。
全国有色金属标准化技术委员会
采纳
2
前言
将“由全国有色金属标准化技术委员会提出并归口”改为“由全国有色金属标准化技术委员会归口”。
青岛联拓工贸有限公司
采纳
3
3.1
将“产品形状”改为“产品状态”。
北京矿冶
研究总院
采纳
4
4.1
将“外观质量的测定采用目视测定”改为“外观质量采用目视检测法”。
云南锡业集团有限责任公司
采纳
5
5.4
将“用清洁干燥的玻璃采样管徐徐插入桶底后,按住玻璃管迅速取出”改为“用清洁干燥的玻璃采样管徐徐插入近桶底后,用大拇指按住玻璃管迅速取出”。
③收到《征求意见稿》后,回函并有建议或意见的单位数:5个
④没有回函的单位数:0个。
湖南明珠选矿药剂有限责任公司
采纳6Leabharlann 附录A中将“附录A中的补充件修订为规范性资料”。
全国有色金属标准化技术委员会
采纳
7
附录A中的A.3
编写试剂的具体配制及标定方法。
全国有色金属标准化技术委员会、湖南明珠选矿药剂有限责任公司
采纳
8
说明:①发送《征求意见稿》的单位数:7个;
②收到《征求意见稿》后,回函的单位数:7个;
农药登记试验单位现场检查综合评审意见表

资料审查:
现场检杳:
综合评审:
经办人:
年 月日
审批人:
年 月日
备注
农药登记试验范围和项目表
试验范围
具体试验项目
产品化学试验
(全)组分分析试验
理化性质测定试验
产品质量检测试验/储存稳定性试验
药效试验
农林用农药试验
卫生用农药试验
1.杀虫剂试验
2.杀菌剂试验
3.除草剂试验
4.植物生长调节剂试验
(可另附页)
检查组成员签名:
年 月日
检查组组长签名:
年 月日
试验机构负责人签名:
(单位公章)年 月日
申请人名称
申请试验范围
申请类型
□首次申请
□到期再次申请
勾分设或合并
□地址变更或设施重大变化
□扩大范围
C其他事项
综合评审意见:
(可另附页)
检查组组长及成员签名:
年 月日
申请人名称
申请试验范围
申请类型
□首次申请
□代谢试验:□动物代谢 □植物代谢
□农作物残留试验:□室内检测 □田间试验 □加工农产品残留试验
毒理学 试验
□急性毒试验□重复染毒毒性试验
□特殊毒性试验□弋谢和毒物动力学试验
□微生物致病性试验 □暴露量测试试验
环境影 响试验
□生态毒理试验(口人类DB类类口。类) □环境归趋试验(DA类DB类)
申请类型
2.微生物农药蜜蜂毒性 试验
3.微生物农药家蚕毒性 试验
4.微生物农药鱼类毒性 试验
5.微生物农药溞类毒性 试验
6.微生物增殖试验
1.水解试验
2.水中光解试验
药品不良反应报表空白表

报告人评价: 肯定□√很可能□可能□可能无关□待评价□无法评价□签名:
报告单位评价: 肯定□√很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息
联系电话:
职业:医生□药师□护士□√其他□
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:年月日
生产企业请
填写信息来源
医疗机构□经营企业□个人□文献报道□上市后研究□其他□
备注
不良反应/事件的结果:痊愈□√好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□√否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□√不明□未再使用□
对原患疾病的影响:不明显□√病程延长□病情加重□导致后遗症□导致死亡□
附表1
药品不良反应/事件报告表
首次报告□√跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□√经营企业□生产企业□个人□其他□
患者姓名:
性别:男□女□
出生日期:
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:盆腔炎
医院名称:xxxx
病历号/门诊号:xxxx
既往药品不良反应/事件:有□无□√不详□
家族药品不良反应/事件:有□无□√不详□
相关重要信息:吸烟史□饮酒史□妊娠期□肝病史□肾病史□过敏史□其他□
药品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间
编号QR—030通用名称商品名称...

信息联系处理单药品质量档案表文件修订申请表文件销毁审批记录质量事故报告处理记录质量分析记录药品拒收报告单质量管理制度执行情况检查考核记录表编号:QR—010问题改进和措施跟踪记录编号:QR 011说明:本表一式三份,由实施部门实施后反馈到下达改进任务部门和分管领导各一份,自留一份。
内部质量管理体系审核报告(可另附纸叙述)不符合报告GSP自查评审表职工登记表编号:QR—020编号:QR—021 填表日期:健康档案登记表编号:QR—023强制检定计量器具检定记录卡编号:QR—026 制卡日期年月日制卡人:供货方一览表合格供货方档案首营企业审批表首营品种审批表编号:QR—030电话订货记录(代合同)编号:QR—033 年月日照,质量标准,生产批文。
所供药品包装、标签、说明书符合有关规定,药品应附产品合格证,包装符合运输要求,如遇有假药、劣药供方承担一切法律责任。
药品拆零登记表编号:QR—039购进退出通知单经办人:药品停售通知单编号:QR—043年第号通用名称规格剂型产品批号有效期生产日期生产企业经手人复核人其它停售原因签名:年月日药品解除停售通知单编号:QR—044年第号如下药品质量复查结果合格,撤消年第号“药品停售通知单”,请恢复正常出库及销售使用,特此告知。
通用名称规格剂型产品批号有效期生产日期生产企业经手人复核人其它签名:年月日不合格药品报损审批表编号:QR—046 报告时间:年月日说明:本表应附拟报损品种清单不合格药品销毁记录注:本表应附销毁品种清单。
记录人:药品质量复查报告单销后退回通知单经办人:药品养护档案表编号:QR—055 建档日期:中药饮片质量检查记录养护设备检修维护记录编号:QR—058药品储存温湿度记录表编号:QR—059 库区表号时间:年月药品陈列环境温湿度记录表编号:QR—060 库区表号时间:年月效期药品催销表报告人签字:年月日质量部门:业务部门经理注:1.此报告单由仓库保管员填写2.此报告单自填报日起保存2年3.此报告单一式四份,仓库、质量、业务、主管经理各一份。
HM化学品限制

化学品限制条款
质量部门 2005 年 10 月
Hale Waihona Puke ________________________________________________________________________________________________________________
H&M 化学品限制条款,2005 年 10 月
1 (14)
概要..................................................................................................................................................................................................3 产品中限制使用的物质名称 ..........................................................................................................................................................4 偶氮染料和涂料 .......................................................................................................................................................................
食品药品安全“黑名单”管理规定(征求意见稿5篇

食品药品安全“黑名单”管理规定(征求意见稿5篇第一篇:食品药品安全“黑名单”管理规定(征求意见稿食品药品安全“黑名单”管理规定(征求意见稿)第一章总则第一条为进一步加强食品药品安全监督管理,推进诚信体系建设,加大对生产经营者失信行为的惩戒力度,监督生产经营者全面履行安全责任,根据《食品安全法》、《药品管理法》、《医疗器械监督管理条例》、《化妆品卫生监督条例》等有关法律、法规,制定本规定。
第二条县级以上食品药品监督管理部门应当按照本规定的要求,建立食品药品安全“黑名单”,将因严重违反食品、药品、医疗器械、化妆品管理法律、法规、规章,受到行政处罚的生产经营者及其直接负责的主管人员和其他直接责任人员(以下简称责任人员)等的有关信息,通过政务网站公布,接受社会监督。
第三条本规定所称生产经营者包括在中华人民共和国境内从事食品(含保健食品、食品添加剂)生产经营的企业或者其他单位,药品、医疗器械、化妆品研制、生产、经营和使用的企业或者其他单位。
第四条国家食品药品监督管理总局负责全国食品药品安全“黑名单”管理工作。
县级以上地方食品药品监督管理部门负责本行政区域内食品药品安全“黑名单”管理工作。
第五条食品药品安全“黑名单”管理应当遵循依法、客观、及时、公开、公正的原则。
第六条地方各级食品药品监督管理部门负责公布其作出行政处罚案件相关的生产经营者、责任人员和涉案产品的相关信息。
国家食品药品监督管理总局负责公布其直接查办、挂牌督办的重大行政处罚案件相关的生产经营者、责任人员和涉案产品的相关信息。
第七条行政处罚决定生效的,当事人提起行政复议或行政诉讼不影响纳入食品药品安全“黑名单”。
第八条国家食品药品监督管理总局建立“黑名单”数据库,实现信息共享。
第二章纳入范围第九条根据《行政处罚法》受到责令停产停业、吊销许可证、撤销批准证明文件以及法律法规规定的其他严重行政处罚的生产经营者和责任人员。
第十条隐瞒有关情况或者提供虚假材料申请行政许可,或者以欺骗、贿赂等不正当手段取得行政许可,受到行政处罚的行政许可申请人或被许可人。
药品安全“黑名单”管理规定范本

药品安全“黑名单”管理规定范本第一章总则第一条为了加强药品安全监管,保障人民群众健康权益,制定本规定。
第二条本规定适用于我国境内的药品生产、流通、使用等环节的监管。
第三条药品安全“黑名单”管理,是指对涉嫌违法犯罪或存在严重质量、安全问题的药品生产、经营者进行名单管理和监管措施的制度。
第四条药品安全“黑名单”管理应坚持法治原则,依法进行,公正、公开、透明。
第五条药品监管部门应建立健全药品安全“黑名单”管理制度,明确相应的管理职责和流程。
第六条药品生产、经营者应加强自律,履行社会责任,依法经营,保障药品质量、安全。
第七条药品安全“黑名单”管理工作应与相关行业、部门相互协作、信息共享,形成合力。
第二章药品安全“黑名单”管理的程序第八条药品安全“黑名单”管理的程序包括名单推荐、名单审核、名单公示、名单发布等环节。
第九条名单推荐工作由药品监管部门负责开展,接受社会各界举报、监督。
第十条名单审核工作由相关专家组成的评议会负责,评议会成员由药品监管部门确定。
第十一条名单公示工作由药品监管部门负责,公示内容包括被列入名单的药品生产、经营者的基本信息、违规违法行为等。
第十二条名单发布工作由药品监管部门负责,发布药品安全“黑名单”,并通过各种媒体向社会公开。
第三章药品安全“黑名单”管理的制度第十三条药品安全“黑名单”管理制度包括追溯管理、信用评价、监管限制等措施。
第十四条追溯管理是指通过采集、整理相关信息,对列入药品安全“黑名单”中的药品生产、经营者进行溯源追踪,以确定违法违规行为或存在的质量、安全问题。
第十五条信用评价是指对药品生产、经营者的诚信度进行评估,形成信用档案,对信用状况进行分类管理。
第十六条监管限制是指根据药品安全“黑名单”中的药品生产、经营者的违法违规信息,采取限制措施,如暂停许可证、撤销执照等。
第十七条追溯管理、信用评价、监管限制等措施的具体实施办法由药品监管部门另行制定。
第四章药品安全“黑名单”管理的监督与处罚第十八条药品监管部门应建立健全药品安全“黑名单”管理的监督机制,定期进行监督检查。
(完整版)丁铵黑药安全技术说明书

立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
吸入:
脱离现场至空气新鲜处。如呼吸困难,给输氧。就医。
食入:
用水漱口,给饮牛奶或蛋清。就医。
第五部分:消防措施
危险特性:
易燃、有较弱的毒性。
有害燃烧产物:
有毒的硫氧化物。
灭火方法:
消防人员必须穿全身耐酸碱消防服、防毒口罩。
第六部分:泄漏应急处理
生态毒理毒性:
无资料
生物降解性:
无资料
非生物降解性:
无资料
生物富集或生物积累性:
无资料
其它有害作用:
无资料。
第十三部分:废弃处置
废弃物性质:
有害废物
废弃处置方法:
处置前应参阅国家和地方有关法规。
废弃注意事项:
第十四部分:运输信息
危险货物编号:
无资料
UN编号:
无资料
包装标志:
有毒品
包装类别:
Ⅲ类包装
包装方法:
敞口钢桶内衬塑料袋或改制小口钢桶包装,每桶净重120Kg
运输注意事项:
起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与酸类、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。车辆运输完毕应进行彻底清扫。
第十五部分:法规信息
法规信息
化学危险物品安全管理条例(1987年2月17日国务院发布),化学危险物品安全管理条例实施细则(化劳发[1992] 677号),工作场所安全使用化学品规定([1996]劳部发423号)等法规,针对化学危险品的安全使用、生产、储存、运输、装卸等方面均作了相应规定。
应急处理:
隔离泄漏污染区,限制出入。建议应急处理人员戴防尘面具(全面罩),穿防毒服。避免扬尘,小心扫起,置于袋中转移至安全场所。若大量泄漏,用塑料布、帆布覆盖。收集回收或运至废物处理场所处置。
异丁钠黑药 标准

异丁钠黑药标准
异丁钠黑药是一种黑色粉末,无臭,无味,不溶于水,溶于丙酮,易潮解。
主要用作选矿捕收剂。
异丁钠黑药的标准可能因国家、地区或行业而有所不同。
以下是一些常见的异丁钠黑药标准:
1. 外观:黑色粉末,无结块。
2. 有效成分含量:不低于 90%。
3. 水分:不高于 1.0%。
4. 细度:通过 200 目标准筛的通过率不低于 95%。
5. 水溶性:不溶于水。
6. 稳定性:在正常储存条件下,保质期为 12 个月。
这些标准仅供参考,具体的标准可能因不同的用途和要求而有所不同。
在使用异丁钠黑药之前,建议先了解相关的标准和规定,并按照要求进行检验和使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
④没有回函的单位数:0个。
湖南明珠选矿药剂有限责任公司
采纳
6
附录A中
将“附录A中的补充件修订为规范性资料”。
全国有色金属标准化技术委员会
采纳
7
附录A中的A.3
编写试剂的具体配制及标定方法。
全国有色金属标准化技术委员会、湖南明珠选矿药剂有限责任公司
采纳
8
说明:①发送《征求意见稿》的单位数:6个;
②收到《征求意见稿》后,回函的单位数:6个;
采纳
2
前言
将“由全国有色金属标准化技术委员会提出并归口”改为“由全国有色金属标准化技术委员会归口”。
丹东鑫扬化工公司
采纳
3
3.1
将“产品形状”改为“产品状态”。
北京矿冶
研究总院
采纳
4
4.1
将“外观质量的测定采用目视测定”改为“外观质量采用目视检测法”。
云南锡业集团有限责任公司
采纳
5
5.4
将“用清洁干燥的玻璃采样管徐徐插入桶底后,按住玻璃管迅速取出”改为“用清洁干燥的玻璃采样管徐徐插入近桶底后,用大拇指按住玻璃管迅速取出”。
标准征求意见稿意见汇总处理表
标准项目名称:丁钠黑药承办人:共1页第1页
标准项目负责起草单位:铁岭选矿药剂有限公司电话:04101-41270042010年6月6日填写
序号
标准章条编号
ቤተ መጻሕፍቲ ባይዱ意见内容
提出单位
处理意见
备注
1
封面
将“国家发展和改革委员会”改为“中华人民共和国工业和信息化部”。
全国有色金属标准化技术委员会
